หลักการส่งตรวจทางพันธุศาสตร์ในผู้ป่วยมะเร็ง
(The Basis of Genetic Testing in Cancer Patient)
อ.นพ.ธรรมพจน์ จีรากรภาสวัฒน์
บทนำ
ปัจจุบันการดูแลรักษาผู้ป่วยมะเร็งมีการพัฒนามากขึ้นเป็นลำดับ เรียกว่า precision medicine ซึ่งใช้องค์ความรู้ทางด้านพันธุศาสตร์และการกลายพันธุ์ของยีนก่อโรค เป็นเป้าหมายในการรักษา เพื่อเพิ่มประสิทธิภาพการรักษาและลดอาการข้างเคียงจากยากลุ่มเคมีบำบัดในอดีต ที่เรียกว่าการรักษาด้วยยาพุ่งเป้า (targeted therapy) และการรักษาตามแนวทาง precision medicine นั้น พัฒนาจากพื้นฐานขององค์ความรู้ทางเทคโนโลยีด้านพันธุศาสตร์ โดยเฉพาะการส่งตรวจพันธุกรรมยีโนมของมนุษย์ทั้งหมด (whole genome) ที่สะดวกและรวดเร็วมากขึ้นตั้งแต่ทศวรรษ 1990 ด้วยเทคนิคการตรวจ next generation sequencing (NGS) ทำให้สามารถวิเคราะห์ความผิดปกติทางพันธุกรรมหรือการกลายพันธุ์ (mutation) ได้อย่างรวดเร็ว จนกระทั่งโครงการ Human genome project ได้ทำการตรวจยีโนมของมนุษย์ทั้งหมดได้สำเร็จอย่างครบถ้วน ในปี ค.ศ. 2003 ยิ่งส่งเสริมให้มีการนำองค์ความรู้ทางพันธุศาสตร์และการกลายพันธุ์ของยีน มาอธิบายพยาธิกำเนิดของโรคต่าง ๆ โดยเฉพาะมะเร็ง ยกตัวอย่างของยีนกลายพันธุ์ที่สัมพันธ์กับพยาธิกำเนิดของมะเร็งทางนรีเวช คือ breast cancer gene 1 และ 2 (BRCA1,2) ซึ่งก่อให้เกิดมะเร็งเต้านม และมะเร็งรังไข่ ท่อนำไข่ และเยื่อบุช่องท้อง ที่สามารถส่งผ่านยีนกลายพันธุ์ในครอบครัวจากรุ่นสู่รุ่น
เทคนิคการตรวจสารพันธุกรรมและลำดับนิวคลีโอไทด์ในมนุษย์
มนุษย์มีองค์ประกอบของสารพันธุกรรม DNA (whole genome) ทั้งสิ้น 3,000 ล้านคู่เบส โดยแบ่งเป็นส่วนที่เป็น DNA ที่มีการคัดลอกและแปลข้อมูลสารพันธุกรรมเป็นโปรตีน (coding DNA) ร้อยละ 1.1 ซึ่งเรียกกลุ่มของ coding DNA นี้ว่า exons โดยเรียก exons ทั้งหมดในยีโนมนุษย์นี้ว่า whole exome และส่วนที่เป็น DNA ที่ไม่ได้รับการแปลข้อมูลเป็นโปรตีน (non-coding DNA) ซึ่งมีองค์ประกอบภายในมากมายที่จะไม่ได้กล่าวถึงในที่นี้ และเรียก DNA กลุ่มนี้ว่า introns(1) ซึ่งจากข้อมูลข้างต้นสามารถจำแนกวิธีการตรวจสารพันธุกรรมและลำดับนิวคลีโอไทด์ได้ ดังนี้
- การตรวจจำเพาะยีนที่สนใจ (targeted gene sequencing)
- การตรวจยีนจำเพาะเพียงยีนเดียว (single gene analysis)
- การตรวจกลุ่มของยีนที่สนใจหรือมีความสัมพันธ์กัน (multi genes panel analysis)
- การตรวจกลุ่มของ exons ทั้งหมด (whole exome sequencing)
- การตรวจยีโนมของมนุษย์ทั้งหมด (whole genome sequencing)
ซึ่งการเลือกวิธีการส่งตรวจในผู้ป่วยแต่ละรายนั้น ขึ้นกับข้อมูลของกลุ่มยีนที่ก่อนโรคแน่ชัดหรือไม่ และค่าใช้จ่ายในการส่งตรวจ ยกตัวอย่างเช่น ในผู้ป่วยมะเร็งรังไข่ ที่สงสัยว่ามีความผิดปกติของยีนในโรค Hereditary breast ovarian cancer (HBOC) ซึ่งจำเพาะกับ BRCA 1 และ 2 สามารถส่งตรวจเฉพาะ single gene analysis ได้เพื่อลดค่าใช้จ่าย แต่บางครั้งในโรค HBOC อาจเกิดจากการกลายพันธุ์ของยีนอื่นที่ส่งผลต่อการทำงานของกระบวนการ homologous recombination repair บกพร่อง ซึ่งเรียก กลุ่มยีนนี้ว่า BRCAness ( ATM, BARD1, CHEK2, FANCA, FANCB, FANCl, PALB2, RAD50, RAD51D)(2) ดังนั้นในกรณีนี้การเลือกส่งตรวจ Multi genes panel analysis ในยีนที่สนใจ จะได้ข้อมูลสำหรับการวิเคราะห์ที่เหมาะสมและครบถ้วน แต่ในมะเร็งบางชนิดที่ยังไม่ทราบข้อมูลของยีนกลายพันธุ์ที่ก่อโรคชัดเจน จำเป็นต้องส่งตรวจในลักษณะ Whole exome sequencing หรือ Whole genome sequencing เป็นต้น
สิ่งส่งตรวจเพื่อการตรวจทางพันธุศาสตร์ในมะเร็ง
ในผู้ป่วยมะเร็งนั้นสามารถเลือกสิ่งส่งตรวจ เพื่อตรวจหายีนกลายพันธุ์ได้จากเนื้อเยื่อสองลักษณะ คือ เนื้อเยื่อจากชิ้นส่วนมะเร็ง หรือเลือด หรือเยื่อบุผิวที่ปกติภายในร่างกายของผู้ป่วย โดยมีนิยามของการกลายพันธุ์จากเนื้อเยื่อที่ส่งตรวจดังนี้ (4)
- Somatic mutation คือ การกลายพันธุ์ของยีน เฉพาะเนื้อเยื่อบางส่วนของร่างกาย ที่ไม่ใช่เซลล์สืบพันธุ์ ซึ่งไม่สามารถถ่ายทอดทางพันธุกรรมของการกลายพันธุ์นั้นไปสู่รุ่นถัดไปได้ หากต้องการตรวจว่าสามารถถ่ายทอดทางพันธุกรรมได้หรือไม่ จำเป็นต้องส่งตรวจด้วย germline testing เพิ่มเติม ซึ่งผลการตรวจลักษณะนี้ได้จากการส่งตรวจจากชิ้นเนื้อมะเร็ง (tumor profiling)
- Germline mutation คือ การกลายพันธุ์ของยีนในเนื้อเยื่อทุกชนิดของร่างกาย ซึ่งผู้ป่วยได้รับการถ่ายทอดมาจากพ่อหรือแม่ตั้งแต่การปฏิสนธิ และสามารถถ่ายทอดยีนกลายพันธุ์นี้ไปสู่รุ่นถัดไปได้ ซึ่งเป็นสาเหตุของโรคมะเร็งในครอบครัว เช่น Hereditary breast ovarian cancer (HBOC) โดยผลการตรวจได้จากการตรวจเนื้อเยื่อบุผิว เช่น กระพุ้งแก้ม หรือเลือด
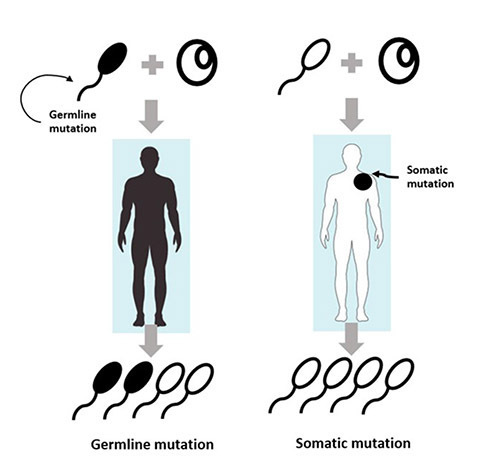
รูปที่ 1 การกลายพันธุ์ชนิด somatic mutation และ Germline mutation
ที่มา: จัดทำโดย นพ. ธรรมพจน์ จีรากรภาสวัฒน์ หน่วยมะเร็งวิทยานรีเวช ภาควิชาสูติศาสตร์และนรีเวชวิทยา
คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
ตารางที่ 1 ข้อดีของการส่งตรวจ germline testing และ somatic tumor testing
| Germline Testing | Somatic Tumor Testing |
| เทคนิคการตรวจมีความแม่นยำ เนื่องจากสามารถสกัด DNA ได้ง่าย | ไม่จำเป็นต้องได้รับการอธิบายหรือแนะนำจากนักพันธุศาสตร์ก่อนการส่งตรวจ เหมาะสำหรับสถานที่ที่มีจำนวนของนักพันธุศาสตร์น้อย |
| ผลการตรวจที่ได้สามารถประเมินความเสี่ยงของมะเร็งชนิดอื่นที่สัมพันธ์กับยีนกลายพันธุ์ที่ตรวจพบได้ | เพิ่มโอกาสการรักษาด้วยยาพุ่งเป้า (targeted therapy) ในกรณีที่พบการกลายพันธุ์ของยีน ในลักษณะ somatic mutation แต่ไม่พบการกลายพันธุ์ของยีน ในลักษณะ germline mutation |
| สามารถประเมินความเสี่ยงการเกิดโรคมะเร็ง สำหรับสมาชิกในครอบครัวได้ | สามารถใช้เป็นการตรวจคัดกรองในเนื้อเยื่อมะเร็ง หากพบการกลายพันธุ์ จึงพิจารณาส่งตรวจทาง germline testing เพิ่มเติม |
| ผลการตรวจที่พบการกลายพันธุ์สามารถนำไปตรวจเพิ่มเติมจำเพาะสำหรับสมาชิกในครอบครัวได้ |
ดัดแปลงจาก Homologous recombination deficiency (HRD) testing in ovarian cancer clinical practice: a review of literature.2017(3)
ลำดับขั้นตอนการส่งตรวจทางพันธุศาสตร์ในผู้ป่วยมะเร็ง(4)
- การประเมินความเสี่ยงการเกิดมะเร็ง (risk assessment) คือการซักประวัติผู้ป่วย ลักษณะของโรคมะเร็งและชนิดของมะเร็งในสมาชิกครอบครัว ด้วยการวาดแผนภาพพงศาวลี (pedigree)
- การให้คำแนะนำทางพันธุศาสตร์เกี่ยวกับความเสี่ยงและโอกาสการเกิดมะเร็งในผู้ป่วยและครอบครัว (genetic counselling) มีความจำเป็นต้องมีการให้คำแนะนำโดยนักพันธุศาสตร์หรือผู้เชียวชาญในสาขานั้น ๆ เพื่อให้ผู้ป่วยหรือสมาชิกในครอบครัวเข้าใจถึงการถ่ายทอดทางพันธุกรรมของยีนกลายพันธุ์ก่อมะเร็ง รวมถึงข้อดีและข้อเสียของการส่งตรวจ โดยประเมินเป็นความเสี่ยงการเกิดมะเร็งจำเพาะบุคคล ตลอดจนค่าใช้จ่ายในการตรวจ และข้อจำกัดของวิธีการตรวจและผลการตรวจ
- การให้คำยินยอมและรับทราบข้อกำหนดของการตรวจทางพันธุศาสตร์ (informed consent) ภายหลังจากการประเมินความเสี่ยงและได้รับคำแนะนำในการส่งตรวจจากผู้เชี่ยวชาญเป็นที่เรียบร้อยแล้ว
- การเก็บสิ่งส่งตรวจ เช่น เลือด เส้นผม เยื่อบุผิวกระพุ้งแก้ม ปัสสาวะ น้ำคร่ำ หรือเนื้อเยื่อส่วนใดส่วนหนึ่งในร่างกาย
- การรายงานผลการตรวจทางพันธุศาสตร์ ซึ่งจะอธิบายโดยละเอียดในลำดับถัดไป
- การวางแผนให้การดูแล เฝ้าระวัง และการตรวจติดตาม หรือการอภิปรายการลดความเสี่ยงการเกิดมะเร็งสำหรับผู้ตรวจ
การรายงานผลการตรวจทางพันธุศาสตร์ในยีนกลายพันธุ์ก่อมะเร็ง (4)
- ผลการตรวจเป็นบวก (positive result) คือ พบยีนกลายพันธุ์ ที่มีข้อมูลบ่งชี้ว่าเป็นลักษณะการกลายพันธุ์ที่ตรวจพบมีความเสี่ยงต่อการก่อโรคมะเร็งดังกล่าว (pathogenic or likely pathogenic variants)
- ผลการตรวจเป็นลบ (negative result) คือ ไม่พบยีนกลายพันธุ์ที่ก่อโรคมะเร็งชนิดที่สงสัย
- แปลได้ไม่ชัดเจน (variant of uncertain significant, VUS) คือ พบยีนกลายพันธุ์ ในลักษณะที่ข้อมูลในปัจจุบันยังไม่เพียงพอที่จะบ่งชี้ว่าสัมพันธ์กับพยาธิกำเนิดของมะเร็งชนิดที่สงสัยหรือไม่ ควรติดตามผู้ป่วยและติดตามข้อมูลที่ทันสมัยล่าสุดเป็นระยะ ๆ ยกตัวอย่างเช่น การส่งตรวจยีน BRCA 1 และ 2 หากผลการตรวจเป็น VUS จะมีฐานข้อมูลที่ให้แพทย์หรือนักพันธุศาสตร์เข้าไปติดตามข้อมูลงานวิจัยเป็นระยะ เพื่อยืนยันว่าลักษณะการกลายพันธุ์ที่เป็น VUS นั้นเป็นลักษณะการกลายพันธุ์ที่จะก่อโรคมะเร็งในอนาคตได้หรือไม่(5, 6) ทั้งนี้ในบริบทของประเทศไทย ที่ยังมีข้อมูลด้านพันธุศาสตร์และยีนกลายพันธุ์ไม่มาก และมีความแตกต่างกันทางเชื้อชาติกับแหล่งข้อมูลของยีนกลายพันธุ์ที่อ้างอิงจากประเทศโลกตะวันตก นั้นการให้ความสำคัญในการติดตามผู้ป่วยที่รายงานผล VUS ในประเทศไทย จึงมีความจำเป็นอย่างยิ่ง
อย่างไรก็ตามการแปลผลการตรวจทางพันธุศาสตร์มีความจำเป็นที่ผู้ตรวจจะต้องได้รับคำแนะนำจากนักพันธุศาสตร์หรือผู้เชี่ยวชาญอย่างเหมาะสม โดยเฉพาะอย่างยิ่งผู้ตรวจที่ยังไม่เกิดโรคมะเร็ง เนื่องจากการตรวจพบยีนกลายพันธุ์ในลักษณะ pathogenic หรือ likely pathogenic variant นั้นไม่จำเป็นว่าจะก่อให้เกิดมะเร็งในทุกบุคคล ขึ้นกับปัจจัยอื่น ๆ อีกหลายชนิด ซึ่งการแปลผลนั้นจะบ่งชี้ได้เพียงว่าผู้ตรวจมีความเสี่ยงสูงเท่านั้น เช่น การพบยีน BRCA 1 กลายพันธุ์ มีโอกาสเกิดมะเร็งเต้านม ร้อยละ 55 -72 และมะเร็งรังไข่ ร้อยละ 39-44 และในยีน BRCA 2 กลายพันธุ์ มีโอกาสเกิดมะเร็งเต้านม ร้อยละ 45 -69 และมะเร็งรังไข่ ร้อยละ 11-17(7-9)
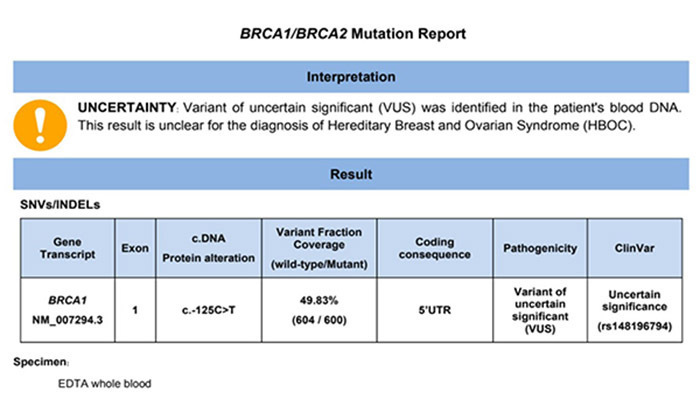
รูปที่ 2 ตัวอย่างการรายงานผลการส่งตรวจยีน BRCA ในผู้ป่วยมะเร็งท่อนำไข่ (ที่มา: ดัดแปลงจากเอกสารการรายงานผล โดย นพ. ธรรมพจน์ จีรากรภาสวัฒน์ หน่วยมะเร็งวิทยานรีเวช ภาควิชาสูติศาสตร์และนรีเวชวิทยาคณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่)
การนำข้อมูลและผลการตรวจทางพันธุศาสตร์ไปประยุกต์ใช้
ในกรณีตรวจจากผู้ป่วยมะเร็ง
- แนะนำตรวจในผู้ป่วยที่วินิจฉัยมะเร็งบางชนิดทุกราย ยกตัวอย่างเช่น ผู้ป่วยมะเร็งรังไข่ ท่อนำไข่ หรือเยื่อบุช่องท้อง ชนิดเยื่อบุผิว ตามข้อแนะนำของ National Comprehensive Cancer Network (NCCN)(10)
- หากตรวจพบยีนกลายพันธุ์ที่ก่อมะเร็ง ที่มียาพุ่งเป้าที่จำเพาะ ผู้ป่วยมะเร็งรายนั้นจะได้รับยาพุ่งเป้าที่เหมาะสม และข้อมูลในปัจจุบันยาพุ่งเป้าบางชนิดเพิ่มอัตราการรอดชีวิตอย่างมีนัยสำคัญทางสถิติ ยกตัวอย่างเช่น ผู้ป่วยมะเร็งรังไข่ ที่ตรวจพบการกลายพันธุ์ของยีน BRCA 1 หรือ 2 หากได้รับการรักษาด้วยยาพุ่งเป้ากลุ่ม poly ADP ribose polymerase (PARP) inhibitor ภายหลังการรักษาที่ตอบสนองด้วยยาเคมีบำบัดกลุ่มแพลทตินัม พบว่ามี median progression free survival ยาวนานกว่ากลุ่มที่ไม่ได้รับยาอย่างมีนัยสำคัญทางสถิติ(11)
- หากตรวจพบยีนกลายพันธุ์ก่อมะเร็งที่จำเพาะ จากผู้ป่วยมะเร็งแล้ว สามารถนำข้อมูลลักษณะของยีนกลายพันธุ์นี้ไปส่งตรวจในลักษณะ single gene analysis ในสมาชิกในครอบครัว ซึ่งช่วยลดค่าใช้จ่ายในการส่งตรวจ
ในกรณีตรวจจากผู้ป่วยที่มีความเสี่ยงการเกิดมะเร็ง
- ส่งเสริมการตรวจคัดกรองมะเร็งที่เกี่ยวเนื่องกับยีนกลายพันธุ์ ยกตัวอย่างเช่น พบการยีน BRCA 1 หรือ 2 กลายพันธุ์ มีข้อแนะนำให้ตรวจมะเร็งเต้านม มะเร็งท่อนำไข่ รังไข่ รวมทั้งมะเร็งตับอ่อน และมะเร็งต่อมลูกหมากในรายที่พบยีนกลายพันธุ์(10)
- การผ่าตัดเพื่อลดความเสี่ยงการเกิดมะเร็งที่เกี่ยวเนื่องกับยีนกลายพันธุ์ ยกตัวอย่างเช่น พบการยีน BRCA 1 หรือ 2 กลายพันธุ์ มีข้อแนะนำในการผ่าตัดเต้านม ท่อนำไข่และรังไข่สองข้างในการลดความเสี่ยงการเกิดมะเร็ง ตามอายุที่เหมาะสมสำหรับชนิดของยีนที่กลายพันธุ์ (risk reducing surgery)(10)
สรุป
หลักการในการส่งตรวจทางพันธุศาสตร์ในผู้ป่วยมะเร็ง สามารถส่งตรวจได้จากเนื้อเยื่อมะเร็ง เพื่อวิเคราะห์ somatic mutation ซึ่งการส่งตรวจในลักษณะนี้ เหมาะสมสำหรับสถานที่ที่มีจำนวนนักพันธุ -ศาสตร์หรือผู้เชี่ยวชาญที่จำกัด แต่การส่งตรวจโดยเนื้อเยื่อบุผิว หรือเลือด เพื่อวิเคราะห์ยีนกลายพันธุ์ ลักษณะ germline mutation มีความจำเป็นอย่างยิ่งที่ผู้ป่วยและสมาชิกในครอบครัว ควรได้รับการประเมินความเสี่ยงของการเกิดโรคมะเร็งจากยีนกลายพันธุ์ ประวัติมะเร็งในครอบครัว การให้คำแนะนำก่อนการส่งตรวจ วิธีการตรวจ ข้อจำกัดของการตรวจทางพันธุศาสตร์ ตลอดจนผลการตรวจ ที่อาจจะมีความซับซ้อนในการแปลผล เช่น variant of uncertain significant (VUS) ซึ่งผู้ป่วยควรได้รับการตรวจติดตามอย่างเหมาะสม และนำข้อมูลจากการส่งตรวจทางพันธุศาสตร์ไปประยุกต์ใช้เพื่อลดความเสี่ยงการเกิดมะเร็งชนิดอื่น หรือมะเร็งในครอบครัว และเสริมประสิทธิภาพในการรักษาโรคมะเร็งนั้น
เอกสารอ้างอิง
1. Venter JC, Adams MD, Myers EW, et al. The sequence of the human genome. Science. 2001;291:1304-51.
2. Lin PH, Chen M, Tsai LW, et al. Using next‐generation sequencing to redefine BRCAness in triple‐negative breast cancer. Cancer Science. 2020;111:1375.
3. Frey MK, Pothuri BJGor, practice. Homologous recombination deficiency (HRD) testing in ovarian cancer clinical practice: a review of the literature. Gynecol Oncol Res Pract. 2017;4:1-11.
4. Tracy Wyant RA, Mamta Kalidas. What Happens During Genetic Testing for Cancer Risk? 2020 [cited 2020 Nov 27] [updated June 9, 2020. Available from: https://www.cancer.org/cancer/cancer-causes/genetics/what-happens-during-genetic-testing-for-cancer.html.
5. Findlay GM, Daza RM, Martin B, et al. Accurate classification of BRCA1 variants with saturation genome editing. Nature. 2018;562:217-22.
6. Cline MS, Liao RG, Parsons MT, et al. BRCA Challenge: BRCA Exchange as a global resource for variants in BRCA1 and BRCA2. PLoS genetics. 2018;14:e1007752.
7. Kuchenbaecker KB, Hopper JL, Barnes DR, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA. 2017;317:2402-16.
8. Antoniou A, Pharoah PD, Narod S, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 2003;72:1117-30.
9. Chen S, Parmigiani GJJocoojotASoCO. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol. 2007;25:1329.
10. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. version 1, 2021 Plymouth Meeting,PA: National Comprehensive Cancer Network; 2020 [cited 2020 Nov 27] [Available from: https://www.nccn.org/store/login/login.aspx?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/genetics_bop.pdf.
11. Moore K, Colombo N, Scambia G, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med. 2018;379:2495-505.

