การรักษาทารกในครรภ์ที่มีปัญหาโรคธาลัสซีเมียชนิดรุนแรง
(Intrauterine treatment for severe thalassemia fetuses)
เกษมศรี ศรีสุพรรณดิฐ
ดังที่ทราบกันดีแล้วว่า โรคธาลัสซีเมียชนิดรุนแรง ที่มีความจำเป็นต้องได้รับการตรวจวินิจฉัยก่อนคลอดมีทั้งหมด 3 โรค ได้แก่ ธาลัสซีเมียชนิดสายอัลฟ่า (Homozygous alpha thalassemia-1 หรือ Hemoglobin Bart’s hydrops fetalis), ธาลัสซีเมียชนิดสายเบต้า (Homozygous beta-thalassemia) และ โรคธาลัสซีเมียชนิดเบต้าอี (Beta-thalassemia / Hemoglobin E disease) ซึ่งแนวทางการดูแลรักษาสำหรับประเทศไทยในปัจจุบันเมื่อตรวจพบว่าทารกในครรภ์เป็นโรคธาลัสซีเมียชนิดรุนแรง 3 โรคดังกล่าวนี้ คือการให้ทางเลือกในการยุติการตั้งครรภ์ได้ เนื่องจากยังไม่มีแนวทางของการรักษาทารกที่เป็นโรคในขณะที่อยู่ในครรภ์ แต่ในความเป็นจริงแล้ว มีผู้ทำการศึกษาและทดลองเกี่ยวกับวิธีการรักษาโรคธาลัสซีเมียชนิดรุนแรงด้วยเช่นกัน ซึ่งเกือบทั้งหมดยังไม่ได้มีการปฏิบัติเป็นกิจวัตรสำหรับทารกในครรภ์ทุกราย แต่เป็นเพียงการรายงานผู้ป่วยหรือเป็นกรณีพิเศษในทารกแต่ละรายเท่านั้น และยังไม่เคยมีการปฏิบัติมาก่อนในประเทศไทยเช่นกัน ดังนั้นเนื้อหาในบทความนี้จะเกี่ยวกับวิธีต่างๆในการรักษาทารกในครรภ์ที่มีโรคธาลัสซีเมียชนิดรุนแรงซึ่งแม้จะยังอยู่ในการขั้นตอนของการศึกษาวิจัยและยังไม่ได้มีการแนะนำให้ปฏิบัติเป็นกิจวัตร แต่ถือเป็นการรวบรวมองค์ความรู้เกี่ยวกับเรื่องนี้เท่าที่เคยมีการรายงานในต่างประเทศโดยสังเขป
แนวคิด หลักการและเหตุผลของการให้การรักษาทารกในครรภ์ที่เป็นโรคธาลัสซีเมียชนิดรุนแรง
เนื่องจากวิธีการรักษาโรคธาลัสซีเมียทั้งสามโรคที่กล่าวมาแล้วให้หายขาดนั้น มีเพียงวิธีเดียวคือการปลูกถ่ายไขกระดูก ซึ่งโดยปกติจะทำในช่วงวัยเด็ก อย่างไรก็ตามการรักษาโดยวิธีนี้ก่อให้เกิดภาวะแทรกซ้อนรวมถึงการเสียชีวิตจากการรักษาได้ค่อนข้างสูง เนื่องจากต้องมีการใช้ยากดภูมิคุ้มกันจึงทำให้เสี่ยงต่อการติดเชื้อในกระแสเลือด และยังมีปัญหาเรื่องของการเกิดปฏิกิริยาทางภูมิคุ้มกันที่ต่อต้านไขกระดูกปกติที่ได้ทำการปลูกถ่ายให้ผู้ป่วย ดังนั้นจึงมีผู้พยายามหลีกเลี่ยงภาวะแทรกซ้อนและอุปสรรคต่างๆเหล่านี้ด้วยความพยายามทำการปลูกถ่ายไขกระดูกให้ทารกตั้งแต่ขณะที่อยู่ในครรภ์ ด้วยความหวังว่าทารกในครรภ์มีข้อได้เปรียบหลายอย่างเมื่อเทียบกับช่วงหลังคลอด จึงน่าจะให้ผลการรักษาที่ดีกว่าโดยมีภาวะแทรกซ้อนน้อยกว่า และการรักษาตั้งแต่ในขณะที่ทารกยังไม่เกิดอาการของโรคอาจทำให้อวัยวะต่างๆทำงานได้ดีกว่า ในกรณีที่รักษาเมื่อตัวโรคได้มีการดำเนินไปแล้ว
อย่างไรก็ตามในกรณีที่ทารกเป็นโรคธาลัสซีเมียชนิดสายอัลฟ่า (homozygous alpha thalassemia-1) ซึ่งแตกต่างจากโรคธาลัสซีเมียชนิดเบต้า หรือ เบต้า/อี ตรงที่ทารกจะมีอาการซีดตั้งแต่อยู่ในครรภ์ และอาจก่อให้เกิดอาการบวมน้ำและหัวใจล้มเหลวได้ ซึ่งเป็นสาเหตุหลักที่ทารกส่วนใหญ่ไม่สามารถรอดชีวิตได้จนถึงอายุครรภ์ครบกำหนดและทำให้เสียชีวิตตั้งแต่อยู่ในครรภ์ ดังนั้นในกรณีของทารกที่เป็นโรคธาลัสซีเมียชนิดอัลฟ่า จึงได้มีผู้พยายามทำการรักษาภาวะซีดของทารกเพื่อประคับประคองอาการ จนกระทั่งอายุครรภ์ครบกำหนดแล้วจึงให้คลอดเพื่อทำการรักษา เช่น การปลูกถ่ายไขกระดูก ในช่วงหลังคลอด ต่อไป
นอกจากนี้ยังมีผู้ทำการศึกษาวิธีการรักษาในระดับของยีน เนื่องจากโรคธาลัสซีเมียถือว่าเป็นโรคที่เกิดจากความผิดปกติของยีนในร่างกายผู้ป่วย ดังนั้นถ้าสามารถแก้ไขที่สาเหตุของการเกิดโรคได้จริงๆ โดยทำการเปลี่ยนแปลงที่ระดับยีนให้กลับมาทำงานเป็นปกติ น่าจะทำให้โรคนี้หายขาดได้ อย่างไรก็ตามการศึกษาด้วยวิธีการเปลี่ยนแปลงยีนนี้ยังเป็นเรื่องที่ซับซ้อนและใหม่มาก ในปัจจุบันจึงยังเป็นเพียงการทดลองในสัตว์ เช่น หนู เท่านั้น และยังไม่ได้มีการศึกษาในมนุษย์แต่อย่างใด
การรักษาด้วยวิธีให้เลือดแก่ทารกในครรภ์ (Intrauterine blood transfusion)
เนื่องจากทารกที่มีปัญหาโรคธาลัสซีเมียชนิดสายอัลฟ่า จะแสดงอาการของโรคตั้งแต่อยู่ในครรภ์ซึ่งเกิดจากทารกไม่สามารถสร้างอัลฟ่าโกลบิน (alpha globin chain) ที่เป็นส่วนประกอบสำคัญของฮีโมโกลบินเอฟ (Hemoglobin F) ที่เป็นฮีโมโกลบินหลักของทารกในครรภ์ได้ จึงทำให้ทารกเกิดอาการซีด ตับม้ามโต และบวมน้ำจากหัวใจล้มเหลว ถ้าไม่ได้ทำการรักษา ในที่สุดแล้วทารกจะเสียชีวิตทุกรายตั้งแต่ในครรภ์หรืออาจเสียชีวิตภายในเวลาไม่นานหลังคลอด แต่ได้มีผู้พยายามทำการประคับประคองไม่ให้ทารกเสียชีวิตโดยการให้เลือดแก่ทารกเป็นระยะๆตั้งแต่ขณะอยู่ในครรภ์ แต่เมื่อคลอดออกมาแล้ว ทารกกลุ่มนี้ยังต้องได้รับการเติมเลือดตลอดชีวิต รวมทั้งต้องได้รับยาขับเหล็กเหมือนผู้ป่วยธาลัสซีเมียชนิดรุนแรงทั่วไป อย่างไรก็ตามจากหลักการที่ได้กล่าวมาแล้วว่าแท้จริงแล้วการรักษาโรคธาลัสซีเมียให้หายขาดนั้นสามารถทำได้โดยการปลูกถ่ายไขกระดูกในช่วงหลังคลอด ดังนั้นจึงได้มีผู้พยายามประคับประคองให้ทารกที่มีปัญหาโรคธาลัสซีเมียชนิดอัลฟ่านี้ สามารถมีชีวิตรอดจนกระทั่งอายุครรภ์ครบกำหนด เพื่อให้ได้รับการรักษาให้หายขาดด้วยการปลูกถ่ายไขกระดูกในช่วงหลังคลอดต่อไป
ซึ่งขั้นตอนการให้เลือดแก่ทารกในครรภ์นั้นมีวิธีการโดยสังเขปดังนี้(1)
1.เตรียมเลือดที่ต้องการให้แก่ทารกในครรภ์ให้พร้อม โดยมักให้เป็น Leukocyte-poor packed red cell, group O, Rh negative, CMV (cytomegalovirus) negative, irradiated และควรมีความเข้มข้นที่มากพอควร เพื่อที่ลดปริมาตรเลือดที่ต้องให้แก่ทารกในครรภ์ ซึ่งโดยส่วนใหญ่เลือดที่นำมาให้ทารกควรมี Hematocrit ประมาณ 80%
2.เป้าหมายของ Hematocrit ที่ต้องการอาจอยู่ที่ประมาณ 40-50% ในกรณีทารกที่ยังไม่มีอาการบวมน้ำเกิดขึ้น แต่ทั้งนี้อาจพิจารณาร่วมกับอายุครรภ์ของทารกว่าเป็นเท่าใด แล้วตั้งเป้าหมายของ Hematocrit หรือ ระดับ Hemoglobin ให้อยู่ในเกณฑ์ปกติของอายุครรภ์นั้นๆก็ได้ ซึ่งการคำนวณปริมาณเลือดที่ต้องการเติมให้ทารกในครรภ์ ขึ้นอยู่กับน้ำหนักของทารกและระดับ Hematocrit ที่ต้องการ ซึ่งมีการคำนวณได้หลายวิธี ตัวอย่างเช่น เมื่อนำค่า 0.02 มาคูณกับน้ำหนักตัวของทารก จะได้ปริมาณที่จำเป็นต้องเติมให้ทารกเพื่อที่จะทำให้ระดับ Hematocrit เพิ่มขึ้นจากเดิม 10% เป็นต้น
3.ในทารกที่มีภาวะซีดอย่างรุนแรงนั้น ในครั้งแรกของการให้เลือดอาจให้ปริมาณน้อยกว่าที่ต้องการเล็กน้อย เนื่องจากการให้เลือดในปริมาณมากในครั้งเดียว ถือเป็นการเพิ่มปริมาตรเลือดโดยรวมของร่างกายทารก และอาจส่งผลให้หัวใจทารกทำงานหนักเกินไปจนเกิดหัวใจล้มเหลวได้ ดังนั้นจึงมีผู้แนะนำว่าอาจทำการให้เลือดในปริมาณไม่มากนักก่อนในครั้งแรก จากนั้นจึงให้เลือดอีกครั้งในประมาณ 2 วันต่อมา และอาจมีการให้เลือดเป็นระยะๆทุก 2-4 สัปดาห์ เป็นต้น
4.สำหรับเทคนิคการทำนั้น โดยทั่วไปอาจพิจารณาให้เลือดทารกผ่านทาง intraperitoneal ก็ได้ แต่ในกรณีที่ทารกเริ่มมีอาการบวมน้ำแล้ว การให้เลือดผ่านทางเส้นเลือดโดยตรง (intravascular) เช่น เส้นเลือดสายสะดือ หรือ เส้นเลือดส่วน portal vein ในบริเวณตับของทารก จะมีประสิทธิภาพมากกว่า ซึ่งในทางปฏิบัติของหน่วยเวชศาสตร์มารดาและทารกของ โรงพยาบาลมหาราชนครเชียงใหม่ การให้เลือดทารกในครรภ์จะทำผ่านเส้นเลือดสายสะดือ โดยเลือกตำแหน่งที่เข็มสามารถเข้าถึงสายสะดือได้ง่ายที่สุด (ไม่จำเป็นต้องเป็นตำแหน่ง placental cord insertion ก็ได้) และใช้เข็ม spinal needle ในการให้เลือดทารกแก่ทารก ซึ่งเทคนิคโดยรวมจะคล้ายกับหัตถการเจาะเลือดสายสะดือ (cordocentesis) ที่ปฏิบัติโดยทั่วไป
จนถึงปัจจุบันมีผู้พยายามให้เลือดแก่ทารกในครรภ์ที่มีปัญหาโรคธาลัสซีเมียรุนแรงชนิดสายอัลฟ่านี้ประมาณ 20 ราย (2) ซึ่งโดยรวมแล้วพบว่าการให้เลือดแก่ทารกตั้งแต่อยู่ในครรภ์จะให้ผลลัพธ์ในเบื้องต้นที่ดีกว่าเมื่อเทียบกับเริ่มให้เลือดแก่ทารกเมื่อหลังคลอดแล้ว จึงเปรียบเสมือนว่าการรักษาตั้งแต่อยู่ในครรภ์จะช่วยลด morbidity และ mortality ของทารกได้ อย่างไรก็ตามทารกในกลุ่มนี้ยังคงเป็นผู้ป่วยธาลัสซีเมียชนิดรุนแรงที่ต้องได้รับเลือดเป็นระยะๆพร้อมทั้งได้รับยาขับเหล็กเช่นกัน ดังนั้นจึงมีผู้ค้นหาการรักษาเพิ่มเติม คือใช้วิธีการให้เลือดทารกเป็นระยะๆตั้งแต่อยู่ในครรภ์ เป็นการประคับประคองให้ทารกมีชีวิตรอด หลังจากนั้นในช่วงหลังคลอดจึงได้ทำการรักษาให้หายขาดด้วยการปลูกถ่ายไขกระดูก ซึ่งจนถึงปัจจุบันได้มีรายงานทารกที่ได้รับการรักษาด้วยวิธีเช่นนี้เป็นจำนวนหนึ่ง(3) ดังตารางที่ 1 (แต่รายงานผู้ป่วยในตารางที่ 1 นี้ ได้รวบรวมทารกที่เป็นโรคธาลัสซีเมียรุนแรงชนิดสายอัลฟ่า ที่ได้รับการรักษาด้วยวิธีการปลูกถ่ายไขกระดูกในช่วงหลังคลอดทั้งหมด โดยทารกบางรายอาจไม่เคยได้รับเลือดมาก่อนในช่วงที่อยู่ในครรภ์)
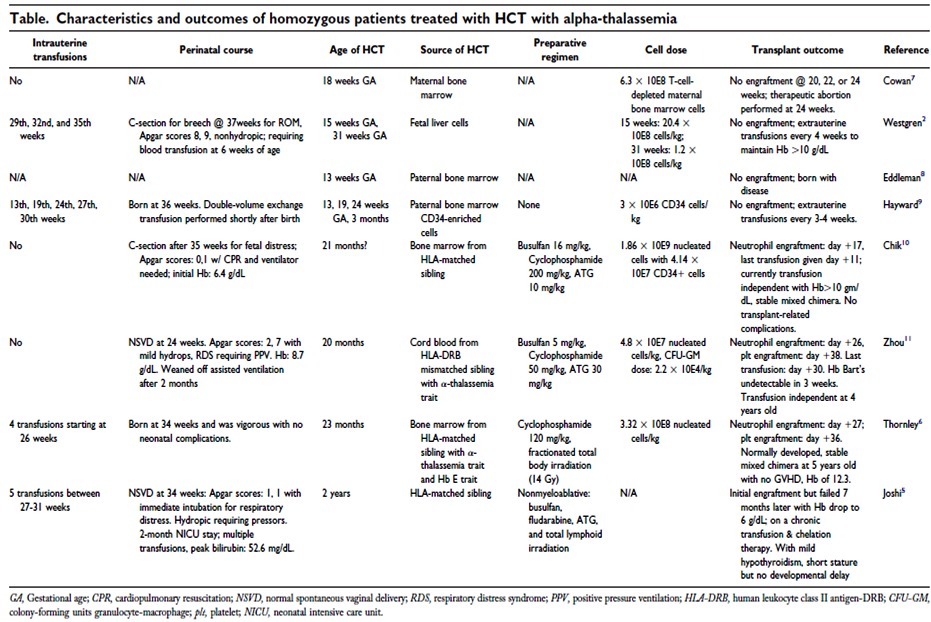
ตารางที่ 1 แสดงลักษณะและผลลัพธ์การรักษาของทารกที่เป็นโรคธาลัสซีเมียรุนแรงชนิดสายอัลฟ่า ที่ได้รับการรักษาด้วยการปลูกถ่ายไขกระดูกในช่วงหลังคลอด ที่มา: Yi JS, Moertel CL, Baker KS. Homozygous alpha-thalassemia treated with intrauterine transfusions and unrelated donor hematopoietic cell transplantation. J Pediatr 2009 May;154(5):766-8.
การรักษาด้วยวิธีปลูกถ่ายไขกระดูกด้วยเซลล์ต้นกำเนิดให้แก่ทารกในครรภ์ (Intrauterine hematopoietic stem cell transplantation)
Stem cells หรือเซลล์ต้นกำเนิด คือเซลล์ตัวอ่อนที่มีความสามารถพิเศษในการปรับเปลี่ยนหรือเปลี่ยนแปลงตนเองให้กลายเป็นเซลล์ชนิดใดก็ได้ ขึ้นอยู่กับสภาพแวดล้อมและปัจจัยต่างๆและชนิดของเซลล์ต้นกำเนิดนั้นๆเอง ซึ่งถ้ากล่าวโดยรวมสามารถแบ่งเซลล์ต้นกำเนิดออกเป็น 3 ลักษณะคร่าวๆตามความสามารถในการเปลี่ยนแปลงของเซลล์เอง ได้แก่
1.Totipotent stem cells คือเซลล์ดั้งเดิมของเซลล์ทั้งหมด ซึ่งมีความสามารถที่จะเปลี่ยนแปลงหรือเจริญแบ่งตัวไปเป็นเซลล์ชนิดใดก็ได้ ตัวอย่างเช่น เซลล์ของตัวอ่อนในระยะแรกที่เกิดขึ้นหลังจากมีการปฏิสนธิ ที่เรียกว่าตัวอ่อนระยะ Morula ซึ่งเซลล์ในระยะนี้ถือเป็น Totipotential stem cell เนื่องจากมีความสามารถในการเปลี่ยนแปลงหรือเจริญไปเป็นอวัยวะทุกอย่างภายในร่างกายมนุษย์ได้ทั้งหมด
2.Pluripotent stem cells คือเซลล์ในส่วน inner cell mass ของตัวอ่อนมนุษย์ที่ผ่านการพัฒนามาแล้วระยะหนึ่งจนถึงระยะ Blastocyst ซึ่งเซลล์ในระยะนี้จะพัฒนาไปเป็นอวัยวะต่างๆของร่างกายได้หลายประเภท แต่ความสามารถในการเปลี่ยนแปลงตนเองถือว่าน้อยกว่า totipotential stem cells
3.Unipotent stem cells คือเซลล์ต้นกำเนิดที่มีหน้าที่จำเพาะของอวัยวะแต่ละระบบในร่างกาย และเจริญเติบโตเพื่อเป็นเซลล์ของระบบนั้นๆโดยเฉพาะ เช่น เซลล์ต้นกำเนิดของระบบประสาท ที่จะเจริญเป็น neuron cells, เซลล์ต้นกำเนิดของหัวใจ และ เซลล์ต้นกำเนิดของระบบเลือด (hematopoietic stem cells) ที่จะเจริญต่อไปเป็นเซลล์เม็ดเลือดต่างๆในร่างกาย เป็นต้น
หลักการและเหตุผลในการรักษาด้วยวิธีปลูกถ่ายไขกระดูกให้ทารกในครรภ์(4)
โดยธรรมชาติของทารกในครรภ์นั้น เป็นช่วงที่เซลล์ต้นกำเนิดในร่างกายทารกมีการเพิ่มจำนวนและเดินทางไปตามอวัยวะต่างๆในร่างกาย เพื่ออยู่ในที่นั้นๆและแบ่งตัวเพิ่มขึ้นเรื่อยๆ ซึ่งในแต่ละ compartment ของร่างกายทารกนั้นมีความสามารถในการปรับตัวให้เกิดสภาพแวดล้อมที่เหมาะสมแก่เซลล์ต้นกำเนิดที่จะเกิดการแบ่งตัวและพัฒนาตนเอง (proliferation & differentiation) ได้อย่างมีประสิทธิภาพอยู่แล้ว นอกจากนี้ในช่วงอายุครรภ์ก่อน 13-14 สัปดาห์ ทารกในครรภ์มีขนาดร่างกายที่เล็กมาก น้ำหนักโดยรวมไม่เกิน 50 กรัม ดังนั้นถ้ามีความจำเป็นต้องได้รับการปลูกถ่ายเซลล์ต้นกำเนิดในระยะนี้ แม้จะให้ได้เพียงปริมาณเล็กน้อย แต่ถือว่าเป็นขนาดที่มากเมื่อเทียบกับขนาดตัวของทารก (dose per kilogram) และที่สำคัญอีกประการหนึ่งคือ ระบบภูมิคุ้มกันทารกในช่วงอายุครรภ์น้อยๆจะยังทำงานได้ไม่สมบูรณ์มากนัก ดังนั้นแม้ว่ามีการปลูกถ่ายเซลล์ซึ่งเปรียบเสมือนเป็นเซลล์แปลกปลอมของร่างกายเข้าไป ก็มักจะไม่มีปฏิกิริยาต่อต้านที่รุนแรง เพราะร่างกายทารกเข้าใจว่าเซลล์ที่ปลูกถ่ายเข้าไปนั้นเป็นเซลล์ของร่างกายทารกเอง (recognized as “self”) และทำให้ลดความจำเป็นในการใช้ยากดภูมิคุ้มกันอีกด้วย ซึ่งในทางทฤษฎีนั้น โรคที่สามารถทำการรักษาให้หายขาดได้ด้วยวิธีการปลูกถ่ายไขกระดูกในช่วงหลังคลอดควรจะสามารถรักษาด้วยการปลูกถ่ายไขกระดูกตั้งแต่ช่วงที่เป็นทารกในครรภ์ได้ทุกราย แต่ความเป็นจริงแล้วมีความซับซ้อนมากกว่านั้นเนื่องจากลักษณะทางชีวภาพของโรคแต่ละชนิดแตกต่างกัน ทำให้การรักษาจะได้ผลดีในโรคบางประเภทเท่านั้น
โดยสรุปแล้วข้อได้เปรียบของการรักษาด้วยวิธีการปลูกถ่ายไขกระดูกให้ทารกในครรภ์ ได้แก่(5)
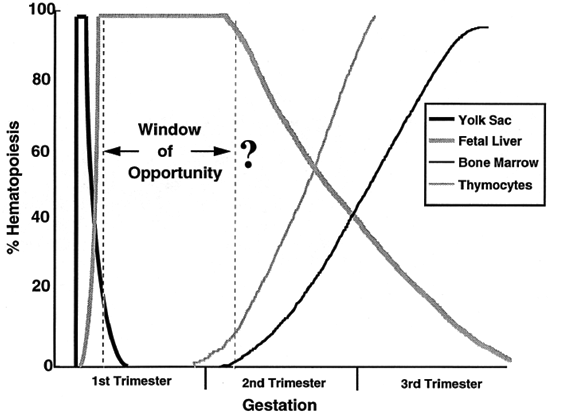
1.กลไกการเกิด engraftment (การที่ทารกยอมรับเซลล์ที่ปลูกถ่ายให้ไปว่าเป็นเซลล์ของตนเอง) มาจากการแข่งขันกันระหว่างเซลล์ทารกเองและเซลล์ที่ปลูกถ่าย ในส่วนของร่างกายที่เป็นที่รองรับเซลล์ต้นกำเนิดอยู่แล้วโดยธรรมชาติ ซึ่งตามช่วงเวลาของอายุครรภ์และการพัฒนาการของระบบโลหิตวิทยาของทารกในครรภ์ พบว่ามีช่วงที่อาจเรียกว่าเป็น Window of opportunity ดังภาพที่ 1 ซึ่งเป็นช่วงประมาณปลายไตรมาสแรกของการตั้งครรภ์ เนื่องจากเป็นช่วงที่การสร้างเม็ดเลือดจากส่วน yolk sac ของทารกได้หมดหน้าที่ลง และการเริ่มสร้างเม็ดเลือดจากไขกระดูกทารกยังไม่เริ่มต้นขึ้น ดังนั้นถ้าทารกได้รับการปลูกถ่ายเซลล์ต้นกำเนิดไปในช่วงเวลานี้ จึงมีความเป็นไปได้ที่ไขกระดูกของทารกอาจมีที่ว่างเพียงพอสำหรับเซลล์ต้นกำเนิดที่ได้รับเข้าไปได้
ภาพที่ 1 แสดงขั้นตอนการสร้างระบบโลหิตวิทยาของทารกในครรภ์ และแสดงช่วง Window of opportunity ซึ่งน่าจะเป็นช่วงที่เหมาะสมในการปลูกถ่ายไขกระดูกให้ทารกในครรภ์ (ที่มา: Flake AW, Zanjani ED. In utero transplantation for thalassemia. Ann N Y Acad Sci 1998 Jun 30;850:300-11. )
2.ข้อได้เปรียบทางระบบภูมิคุ้มกันของทารกในครรภ์ ดังที่ได้กล่าวไปแล้วว่าถ้าทำการปลูกถ่ายเซลล์ต้นกำเนิดในช่วงเวลาที่เหมาะสม คือในช่วงก่อนที่ต่อมไทมัสจะทำหน้าที่อย่างสมบูรณ์ จะทำให้ทารกไม่เกิดการต่อต้านเซลล์แปลกปลอมที่ได้รับการปลูกถ่าย และทำให้ร่างกายทารกเข้าใจว่าเซลล์แปลกปลอมที่ได้รับนั้นเป็นเซลล์ปกติของร่างกายตนเอง
3.การรักษาตั้งแต่อยู่ในครรภ์ ซึ่งถือว่าเป็นการรักษาก่อนที่จะเกิดอาการของโรค (โดยเฉพาะกรณีของโรคธาลัสซีเมียรุนแรงชนิดสายเบต้า และ เบต้า/อี ที่อาการของโรคจะเกิดขึ้นในช่วงหลังคลอดเท่านั้น) น่าจะเป็นประโยชน์เนื่องจากอวัยวะต่างๆของทารกยังมีความแข็งแรงและยังไม่ถูกทำลายจากตัวโรค จึงน่าจะช่วยลด morbidity & mortality และทำให้คุณภาพชีวิตโดยรวมดีขึ้นได้
จะเห็นได้ว่าการปลูกถ่ายไขกระดูกด้วยเซลล์ต้นกำเนิดให้ทารกตั้งแต่อยู่ในครรภ์มีข้อดีหลายประการ (6) ดังข้อสรุปในภาพที่ 2 และ ตารางที่ 2
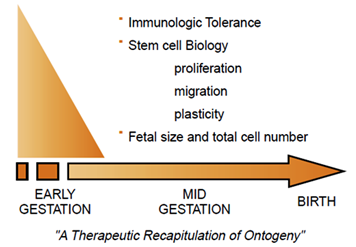
ภาพที่ 2 แสดงหลักการและเหตุผลในการใช้เซลล์ต้นกำเนิดเพื่อรักษาทารกในครรภ์ (ที่มา: Flake AW. In utero stem cell transplantation. Best Pract Res Clin Obstet Gynaecol 2004 Dec;18(6):941-58.)
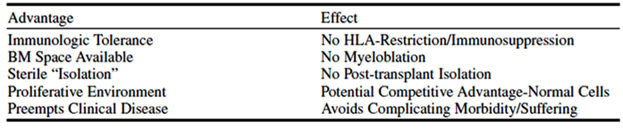
ตารางที่ 2 แสดงข้อได้เปรียบของการรักษาทารกในครรภ์ด้วยการปลูกถ่ายเซลล์ต้นกำเนิดโลหิต (ที่มา: Flake AW, Zanjani ED. In utero transplantation for thalassemia. Ann N Y Acad Sci 1998 Jun 30;850:300-11.)
จากรายงานทางการแพทย์ในปัจจุบันพบว่าที่ทารกในครรภ์ที่เป็นโรคธาลัสซีเมียรุนแรงที่ได้รับการปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์ รวมแล้วประมาณ 16 ราย ดังตารางที่ 3 ซึ่งในจำนวนนี้มีทารก 2 รายที่เป็นโรคธาลัสซีเมียชนิดสายอัลฟ่า โดยทารกรายหนึ่งได้รับการปลูกถ่ายไขกระดูกจากไขกระดูกของบิดา และจากการตรวจทางห้องปฏิบัติการพบว่าการปลูกถ่ายให้ผลสำเร็จ แต่สำหรับทางคลีนิกทารกยังคงเป็นผู้ป่วยที่ต้องการได้รับเลือดอย่างต่อเนื่องเหมือนผู้ป่วยโรคธาลัสซีเมียรุนแรง ส่วนทารกอีกรายนั้นได้รับการปลูกถ่ายด้วยเซลล์จากตับของทารกในครรภ์ (fetal liver) แต่ไม่พบว่าการปลูกถ่ายประสบความสำเร็จแต่อย่างใด
สำหรับในทารกที่เป็นโรคธาลัสซีเมียรุนแรงชนิดสายเบต้านั้น มีรายงานว่ามีทารกทั้งหมด 14 รายที่ได้รับการปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์ ซึ่งผลลัพธ์ที่ได้แตกต่างกันออกไป ในทารกบางคนตรวจพบว่ามี engraftment เกิดขึ้น แต่พบว่าทารกทุกรายยังคงต้องการได้รับการเติมเลือดอยู่ตลอด จึงแสดงให้เห็นว่ายังไม่สามารถทำให้ตัวโรคหายขาดได้
ดังนั้นจากที่ได้กล่าวมาแล้วข้างต้นว่า แม้ในทางทฤษฎีแล้วการรักษาโรคธาลัสซีเมียชนิดรุนแรงด้วยวิธีการปลูกถ่ายไขกระดูกตั้งแต่ทารกอยู่ในครรภ์ควรจะได้ผลดี แต่ในความเป็นจริงไม่เป็นเช่นนั้นเสมอไป เนื่องจากการรักษาด้วยวิธีนี้มักได้ผลลัพธ์ดีในกรณีที่ทารกเป็นโรคกลุ่ม immunodeficiency หรือภูมิคุ้มกันบกพร่องแต่กำเนิด เช่น Severe combined immunodeficiency disease (SCID) มากกว่า เนื่องด้วยสภาพแวดล้อมของร่างกายทารกที่เปิดโอกาสในการยอมรับ donor cells ได้ง่ายเมื่อเทียบกับทารกที่เป็นโรคธาลัสซีเมีย ดังตารางที่ 4
จากเหตุผลที่กล่าวมาข้างต้น ในการรักษาทารกในครรภ์ที่เป็นโรคธาลัสซีเมียรุนแรงด้วยวิธีการปลูกถ่ายไขกระดูก จึงควรมีข้อพิจารณาและทราบถึงลักษณะทางชีวภาพของทารกกลุ่มนี้ ดังต่อไปนี้ (5)
- 1.ทารกที่เป็นโรคธาลัสซีเมียรุนแรงชนิดสายอัลฟ่า (Homozygous alpha thalassemia)
- a.โดยปกติแล้วการสร้างฮีโมโกลบินที่ประกอบด้วยอัลฟ่าโกลบิน (alpha- globin haemoglobin) เช่น Hemoglobin F ซึ่งเป็นฮีโมโกลบินหลักของทารกในครรภ์ จะเริ่มเมื่ออายุครรภ์ 8 สัปดาห์ ดังนั้นในทารกที่เป็นโรคกลุ่มนี้สามารถแสดงอาการซีดได้ตั้งแต่อายุครรภ์น้อยๆ เช่น ประมาณ 10 สัปดาห์อาจพบลักษณะรกที่หนากว่าปกติ (placentomegaly) และมีรายงานว่าพบทารกเกิดอาการบวมน้ำ (hydrops fetlais) ได้ตั้งแต่อายุครรภ์ 12-14 สัปดาห์
- b.ในช่วงดังกล่าว ผลจากตัวโรคทำให้การสร้างเม็ดเลือด (hematopoiesis) ซึ่งเกิดขึ้นที่ตับของทารกทำได้ไม่สมบูรณ์ และจะเกิดการสร้างเม็ดเลือดทดแทนในตำแหน่งอื่นๆของร่างกาย (extramedullary hematopoiesis) และมีการเพิ่มจำนวนเซลล์ของระบบการสร้างเม็ดเลือดร่วมด้วย (hypercellular hematopoiesis environment) ซึ่งการเกิดเหตุการณ์ทั้งหมดนี้อาจส่งผลให้สภาพแวดล้อมโดยรวมของระบบโลหิตของทารกไม่เหมาะสมหรือทำให้การปลูกถ่ายเซลล์ใหม่ๆจาก donor เข้าไปในร่างกายทำได้ยาก
- c.อย่างไรก็ตามแม้การปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์อาจให้ผลลัพธ์ไม่ดีนัก แต่การรักษาด้วยวิธีนี้มาก่อนตั้งแต่ทารกยังอยู่ในครรภ์ น่าจะทำให้การปลูกถ่ายไขกระดูกอีกครั้งสำหรับทารกในคนดังกล่าวในช่วงหลังคลอด โดยใช้ donor cells จากคนเดิม ประสบความสำเร็จมากขึ้น
- 2.ทารกที่เป็นโรคธาลัสซีเมียรุนแรงชนิดสายเบต้า (Homozygous beta thalassemia)
- a.โดยปกติแล้ว การสร้างฮีโมโกลบินที่มีสายเบต้าโกลบินเป็นส่วนประกอบ (beta-globin-dependent haemoglobin) จะยังไม่เกิดขึ้นจนกระทั่งช่วงเวลาหลังคลอด ดังนั้นในช่วงที่ทารกอยู่ในครรภ์ การผลิตฮีโมโกลบินต่างๆจะดำเนินไปอย่างปกติ ซึ่งแสดงให้เห็นว่าสภาพแวดล้อมทางระบบโลหิตวิทยาของทารกกลุ่มนี้จะใกล้เคียงกับทารกปกติที่ไม่เป็นโรค
- b.คำถามที่เกิดขึ้นคือ ถ้าทำการปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์ การ engraftment ของ donor cells จะเกิดขึ้นได้หรือไม่ในสภาพแวดล้อมที่คล้ายคลึงกับทารกปกติเช่นนี้ และถ้าสามารถเกิดขึ้นได้จริง ระดับของการ engraftment จะเพียงพอต่อการรักษาโรคหรือไม่
- c.จากผลการศึกษาที่ผ่านมา พบว่าการรักษาโรคธาลัสซีเมียรุนแรงสามารถทำได้ด้วยการทำให้เกิด mixed chimerism (คือการทำให้มีเซลล์ 2 ชนิดที่มาจากคนละต้นกำเนิดในทารกคนเดียวกัน หมายถึงเซลล์ของผู้ป่วยเองและเซลล์ที่ได้รับการปลูกถ่ายเข้าไปในภายหลัง) ดังนั้นการเกิด engraftment แม้ว่าจะมีระดับที่ไม่มากนัก แต่ก็น่าจะส่งผลในการรักษาผู้ป่วยกลุ่มนี้ได้
- d.อย่างไรก็ตามแม้การรักษาด้วยการปลูกถ่ายไขกระดูกให้ทารกตั้งแต่ยังอยู่ในครรภ์ อาจไม่สามารถทำให้โรคหายขาดได้ในทันที แต่การกระทำเช่นนี้น่าจะทำให้การปลูกถ่ายไขกระดูกโดยใช้ donor cells จากคนเดิม ที่จะกระทำให้ทารกอีกครั้งในช่วงหลังคลอดได้ผลลัพธ์ที่ดีขึ้น โดยไม่มีความจำเป็นต้องให้ยากดภูมิคุ้มกันมากนัก ซึ่งช่วยลดภาวะแทรกซ้อนที่เกิดจากการให้ยากดภูมิคุ้มกันเหล่านี้ได้ด้วย

ตารางที่ 3 แสดงทารกที่เป็นโรคธาลัสซีเมียรุนแรงที่ได้รับการปลูกถ่ายไขกระดูกตั้งแต่ขณะอยู่ในครรภ์ (ที่มา: Tiblad E, Westgren M. Fetal stem-cell transplantation. Best Pract Res Clin Obstet Gynaecol 2008 Feb;22(1):189-201.)

ตารางที่ 4 แสดงความแตกต่างของทารกที่เป็นโรคธาลัสซีเมียและโรคภูมิคุ้มกันบกพร่องแต่กำเนิด ซึ่งทำให้ได้ผลลัพธ์ในการรักษาด้วยวิธีปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์ที่แตกต่างกัน (ที่มา: Jones DR. In utero stem cell transplantation: two steps forward but one step back? Expert Opin Biol Ther 2001 Mar;1(2):205-12.)
จากที่กล่าวมาแล้วข้างต้น ได้มีผู้พยายามคิดแนวทางการรักษาด้วยวิธีปลูกถ่ายไขกระดูกตั้งแต่อยู่ในครรภ์สำหรับทารกที่เป็นโรคธาลัสซีเมียรุนแรง ดังภาพที่ 3
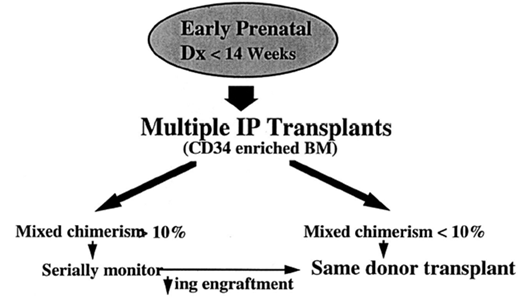
ภาพที่ 3 แสดงแนวทางการรักษาด้วยวิธีปลูกถ่ายไขกระดูกด้วยเซลล์โลหิตต้นกำเนิดตั้งแต่อยู่ในครรภ์สำหรับทารกที่เป็นโรคธาลัสซีเมียรุนแรง (ที่มา: Flake AW, Zanjani ED. In utero transplantation for thalassemia. Ann N Y Acad Sci 1998 Jun 30;850:300-11.)
การรักษาด้วยวิธีการปรับเปลี่ยนยีนของทารก (Fetal gene therapy)
การรักษาด้วยวิธีนี้มีหลักการคร่าวๆคือ เนื่องจากโรคธาลัสซีเมียเป็นโรคที่เกิดจากความผิดปกติของยีน เช่น deletion หรือ mutation ดังนั้นจึงมีผู้คิดค้นวิธีการรักษาที่สาเหตุของโรคโดยตรงคือเปลี่ยนแปลงยีนที่ผิดปกติให้กลับมาเป็นยีนปกติอีกครั้ง โดยใช้สิ่งที่เรียกว่า vector ซึ่งอาจเป็น virus ในการบรรจุยีนปกติ แล้วจึงฉีด vector นี้เข้าไปในร่างกายผู้เป็นโรค เพื่อให้ยีนปกติดังกล่าวเข้าไปแทนที่ยีนที่ผิดปกติของผู้ป่วย เช่นมีผู้ทำการทดลองในหนูที่ทำให้เกิดโรคธาลัสซีเมียรุนแรง ทั้งชนิดเบต้า และ อัลฟ่า โดยใช้ lentivirus vector ทีมี beta-gobin และ alpha-globin gene แต่ผลที่ได้ยังไม่เป็นที่น่าพอใจนัก(7)
อย่างไรก็ตามวิธีการรักษาดังกล่าวเป็นเรื่องที่ซับซ้อนเป็นอย่างมาก ยังไม่เคยมีการปฏิบัติในมนุษย์มาก่อน เพราะทุกวันนี้เป็นเพียงข้อมูลที่ได้จากสัตว์ทดลองเท่านั้น ยังมีหลายสิ่งที่ยังหาคำตอบไม่ได้ และต้องการการศึกษาเพิ่มเติม เช่น ระยะเวลาที่เหมาะสม, วิธีที่ปลอดภัยที่สุดในการทำ, เซลล์เป้าหมายที่สมควรได้รับ vector เข้าไป, ทำอย่างไรเซลล์และยีนที่มอบให้ผู้ป่วยจะไม่ทำอันตรายแก่ผู้ป่วยในภายหลัง เช่น แบ่งตัวจนกลายเป็น leukemia เป็นต้น รวมถึงความเหมาะสมทางด้านจริยธรรมของการรักษาด้วยวิธีนี้อีกด้วย
สรุป
การรักษาทารกในครรภ์ที่เป็นโรคธาลัสซีเมียรุนแรง ในปัจจุบันอาจแบ่งได้เป็น 3 วิธี คือการรักษาแบบประคับประคองโดยการให้เลือดแก่ทารกเป็นระยะๆ ในกรณีทารกเป็นโรคธาลัสซีเมียชนิดอัลฟ่า หรือการปลูกถ่ายไขกระดูกโดยใช้เซลล์โลหิตต้นกำเนิด และ วิธีการรักษาในระดับยีน ซึ่งทั้ง 3 วิธีนี้ไม่เคยมีการปฏิบัติในประเทศไทยมาก่อน และแม้แต่ในระดับนานาชาติก็ไม่ได้ปฏิบัติเป็นกิจวัตร และทำได้ในโรงพยาบาลที่มีความพร้อมและความชำนาญในด้านนี้เป็นอย่างสูงเท่านั้น ซึ่งข้อมูลทุกอย่างยังอยู่ในขั้นตอนของการศึกษาทดลองเพื่อหาแนวทางที่เหมาะสมเพื่อประโยชน์สูงสุดแก่ผู้ป่วยต่อไป
เอกสารอ้างอิง
(1) Prenatal diagnosis and fetal therapy. In: F Gary Cunningham, Kenneth J Leveno, Steven L Bloom, John C Hauth, Dwight J Rouse, Catherine Y Spong, editors. Williams Obstetrics. 23 ed. Mc Graw hill; 2010. p. 287-311.
(2) Vichinsky E. Complexity of alpha thalassemia: growing health problem with new approaches to screening, diagnosis, and therapy. Ann N Y Acad Sci 2010 Aug;1202:180-7.
(3) Yi JS, Moertel CL, Baker KS. Homozygous alpha-thalassemia treated with intrauterine transfusions and unrelated donor hematopoietic cell transplantation. J Pediatr 2009 May;154(5):766-8.
(4) Tiblad E, Westgren M. Fetal stem-cell transplantation. Best Pract Res Clin Obstet Gynaecol 2008 Feb;22(1):189-201.
(5) Flake AW, Zanjani ED. In utero transplantation for thalassemia. Ann N Y Acad Sci 1998 Jun 30;850:300-11.
(6) Flake AW. In utero stem cell transplantation. Best Pract Res Clin Obstet Gynaecol 2004 Dec;18(6):941-58.
(7) Han XD, Lin C, Chang J, Sadelain M, Kan YW. Fetal gene therapy of alpha-thalassemia in a mouse model. Proc Natl Acad Sci U S A 2007 May 22;104(21):9007-11.