Simple ultrasound rules to differentiate benign from malignant conditions
ธีระ ทองสง
บทบาทของอัลตราซาวด์ต่อก้อนที่ปีกมดลูก
การตรวจอัลตราซาวด์ทางนรีเวชบ่อยครั้งที่พบก้อนผิดปกติที่รังไข่ ซึ่งอาจนำไปสู่การวินิจฉัยและรักษามะเร็งตั้งแต่ระยะเริ่มต้นได้ การพยายามแยกก้อนเนื้องอกธรรมดาจากมะเร็ง ซึ่งนับว่ามีความสำคัญมาก เพราะแนวทางในการดูแลรักษาต่างกัน ทำให้การดูแลรักษาก้อนที่รังไข่หรือปีกมดลูกดีขึ้นกว่าแต่ก่อนมาก โดยเฉพาะอย่างยิ่งทำให้หลีกเลี่ยงการผ่าตัดโดยไม่จำเป็นในราย functional cyst ช่วยคัดเลือกหลายรายเพื่อการผ่าตัดผ่านทางแลพพาโรสโคป เช่น การแยก dermoid cyst ออกจากมะเร็ง แผนการรักษาจะเปลี่ยนไป คือนิยมผ่าทางแลพพาโรสโคปกันมากขึ้นและได้ผลดี(1) ถ้าสงสัยมะเร็งจะได้วางแผน complete staging เป็นต้น ประโยชน์สูงสุดของการตรวจ TVS ในกรณีก้อนที่ปีกมดลูก คือ ช่วยแยกก้อนจาก functional change, เนื้องอกชนิดธรรมดาและมะเร็ง แม้บางครั้งแยกได้ไม่แน่นอนแต่ก็บอกแนวโน้มได้เป็นส่วนมาก ยิ่งการใช้ดอพเลอร์ควบคู่กับรูปลักษณ์ (morphology) ทางคลื่นเสียงความถี่สูงช่วยในการแยกก้อนเนื้อระหว่างชนิดธรรมดากับมะเร็งได้ง่ายขึ้น
ภาพของก้อนปีกมดลูกจาก TVS มักจะให้แนวทางหลัก ๆ ในการดูแลรักษาขั้นต่อไปได้อย่างเหมาะสม ซึ่งแนวทางที่เป็นไปได้คือ
- ไม่ต้องตรวจเพิ่มเติม เพราะไม่มีก้อนที่สำคัญ (หลายครั้งที่ส่งตรวจเพราะไม่แน่ใจว่ามีก้อนหรือไม่)
- ก้อนเป็นเพียง functional cyst หรือฟอลลิเคิลที่โตผิดปกติ ไม่จำเป็นต้องตรวจติดตามแต่ประการใด
- ก้อนที่เป็นเพียงถุงน้ำธรรมดา (simple cyst) ซึ่งอาจเป็น functional หรือเนื้องอกก็ได้ ใช้วิธีตรวจติดตามดูการเปลี่ยนแปลง
- ก้อนเนื้องอกชนิดธรรมดาที่ควรนัดผ่าตัดตามคิว คัดเลือกบางรายเพื่อผ่าตัดผ่านกล้องแลพพาโรสโคป หรือผ่าตัดแบบฉุกเฉินในรายมีภาวะแทรกซ้อน
- ก้อนเนื้องอกที่เป็นมะเร็ง หรือสงสัยมะเร็ง วางแผนผ่าตัดโดยเร็ว เตรียมพร้อมทางด้านผู้เชี่ยวชาญ หรืออาจส่งตัวผู้ป่วยไปทำการรักษาในสถานที่ที่มีความพร้อมกว่า
ก้อนที่ปีกมดลูกจำนวนมากให้ภาพคลื่นเสียงที่แตกต่างกัน มีแบบฉบับจำเพาะโรคในหลายกรณี แต่อย่างไรก็ตาม มีความเหลื่อมล้ำระหว่างโรคอยู่ไม่น้อย ทำให้บ่อยครั้งที่ก้อนเหล่านี้ให้ภาพที่ขาดความจำเพาะ แต่อย่างน้อยที่สุด ภาพเหล่านี้จะให้แนวทางในการรักษาโดยรวมได้ดี ในที่นี้จึงขอเน้นเฉพาะการตรวจด้วยอัลตราซาวด์สองมิติของภาวะที่พบได้บ่อย ๆ
การแยกระหว่างมะเร็งกับเนื้องอกธรรมดา
การประเมินรูปลักษณ์ (morphology) จากภาพอัลตราซาวด์
รูปลักษณ์ของเนื้องอกจาก transvaginal sonography (TVS) มีบทบาทสำคัญในการช่วยแยกภาวะมะเร็งรังไข่ออกจากเนื้องอกธรรมดาได้ดี แม้จะมีขีดจำกัดด้านความถูกต้องอยู่บ้าง โดยเฉพาะในแง่ของผลบวกลวง ลักษณะเด่นของมะเร็งรังไข่ ได้แก่ ถุงน้ำชนิดหลายช่อง ผนังหรือแผ่นกั้นหนา หรือขรุขระ ขอบไม่ชัดเจน ปุ่มปมเนื้อตันที่ยื่นจากผนังหรือแผ่นกั้น มีส่วนประกอบเนื้อตัน ส่วนประกอบที่มีความเข้มสูง เพื่อให้การวินิจฉัยแม่นยำขึ้นจึงมีผู้พยายามจัดระบบให้คะแนนเพื่อบอกความเสี่ยง โดยถือตามคุณสมบัติจากภาพคลื่นเสียงที่เห็น(2-6) ผลบวกลวงที่พบได้บ่อย ๆ คือ dermoid cyst ซึ่งให้ภาพเนื้อตันหรือซับซ้อนที่สับสนกับมะเร็งได้ บางระบบจึงผนวกเอาเกณฑ์การวินิจฉัย dermoid และ hemorrhagic cyst เข้าไปด้วย ซึ่งทำให้มีความถูกต้องมากขึ้น(4) ถึงแม้ว่าระบบให้คะแนนจะแยกเนื้องอกธรรมดาออกจากมะเร็งได้ด้วยความถูกต้องสูง แต่ก็ไม่สมบูรณ์เลยทีเดียว และในมือผู้เชี่ยวชาญแล้วอาศัยการแปลผลจากรูปลักษณ์จากภาพอัลตราซาวด์โดยอัตวิสัย (subjective) ก็อาจเป็นวิธีดีที่สุดในการแยกมะเร็งของก้อนที่ปีกมดลูก(7, 8) ความพยายามในการสร้างทักษะการตรวจ แยกแยะด้วยรูปลักษณ์ของก้อน จึงเป็นสิ่งจำเป็นอย่างยิ่ง ถ้าผู้ตรวจมีความคุ้นเคยกับการแยก dermoid cyst, endometrioma และ hemorrhagic cyst (ซึ่งให้ภาพหลากหลายและหลายครั้งดูคล้ายมะเร็ง) และแยกก้อนเนื้อตันของ myoma หรือ fibroma ได้ การแยกเนื้องอกธรรมดากับมะเร็งโดยรูปลักษณ์จากภาพคลื่นเสียงก็ไม่ยากนัก
การประเมินจากคลื่นเสียงดอพเลอร์
ในมะเร็งรังไข่มีการสร้างเส้นเลือดขึ้นมาใหม่ (neoangiogenesis) ซึ่งเป็นการสร้าง capillary blood vessels ใหม่ ปริมาณเส้นเลือดมีความหนาแน่นมากกว่าเนื้อเยื่อปกติ อาจขยาย หรือโป่งเป็นถุงออกไป กลายเป็นแอ่งเลือด และสร้าง arteriovenous shunts โดยไม่มี intervening capillaries เส้นเลือดที่สร้างขึ้นมาใหม่ในเนื้องอกนี้มักจะมีผนังที่ปราศจากกล้ามเนื้อเรียบ ซึ่งต่างจากเส้นเลือดปกติ มีเพียงเนื้อเยื่อเกี่ยวพันหรือไฟบรัสปริมาณเล็กน้อยเท่านั้น ค่าความต้านทาน (RI values) ใน neoangiogenesis เหล่านี้มีค่าลดลง อย่างไรก็ตามในมะเร็งมักจะมีบริเวณความดันในเนื้อเยื่อสูงที่ทำให้การไหลเวียนลดลง จึงมีสภาพการไหลเวียนที่ไม่สม่ำเสมอเกิดขึ้นในก้อนเนื้องอก โดยทั่วไปแล้วในก้อนมะเร็งจะมีค่า RI (resistance index ซึ่งมีค่าจาก 0-1) และค่า PI (pulsatility index มีค่าแปรปรวนจาก 0-10) ต่ำกว่าปกติ (ส่วนมากถือค่าจุดตัดความเป็นมะเร็งที่ค่า RI ต่ำกว่า 0.4 และค่า PI ต่ำกว่า 1.0) ซึ่งแสดงถึงความต้านทานการไหลต่ำ ในมือผู้ชำนาญแล้วพบว่าการตรวจค่า PI, RI ทำได้สะดวก และให้ค่าคงที่ในการตรวจซ้ำ (reproducible) และมีคุณค่าในการช่วยแยกมะเร็งออกจากก้อนเนื้อธรรมดาได้ แต่อย่างไรก็ตามถึงแม้ว่ามีการศึกษาเรื่องนี้จำนวนมากแต่ก็ยังถือว่าอยู่ในขั้นการศึกษาทดลองเท่านั้น ปัญหายังคงมีอยู่ในด้านเทคนิค อุปกรณ์ ความแปรปรวนระหว่างผู้ตรวจ อัตวิสัยในการตรวจ อคติของผู้ตรวจเนื่องจากทราบแนวโน้มของเนื้องอกจากการเห็นรูปลักษณ์จากภาพคลื่นเสียงมาก่อน ในขณะนี้ถือว่ายังไม่เป็นเทคนิคมาตรฐานในการนำมาคัดกรองมะเร็งรังไข่อย่างเป็นกิจวัตร สำหรับ color flow mapping (CFM) เป็นการประเมินปริมาณการไหลเวียนเลือดในก้อนเนื้องอกเชิงกึ่งอัตวิสัย เป็นการตรวจอย่างง่ายอาศัยการแบ่งเกรด 4 ระดับ คือ 1 ในเนื้องอกไม่มีเส้นเลือด หรือแทบไม่มีเลย 2 มีเส้นเลือดในก้อนเนื้องอกปริมาณเล็กน้อย 3 มีเส้นเลือดในก้อนเนื้องอกปริมาณปานกลาง และ 4 มีปริมาณเส้นเลือดในก้อนมาก วิธีการประเมินนี้สะดวก และนิยมใช้ประกอบการทำนายของมะเร็ง การประเมินอย่างง่ายนี้ยังมีประโยชน์ในการประเมินการช่วยแยกก้อนเนื้อตันจำนวนมาก เช่น เกรด 0-1 ในกรณีก้อนเลือดคั่งในถุงน้ำ ก้อน fibroma หรือ peduculated myoma เป็นต้น ก้อนมะเร็งจะมีเส้นเลือดเกรด 3-4
ภาพอัลตราซาวด์ของก้อนที่มีรูปแบบจำเพาะ
Follicular cyst(9-12)
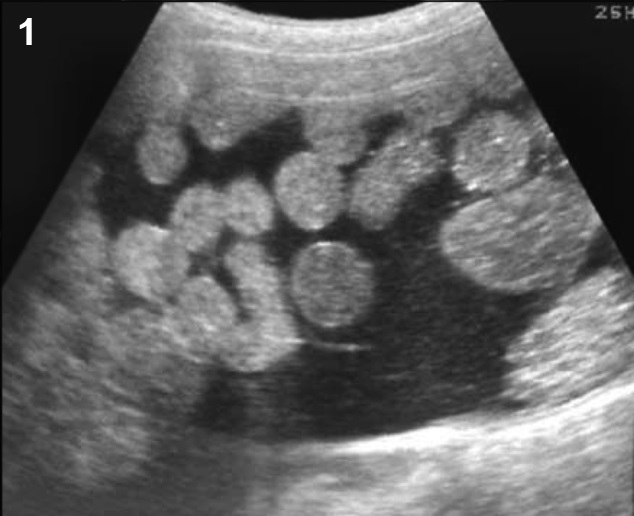
- ถุงน้ำช่องเดี่ยว ผนังบาง ผิวด้านในเรียบ อยู่ในรังไข่ ขอบเขตชัดเจน กลม เบียดเนื้อรังไข่ปกติให้แบนเรียวยาวออกเป็นรูปปากนก (รูปที่ 1)
- ไม่มีความเข้มเสียงภายใน (anecho) มี posterior enhancement (เงาขาว) หลังถุงน้ำ แต่ในน้อยรายอาจพบมีความเข้มเสียงระดับต่ำ ๆ ภายในได้
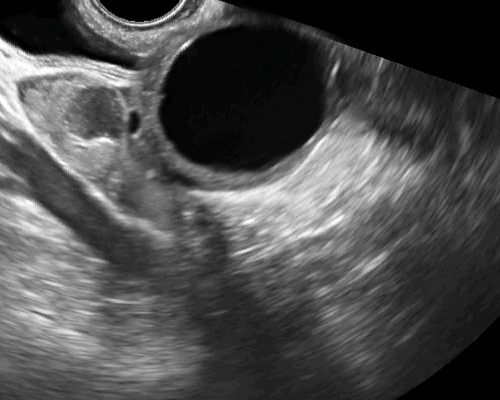
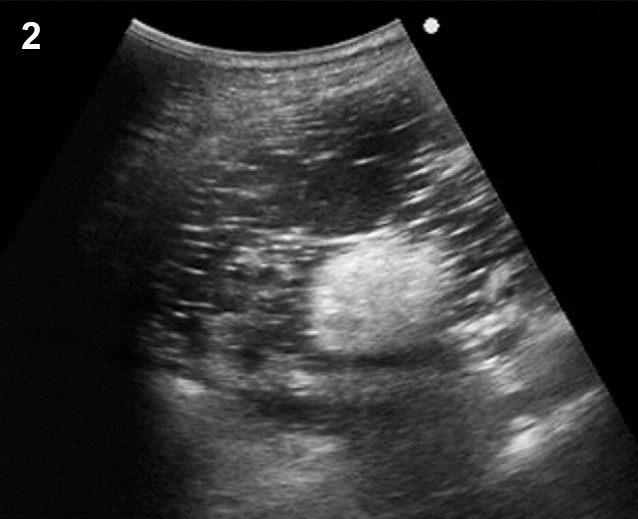
- ขนาด 2.5- 5 เซนติเมตร แต่อาจโตได้ถึง 15 ซม. (< 2.5 ซม.ควรเรียกฟอลลิเคิล) ในกรณีที่ได้รับยากระตุ้นตกไข่จะเห็นโตขึ้นหลายฟอง ๆ พร้อมกัน (รูปที่ 2: ซ้าย) อาจดูคล้าย theca luteal cysts ที่พบได้บ่อย ๆ ในครรภ์ไข่ปลาอุก (รูปที่ 2: ขวา)
- การตรวจซ้ำเป็นระยะและพบว่าหายไปเองถือเป็นการยืนยันการวินิจฉัย
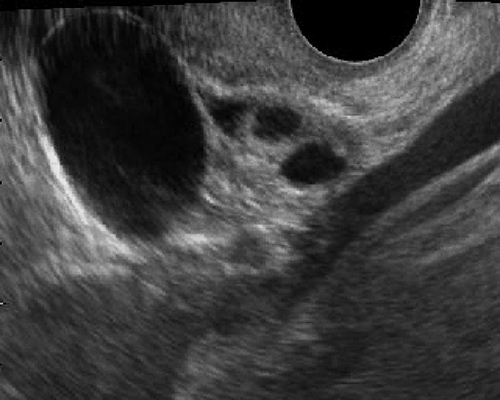
รูปที่ 1 Follicular cyst เป็นฟองไข่ที่กำลังจะตกไข่
รูปที่ 2 ฟองไข่ที่ได้รับยากระตุ้นตกไข่ซึ่งโตขึ้นหลายฟอง ๆ พร้อม ๆ กัน (ซ้าย) และ theca lutein cyst (ขวา) ซึ่งเป็นสองข้างในครรภ์ไข่ปลาอุก
Corpus Luteum Cyst (13, 14)
- คอร์ปัสลูเตียมปกติจะเห็นเป็นเนื้อตัน เด่นขึ้นภายหลังจากตกไข่ ซึ่งฟอลลิเคิลแฟบลง ภาพแปรปรวนได้มาก อาจเห็นเป็นก้อนที่มีความเข้มเสียงปานกลางมีเพียงร่องเล็ก ๆ สูงอยู่กลาง หรือเป็นก้อนเนื้อตันทั้งก้อนของก้อนเลือดคั่ง (hemorrhagic mass) มีเส้นเลือดอยู่รอบ ๆ หรืออาจเป็นถุงน้ำใส (กรณีที่มี serous fluid สะสมแทนเลือด หรือก้อนเลือดคั่งสลายไปแล้ว) เป็นต้น
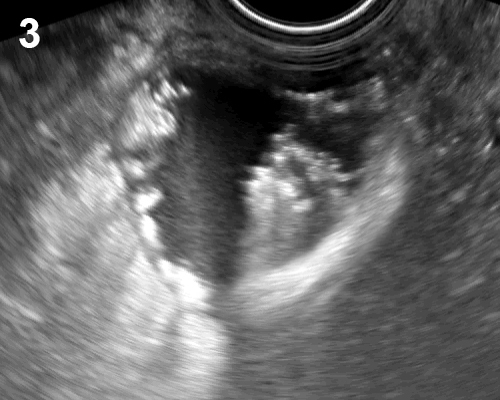
- ลักษณะภาพอัลตราซาวด์ขึ้นกับการมีเลือดออกภายใน ระยะเวลาของการมีเลือดออก (รูปที่ 3) ในช่วงเลือดออกใหม่ ๆ จะให้ภาพมีความเข้มเสียงสูง (hyperechoic) ทำให้ดูเป็นก้อนเนื้อตัน การมีเลือดออกภายในถุงน้ำทำให้ภาพคลื่นเสียงดูเหมือนมะเร็งได้ แต่เมื่อติดตามไป (4-6 สัปดาห์) จะหายไป หรือกลายเป็นถุงน้ำที่ใสขึ้น
- มักจะมีผนังหนากว่า follicular cyst และผนังมีความเข้มเสียงมากกว่าเนื้อรังไข่ข้างเคียง
- บ่อยครั้งพบระดับความเข้มต่ำภายในแบบกระจาย (diffuse) ร่วมกับ posterior enhancement แต่มักจะหยาบกว่าใน endometrioma เห็นเป็นเส้นขาว ๆ กระจายไม่เป็นระเบียบอยู่ในบริเวณที่ไม่มีความเข้มหรือความเข้มต่ำ ซึ่งเป็นตาข่ายไฟบริน (reticular หรือ cob-web pattern) ในช่วงก้อนเลือดคั่งสลายตัว เส้นเหล่านี้ไม่ใช่ true septum ซึ่งมีลักษณะไยไร้ความโค้งความเว้าอยู่ภายในโพรงถุงน้ำ
- Fluid-fluid level มีแนวแยกระหว่างของเหลวสองส่วนภายใน เป็นแนวเส้นตรง แบ่งส่วนประกอบสารน้ำออกจากส่วนที่มีเม็ดเลือด (บางครั้ง concealed) เมื่อก้อนเลือดเริ่มสลายตัว
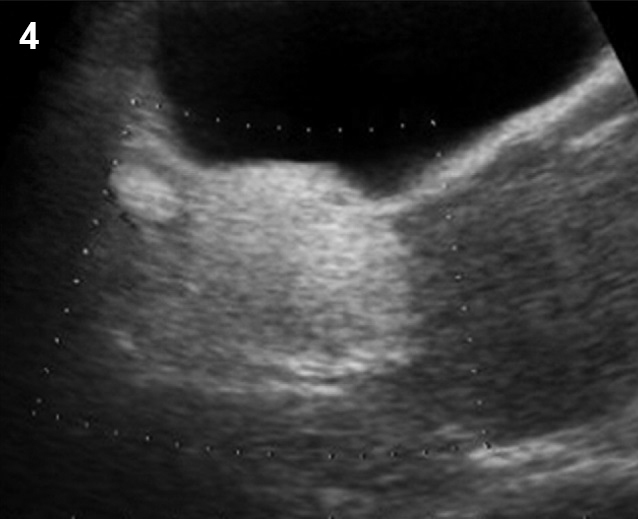
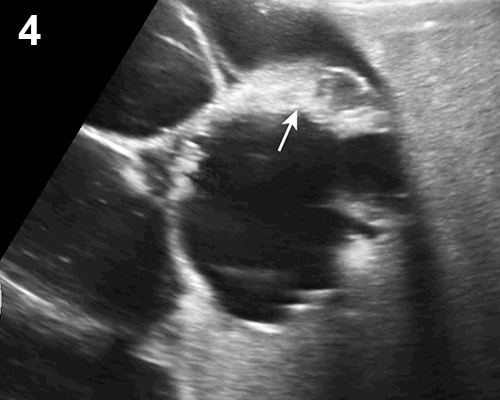
- ก้อนเลือดออกที่รังไข่ (รูปที่ 4) พบได้บ่อยที่สุดจาก corpus luteal cysts แต่อาจเกิดจากสาเหตุอื่น เช่น เลือดออกใน endometrioma ดอพเลอร์พบมีเส้นเลือดมากอยู่รอบก้อน แต่ไม่มีเส้นเลือดภายในก้อน
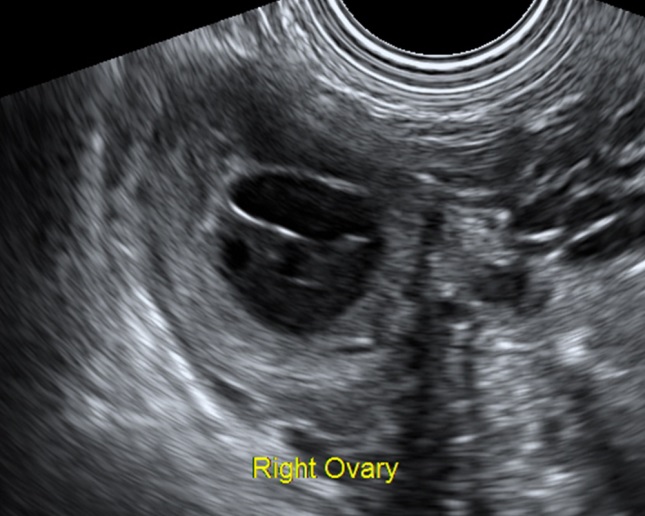
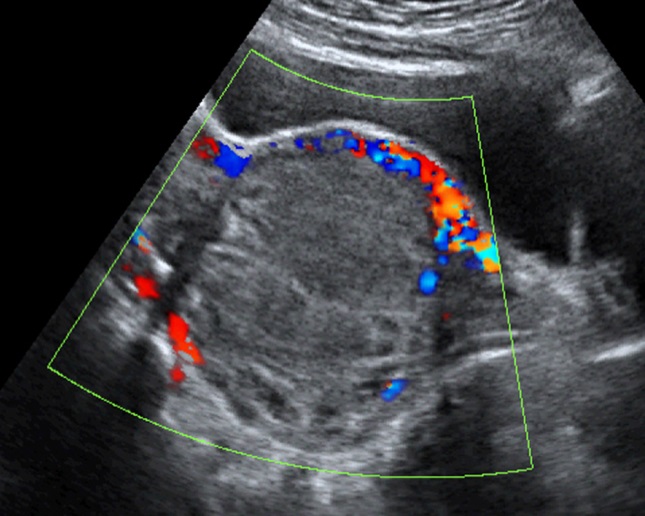
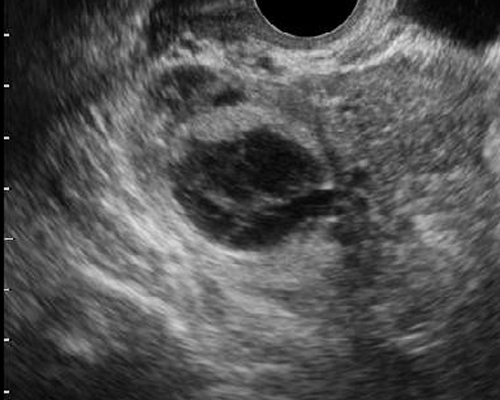
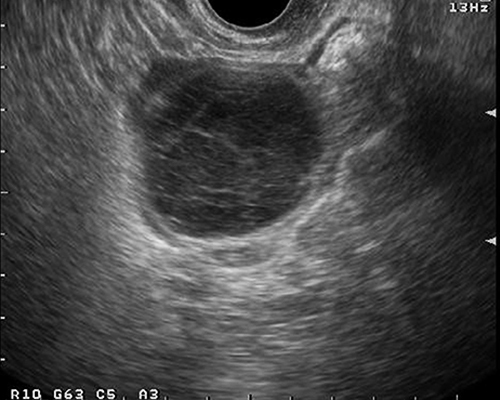
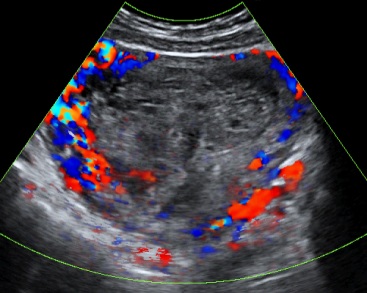
รูปที่ 3 ตัวอย่างของ corpus luteum หลายรูปแบบ สัมพันธ์กับระยะต่าง ๆ ของการเกิดและสลายของก้อนเลือดคั่งภายในก้อน จาก color flow mapping จะเห็นเส้นเลือดเด่นอยู่รอบนอก
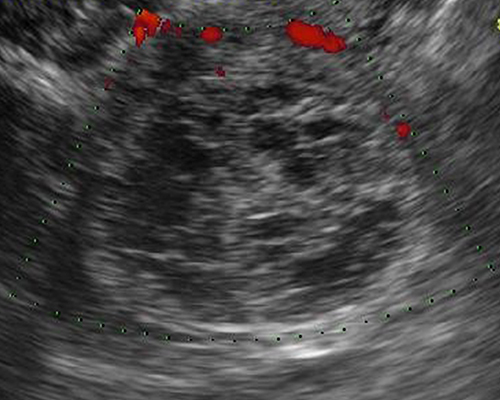
รูปที่ 4 ก้อนเลือดคั่งในรังไข่ (hemorrhagic cyst) ซึ่งเป็นเนื้อตันขรุขระ บริเวณที่มีการสลายจะมีแอ่งใสกระจัดกระจายภายใน และไม่มีเส้นเลือดภายในก้อนเลือดคั่ง
Polycystic Ovaries (15, 16)
- ปริมาตรและพื้นผิวของรังไข่เพิ่มมากขึ้น รังไข่มีขนาดใหญ่กว่า 10 มล. โดยเฉพาะอย่างยิ่งส่วนสโตรมา
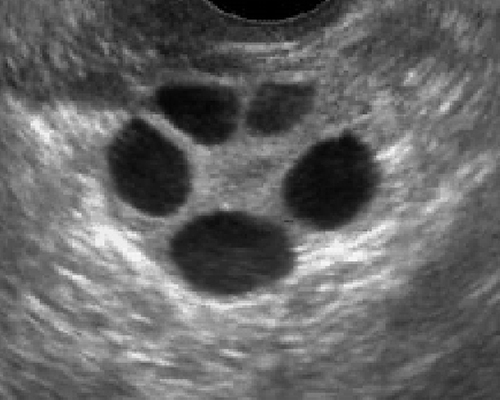
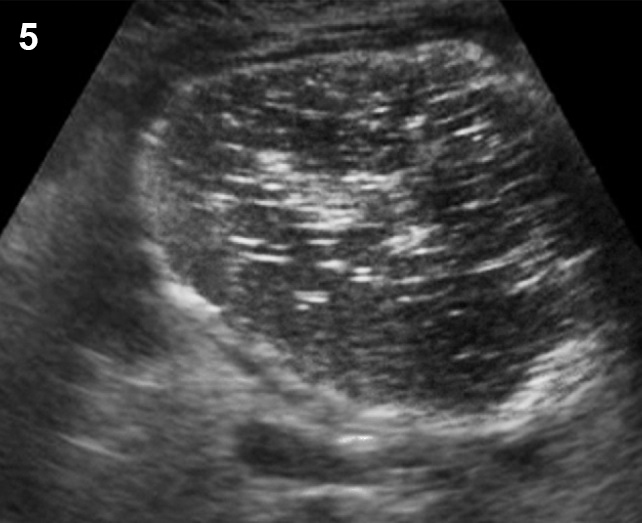
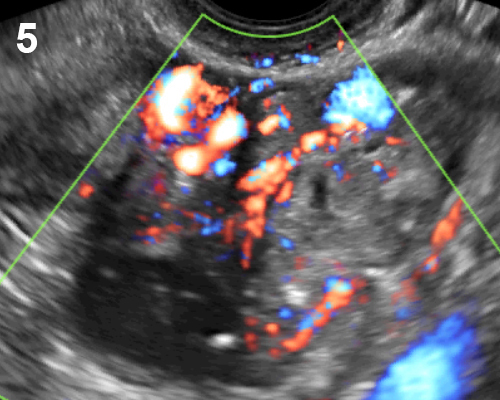
- มีถุงน้ำขนาดเล็ก ๆ (ขนาด 2-9 มม) จำนวนมาก (มากกว่า 12 ฟอง) ในหนึ่งข้างเป็นอย่างน้อย (รูปที่ 5)
- ถุงน้ำอยู่รอบนอกชิดผิวรังไข่ ดูเป็นสร้อยประคำหรือ necklace sign
- ความเข้มเสียงของสโตรมาส่วนกลางเพิ่มมากขึ้นเมื่อเปรียบเทียบกับบริเวณรอบ ๆ นอก
- มีรูปร่างลักษณะกลมมากขึ้น
- CFM พบมีการเพิ่มปริมาณเส้นเลือดในสโตรมา
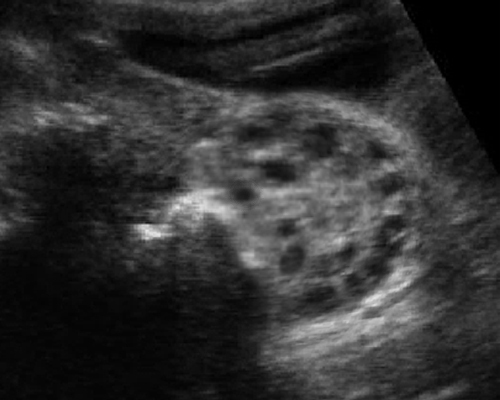

รูปที่ 5 Polycystic ovary มีฟองไข่จำนวนมาก ขนาดเล็ก ๆ กระจายอยู่รอบนอก
ภาพอัลตราซาวด์ของ Tumor-like Conditions
Peritoneal pseudocyst
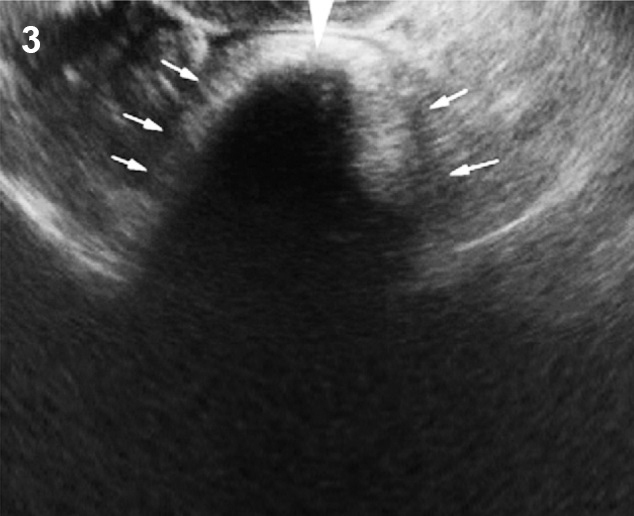
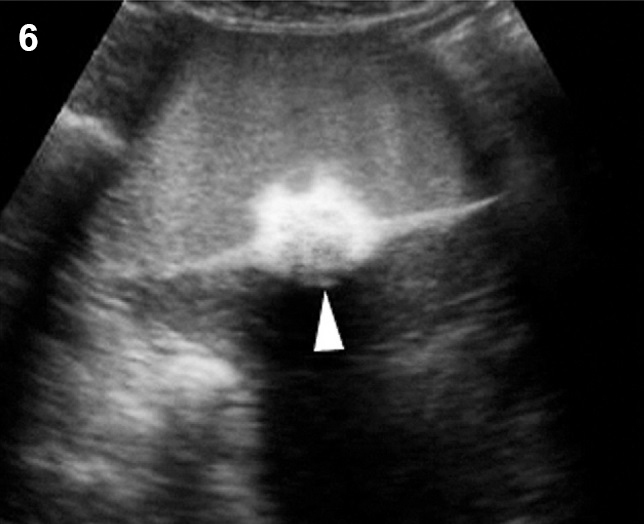
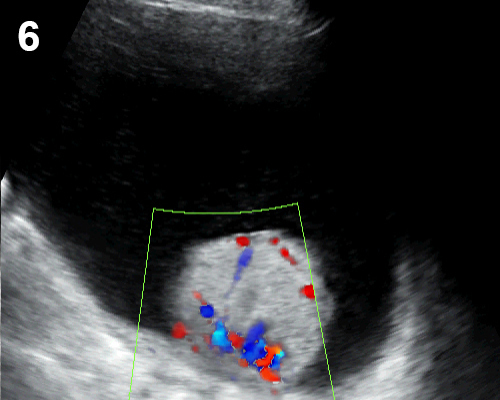
- เป็นถุงน้ำปลอม หรือแอ่งน้ำคั่งหรือเซาะแทรกอยู่ในอุ้งเชิงกราน โดยมีพังผืดหุ้มไว้ ไม่ได้เป็นผนังที่แท้จริง อาจมีอวัยวะในช่องท้อง หรือผนังเชิงกรานทำหน้าที่เป็นผนังแอ่งน้ำนั้น (รูปที่ 6) ที่เกิดจากการมีปฏิกิริยาอักเสบในอุ้งเชิงกรานนำมาก่อน เช่น อุ้งเชิงกรานอักเสบ endometriosis วัณโรคของเยื่อบุช่องท้อง เป็นต้น
- ส่วนมากเป็นแอ่งหรือถุงน้ำใส (anechoic) แต่ขอบไม่ชัดเจน (blurred, undefined) รูปร่างแปลก ๆ เช่น เป็นท่อ ลำๆ เป็นรูปดาว อาจเห็นรังไข่ถูกหุ้มด้วยน้ำและไฟบรินคล้ายแมงมุมในใยตาข่าย มีแผ่นกั้นด้วยพังผืดบาง ๆ ได้บ่อย ซึ่งขยับหรือกระพือเวลาใช้หัวตรวจแตะ (flapping sail sign)
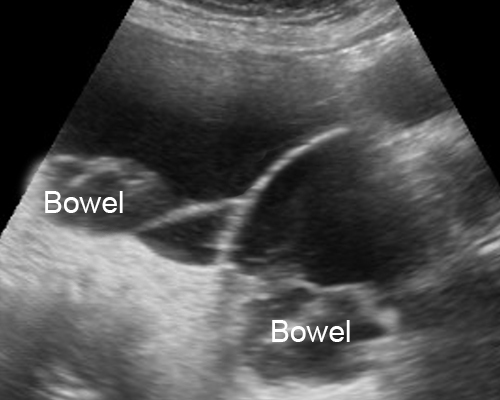
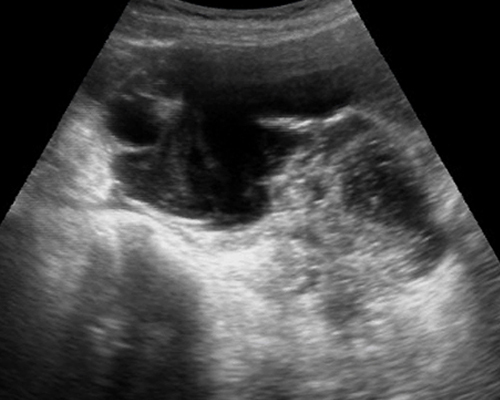
รูปที่ 6 Pseudocyst มี pseudoseptum กั้นแอ่งน้ำในอุ้งเชิงกราน อาจพบลำไส้ปนในแอ่งน้ำ ไม่สามารถแสดงขอบนอกของถุงน้ำให้เห็นได้ชัดเจน และมีแผ่นกั้นไม่สมบูรณ์ (incomplete septum)
Endometriotic Cyst (19, 20)
- ถ้าขนาดเล็ก ๆ ก็จะมองไม่เห็นจาก TVS จะเห็นเฉพาะรายที่เป็นถุงน้ำแล้ว (endometrioma)
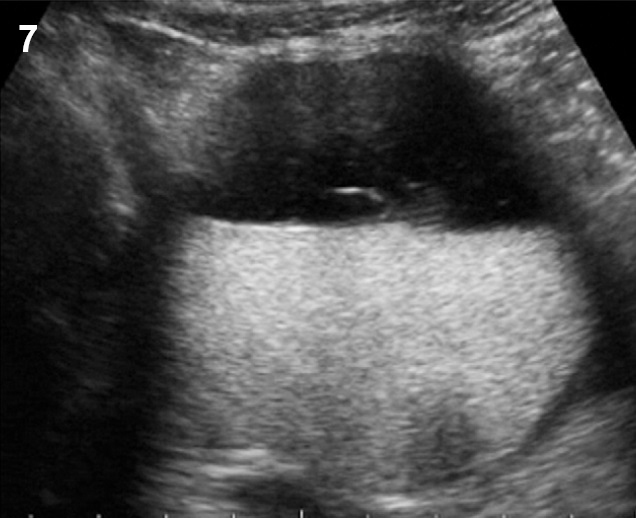
- Ground glass appearance เป็นลักษณะที่พบได้บ่อยที่สุดจาก TVS คือ เห็นความเข้มต่ำ ๆ เม็ดละเอียดกระจายสม่ำเสมอเป็นเนื้อเดียวกัน (รูปที่ 7) ซึ่งพบได้ร้อยละ 82-89 ยิ่งถ้าไม่มีลักษณะของเนื้องอกอย่างอื่นร่วมด้วยจะมีโอกาสถูกต้องสูงถึงร้อยละ 95
- มักมี acoustic enhancement คือเงาขาวใต้ต่อก้อน
- ในกรณีที่มีพังผืดห้อมล้อมจะมีผนังหนาขึ้น อาจจะหนาตลอดแนว หรือหนาเฉพาะที่ในหลาย ๆ บริเวณ
- อาจมีผนังแยกห้องภายใน มีช่องเดี่ยวหรือหลายช่องภายในก็ได้ หรือแม้แต่เป็นเนื้อตันก็เป็นได้แต่น้อย
- มักจะเป็นทั้งสองข้าง แต่ขนาดอาจแตกต่างกัน
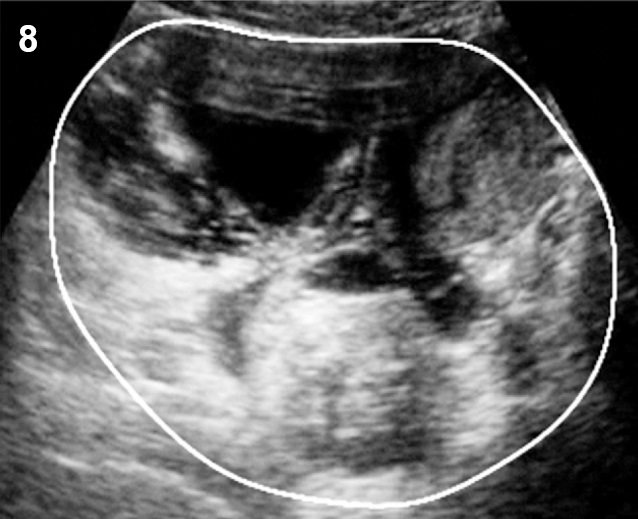
- ในรายที่ความเข้มภายในไม่สม่ำเสมอ ไม่เป็นเนื้อเดียวกันบ่งชี้ถึงการมีเลือดออกภายในใหม่ ๆ จะมีระดับของความเข้มเสียงแปรปรวน และขึ้นกับระยะเวลาของการมีเลือดออก คล้ายในคอร์ปัสลูเตียม อาจมีติ่งก้อนคล้ายเนื้อตันแพ็คกันติดผนัง (รูปที่ 8) ซึ่งอาจเป็นก้อนเลือดเก่า หรือช็อคโคแลตข้นจนอาจเข้าใจผิดเป็นเนื้อตันแบบมะเร็ง แต่ภายในติ่งก้อนนี้ไม่มีเส้นเลือด และการขยับหัวตรวจมักจะทำให้ก้อนขยับแยกจากผนังได้
- ลักษณะการแยกชั้นของของเหลว (fluid-fluid level) ก็พบได้ใน endometrioma แต่ลักษณะนี้พบได้ไม่บ่อย ทั้งสองชั้นแม้จะมีความเข้มเสียงต่างกันแต่ก็ยังจัดว่าเป็นความเข้มระดับต่ำทั้งคู่
- Solid-appearing endometrioma ก็อาจพบได้ (ไม่บ่อย) ดูคล้ายก้อนเนื้อตันที่มีเนื้อสม่ำเสมอ ขอบเขตยังชัดเจน แม้จะมีเงาเสียงบ้าง และระดับความเข้มก็นับว่ายังน้อยกว่า dermoid cyst เมื่อใส่ CFM จะพบว่าไม่มีเส้นเลือดภายใน ซึ่งช่วยแยกจากก้อนมะเร็งได้
- ผลบวกลวงที่พบได้บ่อยที่สุดคือ hemorrhagic cyst (โดยเฉพาะคอร์ปัสลูเตียม) แต่ก็เป็นไปได้ที่จะแยกจาก hemorrhagic cyst โดยการแสดงให้เห็นผนังหนาหลาย ๆ ที่ ความเป็นเนื้อเดียวกันของสารภายใน และการมีรอยโรคหลายแห่ง(21) มีข้อสังเกตสำคัญคือ hemorrhagic cyst มักจะพบว่ามีการยุบหรือหายไปในขณะตรวจซ้ำในรอบเดือนต่อมา และการพบจุดหรือเส้นขาวเข้ม (bright echogenic foci) ที่ผนังของถุงน้ำจะช่วยสนับสนุนการวินิจฉัย endometrioma ด้วย(22)
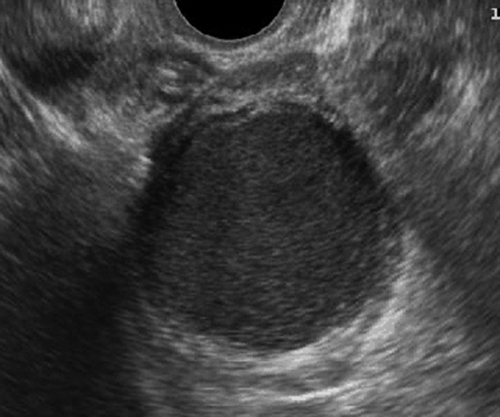
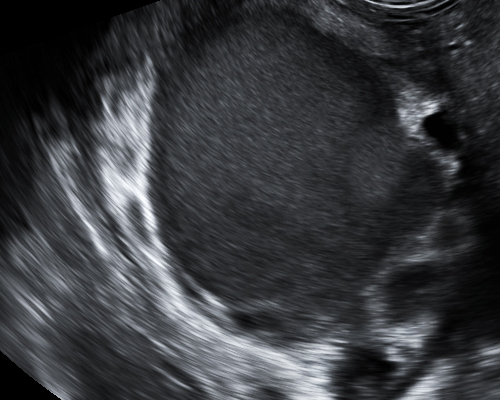
รูปที่ 7 Endometrioma (ground glass)
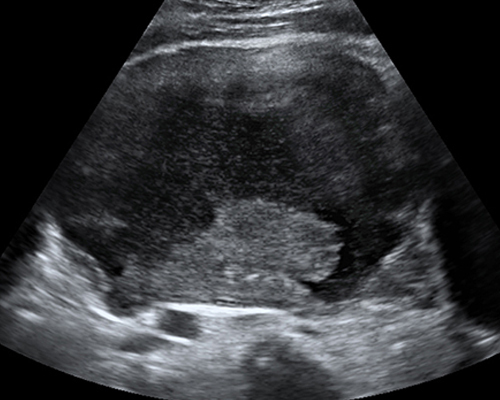
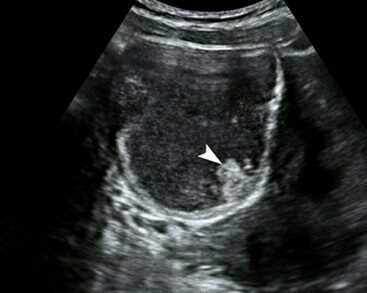
รูปที่ 8 Endometrioma (mural nodule)
Tubo-ovarian abscess (9-12)
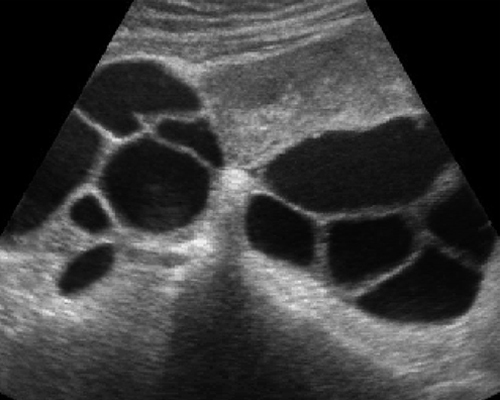
- ถุงฝีหนองที่รังไข่และท่อนำไข่ มักจะเป็นถุงน้ำเชิงซ้อน ขอบเขตภายนอกไม่ชัดเจน ขอบเขตภายในชัดกว่า มีน้ำขุ่นคล้าย endometrioma ได้ มีความเข้มต่ำ ๆ สม่ำเสมอ (รูปที่ 9) หนึ่งหรือหลายแอ่งก็ได้ บางรายผนังหนามากด้วยพังผืด บ่อยครั้งที่มี hydro / pyosalpinx เป็นถุงน้ำยาวเป็น sausage-like มีแผ่นกั้นไม่สมบูรณ์ภายใน (รูปที่ 10)
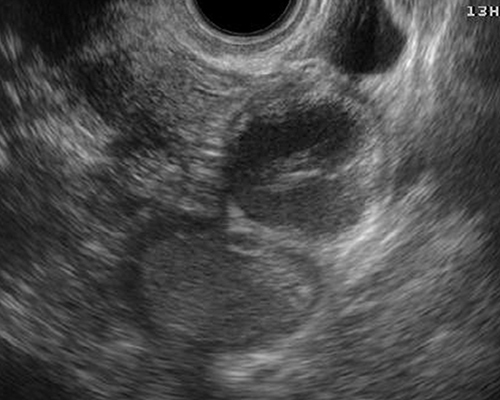
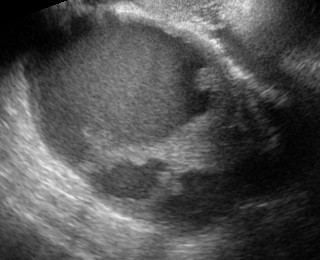
รูปที่ 9 Tubo-ovarian abscess ประกอบด้วยแอ่งน้ำมีพังผืดดึงรั้งรอบนอก ทำให้มีหลายแอ่งได้
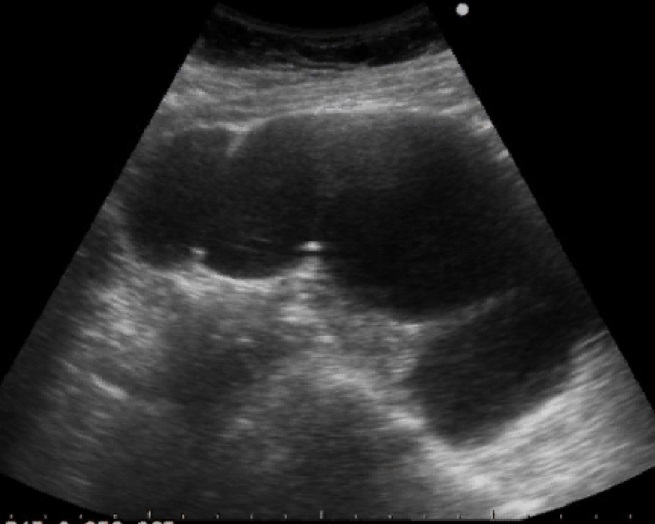
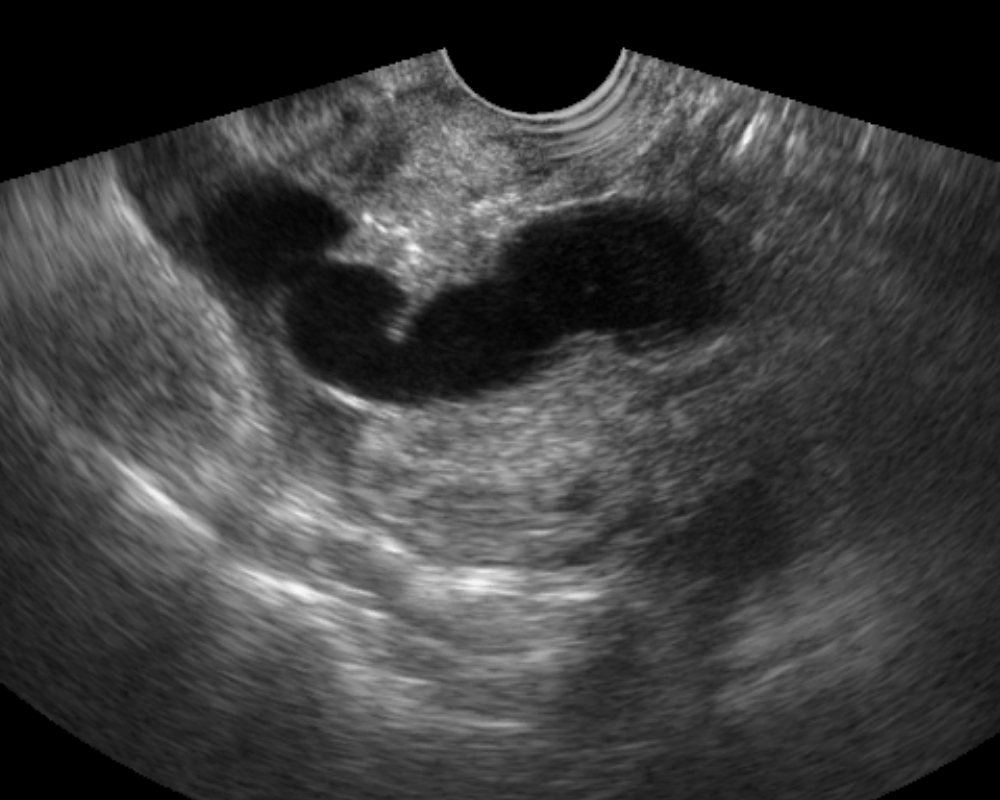
รูปที่ 10 Hydro / pyosalpinx มีลักษณะ sausage cyst ที่มีแผ่นกั้นไม่สมบูรณ์
ภาพอัลตราซาวด์ของ Benign Tumors
Cystic Teratoma (Dermoid)(23)
- ความถูกต้องในการวินิจฉัยด้วยอัลตราซาวด์ (รูปที่ 11) อยู่ในเกณฑ์ดีมาก คือประมาณร้อยละ 85-95
- ลักษณะภายในมีความแปรปรวนได้มาก ขึ้นกับส่วนประกอบภายในซึ่งมีได้หลากหลาย ไขมัน sebum ฟัน เนื้อเยื่อผิวหนัง หินปูนจับ เส้นผม เยื่อสมอง เป็นต้น ลักษณะสำคัญที่ค่อนข้างจำเพาะคือ หย่อมที่มีความเข้มสูงกระจัดกระจายอยู่ (regional diffuse bright echoes) (เกิดจากการจับกลุ่มของเส้นผม หรือไขมัน) เส้นหรือจุดเข้มเสียง (speckles; lines & dots) ก้อนความเข้มเสียงที่มีเงา (shadowing echodensity) และการแยกชั้นของของเหลว (fluid-fluid level)
- อาจพบเป็นก้อนความเข้มสูงทั้งก้อนของ echogenic sebum (ส่วนใหญ่มีความสม่ำเสมอ) อาจเป็นทั้งก้อน หรือแยกส่วนระดับกับสารน้ำภายใน และ acoustic shadowing ทางด้านหลังหรือด้านข้าง
- ขนาดแปรปรวน พบเป็นทั้งสองข้างได้ประมาณร้อยละ 15
- หนึ่งในสามจะมี atypical solid-appearing mass ซึ่งร้อยละ 75 ของกลุ่มนี้มี peripheral hypoechogenicity ซึ่งถือเป็นลักษณะจำเพาะของ solid-appearing ovarian teratomas (24)
- เส้นหรือจุดเข้มเสียง เกิดจากเส้นผมกระจายอยู่ในน้ำที่ไม่มีความเข้ม หรือมีความเข้มต่ำ
- ส่วนเนื้อตันความเข้มสูงที่มีเงาเสียง (shadowing) คือบริเวณหินปูนจับเช่น กระดูก ฟัน
- การแบ่งชั้นของสารในถุงน้ำ (fluid-fluid level) เกิดจากการแบ่งชั้นของ sebum และ serous fluid ซึ่งมักเห็นแนวแยกเป็นเส้นตรง
- Tip of the iceberg sign คือการเห็นบริเวณความเข้มเสียงสูงของก้อนส่วนที่อยู่ใกล้หัวตรวจ ส่วนบริเวณอื่น ๆ จะถูกบดบังโดยเงาเสียง ทำให้ไม่เห็นขอบเขตชัดเจน มีเงาเสียงบดบังทางขอบด้านข้างและด้านหลัง ทำให้เห็นเฉพาะส่วนด้านหน้าโผล่ขาวขึ้นมาคล้ายยอดภูเขาน้ำแข็ง ลักษณะนี้อาจถูกมองข้ามได้ง่าย ถ้าไม่ตรวจอย่างรอบคอบ เนื่องจากขอบเขตของก้อนถูกบดบังจนไม่ชัดเจน
- อย่างไรก็ตามหลายลักษณะที่กล่าวมาอาจเหลื่อมล้ำกับก้อนชนิดอื่น ๆ ซึ่งทำให้ความจำเพาะลดลงไปบ้าง เช่น บางรายของ endometrioma อาจมีส่วนความเข้มเสียงที่มีเงาเสียงได้บ้าง ในกรณีมีเลือดหรือก้อนไฟโบรซิสที่ผนัง เลือดอาจให้ภาพหย่อมความเข้มกระจายภายใน เส้นเข้ม หรือการแยกชั้นของของเหลว (fluid-fluid level) ได้ แต่อย่างไรก็ตามลักษณะเด่นอื่น ๆ เช่น ไยไฟบริน ก้อนเลือดที่ยุบตัว และการเปลี่ยนแปลงเมื่อตรวจซ้ำภายหลัง ช่วยให้แยกกันได้ไม่ยากนัก
- ผนังของเนื้องอกมีหลอดเลือดปริมาณเล็กน้อย แม้ก้อนใหญ่ก็ไม่ค่อยมีเส้นเลือด หรือมีก็เพียงในแคปซูลที่อยู่รอบนอกเท่านั้น เนื้อเยื่อที่มีหินปูนจับจะรบกวนลำเสียงดอพเลอร์และทำให้มี typical bizarre waveform การพบมีเส้นเลือดในก้อนเนื้องอกทำให้แยกมะเร็งสแควมัสที่เกิดขึ้นใน dermoid ออกจาก dermoid ธรรมดาได้
รูปที่ 11 Dermoid cyst แบบต่าง ๆ (1: free floating ball; 2: fried egg; 3: tip of the iceberg; 4) dermoid plug; 5: speckles; 6: calcification with acoustic shadows; 7: fluid-fluid levels; 8: mixed tissue)
Benign neoplastic cysts(9)
- ขอบเขตชัดเจน อาจเป็นถุงน้ำหลายช่อง หรือช่องเดี่ยว ชนิด serous มักจะเป็นช่องเดี่ยว ๆ น้ำใส (รูปที่ 12) อาจจะแยกจาก functional cyst ได้ยาก แต่ติดตามตรวจซ้ำก็ไม่ยุบ ชนิด serous พบเป็นสองข้างได้ร้อยละ 25
- ส่วนชนิด mucinous มักจะเป็นหลายช่อง มีแผ่นกั้นจำนวนมาก และมีถุงน้ำย่อยภายในได้บ่อย (daughter cyst) มีแนวโน้มที่จะมีแผ่นกั้นหนากว่า และจำนวนมากกว่า ชนิด serous
- น้ำในถุงไม่มีความเข้มเสียง บ่อยครั้งที่ชนิด mucinous มีความเข้มเสียงเล็กน้อย และมีลักษณะอนุภาคตะกอนลอยภายใน (รูปที่ 13) และบ่อยครั้งที่มีสารภายในหนาแน่น มีความเข้มเสียง และตกตามแรงโน้มถ่วง การมีเศษตะกอน (debris) อาจทำให้ดูคล้ายส่วนเนื้อตันได้
- อาจมีแผ่นกั้นภายในบาง ๆ ส่วนเนื้อตันขนาดเล็ก หรือติ่งเล็กยื่นภายในอาจพบได้ในน้อยราย
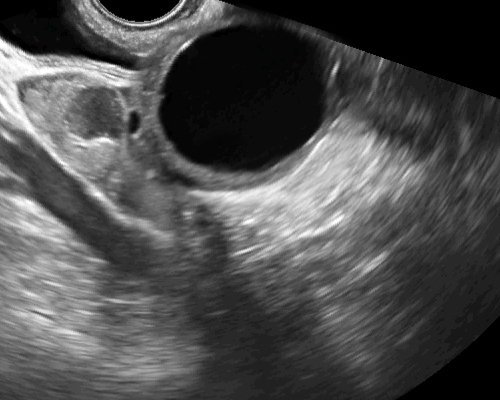
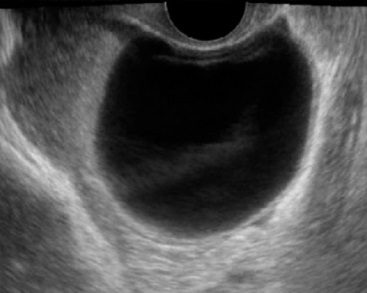
รูปที่ 12 Simple cyst ชนิด serous
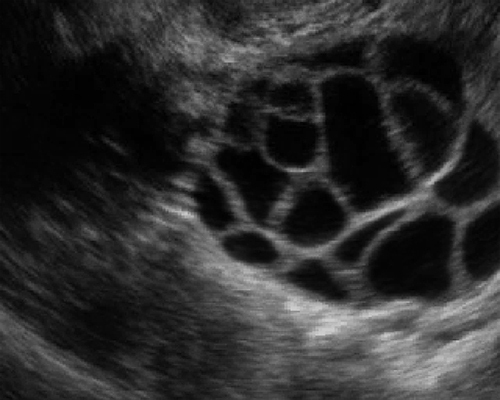
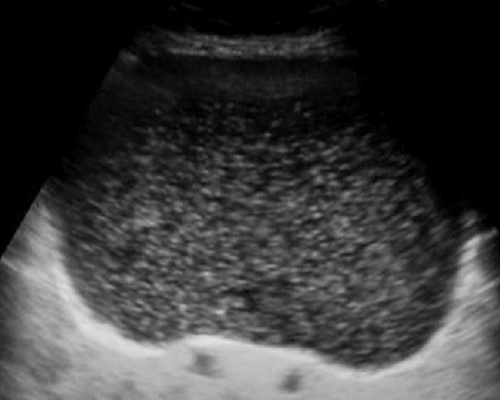
รูปที่ 13 Mucinous cyst ชนิดมีแผ่นกั้นและแอ่งจำนวนมาก และชนิดอนุภาคหยาบ ๆ แขวนลอย
Benign solid tumor(12)
- เนื้องอกที่ไม่ร้ายแรงอาจมีลักษณะเนื้อตันได้ เช่น brenner tumor หรือ fibroma (แต่การเนื้อตันที่ไม่มีลักษณะ typical ของภาวะจำเพาะนั้น ๆ ก็ควรคิดว่าอาจมะเร็งไว้ก่อน) มักจะเป็นข้างเดียว (ร้อยละ 90)
- ก้อนเนื้อตัน เนื้อไม่สม่ำเสมอเหมือนกลุ่มถุงน้ำ อาจมีส่วนถุงน้ำ (mucinous) ร่วมด้วย ใน fibroma จะมีลักษณะค่อนข้างจำเพาะคือเป็นเนื้อตันที่คล้ายเนื้องอกกล้ามเนื้อมดลูก ซึ่งมี multiple-edged acoustic shadow (รูปที่ 14) ขอบเขตชัดเจน ภายในก้อนมีความเข้มเสียงต่ำ ๆ ที่มีเงาเสียงตามหลัง (hypoechoic attenuating) มี pseudocapsule ซึ่งเกิดจากเนื้อเยื่อรังไข่ข้างเคียงที่ถูกกดเบียดแบนโอบก้อนเนื้องอก
- บางรายมี Meig’s syndrome ทำให้พบมีน้ำในช่องท้องและทรวงอกร่วมด้วย
- เส้นเลือดค่อนข้างน้อย CFM เกรด 1-2 มักจะเห็นเส้นเลือดทอดอยู่รอบก้อนมากกว่าพุ่งเข้าไปในก้อน
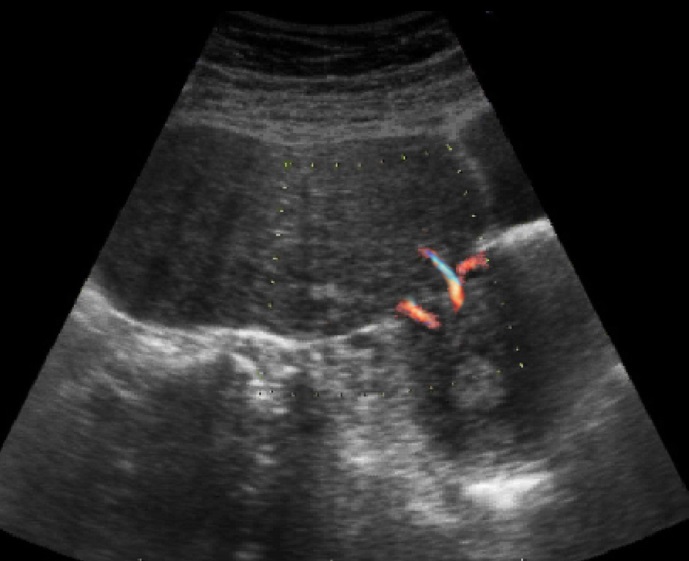

รูปที่ 14 Pedunculated leiomyoma (ซ้าย) และ ovarian fibroma (ขวา) สังเกตการณ์มี edge shadow ภายในก้อนเนื้อตัน คล้ายเนื้องอกกล้ามเนื้อมดลูกมาก (leiomyoma)
ภาพอัลตราซาวด์ของมะเร็งรังไข่
ภาพอัลตราซาวด์อาจไม่สามารถแยกเนื้องอกมะเร็งออกจากชนิดธรรมดาได้ร้อยเปอร์เซ็นต์ แต่จะบอกถึงความเป็นไปได้มากน้อยเพียงใด ซึ่งเป็นข้อมูลสำคัญช่วยให้แพทย์ได้ตัดสินใจในแนวทางการดูแลรักษาขั้นต่อไปได้ ภาพอัลตราซาวด์พอจะช่วยแยกชนิดของมะเร็งรังไข่ได้ดังรายละเอียดที่จะได้กล่าวต่อไป (แต่ในทางปฏิบัติไม่มีความจำเป็นต้องแยกชนิดของมะเร็ง เพียงแค่บอกว่าเป็นมะเร็งหรือเป็นเนื้องอกธรรมดาก็เพียงพอแล้ว)
ก้อนที่สงสัยมะเร็ง ได้แก่ก้อนที่มีลักษณะทางอัลตราซาวด์ (รูปที่ 15) ดังต่อไปนี้
-
- มีส่วนเนื้อตัน (ซึ่งไม่ใช่ hyperechoic) บ่อยครั้งเป็นตุ่ม/ติ่งยื่นออกมา
- มีแผ่นกั้น (septation) ซึ่งหนาและขรุขระ (> 2-3 มม.)
- CFM พบมีการไหลเวียนเลือดในก้อน
- มีน้ำในช่องท้อง
- มีก้อนที่เยื่อบุช่องท้อง ต่อมน้ำเหลืองโต ลำไส้ติดกัน (อาจตรวจยากด้วยอัลตราซาวด์)
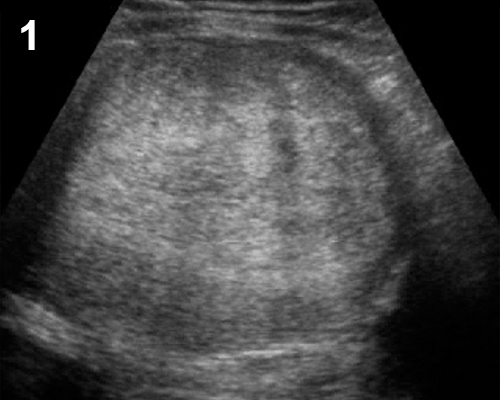
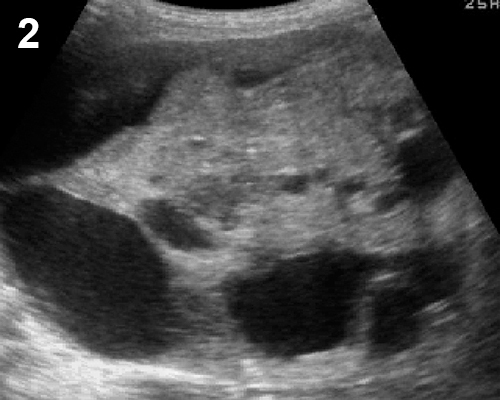
รูปที่ 15 ภาพอัลตราซาวด์ของมะเร็งรังไข่รูปแบบต่าง ๆ 1) เนื้อตัน (solid); 2) เนื้อตัน-ถุงน้ำ (solid-cystic) 3) ถุงน้ำที่มีติ่งยื่นยื่นเข้ามาจากผนัง (cyst with papillary projection) 4) ถุงน้ำที่มีแผ่นกั้นหนาและขรุขระ (cystic with irregular / thick septum) 5) เนื้อตันที่มีเส้นเลือดหล่อเลี้ยงมาก (solid with high vascularized) 6) ถุงน้ำที่มีก้อนเนื้อตันงอกมาจากผนังมีเส้นเลือดในส่วนนี้มาก (cyst with solid part with vascularization)
มะเร็งเซลล์เยื่อบุผิวรังไข่ (12)
- มีความแปรปรวนได้มาก อาจเป็นถุงช่องเดี่ยวหรือหลายช่อง แต่โดยแบบฉบับแล้วจะมีธรรมชาติเป็นถุงน้ำมาแต่เดิม แล้วมีส่วนเนื้อตันแตกงอก (excrescence) แทรกเข้าไปในถุง (รูปที่ 16)
- แผ่นกั้นมีความหนามากขึ้น (มากกว่า 2 มม.) ติ่งเนื้อยื่นออกจากแผ่นกั้น (รูปที่ 16) หรือเป็นปุ่มปมเนื้อตัน
- เป็นกับรังไข่ทั้งสองข้างได้บ่อย (ร้อยละ 20-50)
- กรณีที่ลุกลามในช่องท้องแล้วจะมีน้ำในช่องท้อง และก้อนเชิงซ้อนของมะเร็ง หรือ omental cake
- CFM พบมีเส้นเลือดแผ่กิ่งก้านแตกออกไปไม่เป็นระเบียบโดยเฉพาะในส่วนติ่งก้อนเนื้อตัน และแผ่นกั้น รูปคลื่นดอพเลอร์มักจะแสดง impedance indices ต่ำ (PI < 1 และ RI<0.5)
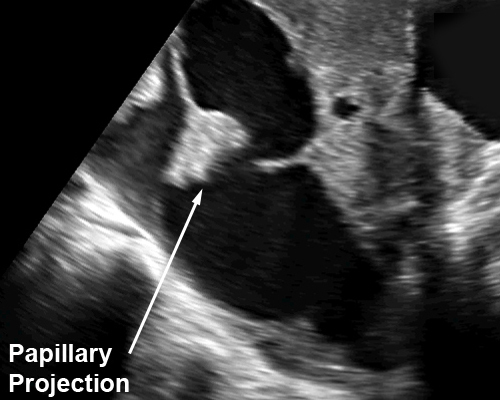
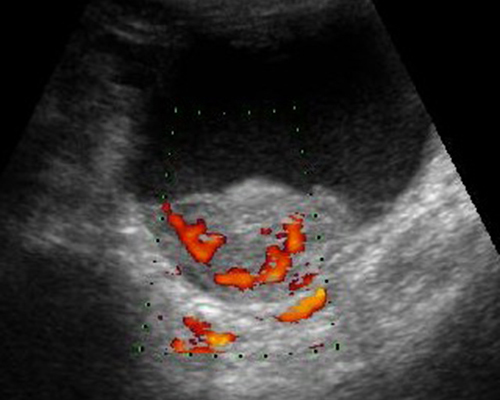
รูปที่ 16 ถุงน้ำที่มีติ่งก้อนเนื้อตันงอกออกจากผนัง มีเส้นเลือดแทรกเข้าไปหล่อเลี้ยง (ซ้าย) และก้อนเนื้อตันงอกออกจากผนังถุงน้ำรังไข่ มีเส้นเลือดแทรกเข้าไปหล่อ ซึ่งเป็นเนื้องอกมะเร็งชนิด serous (ขวา)
มะเร็งของสโตรมาและเซลล์เพศ(12)
- ส่วนใหญ่เป็นก้อนเนื้อตันปนแอ่งน้ำ (solid-cystic) เริ่มต้นมักจะเป็นเนื้อตันแต่เมื่อก้อนโตขึ้นจะมีแอ่งน้ำภายใน มีลักษณะแบบโพรงน้ำที่เกิดในก้อนเนื้อตันมาแต่เดิม (รูปที่ 17) (ไม่เหมือนกับเนื้อตันที่แตกงอกออกมาจากผนังถุงน้ำ) เมื่อมีแอ่งน้ำภายในเกิดขึ้นจะมีลักษณะ fibrovascular septa
- ลักษณะของก้อนเนื้อตันมักจะมีลักษณะก้อนย่อยภายใน (multilobulated appearance)
- กรณีที่ยังไม่ลุกลามออกไปนอกรังไข่จะมีขอบเขตชัดเจน
- ความเข้มเสียงต่ำ ไม่มีเงาเสียงที่เด่นชัดเหมือนในเนื้องอกกล้ามเนื้อมดลูก
- โดยมากเป็นข้างเดียว (ร้อยละ 10 ของ granulosa cell tumor และ dysgerminoma เป็นทั้งสองข้าง)
- มีน้ำในช่องท้อง แบบ Meig’s syndrome หรือเกิดจากมะเร็งลุกลาม
- ปริมาณเส้นเลือดเพิ่มขึ้นมาก แตกกิ่งก้านไม่สม่ำเสมอ มักแสดงรูปคลื่นดอพเลอร์ spiky envelope ที่เป็นแบบฉบับของ angiogenic turbulent flow แต่ใน granulosa cell tumor มักจะมีการแตกแขนงกิ่งก้านของเส้นเลือดเป็นระเบียบหรือสม่ำเสมอกว่ามะเร็งทั่วไป
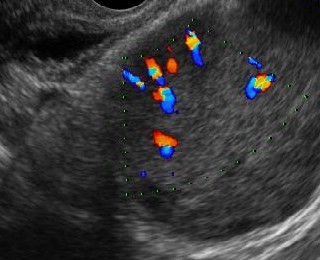
รูปที่ 17 ก้อนเนื้อตันงอกออกจากผนังถุงน้ำรังไข่ มีเส้นเลือดแทรกเข้าไปหล่อ ซึ่งเป็นเนื้องอกมะเร็งชนิด dysgerminoma (ซ้าย) ก้อนเนื้อตันและมีแอ่งน้ำเกิดขึ้นบางส่วน
มะเร็งกระจายมาที่รังไข่(12)
- มักจะเป็นสองข้าง (ประมาณร้อยละ 70)
- มีน้ำในช่องท้องประมาณร้อยละ 50
- ขนาดแปรปรวนได้มาก ส่วนใหญ่พบเป็นก้อนขนาดใหญ่
- เป็นก้อนซับซ้อน แต่ไม่มีลักษณะจำเพาะของมะเร็ง Krugkenberg’s tumor มักจะเป็นก้อนเนื้อตัน (แม้ว่าส่วนน้อยเด่นแบบถุงน้ำก็ตาม) บริเวณความเข้มต่ำมักจะแสดงถึงการเสื่อมสลายเป็นถุงน้ำ หรือเนื้อตายของมะเร็ง lymphoma ให้ภาพเนื้อตันความเข้มต่ำ
- ปริมาณเส้นเลือดหนาแน่นมากกว่าปกติ
- การพบรังไข่โตขึ้นทั้งสองข้างแบบเนื้อตัน ควรคิดถึงมะเร็งกระจายไว้ก่อน
มีการศึกษาจำนวนมากได้เสนอระบบการแยกมะเร็งออกจากเนื้องอกธรรมดา ซึ่งมีความไวและความจำเพาะใกล้เคียงกัน โดยระบบต่าง ๆ มุ่งหวังในการคัดกรอง (screening) เพื่อให้สูติแพทย์ทั่วไปประยุกต์ใช้ทางคลินิก คัดเลือกรายที่เป็นมะเร็งเพื่อส่งต่อผู้เชี่ยวชาญรักษา ระบบที่แพร่หลายมากกในปัจจุบันได้แก่ IOTA simple rules ซึ่งมีรายละเอียดดังในตารางที่ 1(25)
ตารางที่ 1 IOTA Simple Rules
| ลักษณะที่บ่งชี้หรือทำนายว่าก้อนนั้นมีโอกาสเป็นมะเร็ง (M features) (รูปที่ 18) | |
| M 1 | Irregular solid tumor |
| M 2 | Presence of ascites |
| M 3 | At least four papillary structures |
| M 4 | Irregular multi-locular solid tumor with largest diameter ≥ 10 cm. |
| M 5 | Very strong blood flow |
| ลักษณะที่บ่งชี้หรือทำนายว่าก้อนนั้นเป็นเนื้องอกชนิดธรรมดา (B features) (รูปที่ 19) | |
| B 1 | Unilocular |
| B 2 | Presence of solid component, of which largest solid component has largest diameter < 7 mm. |
| B 3 | Presence of acoustic shadows |
| B 4 | Smooth multi-locular tumor with the largest diameter < 10 cm. |
| B 5 | No blood flow |
ที่มา: ดัดแปลงจาก Timmerman D, Van Calster B, Testa A, et al. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis group. Am J Obstet Gynecol. 2016;214:424-37.
จากตารางสามารถแปลผลได้ดังนี้
Rule 1: ถ้ามี M feature อย่างน้อย 1 อย่างขึ้นไป โดยไม่มี B feature ทำนายว่าก้อนนั้นเป็นมะเร็ง
Rule 2: ถ้ามี B feature อย่างน้อย 1 อย่างขึ้นไป โดยไม่มี M feature ทำนายว่าก้อนนั้นเป็นเนื้องอกธรรมดา
Rule 3: ถ้ามีทั้ง M และ B feature หรือไม่มีทั้ง M และ B feature จะยังสรุปไม่ได้ ซึ่งอาจต้องประเมินเพิ่มเติม หรือปรึกษาผู้เชี่ยวชาญ
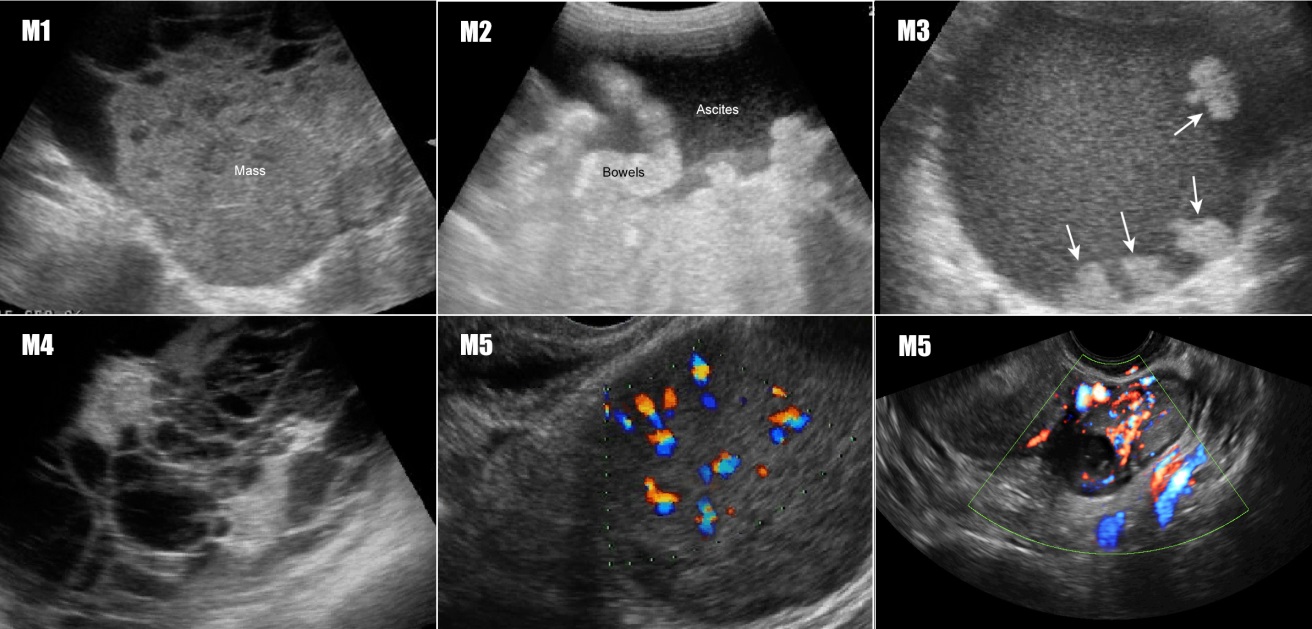
รูปที่ 18 ตัวอย่างภาพอัลตราซาวด์ IOTA M-rules (บ่งชี้ว่าเป็นเนื้องอกชนิดมะเร็ง)
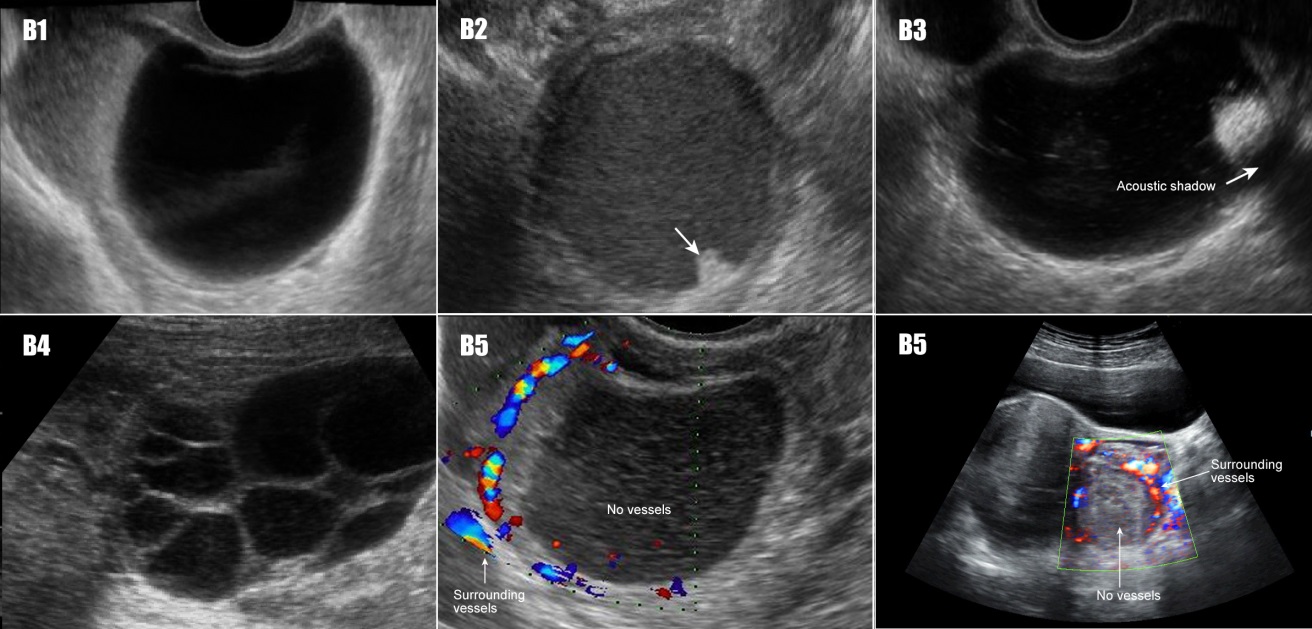
รูปที่ 19 ตัวอย่างภาพอัลตราซาวด์ IOTA B-rules (บ่งชี้ว่าเป็นเนื้องอกชนิดธรรมดา)
ข้อควรพิจารณา: 1) ควรใช้ CFM ผนวกเข้าไปทุกครั้งในการตรวจแยกมะเร็งและเนื้องอกธรรมดา ไม่ควรถือว่าเป็นเพียงการตรวจเสริมเท่านั้น 2) การทำนายว่าเป็นมะเร็งหรือไม่คือโอกาสมากกว่า ราวร้อยละ 90 คือยังมีโอกาสอีกร้อยละ10 ที่ระบุไม่ได้ชัด (unclassified)(26) กลุ่มนี้มักจะเป็น borderline tumor, struma ovarii, papillary cystadenofibroma หรือ myoma เป็นต้น เป็นกลุ่มที่จำแนกยาก การศึกษาใหญที่สุดที่ผ่านมาคือ IOTA study(25, 27) ซึ่งรวมผู้ป่วยเกือบ 5000 รายที่มีก้อนที่ปีกมดลูก ซึ่งแสดงให้เห็นว่าอัลตราซาวด์มีความสามารถสูงในการบอก “risk of malignancy” และยิ่งมีความน่าเชื่อถือสูงมากเมื่อทำนายว่าไม่น่าจะเป็นมะเร็ง ใน meta-analysis ที่ทำการเปรียบเทียบ 19 เทคนิคของการแยก พบว่า Simple rules มีความไวร้อยละ 93 ความจำเพาะร้อยละ 81 (โดยเพื่อพิจารณาว่า inconclusive คือมะเร็ง) (28)
American College of Radiology (ACR) Ovarian-Adnexal Reporting and Data System (O-RADS) เป็นระบบจัดลำดับความเสี่ยงและการดูแล ซึ่งช่วยให้ผู้แปลผลตรวจอัลตราซาวด์ไม่สับสนในการประเมินความเสี่ยงต่อมะเร็ง(29) การใช้ O-RADS ลักษณะที่พบจะจัดความเสี่ยงต่อมะเร็งเป็นหนึ่งในหกประเภทตามลักษณะทางอัลตราซาวด์ เป็นระบบที่ใหม่อยู่และยังไม่มีการใช้อย่างแพร่หลาย จากการศึกษาย้อนหลังซึ่งรวมผู้ป่วยที่มีก้อนที่ปีกมดลูกกว่า 600 ราย ทำการเปรียบเทียบประสิทธิภาพการทำนายของ O-RADS กับ IOTA และ GI-RADS พบว่า inter-reviewer agreement ไม่แตกต่างกัน แต่มีความไวสูงกว่า (ร้อยละ 97 เทียบกับ 92 และ 93 ตามลำดับ)(30)
บทสรุป
- ก้อนที่ปีกมดลูก (รังไข่ ท่อนำไข่ และเนื้อเยื่อข้างเคียง) เป็นปัญหาทางนรีเวชที่พบได้บ่อย การตรวจอัลตราซาวด์เป็นการตรวจค้นด้วยภาพลำดับแรกที่ใช้เพื่อจำแนกชนิดของก้อนเนื้องอก
- จุดประสงค์หลักของอัลตราซาวด์เพื่อแยกก้อนเนื้องอกธรรมดาออกกับมะเร็งได้ ซึ่งอาจไม่สามารถแยกได้แน่นอนร้อยเปอร์เซ็นต์ แต่ก็บอกถึงความเป็นไปได้มากน้อยเพียงใด
- ก้อนที่ปีกมดลูกอาจเป็นก้อนการเปลี่ยนแปลงปกติ (physiologic) หรือผิดปกติ (pathologic) ของร่างกาย ก้อนที่เป็นการเปลี่ยนแปลงปกติมักจะเป็นถุงน้ำ โอกาสเป็นมะเร็งมีน้อยมากถ้าไม่มีส่วนเนื้อตัน
- อัลตราซาวด์ขาวดำช่วยแยกลักษณะของก้อนได้ดี โดยเฉพาะเมื่อร่วมกับดอพเลอร์สี การตรวจด้วย MRI อาจมีประโยชน์เพิ่มเติมในบางราย ซึ่งให้ข้อมูลที่เป็นประโยชน์ทั้งในด้านการวินิจฉัยและวางแผนการรักษา
- ขั้นแรก ให้ดูว่าเป็นถุงน้ำหรือไม่ ถ้าเป็นถุงน้ำธรรมดา สามารถตัดมะเร็งออกไปได้ แต่อาจเป็นได้ทั้งถุงน้ำของการเปลี่ยนแปลงตามปกติหรือเนื้องอกถุงน้ำธรรมดา
- ขั้นที่สอง ถ้าไม่ใช่ถุงน้ำธรรมดา ให้พยายามดูลักษณะทางสรีรวิทยาปกติอื่น ๆ ในกรณีที่สงสัยแต่ไม่มั่นใจให้ตรวจติดตามดูความเปลี่ยนแปลง
- ขั้นที่สาม มีลักษณะจำเพาะที่เข้าได้กับรอยโรคบางอย่าง ได้แก่ endometrioma, dermoid, hydrosalpinx, peritoneal inclusion cysts และ pedunculated fibroid
- ก้อนที่สงสัยมะเร็ง ได้แก่ก้อนที่มีลักษณะ ดังต่อไปนี้
- มีส่วนเนื้อตัน (ซึ่งไม่ใช่ hyperechoic) บ่อยครั้งเป็นตุ่ม/ติ่งยื่นออกมา
- มีแผ่นกั้น (septation) ซึ่งหนาและขรุขระ (> 2-3 มม.)
- CFM พบมีการไหลเวียนเลือดในก้อน
- มีน้ำในช่องท้อง
- มีก้อนที่เยื่อบุช่องท้อง ต่อมน้ำเหลืองโต ลำไส้ติดกัน (อาจตรวจยากด้วยอัลตราซาวด์)
- ขั้นที่สี่ ในบางราย ลักษณะทางอัลตราซาวด์ให้ภาพไม่สมบูรณ์ (suboptimal) การตรวจตามหรือตรวจด้วยภาพวิธีอื่น หรือ tumor markers หรือร่วมกัน
- ภาพอัลตราซาวด์ของก้อนที่ปีกมดลูกจำนวนมากมีลักษณะจำเพาะที่ผู้คุ้นเคย ที่มีทักษะหรือประสบการณ์สูง สามารถวินิจฉัยได้เลยโดยไม่ต้องอาศัยระบบคัดกรองใด ๆ (pattern recognition)
เอกสารอ้างอิง
1. Berg C, Berndorff U, Diedrich K, Malik E. Laparoscopic management of ovarian dermoid cysts. A series of 83 cases. Arch Gynecol Obstet 2002;266:126-9.
2. Bromley B, Goodman H, Benacerraf BR. Comparison between sonographic morphology and Doppler waveform for the diagnosis of ovarian malignancy. Obstet Gynecol 1994;83:434-7.
3. DePriest PD, Shenson D, Fried A, Hunter JE, Andrews SJ, Gallion HH, et al. A morphology index based on sonographic findings in ovarian cancer [see comments]. Gynecol Oncol 1993;51:7-11.
4. Ferrazzi E, Zanetta G, Dordoni D, Berlanda N, Mezzopane R, Lissoni AA, et al. Transvaginal ultrasonographic characterization of ovarian masses: comparison of five scoring systems in a multicenter study. Ultrasound Obstet Gynecol 1997;10:192-7.
5. Lerner JP, Timor-Tritsch IE, Federman A, Abramovich G. Transvaginal ultrasonographic characterization of ovarian masses with an improved, weighted scoring system. Am J Obstet Gynecol 1994;170:81-5.
6. Sassone AM, Timor-Tritsch IE, Artner A, Westhoff C, Warren WB. Transvaginal sonographic characterization of ovarian disease: evaluation of a new scoring system to predict ovarian malignancy. Obstet Gynecol 1991;78:70-6.
7. Timmerman D, Schwarzler P, Collins WP, Claerhout F, Coenen M, Amant F, et al. Subjective assessment of adnexal masses with the use of ultrasonography: an analysis of interobserver variability and experience. Ultrasound Obstet Gynecol 1999;13:11-6.
8. Valentin L. Prospective cross-validation of Doppler ultrasound examination and gray-scale ultrasound imaging for discrimination of benign and malignant pelvic masses. Ultrasound Obstet Gynecol 1999;14:273-83.
9. Dill-Macky MJ, Atri M. Ovarian sonography. In: Callen PW, editor. Ultrasonography in obstetrics and gynecology. 4 ed. Philadelphia: W.B.Saunders; 2000. p. 857-96.
10. Dodson MG. The ovary. In: Dodson MG, editor. Transvaginal ultrasound. 2 ed. New York: Churchill Livingstone; 1995. p. 105-32.
11. Timor-Tritsch IE. Adnexal masses. In: Goldstein SR, Timor-Tritsch IE, editors. Ultrasound in gynecology. 1 ed. New York: Churchill Livingstone; 1995. p. 103-14.
12. ธีระ ทองสง, ชเนนทร์ วนาภิรักษ์, สุพัตรา ศิริโชติยะกุล, พฤหัส จันทร์ประภาพ, พรรณี ศิริวรรธนาภา. โรคของปีกมดลูก. 1 ed. กรุงเทพฯ: พี.บี. ฟอเรน บุ๊คส์ เซนเตอร์; 2002.
13. Rowan K, Meagher S, Teoh M, Vollenhoven B, Choong S, Tong S. Corpus luteum across the first trimester: size and laterality as observed by ultrasound. Fertil Steril 2008;90:1844-7.
14. Bourne TH, Hagström H, Hahlin M, Josefsson B, Granberg S, Hellberg P, et al. Ultrasound studies of vascular and morphological changes in the human corpus luteum during the menstrual cycle. Fertil Steril 1996;65:753-8.
15. Brown MA, Chang RJ. Polycystic ovary syndrome: clinical and imaging features. Ultrasound Q 2007;23:233-8.
16. Azziz R. Polycystic Ovary Syndrome. Obstet Gynecol 2018;132:321-36.
17. Ying W, Li Y, Zhou Y, Xie X. Cyst distortion: a new sonographic sign of peritoneal pseudocyst with regular morphology. Ultrasound Obstet Gynecol 2007;29:240-1.
18. Savelli L, de Iaco P, Ghi T, Bovicelli L, Rosati F, Cacciatore B. Transvaginal sonographic appearance of peritoneal pseudocysts. Ultrasound Obstet Gynecol 2004;23:284-8.
19. Saeng-Anan U, Pantasri T, Neeyalavira V, Tongsong T. Sonographic pattern recognition of endometriomas mimicking ovarian cancer. Asian Pac J Cancer Prev 2013;14:5409-13.
20. Sasaran V, Alexa Bad CM, Muresan D, Puscasiu L. Ultrasound pattern and diagnostic accuracy of primary ovarian endometrioma and its recurrence: a pictorial essay. Med Ultrason 2020;22:230-5.
21. Atri M, Nazarnia S, Bret PM, Aldis AE, Kintzen G, Reinhold C. Endovaginal sonographic appearance of benign ovarian masses. Radiographics 1994;14:747-60.
22. Patel MD, Feldstein VA, Chen DC, Lipson SD, Filly RA. Endometriomas: diagnostic performance of US. Radiology 1999;210:739-45.
23. Tongsong T, Luewan S, Phadungkiatwattana P, Neeyalavira V, Wanapirak C, Khunamornpong S, et al. Pattern recognition using transabdominal ultrasound to diagnose ovarian mature cystic teratoma. Int J Gynaecol Obstet 2008;103:99-104.
24. Patel MD, Feldstein VA, Lipson SD, Chen DC, Filly RA. Cystic teratomas of the ovary: diagnostic value of sonography. AJR Am J Roentgenol 1998;171:1061-5.
25. Timmerman D, Van Calster B, Testa A, Savelli L, Fischerova D, Froyman W, et al. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis group. Am J Obstet Gynecol 2016;214:424-37.
26. Valentin L, Ameye L, Jurkovic D, Metzger U, Lécuru F, Van Huffel S, et al. Which extrauterine pelvic masses are difficult to correctly classify as benign or malignant on the basis of ultrasound findings and is there a way of making a correct diagnosis? Ultrasound Obstet Gynecol 2006;27:438-44.
27. Kaijser J. Towards an evidence-based approach for diagnosis and management of adnexal masses: findings of the International Ovarian Tumour Analysis (IOTA) studies. Facts Views Vis Obgyn 2015;7:42-59.
28. Kaijser J, Sayasneh A, Van Hoorde K, Ghaem-Maghami S, Bourne T, Timmerman D, et al. Presurgical diagnosis of adnexal tumours using mathematical models and scoring systems: a systematic review and meta-analysis. Hum Reprod Update 2014;20:449-62.
29. Andreotti RF, Timmerman D, Strachowski LM, Froyman W, Benacerraf BR, Bennett GL, et al. O-RADS US Risk Stratification and Management System: A Consensus Guideline from the ACR Ovarian-Adnexal Reporting and Data System Committee. Radiology 2020;294:168-85.
30. Basha MAA, Metwally MI, Gamil SA, Khater HM, Aly SA, El Sammak AA, et al. Comparison of O-RADS, GI-RADS, and IOTA simple rules regarding malignancy rate, validity, and reliability for diagnosis of adnexal masses. Eur Radiol 2021;31:674-84.

