มะเร็งปากมดลูก (cervical cancer)
มะเร็งปากมดลูก (cervical cancer)
ธนิยาภรณ์ เศรษฐิยานันท์
อาจารย์ที่ปรึกษา อ.กิตติภัต เจริญขวัญ
บทนำ
ในประเทศไทย มะเร็งปากมดลูกเป็นมะเร็งที่พบมากเป็นอันดับสอง ของมะเร็งทั้งหมดที่พบในสตรีไทย รองจากมะเร็งเต้านม และสตรีไทยเสียชีวิตจากมะเร็งปากมดลูกเป็นอันดับสอง รองจากมะเร็งตับ ซึ่งในปัจจุบันมีการศึกษายืนยันแล้วว่า การติดเชื้อHuman papillomavirus (HPV) เป็นสาเหตุหลักสำคัญที่ทำให้เกิดการพัฒนาไปสู่การเป็นมะเร็งปากมดลูกได้ ดังนั้นการตรวจคัดกรองมะเร็งปากมดลูกที่มีประสิทธิภาพ และการได้รับวัคซีนป้องกันเชื้อHPVอย่างเหมาะสม สามารถป้องกันการเกิดมะเร็งปากมดลูกได้
Epidemiology
จากข้อมูลขององค์การอนามัยโลกในปี 2008 พบว่ามีผู้ป่วยมะเร็งปากมดลูกรายใหม่ ประมาณ 530,000 คน และมี 275,000 คน ที่เสียชีวิตจากมะเร็งปากมดลุก โดยที่ 80เปอร์เซ็นต์ของผู้ป่วยมะเร็งปากมดลูกรายใหม่ พบในประเทศกำลังพัฒนา และอัตราการเสียชีวิตจากมะเร็งปากมดลูกอยู่ที่ 52เปอร์เซ็นต์ โดยที่อุบัติการณ์การเกิดโรคและอัตราการเสียชีวิต (Incidence and mortality rates) ขึ้นอยู่กับระบบการตรวจคัดกรองมะเร็งปากมดลูก และการได้รับวัคซีนป้องกัน HPV ซึ่งสามารถทำได้ในกลุ่มประเทศที่พัฒนาแล้ว จึงมีผลทำให้ในช่วง 50 ปีที่ผ่านมา Incidence และ mortality rate ในประเทศพัฒนาแล้วลดลงถึง 75 เปอร์เซ็นต์ และทำให้ มะเร็งปากมดลูก อยู่ในอันดับสิบของมะเร็งที่พบบ่อยในผู้หญิง (9.0 ต่อสตรี 100000คน) และอัตราการเสียชีวิตจากมะเร็งปากมดลูกก็อยู่ในอันดับต่ำกว่าสิบ (3.9 ต่อสตรี 100000คน)
ในทางตรงกันข้าม ประเทศที่กำลังพัฒนา มะเร็งปากมดลูกพบมากเป็นอันดับสองของโรคมะเร็งที่พบบ่อยในสตรีทั้งหมด (17.8 ต่อสตรี 100000คน) และอัตราการเสียชีวิตจากมะเร็งอยู่ที่ (9.8 ต่อสตรี 100000คน) แต่ในทวีปแอฟริกาและแถบอเมริกากลาง มะเร็งปากมดลูกเป็นสาเหตุการเสียชีวิตจากมะเร็งเป็นอันดับหนึ่ง (1,2)
ปัจจัยเสี่ยง (Risk factor)
ไม่ว่าจะเป็นมะเร็งปากมดลูกชนิดใด ความเสี่ยงในการเกิดโรค สัมพันธ์กับโอกาสเสี่ยงในการติดเชื้อHPV ซึ่งสัมพันธ์กับพฤติกรรมทางเพศ และโรคติดต่อทางทางเพศสัมพันธ์ ซึ่งได้แก่
- การเริ่มมีเพศสัมพันธ์เมื่ออายุยังน้อย – พบว่าความเสี่ยงต่อการเป็นมะเร็งปากมดลูกเพิ่มขึ้นเป็นสองเท่าในกลุ่มที่เริ่มมีเพศสัมพันธ์ตอนอายุน้อยกว่า 18 ปี เมื่อเทียบกับกลุ่มที่เริ่มมีเพศสัมพันธ์ตอนอายุมากกว่าหรือเท่ากับ 21 ปี (3)
- การมีคู่นอนหลายคน –เมื่อเปรียบเทียบกับคู่นอนคนเดียว พบว่าความเสี่ยงต่อการเป็นมะเร็งปากมดลูกเพิ่มขึ้นเป็น 2เท่าในคนที่มีคู่นอน 2 คน และเพิ่มเป็น 3เท่าในคนที่มีคู่นอนมากกว่าหรือเท่ากับ 6 คน (3)
- คู่นอนที่มีความเสี่ยงสูง ได้แก่ คู่นอนที่มีคู่นอนหลายคน หรือคู่นอนที่มีประวัติติดเชื้อ HPV
- มีประวัติเป็นโรคติดต่อทางเพศสัมพันธ์ – เช่น Chlamydia trachomatis , genital herpes
- ประวัติการเคยเป็นมะเร็งหรือมีเซลล์เยื่อบุผิดปกติ ที่ช่องคลอดหรือที่อวัยวะสืบพันธุ์ภายนอก (vulva or vaginal squamous intraepithelial neoplasia or cancer) ซึ่งเชื้อ HPV เป็นสาเหตุหลักของความผิดปกติชนิดนี้
- ภาวะภูมิคุ้มกันบกพร่อง(Immunosuppression) – เช่น การติดเชื้อHIV
- อายุที่เริ่มมีบุตรคนแรก(น้อยกว่า 20 ปี) และการมีบุตรหลายคน (3)
- สตรีที่มีฐานะทางเศรษฐกิจต่ำ (Low socioeconomic status)
- การรับประทานยาคุมกำเนิดเป็นเวลานาน –จากการศึกษาพบว่า ปัจจัยเสี่ยงของมะเร็งปากมดลูกจะเพิ่มขึ้นตามระยะเวลาในการรับประทานยาคุมกำเนิด
- การสูบบุหรี่ –สัมพันธ์กับการเกิดมะเร็งปากมดลูกชนิด squamous cell แต่ไม่เพิ่มความเสี่ยงต่อการเกิดมะเร็งปากมดลูกชนิด adenocarcinoma เมื่อเทียบกับคนที่ไม่สูบบุหรี่(3)
- ในสตรีที่มีคู่นอนที่ขลิบอวัยวะเพศ( Circumcision) พบว่ามีโอกาสเสี่ยงในการเกิดมะเร็งปากมดลูกได้น้อยกว่า(4)
พยาธิวิทยา (Pathology)
- เชื้อ human papillomavirus (HPV) เป็นสาเหตุหลักที่ทำให้เกิดเนื้องอกที่ปากมดลูก และสามารถตรวจพบได้ถึง 99.7%ของมะเร็งปากมดลูก (5)
- เชื้อ HPVที่พบบริเวณอวัยวะเพศ มีมากกว่า 40 types และมีประมาณ 15 types ที่เป็น oncogenic HPV และ มากกว่า 70%ของมะเร็งปากมดลูก พบว่าเป็น HPV subtypes ที่ 16 และ 18
{tabulizer:style[gr.alterora.elemental_1_blue.css]}
| Risk of cervical CA with HPV |
| High-risk (oncogenic or cancer-associated) types |
| Common types: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 69, 82 |
| Low-risk (non-oncogenic) types |
| Common types: 6, 11, 40, 42, 43, 44, 54, 61, 72, 81 |
- ปกติการติดเชื้อ HPV ที่อวัยวะเพศสามารถพบได้ทั่วไป แต่ที่จะทำให้เกิดมะเร็งปากมดลูกจริงๆในสตรีนั้นพบเป็นสัดส่วนที่น้อย พบว่าประมาณ 75-80%ของคนที่อยู่ในวัยเจริญพันธุ์ ได้รับเชื้อ HPV ที่อวัยวะเพศก่อนอายุ 50 ปี (6,7) ส่วนใหญ่การติดเชื้อ HPV จะเป็นแบบชั่วคราว และเชื้อไวรัส HPV อย่างเดียวไม่สามารถทำให้เกิดมะเร็งปากมดลูกได้ แต่ถ้าการติดเชื้อเป็นแบบติดทนนาน ก็จะสามารถพัฒนาทำให้เกิดมะเร็งปากมดลูกได้ โดยระยะเวลาตั้งแต่เริ่มติดเชื้อ และพัฒนาไปเป็น HSIL จนเกิดเป็น invasive cancer ใช้เวลาประมาณ 15 ปี
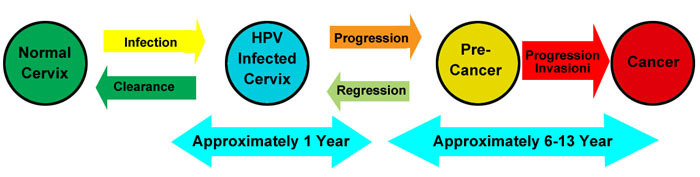
ขั้นตอนหลักในการพัฒนาทำให้เกิดมะเร็งปากมดลูก (8)
- ติดเชื้อชนิด Oncogenic HPV ที่บริเวณเยื่อบุผิวบริเวณ transformation zoneของปากมดลูก
- การติดเชื้อเป็นแบบติดทนนาน (persistent infection)
- มีการ progression of clone of epithelial cells จาก persistent infection ไปเป็น precancer
- การพัฒนาของมะเร็งและลุกลามผ่านชั้น basement membrane
- มีรายงานในบางการศึกษาพบว่า เชื้อ Herpes simplex virus-2 มีส่วนร่วม(cofactor) ในการทำให้เกิดมะเร็งปากมดลูก แต่ยังคงต้องมีการศึกษาเพิ่มเติมต่อไป
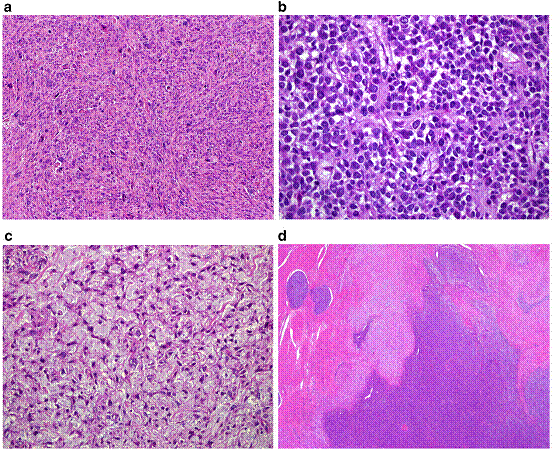
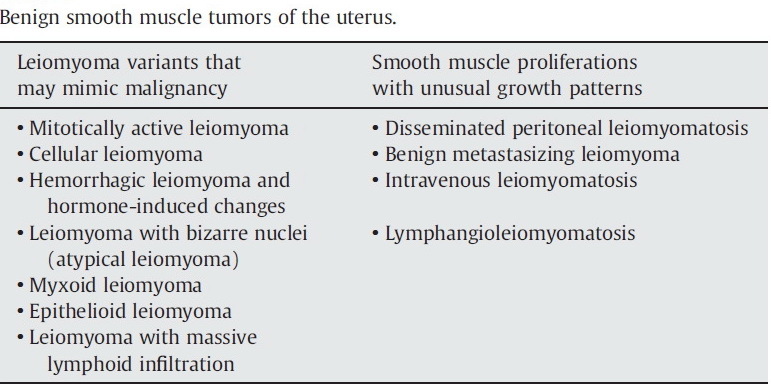
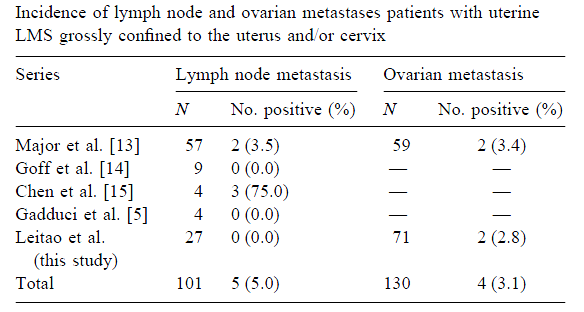
- การแบ่งชนิดของเซลล์มะเร็งปากมดลูก แบ่งได้ ดังนี้{tabulizer:style[gr.alterora.elemental_1_blue.css]}
Histopathology cervical cancer A. Squamous cell carcinoma Large cell, keratinizing squamous cell carcinoma Large cell, non-keratinizing squamous cell carcinoma Verrucous carcinoma Papillary squamous and transitional cell carcinoma Lymphoepithelioma-like carcinoma” B. Adenocarcinoma Mucinous, endocervical variant Mucinous, intestinal type, signet ring variant Mucinous, adenoma malignum (minimal deviation variant) Mucinous,villoglandular adenocarcinoma (well differentiated) Endometriod type Clear cell type Papillary serous type Mesonephric type” C. Adenosquamous carcinoma D. Adenoid cystic carcinoma E. Neuroendocrine (carcinoid, small cell, large cell) F. Undifferentiated carcinoma G. Mixed epithelial and mesenchymal tumors - โดยชนิดที่พบมากที่สุดคือ Squamous cell carcinoma (69%) ,adenocarcinoma(25%) และชนิดอื่นๆ (6%)
- โดยในช่วงสิบปีผ่านมา พบแนวโน้วการเกิดมะเร็งปากมดลูกชนิด adenocarcinoma มากขึ้น โดยเฉพาะในผู้หญิงอายุน้อย (9) ได้มีการอธิบายถึงแนวโน้มนี้ว่า มีการเพิ่มขึ้นของเชื้อ HPV 16,18 ที่จำเพาะต่อมะเร็งชนิด adenocarcinoma และการได้รับฮอร์โมนเอสโตรเจน ที่มากกว่า
การแพร่กระจาย (Routes of spread)
- การแพร่กระจายของมะเร็งปากมดลูก มีด้วยกัน 3 ทางคือ การลุกลามโดยตรง (Direct invasion) , การแพร่กระจายผ่านทางต่อมน้ำเหลือง (Lymphatic dissemination) และการแพร่กระจายผ่านทางกระแสเลือด(Hematogenous dissemination)
- การลุกลามโดยตรง อาจลุกลามไปยังมดลูก, ช่องคลอด, พารามีเทียม, เยื่อบุช่องท้อง,กระเพาะปัสสาวะ หรือช่องทวารหนัก
- ส่วนการลุกลามไปยังรังไข่ค่อนข้างพบได้น้อยมาก พบว่ามะเร็งปากมดลูกแพร่กระจายไปยังรังไข่พบได้ประมาณ 0.5 เปอร์เซ็นต์ของมะเร็งชนิด squamous cell และ 1.7 เปอร์เซ็นต์ของมะเร็งชนิด adenocarcinoma(10)
- ส่วนตำแหน่งที่มะเร็งปากมดลูกแพร่กระจายทางกระแสเลือดมากที่สุด คือที่ ปอด,ตับ และกระดูก
- จากประวัติศาสตร์ที่ผ่านมาเชื่อว่า obturator lymph nodes เป็นต่อมน้ำเหลืองที่มะเร็งปากมดลูกแพร่กระจายไปมากที่สุด(11) และยังเชื่อว่าการแพร่กระจายทางท่อน้ำเหลือง จะเป็นไปตามแบบแผน โดยเริ่มจากต่อมที่ผนังด้านข้างของอุ้งเชิงกราน(pelvic side wall) ต่อไปยัง common iliac lymph nodes และต่อไปยัง paraaortic group อย่างไรก็ตาม การศึกษาภายหลังต่อมาได้ใช้ประโยชน์ของ sentinel lymph node mapping technique และเน้นย้ำว่า ไม่ว่าจะเป็น pelvic lymph node groups หรือ paraaortic lymph nodes ก็สามารถเป็นตำแหน่งของต่อมน้ำเหลืองแรกที่มะเร็งปากมดลูกจะแพร่กระจายไปได้ (12,13) โดยมีตัวอย่างอธิบายจากการศึกษา แบบ retrospective study ขนาดใหญ่(1971-2005)ของผู้ป่วยที่เป็นมะเร็งปากมดลูกจำนวน 619 คน ที่ตรวจพบการกระจายไปยังต่อมน้ำเหลือง 1-2 ต่อมจากการทำ radical hysterectomy ร่วมกับ complete lymphadenectomy(14) พบว่า มีการแพร่กระจายของมะเร็งไปยังต่อมน้ำเหลือง external iliac(43%), obturator(26%), parametrial(21%), common iliac (7%), presacral(1%)
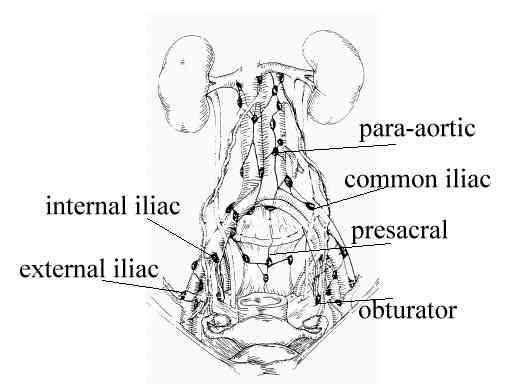
ลักษณะทางคลินิก (Clinical manifestation)
- ในมะเร็งปากมดลูกระยะเริ่มต้น บ่อยครั้งที่พบว่าไม่มีอาการผิดปกติ(asymptomatic) เพราะฉะนั้นมีความจำเป็นอย่างยิ่งต้องตรวจคัดกรองมะเร็งปากมดลูก โดยในสตรีที่ไม่มีอาการอาจตรวจพบมะเร็งปากมดลูกได้จากการตรวจคัดกรอง หรือเห็นรอยโรคโดยบังเอิญจากการตรวจภายใน
- อาการที่พบบ่อบที่สุดของผู้ป่วยมะเร็งปากมดลูก คือ (15)
- เลือดออกกระปริดกระปรอย หรือการตกเลือดทางช่องคลอด (Irregular or heavy vaginal bleeding)
- เลือดออกหลังมีเพศสัมพันธ์ (Postcoital bleeding)
- ในสตรีบางคน อาจมี vaginal discharge ซึ่งมีลักษณะเป็นได้ทั้งแบบ น้ำ(watery),เมือก(mucoid), หนอง(purulent), หรือหนองปนเลือดที่มีกลิ่นเหม็นมาก(malodorous) ซึ่งอาการที่ไม่เฉพาะเจาะจงนี้ อาจทำให้เข้าใจผิดกับภาวะ ช่องคลอดอักเสบ(vaginitis) หรือ ปากมดลูกอักเสบ(cervicitis)ได้
- ในระยะลุกลาม( Advanced disease) ผู้ป่วยอาจมีอาการปวดท้องน้อย ปวดหลัง ร้าวไปก้นกบ หรือ ต้นขา ,ปัสสาวะเป็นเลือด,ถ่ายเป็นเลือด, หรือ มีอุจจาระหรือปัสสาวะออกมาทางช่องคลอด ซึ่งพบได้น้อยและบ่งบอกถึงอยู่ในมะเร็งระยะลุกลามแล้ว
การวินิจฉัยมะเร็งปากมดลูก (Diagnosis)
- การวินิจฉัยมะเร็งปากมดลูก ต้องได้จากการตรวจทางพยาธิวิทยาของชิ้นเนื้อปากมดลูก (cervical biopsy)
- การตรวจร่างกาย
- ในสตรีที่มีอาการหรือสงสัยโรคมะเร็งปากมดลูกควรได้รับการตรวจภายในทุกราย
- การดูด้วยตาเปล่าทาง speculum examination อาจเห็นเหมือนปกติ หรือเห็นรอยโรคที่ ปากมดลูก ก้อนมะเร็งขนาดใหญ่อาจคลุมปากมดลูกทั้งหมดได้
- รอยโรคใดก็ตามที่มีลักษณะนูนขึ้น เปราะง่าย หรือมีลักษณะเหมือน condyloma ควรได้รับการตรวจชิ้นเนื้อ โดยไม่คำนึงถึงผลตรวจทางเซลวิทยาก่อนหน้านี้ แม้ผลจะเป็น benign ก็ตาม(16)
- รอยโรคที่มองเห็นด้วยตา เพียงอย่างเดียวที่อาจไม่จำเป็นต้องตรวจชิ้นเนื้อ คือ Nabothian cyst แต่ทั้งนี้ทั้งนั้นต้องได้รับการตรวจยืนยันจากผู้ที่มีประสบการณ
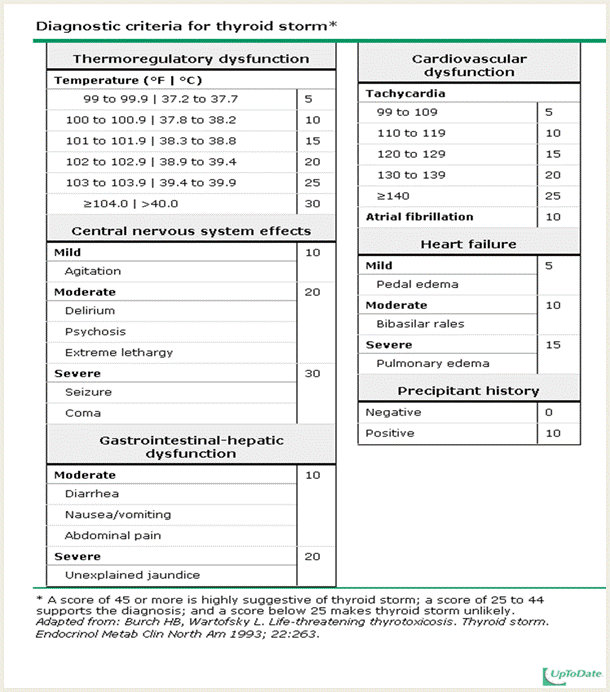
- มะเร็งปากมดลูกมักมีจุดกำเนิดตรงบริเวณ transformation zone (รอยต่อระหว่าง squamous epithelium ของ ectocervix กับ glandular epithelium ของ endocervical canal ) รอยโรคที่พบอาจเป็นแบบรอยแผลบนชั้นเยื่อบุผิว (Ulcerative type) ,แบบเนื้องอกออกจากเยื่อบุปากมดลูก (Exophytic type) หรือเป็นแบบแทรกซึมเข้าไปในปากมดลูก (infiltrative type)
- ก้อนมะเร็งที่เกิดภายในปากมดลูก อาจเป็นผลทำให้ปากมดลูกขยายถ่างออกคล้ายถังเบียร์เรียกว่า ” Barrel shaped cervix”
- ในมะเร็งปากมดลูกชนิด adenocarcinoma พบว่าประมาณครึ่งหนึ่งเป็นแบบ exophytic type และอีกประมาณ 15เปอร์เซ็นต์มองไม่เห็นรอยโรคเนื่องจากก้อนมะเร็งอยู่ภายใน endocervical canal
- ส่วนการแบ่งระยะของมะเร็งปากมดลูก (staging) จะใช้การตรวจภายใน ร่วมกับ การตรวจ rectovaginal examination เพื่อประเมินขนาดของก้อน และการแพร่กระจายไปยังช่องคลอด หรือ พารามีเทียม
- การคลำพบต่อมน้ำเหลืองบริเวณขาหนีบและไหปลาร้า ควรสงสัยรอยโรคของมะเร็งไว้ด้วย
- การวินิจฉัยแยกโรคมะเร็งปากมดลูก ให้แยกกับโรคอื่นๆที่ทำให้ภาวะเลือดออกผิดปกติ หรือ ทำให้เกิด vaginal discharge เช่น ปากมดลูกอักเสบ (cervicitis) ช่องคลอดอักเสบ (vaginitis)
- รอยโรคที่มีลักษณะเป็นก้อน ที่อาจทำให้ดูคล้ายก้อนมะเร็ง (benign tomor-like lesios) ได้แก่ nabothian cysts, mesonephric cysts, cervical ectropian , รอยแผลจากโรคติดต่อทางเพศสัมพันธ์, endometriosis เป็นต้น
Cervical biopsy and colposcopy
- ในสตรีที่สามารถเห็นรอยโรคชัดเจน และสงสัยมะเร็งปากมดลูก ต้องได้รับการทำ biopsy เพื่อยืนยัน และควรทำ biopsy ตรงตำแหน่งรอยโรคที่สงสัย และควรหลีกเลี่ยงบริเวณเนื้อตาย (necrotic area) ซึ่งมักเป็นตำแหน่งที่พบว่าไม่สามารถวินิจฉัยได้
- ถ้าตรวจพบปากมดลูกมีลักษณะแข็งผิดปกติ หรือขยายถ่างออก ควรทำ punch biopsy และ endocervical curettage ถึงแม้ผลทางเซลวิทยาจะไม่บ่งถึงภาวะเนื้องอก
- การทำ biopsy ในรอยโรคที่เห็นชัดเจน อาจทำให้เกิดเลือดออกอย่างมาก จนถึงขั้นตกเลือดได้ ดั้งนั้นผู้ทำควรเตรียมสารห้ามเลือด (homeostatic agents) เช่น Monsel solution ให้พร้อม และสามารถทำ vaginal packing ได้เมื่อมีเลือดออกอย่างรุนแรง
- ในสตรีที่มองไม่เห็นรอยโรคอย่างชัดเจน แต่พบว่ามีอาการ หรือมีผลเซลล์วิทยาของปากมดลูกที่ผิดปกติ ควรทำ colposcopy และ directed biopsy โดยที่การทำ colposcopy ที่เพียงพอ ต้องครอบคลุมทั่วทั้ง squamocolumnar junction และรอยโรคทั้งหมดที่เห็นด้วยตาแล้วจึงค่อยทำ biopsy ตรงบริเวณที่เซลล์วิทยาผิดปกติ
- ในสตรีที่อยู่ในที่ ที่ไม่สามารถทำ colposcopy ได้ ต้องทำ directed biopsy ร่วมกับ aid of visual inspection method (VIA,VILI)
- ถ้าสงสัยมะเร็งปากมดลูก แต่ผลตรวจชิ้นเนื้อปกติ จำเป็นต้องทำ conization และ conization ยังช่วยในเรื่องการตัดสินใจรักษาในกรณีที่เป็น microinvasive cancer ได้ด้วย
การแบ่งระยะมะเร็งปากมดลูก (Staging) (17)
- การแบ่งระยะมะเร็งปากมดลูก เป็นการแบ่งโดยอาศัยการตรวจทางคลินิก (Clinical staging) ตามระบบของ FIGO ซึ่งเป็นมาตรฐาน และใช้ได้กับทุกชนิดของเซลล์มะเร็ง
- FIGO Staging ofCarcinoma of the Cervix Uteri{tabulizer:style[gr.alterora.elemental_1_orange.css]}
Stage I The carcinoma is strictly confined to the cervix (extension to the corpus would be disregarded). IA Invasive carcinoma, which can be diagnosed only by microscopy with deepest invasion ≤5 mm and largest extension ≥7 mm. IA1 Measured stromal invasion of ≤3.0 mm in depth and extension of ≤7.0 mm. IA2 Measured stromal invasion of >3.0 mm and not >5.0 mm with an extension of not >7.0 mm. IB Clinically visible lesions limited to the cervix uteri or preclinical cancers greater than stage IA.b IB1 Clinically visible lesion ≤4.0 cm in greatest dimension. IB2 Clinically visible lesion >4.0 cm in greatest dimension. II Cervical carcinoma invades beyond the uterus but not to the pelvic wall or to the lower third of the vagina. IIA Without parametrial invasion. IIA1 Clinically visible lesion ≤4.0 cm in greatest dimension. IIA2 Clinically visible lesion >4.0 cm in greatest dimension. IIB With obvious parametrial invasion. III The tumor extends to the pelvic wall and/or involves lower third of the vagina and/or causes hydronephrosis or nonfunctioning kidney.c IIIA Tumor involves lower third of the vagina with no extension to the pelvic wall. IIIB Extension to the pelvic wall and/or hydronephrosis or nonfunctioning kidney. IV The carcinoma has extended beyond the true pelvis or has involved (biopsy proven) the mucosa of the bladder or rectum. A bullous edema, as such, does not permit a case to be allotted to stage IV. IVA Spread of the growth to adjacent organs. IVB Spread to distant organs. 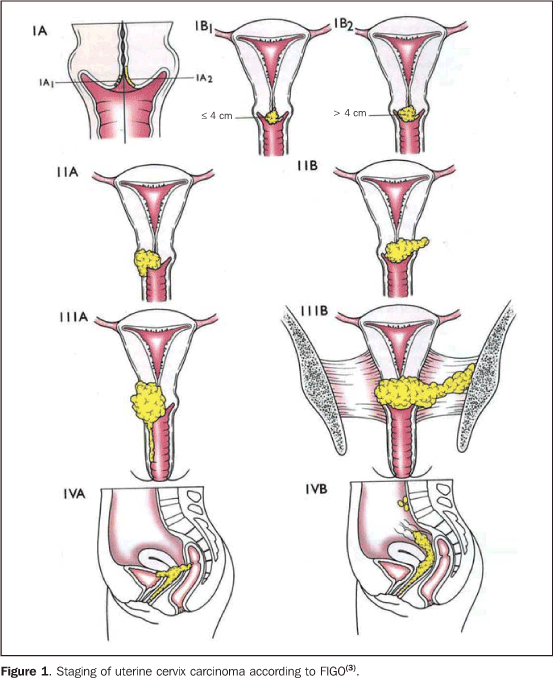
วิธีการตรวจเพื่อแบ่งระยะของมะเร็งปากมดลูกที่ได้รับอนุญาตโดย FIGO ได้แก่
Physical examination
- Palpable lymph node
- Examine vagina
- Bimanual rectovaginal examination
Radiologic studies
- Intravenous pelogram
- Barium enema
- Chest x-ray
- Skeletal x-ray
Procedures
- Biopsy
- Conization
- Hysteroscopy
- Colposcopy
- Endocervical curettage
- Cystoscopy
- Proctoscopy
- ส่วนการสืบค้นวิธีอื่นๆ เช่น Lymphagiography, Computed tomography(CT) ,ultrasonography, magnetic resonance imaging(MRI) ,หรือ positron emission tomography (PET) อาจนำมาช่วยในเพิ่มความถูกต้องในการแบ่งระยะของมะเร็ง แต่ข้อมูลเหล่านี้ไม่สามารถเปลี่ยนแปลงระยะมะเร็งปากมดลูก และจากการศึกษาพบว่า การสืบค้นต่างๆที่กล่าวมามี ความไว(sensitivity)ที่ต่ำ และ false negative rates ที่ค่อนข้างสูง
การรักษา (Treatment)
การรักษาโดยแบ่งตามระยะของมะเร็งปากมดลูก
{tabulizer:style[gr.alterora.elemental_1_blue.css]}
| Stage IA 1 | < 3 mm invasion, no LVSI | Conization or type 1 hysterectomy |
| > 3 mm invasion, w/ LVSI | Radical trachelectomy or type 2 hysterectomy with pelvic lymphadenectomy | |
| Stage IA2 | > 3-5 mm invasion | Radical trachelectomy or type 2 hysterectomy with pelvic lymphadenectomy |
| Stage IB1 | > 5 mm invasion, < 2 cm | Radical trachelectomy or type 3 hysterectomy with pelvic lymphadenectomy |
| > 5 mm invasion, > 2 cm | type 3 hysterectomy with pelvic lymphadenectomy | |
| Stage IB2 | type 3 hysterectomy with pelvic and para-aortic lymphadenectomy or primary chemoradiation | |
| Stage IIA1,IIA2 | type 3 hysterectomy with pelvic and para-aortic lymphadenectomy or primary chemoradiation | |
| Stage IIB, IIIA, IIIB | primary chemoradiation | |
| Stage IVA | primary chemoradiation or primary exenteration | |
| Stage IVB | primary chemoradiation + radiation |
LVSI =lymph vascular space invasion
- การรักษามะเร็งปากมดลูกคล้ายกับการรักษามะเร็งชนิดอื่นๆ ซึ่งมีรูปแบบในการรักษา (therapeutic modalities) ที่ประกอบไปด้วย การผ่าตัด, รังสีรักษา(radiotherapy), เคมีบำบัด (chemotherapy) และการรักษาร่วม (combined treatment) เช่น chemoradiation
- รังสีรักษา(radiotherapy) สามารถทำได้ในทุกระยะของโรค แต่การผ่าตัดรักษา จำกัดในผู้ป่วยมะเร็งปากมดลูกระยะ stage I ถึง IIA เท่านั้น และอัตราการรอดชีวิตภายใน 5 ปี (5-year survival rate) ของมะเร็ง stage I อยู่ที่ 85 เปอร์เซ็นต์ไม่ว่าจะรักษาด้วย radiotherapy หรือ radical hysterectomy
- การรักษาด้วยการผ่าตัดมีประโยชน์มากกว่ารังสีรักษา โดยเฉพาะในสตรีที่อายุน้อย และต้องการรักษารังไข่เอาไว้ และการรักษาด้วยการผ่าตัดจะมีปัญหาเรื่อง sexual dysfunction ได้น้อยกว่า
- การทำ cone biopsy ของปากมดลูกสามารถเป็นได้ทั้งการวินิจฉัยโรค และการรักษามะเร็งปากมดลูกระยะ stage IA1 ในผู้ป่วยที่ต้องการรักษาภาวะเจริญพันธุ์ไว้
- Simple (Extrafascial Hysterectomy) หรือ Type I hysterectomy ใช้รักษาผู้ป่วยมะเร็งปากมดลูกระยะ stage Ia1 ที่ไม่มี lymph-vascular space invasion และไม่ต้องการรักษาภาวะเจริญพันธุ์ไว้
- Radical trachelectomy เป็นการผ่าตัดปากมดลูกออก ซึ่งกำลังเป็นที่นิยมในผู้ป่วยมะเร็งปากมดลูกระยะ stage IA2 และ IB1 ซึ่งต้องการเก็บรักษามดลูกและภาวะเจริญพันธุ์ไว้ ซึ่งการผ่าตัดแบบนี้สามารถทำได้ทั้งผ่านทาง ช่องคลอด, ทางหน้าท้อง(laparotomy), ทางกล้องส่องตรวจทางช่องท้อง(laparoscopy) หรือผ่านทางหุ่นยนต์ (Robotic) และมักทำร่วมกับการเลาะต่อมน้ำเหลืองในอุ้งเชิงกราน(pelvic lymphadenectomy) ร่วมกับการทำ cervical cerclage
ผู้ป่วยที่เหมาะสมกับการผ่าตัดชนิดนี้ คือผู้ป่วยที่มีก้อนมะเร็งน้อยกว่า 2 ซม. และไม่พบการแพร่กระจายไปที่ต่อมน้ำเหลือง
- Radical hysterectomy คือการผ่าตัดมดลูกออกร่วมกับการทำ pelvic lymphadenectomy และเอา uterosacral ligament, cardinal ligament และหนึ่งในสามด้านบนของช่องคลอดออก การผ่าตัดแบบนี้เรียกว่า Type III radical hysterectomy
ส่วน Type II radical hysterectomy หรือ Modified radical hysterectomy คือการผ่าตัดเอามดลูกออกที่ โดยตัด uterosacral ligament และ cardinal ligament ออกแค่ครึ่งเดียว - รังสีรักษา (Radiotherapy) สามารถรักษาได้ทุกระยะของมะเร็งปากมดลูก และอัตราการรักษาให้หายขาดใน stage I ประมาณ 70% , stage II ประมาณ 60% , stage III ประมาณ 45% และ stage IV ประมาณ 18%
- การให้เคมีบำบัดพร้อมกับรังสีรักษา เรียกว่า chemoradiation ซึ่งเป็นวิธีการรักษามะเร็งปากมดลูกในระยะลุกลาม ที่จะรักษาด้วยรังสี แนะนำให้ทำเคมีบำบัดร่วมด้วย และนิยมให้ยาเคมีบำบัดที่มียา cisplatin เป็นหลัก
สรุป
- มะเร็งปากมดลูกเป็นมะเร็งที่พบบ่อย และสาเหตุการตายอันดับสอง ของมะเร็งทั้งหมดที่พบในสตรีไทย
- ระบบการตรวจคัดกรองมะเร็งปากมดลูกที่มีประสิทธิภาพ และการได้รับวัคซีนป้องกันเชื้อHPVอย่างเหมาะสม สามารถป้องกันการเกิดมะเร็งปากมดลูกได้
- การติดเชื้อ HPV เป็นสาเหตุหลักในการพัฒนาให้เกิดมะเร็งปากมดลูก และสามารถตรวจพบได้ถึง 99.7 เปอร์เซ็นต์ และเชื้อ HPV ชนิด subtype ที่ 16 และ 18 พบได้ประมาณ 70 เปอร์เซ็นต์ ของมะเร็งปากมดลูกทั้งหมด
- ปัจจัยเสี่ยงในการเกิดมะเร็งปากมดลูก เพิ่มตามความเสี่ยงในการติดเชื้อ HPV และภาวะภูมิคุ้มกันบกพร่องต่อการตอบสนองต่อเชื้อ HPV
- มะเร็งปากมดลูกชิดที่พบบ่อยที่สุด คือ squamous cell carcinoma (69%) และ adenocarcinoma (25%)
- มะเร็งปากมดลูกระยะเริ่มต้น มักไม่มีอาการ จึงมีความจำเป็นในการตรวจคัดกรองมะเร็งปากมดลูก และอาการแสดงที่พบบ่อยที่สุด คือ การมีเลือดออกทางช่องคลอด ,เลือดออกหลังมีเพศสัมพันธ์ หรือ การมี vaginal discharge
- การแบ่งระยะมะเร็งปากมดลูกเป็นการแบ่งโดยอาศัยการตรวจทางคลินิก (clinical staging) และมะเร็งระยะเริ่มต้นสามารถรักษาให้หายขาดได้ด้วยการผ่าตัดและการฉายรังสี ส่วนมะเร็งระยะลุกลาม วิธีการรักษาที่ดีที่สุดคือการรักษาด้วย chemoradiotherapy
References
- Cervical Cancer Incidence, Mortality and prevalence worldwide in 2008: Summary. http://globocan.iarc.fr/factsheet.asp (Accessed on January 30, 2013).
- WHO/ICO Information Center of HPV and Cervical Cancer (HPV Information Center). Human Papillomavirus and Related Cancers in the World. Summary Report 2010. http://www.who.int/hpvcentre/en/ (Accessed on September 19, 2011).
- Berrington de Gonzalez A, Green J, International Collaboration of Epidemiological Studies of Cervical Cancer. Comparison of risk factors for invasive squamous cell carcinoma and adenocarcinoma of the cervix: collaborative reanalysis of individual data on 8,097 women with squamous cell carcinoma and 1,374 women with adenocarcinoma from 12 epidemiological studies. Int J Cancer 2007; 120:885.
- Castellsague X, Bosch FX, Muñoz N, et al. Male circumcision, penile human papillomavirus infection, and cervical cancer in female partners. N Engl J Med 2002; 346:1105.
- Cervical Cancer Incidence, Mortality and prevalence worldwide in 2008: Summary. http://globocan.iarc.fr/factsheet.asp (Accessed on January 30, 2013).
- Manhart LE, Holmes KK, Koutsky LA, et al. Human papillomavirus infection among sexually active young women in the United States: Implications for developing a vaccination strategy. Sex Transm Dis 2006; 33:502.
- Centers for Disease Control and Prevention, Workowski KA, Berman SM. Sexually transmitted diseases treatment guidelines, 2006. MMWR Recomm Rep 2006; 55:1.
- Schiffman M, Castle PE, Jeronimo J, et al. Human papillomavirus and cervical cancer. Lancet 2007; 370:890.
- Eifel PJ, Burke TW, Morris M, Smith TL. Adenocarcinoma as an independent risk factor for disease recurrence in patients with stage IB cervical carcinoma. Gynecol Oncol 1995; 59:38.
- Sutton GP, Bundy BN, Delgado G, et al. Ovarian metastases in stage IB carcinoma of the cervix: a Gynecologic Oncology Group study. Am J Obstet Gynecol 1992; 166:50.
- Pilleron JP, Durand JC, Hamelin JP. Prognostic value of node metastasis in cancer of the uterine cervix. Am J Obstet Gynecol 1974; 119:458.
- Metcalf KS, Johnson N, Calvert S, Peel KR. Site specific lymph node metastasis in carcinoma of the cervix: Is there a sentinel node? Int J Gynecol Cancer 2000; 10:411.
- Levenback C, Coleman RL, Burke TW, et al. Lymphatic mapping and sentinel node identification in patients with cervix cancer undergoing radical hysterectomy and pelvic lymphadenectomy. J Clin Oncol 2002; 20:688.
- Bader AA, Winter R, Haas J, Tamussino KF. Where to look for the sentinel lymph node in cervical cancer. Am J Obstet Gynecol 2007; 197:678.e1.
- DiSaia PJ, Creasman WT. Invasive cervical cancer. In: Clinical Gynecologic Oncology, 7th ed., Mosby Elsevier, Philadelphia 2007. p.55.
- Partridge EE, Abu-Rustum NR, Campos SM, et al. Cervical cancer screening. J Natl Compr Canc Netw 2010; 8:1358.
- Berek JS. Berek JS, editor. Berek & Novak’s gynecology. 15th ed. Philadelphia : Lippincott Williams & Wilkins; 2012