Beyond Contraceptive Benefit
พญ.นพมาศ ถาธัญ
อ.ที่ปรึกษา อ.อินทิรา ศรีประเสริฐ
บทนำ
การคุมกำเนิดฮอร์โมน หมายถึง การคุมกำเนิดด้วยวิธีการทางระบบต่อมไร้ท่อ ซึ่งเกือบทุกวิธีจะประกอบด้วยฮอร์โมนสเตียรอยด์ชนิดต่าง ๆ ยาเม็ดคุมกำเนิด เป็นวิธีการคุมกำเนิดวิธีแรก ที่ได้รับการพัฒนาขึ้นมา และเริ่มมีการจำหน่ายตั้งแต่ปี 1960 และในช่วงหลายทศวรรษที่ผ่านมา ก็ได้มีการพัฒนารูปแบบวิธีการคุมกำเนิดชนิดอื่น ๆ ขึ้น และวิธีที่เป็นที่นิยมมากที่สุดได้แก่ยาเม็ดและยาฉีดคุมกำเนิด
นับตั้งแต่มีการค้นพบสารประกอบ ethinyl estradiol ในปี 1938 ที่ให้ฤทธิ์ของเอสโตรเจน และหลังจากนั้นก็มีการคิดค้นสารประกอบของเทสโทสเตอโรนที่ออกฤทธิ์ได้จริง (Ethisterone) ก็เริ่มมีการนำความรู้เหล่านี้ไปใช้ในด้านการคุมกำเนิดและพัฒนามาเรื่อย ๆ ปัจจุบันมีรูปแบบของยาคุมกำเนิดหลายรูปแบบ เมื่อให้สามารถปรับใช้ได้กับผู้หญิงทุกคน และยาคุมกำเนิดรุ่นใหม่ ๆ ก็มีการพัฒนา และพยายามลดขนาดของฮอร์โมนที่ใช้ เพื่อลดผลข้างเคียง และภาวะแทรกซ้อนทางระบบหัวใจและหลอดเลือด (1)
การคุมกำเนิดฮอร์โมน เป็นวิธีที่มีประสิทธิภาพสูง มีอัตราการตั้งครรภ์น้อยกว่า 1% และเมื่อใช้อย่างถูกวิธี พบอัตราการตั้งครรภ์เพียง 0.3% – 1% นอกจากนี้ปัจจุบันยังมีการประยุกต์ใช้ยาคุมกำเนิด ในการป้องกัน บรรเทาอาการ และรักษาโรคต่าง ๆ อีกมากมาย ซึ่งส่วนใหญ่เป็นโรคที่มีส่วนเกี่ยวข้องกับการทำงานของระบบต่อมไร้ท่อ
ยาคุมกำเนิดฮอร์โมน
ยาคุมกำเนิดฮอร์โมน โดยทั่วไปแบ่งเป็น 2 ประเภทคือ
1. ยาคุมชนิดฮอร์โมนรวม ประกอบด้วย Estrogen และ Progesterone
2. ยาคุมชนิดฮอร์โมนเดียว ประกอบด้วย Progesterone เพียงอย่างเดียว
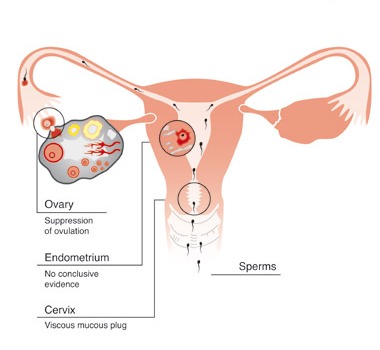
ซึ่งแต่ละชนิด ยังมีวิธีการบริหารยาในรูปแบบต่างๆ เพื่อให้สามารถนำไปปรับใช้ได้อย่างกว้างขวาง กลไลการทำงานของยาคุมกำเนิดฮอร์โมนมีซับซ้อน แต่ที่มีบทบาทสำคัญ คือ
– Estrogen ยับยั้งการหลั่ง Follicle stimulating hormone; FSH จาก hypothalamus ทำให้กดการเจริญของ follicles
– Estrogen ยับยั้งการเกิด LH-surge ในช่วงกลางรอบเดือน ทำให้ไม่เกิดการตกไข่ (ในยาคุมกำเนิดชนิดฮอร์โมนเดี่ยวจะไม่มีกลไกนี้)
ส่วนกลไลที่เกี่ยวกับฤทธิ์ของ Progesterone ได้แก่
– ทำให้เยื่อบุของผนังมดลูกหนาตัว ไม่เหมาะสมแต่การฝังตัวของตัวอ่อน
– ทำให้มุกปากมดลูกข้นมากขึ้น ทำให้อสุจิเคลื่อนที่ผ่านได้ยาก
– ทำให้การเคลื่อนตัวของท่อนำไข่ผิดปกติไป
นอกจากนี้ ยังมีกลไกอื่น ๆ เช่น การควบคุมรอบเดือน โดยทำให้เยื่อบุมดลูกมีความแข็งแรงเพียงพอ ไม่เกิดการหลุดลอกตัวง่าย
Points of intervention in hormonal contraception
รูปภาพจาก http://www.bayerpharma.com
รูปแบบของยาฮอร์โมนคุมกำเนิด
ยาฮอร์โมนคุมกำเนิดมีหลายรูปแบบ ทั้งชนิดเม็ด ชนิดยาฉีด ชนิดหลอดฝังใต้ผิวหนัง ชนิดแผ่นแปะ ชนิดห่วงคุมกำเนิด ในที่นี้จะขอแยกประเภท และยกตัวอย่างตามชนิดของยาคุมกำเนิด
ยาคุมกำเนิดชนิดฮอร์โมนรวม (Combine estrogen-progestin contraception)
1. ยาเม็ดคุมกำเนิด (Combined oral contraception pill; combined pill)
เป็นวิธีการคุมกำเนิดที่ได้รับความนิยมและใช้กันอย่างแพร่หลายมากที่สุด มีแบบ 21 เม็ด และ 28 เม็ด โดยในแบบ 28 เม็ด จะเป็นเม็ดที่มีฮอร์โมน 21เม็ด อีก 7 เม็ดเป็นเม็ดที่ไม่มีฮอร์โมน แบ่งเป็น 3 ชนิด คือ
1.1 Monophasic combined pill ประกอบด้วย estrogen และ progestogen ในขนาดคงที่ทุกเม็ด โดยมีอยู่ 21 เม็ด ส่วนยาคุมชนิด 28 เม็ด อีก 7 เม็ดจะเป็นวิตามิน แป้ง หรือ ferrous fumarate
1.2 Biphasic combined pill เป็นยาเม็ดคุมกำเนิดที่ประกอบด้วย estrogen และ progestrogen ในปริมาณที่ต่างกัน 2 ระดับ ในแต่ละช่วงของรอบเดือน เพื่อเลียนแบบการหลั่งของฮอร์โมนตามธรรมชาติ คือ
– estrogen จะมีระดับสูงช่วงต้นเดือนและลดต่ำลงช่วงปลายเดือน
– progestogen จะมีระดับต่ำช่วงต้นเดือน และ จะสูงขึ้นช่วงปลายเดือน
1.3 Triphasic combined pill เป็น combined pill ที่ผลิตขึ้นเพื่อเลียนแบบฮอร์โมน estrogen และ progestogen ในอัตราส่วนซึ่งคล้ายกับธรรมชาติของฮอร์โมนในรอบเดือนปกติของสตรี คือ
– estrogen จะมีระดับต่ำในช่วงต้นและปลายรอบเดือน จะสูงช่วงกลางรอบเดือน
– progestogen จะมีระดับต่ำในช่วงต้นรอบเดือนและจะสูงสุดในช่วงปลายรอบเดือน
นอกจากนี้ ยังสามารถประยุกต์ใช้เป็นยาคุมกำเนิดฉุกเฉินได้อีกด้วย ตัวอย่างยาคุมกำเนิดในกลุ่มนี้ ได้แก่ Anamai, Anna, Diane-35, Eugynon250, Margaret, Marvelon28, Meliane, Mercilon, MicrogestED, Microgynon30 ED, Minulet, Nordette, Preme, Sucee, Gynera
2. ยาคุมกำเนิดชนิดแผ่นแปะ (Transdermal patch)
โดยใช้แปะผิวหนังบริเวณหน้าท้อง ไหล่ สัปดาห์ละ 1 แผ่น ติดต่อกัน 3 สัปดาห์ จากนั้นเว้นช่วงไป 1 สัปดาห์ ได้แก่ Ortho Evra (EE 20 mcg, Norelgestromin 150 mcg)

รูปภาพจาก buydrugswithoutaprescription.com
3. ยาคุมกำเนิดชนิดสอดในช่องคลอด (Intravaginal ring)
ใช้สอดไว้ในช่องคลอด 3 สัปดาห์ แล้วจึงถอดออก เว้นระยะ 1 สัปดาห์ ก่อนใส่อันใหม่ ได้แก่ NuvaRing (EE 15 mcg, etonogestrel 120 mcg)

รูปภาพจาก mastersoftrivia.com
4. ยาคุมกำเนิดชนิดฉีด (Combined contraceptive inection)
ฉีดเดือนละ 1 ครั้ง ได้แก่ Lunelle (Estradiol cypionate, medoxyprogesterone)
รูปภาพจาก contraception.about.com
ยาคุมกำเนิดชนิดฮอร์โมนเดี่ยว (Progestin-only contraception)
1. ยาเม็ดคุมกำเนิด (Minipill)
ประกอบด้วย Progentogen เพียงอย่างเดียว ในปริมาณต่ำ มักมีปัญหาเลือดออกกะปริบกะปรอยได้บ่อย นิยมใช้ในช่วงให้นมบุตรเท่านั้น ตัวอย่างเช่น Exluton
2. ห่วงคุมกำเนิดที่มีฮอร์โมน Progestin (Levonorgestrel-releasing IUD; LNG IUC)
ให้ปริมาณฮอร์โมนเพียงครึ่งเดียวของยาคุมกำเนิดชนิดหลอดฝัง จึงลดผลข้างเคียงที่มักจะเกิดขึ้น แต่อาจไม่สามารถยับยั้งการเจริญของ follicle และกระบวนการตกไข่ได้เต็มที่, ใช้ได้ 5 ปี ได้แก่ Mirena
3. ยาฉีดคุมกำเนิด เช่น Depotmedroxyprogesterone acetate; DMPA (DepoProvera), Noristerat
4. ยาคุมกำเนิดชนิดฝัง (Implantation)
ให้ประสิทธิภาพในการคุมกำเนิดค่อนข้างสูง แต่มีผลกดการเจริญของรังไข่และฮอร์โมนน้อย เนื่องจากค่อย ๆ ปล่อยฮอร์โมนออกมาอย่างต่อเนื่องในขนาดต่ำ จึงมีผลข้างเคียงน้อย กลับเข้าสู่ภาวะเจริญพันธุ์หลังหยุดยาได้เร็ว ได้แก่ Norplant, Jadelle, Implanon
อาการไม่พึงประสงค์ของยาฮอร์โมนคุมกำเนิด
– ผลจาก Estrogen สูง ได้แก่ คลื่นไส้อาเจียน, เวียนศรีษะ, ปวดศรีษะไมเกรน, ประจำเดือนมามากกว่าปกติ, ปวดประจำเดือนมาก, เต้านมโต, คัดตึงเต้านม, มดลูกโต และเส้นเลือดอุดตัน
– ผลจาก Estrogen ต่ำ ได้แก่ ประจำเดือนมาน้อยกว่าปกติ, เต้านมเล็กลง, มดลูกเล็กลง, มีเลือดออกกะปริบกะปรอย โดยเฉพาะในช่วงต้นและกลางรอบเดือน
– ผลของ Progesterone สุง ได้แก่ น้ำหนักเพิ่ม, เป็นสิว, หน้ามัน, ขนดก, เต้านมเล็กลง, ประจำเดือนมาน้อย, ตกขาวจากการติดเชื้อราในช่องคลอด
– ผลอของ Progesterone ต่ำ ได้แก่ เลือดออกกะปริบกะปรอย โดยเฉพาะในช่องหลังของรอบเดือน
ข้อห้ามใช้ยาฮอร์โมนคุมกำเนิด (Contraindication)
Absolute contraindication
1. ห้ามใช้ในผู้ป่วยที่เป็น หรือมีประวัติลิ่มเลือดอุดตัน (Thrombophlebitis, Thromboembolic phenomena) หรือมีอุบัติการณ์ของโรคหลอดเลือดสมองอุตตัน (Stroke)
2. มีประวัติเป็นมะเร็ง หรือคาดว่าจะเป็นมะเร็งเต้านม หรือเนื้องอกที่สัมพันธ์กับฮอร์โมนเอสโตรเจนอื่น ๆ
3. มีโรคของตับที่กำลังกำเริบอยู่ (2)
4. ตั้งครรภ์ (3) รวมถึงวัยรุ่นที่เริ่มมีประจำเดือน ซึ่ง epiphyseal plate ยังไม่ปิดสมบูรณ์
5. ผู้ป่วยที่มีเลือดพออกจากช่องคลอด โดยไม่ทราบสาเหตุ
6. ผู้ป่วยที่มีไขมันในเลือดสูง
7. ผู้หญิงอายุ >35 ปีที่สูบบุหรี่จัด (> 15 มวน/วัน)
นอกจากนี้ ยังมีข้อควรระวังในการใช้ในกลุ่มผู้หญิงที่เป็นโรคความดันโลหิตสูง ที่ยังควบคุมอาการได้ไม่ดี และผู้หญิงอายุ > 35 ปีที่เป็นโรคไมเกรน หรือในผู้ป่วยโรคไมเกรนที่มีอาการนำทุกกลุ่มอายุ (2006 World Health Organization) เนื่องจากกอาจทำให้อาการกำเริบ และเพิ่มโอกาสเสี่ยงต่อภาวะแทรกซ้อนทางหัวใจและหลอดเลือดได้
นอกจากนี้ยาฮอร์โมนคุมกำเนิดยังสามารถใช้ได้ในผู้ป่วยโรคเบาหวาน แต่อาจจะต้องเพิ่มปริมาณอินซูลินที่ใช้ด้วย
การใช้ยาฮอร์โมนคุมกำเนิดเพื่อประโยชน์ด้านอื่น ๆ (4)
นอกจากประโยชน์ในด้านการควบคุมรอบเดือน และการคุมกำเนิดที่มีประสิทธิภาพสูงแล้ว ยาฮอร์โมนคุมกำเนิด ยังสามารถนำมาใช้ประโยชน์ในด้านการรักษาอื่น ๆ ได้อีก เช่น
1. ความผิดปกติเกี่ยวกับการมีประจำเดือน
– อาการมีประจำเดือนมามาก (Menorrhagia)
– อาการปวดประจำเดือน (Dysmenorrhea)
– กลุ่มอาการก่อนมีประจำเดือน (Premenstrual syndrome; PMS and Premenstrual dysphoric disorder; PMDD)
– การป้องกันโรคไมเกรนที่สัมพันธ์กับประจำเดือน (Menstrual Migraine)
2. ภาวะฮอร์โมนเพศชายสูง (Hyperandrogenism)
– สิว (Acne)
– ภาวะขนดก (Hirsutism)
3. โรคทางนรีเวชวิทยา (Gynecologic disorder)
– เนื้องอกกล้ามเนื้อมดลูก (Leiomyoma)
– อาการปวดท้องน้อยที่สัมพันธ์กับภาวะเนื้อเยื่อบุโพรงมดลูกเจริญผิดที่ (Endometriosis)
4. ลดปัจจัยเสี่ยงต่อการเกิดมะเร็งบางชนิด (Cancer risk reduction) เช่น มะเร็งเยื่อบุโพรงมดลูก, มะเร็งรังไข่, มะเร็งลำไส้
ภาวะประจำเดือนมามาก (Menorrhagia)
การมีประจำเดือน คือ การมีเลือดออกจากมดลูก ภายหลังการตกไข่ ซึ่งในความเป็นจริง ผู้หญิงในยุคปัจจุบันมีรอบประจำเดือนที่มากเกินไปในช่วงชีวิตของแต่ละคน ทั้งนี้เกิดจากการมีประจำเดือนเร็วขึ้น การตั้งครรภ์ลดลง การลดระยะเวลาการให้นมบุตร และการหมดประจำเดือนช้า (5), ซึ่งความถี่ของการมีประจำเดือนนี้ เพิ่มโอกาสเสี่ยงต่อการเกิดโรคบางอย่าง เช่น มะเร็งรังไข่, ซีดจากการเสียเลือดมากเรื้อรัง ซึ่งพบว่าประมาณ 10% ของผู้หญิงที่มีเลือดประจำเดือนออกมากกว่า 60 – 80 ml/รอบเดือนอาจเกิดภาวะโลหิตจางจากการขาดธาตุเหล็ก ได้
ยาฮอร์โมนคุมกำเนิดหลายชนิด สามารถนำมาใช้ประโยชน์ในการช่วยลดปริมาณเลือดประจำเดือน ซึ่งจากศึกษาพบว่าสามารถช่วยบรรเทาอาการได้ถึง 40-50% ในผู้ป่วยที่ใช้ยาคุมกำเนิดเป็นประจำ และเนื่องจากเหตุผลด้านความปลอดภัยและความคุ้มค่า การใช้ยาฮอร์โมนคุมกำเนิด จึงมักถูกนำมาเป็นวิธีการรักษาอาการเริ่มต้น ในผู้ที่มีปัญหาจากการมีประจำเดือนออกมาก รวมถึงในผู้ที่ต้องการความสะดวกสบายของการเลื่อนประจำเดือน เช่น ผู้ที่ต้องเดินทาง หรือมีธุระในช่วงที่จะมีประจำเดือน (8)
ทางเลือกในการรักษา
1. Estrogen-Progestin Regimen
Cyclic contraception pills เป็นทางเลือกแรกในการรักษาถ้าต้องการลดปริมาณเลือดประจำเดือน โดยที่ผู้ป่วยไม่มีข้อห้ามในการเอสโตรเจน นอกจากนี้ยังพบว่าการย่นระยะช่วงที่ไม่ได้รับฮอร์โมนให้สั้นลง หรือให้เอสโตรเจนทดแทนในช่วงดังกล่าว จะช่วยทำให้การกดการทำงานของรังไข่ดีขึ้น ซึ่งช่วยลดการเกิดอาการที่เกิดจากการขาดฮอร์โมนและลดอาการการตั้งครรภ์ได้มากขึ้น
การยืดระยะเวลาการใช้เม็ดยาคุมกำเนิดที่มีฮอร์โมนออกไปหลาย ๆ รอบ สามารถช่วยลดความถี่ของการที่ผู้ป่วยจะต้องประสบกับอาการไม่พึงประสงค์ต่าง ๆ และลดปริมาณเลือดที่ต้องเสียไปได้ จึงได้มีการจัดทำยาเม็ดคุมกำเนิดที่มีจำนวนเม็ดยาออกฤทธิ์นา นขึ้น เช่น Seasonale (84/7), Lybrel (365) เพื่อเป็นทางเลือกให้เลือกใช้ได้ตามความต้องการ โดยที่ประสิทธิภาพในการคุมกำเนิดของการบริหารยาแบบต่าง ๆ ไม่ได้ลดลง (6,7)
2. Progestin contraception
ในช่วงแรกของการใช้ มักพบว่ามีปัญหาเลือดออกกะปริบกะปรอยได้ แต่ภายหลังจะทำให้ไม่มีประจำเดือนได้ถึง 40%
Levonorgestrel intrauterine contraception; LNG IUC ช่วยลดปริมาณเลือดที่ออกได้ถึง 86% ในช่วง 3 เดือนแรก และถ้าใช้ครบ 1 ปี จะลดได้ถึง 97% เหมาะกับผู้ที่มีปัญหาด้านการแข็งตัวของเลือดและมีข้อห้ามใช้เอสโตรเจน
Depot-medroxyprogesterone acetate injection ลดปริมาณเลือดประจำเดือนได้ 50-75% ของผู้ใช้ยามาประมาณ 1 ปี เป็นตัวเลือกที่ดีในผู้ที่มีข้อห้ามใช้ยาคุมกำเนิดชนิดฮอร์โมนรวมและไม่สามารถใส่ห่วงคุมกำเนิดได้ รวมถึงผู้ที่มีปัญหาด้านสุขภาพอื่น ๆ
Progestin implant มีประสิทธิภาพในการยับยั้งประจำเดือนน้อยกว่าวิธีอื่น พบว่ามักมีปัญหาเลือดออกกระปริบกระปรอยในช่วง 3 เดือนแรก หลังจากนั้นจะไม่มีประจำเดือนประมาณ 40%
จากการศึกษาของ Cochrane และ Markov พบว่าการใส่ห่วงคุมกำเนิดมีประสิทธิภาพและความคุ้มค่ากว่ายาเม็ดฮอร์โมนคุมกำเนิดในการรักษาภาวะเลือดประจำเดือนมามาก และผู้ป่วยส่วนใหญ่มีความพึงพอใจในการที่จะใช้รักษาต่อมากกว่า อย่างไรก็หากผู้ป่วยไม่ตอบสนองต่อการรักษาด้วยยาคุมกำเนิดฮอร์โมน ก็ควรได้รับการรักษาด้วยการผ่าตัดต่อไป
Dysmenorrhea
Dysmenorrheal คืออาการปวดบีบท้องน้อยซึ่งเกิดขึ้นขณะมีประจำเดือนซ้ำๆ มักเป็นปัญหาเกี่ยวกับประจำเดือนที่พบได้บ่อยที่สุด เกือบ 90% ของผู้หญิงวัยรุ่น แบ่งเป็น 4 ระดับ โดยอาศัยความรุนแรงของอาการเจ็บ และการขัดขวางการใช้ชีวิตประจำวัน เพื่อนำมาประกอบในการตัดสินใจให้การรักษา
|
Grade
|
Working ability
|
Systemic symptoms
|
Analgesics
|
|
Grade 0: Menstruation isn’t pailful & daily activity is unaffected
|
Unaffected
|
None
|
None required
|
|
Grade 1: Menstruation is painful but seldom inhibit normal activity: analgesics are seldom required: Mild pain
|
Rarely affected
|
None
|
Rarely required
|
|
Grade 2: Daily activity is affected: analgesics required and give sufficient relief so that absence from school is unusual: Moderate pain
|
Moderately affected
|
Few
|
Few required
|
|
Grade 3: Activity clearly inhibited; poor effect of analgesics; vegetative symptoms (headache, fatigue, vomiting, and diarrhea); severe pain
|
Clearly inhibited
|
Apparent
|
Perfect
|
Adapted from Andersch, B, Milsom, I, Am J Obstet Gynecol 1982; 144:655
กลไลการเกิด Dysmenorrhea
เมื่อเริ่มมีการลอกตัวของเยื่อบุโพรงมดลูก จะกระตุ้นให้เกิดการหลั่ง prostaglandins ซึ่งส่งผลให้เกิดการหดรัดตัวของมดลูกอย่างไม่เป็นจังหวะ ไม่สัมพันธ์กัน ทำให้แรงตึงตัวของมดลูกเพิ่มมากขึ้น เพิ่มแรงดันในโพลงมดลูก ซึ่งถ้าหากแรงดันในโพรงมดลูกสูงกว่าแรงดันในหลอดเลือดแดง ก็จะทำให้เกิดภาวะมดลูกขาดเลือดไปเลี้ยง ซึ่งกระตุ้นให้เกิดการเมตาบอลิซึ่มแบบไม่ใช้อากาศ กระตุ้นการส่งกระแสประสาทส่งผ่านความเจ็บปวดขึ้นสู่สมอง
การรักษา
ยาฮอร์โมนคุมกำเนิดช่วยลดการสร้าง prostaglandins ของมดลูก ซึ่งสามารถช่วยลดอาการปวดประจำเดือนได้มากถึง 70-80%
ประกอบด้วยวิธีการใช้ยา และไม่ใช้ยาหลากหลายวิธี ได้แก่
1. Non-pharmacological intervention
1.1 Heat พบว่าการประคบร้อนบริเวณท้องน้อย ให้ผลดีพอ ๆ กับการใช้ยาแก้ปวด (9, 10)
1.2 Dietary, vitamin, Herbal treatment มีการรักษาด้วยการควบคุมอาหารและวิตามินหลายชนิดที่พบว่าอาจช่วยในการลดความรุนแรงของการปวดประจำเดือน แต่ข้อมูลเกี่ยวกับการรักษาเหล่านี้ยังเป็นเพียงการศึกษาในกลุ่มเล็ก ๆ และมีข้อมูลไม่เพียงพอ จึงยังไม่แนะนำให้นำมาใช้ในการรักษาในชณะนี้ (12 – 17)
1.3 Exercise มีการศึกษาพบว่าการออกกำลังกายสามารถช่วยลดอาการปวดประจำเดือนได้ (18-20)
2. Behavior intervention
2.1 การปรับเปลี่ยนแนวคิดเกี่ยวกับอาการเจ็บปวด (Modified of the way thinks about pain) เ
– Desensitization based procedures
– Hypnotherapy
– Imagery
– Coping strategies
2.2 การปรับเปลี่ยนการตอบสนองต่อความเจ็บปวด (Attempts at modification of her response to pain)
– Biofeedback
– Electromyographic training
– Lamaze exercises
– Relaxation training
วิธีการเหล่านี้ ยังไม่มีหลักฐานแน่ชัดรองรับว่าได้ผลดีหรือไม่ จากการรายงานที่ผ่านมา พบว่าผู้หญิงบางคนได้ประโยชน์จากการรักษาเหล่านี้ (21)
3. Pharmacologic intervention
เป็นการรักษาที่มีหลักฐานรองรับมากที่สุดว่ามาช่วยลดอาการปวดได้จริง โดยยาที่ใช้เป็นหลักในการรักษาคือกลุ่ม NSAID และยาคุมกำเนิดฮอร์โมน โดยหากใช้เพียงกลุ่มเดียวแล้วยังไม่สามารถลดอาการได้ อาจใช้ร่วมกันได้ แต่หากใช้ร่วมกันแล้วยังไม่ได้ผล ค่อยใช้ยาในกลุ่มอื่นร่วมด้วย เช่น Tocolytic drug, Nifedipine, Magnesium และพิจารณาหาสาเหตุอื่น ๆ ที่เป็นไปได้
ยาฮอร์โมนคุมกำเนิดที่นำมาใช้ในการรักษาเป็นกลุ่มแรกคือ ยาคุมกำเนิดฮอร์โมนรวม โดยพบว่ายาเม็ดคุมกำเนิดฮอร์โมนรวมสามารถใช้ลดอาการได้อย่างมีประสิทธิภาพ โดยที่ปริมาณฮอร์โมนที่ต่างกันกันในแต่ละชนิด ไม่ได้มีผลต่อประสิทธิภาพในการลดอาการปวดประจำเดือน (22), ยาคุมกำเนิดแบบสอดช่องคลอดให้ประสิทธิภาพพอ ๆ กัน (23) ส่วนยาคุมกำเนิดแบบแผ่นแปะมีประสิทธิภาพน้อยกว่ายาเม็ดคุมกำเนิด (24)
ยาคุมกำเนิดแบบฮอร์โมนเดี่ยวก็พบว่าให้ประสิทธิภาพในการรักษาภาวะปวดประจำเดือนได้เช่นกัน แต่ยังมีการศึกษารองรับน้อย และมักพบปัญหาเลือดออกกะปริบกะปรอยได้มากว่า จึงยังไม่เป็นที่นิยม ยาคุมกำเนิดแบบฉีดเข้ากล้ามเนื้อ (DMPA) พบว่ามีประสิทธิภาพดี จึงเป็นทางเลือกหนึ่งในการรักษา โดยเฉพาะผู้ที่ยังไม่ต้องการมีบุตร (25), ยังไม่มีการศึกษาเกี่ยวกับประสิทธิภาพของยาคุมกำเนิดแบบห่วง (LNG-IUS) ต่ออาการปวดประจำเดือน แต่จากประสิทธิภาพในการลดประจำเดือนของตัวยาชนิดนี้ ร่วมกับประสบการณ์ในการใช้ ที่พบว่าสามารถช่วยลดอาการปวดประจำเดือนและลดปริมาณเลือดประจำเดือน (26) จึงยังต้องมีการเฝ้าสังเกตกันต่อไป ส่วนประสิทธิภาพของยาคุมกำเนิดแบบหลอดฝัง (Implant) แม้จะยังไม่มีการศึกษาวิจัยมารองรับ แต่จากการติดตามอาการของคนทึ่เข้ารับการรักษาด้วยการฝังยาคุม พบว่าอาการปวดประจำเดือนโดยรวมดีขึ้นร่วมด้วย (27 – 28)
4. Complementary or alternative medicine เช่น การฝังเข็ม โยคะ แม้จะมีการวิจัยที่พบว่าให้ประสิทธิภาพในการรักษาดี แต่เป็นเพียงการศึกษาเพียงขนาดเล็ก มีข้อมูลค่อนข้างน้อย และรูปแบบการเก็บข้อมูลยังไม่ครบถ้วน (29)
Premenstrual syndrome; PMS & Premenstrual dysphoric disorder; PMDD
Premenstrual syndrome; PMS คือ การมีอาการทางร่างกาย และหรืออาการทางพฤติกรรมที่เกิดขึ้นแบบซ้ำ ๆ ในช่วงครึ่งหลังของรอบประจำเดือน ไปจนถึงช่วง 1-2 วันแรกของการมีประจำเดือน ซึ่งมีผลกระทบต่อการใช้ชีวิตประจำวัน เช่น ความสัมพันธ์ในครอบครัว และสังคม การทำงานนอกบ้าน เป็นต้น อาการทางร่างกายที่พบได้บ่อยที่สุดคือ อาการอืดบวม (90%), อาการคัดตึงเต้มนมและปวดศึกษะ (50%) เป็นต้น
Premenstrual dysphoric disorder; PMDD / Late luteal phase dysphoric disorder เป็นรูปแบบที่รุนแรงมากขึ้นของ PMS โดยมักจะมีอย่างน้อย 1 อาการที่มีผลกระทบต่อชีวิตประจำวันเช่น โมโหหรือฉุนเฉียวง่าย ร่วมกับมีความกดดันภายในสูง
กลุ่มอาการก่อนมีประจำเดือนเหล่านี้ มักพบได้บ่อยมากกว่า 75% ของผู้หญิงที่มีประจำเดือนสม่ำเสมอ อย่างไรก็ตาม อาการที่แสดงให้เห็นถึง PMS พบได้เพียง 20%-30% ของผู้หญิง (29, 30) และ PMDD ก็เป็นกลุ่มย่อยที่เล็กลงไปอีก
ตัวอย่างยาที่ใช้ในการรักษา
|
Treatments with demonstrated efficacy
|
Treatments with possible efficaty
|
Ineffective treatments
|
|
Serotonin reuptake inhibitors
Alprazolam
Agents that suppress ovulation
– GnRH agonists
– Danazol
|
Oral contraceptives
Diretics
Exercise
|
Progesterone
Vitamin supplements
Dietary restrictions
|
จะเห็นว่ายาคุมกำเนิดฮอร์โมนที่สามารถใช้รักษาอาการเหล่านี้ได้ มีเพียงบางกลุ่มเท่านั้น และส่วนใหญ่ยังไม่มีหลักฐานชัดเจนว่าสามารถใช้รักษาได้ผลจริง โดยในช่วงแรกของการใช้ยา พบว่ามีความแตกต่างเพียงเล็กน้อยเท่านั้นในกลุ่มผู้ป่วยที่ได้รับการรักษาด้วยยาเม็ดคุมกำเนิด แต่มามีการศึกษาเพิ่มเติมแบบ RCT ที่แสดงให้เห็นว่าการใช้ยาเม็ดคุมกำเนิดฮอร์โมนรวมสูตร 24/4 ซึ่งประกอบด้วย Ethinyl estradiol 30 mcg และ Drespirenone และยาคุมกำเนิดแบบห่วงสอดทางช่องคลอด ช่วยลดอาการเหล่านี้ได้ ซึ่งการศึกษานี้ได้นำมาเผยแพร่เพื่อสนับสนุนการใช้ยาเพื่อช่วยลดอาการทั้งทางร่างกายและจิตใจของผู้ป่วย PMD และผู้ป่วยที่มีภาวะซึมเศร้า ทำให้คุณภาพชีวิตดีขึ้น (31 – 34)
Menstrual migraine
Estrogen-associated migraine คือ อาการปวดศรีษะไมเกรนที่เกิดขึ้นระหว่างที่มีการลดลงของระดับ estrogen หลังจากทีมีระดับฮอร์โมน estrogen ที่สูงอยู่หลายวัน (Estrogen priming) ซึ่งพบได้ในสภาวะ เช่น
– การลดลงโดยธรรมชาติของ estrogen ในร่างกาย เช่น ในช่วงเริ่มต้นของรอบประจำเดือน วัยหมดระดู
– การขาด estrogen จากภายในนอกเป็นช่วง ๆ เช่น ตามรอบยาคุมกำเนิด การหยุดใช้ estrogen therapy
– การขาด estrogen โดยไม่ได้ตั้งใจ เช่น การลืมกินยาที่มีส่วนประกอบของ estrogen, การกินยาที่มีปฏิกิริยาระหว่างกัน ทำให้ฤทธิ์ของ estrogen ลดลง (35, 36)
โดยการลดลงของความเข้มข้นของ estrogen เป็นปัจจัยสำคัญในการกระตุ้นให้เกิดไมเกรนในผู้หญิง (37) เนื่องจาก estrogen มีความสำคัญต่อกลไกหลายอย่างในระบบประสาทส่วนกลางซึ่งมีความสัมพันธ์กับไมเกรน ผลที่เห็นได้ชัดคือการกระตุ้นระบบการสร้าง serotonin และ glutamic acid, เมื่อ estrogen ลดลง การสร้าง serotonin มักจะลดลง ร่วมกับมีอัตราการทำลายเพิ่มขึ้น ทำให้ความเข้มข้นของ serotonin ลดลง เกิดการปล่อย calcitonic gene-related peptide และ substance P จาก Trigerminal nerve และนำไปสู่ vasodilation ของ cranial vessels และกระตุ้นการรับสัมผัสของ meningeal afferents ของ trigeminal nerve (38) นอกจากนี้ ยังอาจมีผลต่อการเปลี่ยนแผลงของการรับความเจ็บปวดในสมองร่วมด้วย
ในวัยเด็ก ไมเกรนพบได้ 2.5 – 4% ซึ่งมักจะพบในเด็กชายมากกว่า แต่เมื่อเข้าช่วงเริ่มวัยรุ่น จะเริ่มพบในเด็กหญิงมากกว่าเด็กชาย การเปลี่ยนแปลงนี้มักถูกอธิบายว่าเกิดจากการขึ้นลงของฮอร์โมนซึ่งเกี่ยวกับการเปลี่ยนแปลงเข้าสู่วัยหนุ่มสาว ซึ่งมักมีรูปแบบของฮอร์โมนที่เป็นเอกลักษณ์ในช่วงตกไข่ของผู้หญิง ทฤษฎีนี้ถูกสนับสนุนด้วยการวิจัยที่พบว่า 25% ของเด็กหญิงอายุ 9 – 12 ปี มีรูปแบบการปวดศรีษะเป็นรายเดือน และลดลงเหลือเพียง 13% เมื่อเข้าสู่วัยเริ่มมีประจำเดือน และจะกลับมาพบได้บ่อยขึ้นในช่วง perimenopause โดยเฉพาะในช่วงวันแรกของการมีประจำเดือน ซึ่งมีการเปลี่ยนแปลงอย่างมากของระดับ estrogen แต่ในช่วง postmenopause อุบัติการณ์ของไมเกรนจะลดลงเกือบครึ่ง ซึ่งคิดว่าแป็นผลมาจากการคงที่ของระดับฮอร์โมนในร่างกาย
นอกจากนี้ ไมเกรนยังเป็นภาวะที่ไม่พึงประสงค์ที่พบได้บ่อยทึ่สุดในช่วงวัยเจริญพันธ์ของผู้หญิง ประมาณ 60% ของผู้หญิงที่เป็นไมเกรน มักมีอาการกำเริบสัมพันธ์กับการมีประจำเดือน โดยมักมีอาการช่วง 2-3 วันก่อนมีประจำเดือน และยาวต่อเนื่องไปจนถึงประมาณ 2/3 ของระยะเวลามีประจำเดือน และส่วนใหญ่จะเป็นอาการปวดศรีษะไมเกรนแบบไม่มี aura
การรักษา menstrual migraine ในระยะเริ่มแรกเป็นเช่นเดียวกับการรักษาไมเกรนอื่น ๆ คือ การให้ Rapid-onset Triptane หรือ ยากลุ่ม NSAID ตั้งแต่ช่วงแรกที่มีอาการปวดเล็กน้อย ถ้าการรักษาเหล่านี้ยังไม่เพียงพอหรือไม่มีประสิทธิภาพ ก็มีข้อบ่งชี้ในการให้การรักษาด้วยฮอร์โมนเพื่อป้องกัน (Hormonal-based prophylaxis) โดยสูตรยาที่เลือกใช้ มีดังนี้
1. Extended-cycle estrogen-progestin contraception
2. Cyclic estrogen-progestin contraception ร่วมกับ supplemental estrogen
3. Natural cycles ร่วมกับ Targeted supplemental estrogen
Hormonal-based prophylaxis เป็นทางเลือกที่มีประสิทธิภาพสำหรับผู้หญิงที่ต้องการคุมกำเนิด ผู้หญิงที่มี menstrual migraine ซึ่งไม่ตอบสนองต่อการรักษาแบบ non-specific และผู้หญิงที่มีภาวะอื่น ๆ ที่เป็นอันตรายร่วมด้วย เช่น Endometriosis, menorrhagia, dysmenorrhea เช่นเดียวกับผู้หญิงที่มีรอบเดือนไม่สม่ำเสมอ โดยมีเป้าหมายคือ การจำกัดหรือพยายามลดการเปลี่ยนแปลงของ estrogen ในช่วงก่อนมีประจำเดือน ซึ่งเป็นตัวกระตุ้น menstrual migraine ให้น้อยที่สุด
อย่างไรก็ตาม การใช้ estrogen-progestin contraception ควรใช้อย่าวระมัดระวังในรายที่มีไมเกรนแบบมี aura เนื่องจากพบว่าอาจเพิ่มโอกาสเสี่ยงต่อการเกิดโรคหลอดเลือดสมอง (39, 40) โดยพบว่ามีความสัมพันธ์กันอย่างชัดเจนระหว่างการใช้ยาคุมกำเนิดที่มี estrogen-progestin กับการเกิดโรคหลอดเลือดสมอง ในกลุ่มผู้หญิงอายุมากกว่า 35 ปีที่สูบบุหรี่
ดังนั้น หากเป็นผู้หญิงที่มีข้อห้ามใช้ estrogen หรือมีอาการปวดศรีษะไมเกรนแบบมี aura หรือมีอาการของ focal neurological ร่วมด้วย, อายุมากกว่า 35 ปี หรือสูบบุหรี่ ควรพิจารณาใช้ progestin-only, intrauterine or barrier contraception แทน หรือใช้การป้องกันแบบไม่ใช้ฮอร์โมน ซึ่งสนับสนุนให้ใช้ long-acting triptan วันละ 2 ครั้ง
Hyperandrogenism
สิว (Acne)
Androgen มีบทบาทสำคัญในการเกิดสิว การเพิ่มขึ้นของระดับ serum androgen ตามธรรมชาติ เป็นจุดเริ่มต้นของ prepubertal period ซึ่งสัมพันธ์กับการเริ่มมีการสร้าง sebum มากขึ้นของผิวหนัง ต่อม sebaceous มีความไวต่อการกระตุ้นมากขึ้น จึงเพิ่มโอกาสต่อการเกิดสิว (41) เนื่องจาก androgen จะกระตุ้นการสร้างและสะสม sebum และ keratinous material ใน pilosebaceous follicle เกิดเป็นหัวสิว, sebum เป็นอาหารสำคัญของเชื้อแบคทีเรียน Propionibacterium acnes ซึ่งเจริญใน pilosebaceous follicle ทำให้เกิดปฏิกิริยาการอักเสบเกิดขึ้นบริเวณหัวสิว และผู้ป่วยที่มีภาวะ hyperaldrogenism เช่น PCOS, congenital adrenal hyperplasia, adrenal tumor, androgen-secreting ovarian tumors ก็มีแนวโน้มในการเปิดปัญหาสิวได้มากกว่าคนทั่วไป
ในผู้ป่วยที่มีสิวปานกลางถึงมาก ที่ไม่ตอบสนองต่อการรักษาแบบอื่น ๆ ทั้งที่มีและไม่มีภาวะ hyperandrogenism การรักษาด้วยฮอร์โมนร่วมกับการรักษาแบบอื่น ๆ นับว่ามีประสิทธิภาพดี โดยฮอร์โมนที่ให้จะไปยับยั้งบทบาทของ androgen ที่มีต่อ pilocebaceous follicle, กดการสร้าง androgen จากรังไข่ และลดระดับ biological available circulating androgen ทำให้ช่วยลดทั้งปริมาณสิว และลดปฏิกิริยาการอักเสบของสิวได้ด้วย โดยต้องใช้ระยะเวลารักษาอย่างน้อย 3-6 เดือน จึงจะประเมินประสิทธิภาพในการรักษาได้
ภาวะขนดก (Hirsutism)
ภาวะขนดก (Hirsutism) คือภาวะที่มีการเจริญของขนในรูปแบบของผู้ชายมากกว่าปกติ พบได้ประมาณ 5-10% ของผู้หญิงวัยเจริญพันธุ์ บางรายอาการอาจเป็นน้อยและต้องการเพียงการให้ความมั่นใจและการรักษาด้านความสวยงาม ในขณะที่บางกลุ่มอาจเป็นส าเหตุสำคัญของความเครียดและต้องการการรักษาเพิ่มเติม โดยในการพิจารณาทางเลือกของการรักษา สิ่งที่ควรพิจารณาคือ ความรุนแรงของโรค, ความผิดปกติอื่น ๆ ที่พบร่วมด้วย เช่น PCOS, ความคาดหวังและเป้าหมายของผู้ป่วย
ในผู้ป่วยที่มีภาวะขนดก และต้องการรักษาด้วยยา มีการแนะนำให้ใช้ estrogen-progestin contraceptives ในการเริ่มการรักษา ซึ่งพบว่า 60 – 100% ได้ผลดี มีการงอกของขนลดลงอย่างชัดเจน (47) โดยจะเห็นผลเมื่อรักษาไปได้ประมาณ 6 เดือน แต่หากหลัง 6 เดือนพบว่าการตอบสนองต่อการรักษายังไม่ได้ผลดีเท่าที่ควร แนะนำให้เปลี่ยนขนาดยา หรือเปลี่ยนตัวยา หรือเพิ่มยาตัวอื่น ๆ เข้าไปเพิ่มเติม และควรรักษาต่อเนื่องไปเรื่อย ๆ ในช่วงวัยเจริญพันธุ์ ในกรณีที่สาเหตุยังคงอยู่ตลอดในช่วงนี้ และภาวะขนดกอาจกลับมาเป็นซ้ำเมื่อหยุดยาลง
ฮอร์โมนที่ใช้ในการรักษา
Combined oral contraception ทุกชนิดมีประสิทธิภาพดีในการรักษาภาวะสิวและขนดก โดย estrogen ที่อยู่ในยาคุมกำเนิด จะกดการสร้าง androgen จากรังไข่ผ่านทางการยับยั้งการสร้าง gonadotropin และเพิ่ม sex-hormone binding globulin ทำให้ลดประสิทธิภาพของ testosterone (42) นอกจากนี้ยังยับยั้งการหลั่ง androgen จากต่อมหมวกไต และช่วยป้องกันการเพิ่มขึ้นของปริมาณขนด้วย แต่ยาคุมกำเนิดที่มี Levonorgestrel ซึ่งเป็น progestin ที่มีฤทธิ์ androgenic มากที่สุดควรจะหลีกเลี่ยง ในผู้ป่วยที่มีภาวะขนดก เนื่องจากอาจทำให้อาการแย่ลง
Combined oral contraception ที่มี antiandrogenic progestins (เช่น Cyprotenone acetate, Drospirenone) เช่น Yasmin, Yaz ในการศึกษาบางแห่ง พบว่ามีประสิทธิภาพดีกว่า combined OCs เล็กน้อย (43-45) แต่ยังไม่ทราบกลไกที่แน่ชัด
Combined progestin-progesterone contraception ในรูปแบบอื่น ๆ ที่ไม่ผ่านตับ เช่น ring, patch อาจให้ผลต่อ sex-hormone binding globulin จึงไม่ค่อยนำมาใช้ในการรักษาสิว แต่พบว่ายังได้ผลดีในการรักษาภาวะขนดก
Progestin-only contraception อาจกระตุ้นสิวและภาวะขนดกให้มากขึ้น จึงควรหลีกเลี่ยงในการใช้ (46)
โรคทางนรีเวชวิทยา (Gynecologic disorder)
เนื้องอกกล้ามเนื้อมดลูก (Uterine leiomyoma)
เนื้องอกกล้ามเนื้อมดลูก จัดเป็นเนื้องอกธรรมดา ที่มีโอกาสกลายเป็นมะเร็งน้อย ในผู้ป่วยที่ไม่มีอาการ สามารถตรวจติดตามอาการได้โดยไม่ต้องรับการรักษาอื่น ๆ เพิ่มเติม และการรักษาเพื่อป้องกันภาวะแทรกซ้อนในอนาคตก็ไม่มีความจำเป็น ยกเว้นในผู้หญิงที่เป็นเนื้องอกชนิด submucosal ซึ่งต้องการตั้งครรภ์ หรือในผู้ป่วยที่มีอาการไตบวมน้ำเนื่องจากการที่ท่อไตถูกกดทับจากขนาดของมดลูกและเนื้องอก
การรักษาผู้ป่วยเนื้องอกกล้ามเนื้อมดลูก มักมุ่งเน้นที่การลดอาการที่เกี่ยวกับตัวเนื้องอก เช่น การมีเลือดออกผิดปกติจากมดลูก, อาการอื่น ๆ เนื่องจากการกดทับของเนื้องอก โดยพิจารณาให้การรักษาจากปัจจัยต่าง ๆ เช่น
– ชนิดและความรุนแรงของอาการ
– ขนาดและตำแหน่งของเนื้องอก
– อายุผู้ป่วย
– ความต้องการด้านการเจริญพันธุ์ และประวัติการคลอด
การรักษาแบ่งเป็น
– Expectant management ควรมีการตรวจเบื้องต้นเพื่อยืนยันว่าเนื้องอกกล้ามเนื้อมดลูก ไม่ใช่ก้อนที่มาจากเนื้องอกรังไข่ และสามารถตรวจติดตามด้วยการตรวจภายในเพื่อประเมินขนาดของเนื้องอก ถ้ามีขนาดโตขึ้น หรือมีภาวะซีดเนื่องจากประจำเดือนมามาก ก็ให้การรักษาวร่วมด้วย หรือแนะนำทางเลือกอื่น ๆ ในการรักษาเพิ่มเติม
– Medical therapy พบว่าสามารถลดอาการได้อย่างเพียงพอ ในกลุ่มที่มีอาการเลือดออกผิดปกติ โดยอาการมักจะดีขึ้นใน 1 ปี แต่ในระยะยาวมักไม่ประสบผลสำเร็จ (47) ผู้ป่วยส่วนใหญ่มักต้องเข้ารับการรักษาด้วยการผ่าตัดในระยะเวลา 2 ปี หลังจากให้การรักษาด้วยยา (48)
– Surgical therapy เป็นการรักษาหลัก โดยมีข้อบ่งชี้ในการผ่าตัดคือ มีอาการเลือดออกผิดปกติจากมดลูก หรือมีอาการต่าง ๆ เนื่องจากขนาดของก้อน, ภาวะมีบุตรยากหรือแท้งซ้ำซากที่คาดว่าสาเหตุมาจากตัวเนื้องอก
Hormonal therapy: ยาคุมกำเนิดชนิดฮอร์โมนรวมและกลุ่ม progestin มักถูกนำมาใช้ในการควบคุมรักษาอาการเลือกออกผิดปกติ รวมถึงอาการอื่นๆ เช่น ปวดท้องน้อย มีรอบเดือนไม่สม่ำเสมอ แต่ยังมีประสิทธิภาพจำกัดในการรักษาหรือลดขนาดของเนื้องอก (49, 50) แต่ก็ไม่พบว่าเพิ่มโอกาสในการเกิดเนื้องอกมดลูกเพิ่มขึ้น
ได้มีการศึกษาต่อมาเกี่ยวการใช้ยาเม็ดคุมกำเนิดฮอร์โมนรวม พบว่ายาเม็ดคุมกำเนิดฮอร์โมนรวมมีความสัมพันธ์กับการลดโอกาสในการเกิดเนื้องอกกล้ามเนื้อมดลูก และลดอาการที่สัมพันธ์กับเนื้องอกมดลูกได้ โดยกลไกคาดว่าเป็นจากการทำให้เกิดการบางตัวของเยื่อบุโพรงมดลูก ดังดนั้น การรักษาด้วยวิธีนี้อาจมีความเหมาะสมในช่วงแรก ก่อนที่จะรักษาด้วยขั้นตอนอืน ๆ ที่มีความอันตรายมากกว่า
จากการศึกษาแบบเฝ้าสังเกตและทบทวนการรักษาที่ผ่านมา พบว่า การใส่ห่วงคุมกำเนิดที่มีฮอร์โมน Levonorgestrel สามารถลดขนาดของมดลูกอละปริมาณเลือดที่ออก และเพิ่มค่าความเข้มข้นเลือดภายหลังการใช้ ดังนั้นจึงมีการนำมาใช้อย่าางแพร่หลายในการควบคุมปริมาณเลือดที่ออก โดยมีข้อห้ามใช้ในผู้ป่วยที่มีเนื้องอกกล้ามเนื้อมดลูกชนิดที่ยื่นเข้าไปในโพรงมดลูก
ส่วน ยาคุมกำเนิดที่มี progestin เพียงอย่างเดียว ทั้งชนิดฉีด ฝัง และเม็ด ยังไม่มีหลักฐานที่บ่งบอกว่าสามารถรักษาเนื้องอกมดลูก แต่พบว่าสัมพันธ์กับการลดโอกาสในการเกิดเนื้องอกมดลูกด้วย
ภาวะเนื้อเยื่อบุโพรงมดลูกเจริญผิดที่ (Endometriosis)
จากการประชุมของ Practice Committee of the American society for Reproductive Medicine สรุปว่า Endometriosis เป็นโรคเรื้อรังที่ต้องการการรักษาแต่เนื่องตลอดชีวิต โดยมีเป้าหมายคือพยายามใช้ยา และหลีกเลี่ยงการผ่าตัดรักษาซ้ำซาก (51)
อาการของ endometriosis ประกอบด้วยอาการปวดท้องน้อย, การมีบุตรยาก และการมีก้อนในท้องน้อย ดังนั้น เป้าหมายของการรักษาจึงเพื่อต้องการลดอาการเหล่านี้ โดยมีวิธีการรักษาต่าง ๆ คือ
– Expectant management
– Analgesis
– Hormonal medical therapy
Estrogen-progestin oral contraceptives
Gonadotropin-releasing hormone (GnRH) agonists
Progestins
Danazol
Aromatase inhibitors
– Surgical intervention
– Combination therapy โดยให้การรักษาด้วยยาก่อนหรือหลังการผ่าตัด
ยังไม่มีข้อมูลเพียงพอที่จะบอกกว่าการรักษาใดดีกว่า การเลือกวิธีการรักษาจึงแล้วแต่สภาวะของผู้ป่วยแต่ละคน โดยควรให้ข้อมูลเกี่ยวกับอาการและความรุนแรงของโรค ตำแหน่งของโรค ผลที่คาดว่าจะมีผลต่อการตั้งครรภ์ อายุของผู้ป่วย ภาวะแทรกซ้อนที่เกิดจากการผ่าตัด และค่าใช้จ่ายในการรักษา เพื่อนำไปประกอบการตัดสินใจเลือกวิธีการรักษาที่เหมาะสม
ยาเม็ดคุมกำเนิดฮอร์โมนรวม เป็นทางเลือกที่ดีในผู้ป่วยที่มีอาการปวดเล็กน้อยถึงปานกลางที่ต้องการคุมกำเนิดร่วมด้วย (52) โดยกลไกในการรักษาคาดว่าเกิดจาก Decidualization และทำให้เยื่อบุโพรงมดลูกฝ่อตัว ซึ่งรวมถึงเยื่อบุโพรงมดลูกที่ไปเจริญอยู่นอกมดลูกร่วมด้วย
ยาคุมกำเนิด Progestin จัดเป็น second line treatment โดยช่วยยับยั้งการเจริญเติบโตของเยื่อบุโพรงมดลูกโดยกลไก Decidualziation ทำให้เกิดการบางตัว และยังช่วยยับยั้งการหลั่ง gonadotropin จากต่อมใต้สมอง และยับยั้งการสร้างฮอร์โมนจากรังไข่ สามารถลดอาการปวดท้องที่เกิดจาก endometriosis ได้ดี นอกจากนี้ยังช่วยกำจัดการฝังตัวของเยื่อบุโพรงมดลูกและลดโอกาสในการเกิดการกลับเป็นซ้ำของ endometriosis (53-58)
Ovarian cyst
มีการรายงานจากวิจัยบางอัน ที่พบว่ายาฮอร์โมนคุมกำเนิดสามารถลดจำนวนของ ovarian follicle และ corpus luteal cyst ได้ด้วยการยับยั้งการตกไข่ แต่ก็ไม่ได้ผลกับถุงน้ำทั้งหมดในรังไข่ นอกจากนี้ยังไม่พบว่ามีความแตกต่างกันของประสิทธิภาพในการลดขนาดถุงน้ำรังไข่ ระหว่างยาคุมกำเนิดชนิด monophasic, triphasic และ progestin-only และส่วนใหญ่ถุงน้ำเหล่านี้มักมีขนาดเล็ก ไม่มีอาการ และสามารถหายได้เอง ดังนั้นจึงไม่ม่มีข้อสนับสนุนให้ช้ฮอร์โมนคุมกำเนิดในการรักษาภาวะนี้
ลดปัจจัยเสี่ยงต่อการเกิดมะเร็ง (Cancer risk reduction)
มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer)
มะเร็งของเยื่อบุโพรงมดลูก เป็นมะเร็งทางนรีเวชที่พบได้บ่อยที่สุดในสหรัฐอเมริกา อาการที่พบได้บ่อยคือมีเลือดออกผิดปกติจากช่องคลอด ผู้ป่วยส่วนใหญ่จะได้รับการวินิจฉัยในระยะแรก ซึ่งการผ่าตัดรักษาก็เพียงพอในการรักษาให้หายขาด สามารถแบ่งรูปแบบของมะเร็งเยื่อบุโพรงมดลูกได้เป็น 2 ชนิด คือ
1. Type I: เป็นมะเร็งที่สัมพันธ์กับการกระตุ้นจาก estrogen ซึ่งมักจะมีลักษณะเป็น Low grade endometrioid tumor และสัมพันธ์กับการมี atypical endometrial hyperplasia ซึ่งผู้ป่วยมักจะมีปัจจัยเสี่ยงคือ อ้วน, ไม่เคยมีบุตร, สัมพันธ์กับการได้รับ estrogen ในปริมาณสูง, เป็นเบาหวานหรือความดันโลหิตสูง
2. Type II: มักไม่สัมพันธ์กับการกระตุ้นจาก estrogen หรือสัมพันธ์กับ endometrial hyperplasia และมักเป็นมะเร็งที่มีความรุนแรงมากกว่า หรือมีการพยากรณ์โรคแย่กว่า ผู้ป่วยมักจะเคยมีบุตรมาแล้ว และไม่สัมพันธ์กับภาวะอ้วน เบาหวาน และความดันโลหิตสูง และมักอยู่ในช่วงอายุที่สูงกว่ากลุ่มแรก
การใช้ยาคุมกำเนิดจะช่วยลดโอกาสได้ในการเกิดมะเร็งได้ 50-80% (59-65) เนื่องจาก progestin ที่เป็นองค์ประกอบหนึ่งในยาเม็ดคุมกำเนิด จะช่วยกดการหนาตัวของเยื่อบุโพรงมดลูก มีการศึกษาพบว่าผู้หญิงที่ใช้ยาเม็ดคุมกำเนิดฮอร์โมนรวม เป็นระยะเวลาอย่างน้อย 1 ปี จะลดโอกาสเกิดมะเร็งได้ 0.6% เมื่อเทียบกะผู้ที่ไม่ใช้ ผลของการป้องกันจะสัมพันธ์กับระยะเวลาในการใช้ยา โดยยิ่งใช้ติดต่อกันเป็นระยะเวลานานก็จะยิ่งช่วยลดโอกาสเสี่ยงได้มากกวา และผลในการป้องกันจะคงอยู่อย่างน้อย 15 ปี หลังจากหยุดใช้ แต่ยังไม่มีข้อมูลเกี่ยวกับยาคุมกำเนิดฮอร์โมนรวมในรูปแบบอื่นว่าได้ผลดีเช่นเดียวกันหรือไม่ แต่ยาคุมกำเนิดชนิดที่มีแต่ progestin เพียงอย่างเดียว เช่น DMPA, progestin-releasing IUD พบกว่าสามารถปป้องกันกันหนาตัวของเยื่อบุโพรงมดลูก และลดโอกาสเกิดมะเร็งได้เช่นเดียวกัน (66-68)
นอกจากนี้ levonorgestrel IUD ยังมีประสิทธิภาพในการรักษา endometrial hyperplasia with out atypia ได้ถึง 96% และยังสามารถลดจำนวนผู้ป่วยที่เป็น endometrium hyperplasia with atypia ได้ นอกจากนี้การใช้ levonorgestrel IUD ในผู้ป่วยมะเร็งเต้านมที่ได้รับ Tamoxifen ยังช่วยลดโอกาสเสี่ยงในการเกิดมะเร็งเยื่อบุโพรงมดลูกได้อีกด้วย
ในผู้หญิงวัยหมดประจำเดิอนที่ได้รับการรักษาด้วยการให้ estrogen ต่อเนื่องเป็นเวลานาน พบว่าการให้ progestin ควบคู่ไปด้วยมีโอกาสเกิดมะเร็งขอเยื่อบุโพรงมดลูกได้น้อยกว่ากลุ่มที่ไม่ได้ใช้ (69)
มะเร็งรังไข่ (Ovarian cancer)
มะเร็งรังไข่ส่วนใหญ่เจริญมาจากเซลล์เยื่อบุผิวบริเวณรังไข่ นอกจากนี้ยังสามารถเจริญขึ้นมาจากเซลล์อื่น ๆ ได้อีก มะเร็งเยื่อบุผิวของรังไข่มักเกิดจากการเปลี่ยนแปลงไปสู่เซลล์มะเร็งของเซลล์ที่อยู่บริเวณเยื่อบุผิว ซึ่งมีปัจจัยส่งเสริมหลายประการ แต่มีอยู่ 2 ทฤษฎีที่คาดว่าจะสามารถอธิบายการเปลี่ยนแปลงนี้ได้ดี คือ
– การตกไข่เกินความจำเป็น ทำให้เกิดการบาดเจ็บซ้ำ ๆ และการซ่อมแซมตัวของเยื่อบุผิวรังไข่ ซึ่งอาจจะทำไปสู่การเปลี่ยนแปลงในระดับยีน ทำให้เกิดเป็นเซลล์มะเร็งขึ้น ซึ่งทฤษฎีนี้ได้รับการยืนยันจากผลของการตั้งครรภ์และการกินยาเม็ดคุมกำเนิดที่สามารถช่วยป้องกันการเกิดมะเร็งเยื่อบุผิวรังไข่ได้
– การหลั่ง gonadotropin ที่มากเกินไป จะกระตุ้นให้มีความเข้มข้นของ estrogen ในเลือดในประมาณสูง ซึ่งนำไปสู่การเจริญของเยื่อบุผิวรังไข่ และอาจจะเป็นสามารถทำให้มีการเจริญเป็นเซลล์มะเร็งได้
นอกจากนี้ยังมีทฤษฎีอื่น ๆ เช่น จากการมี androgen ในระดับสูง ๆ, การเกิดการอักเสบ และการที่เนื้อเยื่อของรังไข่มีการหนาตัวขึ้น
ในการศึกษาขนาดใหญ่ โดยรวบรวมข้อมูลจากทั่วโลก ที่ต้องการดูความสัมพันธ์ระหว่างยาคุมกำเนิดฮอร์โมนรวมและโอกาสเกิดมะเร็งรังไข่ พบว่าการให้ยาคุมกำเนิด ช่วยลดโอกาสในการเกิดมะเร็งรังไข่ได้ 27% และระยะเวลาที่ใช้ถ้ายาวนานก็จะจะยิ่งช่วยลดโอกาสเสี่ยงได้มากขึ้น ประมาณว่าทุ ก ๆ 5 ปีของการใช้ยาคุมกำเนิด จะช่วยลดโอกาสการเป็นมะเร็งรังไข่ได้ประมาณ 20% นอกจากนี้ยังมีบางรายงานพบว่า ยาคุมกำเนิดฮอร์โมนรวมสามารถใช้ในเป็น chemoprotection ในการป้องกันมะเร็งรังไข่ในผู้หญิงที่มียีน BRCA ผิดปกติ
มะเร็งลำไส้ (Colorectal cancer)
มีการศึกษาเปรียบเทียบขนาดใหญ่ พบว่าในกลุ่มผู้ใช้ยาเม็ดคุมกำเนิดสามารถลดโอกาสในการเกิดมะเร็งลำไส้ได้ถึง 17% เมื่อเทียบกับกลุ่มที่ไม่ใช้ แต่ยังไม่มีความแตกต่างทางสถิติในกลุ่มคนที่เคยใช้ในอดีตและคนที่กำลังใช้อยู่ ว่าสามารถลดโอกาสในการเกิดมะเร็งได้ต่างกันหรือไม่
Reference
1. Petitti DB. Clinical practice. Combination estrogen-progestin oral contraceptives. N Engl J Med 2003; 349:1443.
2. Hannaford PC, Kay CR, Vessey MP, et al. Combined oral contraceptives and liver disease. Contraception 1997; 55:145.
3. Li DK, Daling JR, Mueller BA, et al. Oral contraceptive use after conception in relation to the risk of congenital urinary tract anomalies. Teratology 1995; 51:30.
4. Practice Bulletin. Noncontraceptive uses of hormonal contraceptives. ACOG 2010; 115: 206.
5. Lin K, Barnhart K. The clinical rationale for menses-free contraception. J Womens Health (Larchmt) 2007; 16:1171.
6.. Sulak PJ, Kuehl TJ, Coffee A, Willis S. Prospective analysis of occurrence and management of breakthrough bleeding during an extended oral contraceptive regimen. Am J Obstet Gynecol 2006; 195:935.
7.. Machado RB, de Melo NR, Maia H Jr. Bleeding patterns and menstrual-related symptoms with the continuous use of a contraceptive combination of ethinylestradiol and drospirenone: a randomized study. Contraception 2010; 81:215.
8. Andrew M Kaunitz, MD, Robert L Barbieri, MD. Hormonal contraception for suppression of menstruation. UpToDate
9. Akin MD, Weingand KW, Hengehold DA, et al. Continuous low-level topical heat in the treatment of dysmenorrhea. Obstet Gynecol 2001; 97:343.
10. Akin M, Price W, Rodriguez G Jr, et al. Continuous, low-level, topical heat wrap therapy as compared to acetaminophen for primary dysmenorrhea. J Reprod Med 2004; 49:739.
11. Israel RG, Sutton M, O’Brien KF. Effects of aerobic training on primary dysmenorrhea symptomatology in college females. J Am Coll Health 1985; 33:241.
12. Brown J, Brown S. Exercise for dysmenorrhoea. Cochrane Database Syst Rev 2010; :CD004142.
13. Golomb LM, Solidum AA, Warren MP. Primary dysmenorrhea and physical activity. Med Sci Sports Exerc 1998; 30:906.
14. Rakhshaee Z. Effect of three yoga poses (cobra, cat and fish poses) in women with primary dysmenorrhea: a randomized clinical trial. J Pediatr Adolesc Gynecol 2011; 24:192.
15. Hatcher RA. Counseling couples about coitus during menstrual flow. Contracept Technol Update 1981; 2:167.
16. Proctor ML, Murphy PA, Pattison HM, et al. Behavioural interventions for primary and secondary dysmenorrhoea. Cochrane Database Syst Rev 2007; :CD002248.
17. Barnard ND, Scialli AR, Hurlock D, Bertron P. Diet and sex-hormone binding globulin, dysmenorrhea, and premenstrual symptoms. Obstet Gynecol 2000; 95:245.
18. Abdul-Razzak KK, Ayoub NM, Abu-Taleb AA, Obeidat BA. Influence of dietary intake of dairy products on dysmenorrhea. J Obstet Gynaecol Res 2010; 36:377.
19. Ziaei S, Faghihzadeh S, Sohrabvand F, et al. A randomised placebo-controlled trial to determine the effect of vitamin E in treatment of primary dysmenorrhoea. BJOG 2001; 108:1181.
20. Ziaei S, Zakeri M, Kazemnejad A. A randomised controlled trial of vitamin E in the treatment of primary dysmenorrhoea. BJOG 2005; 112:466.
21. Norman RJ, Wu R. The potential danger of COX-2 inhibitors. Fertil Steril 2004; 81:493.
22. Harel Z, Biro FM, Kollar LM. Depo-Provera in adolescents: effects of early second injection or prior oral contraception. J Adolesc Health 1995; 16:379.
23. Hubacher D, Lopez L, Steiner MJ, Dorflinger L. Menstrual pattern changes from levonorgestrel subdermal implants and DMPA: systematic review and evidence-based comparisons. Contraception 2009; 80:113.
24. Varma R, Sinha D, Gupta JK. Non-contraceptive uses of levonorgestrel-releasing hormone system (LNG-IUS)–a systematic enquiry and overview. Eur J Obstet Gynecol Reprod Biol 2006; 125:9.
25. Bahamondes L, Petta CA, Fernandes A, Monteiro I. Use of the levonorgestrel-releasing intrauterine system in women with endometriosis, chronic pelvic pain and dysmenorrhea. Contraception 2007; 75:S134.
26. Wildemeersch D, Schacht E, Wildemeersch P. Treatment of primary and secondary dysmenorrhea with a novel ‘frameless’ intrauterine levonorgestrel-releasing drug delivery system: a pilot study. Eur J Contracept Reprod Health Care 2001; 6:192.
27. Croxatto HB. Clinical profile of Implanon: a single-rod etonogestrel contraceptive implant. Eur J Contracept Reprod Health Care 2000; 5 Suppl 2:21.
28. Sandahl B, Ulmsten U, Andersson KE. Trial of the calcium antagonist nifedipine in the treatment of primary dysmenorrhoea. Arch Gynecol 1979; 227:147.
29. Borenstein J, Chiou CF, Dean B, et al. Estimating direct and indirect costs of premenstrual syndrome. J Occup Environ Med 2005; 47:26.
30. Deuster PA, Adera T, South-Paul J. Biological, social, and behavioral factors associated with premenstrual syndrome. Arch Fam Med 1999; 8:122.
31. Yonkers KA, Brown C, Pearlstein TB, et al. Efficacy of a new low-dose oral contraceptive with drospirenone in premenstrual dysphoric disorder. Obstet Gynecol 2005; 106:492.
32. Pearlstein TB, Bachmann GA, Zacur HA, Yonkers KA. Treatment of premenstrual dysphoric disorder with a new drospirenone-containing oral contraceptive formulation. Contraception 2005; 72:414.
33. Lopez LM, Kaptein AA, Helmerhorst FM. Oral contraceptives containing drospirenone for premenstrual syndrome. Cochrane Database Syst Rev 2009; :CD006586.
34. Milsom I, Lete I, Bjertnaes A, Rokstad K, Lindh I, Gruber CJ, et al. Effects on cycle control and bodyweight of the combined contraceptive ring, NuvuRing, versus an oral contraceptive containing 30 microg ethinyl estradiol and 3 mg drospirenone. Hum Reprod 2006; 21 : 2304-11.
35. Somerville BW. Estrogen-withdrawal migraine. II. Attempted prophylaxis by continuous estradiol administration. Neurology 1975; 25:245.
36. Somerville BW. Estrogen-withdrawal migraine. I. Duration of exposure required and attempted prophylaxis by premenstrual estrogen administration. Neurology 1975; 25:239.
37. Scharff L, Turk DC, Marcus DA. Triggers of headache episodes and coping responses of headache diagnostic groups. Headache 1995; 35:397.
38. Winner P, Ricalde O, Le Force B, et al. A double-blind study of subcutaneous dihydroergotamine vs subcutaneous sumatriptan in the treatment of acute migraine. Arch Neurol 1996; 53:180.
39. Ischaemic stroke and combined oral contraceptives: results of an international, multicentre, case-control study. WHO Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Lancet 1996; 348:498.
40. Chan WS, Ray J, Wai EK, et al. Risk of stroke in women exposed to low-dose oral contraceptives: a critical evaluation of the evidence. Arch Intern Med 2004; 164:741.
41. Lolis MS, Bowe WP, Shalita AR. Acne and systemic disease. Med Clin North Am 2009; 93:1161.
42. Haider A, Shaw JC. Treatment of acne vulgaris. JAMA 2004; 292:726.
43. Thorneycroft H, Gollnick H, Schellschmidt I. Superiority of a combined contraceptive containing drospirenone to a triphasic preparation containing norgestimate in acne treatment. Cutis 2004; 74:123.
44. Carlborg L. Cyproterone acetate versus levonorgestrel combined with ethinyl estradiol in the treatment of acne. Results of a multicenter study. Acta Obstet Gynecol Scand Suppl 1986; 134:29.
45. Lachnit-Fixson U, Kaufmann J. [Therapy of androgenization symptoms: double blind study of an antiandrogen preparation (SH B 209 AB) against neogynon (author’s transl)]. Med Klin 1977; 72:1922.
46. Burkman RT Jr. The role of oral contraceptives in the treatment of hyperandrogenic disorders. Am J Med 1995; 98:130S
47. Laughlin SK, Hartmann KE, Baird DD. Postpartum factors and natural fibroid regression. Am J Obstet Gynecol 2011; 204:496.e1.
48. Viswanathan M, Hartmann K, McKoy N, et al. Management of uterine fibroids: an update of the evidence. Evid Rep Technol Assess (Full Rep) 2007; :1.
49. Fedele L, Bianchi S, Raffaelli R, Zanconato G. A randomized study of the effects of tibolone and transdermal estrogen replacement therapy in postmenopausal women with uterine myomas. Eur J Obstet Gynecol Reprod Biol 2000; 88:91.
50. Palomba S, Sena T, Morelli M, et al. Effect of different doses of progestin on uterine leiomyomas in postmenopausal women. Eur J Obstet Gynecol Reprod Biol 2002; 102:199.
51. Practice Committee of American Society for Reproductive Medicine. Treatment of pelvic pain associated with endometriosis. Fertil Steril 2008; 90:S260.
52. Harada T, Momoeda M, Taketani Y, et al. Low-dose oral contraceptive pill for dysmenorrhea associated with endometriosis: a placebo-controlled, double-blind, randomized trial. Fertil Steril 2008; 90:1583.
53. Luciano AA, Turksoy RN, Carleo J. Evaluation of oral medroxyprogesterone acetate in the treatment of endometriosis. Obstet Gynecol 1988; 72:323.
54. Telimaa S, Puolakka J, Rönnberg L, Kauppila A. Placebo-controlled comparison of danazol and high-dose medroxyprogesterone acetate in the treatment of endometriosis. Gynecol Endocrinol 1987; 1:13.
55. Prentice A, Deary AJ, Bland E. Progestagens and anti-progestagens for pain associated with endometriosis. Cochrane Database Syst Rev 2000; :CD002122.
56. Crosignani PG, Luciano A, Ray A, Bergqvist A. Subcutaneous depot medroxyprogesterone acetate versus leuprolide acetate in the treatment of endometriosis-associated pain. Hum Reprod 2006; 21:248.
57. Vercellini P, Cortesi I, Crosignani PG. Progestins for symptomatic endometriosis: a critical analysis of the evidence. Fertil Steril 1997; 68:393.
58. Dawood MY, Obasiolu CW, Ramos J, Khan-Dawood FS. Clinical, endocrine, and metabolic effects of two doses of gestrinone in treatment of pelvic endometriosis. Am J Obstet Gynecol 1997; 176:387.
59. Lerner-Geva L, Rabinovici J, Lunenfeld B. Ovarian stimulation: is there a long-term risk for ovarian, breast and endometrial cancer? Womens Health (Lond Engl) 2010; 6:831.
60. Furberg AS, Thune I. Metabolic abnormalities (hypertension, hyperglycemia and overweight), lifestyle (high energy intake and physical inactivity) and endometrial cancer risk in a Norwegian cohort. Int J Cancer 2003; 104:669.
61. Noto H, Osame K, Sasazuki T, Noda M. Substantially increased risk of cancer in patients with diabetes mellitus: a systematic review and meta-analysis of epidemiologic evidence in Japan. J Diabetes Complications 2010; 24:345.
62. Friberg E, Orsini N, Mantzoros CS, Wolk A. Diabetes mellitus and risk of endometrial cancer: a meta-analysis. Diabetologia 2007; 50:1365.
63. Shoff SM, Newcomb PA. Diabetes, body size, and risk of endometrial cancer. Am J Epidemiol 1998; 148:234.
64. Soler M, Chatenoud L, Negri E, et al. Hypertension and hormone-related neoplasms in women. Hypertension 1999; 34:320.
65. Soliman PT, Wu D, Tortolero-Luna G, et al. Association between adiponectin, insulin resistance, and endometrial cancer. Cancer 2006; 106:2376.
66. Zendehdel K, Nyrén O, Ostenson CG, et al. Cancer incidence in patients with type 1 diabetes mellitus: a population-based cohort study in Sweden. J Natl Cancer Inst 2003; 95:1797.
67. Weiderpass E, Persson I, Adami HO, et al. Body size in different periods of life, diabetes mellitus, hypertension, and risk of postmenopausal endometrial cancer (Sweden). Cancer Causes Control 2000; 11:185.
68. La Vecchia C, Negri E, Franceschi S, et al. A case-control study of diabetes mellitus and cancer risk. Br J Cancer 1994; 70:950.
69. Parazzini F, La Vecchia C, Negri E, et al. Diabetes and endometrial cancer: an Italian case-control study. Int J Cancer 1999; 81:539.
70. Up-To-Date 2012. Version 13.0; Kathryn A M: Overview of the use of estrogen-progestin contraceptives; 2012
71. Up-To-Date 2012. Version 13.0; Andrew MK: Hormonal contraception for suppression of menstruation; 2012
72. Up-To-Date 2012. Version 13.0; Roger PS: Treatment of primary dysmenorrhea in adult women; 2012
73. Up-To-Date 2012. Version 13.0; Anne HC: Estrogen-associated migraine; 2012
74. Up-To-Date 2012. Version 13.0; Robert FC; Treatment of premenstrual syndrome and premenstrual dysphoric disorder; 2012
75. Up-To-Date 2012. Version 13.0; Jacqueline JH; Hormonal therapy for women with acne vulgaris; 2012
75. Up-To-Date 2012. Version 13.0;Robert LB: Treatment of hirsutism; 2012
76. Up-To-Date 2012. Version 13.0; Elizabeth AS: Overview of treatment of uterine leiomyomas (fibroids); 2012
77. Up-To-Date 2012. Version 13.0; Robert SS: Overview of the treatment of endometriosis; 2012
78. Up-To-Date 2012. Version 13.0; Lee-may Chen: Endometrial cancer: Epidemiology, risk factors, clinical features, diagnosis, and screening; 2012
79. Up-To-Date 2012. Version 13.0; Lee-may Chen: Epithelial ovarian cancer: Pathology; 2012