Leiomyosarcoma (LMS)
พ.ญ.สุพรรษา ศรีชุ่มจิตร
ผศ.นพ.ฉลอง ชีวเกรียงไกร
Uterine cancer
มะเร็งมดลูก แบ่งออกเป็น 2 ประเภท ได้แก่ มะเร็งเยื่อบุโพรงมดลูก (endometrial cancer) ซึ่งเป็นมะเร็งที่เกิดจากความผิดปกติของเซลล์เยื่อบุโพรงมดลูก และ มะเร็งมดลูกชนิดซาร์โคมา (uterine sarcoma) ซึ่งเป็นมะเร็งที่เกิดจากความผิดปกติของเซลล์กล้ามเนื้อมดลูกหรือเนื้อเยื่อเกี่ยวพัน
Uterine sarcoma
มะเร็งมดลูกชนิดซาร์โคมา พบได้ประมาณร้อยละ 1 ของมะเร็งนรีเวช ร้อยละ3-7 ของมะเร็งมดลูกทั้งหมด (1) ซึ่งมีการจัดแบ่งชนิดของมะเร็งมดลูกชนิดซาร์โคมาดังนี้
1. Non-epithelium neoplasm
- Endometrial stromal tumors
- Stromal nodule
- Endometrial stromal sarcroma
- Undifferentiated endometrial sarcoma
- Smooth muscle tumor of uncertain malignant potential
- Leiomyosarcoma
- Epithelioid
- Myxoid
- Mixed endometrial stromal and smooth muscle tumor
- Other soft tissue tumors
- Homologous
- Heterogenous
2. Mixed epithelial-non epithelial tumors
- Adenosarcoma
- Homologous
- Heterologous
- With high grade stromal overgrowth
Leiomyosarcoma (LMS)
บทนำ
Leiomyosarcoma คือมะเร็งกล้ามเนื้อเรียบมดลูก เป็นมะเร็งที่มีต้นกำเนิดมาจากกล้ามเนื้อเรียบของมดลูก มีเพียงเล็กน้อยเท่านั้นที่เป็นการกลายเป็นมะเร็งจากเนื้องอกกล้ามเนื้อมดลูกธรรมดา (leiomyoma) มะเร็งกล้ามเนื้อเรียบมดลูกพบได้ประมาณ 1 ใน 3 ส่วนของมะเร็งมดลูกชนิดซาร์โคมา(2) โดยมีการศึกษาพบว่าอุบัติการณ์ของการวินิจฉัยมะเร็งกล้ามเนื้อมดลูกโดยก่อนผ่าตัดได้รับการวินิจฉัยว่าเป็นเนื้องอกกล้ามเนื้อมดลูกธรรมดาประมาณร้อยละ 0.1-0.3 และพบว่าอุบัติการณ์การเกิดโรคพบมักพบสูงขึ้นในกลุ่มสตรีที่มีอายุ 40-70 ปี (3)
อาการที่พบได้และเป็นอาการนำที่ผู้ป่วยมาโรงพยาบาล เช่น (1)
- มีเลือดออกทางช่องคลอดผิดปกติ ร้อยละ 56
- คลำพบก้อนบริเวณท้องน้อย ร้อยละ 54
- อาการปวดท้องน้อย ร้อยละ 22
โดยอาการและอาการแสดงส่วนใหญ่อาจไม่สามารถแยกระหว่างเนื้องอกกล้ามเนื้อมดลูกธรรมดา และมะเร็งกล้ามเนื้อเรียบมดลูกได้ แต่ลักษณะบางอย่างที่อาจชี้นำให้คำนึงถึงภาวะมะเร็งมากกว่า เช่น การมีขนาดที่ใหญ่ขึ้นอย่างรวดเร็วของก้อนเนื้องอกมดลูกธรรมดา การมีก้อนเนื้องอกมดลูกที่มีขนาดใหญ่ขึ้นในกลุ่มสตรีวัยหมดระดูที่ไม่ได้รับฮอร์โมนทดแทน(4) นอกจากนี้อาจมีอาการที่แสดงถึงภาวะแทรกซ้อนจากก้อนมะเร็ง เช่น อาการแสดงจากก้อนมะเร็งแตก แล้วเกิดเลือดออกในเยื่อบุช่องท้อง และอาการแสดงจากการกระจายของก้อนมะเร็งไปยังอวัยวะต่างๆของร่างกาย เป็นต้น
พยาธิวิทยา
ลักษณะทางกายวิภาคของมะเร็งกล้ามเนื้อเรียบมดลูก มักพบเป็นก้อนเดี่ยว ขนาดแตกต่างกันไป มีลักษณะนิ่มเนื่องจากมีเนื้อตายและเลือดออกภายใน สีพื้นผิวมีทั้งสีเทา น้ำตาล และเหลือง ส่วนลักษณะทางจุลพยาธิวิทยาของมะเร็งกล้ามเนื้อเรียบมดลูกคือ มีการแบ่งตัวเพิ่มจำนวนเซลล์มาก มีลักษณะความผิดปกติของนิวเคลียสรุนแรง ดังรูป
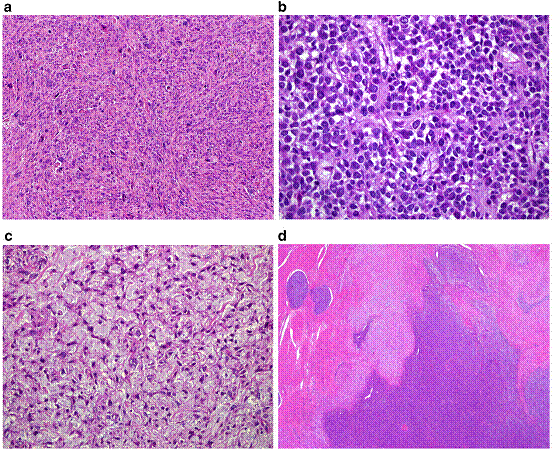
Fig.1. (a) Leiomyosarcoma, spindle-cell variant; (b) Myxoid leiomyosarcoma; (c) Epithelioid leiomyosarcoma; (d) Endometrial stromal sarcoma. (1)
ได้มีการกำหนดเกณฑ์การวินิจฉัยมะเร็งกล้ามเนื้อเรียบมดลูกโดยองค์การอนามัยโลกเมื่อปีค.ศ.2003 โดยใช้เกณฑ์จากจุลพยาธิวิทยา คือมีลักษณะอย่างน้อย 2 ประการ ดังนี้ (5 ,6)
- Moderate to severe nuclear atypia
- Mitotic index ≥10 mitotic figures per 10 high-power fields
- Tumor cell necrosis
เกณฑ์ดังกล่าว มีชื่อเรียกว่า Stanford criteria ซึ่งหากผู้ป่วยพบลักษณะดังกล่าวข้างต้นอย่างน้อย 2 ประการ จะบ่งชี้ว่ามีความเสี่ยงต่อการแพร่กระจายของโรคมากกว่าร้อยละ 10 (7) นอกจากนี้ยังมีลักษณะทางคลินิกและพยาธิวิทยาบางอย่างที่ช่วยสนับสนุน เช่น อายุในช่วงขณะหรือหลังหมดระดู การกระจายของก้อนออกนอกตัวมดลูก ก้อนขนาดใหญ่ (>10 ซม.) และการตายของเนื้อเยื่อ เป็นต้น
มะเร็งกล้ามเนื้อเรียบ จำแนกเป็น 2 กลุ่มย่อย ได้แก่
- Epithelioid LMS
- Myxoid Leiomyosarcoma
มะเร็งทั้ง 2 กลุ่มนี้ จะมีความแตกต่างกันทางด้านจุลพยาธิวิทยา กล่าว คือ epithelioid LMS มีลักษณะเป็น round to polygonal cells พบ cytoplasm เป็นแบบ eosinophilic หรืออาจมีลักษณะใส หากพบลักษณะนิวเคลียสที่มี atypia และมี >5 mitoses/ 10 HPF สามารถให้การวินิจฉัยภาวะนี้ได้ อย่างไรก็ตาม หากพบลักษณะของ mitotic activity เพียง 2-4 mitoses/ 10 HPF อาจเรียกว่า epithelioid smooth muscle tumor of uncertain malignant potential ส่วน myxoid LMS จะมีลักษณะ myxoid appearance ที่หนาแน่น มี mitotic index ต่ำ โดยบริเวณ stroma จะพบเซลล์ที่อุดมไปด้วยสารคล้าย mucin เนื้องอกชนิดนี้มีคุณสมบัติความเป็นมะเร็งสูง จัดได้ว่าเป็น high-grade leiomyosarcoma
การวินิจฉัยแยกโรค
เนื่องจากมะเร็งกล้ามเนื้อเรียบมดลูก มีต้นกำเนิดมาจากกล้ามเนื้อของตัวมดลูก ดังนั้นควรให้การวินิจฉัยแยกโรคจากเนื้องอกกล้ามเนื้อมดลูกธรรมดา เนื่องจากมีเนื้องอกกล้ามเนื้อบางอย่างที่มีพฤติกรรมคล้ายกับก้อนเนื้องอกมะเร็ง ดังตาราง (1)
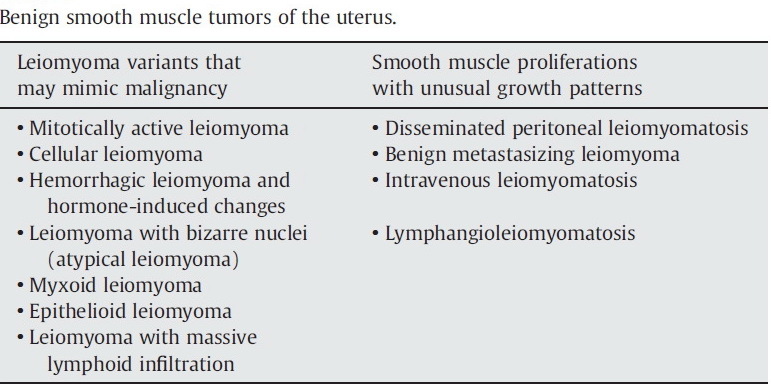
นอกจากนี้ ยังต้องให้การวินิจฉัยแยกโรคจาก smooth muscle tumors of uncertain malignant potential (STUMP) เช่น the epithelioid smooth-muscle tumor , the clear cell variant of the smooth-muscle tumors เป็นต้น (8) ซึ่งการดูแลรักษา สามารถทำได้เช่นเดียวกับการดูแลรักษาเนื้องอกกล้ามเนื้อมดลูกแบบธรรมดา โดย STUMP มีเกณฑ์การวินิจฉัยดังนี้ (1)

ได้มีการศึกษาเกี่ยวกับสารชีวโมเลกุลของมะเร็งกล้ามเนื้อเรียบมดลูก พบว่ามะเร็งดังกล่าวสามารถแสดงออกถึงสารชีวเคมีของกล้ามเนื้อเรียบหลายอย่าง เช่น desmin , h -caldesmon, smooth muscle actin, and histone deacetylase 8 (HDCA8) เป็นต้น (1) และมะเร็งกล้ามเนื้อเรียบมดลูกยังสามารถมีปฏิกิริยาทางอิมมูนต่อ CD10 และต่อสารชีวเคมีของเยื่อบุผิว เช่น keratin , EMA เป็นต้น
มีการศึกษาพบว่าในมะเร็งกล้ามเนื้อเรียบมดลูก พบสาร Ki67 เพิ่มสูงขึ้นกว่า เมื่อเทียบกับเนื้องอกกล้ามเนื้อมดลูกธรรมดา และพบว่ามีการเปลี่ยนแปลงและการแสดงออกที่ผิดปกติของ p53 ในมะเร็งกล้ามเนื้อเรียบมดลูกประมาณร้อยละ 25-47 แต่กลับไม่พบในกลุ้มเนื้องอกกล้ามเนื้อมดลูกธรรมดา (1) นอกจากนี้ยังพบการแสดงออกผิดปกติของ p16 ในกลุ่มมะเร็งกล้ามเนื้อเรียบมดลูก แต่ไม่พบในกลุ่มเนื้องอกกล้ามเนื้อมดลูกธรรมดาอีกด้วย
มีการศึกษาพบว่า ในมะเร็งกล้ามเนื้อเรียบมดลูก มีการแสดงออกของ estrogen receptor (ER) ร้อยละ 26-87 และ progesterone receptor (PR) ร้อยละ 17-80 และพบว่าระดับของ progesterone receptor (PR) ของมะเร็งกล้ามเนื้อเรียบมดลูกน้อยกว่ากลุ่ม STUMP และกลุ่มกล้ามเนื้อเรียบมดลูกธรรมดาอย่างมีนัยสำคัญทางสถิติ ซึ่งเป็นการพิสูจน์ว่า การใช้สารชีวโมเลกุลต่างๆเหล่านี้ อาจเป็นประโยชน์ในการใช้วินิจฉัยแยกโรคระหว่างมะเร็งกล้ามเนื้อเรียบมดลูกและเนื้องอกกล้ามเนื้อมดลูกธรรมดาได้
ระยะโรค
การแบ่งระยะโรคของมะเร็งกล้ามเนื้อเรียบมดลูก ใช้ตามเกณฑ์ของ International Federation of Gynecology and Obstetrics (FIGO) ปี ค.ศ.2009 ดังตาราง (6)

การรักษา
การผ่าตัดมดลูกและรังไข่ทั้งสองข้างผ่านทางหน้าท้องถือว่าเป็นการรักษามาตรฐานสำหรับมะเร็งกล้ามเนื้อมดลูก (Uterine sarcoma) แต่สำหรับการรักษามะเร็งกล้ามเนื้อเรียบมดลูก(Leiomyosarcoma)นั้น พบว่าไม่มีความจำเป็นที่ต้องผ่าตัดรังไข่ทั้งสองข้างออกในสตรีวัยก่อนหมดระดู ยกเว้นในกรณีที่พบว่ามีการลุกลามของมะเร็งเข้าสู่รังไข่ที่เห็นด้วยตาเปล่า (8) เนื่องจากมีการศึกษาพบว่าไม่มีความแตกต่างของอัตราการรอดชีวิตและการกลับเป็นซ้ำในกลุ่มผู้ป่วยที่ได้รับการผ่าตัดแบบรักษาเนื้อเยื่อรังไข่ไว้เปรียบเทียบกับกลุ่มที่ผ่าตัดรังไข่ทั้งสองข้างออก(9)
การผ่าตัดเลาะต่อมน้ำเหลืองบริเวณอุ้งเชิงกรานและบริเวณข้างหลอดเลือดแดงเอออร์ต้าร์ ไม่เป็นข้อบ่งชี้ในการรักษามะเร็งกล้ามเนื้อเรียบมดลูก เนื่องจากพบว่าการกระจายของโรคไปยังต่อมน้ำเหลืองและอวัยวะหลังเยื่อหุ้มช่องท้องพบได้น้อย ยกเว้นในกรณีที่มีรอยโรคกระจายไปยังอวัยวะนอกมดลูกที่มองเห็นด้วยตาเปล่า(8)
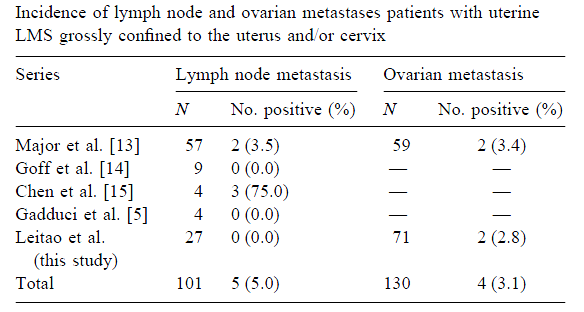
ได้มีการศึกษาถึงอัตราการแพร่กระจายของมะเร็งกล้ามเนื้อเรียบมดลูกที่ไปยังต่อมน้ำเหลืองและรังไข่ พบว่ามีอัตราการแพร่กระจายดังกล่าวน้อยมาก ดังตาราง (10)
จึงมีข้อสรุปว่า ในกรณีที่พบรอยโรคอยู่ภายในมดลูกเท่านั้น ไม่มีความจำเป็นที่จะต้องผ่าตัดเลาะต่อมน้ำเหลืองในผู้ป่วยทุกราย ยกเว้นกรณีที่พบต่อมน้ำเหลืองบริเวณใกล้เคียงมีขนาดใหญ่ สามารถผ่าตัดเลาะต่อมน้ำเหลืองเพื่อประเมินระยะโรคอย่างสมบูรณ์ สำหรับการผ่าตัดรังไข่ทั้งสองข้าง ไม่แนะนำให้ทำการผ่าตัดแบบเก็บรักษารังไข่ไว้ในผู้ป่วยที่หมดระดูแล้ว ในขณะเดียวกัน ไม่แนะนำให้ผ่าตัดรังไข่ทั้งสองข้างออกในกรณีที่รังไข่ทั้งสองข้างดูภายนอกปกติและผู้ป่วยอยู่ในช่วงวัยก่อนหมดระดู (10)
สำหรับสตรีที่มีอายุน้อย อยู่ในช่วงวัยเจริญพันธุ์ และต้องการมีบุตร หากได้รับการวินิจฉัยว่าเป็นมะเร็งกล้ามเนื้อเรียบมดลูก และวินิจฉัยแยกโรคอื่นๆที่ใกล้เคียงเช่น STUMP ออกไปแล้ว อาจต้องพิจารณาวิธีการรักษาอย่างรอบคอบและคำนึงถึงหลักจริยธรรม มีรายงานถึงการรักษาในกลุ่มผู้ป่วยดังกล่าวด้วยวิธีแบบอนุรักษ์ คือการผ่าตัดเลาะเฉพาะก้อนเนื้อมะเร็งออก ไม่ตัดมดลูกรังไข่ จากนั้นมีการตรวจติดตามอย่างใกล้ชิดทั้งการตรวจร่างกาย ตรวจภายใน เอกซ์เรย์คลื่นแม่เหล็กไฟฟ้าบริเวณอุ้งเชิงกรานและช่องท้อง พบว่าผู้ป่วยส่วนหนึ่งสามารถตั้งครรภ์และคลอดได้ตามปกติ แต่พบหนึ่งรายที่ได้รับการวินิจฉัยการกลับเป็นซ้ำของโรคขณะผ่าตัดคลอดลูกทางหน้าท้อง และเสียชีวิตในเวลาต่อมา จึงมีการแนะนำให้พิจารณาแนวทางการรักษาในกลุ่มสตรีที่อยู่ในช่วงวัยเจริญพันธุ์และต้องการมีบุตรว่า อาจจะสามารถให้การรักษาแบบอนุรักษ์ได้เป็นรายๆไป และต้องดูแลรักษาติดตามการกลับเป็นซ้ำของโรคอย่างระมัดระวัง (8)
การฉายแสง พบว่าเป็นการรักษาเพิ่มเติมที่มีประโยชน์หลังผ่าตัดสำหรับมะเร็งกล้ามเนื้อมดลูก เนื่องจากมีการศึกษาพบว่าช่วยลดอัตราการกลับเป็นซ้ำเฉพาะที่ของโรคถึงแม้จะไม่ได้เพิ่มอัตราการรอดชีวิตก็ตาม(8,9) แต่สำหรับโรคมะเร็งกล้ามเนื้อเรียบมดลูกยังไม่มีการสรุปที่แน่ชัด เนื่องจากมีการศึกษาพบว่าการรักษาเพิ่มเติมด้วยการฉายแสงไม่มีความแตกต่างทั้งอัตราการกลับเป็นซ้ำเฉพาะที่และอัตราการรอดชีวิต(9)
เคมีบำบัด เป็นการรักษาเพิ่มเติมหลังการผ่าตัด เหมาะสมสำหรับผู้ป่วยที่เป็นโรคมะเร็งกล้ามเนื้อเรียบมดลูกในระยะลุกลามหรือมีการกลับเป็นซ้ำของโรค โดยยาเคมีบำบัดที่ใช้ เช่น doxorubicin หรือ docetaxel/gemcitabine เป็นต้น โดยมีการตอบสนองต่อการรักษาด้วยยาเคมีบำบัดเฉลี่ยประมาณร้อยละ 27-36 (1,11)
พยากรณ์โรค
มะเร็งกล้ามเนื้อเรียบมดลูก จัดว่าเป็นมะเร็งที่มีพยากรณ์โรคไม่ดีชนิดหนึ่ง ถึงแม้จะมีรอยโรคอยู่เฉพาะภายในโพรงมดลูก หรือถึงแม้จะได้รับการวินิจฉัยในระยะต้นของโรคก็ตาม พบการกลับเป็นซ้ำของโรคภายหลังการรักษาประมาณร้อยละ 53-71 โดยการกลับเป็นซ้ำของโรคพบบ่อยที่ปอดประมาณร้อยละ 40 และพบการกลับเป็นซ้ำของโรคบริเวณอุ้งเชิงกรานเพียงร้อยละ
13 เท่านั้น(1) มีการศึกษาในประเทศนอร์เวย์ พบว่าอัตราการรอดชีวิตภายใน 5 ปี ของผู้ป่วยที่มีรอยโรคอยู่ภายในมดลูกประมาณร้อยละ 51 ในโรคระยะที่ 1 และร้อยละ 25 ในโรคระยะที่ 2 ส่วนผู้ป่วยที่มีรอยโรคกระจายออกนอกมดลูก พบว่าทั้งหมดเสียชีวิตในเวลาต่อมา(12)
จากการศึกษาต่างๆ ยังไม่มีข้อสรุปเกี่ยวกับความสอดคล้องของอัตราการรอดชีวิต กับอายุของผู้ป่วย ระยะโรคทางคลินิก ขนาดของก้อน การมีหรือไม่มีเนื้อตายในก้อน อัตราการแบ่งตัว และความรุนแรงของการเปลี่ยนแปลงของนิวเคลียส มีการศึกษาหนึ่งพบว่า ขนาดของก้อนมะเร็ง เป็นตัวบ่งชี้ที่สำคัญสำหรับการพยากรณ์โรค(12) โดยการศึกษาดังกล่าวพบว่าผู้ป่วยจำนวน 5 ใน 8 คนที่มีขนาดก้อนมะเร็งน้อยกว่า 5 ซม. รอดชีวิตจากโรค ในขณะที่ผู้ป่วยทั้งหมดที่มีขนาดของก้อนมะเร็งที่มากกว่า 5 ซม. จะเสียชีวิตในเวลาต่อมา ในการศึกษาเดียวกันนี้ พบว่าปัจจัยอื่นที่ส่งผลต่อการพยากรณ์โรคคือ เกรดของมะเร็งและระยะโรค ขณะเดียวกันมีการศึกษาจากนอร์เวย์พบว่าเกรดของมะเร็งทางจุลชีววิทยาไม่ได้เป็นตัวบ่งชี้ของพยากรณ์โรคที่มีนัยสำคัญทางสถิติ แต่พบว่า ขนาดของก้อนมะเร็งและอัตราการแบ่งตัว เป็นตัวบ่งชี้ของพยากรณ์โรคที่สำคัญของมะเร็งกล้ามเนื้อเรียบมดลูกที่รอยโรคอยู่ภายในตัวมดลูก(12) นอกจากนี้ยังมีปัจจัยอื่นที่อาจจะนำมาช่วยในการทำนายพยากรณ์โรคคือ p53, p16, Ki 67, และ Bcl-2 เป็นต้น
References
- D’Angelo E, Prat J.Uterine sarcoma:a review.Gynecol Oncol. 2010 Jan;116(1):131-9.
- Zaloudek C, Hendrickson MR. Mesenchymal tumors of the uterus.In: Kurman RJ, editor. Blaustein’s pathology of the female genitaltract. New York: Springer-Verlag, Inc.; 2002. p. 561–615.
- Leibsohn S, d’Ablaing G, Mishell Jr DR, Schlaerth JB. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. Am J Obstet Gynecol 1990;162:968–76.
- Perri T, Korach J, Sadetzki S, Oberman B, Fridman E, Ben-Baruch G. Uterine leiomyosarcoma: does the primary surgical procedure matter. Int J Gynecol Cancer 2009;19:257–60.
- Tavassoli FA, Devilee P, editors. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. IARC Press: Lyon; 2003.
- FIGO staging for uterine sarcomas. Int J Gynaecol Obstet 2009;104:179.
- Bell SW, Kempson RL, Hendrickson MR. Problematic uterine smooth muscle neoplasm. A clinicopathologic study of 213 case. Am J Surg Pathol 1994;18:535-58.
- Gadducci A, et al.The management of patient with uterine sarcoma: a debated clinical challenge. Crit Rev Oncol Hematol.2008 Feb;65(2):129-42.Eup 2007 Aug 13.
- Giuntoli 2nd RL, Metzinger DS, DiMarco CS, et al. Retrospective review of 208 patients with leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy. Gynecol Oncol 2003;89:460–9.
- Leitoa MM ,et al. Incidence of lymph node and ovarian metastases in leiomyosarcoma of the uterus. Gynecol Oncol. 2003;91(1):209.
- Hensley ML, Ishill N, Soslow R, Larkin J, Abu-Rustum N, Sabbatini P, et al. Adjuvant gemcitabine plus docetaxel for completely resected stages I-IV high grade uterine leiomyosarcoma: results of a prospective study. Gynecol Oncol 2009;112:563–7.
- Abeler VM, Royne O, Thoresen S, Danielsen HE, Nesland JM, Kristensen GB. Uterine sarcomas in Norway. A histopathological and prognostic survey of a total population from 1970 to 2000 including 419 patients. Histopathology 2009;54:355–64.


