ภาวะโปรแลคตินในเลือดสูง (Hyperprolactinemia)
นพ. พิชญ์ จันทร์ดียิ่ง
อ.พ.ญ. ทวิวัน พันธศรี
ภาวะระดับโปรแลคตินสูง (Hyperprolactinemia) คือ ภาวะที่พบความผิดปกติของระดับโปรแลคตินในเลือด (ค่าปกติ น้อยกว่า 25 mcg/L ในผู้หญิง และ 20 mcg/L ในผู้ชาย)1 สามารถพบได้ในทุกช่วงอายุ อุบัติการณ์ (prevalence) พบได้ร้อยละ 0.4 ในประชากรปกติ ร้อยละ 9-17 ในผู้ป่วยที่มีปัญหาความผิดปกติของประจำเดือน 2,3,4 และสูงถึง ร้อยละ 30-40 ของผู้ป่วยภาวะมีบุตรยาก5 หากศึกษาในกลุ่มผู้ป่วยที่มีปัญหาไม่ตกไข่ พบอุบัติการณ์ของภาวะระดับโปรแลคตินสูง ร้อยละ 15 และ สูงถึง ร้อยละ 43 ในกลุ่มที่อาการน้ำนมไหล (galactorrhea) ร่วมด้วย4 แต่อย่างไรก็ตามอุบัติการณ์เกิดที่แท้จริงอาจจะยากที่จะศึกษาเนื่องจากผู้ป่วยหลายคนไม่มีอาการแสดง (asymptomatic) 6
โปรแลคติน (Prolactin;PRL) เป็น single-chain peptide hormone1 ประกอบด้วย อะมิโน แอซิด(amino acid) 199 ตัว ยีนบนโครโมโซม คู่ที่ 6 ทำหน้าที่ควบคุมการสร้างสารโปรแลคติน ในภาวะปกติ(basal state) โปรแลคตินสามารถแบ่งออกได้ 3 รูปแบบ คือ monomer(little prolactin,23 kDa) เป็นรูปแบบที่พบได้มากสุด พบประมาณ ร้อยละ 85 และ มีประสิทธิภาพในการออกฤทธิ์มากสุด ,dimer(big prolactin,50 kDa) พบประมาณร้อยละ 5-10 และ multimeric(big-big prolactin, ,มากกว่า 100 kDa) เป็นต้น7,8 dimer และ multimeric prolactin สามารถเปลี่ยนเป็น monomeric prolactin ได้โดยการสลาย disulfide bond หากพบปริมาณของโปรแลคตินที่น้ำหนักมากกว่า 100 kDa เป็นส่วนใหญ่ เรียกว่า macroprolactinemia นอกจากนี้โปรแลคตินยังมีความคล้ายคลึงกับ growth hormone และ placental lactogen โดยพบว่ามีลำดับของอะมิโน แอซิค ที่เหมือนกัน ร้อยละ 16 และ 13 ตามลำดับ หน้าที่ของโปรแลคตินมีหลายอย่าง ได้แก่ lactation(หน้าที่หลัก), luteal function, reproductive behavior และ การแข็งตัวของเลือด เป็นต้น
การหลั่งโปรแลคตินจะถูกหลั่งจาก lactotroph cell ของ ต่อมใต้สมอง 1,9 และถูกควบคุมจากฮอร์โมนจากต่อมใต้สมอง(hypothalamus) โดยสารที่มีบทบาทคือ hypothalamic-releasing factor หลักฐานหลายแนวทางสนับสนุนว่า Dopamine เป็น primary prolactin inhibiting factor ซึ่งถูกหลั่งโดย tuberoinfundibular dopaminergic neuron เข้าไปยัง portal hypophyseal vessel ไปออกฤทธิ์กับตัวรับของ dopamine ที่ต่อมใต้สมอง นอกจากนี้ thyrotrophin-releasing hormone (TRH), vasoactive intestinal peptide และ prolactin-releasing peptide มีบทบาทในการกระตุ้นการหลั่งโปรแลคตินเช่นกัน1
ดังนั้นหากการหลั่งสาร dopamine จาก ต่อมใต้สมอง(hypothalamus)ไปยัง ต่อมใต้สมองส่วนหน้า ถูกขัดขวาง เช่น จาก ก้อนเนื้องอก ยาบางชนิด หรือ การตัดก้านต่อมใต้สมองออก เป็นต้น ย่อมส่งผลทำให้ระดับ prolactin สูงขึ้น จนเกิดภาวะ hyperprolactinemia ได้ในที่สุด
สาเหตุของภาวะโปรแลคตินสูง
สาเหตุของภาวะโปรแลคตินสูงมีหลายสาเหตุ ทั้งจาก physiologic และ pathologic problem ดังตารางที่ 1
ตัวอย่างสาเหตุของภาวะระดับโปรแลคตินสูง
1. Pituitary tumor
สามารถแบ่งประเภทได้หลายวิธี เช่น ตามขนาด หรือ ตามตามการสร้างฮอร์โมน เป็นต้น เนื้องอกของต่อมใต้สมองสามารถสร้างฮอร์โมนโปรแลคตินเรียกว่า prolactinoma พบได้บ่อยที่สุดในผู้ป่วยภาวะระดับโปรแลคตินสูงถาวร(persistent hyperprolactinemia) อุบัติการณ์ ประมาณร้อยละ 25-30ของกลุ่ม functioning pituitary tumor นอกจากนี้ยังเป็นส่วนหนึ่งของกลุ่มโรค multiple endocrine neoplasia syndrome type 1(MEN-1) ด้วย 10 หากแบ่งเนื้องอกต่อมใต้สมองตามขนาด แบ่งออกเป็น 2 ชนิดตามขนาด คือ
1.1 Microadenoma
เป็น monoclonal in origin ขนาดเส้นผ่านศูนย์กลางของก้อนเนื้องอกน้อยกว่า 10 มิลลิเมตร เกิดจากกลไกการยับยั้งการเพิ่มจำนวนของเซลล์ที่ต่อมใต้สมองผิดปกติ ทำให้เกิดการสร้างและหลั่งฮอร์โมน รวมถึงการเพิ่มจำนวนของเซลล์ ซึ่งเป็นสาเหตุให้เกิดก้อนเนื้องอก นอกจากนี้ปัจจัยทางกายวิภาคที่ส่งผลต่อการเกิดเนื้องอก เช่น การลดความเข้มข้นของสารโดปามีน(dopamine)ใน hypophyseal portal system และ/หรือ vasucular isolation ของก้อนเนื้องอก เป็นต้น ส่วนใหญ่ microadenoma สามารถลดขนาดและหายไปได้เอง มีส่วนน้อยมากที่โตขึ้นกลายเป็น macaroadenoma มีการศึกษาในผู้ป่วย microadenoma ที่ไม่ได้รับการรักษาพบว่า โอกาสโตขึ้นกลายเป็น macroadenoma ประมาณร้อยละ 7
1.2 Macroadenoma
ก้อนเนื้องอกที่ขนาดเส้นผ่านศูนย์กลางของมากกว่าหรือเท่ากับ 10 มิลลิเมตร กลไกการเกิดเช่นเดียวกับ microadenoma
2. Idiopathatic hyperprolactiemia
ภาวะระดับโปรแลคตินสูงที่ไม่พบสาเหตุ พบได้ประมาณร้อยละ 30-40 ของกลุ่มที่ไม่มีความผิดปกติทางกายวิภาค(hypothalamic pituitary anatomy) โดยประมาณร้อยละ 10 ตรวจพบว่าเป็น microprolactinoma ที่ไม่พบในช่วงแรกจากภาพทางรังสี และประมาณร้อยละ 33 ของผู้ป่วยกลุ่มนี้ระดับโปรแลคตินกลับสู่ปกติเอง ในขณะที่เหลือยังคงพบระดับโปรแลคตินสูง 11
3. Iatrogenic hyperprolactinemia
สาเหตุในกลุ่มนี้ส่วนใหญ่คือ ยา (drug induced hyperprolactinemia ) เช่น ยากลุ่มยาต้านซึมเศร้า ยารักษาทางโรคจิตเวช ยาป้องกันอาเจียน และ ยาลดความดัน เป็นต้น ดังตารางที่ 1
4. Other cause
มักสัมพันธ์กับโรคประจำตัว เช่น โรคไทรอยด์พร่อง(hypothyroidism) จากการเพิ่มการหลั่ง TRH , โรคไตวาย(renal failure) และ โรคตับวาย(hepatic failure) จากการลดการกำจัดโปรแลคติน และ โรคถุงน้ำรังไข่(PCOS) จากการเพิ่มการสร้างโปรแลคติน เป็นต้น
อาการของภาวะระดับโปรแลคตินสูง (Clinical manifestation)
อาการจากระดับโปรแลคตินที่สูงในเลือด มักจะพบในผู้หญิงวัยก่อนหมดระดู (premenopausal women) และผู้ชาย แต่ไม่ค่อยพบในผู้หญิงวัยหลังหมดระดู (postmenopause women) ผลจากภาวะนี้ส่งผลต่อกระตุ้นการสร้างและหลั่งน้ำนมแล้วยังส่งผลต่อการทำงานของระบบสืบพันธุ์ (gonadal function)12,13 ทำให้เกิดภาวะรังไข่ทำงานบกพร่อง(hypogonadism) กล่าวคือ ระดับโปรแลคตินที่สูงจะรบกวนการหลั่งของ GnRH (gonadoytrophin-releasing hormone) , ยับยั้งการหลั่ง FSH และ LH นอกจากนี้ยังส่งผลต่อโดยตรงต่อกระบวนการ gonadal steroidogenesis บกพร่อง เป็นต้น 1,12 ส่งผลให้เกิดภาวะ anovulation โดยความรุนแรงของอาการแปรผันโดยตรงกับระดับโปรแลคติน กล่าวคือ ในรายที่มีระดับโปรแลคตินที่สูงมาก ส่งผลให้เกิดความผิดปกติของประจำเดือน และน้ำนมไหล ในขณะที่ระดับโปรแลคตินที่สูงเล็กน้อย สัมพันธ์กับ ภาวะ short luteal phase, ความต้องการทางเพศลดลง(decrease libido) และ ภาวะมีบุตรยาก เป็นต้น
ระดับเอสโตเจนที่ต่ำลง จากภาวะ hypogonadism ทำให้มวลกระดูกน้อยลงโดยเฉพาะส่วน trabecular bone13 อาจทำให้เกิดกระดูกบางตามมา(osteopenia) และเพิ่มความเสี่ยงต่อโรคกระดูกพรุน 4.5 เท่า14 แม้ภายหลังการรักษาจนระดับเอสโตเจนและโปรแลคตินกลับคืนสู่ระดับปกติจะช่วยเพิ่มมวลกระดูกได้ แต่ไม่เท่าระดับปกติ12
ในกรณีที่สาเหตุของภาวะโปรแลคตินสูงเกิดจากก้อนเนื้องอกที่ต่อมใต้สมอง มักส่งผลต่อระบบประสาทจากที่กดเบียดของก้อนเนื้องอกขนาดใหญ่ขึ้น เช่น ปวดศีรษะ การมองเห็นบกพร่องเพียงเล็กน้อย หรือ ตาบอด เป็นต้น12
จากการศึกษาในปี 2005 ของ Aykut และคณะ15 โดยทำการรวบรวมข้อมูลจากผู้ป่วยระดับโปรแลคตินสูง จำนวน 104 คน พบว่าอาการที่พบบ่อยที่สุด คือ Infertility(ร้อยละ 48) และ oligomenorrhea(ร้อยละ 29) galactorrhea (ร้อยละ 24) และ visual change(ร้อยละ 13)
ในผู้ชาย ภาวะนี้ส่งผลให้เกิด hypogonadotropic hypogonadism จะมีอาการ เช่น ความต้องการทางเพศลดลง, มีบุตรยาก ,เสื่อมสมรรถภาพทางเพศ และ มีเต้านม(gynecomastia) เป็นต้น นอกจากนี้มักพบอาการผิดปกติทางระบบประสาทจาการโตของเนื้องอก12 ในขณะที่เรื่อง galactorrhea พบได้ค่อนข้างน้อย เนื่องจากเนื่อเยื่อเต้านมของผู้ชายไม่ได้ถูกกระตุ้นจากฮอร์โมนเอสโตเจนและโปรเจสเทอโรน ความไวต่อโปรแลคตินจึงน้อย
ในวัยหลังหมดประจำเดือน ระดับโปรแลคตินไม่ได้ทำให้เกิดการเปลี่ยนแปลงมากนัก เนื่องจากฮอร์โมนมันอยู่ในระดับต่ำ แต่อาจพบการโตขึ้นของก้อนเนื้องอกบริเวณต่อมใต้สมองส่งผลให้เกิดอาการทางระบบประสาทและการมองเห็นได้ดังที่กล่าวข้างต้น12
ตารางที่ 1 : ตารางแสดงสาเหตุของภาวะโปรแลคตินสูงในเลือด1
Stimulatory factors
- β–Endorphin
- 17β–Estradiol
- Enkephalins
- Gonadotropin–releasing hormone
- Histamine
- Serotonin
- Substance P
- Thyrotropin–releasing hormone
- Vasoactive intestinal peptide acid
Pituitary conditions
- Acromegaly
- Addison disease
- Craniopharyngioma
- Cushing syndrome
- Hypothyroidism
- Histiocytosis
- Lymphoid hypophysitis
- Metastatic tumors (especially of the lungs and breasts)
- Multiple endocrine neoplasia
- Nelson syndrome
- Pituitary adenoma (microadenoma or macroadenoma)
- Post–oral contraception
- Sarcoidosis
- Thyrotropin–releasing hormone administration
- Trauma to stalk
- Tuberculosis
Inhibitory factors
- Dopamine
- γ–Aminobutyric acid
- Histidyl–proline diketopiperazine
- Pyroglutamic
Metabolic dysfunction
- Ectopic production (hypernephroma, bronchogenic sarcoma)
- Hepatic cirrhosis
- Renal failure
- Starvation refeeding
Physiologic conditions
- Anesthesia
- Empty sella syndrome
- Idiopathic
- Intercourse
- Major surgery and disorders of chest wall (burns, herpes, chest percussion)
- Newborns
- Nipple stimulation
- Pregnancy
- Postpartum (nonnursing: days 1–7; nursing: with suckling)
- Sleep
- Stress
- Postpartum
Drug conditions
- αMethyldopa
- Antidepressants (amoxapine, imipramine, amitriptyline)
- Cimetidine
- Dopamine antagonists (phenothiazines, thioxanthenes, butyrophenone, diphenylbutylpiperidine, dibenzoxazepine, dihydroindolone, procainamide, metaclopramide)
- Estrogen therapy
- Opiates
- Reserpine
- Sulpiride
- Verapamil
ในเด็กพบ prolactinoma ได้ไม่บ่อย แต่เมื่อเปรียบเทียบกับผู้ใหญ่แล้ว อัตราส่วนพบ macroadenoma สูงกว่า อาการที่พบ ได้แก่ delayed puberty, primary amenorrhea และ galactorrhea12
การวินิจฉัยภาวะโปรแลคตินสูง(diagnosis of hyperprolactinemia)
การวินิจฉัยจะพบระดับโปรแลคตินสูงกว่าค่าปกติ โดยแนะนำให้วินิจฉัยแยกโรคอื่นๆออกไป เช่น ประวัติการรับประทานยาบางชนิด โรคไทรอยด์พร่อง โรคไตวาย โรคตับวาย และ เนื้องอกของต่อมพิทูอารี เป็นต้น ดังนั้นจึงแนะนำซักประวัติ และเจาะเลือด เช่น prolactin ,TSH ,BUN, Cr, AST, ALT เป็นต้น โดยทั่วไปความถี่ของหลั่งโปรแลคตินแบบ pulsatile จะแตกต่างกันไปตามช่วงเวลา การหลั่งจะถูกออกมาเป็นช่วง กล่าวคือ ในช่วง follicular phase พบได้ 14 pulsatile/day ในขณะที่ช่วง late luteal phase จะความถี่ของการหลั่งเพียง 9 pulsatiles/day และระดับที่ต่ำที่สุดคือ ช่วงเช้า (Midmorning) ระดับโปรแลคตินจะเริ่มสูงประมาณ 1 ชั่วโมงหลังจากนอนหลับ จนสูงสุดในช่วง 5.00น.-7.00น. ในตอนเช้าจึงควรเจาะหลังตื่นนอนอย่างน้อย 1-2 ชั่วโมง12 นอกจากนี้ยังมีภาวะอื่นๆที่ส่งผลให้ระดับโปรแลคตินสูงได้ เช่น ความเครียด การเจาะเลือด9 กระตุ้นเต้านม หรือ การตรวจร่างกาย เป็นต้น ดังนั้นหากมีระดับโปรแลคตินสูงและไม่แน่ใจควรทำการตรวจซ้ำเพื่อยืนยันอีกครั้ง16 อาจตรวจในวันถัดไปร่วมกับเจาะ 2-3 ครั้ง ห่างกัน 15-20 นาทีเพื่อหลีกเลี่ยงผลกระทบจากการหลั่งโปรแลคตินในลักษณะ pulsatile12
ระดับโปรแลคตินที่สูงกว่า 500 mcg/L สามารถวินิจฉัย macroprolactinoma ได้เลย แม้ว่าระดับโปรแลคตินที่สูงมากว่า 250 mcg/L บ่งชี้ถึงสาเหตุจาก prolactinoma แต่ยาบางชนิด เช่น Risperidone และ metoclopramide อาจพบระดับโปรแลคตินที่สูงกว่า 200 mcg/L ได้ ดังนั้นนักวิจัยบางท่านแนะนำให้ส่งตรวจ MRI ในผู้ป่วยทุกราย หากระดับโปรแลคตินสูงกว่า 100 mcg/L แนวทางการวินิจฉัยระดับโปรแลคตินสูงดัง แผนภาพที่ 1
ในผู้ป่วยระดับโปรแลคตินสูงที่ไม่มีอาการ แนะนำประเมิน macroprolactin เนื่องจาก ร้อยละ 85 ของโปรแลคตินในกระแสเลือด เป็น monomeric form ส่วนที่เหลือ เป็น dimer และ polymeric form macroprolactin คือ โปรแลคตินที่จับอยู่กับ Antiprolactin autoantibody(IgG) โดยระดับโปรแลคตินที่สูงขึ้นเป็นผลจากการลดความสามารถในการกำจัด macroprolactin เรียกว่า pseudo-hyperprolactinemia12 การตรวจวัดระดับโปรแลคตินหลายๆวิธีไม่สามารถใช้ได้ ดังนั้นผู้ทำการส่งตรวจจำเป็นต้องทราบลักษณะวิธีของการตรวจวัดระดับโปรแลคตินที่มี โดยการตรวจด้วยวิธี Polyethylene glycol precipitation สามารถใช้ได้และราคาไม่แพง(most practical method) และการวินิจฉัยนี้จะสามารถช่วยลดการส่งตรวจและการรักษาที่ไม่จำเป็นได้ เพื่อหลีกเลี่ยงความผิดพลาด การอาศัยเพียงอาการเพียงอย่างเดียวไม่สามารถใช้แยก hyperprolactinemia กับ macroprolactinemia ได้ การตรวจ ด้วยgel-filtration chromatography เป็น gold standard method ที่ใช้ในการยืนยันผลการตรวจได้แต่ราคาค่อนข้างแพง และใช้ระยะเวลานาน 17
ปรากฏการณ์ฮุค(hook effect) พบในรายที่ระดับโปรแลคตินกับอาการทางคลินิกไม่สัมพันธ์กัน คือในผู้ป่วย macroadenoma ที่พบระดับโปรแลคตินปกติ หรือสูงเล็กน้อย อธิบายจากความเข้มข้นของโปรแลคตินสูงมากเกินไปทำให้เกิดการอิ่มตัวของแอนตี้บอดี้จากการจับกับโปรแลคตินใน immunoradiometric assay ทำให้ค่าโปรแลคตินที่น้อยกว่าความเป็นจริง สามารถตรวจยืนยันได้โดยการเจือจางซีรัม 1:100 เพื่อกำจัด unbound form ของโปรแลคตินที่มากเกินไป12
นอกจากนี้ยังมีอีกหลายวิธีการตรวจเกี่ยวกับการหลั่งโปรแลคติน (dynamic tests for prolactin secretion)เช่น การให้ TRH, nomifensine, domperidone, insulin-induced hypoglycaemia เป็นต้น แต่ไม่ได้ดีไปกว่าการตรวจระดับโปรแลคติน
การรักษาภาวะโปรแลคตินสูง(Management of hyperprolactinemia)
การรักษาภาวะโปรแลคตินสูง สามารถแบ่งการรักษาออกตามสาเหตุ โดยแบ่งออกได้ดังนี้ คือ
1. กลุ่มที่มีสาเหตุจากก้อนเนื้องอก (Pituitary adenoma cause)
1.1 Microadenoma
เป้าหมายหลักในการรักษา คือ ฟื้นฟูการทำงานของ gonadal และ sexual function จากการลดระดับโปรแลคตินสู่ภาวะปกติ
1.1.1การรักษาเชิงอนุรักษ์ (Expectant management)
พิจารณาในกรณีผู้ป่วยที่ไม่ต้องการมีบุตร โดยประจำเดือนมาปกติ และ ไม่มีอาการผิดปกติจากก้อนเนื้องอกที่โตขึ้น การตรวจติดตามอาศัยระดับโปรแลคติน และ การตรวจเอกซเรย์คอมพิวเตอร์ โดยพิจารณาทำซ้ำภายใน 12 เดือน หากระดับโปรแลคตินไม่เปลี่ยนแปลง การตรวจติดตามสามารถห่างออกได้
1.1.2 การรักษาด้วยยา (Medical treatment)
ยาที่ใช้ในการรักษาแบ่งออกเป็น 2 กลุ่ม คือ
• Ergot alkaloid derivative agent ได้แก่ Bromocriptine , carbergoline และ Pergoline เป็นต้น ผลข้างเคียงจากยาก ได้แก่ คลื่นไส้ อาเจียน ปวดศีรษะ ความดันต่ำ เวียนศีรษะ อ่อนเพลีย คัดจมูม ซึม และ ท้องผูก เป็นต้น ควรระวังในผู้ป่วยโรคตับเนื่องจากยาถูกขับออกผ่านทางน้ำดี
• Non-ergot alkaloid derivative agent ได้แก่ Quinagolide เป็นต้น
1.1.2.1 Bromocriptine
ยากลุ่ม erkot alkaloid ในปัจจุบันตาม Endocrine Society Clinical Practice Guideline แนะนำว่าการใช้ dopamine agonist คือ bromocriptine ช่วยลดระดับโปรแลคติน ลดขนาดก้อนเนื้องอก และ ฟื้นฟูระบบการทำงานของต่อมเพศ(gonadal function) ได้ จากการลดการสร้างโปรแลคติน, การสร้างสารพันธุกรรม DNA, cell multiplication เป็นต้น ระยะเวลาการออกฤทธิ์กับระดับโปรแลคตินภายในเวลา 1 ชม. และสามารถลดขนาดได้ภายใน 1-2 สัปดาห์ Half life 3.3 ชั่วโมง การออกฤทธิ์กระตุ้นผ่าน D2 type dopamine receptor ที่ lactotroph cell ของต่อมใต้สมองส่วนหน้า และยังออกฤทธิ์ทั้งยับยั้งและกระตุ้นที่ D1 type dopamine receptor ด้วย หากได้รับการรักษาอย่างน้อย 2 ปี มีระดับโปรแลคตินปกติและไม่พบเนื้องอกจากการตรวจ MRI สามารถพิจารณาหยุดยาได้
ในกลุ่มที่ไม่มีอาการไม่แนะนำให้ใช้ dopamine agonist ในการรักษา ยกเว้นกรณีมีปัญหาเรื่องขาดประจำเดือน แนะนำให้ยานี้ หรือ ยาคุมกำเนิด เพื่อรักษาอาการ
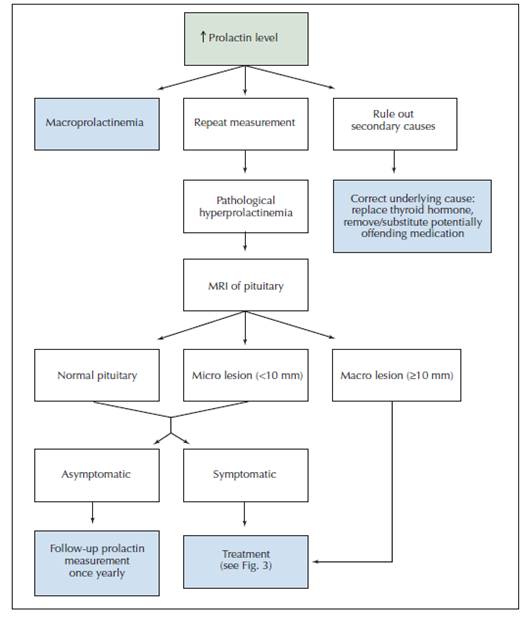
แผนภาพที่ 1 แสดงแนวทางการตรวจวินิจฉัยระดับโปรแลคตินสูงในเลือด34
1.1.2.2 Cabergoline
เป็นยากลุ่ม ergot alkaloid มี Half life ที่ค่อนข้างยาว ประมาณ 65 ชั่วโมง สามารถให้ 2 ครั้งต่อสัปดาห์ได้ เนื่องจากการออกฤทธิ์ที่นาน ส่งผลให้การกำจัดระดับยาออกเนื้อเยื่อช้าลง การจับกับตัวรับแน่น(High affinity )ที่ D2 type dopamine receptor) รวมทั้ง ที่ type 1 dopamine receptor แบบหลวม(low affinity) และ เกิดกระบวนการ enterohepatic recirculation มากขึ้น เมี่อเปรียบเทียบกับ bromocriptine สามารถลดระดับโปรแลคติน และ ขนาดก้อนเนื้องอกได้ แต่ผลข้างเคียงน้อยกว่า มีรายงานบางรายเกี่ยวกับอาการ คลื่นไส้ อาเจียน และ เวียนศีรษะ เป็นต้น นอกจากนี้ยังมีประสิทธิภาพในรายที่ไม่ตอบสนองกับการรักษาด้วย bromocriptine ด้วย18 สอดคล้องกับ การศึกษาในปี 2011 Santos และคณะ 19 ได้ศึกษาแบบ metaanalysis เปรียบเทียบระหว่างการใช้ bromoncriptine และ cabergoline พบว่า cabergoline มีประสิทธิภาพในการลดระดับโปรแลคตินสู่ภาวะปกติ และ ปรับประจำเดือนให้กลับสู่ภาวะปกติมากกว่าอย่างมีนัยสำคัญทางสถิติ และผลข้างเคียงที่น้อยกว่า
ปี 2003 Colao และคณะ 20 ได้ศึกษาเกี่ยวกับการหยุดยา cabergoline ในผู้ป่วยที่ได้รับการรักษาภาวะโปรแลคตินสูง พบว่า ร้อยละ 24 ในกลุ่ม nontumoral hyperprolactinemia , ร้อยละ 31 ในกลุ่ม microprolactinoma และ ร้อยละ36 ในกลุ่ม macroprolactinoma มีอัตราการกลับเป็นซ้ำในระยะเวลา 2-5 ปี ภายหลังการหยุดยา ซึ่งสอดคล้องกับการศึกษา ในปี 2007 ของ Colao และคณะ 21 พบว่า ร้อยละ 25.9 ในกลุ่ม nontumoral hyperprolactinemia , ร้อยละ 33.9 ในกลุ่ม microprolactinoma และ ร้อยละ 53.1 ในกลุ่ม macroprolactinoma มีอัตราการกลับเป็นซ้ำในระยะเวลา 2-8 ปี ภายหลังการหยุดยา ดังนั้นการพิจารณาหยุดยาในกลุ่ม macroadenoma ต้องระวังเพิ่มขึ้นเนื่องจากอัตราการกลับเป็นซ้ำสูง ในปี 2010 Dekkers และคณะ22 ทำการศึกษา metaanalysis เกี่ยวกับการกลับเป็นซ้ำของภาวะระดับโปรแลคตินสูงหลังจากหยุดยา dopamine agonist พบว่า มีเพียง ร้อยละ21 ของผู้ป่วยที่สามารถคงระดับโปรแลคตินปกติได้ โดยประสิทธิภาพสูงในการรักษากลุ่ม idiopathic hyperprolactinemia คือ ร้อยละ 32 เมื่อเปรียบเทียบกับกลุ่ม microprolactinoma และ macroprolactinoma คือ ร้อยละ 21 และ 16 ตามลำดับ ด้วย cabergoline อย่างน้อยเป็นเวลา 2 ปี สอดคล้องกับการศึกษา ในปี 2011 ของ Pereira 23 ดังนั้นวิธีการในการหยุดยาจำเป็นต้องทำการศึกษาต่อไป
1.1.2.3 Pergolide
เป็นยาทางเลือกอีกชนิดหนึ่งในเมื่อ bromocriptine และ cabergoline ไม่สามารถใช้ได้
1.1.2.4 Quinagolide
เป็น second generation dopamine agonist แต่แตกต่างจาก bromocriptine และ cabegoline เนื่องจากเป็นกลุ่ม non ergot derivative agent ข้อดี ที่แตกต่างจาก กลุ่ม ergot ไม่ค่อยพบผลข้างเคียง เช่น peripheral vasospasm, erythromelalgia, pleuropulmonary และ retroperitoneal fibrosis มี half life ประมาณ 22 ชั่วโมง ระยะเวลาการออกฤทธิ์ 24 ชั่วโมง ทำให้การบริหารยาง่ายขึ้น มีรายงานให้ยากลุ่มนี้ว่าการให้วันละครั้งมีประสิทธิภาพในการลดขนาดก้อนเนื้องอก และฟื้นฟูการทำงานของต่อมเพศ(gonadal function) และ ใช้ได้ดีในกลุ่มนี่ดื้อต่อการรักษาด้วย bromocriptine นอกจากนี้มีการศึกษาเพื่อเปรียบเทียบกับ cabergoline พบว่า ให้ผลเช่นเดียวกันในเรื่องการรักษาเกี่ยวกับประจำเดือนที่ผิดปกติ และ ผลข้างเคียง
รูปภาพ 3 แสดงโครงสร้างทางเคมีของยา กลุ่ม dopamine agonist
1.2 Macroadenoma
เป้าหมายหลักของการรักษา คือ การควบคุมและลดขนาดก้อนเนื้องอกเป็นสำคัญ
1.2.2 การรักษาด้วยยา (Medical treatment)
การรักษาด้วยยากลุ่ม ergot alkaloid เป็นการรักษาเริ่มต้นที่ดีที่สุด และทางเลือกที่มีประสิทธิภาพในการรักษาระยะยาว การใช้ยากลุ่มนี่สามารถระดับโปรแลคตินและขนาดก้อน
การตรวจติดตามได้โดยการตรวจ MRI และ ระดับโปรแลคติน โดยการตรวจ MRI ควรทำอีกครั้งที่ 6 เดือน และหากว่าขนาดคงที่ ควรตรวจซ้ำอีก ทุกๆปี ไปอีกหลายปี การตรวจ MRI สามารถทำเร็วขึ้นได้หากว่ามีอาการผิดปกติ หรือ อาการไม่ดีขึ้นจากการรักษา ส่วนระดับโปรแลคตินควรตรวจทุก 6 เดือน ถึงแม้ว่าระดับโปรแลคตินกลับสู่ระดับปกติ หรือ ประจำเดือนกลับมาปกติแล้ว ไม่ได้เป็นตัวบ่งชี้ว่าก้อนเนื้องอกจะตอบสนองต่อการรักษา เนื่องจากก้อนเนื้องอกสามารถโตขึ้นได้ในระดับโปรแลคตินที่ปกติ
1.2.3 การรักษาด้วยการผ่าตัด (Surgical treatment)
การผ่าตัดพิจารณาในกรณีที่ก้อนเนื้องอกไม่ตอบสนองต่อการรักษาด้วยยา หรือ การมองเห็นผิดปกติแบบถาวร (persistent visual field loss) อย่างไรก็ตามภายหลังการผ่าตัดก้อนเนื้องอกสามารถกลับเป็นซ้ำได้ค่อนข้างบ่อย แต่ในกลุ่ม macroadenoma หากมีการลุกลามเข้า cavernous sinus อาจไม่ สามารถหายจากการผ่าตัดได้ ภาวะแทรกซ้อนจากการผ่าตัด ได้แก่ carotid artery injury, diabetes inspidus, meningitis, nasal septum perforation, spinal fluid rhinorrhea, และ third nerve palsy เป็นต้น มีแนวทางการตัดได้หลายทาง เช่น endoscopic transphenoidal surgery มีการศึกษาใน ปี 2010 ของ Zhou และคณะ24 ทำการศึกษาในผู้ป่วย pituitary adenoma จำนวน 375 คน พบว่า total resection 234 คน (ร้อยละ 79.3) , subtotal resection 56 คน(ร้อยละ 19.0) , partial resection 5 คน(ร้อยละ 1.7) ไม่มีรายงานการเสียชีวิตจากการผ่าตัด ในจำนวนผู้ป่วยที่มีระดับโปรแลคตินสูงจำนวน 88 คน พบว่า 68 คน(ร้อยละ 77.3) ระดับโปรแลคตินกลับสู่ปกติ ผลข้างเคียงพบ post-op coma 1 ราย , palsy of oculomotor nerve หรือ abducen nerve 7 ราย, meningitis 3 ราย , CSF leakage 2 ราย , DI 14 ราย และ nose bleeding 6 ราย
การตรวจ MRI ซ้ำ เป็นระยะหลังจากผ่าตัดมีความสำคัญ โดยเฉพาะอย่างยิ่ง ในผู้ป่วย recurrent hyperprolactinemia
1.2.4 การรักษาด้วยรังสีรักษา (radiation therapy)
การรักษาด้วยการฉายแสงด้วยวิธีแบบเดิม คือการได้รับรังสี 5-6 สัปดาห์ ซึ่งพบว่าสามารถช่วยลดขนาดก้อนเนื้องอก และ ปริมาณโปรแลคตินได้ ผลข้างเคียงที่สำคัญ คือ คลื่นไส้อาเจียน, สูญเสียความสามารถในการรักรสและกลิ่น ,ผมร่วง, hypopituitarism , ทำลาย optic nerve และ การทำงานของระบบประสาท เป็นต้น12
นิยมใช้รักษาในกรณีการรักษาด้วยยาและผ่าตัดไม่ได้ผล หรือใช้เพื่อป้องกันการกลับเป็นซ้ำในผู้ป่วย macroadenoma ขนาดใหญ่ภายหลังทำการผ่าตัด อย่างไรก็ตามในปัจจุบันได้มีการคิดค้นวิธีการฉายแสงแบบใหม่ที่ลดทอนการได้รับรังสีของอวัยวะข้างเคียงลง แต่การศึกษาเกี่ยวกับวิธีนี้ยังจำกัด25
2 กลุ่มอื่นๆที่ไม่ใช่สาเหตุจากก้อนเนื้องอก(Non pituitary adenoma cause)
2.1 Drug-induced hyperprolactinemia9
การรักษาไม่จำเป็นในผู้ป่วยทีไม่มีอาการ แต่หากว่าพบปัญหาระยะยาวเกี่ยวกับ hypogonadism เช่น มวลกระดูกลดลง เป็นต้น ควรได้ฮอร์โมน เอสโตเจน หรือ โปรเจสเทอโรน อย่างไรก็ตามแนะนำให้หยุดยาเป็นเวลา 3 วัน หรือ เปลี่ยนไปใช้ยาอื่นแทนที่ออกฤทธิ์เหมือนกันแต่ไม่มีผลเพิ่มระดับโปรแลคติน แล้วทำการตรวจระดับโปรแลคตินอีกครั้ง การหยุดยาหรือการเปลี่ยนยา ควรได้รับการรับรองจากแพทย์ที่ดูแลผู้ป่วยก่อน หากไม่สามารถหยุดยาได้ และ ระยะเวลาการเกิดโรคพิจารณาแล้วไม่ได้สอดคล้องกับการใช้ยา แนะนำว่าควรทำการตรวจเอกซเรย์คอมพิวเตอร์ MRI เพื่อหาสาเหตุต่อไป
การให้ยากลุ่ม erkot alkaloid เช่น bromocriptine ยังคลุมเครือ บางการวิจัยพบว่าการให้ยาสามารถลดระดับโปรแลคตินสู่ระดับปกติ ได้เพียง ร้อยละ 75 และอาจกระตุ้นอาการเกี่ยวกับ psychosis ได้ ดังนั้นการให้ยาเพิ่มควรได้รับการปรึกษาจิตแพทย์ก่อน
2.2 Metabolic causes
รักษาสาเหตุของโรคทางเมตาโบลิกซ์แต่ละชนิด เช่น การให้ยาฮอร์โมนทดแทนใน hypothyroidism หรือ การเปลี่ยนถ่ายไตใน chronic renal failure เป็นต้น สามารถช่วยลดระดับโปรแลคตินได้
บรรณานุกรม
- Pier Giorgio Crosignani. Current treatment issues in female hyperprolactinaemia. European Journal of Obstetrics & Gynecology and Reproductive Biology 2006; 125:152–164.
- Dong-Yun Lee, MD, PhD; Yoon-Kyung Oh, MD; Byung-Koo Yoon, MD, PhD; DooSeok Choi, MD, PhD . Prevalence of hyperprolactinemia in adolescents and young women with menstruation-related problems. Am J Obstet Gynecol 2012;206:213.e1-5.
- Biller BM, Luciano A, Crosignani PG, et al. Guidelines for the diagnosis and treatment of hyperprolactinemia. J Reprod Med 1999;44:1075–84.
- Greer ME, Moraczewski T, Rakoff JS. Prevalence of hyperprolactinemia in anovulatory women. Obstet Gynecol 1980;56:65–9.
- G.S. Wand. Diagnosis and management of hyperprolactinemia. Endocrinologist 2003; 13(1):52–57
- Kars M, Souverein PC, Herings RM, Romijn JA, Vandenbroucke JP, de Boer A, Dekkers OM 2009 Estimated age- and sex-specific incidence and prevalence of dopamine agonist-treated hyperprolactinemia. J Clin Endocrinol Metab Aug 2009;94:2729–2734.
- H.K. Suh, A.G. Frantz, Size heterogeneity of human prolactin in plasma and pituitary extracts. J. Clin. Endocrinol. Metabol. 1974; 39:928–935. น้ำหนักโมเลกุล
- J.B. Josimovich, M.A. Lavenhar, M.M. Devanesan, H.J. Sesta, S.A. Wilchins, A.C. Smith, Heterogeneous distribution of serum prolactin values in apparently healthy young women, and the effects of oral contraceptive medication. Fertil. Steril 1987; 47:785–791.
- Shlomo Melmed, Felipe F. Casanueva, Andrew R. Hoffman, David L. Kleinberg,Victor M. Montori, Janet A. Schlechte,et al. Diagnosis and Treatment of Hyperprolactinemia: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab, February 2011, 96(2):273–288.
- Verges B., Boureille F., Goudet P., Murat A., Beckers A., Sassolas G.et al. Pituitary disease in MEN type 1 (MEN1): data from the France-Belgium MEN1 multicenter study. Journal of Clinical Endocrinology and Metabolism2002; 87:457–465
- Schlechte J, Dolan K, Sherman B, Chapler F, Luciano A. The natural history of untreated hyperprolactinemia: a prospective analysis. J Clin Endocrinol Metab 1989;68:412–8.
- Felipe F. Casanueva, Mark E. Molitch, Janet A. Schlechte, Roger Abs, Vivien Bonert, Marcello D. Bronstein, et al. Guidelines of the Pituitary Society for the diagnosis and management of prolactinomas. Clinical Endocrinology 2006; 65:265–273.
- Schlechte J, el-Khoury G, Kathol M, Walkner L. Forearm and vertebral bone mineral in treated and untreated hyperprolactinemic amenorrhea. J Clin Endocrinol Metab 1987;64:1021–6.
- Vartej P, Poiana C, Vartej I. Effects of hyperprolactinemia on osteoporotic fracture risk in premenopausal women. Gynecol Endocrinol 2001;15:43–7.
- Aykut Bayrak, M.D., Peyman Saadat, M.D., Eliran Mor, M.D., Lisa Chong, M.D., Richard J. Paulson, M.D., Rebecca Z. Sokol, M.D.Pituitary imaging is indicated for the evaluation of hyperprolactinemia. Fertility and Sterility, July 2005, 84(1):181-185.
- Sassin JF, Frantz AG, Kapen S, et al. The nocturnal rise of human prolactin is dependent on sleep. J Clin Endocrinol Metab 1973;37:436–440.
- T.P. Smith, A.M. Suliman, M.N. Fahie-Wilson et al., Gross variability in the detection of prolactin in sera containing big prolactin (macroprolactin) by commercial immunoassays. J. Clin. Endocrinol. Metabol 2002; 87: 5410–5415.
- Colao A., Di Sarno A., Sarnacchiaro F., Ferone D., Di Renzo G., Merola B., et al. Prolactinomas resistant to standard dopamine agonists respond to chronic cabergoline treatment. Journal of Clinical Endocrinology and Metabolism 1997; 82:876–883.
- Dos Santos Nunes V, El Dib R, Boguszewski CL, Nogueira CR. Cabergoline versus bromocriptine in the treatment of hyperprolactinemia: a systematic review of randomized controlled trials and meta-analysis. Pituitary. Sep 2011 ;14(3):259-65.
- Colao A, Di Sarno A, Cappabianca P, Di Somma C, Pivonello R, Lombardi G. Withdrawal of long-term cabergoline therapy for tumoral and nontumoral hyperprolactinemia. N Engl J Med. 20 Nov 2003;349(21):2023-33.
- Colao A, Di Sarno A, Guerra E, Pivonello R, Cappabianca P, Caranci F, et al. Predictors of remission of hyperprolactinaemia after long-term withdrawal of cabergoline therapy. Clin Endocrinol (Oxf). Sep 2007 ;67(3):426-33.
- Dekkers OM, Lagro J, Burman P, Jørgensen JO, Romijn JA, Pereira AM. Recurrence of hyperprolactinemia after withdrawal of dopamine agonists: systematic review and meta-analysis. J Clin Endocrinol Metab. 2010 Jan;95(1):43-51.
- Pereira AM.Update on the withdrawal of dopamine agonists in patients with hyperprolactinemia. Curr Opin Endocrinol Diabetes Obes. Aug 2011;18(4):264-8. หาตัวเต็ม
- Zhou T, Wei SB, Meng XH, Xu BN. Pure endoscopic endonasal transsphenoidal approach for 375 pituitary adenomas.Zhonghua Wai Ke Za Zhi. 1 Oct 2010;48(19):1443-6.
- Tsang RW, Brierley JD, Panzarella T, Gospodarowicz MK, Sutcliffe SB, Simpson WJ. Role of radiation therapy in clinical hormonallyactive pituitary adenomas. Radiother Oncol 1996;41:45–53.


