Surgical treatment of Endometriosis
Surgical treatment of Endometriosis
นพ.กรกช วัฒนศิริ
อ.นพ.มนัสวี มะโนปัญญา
1.นิยามของเยื่อบุโพรงมดลูกเจริญผิดที่ (Definition)
คือ การที่มีเนื้อเยื่อที่มีลักษณะเหมือนเยื่อบุโพรงมดลูก (ทั้งต่อมหรือเนื้อเยื่อ) ออกนอกมดลูก เช่นบริเวณอุ้งเชิงกราน เยื่อบุหัวใจ ปอด หรือแม้กระทั่งสมอง ซึ่งสามารถทำให้เปิดภาวะ ปวดท้องน้อย(pelvic pain) และมีบุตรยาก (Infertility)(1)
2.ระบาดวิทยา (Epidemiology)
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่สามารถเจอได้บ่อยโดยเฉพาะในผู้หญิงวัยเจริญพันธ์ประมาณ 10 เปอร์เซ็นต์ โดยเฉพาะในผู้หญิงที่มาด้วยอาการปวดหน่วงท้องน้อยหรือมีบุตรยากสามารถพบได้ถึง 20 ถึง 90 เปอร์เซ็นต์ (1)
ปัจจัยที่ส่งเสริมให้เกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่คือ การได้รับสาร Diethylstilbetrol (DES), น้ำหนักตัวน้อยช่วงแรกเกิดและ ประจำเดือนมาเร็ว ส่วนในช่วงวัยรุ่นปัจจัยที่ส่งเสริมคือ ช่วงประจำเดือนสั้น, ดัชนีมวลกายต่ำ, มีบุตรน้อย (2) มีการศึกษาที่พบความสัมพันธ์ระหว่างภาวะเยื่อบุโพรงมดลูกเจริญผิดที่กับมะเร็งรังไข่ชนิด clear cell และ endometrioid (meta-analytic odd ratio 1.42)(3)
ปัจจัยที่ป้องกันการเกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่คือ มีบุตรหลายคน, การให้นมบุตร, ดัชนีมวลกายเพิ่ม, การรับประทานผักและผลไม้(1)
3.กลไกการเกิดโรค (Etiology)
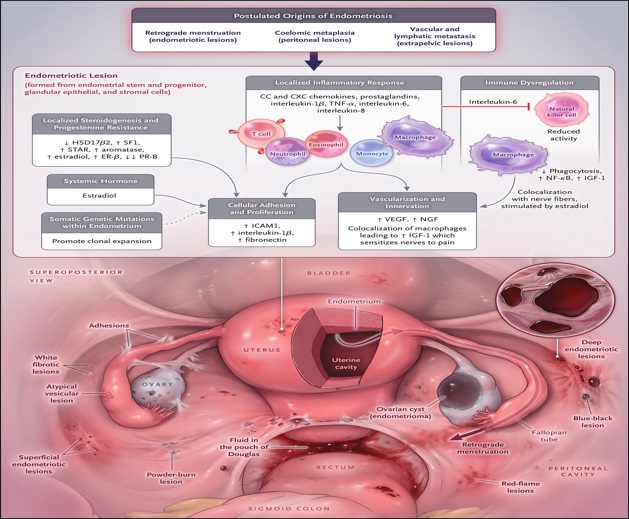
กลไกการเกิดเยื่อบุโพรงมดลูกเจริญผิดที่เกี่ยวข้องกับระบบต่อมไร้ท่อ ระบบภูมิคุ้มกัน สารก่อการอักเสบ และการก่อเกิดเส้นเลือด(Figure 1) (3) โดยมีทฤษฎีอยู่ทั้งหมด 3 ข้อ
1.Retrograde menstruation คือ การมีเศษซากของประจำเดือนที่มีเยื่อบุโพรงมดลูกอยู่ไหลย้อนกลับไปทางท่อนำไข่ไปที่อุ้งเชิงกราน(4) มีการศึกษาที่สนับสนุนทฤษฎีคือการศึกษาความเสี่ยงในการเกิดภาวะนี้จากการมีประจำเดือนสั้นและมีการอุดตันของทางเดินของประจำเดือน
2.Coelomic metaplasia คือ เป็นการที่เซลล์ที่จะพัฒนาไปเป็นเยื่อบุช่องท้องเกิดการเปลี่ยนแปลงไปเป็นต่อมของเบื่อบุโพรงมดลูก ซึ่งจะสนับสนุนทฤษฎีดีในผู้หญิงที่มีภาวะท่อมูลเลอเลียน (Mullerian duct defect)(5)
3.Lymphatic and vascular metastasis คือ การที่เซลล์ของเยื่อบุโพรงมดลูกหลุดและเคลื่อนที่ไปตามท่อน้ำเหลืองและเส้นเลือดเป็นทฤษฎีที่ถูกคิดขึ้นมาสำหรับภาวะเบื่อบุโพรงมดลูกที่เจริญนอกอุ้งเชิงกราน(6)
4.การวินิจฉัย (Diagnosis)
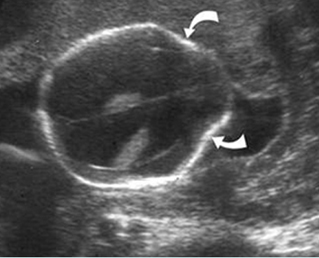
การวินิจฉัยภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ยังคงมีความยาก ยังไม่มีสารชีวะโมเลกุลที่จะบ่งชี้หรือแยกภาวะนี้ได้อย่างชัดเจน(7) โดยตำแหน่งของรอยโรคจะเด่นในช่องท้อง และขนาดค่อนข้างเล็ก จึงทำให้การมองเห็นรอยโรคโดยตรงโดยการส่องกล้อง(โดยการมีผลทางพยาธิยืนยัน)ยังคงเป็นวิธีการที่ได้มาตรฐาน(8)โดยการใช้รังสีในการวินิจฉัยยังคงพบรอยโรคได้น้อยในกรณีที่เป็นรอยโรคที่พื้นผิวผนังอุ้งเชิงกราน(9) อย่างไรก็ตาม ก้อนช๊อคโกแลตซีสส์ (Endometrioma) ยังคงสามารถที่จะพบได้โดยการอัลตร้าซาวด์ทางช่องคลอด (Transvaginal ultrasound) หรือ Magnetic resonance imaging (MRI) โดยมี Sensitivity และ Specitivity ที่ 90 เปอร์เซ็นต์(9)
5.อาการแสดงของโรค (Clinical presentation)
อาการโดยส่วนใหญ่ของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่คือ ปวดประจำเดือน (Dysmenorrhea) มีบุตรยาก (infertility) ปวดลึกๆขณะมีเพศสัมพันธ์ (Dyspareunia) หรือปวดท้องเรื้อรัง (Chronic pelvic pain) โดยอาจจะไม่มีอาการแสดงก็ได้ อาจจะสัมพันธ์กับอาการทางระบบทางเดินอาหารเช่น ปวดท้อง อาเจียนหรือ อืดท้อง
อาการปวดประจำเดือน (Dysmenorrhea) มักจะเป็นอาการสำคัญของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ โดยมักจะมีอาการปวดก่อนจะเริ่มมีประจำเดือนและปวดต่อเนื่องตลอดรอบเดือน อาการปวดจะพบได้หลายแบบแต่มักจะปวดทั้งสองข้าง โดยผู้หญิงบางคนที่มีรอยโรคใหญ่อาจจะไม่มีอาการปวดในขณะที่ผู้หญิงที่มีรอยโรคขนาดเล็กอาจจะมีอาการปวดขั้นรุนแรง โดยอาการปวดอาจจะมาจากการอักเสบบริเวณของผนังคลุมหน้าท้อง หรือการที่มีการรุกรามของรอยโรคไปที่เนื้อเยื้อข้างเคียง และรูปแบบของผังพืด
ภาวะมีบุตรยาก เมื่อรอยโรคของภาวะเยื่อบุโพรงมดลูกในระดับปานกลางถึงรุนแรงและรุกลามถึงรังไข่ จะทำให้เกิดผังพืดขึ้นบริเวณท่อนำไข่ส่งผลให้ปิดกั้นทางผ่านและการเคลื่อนตัวของไข่ ทำให้สัมพันธ์กับภาวะมีบุตรยาก
มีการศึกษาความเกี่ยวข้องการแท้งบุตรซ้ำซาก (recurrent pregnancy loss) กับภาวะเยื่อบุโพรงมดลูกเจริญผิดที่พบว่าไม่มีความสัมพันธ์กัน และการรักษาภาวะเบื่อบุโพรงมดลูกเจริญผิดที่ทั้งโดยยาหรือการผ่าตัดไม่ได้ลดภาวะแท้งบุตร(1)
5.การแบ่งระดับความรุนแรงของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่(1)
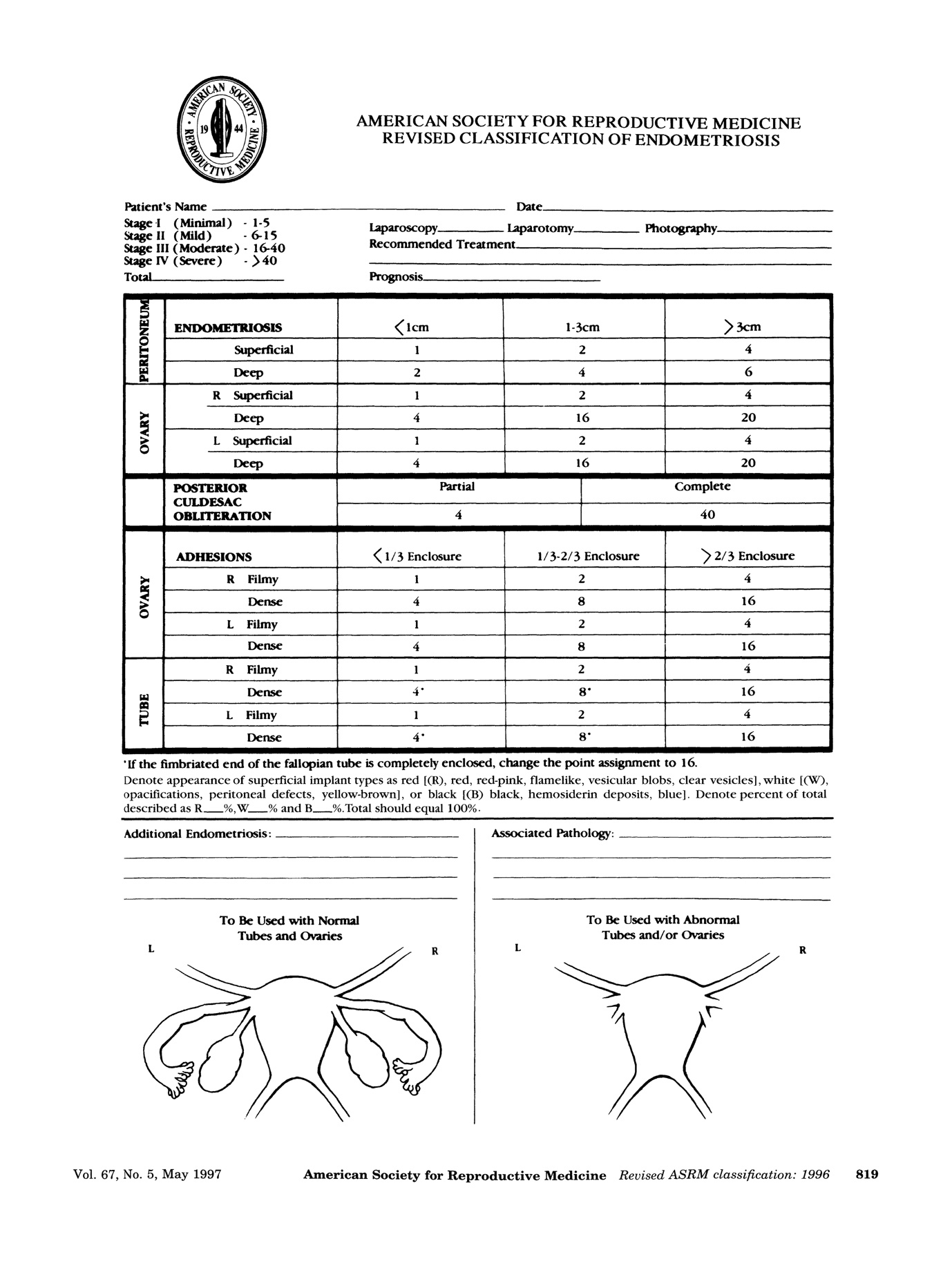
1. American Society for Reproductive Medicine staging (ASRM)
การแบ่งโดยวิธีนี้จะใช้ลักษณะของรอยโรค ขนาด และความลึกที่ฝังในเยื่อบุอุ้งเชิงกรานและรังไข่ โดยจะบรรยายลักษณะของรอยโรคเป็น สีแดง,สีขาวและสีดำ โดยการแบ่งวิธีนี้ค่อนข้างจะเป็นนามอธรรมและไม่ค่อยสัมพันธ์กับความเจ็บปวดและภาวะมีบุตรยาก
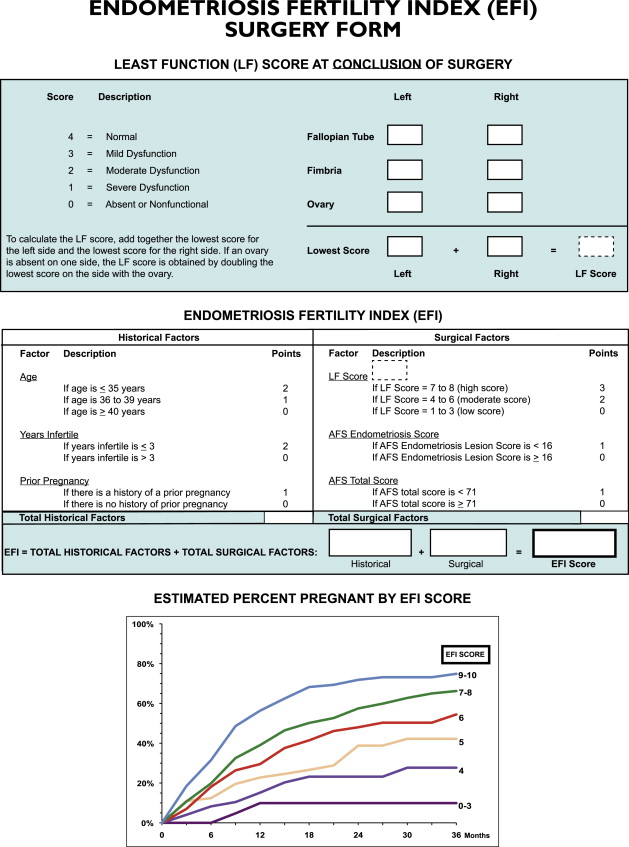
2. Endometriosis Fertility Index (EFI)
การแบ่งวิธีนี้จะช่วยทำนายความสามารถในการตั้งครรภ์โดยไม่ใช้เทคโนโลยีช่วยเจริญพันธุ์หลังจากที่ทำการรักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่แล้ว โดยจะขึ้นกับประวัติ(Historical factors)เช่น อายุ, ระยะเวลาที่เกิดภาวะมีบุตรยากและประวัติการตั้งครรภ์ ปัจจัยที่เกี่ยวข้องกับการผ่าตัด(Surgical factor)คือ คะแนนรวมของ ASRM
3. ENZIAN Classification
การแบ่งวิธีนี้จะช่วยสนับสนุนการแบ่งโดย rASRM ซึ่งจะเจาะจงไปที่ตำแหน่งและการลุกลานของรอยโรคที่ลุกลามไปถึงอุ้งเชิงกรานส่วนหลัง (Retroperitoneal structures) หรืออวัยวะอื่นๆ
6. การรักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ด้วยการผ่าตัด(Surgical Treatment)
มีวัตถุประสงค์เพื่อ
1.แก้ไขให้กายวิภาคของท่อนำไข่และรังไข่กลับมาเหมือนปกติ
2.ตัดหรือทำลายรอยโรคที่เห็นทั้งหมด
3.ป้องกันหรือชะลอการกลับเป็นซ้ำของโรค
การผ่าตัดถือเป็นการรักษาอันดับแรกในรายที่มี endometriotic cyst ที่มีขนาดเส้นผ่านศูนย์กลางมากกว่า 3 เซนติเมตร การผ่าตัดเหมาะสำหรับผู้ป่วยที่ต้องการแก้ไขภาวะมีบุตรยาก การรักษาด้วยยาสามารถรักษาอาการปวดได้ดี แต่ไม่ช่วยให้ความสามารถในการมีบุตรดีขึ้น ซึ่งการผ่าตัดนั้นจะช่วยทำให้ความสามารถในการบุตรดีขึ้นได้ และยังช่วยรักษาอาการปวดจากโรคให้ดีขึ้นด้วย ในรายที่สงสัยที่สงสัยว่ามีความรุนแรวระยะ 3-4 หรือการใช้กล้องส่องตรวจช่องท้องพบว่ามีความรุนแรงของโรคระยะนี้ ซึ่งมีกายวิภาคของระบบสืบพันธุ์ที่ผิดปกติ (Distorted reproductive anatomy) ซึ่งการรักษาด้วยยาไม่สามารถช่วยแก้ไขปัญหาทางกายวิภาคอันนี้ได้ นอกจากนี้ การผ่าตัดนั้นมักจะเป็นวิธีการรักษาในผู้ป่วยที่มีภาวะดื้อต่อฮอร์โมน (Hormone-resistant) ในการลดอาการเจ็บ(8) การผ่าตัดส่องกล้องจะเป็นที่นิยมกว่าการผ่าตัดเปิดหน้าท้องเนื่องจากประสิทธิภาพของการผ่าตัดทั้งสองวิธีเท่ากันแต่การผ่าตัดส่องกล้องจะใช้เวลาฟื้นฟูเร็วกว่า ความสวยงามมากกว่า ความเจ็บปวดหลังการผ่าตัดน้อยกว่า ลดค่าใช้จ่าย ลดภาวะแทรกซ้อนและลดผังพืดจากการผ่าตัด(10)
6.1การผ่าตัดแบบอนุรักษ์ (Conservative surgery)(1)
6.1.1 การผ่าตัดรอยโรคที่เยื่อบุช่องท้อง (Peritoneal endometriosis)
รอยโรคที่เยื่อบุช่องท้องที่ฝังตัวลึกไม่เกิน 5 มิลลิเมตร (superficial peritoneal lesion) สามารถรักษาโดยการจี้ทำลายรอยโรค (ablation) ซึ่งทำได้ด้วยการจี้ไฟฟ้า (electric cauterization) หรือยิงเลเซอร์ (laser vaporization) และการใช้กรรไกรหรือมีดไฟฟ้าตัดออก (excision) โดยยังไม่มีการศึกษาว่าวิธีการใดที่มีประสิทธิภาพมากกว่ากัน แต่การตัดรอยโรคออกมามีข้อดีที่จะได้ชิ้นเนื้อส่งตรวจเพื่อการวินิจฉัยทางพยาธิวิทยา
ในกรณีของรอยโรคที่ฝังลึกมากกว่า 5 มิลลิเมตร (deeply infiltrating endometriosis, DIE) การจี้ด้วยไฟฟ้าหรือเลเซอร์จะทำลายรอยโรคได้ไม่หมด ทำให้มีการกลับเป็นซ้ำของรอยโรคเกิดขึ้นเร็ว ควรทำการผ่าตัดออก เนื่องจากสามารถประมเนความลึกของรอยโรคได้ ในกรณีที่มีพังผืด (adhesion) จากโรคที่ทำให้กายวิภาคผิดปกติไป ควรจะตัดเอาพังผืดออกมาด้วย เนื่องจากในพังผืดมักจะมีเซลล์เยื่อบุมดลูกอยู่ภายใน
6.1.2 การผ่าตัดสำหรับรอยโรคที่เป็นถุงน้ำรังไข่ (Ovarian endometriotic cyst)
สามารถทำการผ่าตัดโดยเลาะผนังถุงน้ำออก (cystectomy) หรือทำการเจาะถุงน้ำเพื่อระบายร่วมกับการจี้ทำลายผนังถุงน้ำดานใน (drainage with ablation of the internal cyst wall) ทั้งสองวิธีจะให้ผลการรักษาในระยะแรกได้พอๆกันและมีรอยโรคเหลือน้อยกว่าการระบายอย่างเดียว (drainage alone) ในกรณี endometriotic cyst มีขนาดมากกว่า 3 เซนติเมตร หรือมี deeply infiltrating nodule ควรทำการเลาะผนังถุงน้ำและผ่าตัดเอารอยโรค DIE ออก เพื่อให้มั่นใจว่าผู้ป่วยไม่ได้เป็นเนื้องอกรังไข่ชนิดอื่นที่อาจจะเป็นมะเร็งได้ (11)การเจาะถุงน้ำเพื่อระบายร่วมกับการจี้ทำลายผนังถุงน้ำด้านใน จะช่วยอนุรักษ์เนื้อรังไข่ที่ปกติได้มากกว่า (12, 13)แต่พบการกลับเป็นซ้ำมากกว่า นอกจากนี้ยังพบว่าทำให้มีอัตราการตั้งครรภ์เอง (spontaneous pregnancy rate) สูงกว่า(14) และพบว่าการกระตุ้นไข่ด้วย gonadotropin หลังการเลาะผนังถุงน้ำยังคงได้ผลดี ดังนั้นในปัจจุบันจึงแนะนำให้ทำการเลาะถุงน้ำออก อย่าเลาะเอาเนื้อเยื่อของรังไข่ออกมา ซึ่งจะทำให้มีปริมาณสำรองของรังไข่(ovarian reserve) เหลือมากที่สุด
โดยในปี 2557 ESHRE แนะนำให้ทำการเลาะผนังถุงน้ำออก ก่อนทำ ART (assisted reproductive technology) ในรายที่มี endometriotic cyst ที่มีขนาดโตกว่า 3 เซนติเมตร เพื่อรักษาอาการปวดที่สัมพันธ์กับโรคเยื่อบุมดลูกต่างที่ (endometriosis related pain) และช่วยทำให้เก็บไข่ได้ง่ายขึ้น (accessibility of follicles) แต่ควรระวังในรายที่เคยได้รับการผ่าตัดรังไข่มาก่อนแล้ว จะทำให้ ovarian reserve ยิ่งลดลงไปอีก(8)
6.1.3 การผ่าสำหรับ deeply infiltrating endometriosis
ในรายที่โรคมีความรุนแรงในระยะที่ 3-4 มักมี DIE ที่ cul de sac และ uterosacral ligament อาจมี obliterate cul de sac แบะมีเยื่อบุมดลูกต่างที่ใน rectovaginal (RV) septum ซึ่งมีลักษณะคล้าย nodule ของ adenomyosis คือ มีกล้ามเนื้อเรียบมาก แต่มี endometrial gland และ stroma น้อยจึงไม่ค่อยตอบสนองต่อการรักษาด้วยตัวยา จำเป็นต้องทำการผ่าตัดอย่างกว้างขวาง (extensive)(15) และควรทำโดยแพทย์ผู้เชี่ยวชาญในการผ่าตัด การผ่าตัดมีภาวะแทรกซ้อนได้สูง พบภาวะแทรกซ้อนระหว่างผ่าตัด (intraoperative complication) ได้ร้อยละ 13.9 เป็นภาวะแทรกซ้อนที่รุนแรงน้อย (minor complication) ร้อยละ 9.5 และเป็นภาวะแทรกซ้อนที่รุนแรงมาก (major complication) ได้ร้อยละ 4.6(16) ก่อนทำการผ่าตัดบริเวณรอยโรคควรต้องทำการเลาะเพื่อหาท่อไตทั้งสองข้าง และกันออกไปให้ไกลจากบริเวณที่จะผ่าตัดเอาออก การผ่าตัดจะต้องเลาะแยกผนังด้านหน้าของไส้ตรงออกจากผนังด้านหลังของช่องคลอด การผ่าตัด DIE ที่ไส้ตรง ควรต้องทำร่วมกับศัลยแพทย์ที่เชี่ยวชาญการผ่าตัดผ่านกล้องส่องทางหน้าท้องเช่นกัน หรือไม่เช่นนั้นต้องทำการผ่าตัดแบบเปิดหน้าท้อง การผ่าตัดรอยโรคบริเวณลำไส้ใหญ่นี้มีความเสี่ยงที่จะเกิดการทะลุหรือรั่วของลำไส้ใหญ่ได้และมีความเสี่ยงที่จะต้องทำศัลยกรรมทำรูเปิดลำไส้ใหญ่ (colostomy) ซึ่งต้องให้ข้อมูลเรื่องนี้ต่อผู้ป่วยก่อนผ่าตัดเสมอ(17)
6.1.4 การผ่าตัดเพื่อรักษาอาการปวด
การผ่าตัดเพื่อทำลายเส้นประสาทที่รับความรู้สึกจากมดลูกและอุ้งเชิงกรานเพื่อรักษาอาการปวดระดูแบะอาการปวดท้องน้อยตรงกลางที่เกิดจากโรคเยื่อบุมดลูกต่างที่ (midline pelvic pain) มี 2 เทคนิคคือ Laparoscopic uterine nerve ablation (LUNA) และ Presacral neurectomy (PSN)
Presacral neurectomy หมายถึง การตัดเส้นประสาท. Sympathetic ของมดลูกที่ระดับ superior hypogastric plexus ส่วน LUNA จะทำลายบริเวณ mid portion ของ uterosacral ligament
ผู้ป่วยที่เหมาะสำหรับการรักษาด้วยวิธี presacral neurectomy และ LUNA ได้แก่ ผู้ป่วยที่มีอาการปวดท้องน้อยตรงกบางอย่างรุนแรง หรือมีอาการปวดระดู (dysmenorrhea) มากและไม่ตอบสนองต่อการรักษาด้วยยาหรือการผ่าตัดแบบอนุรักษ์
โดยมีการศึกษาพบว่าการทำหัตถการชนิดนี้ไม่ควรทำร่วมกับการผ่าตัดสลายเยื่อบุโพรงมดลูกเจริญผิดที่เนื่องจากไม่พบผลประโยชน์ หัตการชนิดนี้ต้องการทักษะในการผ่าตัดอย่างมาก ผลแทรกซ้อนที่เกิดขึ้นได้คือ เลือดออก(Bleeding) ท้องผูก(Constipation) ปัสสาวะเร่งด่วน (Urinary urgency) และอาการุปวดในช่วงเจ็บครรภ์คลอดระยะแรกลดลง (Less pain in first stage of labor) ในกรณีที่ผู้ป่วยต้องการทำการรักษาด้วยวิธีนี้แนะนำให้ทำเป็น presacral neurectomy(8, 18)
7.การผ่าตัดแบบถอนรากถอนโคน (Radical surgery)
ในผู้ป่วยที่มีอาการมากและไม่ต้องการมีบุตร หรือมีบุตรเพียงพอแล้ว หรือผู้ที่ได้รับการรักษาด้วยยาและการผ่าตัดแบบอนุรักษ์แล้วไม่ได้ผล จำเป็นต้องทำการผ่าตัดแบบถอนรากถอนโคน หรือ radical surgery คือการผ่าตัดมดลูก (hysterectomy) และรังไข่ทั้งสองข้างออก (bilateral salpingo-oophorectomy) รวมทั้งรอยโรคของเยื่อบุมดลูกต่างที่ที่มองเห็นทั้งหมด (all visible endometriosis lesions)(8) การผ่าตัดแบบนี้ ต้องพิจารณาและอธิบายทำความเข้าใจกับผู้ป่วยให้ดีก่อน ในรายที่ไม่มีรอยโรคที่รังไข่ อาจจะทำการตัดมดลูกเพียงอย่างเดียวก็ได้ แต่ความเสี่ยงของการกลับเป็นซ้ำของโรคจะสูงกว่ากลุ่มที่ทำการตัดรังไข่ทั้งสองข้างออกด้วยถึง 6 เท่า และมีความเสี่ยงที่จะต้องผ่าตัดซ้ำเพิ่มขึ้น 8 เท่า(19) ถ้าไม่ได้ให้การรักษาต่อด้วยฮอร์โมนในระยะยาว ผลจากการศึกษาติดตามผู้ป่วยหลังผ่าตัดในระยะยาว (long-term follow up) พบว่าในกลุ่มที่ตัดมดลูกและรังไข่ทั้งสองข้างมีอัตราการปลอดจากการผ่าตัดซ้ำ ที่ 2,5 และ 7 ปี เท่ากับร้อยละ 96, 92, และ 92 ตามลำดับ ในขณะที่กลุ่มที่ตัดมดลูกอย่างเดียวมีอัตราการปลอดจากการผ่าตัดซ้ำ ที่ 2,5, และ 7 ปีเท่ากับร้อยละ 96, 87 และ 77 ตามลำดับ ในกลุ่มที่เก็บรังไข่ไว้มีความเสี่ยงที่จะต้องผ่าตัดซ้ำสูงกว่ากลุ่มที่ผ่าตัดรังไข่ออกทั้งสองข้าง 2.44 เท่า แต่ในกลุ่มที่อายุน้อยกว่า 40 ปี พบว่าอัตราการผ่าตัดซ้ำไม่แตกต่างกันระหว่างทั้งสองกลุ่ม ดังนั้น ในกลุ่มที่อายุน้อยกว่า 40 ปี ควรพิจารณาเก็บรังไข่ที่ปกติเอาไว้ และให้การรักษาด้วยยาเพื่อป้องกันการกลับเป็นซ้ำ(20)
8.การป้องกันพังผืด (Adhesion prevention)
สำหรับการผ่าตัดแบบอนุรักษณ์ นอกจากการตัดเอารอยโรคออกหรือจี้ทำลายแล้ว การป้องกันการเกิดพังผืดภายหลังการผ่าตัดมีความสำคัญ โดยเฉพาะสำหรับการตั้งครรภ์ในอนาคต และการรักษาภาวะมีบุตรยากรวมถึงหากต้องมีการผ่าตัดในอนาคต จากการศึกษาวัสดุกันพังผืดที่ละลายได้ (absorbable adhesion barrier) ภายหลังผ่าตัดผ่านกล้องส่องทางหน้าท้องแบบอนุรักษณ์โดยใช้ Interceed ซึ่งเป็น oxidized regenerated cellulose compound วางคลุมบริเวณที่ทำผ่าตัด ในการศึกษานี้ได้ทำการส่องกล้องตรวจในช่องท้องอีกครั้งหลังผ่าตัดไป 12-14 สัปดาห์ พบว่ามีการลดการเกิดพังผืดใหม่ได้อย่างมีนัยสำคัญในกลุ่มที่ใช้ Interceed(21)
4% Icodextrin solution (Adept) เป็นสารที่เป็นของเหลวใช้เคลือบบริเวณผ่าตัดเพื่อป้องกันการเกิดพังผืดเพียงชนิดเดียวที่ได้รับการรับรองจากองค์การอาหารและยาแห่งสหรัฐอเมริกา เพื่อใช้ป้องกันการเกิดพังผืดในการผ่าตัดส่องกล้องทางหน้าท้อง จากการศึกษาแบบ RCT เปรียบเทียบการใส่ Linger lactate solution ภายหลังการผ่าตัดผ่านกล้องส่องหน้าท้องแบบอนุรักษณ์ พบว่าเมื่อทำการส่องกล้องตรวจในช่องท้องอีกครั้งหลังผ่าตัดไป 4-8 สัปดาห์ พบว่ากลุ่มที่ได้ icodextrin พบพังผืดน้อยกว่ากลุ่มที่ได้ Linger lactate solution(22)
Oriplex เป็น viscoelastic gel ใช้สำหรับป้องกันพังผืดและช่วยหยุดเลือดได้ด้วย จากการศึกษาเปรียบเทียบระหว่างการใส่และไม่ใส่ Oriplex ภายหลังการผ่าตัดผ่านกล้องส่องทางหน้าท้องแบบอนุรักษณ์ พบว่ากลุ่มที่ใส่ Oriplex มีพังผืดลดลง ในขณะที่กลุ่มที่ไม่ใส่ Oriplex มีพังผืดเพิ่มขึ้น(23)
9.ผลการประเมินการรักษาด้วยการผ่าตัด
9.1 ผลต่ออาการปวด
การผ่าตัดแบบอนุรักษณ์สามารถบรรเทาอาการปวดได้ 75-100(24) ภายหลังการผ่าตัดพบว่าผู้ป่วยร้อยละ 60-100 มีอาการปวดดีขึ้นทันที(25) การศึกษาแบบ RCT ซึ่งเปรียบเทียบผลการผ่าตัดผ่านกล้องกับการไม่ให้การรักษา หรือการผ่าตัดหลอก พบว่าภายในระยะ 6 เดือนแรกหลังผ่าตัด ร้อยละ 63-80 ของผู้ป่วยที่ได้รับการรักษาด้วยการจี้ทำลายโรค (ablation) หรือตัดรอยโรคออก (excision) มีอาการดีขึ้นหรืออาการปวดหายไป ในขณะที่ร้อยละ 23-32 ของผู้ป่วยที่ไม่ได้รับกาจี้ทำลายรอยโรคมีอาการดีขึ้น(26, 27) จากการวิเคราะห์อภิมาน (meta-analysis) 10 รายงานการศึกษาแบบ RCT (Cochrane review) ในปี พ.ศ.2557(28) พบว่าการผ่าตัดผ่านกล้องส่องหน้าท้องเพื่อทำการผ่าตัดแบบอนุรักษณ์ช่วยลดอาการปวดโดยรวม (overall pain) ได้ดีกว่าการส่องกล้องตรวจในช่องท้องเพื่อการวินิจฉัยโรคอย่างเดียว (diagnostic laparoscopy only) และพบว่าการจี้ทำลายรอยโรค หรือตัดรอยโรคออกได้พบในการรักษาอาการปวดไม่แตกต่างกัน แต่ผลการวิเคราะห์อภิมานอีกการศึกษาในปี พ.ศ.2560(29) ที่เปรียบเทียบการจี้ทำลายรอยโรคและการตัดรอยโรคออก ณ เวลา 12 เดือนหลังผ่าตัดพบว่าทั้งสองกลุ่มอาการปวดดีขึ้น
การกลับเป็นซ้ำของโรคและอาการปวดภายหลังการผ่าตัดแบบอนุรักษณ์ใกล้เคียงกับการรักษาด้วยยาโดยมีการกลับเป็นซ้ำที่ 1 ปีหลังผ่าตัดร้อยละ 10 และหลังผ่าตัด 5-7 ปีพบได้ร้อยละ 40-50 การเลาะผนังถุงน้ำออกมีผลในการบรรเทาอาการปวดในระยะยาวได้ดีกว่าการเจาะถุงน้ำเพื่อระบายร่วมกับการจี้ทำลายผนังถุงน้ำด้านใน
การตัดมดลูกและรังไข่ทั้งสองข้างมีประสิทธิภาพสูงมากในการรักษาอาการปวดที่สัมพันธ์กับโรคเยื่อบุมดลูกต่างที่ที่ได้รับการรักษาด้วยยาและการผ่าตัดแบบอนุรักษณ์ไม่ได้ผล แต่พบว่าโรคยังคงมีอยู่ได้ โดยเฉพาะรอยโรคแบบ DIE และอาจจะมีการกลับเป็นซ้ำได้ในผู้ป่วยบางราย ในรายที่ผ่าตัดทำได้ยาก อาจจะมีเนื้อเยื่อรังไข่ที่ทำงานหลงเหลืออยู่ ทำให้ผู้ป่วยยังคงมีอาการปวด เรียกว่ากลุ่มอาการ ovarian remnant (ovarian remnant syndrome)(30-32) โดยปัจจัยเสี่ยงสำหรับการคงอยู่และการกลับเป็นซ้ำของโรคและอาการปวดภายหลังการผ่าตัดมดลูกได้แก่ การเก็บรังไข่ไว้ การผ่าตัดเอารอยโรคออกไม่หมด และการให้เอสโทรเจนหลังผ่าตัด(33) โดยพบได้ร้อยละ 10 และต้องได้รับการผ่าตัดซ้ำ ร้อยละ 3.7
10.ผลต่อความสามารถในการมีบุตร
ผลของการผ่าตัดต่อความสามารถในการมีบุตรของผู้ป่วยที่มีรอยโรคระยะ 1-2 ได้มาจากการศึกษาแบบ RCT 2 การศึกษาในปี 2553 ในประเทศแคนนาดาและอิตาลี(34, 35) พบว่าช่วยเพิ่มอัตราการตั้งครรภ์ทางคลีนิค (clinical pregnancy rate) และมีรายงานการวิเคราะห์อภิมานอีกการศึกษาในปี พ.ศ.2557 พบว่าการผ่าตัดผ่านกล้องส่องทางหน้าท้อวเพื่อทำการผ่าตัดแบบอนุรักษณ์ช่วยให้อัตราการตั้งครรภ์เพิ่มขึ้น เมื่อเทียบกับการส่องกล้องตรวจในช่องท้องเพื่อการวินิจฉัยโรคอย่างเดียว สำหรับผู้ป่วยในระยะ 3-4 ไม่มีการศึกษาเปรียบเทียบประสิทธิภาพของการผ่าตัดกับการรักษาด้วยยาหรือการไม่รักษา มีเพียงรายงานผู้ป่วย (case series) พบว่า อัตราการตั้งครรภ์สะสมใน 1-3 ปีหลังการรักษาโดยการผ่าตัดประมาณร้อยละ 50 สำหรับผู้ป่วยที่มี endometriotic cyst(36) และ ประมาณร้อยละ 30 สำหรับผู้ป่วยที่มี complete cul de sac obliteration(36)
สำหรับ endometriotic cyst การเลาะผนังถุงน้ำออกมีประสิทธิภาพมากกว่าการเจาะถุงน้ำเพื่อระบายร่วมกับการจี้ทำลายผนังถุงน้ำด้านใน โดยในกลุ่มที่ทำการเลาะผนังถุงน้ำออกมีอัตราการตั้งครรภ์ร้อยละ 61 ในขณะในกลุ่มที่ที่ทำการเจาะถุงน้ำเพื่อระบายร่วมกับการจี้ทำลายผนังถุงน้ำด้านในมีอัตราการตั้งครรภ์ ร้อยละ 23(37) การใช้ adhesion barrier ไม่มีหลักฐานที่แสดงว่าสามารถเพิ่มอัตราการตั้งครรภ์หลังผ่าตัด
อ้างอิง(Reference)
1. Arne Vanhie TMDH. Berek & Novak’s Gynecology.2020 16th.
2. Kalaitzopoulos DR, Lempesis IG, Samartzis N, Kolovos G, Dedes I, Daniilidis A, et al. Leptin concentrations in endometriosis: A systematic review and meta-analysis. Journal of Reproductive Immunology. 2021;146:103338.
3. Wang C, Liang Z, Liu X, Zhang Q, Li S. The association between endometriosis, tubal ligation, hysterectomy and epithelial ovarian cancer: meta-analyses. International journal of environmental research and public health. 2016;13(11):1138.
4. Sampson JA. Peritoneal endometriosis due to menstrual dissemination of endometrial tissue into the peritoneal cavity. Am J Obstet Gynecol. 1927;14:422-69.
5. Suginami H. A reappraisal of the coelomic metaplasia theory by reviewing, endometriosis occurring in unusual sites and instances. American journal of obstetrics and gynecology. 1991;165(1):214-8.
6. Jerman LF, Hey-Cunningham AJ. The role of the lymphatic system in endometriosis: a comprehensive review of the literature. Biology of reproduction. 2015;92(3):64, 1-10.
7. Nisenblat V, Bossuyt PM, Shaikh R, Farquhar C, Jordan V, Scheffers CS, et al. Blood biomarkers for the non‐invasive diagnosis of endometriosis. Cochrane Database of Systematic Reviews. 2016(5).
8. Dunselman G, Vermeulen N, Becker C, Calhaz-Jorge C, D’Hooghe T, De Bie B, et al. ESHRE guideline: management of women with endometriosis. Human reproduction. 2014;29(3):400-12.
9. Nisenblat V, Bossuyt PM, Farquhar C, Johnson N, Hull ML. Imaging modalities for the non‐invasive diagnosis of endometriosis. Cochrane Database of Systematic Reviews. 2016(2).
10. Adamson GD, Pasta DJ. Endometriosis fertility index: the new, validated endometriosis staging system. Fertility and sterility. 2010;94(5):1609-15.
11. Kennedy S, Bergqvist A, Chapron C, D’Hooghe T, Dunselman G, Greb R, et al. ESHRE guideline for the diagnosis and treatment of endometriosis. Human reproduction. 2005;20(10):2698-704.
12. Hemmings R, Bissonnette F, Bouzayen R. Results of laparoscopic treatments of ovarian endometriomas: laparoscopic ovarian fenestration and coagulation. Fertility and sterility. 1998;70(3):527-9.
13. Donnez J, Wyns C, Nisolle M. Does ovarian surgery for endometriomas impair the ovarian response to gonadotropin? Fertility and sterility. 2001;76(4):662-5.
14. Hart RJ, Hickey M, Maouris P, Buckett W. Excisional surgery versus ablative surgery for ovarian endometriomata. Cochrane database of systematic reviews. 2008(2).
15. Donnez J, Pirard C, Smets M, Jadoul P, Squifflet J. Surgical management of endometriosis. Best practice & research Clinical obstetrics & gynaecology. 2004;18(2):329-48.
16. Kondo W, Bourdel N, Tamburro S, Cavoli D, Jardon K, Rabischong B, et al. Complications after surgery for deeply infiltrating pelvic endometriosis. BJOG: An International Journal of Obstetrics & Gynaecology. 2011;118(3):292-8.
17. Donnez J, Squifflet J. Complications, pregnancy and recurrence in a prospective series of 500 patients operated on by the shaving technique for deep rectovaginal endometriotic nodules. Human Reproduction. 2010;25(8):1949-58.
18. Latthe P, Proctor M, Farquhar C, Johnson N, Khan K. Surgical interruption of pelvic nerve pathways in dysmenorrhea: a systematic review of effectiveness. Acta obstetricia et gynecologica Scandinavica. 2007;86(1):4-15.
19. Namnoum AB, Hickman TN, Goodman SB, Gehlbach DL, Rock JA. Incidence of symptom recurrence after hysterectomy for endometriosis. Fertility and sterility. 1995;64(5):898-902.
20. Falcone T, Flyckt R. Clinical management of endometriosis. Obstetrics & Gynecology. 2018;131(3):557-71.
21. Mais V, Ajossa S, Marongiu D, Peiretti RF, Guerriero S, Melis GB. Reduction of adhesion reformation after laparoscopic endometriosis surgery: a randomized trial with an oxidized regenerated cellulose absorbable barrier. Obstetrics & Gynecology. 1995;86(4):512-5.
22. Brown CB, Luciano AA, Martin D, Peers E, Scrimgeour A, Group AARS. Adept (icodextrin 4% solution) reduces adhesions after laparoscopic surgery for adhesiolysis: a double-blind, randomized, controlled study. Fertility and sterility. 2007;88(5):1413-26.
23. Coad J, Donnez J. Clinical evaluation of endometriosis and differential response to surgical therapy with and without application of Oxiplex/AP* adhesion barrier gel. Fertility and sterility. 2007;87(3):485-9.
24. Nezhat C, Hood J, Winer W, Nexhat F, Crowgey S, Garrison C. Videolaseroscopy and laser laparoscopy in gynaecology. British journal of hospital medicine. 1987;38(3):219-24.
25. Adamson D, editor Surgical management of endometriosis. Seminars in reproductive Medicine; 2003: Copyright© 2003 by Thieme Medical Publishers, Inc., 333 Seventh Avenue, New ….
26. Schattman GL. Treatment of chronic pelvic pain in patients with endometriosis. Human Reproduction. 2002;17(4):1128-9.
27. Abbott J, Hawe J, Hunter D, Holmes M, Finn P, Garry R. Laparoscopic excision of endometriosis: a randomized, placebo-controlled trial. Fertility and sterility. 2004;82(4):878-84.
28. Juhasz-Böss I, Laschke M, Müller F, Rosenbaum P, Baum S, Solomayer E, et al. Endometriosis: survey of current diagnostic and therapeutic options and latest research work. Geburtshilfe und Frauenheilkunde. 2014;74(08):733-42.
29. Pundir J, Omanwa K, Kovoor E, Pundir V, Lancaster G, Barton-Smith P. Laparoscopic excision versus ablation for endometriosis-associated pain: an updated systematic review and meta-analysis. Journal of minimally invasive gynecology. 2017;24(5):747-56.
30. Clayton R, Hawe J, Love J, Wilkinson N, Garry R. Recurrent pain after hysterectomy and bilateral salpingo‐oophorectomy for endometriosis: evaluation of laparoscopic excision of residual endometriosis. BJOG: An International Journal of Obstetrics & Gynaecology. 1999;106(7):740-4.
31. Dmowski W, Radwanska E, Rana N. Recurrent endometriosis following hysterectomy and oophorectomy: the role of residual ovarian fragments. International Journal of Gynecology & Obstetrics. 1988;26(1):93-103.
32. Rana N, Rotman C, Hasson HM, Redwine DB, Dmowski WP. Ovarian remnant syndrome after laparoscopic hysterectomy and bilateral salpingo-oophorectomy for severe pelvic endometriosis. The Journal of the American Association of Gynecologic Laparoscopists. 1996;3(3):423-6.
33. Matorras R, Elorriaga MA, Pijoan JI, Ramón O, Rodrı́guez-Escudero FJ. Recurrence of endometriosis in women with bilateral adnexectomy (with or without total hysterectomy) who received hormone replacement therapy. Fertility and sterility. 2002;77(2):303-8.
34. Marcoux S, Maheux R, Bérubé S, Endometriosis CCGo. Laparoscopic surgery in infertile women with minimal or mild endometriosis. New England Journal of Medicine. 1997;337(4):217-22.
35. Parazzini F. Ablation of lesions or no treatment in minimal-mild endometriosis in infertile women: a randomized trial. Gruppo Italiano per lo Studio dell’Endometriosi. Human Reproduction (Oxford, England). 1999;14(5):1332-4.
36. Adamson GD, Pasta DJ. Surgical treatment of endometriosis-associated infertility: meta-analysis compared with survival analysis. American journal of obstetrics and gynecology. 1994;171(6):1488-505.
37. Vercellini P, Somigliana E, Vigano P, Abbiati A, Barbara G, Crosignani PG. Surgery for endometriosis-associated infertility: a pragmatic approach. Human Reproduction. 2009;24(2):254-69.


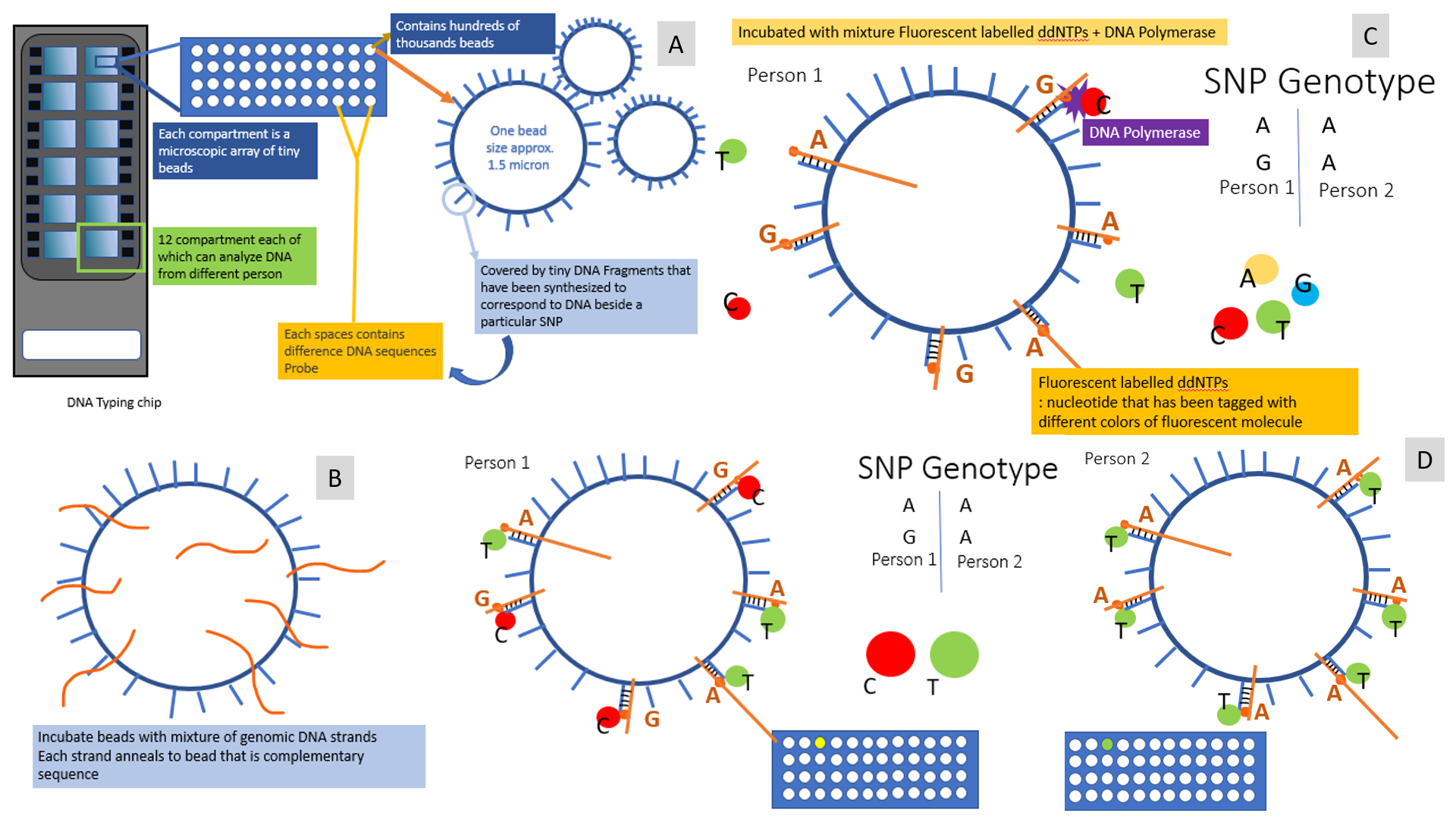
 รูปที่ 3 ภาพแสดง Chromosomal microarray analysis
รูปที่ 3 ภาพแสดง Chromosomal microarray analysis