ปัญหาทางนรีเวชที่พบบ่อยในวัยรุ่น (common gynecological problem in adolescent)
ปัญหาทางนรีเวชที่พบบ่อยในวัยรุ่น
(common gynecological problem in adolescent)
พญ.ณัฏฐา ยศชนะ
ผศ.พญ.อุษณีย์ แสนหมี่
บทนำ (1)
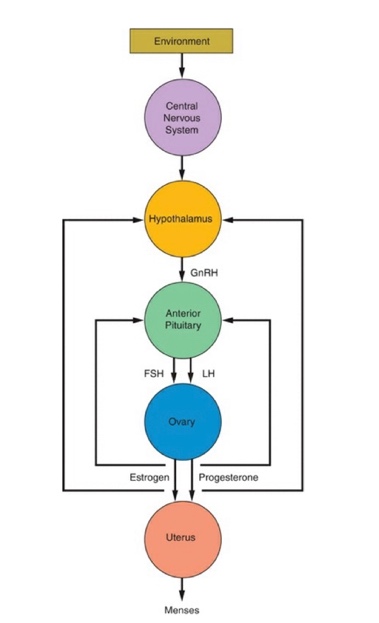
ปัญหาทางนรีเวชในวันรุ่นแตกต่างจากในสตรีวัยเจริญพันธุ์ เนื่องจากสรีรวิทยาของระบบต่อมไร้ท่อทั้งไฮโปทาลามัส ต่อมใต้สมองส่วนหน้าและรังไข่ยังทำงานไม่เต็มที่ มีโรคส่วนหนึ่งที่เกี่ยวข้องกับความผิดปกติแต่กำเนิดที่จะมีอาการแสดงหลังจากเข้าสู่วัยรุ่นเช่น ความผิดปกติแต่กำเนิดของการเจริญอวัยวะสืบพันธ์ภายในเพศหญิง การวินิจฉัยแยกโรคกลุ่มเนื้องอกรังไข่แตกต่างในสตรีวัยเจริญพันธุ์ ในขณะเดียวกันหญิงวัยรุ่นก็มีโอกาสที่จะมีพฤติกรรมทางเพศเหมือนวัยเจริญพันธุ์ได้จึงมีความเสี่ยงที่จะเกิดโรคติดต่อทางเพศสัมพันธ์ และสามารถตั้งครรภ์ได้
การซักประวัติให้ได้ถึงการวินิจฉัยโรคต้องอาศัยความละเอียดอ่อนมากกว่าในผู้ใหญ่ เนื่องจากสตรีวัยรุ่นยังมีประสบการณ์ชีวิตไม่มากพอทั้งด้านร่างกาย จิตใจ และอารมณ์ รวมถึงความสัมพันธ์ของคนในครอบครัว ในหมู่เพื่อน หรือคู่รักอาจมีผลต่อการตัดสินใจ ดังนั้นแพทย์ที่ดูแลควรจะต้องทราบถึงลักษณะที่ปกติของวัยรุ่น โรคทางนรีเวชที่พบได้บ่อยในวัยรุ่น และวิธีการซักประวัติ ตรวจร่างกาย ส่งตรวจทางห้องปฏิบัติการ เพื่อการรักษาที่ถูกต้องและเหมาะสม รวมถึงให้ข้อมูลทั้งต่อตัวผู้ป่วยเองและผู้ปกครองที่อาจมีความกังวลต่อปัญหาของผู้ป่วย
American college of obstetrics and gynecologist แนะนำให้สูตินรีแพทย์เริ่มให้ความรู้เกี่ยวกับสุขศึกษา และ เพศศึกษา การคุมกำเนิด ในสตรีวัยรุ่นตั้งแต่อายุ 13-15 ปี โดยการเข้าพบแต่ละครั้งแพทย์ควรสังเกตความสัมพันธ์ในครอบครัวจากบทสนทนา ว่าเป็นความสัมพันธ์แบบเชื่อใจ ชักนำ หรือตามใจ แพทย์ควรสร้างความสัมพันธ์ที่ดีกับตัวผู้ป่วยเพื่อให้เกิดความเชื่อถือเชื่อใจ การพูดคุยซักประวัติอาจจะเริ่มจากพูดคุยกับตัวผู้ป่วยพร้อมกับผู้ปกครองก่อน และพูดคุยกับผู้ป่วยแยกอีกครั้งเพื่อให้ได้ถึงข้อมูลที่ผู้ป่วยไม่ต้องการให้ผู้ปกครอบทราบ เช่น พฤติกรรมทางเพศ การใช้สารเสพติด เป็นต้น
มีแนวคำถามเพื่อประเมินสุขภาพวัยรุ่นด้านจิตใจ อารมณ์ และสังคม HEEADSSS assessment โดยท่าทีที่เป็นมิตรและไม่ตัดสิน แสดงดังตารางนี้


(ที่มา: องค์ความรู้การดำเนินงานดูแลสุขภาพวัยรุ่นแบบบูรณาการสำหรับทีมนักจัดการสุขภาพวัยรุ่น กระทรวงสาธารณสุข)
ปัญหาทางนรีเวชที่พบในวัยรุ่นอาจแบ่งคร่าวๆ ดังนี้ เลือดประจำเดือนผิดปกติ อาการปวดท้องน้อย ก้อนในอุ้งเชิงกราน ปัญหาของอวัยวะเพศและช่องคลอด โดยจะกล่าวต่อไป
เลือดประจำเดือนผิดปกติ (Abnormal menstrual bleeding)
ลักษณะประจำเดือนที่ปกติของสตรีวัยรุ่นแตกต่างจากสตรีวัยเจริญพันธุ์ โดยเฉพาะในช่วง 2-5 ปีแรกของการเริ่มมีประจำเดือน เนื่องจากการทำงานของระบบต่อมไร้ท่อยังพัฒนาไม่เต็มที่ มีรอบเดือนที่ไข่ไม่ตกเป็นส่วนใหญ่ ทำให้รอบประจำเดือนมาไม่สม่ำเสมอได้ รอบเดือนที่ปกติของวัยรุ่นจะอยู่ในช่วง 21-45 วัน ในขณะที่รอบเดือนปกติของสตรีวัยเจริญพันธุ์จะอยู่ในช่วง 21-38 วัน ค่าเฉลี่ยของช่วงที่ประจำเดือนมาอยู่ที่ 4.7 วัน ปริมาณประจำเดือน 35 มิลลิลิตรต่อรอบเดือน เลือดประจำเดือนส่วนใหญ่ประกอบไปด้วยเยื่อบุโพรงมดลูก
ลักษณะประจำเดือนที่ควรสงสัยว่าผิดปกติของสตรีวัยรุ่น คือระยะห่างของรอบเดือนที่มากกว่า 90 วันในช่วงปีแรกหลังจากเริ่มมีประจำเดือน และระยะห่างของรอบเดือนที่มากกว่า 42 วัน หรือน้อยกว่า 21 วัน มานานเกิน 7 วัน หลังจากที่เริ่มมีประจำเดือนครั้งแรกนาน 2 ปี
ปริมาณประจำเดือนที่มากกว่า 80 มิลลิลิตรต่อรอบเดือนถือว่าเป็นประจำเดือนที่มามากกว่าปกติ และหากประจำเดือนมามากกว่าปกติเรื้อรังจะส่งผลให้เกิดภาวะซีดได้ จึงควรหาสาเหตุและรักษาตามความเหมาะสม(2)
สาเหตุของเลือดประจำเดือนผิดปกติในสตรีวัยรุ่น
1.ภาวะไม่ตกไข่(Anovulation)
ลักษณะประจำเดือนที่ผิดปกติจากการไม่ตกไข่มักมีความถี่ที่มากขึ้น ระยะเวลาที่นานขึ้น ปริมาณที่มากขึ้น ตามหลังการขาดประจำเดือน ในรอบที่ไข่ไม่ตกนั้นจะมีการหลั่งของฮอร์โมนเอสโตรเจนอย่างต่อเนื่องโดยไม่มีฮอร์โมนโปรเจนเตอโรน(unopposed estrogen) ทำให้เยื่อบุโพรงมดลูกอยู่ในระยะ proliferative เมื่อไม่มีโปรเจสเตอโรน เยื่อบุโพรงมดลูกที่ถูกกระตุ้นด้วยเอสโตรเจนเพียงอย่างเดียวจะหนาตัว แต่มีลักษณะที่เปราะบาง มีการหลุดลอกก่อให้เกิดเลือดออกเป็นหย่อม ๆ จะให้มีเลือดออกในความถี่ที่สั้นขึ้นได้ ตามมาด้วยการหลั่ง Lysosomal enzyme จากเซลล์รอบ ๆ ก่อให้เกิดเลือดออกผิดปกติที่มีปริมาณมาก และระยะเวลานาน (3)
แม้ว่าภาวะนี้สามารถเจอได้ในช่วง 2-5 ปีแรกของการมีประจำเดือน แต่แพทย์ควรมองหาสาเหตุอื่นที่ทำให้เกิดภาวะไม่ตกไข่ซึ่งเกิดจากหลายสาเหตุ เพื่อการรักษาที่เหมาะสม ได้แก่ พฤติกรรมการกินอาหารที่ปกติที่พบได้มากในหมู่วัยรุ่น (Anorexia nervosa, Bulimia nervosa) การออกกำลังกายที่หักโหมมากเกินไป ความเครียด โรคเรื้อรัง การใช้สารเสพติด โรคทางอายุรกรรม โรคของต่อมไร้ท่อเช่นไทรอยด์ เบาหวาน ภาวะฮอร์โมนแอนโดรเจนเกิน (4)
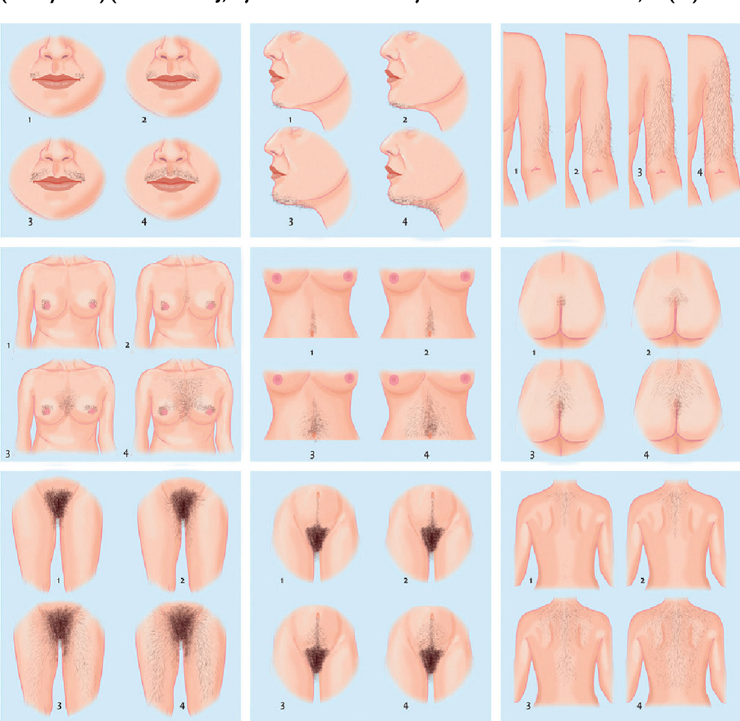
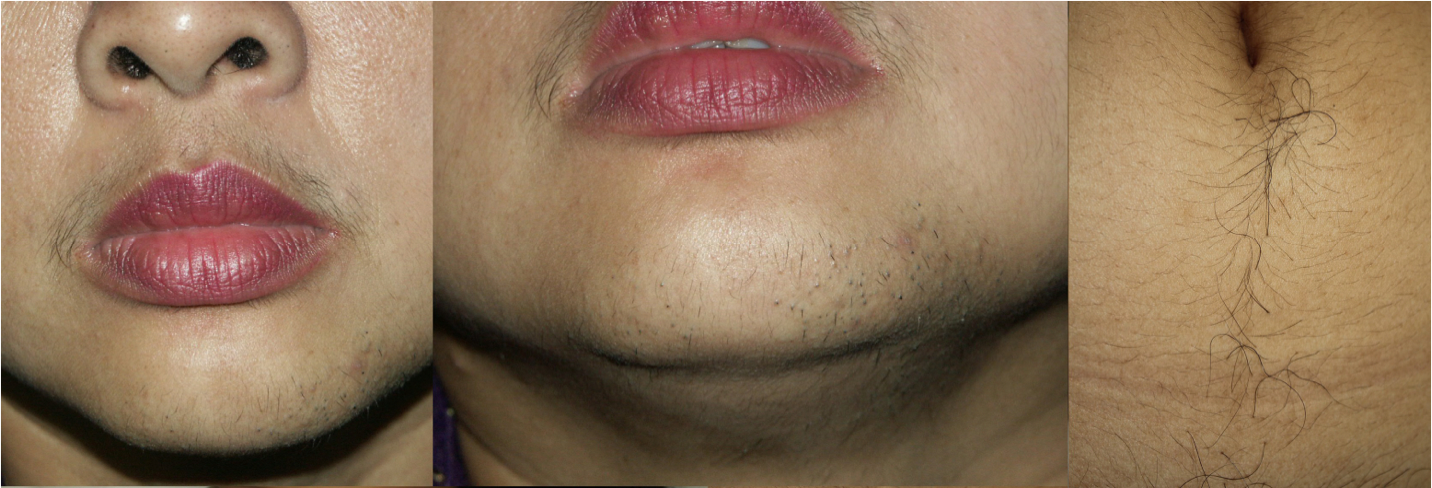
ภาวะฮอร์โมนแอนโดรเจนเกินพบใน ภาวะถุงน้ำรังไข่หลายใบ(polycystic ovary syndrome), Late onset congenital adrenal hyperplasia, เนื้องอกรังไข่และเนื้องอกต่อมหมวกไตที่ผลิตฮอร์โมนเพศชาย โดยจะมีอาการของภาวะแอนโดรเจนเกินคือ ขนดก(Hirsutism) อ้างอิงจาก Modified Ferriman-Gallway score มากกว่าหรือเท่ากับ 8 ในสหรัฐอเมริกา ส่วนในประเทศไทยถือว่ามีภาวะขนดกหากคะแนนมากกว่าเท่ากับ 3 คะแนน (5), สิว, ผิวมัน เป็นต้น ในกรณีที่มีอาการของแอนโดรเจนเกินแบบรวดเร็วร่วมกับมีภาวะ clitoromegaly หรือ มีภาวะขนดกมากควรสงสัยสาเหตุจากเนื้องอกรังไข่หรือเนื้องอกต่อมหมวกไตที่ผลิตฮอร์โมนเพศชาย (6)
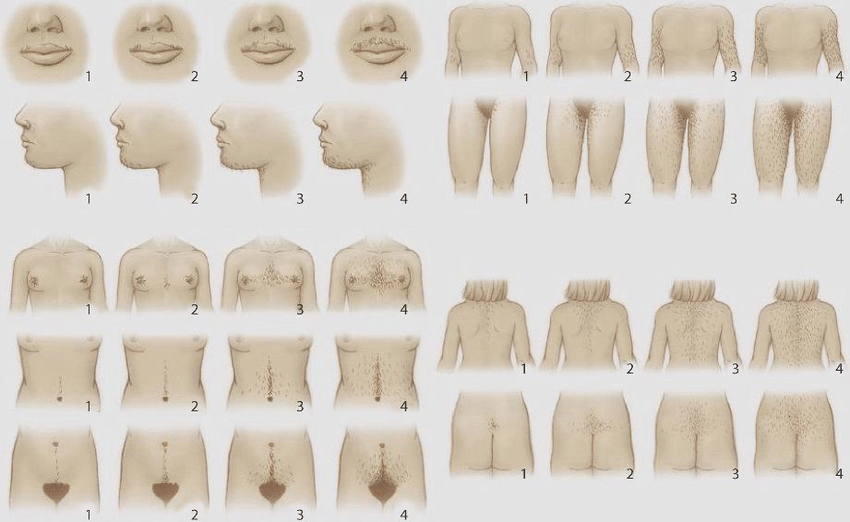
รูปที่ 1 Modified Ferriman-Gallway score (7)
2.เลือดออกผิดปกติที่เกี่ยวข้องกับการตั้งครรภ์ (Pregnancy related bleeding)
สตรีเมื่อเข้าสู่วัยรุ่นและมีการตกไข่สามารถตั้งครรภ์ได้ ดังนั้นสตรีวัยรุ่นที่มาด้วยเลือดออกผิดปกติทางช่องคลอดทุกรายควรคิดถึงภาวะเลือดออกผิดปกติที่เกิดจากการตั้งครรภ์ด้วย แพทย์ควรซักประวัติประจำเดือนครั้งล่าสุด และประจำเดือนเดือนก่อนหน้า ประวัติการมีเพศสัมพันธ์และการคุมกำเนิด ซึ่งบางครั้งสตรีวัยรุ่นอาจปกปิดประวัติเหล่านี้ได้ ดังนั้นอาจจะจำเป็นต้องตรวจปัสสาวะเพื่อยืนยันการตั้งครรภ์ในผู้ป่วยทุกรายที่มาด้วยเลือดออกผิดปกติทางช่องคลอด(1)
เมื่อวินิจฉัยได้ว่าผู้ป่วยตั้งครรภ์ ควรวินิจฉัยให้ได้ว่าเป็นการตั้งครรภ์ที่ปกติในโพรงมดลูกหรือเป็นการตั้งครรภ์ที่ผิดปกติด้วยการทำอัลตราซาวนด์ โดยโรคที่พบได้มีภาวะแท้ง ภาวะท้องนอกมดลูก ภาวะตั้งครรภ์ไข่ปลาอุก เป็นต้น (1)
3.เลือดออกผิดปกติจากการใช้ฮอร์โมน (Exogenous hormone)
เลือดออกผิดปกติทางช่องคลอดในวัยรุ่นอาจเกี่ยวข้องกับการใช้ยาฮอร์โมนในการคุมกำเนิดได้ มีรายงานว่า 30-40% มีเลือดออกผิดปกติหลังจากเริ่มกินยาคุมกำเนิดชนิดเม็ดรวมครั้งแรก และในวัยรุ่นมีโอกาสที่จะลืมกินยาคุมกำเนิดได้มากกว่าผู้ใหญ่ส่งผลให้มีเลือดออกผิดปกติได้ (8)
นอกจากนี้ฮอร์โมนคุมกำเนิดที่เป็นชนิดฮอร์โมนโปรเจสเตอรโรนอย่างเดียวทุกรูปแบบ เช่น progesterone-only pills, LNG-IUD, DMPA, Implantable contraception มีผลข้างเคียงที่สำคัญคือเลือดออกกระปริดกระปรอยทางช่องคลอด หรือในบางรายประจำเดือนไม่มาเลยภายหลังจากเริ่มใช้ฮอร์โมนคุมกำเนิดชนิดฮอร์โมนโปรเจสเตอรโรนอย่างเดียวนาน 1 ปี (9)
4.เลือดออกผิดปกติเนื่องจากมีความผิดปกติของการแข็งตัวของเลือด(Hematologic abnormalities)
ประจำเดือนที่มามากผิดปกติอาจเป็นอาการแสดงของความผิดปกติของการแข็งตัวของเลือดในวัยรุ่น(10) โรคที่พบได้บ่อยคือ Idiopathic thrombocytopenic purpura , von Willebrand disease โดยประวัติที่ต้องสงสัยโรคในกลุ่มนี้คือ มีประวัติเลือดออกง่ายหยุดยากมาก่อน มีประวัติของในครอบครัวเป็นโรค ประจำเดือนมาในปริมาณมากตั้งแต่ครั้งแรกของการมีประจำเดือน (11)
5.สาเหตุจากกายวิภาค (Anatomical cause)
โรคที่เกิดจากความผิดปกติแต่กำเนิดของมดลูกและช่องคลอด อาจจะแสดงอาการในช่วงวัยรุ่นคือ ประจำเดือนไม่มา (Amenorrhea) ประจำเดือนมาน้อย(Oligomenorrhea) เลือดเก่าๆออกกระปริดกระปรอยทางช่องคลอด ขึ้นอยู่กับความรุนแรงของการอุดกั้นของมดลูกและช่องคลอด มีอาการปวดท้องประจำเดือนมากที่เกิดจากการที่มีเลือดประจำเดือนสะสมไม่สามารถระบายออกมาได้ คลำได้ก้อนบริเวณท้องน้อยที่เกิดจากมดลูกที่มีเลือดคั่งอยู่ (hematometra) หรือช่องคลอดที่มีเลือดคั่งอยู่ (hematocolpos) (1)
การวินิจฉัยสาเหตุเลือดประจำเดือนผิดปกติในวัยรุ่น(1)
1.ซักประวัติ
ซักประวัติอาการนำ ลักษณะประจำเดือนที่ผู้ป่วยและผู้ปกครองคิดว่าผิดปกติ ระยะห่างของรอบเดือน ช่วงเวลาที่ประจำเดือนมา ปริมาณประจำเดือน ลักษณะเลือดประจำเดือน อาการซีดอ่อนเพลีย ประวัติเลือดออกง่ายหยุดยาก อาการร่วมเช่นปวดท้องประจำเดือน คลำได้ก้อน ประวัติเพศสัมพันธ์ การใช้ยาคุมกำเนิด เป็นต้น และความกังวลของผู้ป่วยและผู้ปกครอง
2.การตรวจร่างกาย
การตรวจร่างกายอย่างละเอียดตามระบบทั่วไป มองหาอาการแสดงของภาวะแอนโดรเจนเกิน เช่น สิว ผิวมัน Acanthosis nigricans การกระจายตัวของขน เนื่องจากการมีขนเยอะอาจจะเป็นสิ่งไม่พึงประสงค์มีผลต่อรูปลักษณ์และความมั่นใจของวัยรุ่นจึงต้องถามว่ามีการกำจัดขนหรือไม่
การตรวจภายในสามารถทำได้ในผู้ป่วยที่มีเพศสัมพันธ์แล้วและสงสัยพยาธิภาพบริเวณอุ้งเชิงกราน อาจไม่จำเป็นต้องตรวจในผู้ป่วยที่ปฏิเสธการมีเพศสัมพันธ์และซักประวัติเบื้องต้นแล้วคิดว่าเกิดจากภาวะไม่ตกไข่
3.การส่งตรวจทางห้องปฏิบัติการณ์
- Urine pregnancy test: ดังที่ได้กล่าวไปข้างต้นว่าสตรีวัยรุ่นที่มาด้วยเลือดออกผิดปกติควรได้รับการตรวจปัสสาวะว่าตั้งครรภ์หรือไม่เนื่องจากมีความจำเป็นในการวินิจฉัยและรักษาอย่างเหมาะสม
- Complete blood count with platelet : เจาะเลือดเพื่อประเมินความเข้มข้นของเลือดและจำนวนเกล็ดเลือด
- Coagulogram: กรณีสงสัยภาวะการแข็งตัวของเลือดผิดปกติให้ส่งตรวจดูค่าแข็งตัวของเลือด (PT, PTT, INR, von Willebrand factor)
- Iron study: หากมีภาวะซีดควรตรวจระดับธาตุเหล็กเพิ่มเติมว่ามีภาวะขาดธาตุเหล็กร่วมด้วยหรือไม่
- Work up cause of anovulation: กรณีสงสัยเลือดออกผิดปกติจากการไม่ตกไข่ ควรส่งตรวจเพิ่มเติมหาสาเหตุ เช่น pituitary hormone, thyroid function test, prolactin level, androgen level ขึ้นอยู่กับว่าประวัติอาการร่วมและตรวจร่างกายเข้าได้กับภาวะใด
4.การตรวจภาพถ่ายทางรังสี
- Ultrasonography : กรณีตรวจปัสสาวะพบว่าตั้งครรภ์ควรทำการ Ultrasound เพื่อวินิจฉัยการตั้งครรภ์ว่าเป็นการตั้งครรภ์ในโพรงมดลูก หรือการตั้งครรภ์ที่ผิดปกติ เช่นท้องนอกมดลูก หรือตั้งครรภ์ไข่ปลาอุก
- กรณีตรวจพบก้อนในอุ้งเชิงกราน การ Ultrasound จะช่วยบอกลักษณะของก้อนอวัยวะในอุ้งเชิงกรานได้ โดยเริ่มตรวจด้วย Transabdominal ultrasound ก่อน หากต้องการเห็นรายละเอียดอวัยวะอุ้งเชิงกรานให้ชัดเจนพิจารณาทำ Transvaginal ultrasound ในผู้ป่วยที่มีเพศสัมพันธ์แล้ว
- MRI: กรณีสงสัยโรคที่เกิดจากความผิดปกติแต่กำเนิดของมดลูกและช่องคลอด Ultrasound อาจให้รายละเอียดได้ไม่ชัดเจน การทำ MRI สามารถบอกตำแหน่งของความผิดปกติและความรุนแรงได้ มีประโยชน์ในการวางแผนผ่าตัดรักษาได้
การรักษาเลือดประจำเดือนผิดปกติในวัยรุ่น
การรักษาเลือดประจำเดือนผิดปกติขึ้นอยู่กับว่าสาเหตุของเลือดที่ออกผิดปกติเกิดจากสาเหตุอะไร โดยเฉพาะ เลือดออกที่เกิดจากการตั้งครรภ์ โรคทางอายุรกรรมที่ต้องรักษาเช่นไทรอยด์, ความผิดปกติของการแข็งตัวของเลือด ความผิดปกติแต่กำเนิดของมดลูกและช่องคลอด เป็นต้น
ในที่นี้จะขอกล่าวถึงการรักษาเบื้องต้นเมื่อผู้ป่วยมีอาการเลือดออกผิดปกติทางช่องคลอด ที่เกิดจากสาเหตุของภาวะไข่ไม่ตกที่เจอได้บ่อยได้วัยรุ่น และการดูแลในกรณีเลือดออกฉับพลันซึ่งเป็นหน้าที่หลักของสูตินรีแพทย์ที่ต้องประเมินและให้การรักษา
กรณีเลือดออกผิดปกติปริมาณเล็กน้อยจากภาวะไข่ไม่ตก(Anovulation: mild bleeding) หมายถึง มีเลือดออกผิดปกติรบกวนชีวิตประจำวันเล็กน้อย มีภาวะซีดเล็กน้อย การดูแลที่เหมาะสมที่สุดคือการให้คำแนะนำและติดตามผู้ป่วย ให้ผู้ป่วยจดบันทึกประจำเดือนมาให้ และให้ธาตุเหล็กทดแทน
หากติดตามผู้ป่วยแล้วไม่ดีขึ้น พิจารณารักษาด้วยฮอร์โมน
1.Low dose oral contraceptive pill
เริ่มให้ในช่วงที่ไม่ได้มีเลือดออกขณะที่ผู้ป่วยมาปรึกษา ร่วมกับประเมินแล้วว่าไม่มีข้อห้ามในการใช้ฮอร์โมนเอสโตรเจน โดยแพทย์ควรแจ้งจุดประสงค์ของการรับประทานยาคุมกำเนิดนี้เพื่อเป็นการรักษาให้ประจำเดือนมาสม่ำเสมอ และลดปริมาณประจำเดือน เนื่องจากผู้ป่วยและผู้ปกครองอาจจะมีความอึดอัดใจที่จะต้องรับประทานยาฮอร์โมนที่รู้จักกันทั่วไปว่าเป็นยาคุมกำเนิดได้ หลังจากเริ่มยาควรนัดติดตามอาการ 3-6 เดือน
ข้อดีของการรักษาด้วย Low dose oral contraceptive pill คือ นอกจากจะช่วยให้ประจำเดือนมาสม่ำเสมอและลดปริมาณประจำเดือนแล้ว ยังสามารถคุมกำเนิด เพื่อลดการตั้งครรภ์ที่ไม่พร้อมในวัยรุ่นได้ มีรายงานว่าวัยรุ่นส่วนใหญ่ที่เริ่มมีเพศสัมพันธ์ใช้ระยะเวลาหลายเดือนในการตัดสินใจคุมกำเนิด นอกจากนี้ยังมีประโยขน์อื่นๆคือ มีฤทธิ์ในการต้านฮอร์โมนเอนโดรเจนทำให้ สิว ผิวมัน ขน ลดลงได้ซึ่งมีผลดีให้ผู้ป่วยที่มีภาวะเอนโดรเจนเกิน เช่น Polycystic ovary syndrome ลดอาการปวดท้องประจำเดือนได้ และลดการเกิดมะเร็งเยื่อบุโพรงมดลูกและรังไข่ได้
2.Progestin alone
กรณีที่ผู้ป่วยและผู้ปกครองมีความกังวลในการใช้ Low dose oral contraceptive pill หรือผู้ป่วยมีข้อห้ามในการใช้ฮอร์โมนเอสโตรเจน สามารถรักษาด้วยฮอร์โมนโปรเจสเตอโรน ได้ คือ Medroxyprogesterone acetate 5-10 มิลลิกรัมต่อวัน โดยให้กิน 10-13 วันทุกๆ 1-2 เดือน เพื่อป้องกันไม่ให้เยื่อบุโพรงมดลูกหนาจากการที่ถูกกระตุ้นด้วยฮอร์โมนเอสโตรเจนเพียงอย่างเดียวและให้ประจำเดือนมาเป็นรอบๆหลังจากยาหมดในแต่ละเดือน
นอกจากยากลุ่มฮอร์โมนแล้วยังมียากลุ่มที่ไม่ใช่ฮอร์โมนที่สามารถช่วยลดปริมาณเลือดประจำเดือนได้ โดยจะใช้ยากลุ่มนี้เดี่ยวๆหรือร่วมกับฮอร์โมนได้ ขึ้นอยู่กับความรุนแรงของประจำเดือนที่มา
1. Nonsteroidal anti-inflammatory agents (NSAIDs) มีรายงานว่าสามารถช่วยลดปริมาณประจำเดือนได้มากกว่ากลุ่มยาหลอก
2. Antifibrinolytic agent คือ tranexamic acid สามารถลดปริมาณประจำเดือนได้ 30-55 % แต่ควรระวังในการให้ยากลุ่มนี้ร่วมกับฮอร์โมนเอสโตรเจนเนื่องจากจะเพิ่มความเสี่ยงของการเกิดลิ่มเลือดอุดตันได้ อาจพิจารณาให้ร่วมกันในกรณีที่การรักษาด้วยยาตัวใดตัวหนึ่งแล้วไม่ตอบสนอง (12)
กรณีเลือดออกฉับพลัน (Acute bleeding) หากขณะที่ผู้ป่วยมาปรึกษากำลังมีเลือดออกอยู่แพทย์ควรประเมินความรุนแรงของปริมาณเลือดที่ออก และสัญญาณชีพ เพื่อแบ่งผู้ป่วยออกเป็น 2 กลุ่ม คือ กลุ่มที่อาการไม่คงที่ และกลุ่มที่อาการคงที่
กลุ่มอาการไม่คงที่ ควรรักษาแบบผู้ป่วยใน
1.เริ่มจากการปฐมพยาบาลฉุกเฉิน เช่น ให้สารน้ำ ให้ออกซิเจนแก่ผู้ป่วย สาเหตุส่วนใหญ่มักเกิดจากการแข็งตัวของเลือดผิดปกติ เมื่อสามารถเปิดเส้นให้สารน้ำได้แล้วควรส่งตรวจเลือดเบื้องต้นและตรวจการแข็งตัวของเลือด ร่วมกับการเตรียมส่วนประกอบของเลือดในกรณีที่ซีดมากมีอาการอ่อนเพลียมากหรือปฐมพยาบาลเบื้องต้นด้วยสารน้ำแล้วสัญญาณชีพยังไม่คงที่ โดยพิจารณาเติมเลือดในรายที่ระดับฮีโมโกลบินน้อยกว่า 7 เพื่อลดการเติมเลือดที่ไม่จำเป็น(13)
2.การรักษาด้วยฮอร์โมนเพื่อหยุดเลือด (14)
- Conjugated estrogen 25 มิลลิกรัม ให้ทางหลอดเลือดดำทุกๆ 4-6 ชั่วโมง เป็นเวลา 24 ชั่วโมง
- High dose estrogen combine oral contraceptive pill: ให้รับประทานยาคุมกำเนิดชนิดฮอร์โมนรวมให้ได้ปริมาณฮอร์โมนเอสโตรเจน 30-50 ไมโครกรัม รับประทานทุกๆ 6-8 ชั่วโมง
การรักษาด้วยฮอร์โมนเอสโตรเจนขนาดสูงนี้อาจจะมีผลข้างเคียงคือคลื่นไส้อาเจียนมาก ผู้ป่วยควรได้ยาแก้คลื่นไส้อาเจียนร่วมด้วย
- Progesterone alone treatment ในกรณีที่ผู้ป่วยมีข้อห้ามในการใช้ฮอร์โมนเอสโตรเจน โดยให้เป็น Medroxyprogesterone 10-20 มิลลิกรัมรับประทานทุกๆ 6-12 ชั่วโมง Norethindrone acetate 5-10 mg มิลลิกรัมรับประทานทุกๆ 6 ชั่งโมง
3.ให้ยากลุ่ม Antifibrinolytic drug: Tranexamic acid 10 มิลลิกรัมต่อกิโลกรัม ให้ได้ทุกๆ 8 ชั่วโมง โดยสามารถให้ทั้งในรูปแบบทางเส้นเลือดดำหรือรับประทานก็ได้
หากรักษาด้วยฮอร์โมนเพื่อหยุดเลือดแล้วอาการไม่ดีขึ้นควรประเมินผู้ป่วยซ้ำอีกครั้งพิจารณาหาสาเหตุความผิดปกติของมดลูกที่ไม่ได้พบบ่อยในสตรีวัยรุ่น เช่น เนื้องอกกล้ามเนื้อมดลูก, ติ่งเนื้อเยื่อบุโพรงมดลูก, เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (1)
4.กรณีที่ผู้ป่วยไม่ตอบสนองต่อการรักษาด้วยยา ให้พิจารณา Ultrasound หากมีก้อนเลือดอยู่ภายในโพรงมดลูกปริมาณมากจะทำให้การหดรัดตัวของกล้ามเนื้อมดลูกไม่ดี สามารถพิจาณา Evacuate clot ด้วย Suction and curettage หรือ Dilatation and curettage ควรทำภายใต้ยาดมสลบในผู้ป่วยที่ไม่เคยมีเพศสัมพันธ์ อาจให้ยากลุ่มที่ช่วยให้กล้ามเนื้อมดลูกหดรัดตัว (Uterotonic drugs) เพื่อช่วยหยุดเลือด
5.Intrauterine balloon tamponade สามารถช่วยหยุดเลือดได้โดยอาศัยหลักการความดัน ใช้สายสวนปัสสาวะที่สามารถใส่น้ำในballoon ได้ 30 มิลลิตร ใส่สายสวนปัสสาวะเข้าไปผ่านปากมดลูก อาจใช้ Ultrasound ทางหน้าท้องเพื่อช่วยดูตำแหน่งของสายว่าเข้าไปอยู่ในโพรงมดลูก หลังจากนั้นใส่น้ำเข้าไปใน balloon ปริมาณของน้ำขึ้นอยู่กับขนาดของมดลูก ใส่สายค้างไว้เพื่อหยุดเลือด 12-24 ชั่วโมงเพื่อรอให้ยาฮอร์โมนหรือยาห้ามเลือดออกฤทธิ์ หลังจากนั้นค่อยๆดูดน้ำออก ทีละ 5 มิลลิตร แล้วสังเกตเลือดที่ออกทางช่องคลอดว่ามีอยู่หรือไม่ หลังจากนั้นจึงพิจารณาเอาสายออกภายหลัง 24 ชั่วโมง (15)
6.พิจารณาใช้ห่วงอนามัยที่มีฮอร์โมนโปรเจสเตอร์โรนเป็นส่วนประกอบ (Levonorgestrel-releasing IUD) มีประสิทธิภาพในการรักษาประจำเดือนมามากได้ 90% องค์การอาหารและยาแห่งสหรัฐอเมริกา(FDA) แนะนำให้ใช้เป็นยาตัวแรกในการรักษาประจำเดือนมามากในสตรีที่ต้องการคุมกำเนิดด้วย
กลุ่มอาการคงที่ สามารถรักษาแบบผู้ป่วยนอกได้(1)
1.พิจารณาให้ยาฮอร์โมนขนาดสูงเพื่อหยุดเลือดเหมือนกับผู้ป่วยที่อาการไม่คงที่คือ ฮอร์โมนเอสโตรเจนหรือฮอร์โมนโปรเจสเตอโรน รับประทาน 7 วัน ผู้ป่วยส่วนใหญ่เลือดจะหยุด หลังจากนั้นให้ผู้ป่วยรับประทานยาคุมกำเนิด (combine contraceptive pill) ต่อ
2.แพทย์ควรให้คำแนะนำถึงผลข้างเคียงของยาฮอร์โมน อาการคลื่นไส้อาเจียน คัดตึงเต้านม เลือดออกกระปริดกระปรอยทางช่องคลอด และแนะนำให้ผู้ป่วยรับประทานยาอย่างต่อเนื่องเพราะการหยุดรับประทานยาจะทำให้เกิดเลือดออกปริมาณมากซ้ำได้
3.ควรรักษาด้วย Low dose combine oral contraceptive pill ต่อเนื่อง 3-6 เดือน เพื่อให้ประจำเดือนมาสม่ำเสมอตามรอบเดือน
การหยุดประจำเดือนระยะยาว(Long-term menstrual suppression) พิจารณาให้การรักษาระยะยาวในกรณีที่ สาเหตุของประจำเดือนที่มามากต้องใช้เวลาในการรักษาเช่นโรคทางอายุรกรรม หรือการมีประจำเดือนมากส่งผลต่อตัวโรคและ รบกวนชีวิตประจำวันของผู้ป่วย หลักการคือให้ยาเพื่อกดไม่ให้ประจำเดือนมาโดยสามารถเลือกใช้ยาดังต่อไปนี้(16)
1.Progestin : Norethindrone, Norethindrone acetate, Medroxyprogesterone acetate โดยให้รับประทานต่อเนื่องทุกวัน
2. Continuous combine oral contraceptive pill โดยให้รับประทานเฉพาะเม็ดยาที่มีฮอร์โมนเป็นส่วนประกอบต่อเนื่องเพื่อไม่ให้มีประจำเดือน
3.Depot formulation of progestins (DMPA)
4.Gonadotropin-releasing hormone (GnRH) analogs
5.Levonogestrel IUD
การเลือกใช้ยาแต่ละตัวขึ้นอยู่กับโรคร่วมที่ผู้ป่วยเป็นว่ามีข้อห้ามในการให้ยาฮอร์โมนชนิดใดบ้าง การยอมรับถึงข้อเสียของผลข้างเคียงของยาแต่ละตัว และประสบการณ์ของแพทย์ผู้ดูแล มีรายงานว่าภายใน 1 ปีผู้ป่วยจะเข้าสู่ภาวะขาดประจำเดือน 60% ในกลุ่มที่ได้ Continuous combine oral contraceptive pill 50% ในกลุ่มที่ได้ DMPA และ IUD (16, 17)
DMPA และ GnRH analogs มีผลต่อความแข็งแรงของกระดูกจึงอาจไม่เหมาะที่จะนำมาใช้รักษาระยะยาวในวัยรุ่น สูตินรีแพทย์ควรติดตามผู้ป่วยเป็นระยะร่วมกับอายุรแพทย์ที่ดูแลโรคที่มีผลต่อการมีเลือดประจำเดือนผิดปกติของผู้ป่วยด้วย
ภาวะปวดประจำเดือน
ภาวะปวดประจำเดือนพบได้บ่อยในสตรีวัยรุ่น โดยส่วนใหญ่เป็นอาการปวดประจำเดือนที่ไม่ได้เกิดจากความผิดปกติของอวัยวะในอุ้งเชิงกราน(Primary dysmenorrhea) โดยภาวะนี้สามารถรักษาด้วยการให้รับประทานยาแก้ปวดหรือพิจารณารักษาด้วยยากลุ่มฮอร์โมน ผุ้ป่วยส่วนใหญ่จะตอบสนองดีต่อการรักษา หากอาการปวดไม่ดีขึ้นควรพิจารณาหาสาเหตุของอาการปวดประจำเดือนที่มาจากความผิดปกติของอวัยวะในอุ้งเชิงกราน
อาการปวดท้องประจำเดือนที่สัมพันธ์กับพยาธิสภาพในอุ้งเชิงกรานมักเป็นอาการปวดท้องประจำเดือนแบบรุนแรง(Secondary dysmenorrhea) ซึ่งสาเหตุที่พบบ่อยในวัยรุ่น คือ ความผิดปกติแต่กำเนิดของมดลูกหรือช่องคลอดที่ทำให้ประจำเดือนไม่สามารถระบายออกมาได้(Obstructive uterovaginal anomaly), ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่(Endometriosis) โดยการที่จะสงสัย Secondary amenorrhea นั้น ผู้ป่วยควรจะได้รับการรักษาด้วยยาแก้ปวดที่เหมาะสมแล้วคือ ยาในกลุ่ม Nonsteroidal anti-inflammatory drugs หรือ Hormonal therapy แล้ว เว้นแต่ว่าตรวจร่างกายพบความผิดปกติจากอวัยวะในอุ้งเชิงกรานชัดเจน (18)
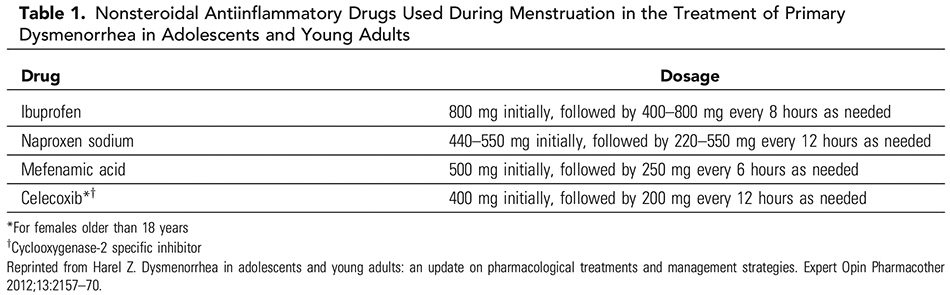
ตารางที่ 1 แสดงยาในกลุ่ม Nonsteroidal anti-inflammatory drugs ที่ใช้รักษาภาวะปวดท้องประจำเดือนในวัยรุ่น(18)
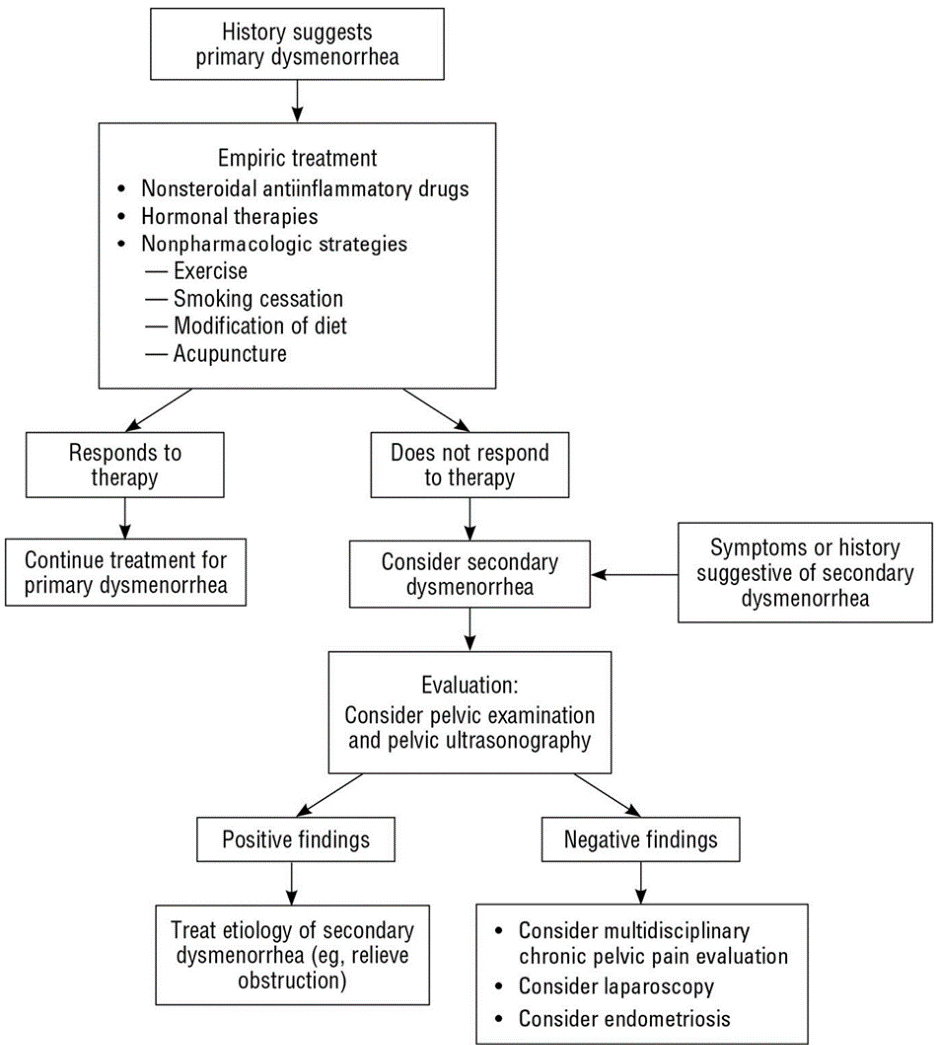
รูปที่ 2 Approach to the adolescent with dysmenorrhea(18)
ก้อนในอุ้งเชิงกราน (Pelvic mass)
อาการแสดงของก้อนในอุ้งเชิงกรานในวัยรุ่นมีได้ตั้งแต่ ไม่มีอาการใดๆแต่บังเอิญตรวจเจอจากการตรวจร่างกายหรือการ Ultrasound ,อาการปวดท้องน้อยแบบฉับพลัน ,อาการปวดท้องน้อยเรื้อรัง,อาการปวดท้องประจำเดือน, คลำได้ก้อนเอง หรือ มีอาการที่เกิดจากตัวก้อนไปกดเบียดอวัยวะข้างเคียง เช่น ปัสสาวะบ่อย ขับถ่ายผิดปกติได้
อาการปวดท้องน้อยแบบเฉียบพลัน รุนแรง และ เป็นๆหายๆ มักสัมพันธ์กับภาวะที่ก้อนในอุ้งเชิงกรานที่มีต้นเหตุจากรังไข่หรือปีกมดลูกมีภาวะแทรกซ้อน เช่น torsion, rupture, internal hemorrhage ได้
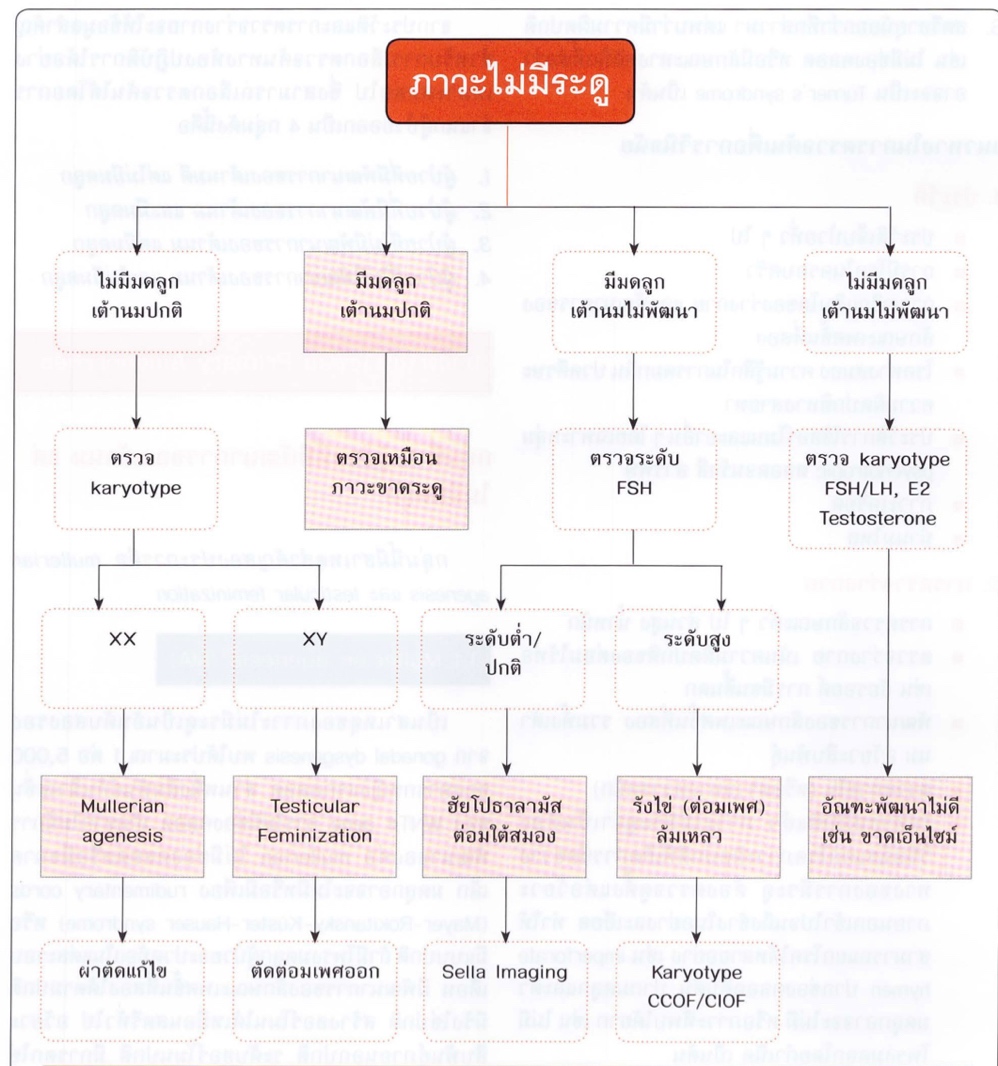
การวินิจฉัยก้อนในอุ้งเชิงกรานในวัยรุ่น(1)
อาศัยจากการซักประวัติและตรวจร่างกายเป็นหลัก ในที่นี้การตรวจภายในมีบทบาทสำคัญที่จะช่วยบอกว่าก้อนในอุ้งเชิงกรานมาจากอวัยวะส่วนใด ดังนั้นควรตรวจภายในในผู้ป่วยที่มีเพศสัมพันธ์แล้ว กรณีที่ผู้ป่วยไม่เคยมีเพศสัมพันธ์อาจใช้การตรวจทางรูทวารแทนได้
การส่งตรวจทางห้องปฏิบัติการ
Complete blood count: กรณีสงสัยว่าก้อนมีภาวะแทรกซ้อนเช่นก้อนติดเชื้อ หรือ บิดขั้ว อาจจะมีการเพิ่มขึ้นของเม็ดเลือดขาวได้ กรณีก้อนแตกหรือมีเลือดออกในก้อนอาจมีภาวะซีดได้
Urine pregnancy test: ควรส่งทุกรายที่มาด้วยก้อนอุ้งเชิงกรานเพื่อแยกภาวะการตั้งครรภ์
Tumor marker: กรณีสงสัยว่าเป็นก้อนเนื้องอกจากรังไข่ โดยอุบัติการณ์ของเนื้องอกรังไข่ในวัยรุ่นมักเป็นกลุ่ม Germ cell tumor มากกว่า Epithelial tumor เมื่อเทียบกับผู้ใหญ่ ควรส่ง AFP, hCG, LDH เป็นต้น ทั้งนี้ขึ้นอยู่กับผลการตรวจUltrasound ด้วยว่าลักษณะเข้าได้กับเนื้องอกชนิดใด
การตรวจภาพถ่ายทางรังสี
Ultrasonography เป็นส่งตรวจทางรังสีที่สามารถใช้วินิจฉัยก้อนในอุ้งเชิงกรานในสตรีวัยรุ่นได้ส่วนใหญ่ เนื่องจากสามารถบอกได้ว่าก้อนในอุ้งเชิงกรานที่ตรวจพบมาจากอวัยวะอุ้งเชิงกรานหรือไม่ โดยเฉพาะการตรวจทาง Transvaginal ultrasound ที่จะเห็นรายละเอียดของอวัยวะอุ้งเชิงกรานได้ชัดเจน สามารถบอกลักษณะพยาธิสภาพได้ว่าเป็นอย่างไร เข้าได้กับอวัยวะใด และบอกแนวโน้มของชนิดของเนื้องอกได้
CT scan กรณีสงสัยว่าเป็นก้อนจากอวัยวะอื่นที่ไม่ใช่มดลูกรังไข่ หรือการตรวจด้วย Ultrasound ไม่สามารถวินิจฉัยก้อนได้
MRI มีประโยชน์ในกลุ่มที่สงสัยความผิดปกติโดยกำเนิดของมดลูกและช่องคลอดที่มีความซับซ้อน ไม่สามารถวินิจฉัยได้จากการตรวจร่างกายและการทำ Ultrasound และยังมีประโยชน์ใช้วางแผนการรักษาผ่าตัด
การวินิจฉัยแยกโรคก้อนในอุ้งเชิงกราน
การวินิจฉัยแยกโรคก้อนในอุ้งเชิงกรานในวัยรุ่นหากอิงตามโรคที่พบบ่อยจากกลุ่มอายุ มักเกิดจาก Functional cyst, Pregnancy, Benign cystic teratoma, Germ cell tumor, Epithelial ovarian tumor หากแบ่งตามอวัยวะในอุ้งเชิงกรานสามารถแบ่งเป็น Adnexal mass, Uterine mass
Adnexal mass
Functional ovarian cyst คือถุงน้ำรังไข่ที่เกิดจากการทำงานปกติของรังไข่ พบได้บ่อยในสตรีวัยรุ่น อาจพบโดยบังเอิญจากการทำultrasound หรืออาจจะมีภาวะแทรกซ้อนได้เช่น ถุงน้ำรังไข่รั่ว, แตก, มีเลือดออกภายในถุงน้ำ โดยเฉพาะ Corpus luteal cyst ที่จะเกิดขึ้นหลังจากตกไข่ ลักษณะอัลตราซาวน์ที่พบมีหลากหลายตั้งแต่เป็นถุงน้ำรังไข่ที่ผนังหนา หากใส่ color doppler จะเห็นลักษณะเส้นเลือดรอบๆ เรียกว่า Ring of fire หากมีเลือดออกภายในถุงน้ำใหม่ๆ จะมีลักษณะ hyperechoic คล้ายเนื้อตันได้ หากเลือดในถุงน้ำเริ่มสลายจะมีลักษณะ septation, reticular pattern ถุงน้ำชนิดนี้จะสามารถหายไปได้เอง อาจติดตามด้วยการทำอัลตราซาวน์ 4-6 สัปดาห์(19)
Paratubal cyst คือ ส่วนที่หลงเหลือของ mesonephric duct ที่ควรจะสลายไปในเพศหญิง หากมีการหลงเหลืออยู่ จะกลายเป็น cyst ที่อยู่ข้างๆกับท่อนำไข่หรือรังไข่ก็ได้ ซึ่งหากมีขนาดใหญ่พออาจทำให้เกิดการบิดขั้วของปีกมดลูกได้ทำให้มีอาการปวดท้องน้อยเป็นๆหายๆ สัมพันธ์กับท่าทางได้ การวินิจฉัยค่อนข้างลำบากเนื่องจาก ultrasound จะเห็นลักษณะเหมือนเป็นถุงน้ำที่ภายในเป็น anechoic content คล้าย simple ovarian cyst ได้ หากสามารถเห็นว่าถุงน้ำนี้แยกได้ชัดเจนจากรังไข่ก็จะทำให้คิดถึงโรคนี้มากขึ้น กรณีที่มีอาการสงสัยการบิดขั้วของปีกมดลูกจากถุงน้ำนี้การรักษาคือการ detorsion และตัดเฉพาะตัวถุงน้ำออกโดยเก็บรังไข่และท่อนำไข่ที่ปกติไว้
เนื้องอกรังไข่ ที่พบบ่อยในวัยรุ่นคือเนื้องอกที่ไม่ใช่มะเร็ง คือ Mature cystic teratoma หรือ Dermoid cyst มักมีภาวะแทรกซ้อนที่พบบ่อยคือบิดขั้ว Endometrioma พบได้น้อยในวัยรุ่นเมื่อเทียบกับวัยเจริญพันธุ์ แต่มักจะเพิ่มความเสี่ยงในกลุ่มที่มีปัญหาเรื่องการอุดกั้นของมดลูกหรือช่องคลอดแต่กำเนิด(obstructive genital anomaly)
กลุ่มเนื้องอกที่เป็นมะเร็งนั้นพบน้อยเมื่อเทียบกับกลุ่มผู้ป่วยเด็ก หากพบจะเป็นชนิด Germ cell tumor โดยมักสัมพันธ์กับผู้ป่วยที่มีความผิดปกติของโครโมโซมเพศคือกลุ่มที่มี Y chromosome
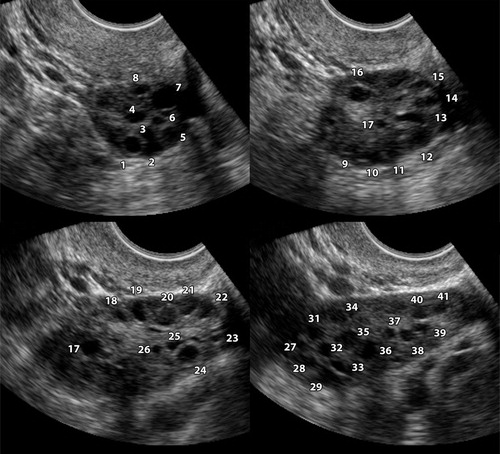
การทำ ultrasound สามารถแยกโรคเนื้องอกรังไข่ได้จากลักษณะที่พบซึ่งอาจมีลักษณะจำเพาะกับโรคแต่ละโรค ดังแสดงในภาพต่อไปนี้
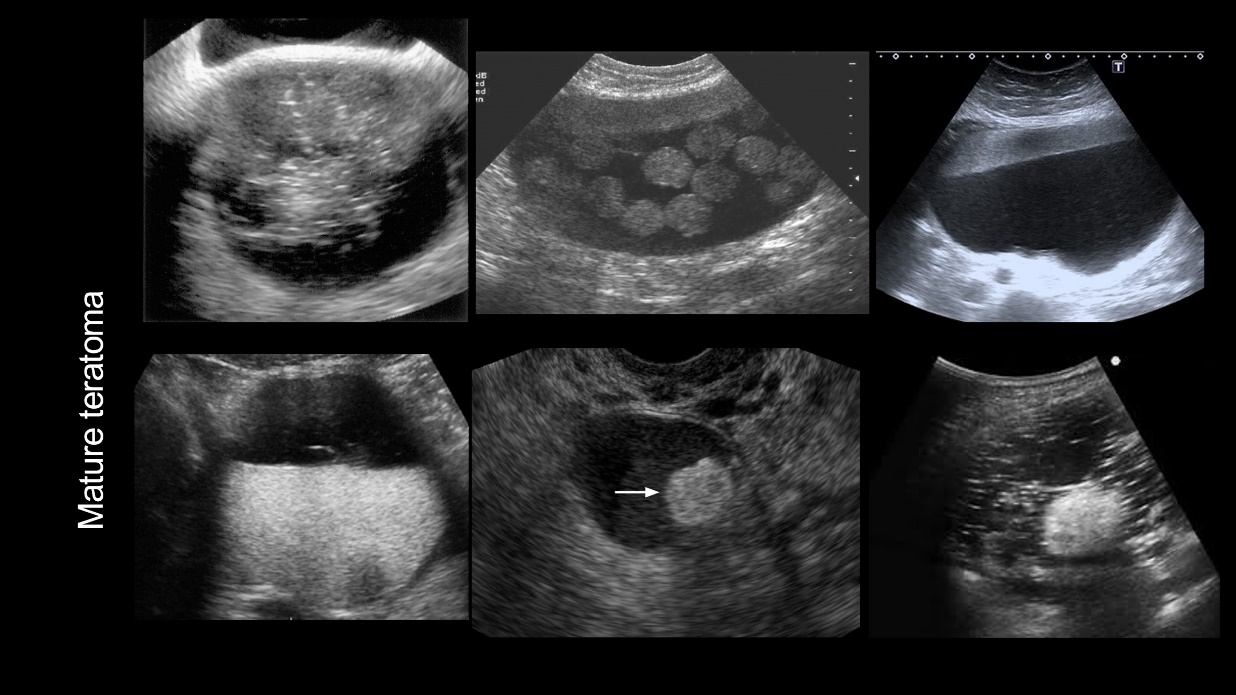
รูปที่ 3 แสดงภาพ Ultrasound ของ Dermoid cyst
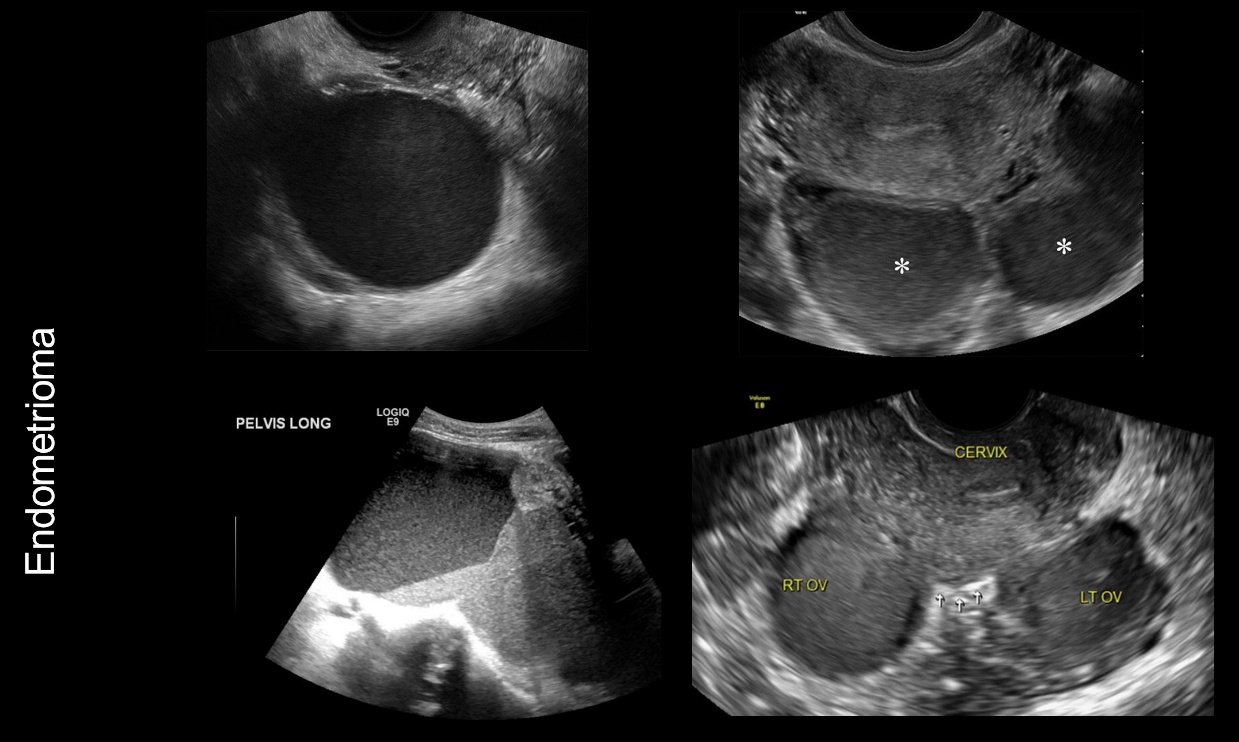
รูปที่ 4 แสดงภาพ ultrasound ของ Endometrioma
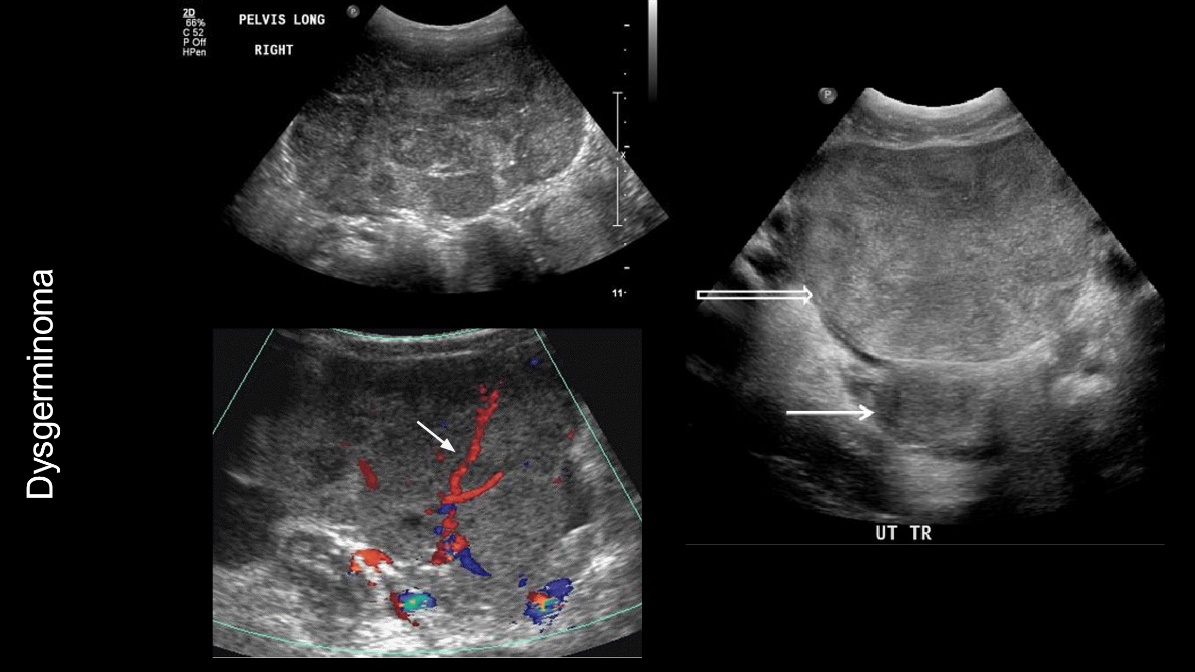
รูปที่ 4 แสดงภาพ ultrasound ของ Dysgerminoma
Tubo-ovarian abscess เป็นภาวะแทรกซ้อนที่เกิดตามหลังภาวะอุ้งเชิงกรานอักเสบ(pelvic inflammatory disease) ซึ่งเป็นโรคติดต่อทางเพศสัมพันธ์ที่พบได้ในวัยรุ่นที่มีความเสี่ยงติดโรคติดต่อทางเพศสัมพันธ์หรือใส่ห่วงคุมกำเนิด โดยจะมีก้อนในอุ้งเชิงกรานที่เกิดจากการบวมและติดเชื้อก่อตัวเป็นฝีที่ท่อนำไข่และรังไข่ การป้องกันไม่ให้เกิดภาวะนี้คือการวินิจฉัยภาวะอุ้งเชิงกรานอักเสบให้ได้ และให้การรักษาอย่างเหมาะสมด้วยยาฆ่าเชื้อ โดยคนไข้จะมาด้วยอาการ ปวดท้องน้อย มีตกขาวผิดปกติคล้ายหนอง มีไข้ ตรวจภายในมีกดเจ็บบริเวณมดลูกหรือปีกมดลูก โยกปากมดลูกแล้วเจ็บ ตรวจทางห้องปฏิบัติการพบมีการเพิ่มขึ้นของเม็ดเลือดขาวในเลือดได้
Uterine mass
ก้อนในอุ้งเชิงกรานที่มาจากมดลูกในวันรุ่นที่พบได้บ่อยคือการตั้งครรภ์เนื่องจากวัยรุ่นส่วนใหญ่มักปฏิเสธการตั้งครรภ์ และปกปิดประวัติการมีเพศสัมพันธ์ ดังนั้นจึงควรแยกภาวะตั้งครรภ์ออกไปก่อน
ส่วนก้อนที่มาจากพยาธิสภาพที่มดลูกจริงๆ ที่พบได้บ่อยในวัยรุ่นคือ มดลูกที่ขยายขนาดใหญ่ขึ้นจากการที่มีการสะสมของเลือดประจำเดือน (hematometra) อาจพบร่วมกับ การขยายใหญ่ขึ้นของช่องคลอดที่เกิดจากเลือดประจำเดือนคั่งอยู่ (hematocolpos) ซึ่งสาเหตุเกิดจากความผิดปกติโดยกำเนิดของมดลูกและช่องคลอด ขึ้นอยู่กับว่ามีการอุดกั้นที่ระดับใด
โดยมีได้หลากหลายตั้งแต่ Imperforated hymen, Transverse vaginal septum, Vaginal stenosis with normal uterus
Vaginal duplication with obstructing longitudinal septa, Obstructed uterine horn.
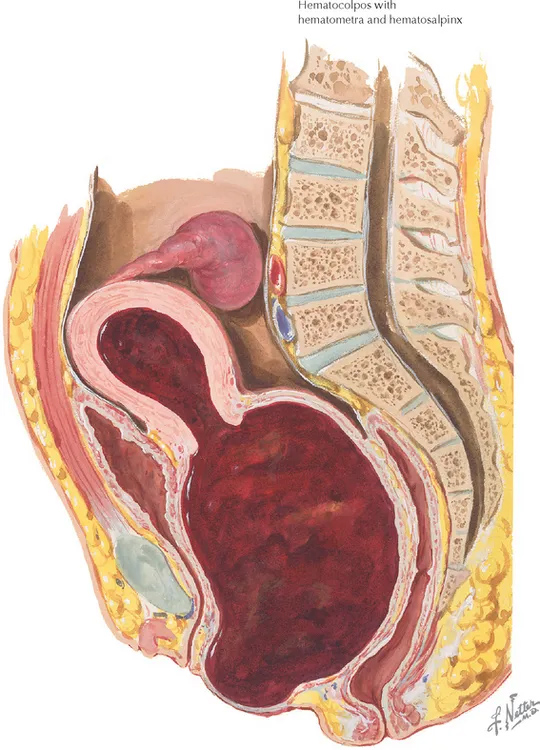
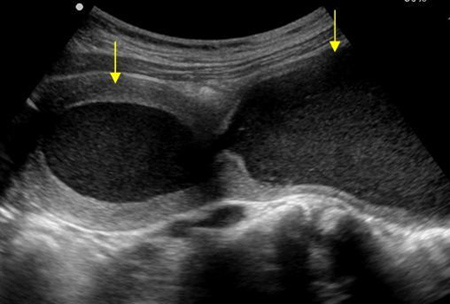
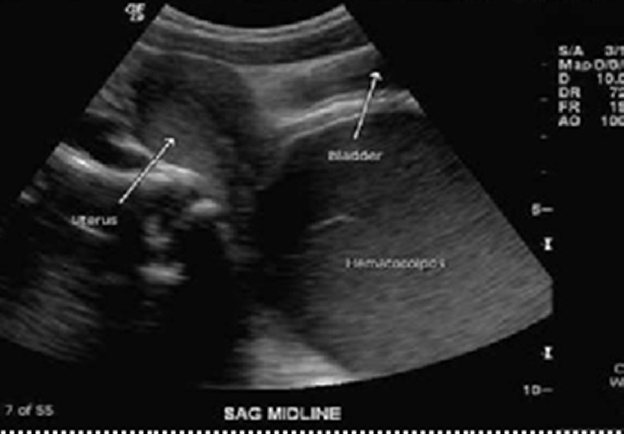
รูปที่ 5 แสดงภาพวาด hematometra และ hematocolpos(ด้านซ้าย) และภาพ ultrasound hematometra และ hematocolpos(ด้านขวา)
แนวทางการดูแลผู้ป่วยที่มีก้อนในอุ้งเชิงกราน(1)
แนวทางการดูแลรักษาขึ้นอยู่กับว่าวินิจฉัยคืออะไรและอาการแสดงของผู้ป่วยคืออะไร กรณีที่เป็น Functional cyst ที่ผู้ป่วยไม่อาการใดๆ แต่เจอโดยบังเอิญจากการตรวจร่างกายหรือ ultrasound การดูแลคือการตรวจติดตามอาการและ ultrasound และให้คำแนะนำแก่ผู้ป่วยว่าเป็นภาวะปกติที่สามารถเจอได้
กรณีที่ผล ultrasound ก้ำกึ้งว่าจะเป็น Functional cyst หรือ Pathological cyst โดยเฉพาะใน Corpus luteal cyst with internal hemorrhage อาจทำการตรวจติดตาม ultrasound ซ้ำดังที่ได้กล่าวไปข้างต้น หากถุงน้ำยังอยู่และลักษณะยังเหมือนเดิมควรคิดถึง Pathological cyst
กรณีที่สงสัยว่ามีภาวะแทรกซ้อนจากก้อนในอุ้งเชิงกราน แพทย์ต้องวินิจฉัยก้อนเบื้องต้นให้ได้ว่าเป็นอะไร และต้องพิจารณาว่ามีความจำเป็นต้องรักษาด้วยการผ่าตัดฉุกเฉินหรือไม่ ซึ่งจะทำให้ผู้ป่วยที่มีสัญญาณชีพไม่คงที่ มี peritonitis จากการตรวจร่างกาย หรือสงสัยภาวะปีกมดลูกบิดขั้ว หลักการในการผ่าตัดจะต้องคำนึงถึงความสามารถในการมีบุตรในอนาคตของผู้ป่วยเป็นหลักสำคัญ โดยจะเน้นหัตถการที่ fertility sparing ให้ได้มากสุด แม้ว่าจะสงสัยภาวะมะเร็งก็ควร conservative surgery คือตัดเพียงปีกมดลูกข้างที่มีพยาธิสภาพก่อน แล้วจึงมาวางแผนการรักษาอีกครั้งหลังจากได้ผลทางพยาธิวิทยา
กรณีที่วินิจฉัยภาวะอุ้งเชิงกรานอักเสบผู้ป่วยควรได้รับยาฆ่าเชื้อที่เหมาะสมกับโรคและความรุนแรง(20) และในกรณีที่เป็น Tubo-ovarian abscess แล้วก็ควรรักษาด้วยการให้ยาฆ่าเชื้อก่อนแล้วดูการตอบสนองหลังจากได้ยาฆ่าเชื้อ 24-48 ชั่วโมง การพิจารณาผ่าตัดจะทำในผู้ป่วยที่สงสัยภาวะแทรกซ้อนจากก้อนฝีหนอง เช่นก้อนแตก โดยหัตถการที่ทำยังคงแนะนำให้เป็น conservative surgery คือ เน้นการล้างอุ้งเชิงกราน ระบายหนองในตำแหน่งท่อนำไข่และรังไข่ก่อน ในกรณีผ่าตัดเนื่องจากไม่ตอบสนองต่อยาฆ่าเชื้ออาจพิจารณาตัดปีกมดลูกข้างที่มีพยาธิสภาพไปเลย
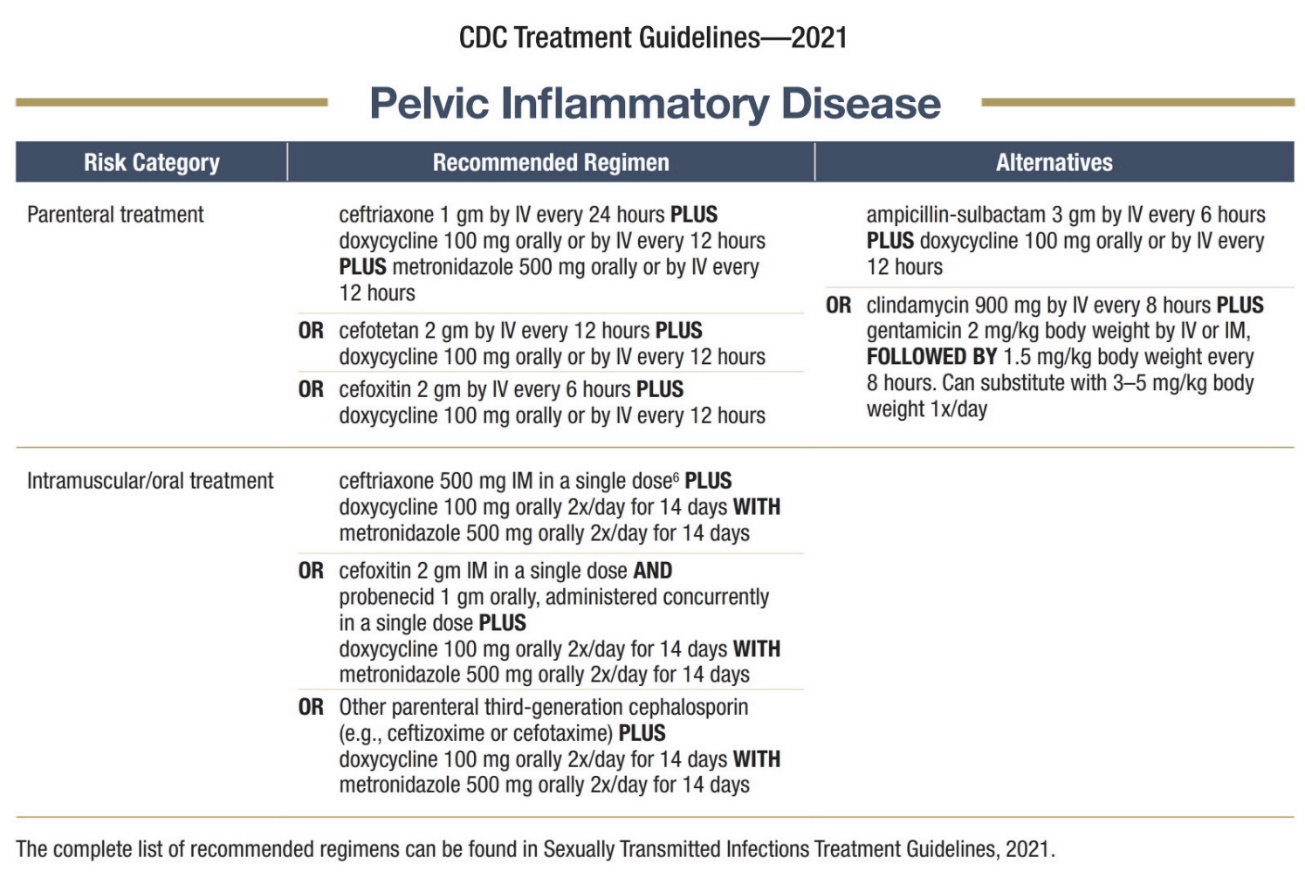
ตารางที่ 2 แสดงยาฆ่าเชื้อที่เหมาะสมในการรักษาภาวะอุ้งเชิงกรานอักเสบ (20)
ปัญหาเกี่ยวกับอวัยวะเพศและช่องคลอด (vulva and vagina conditions)
Hymenal problem (21)
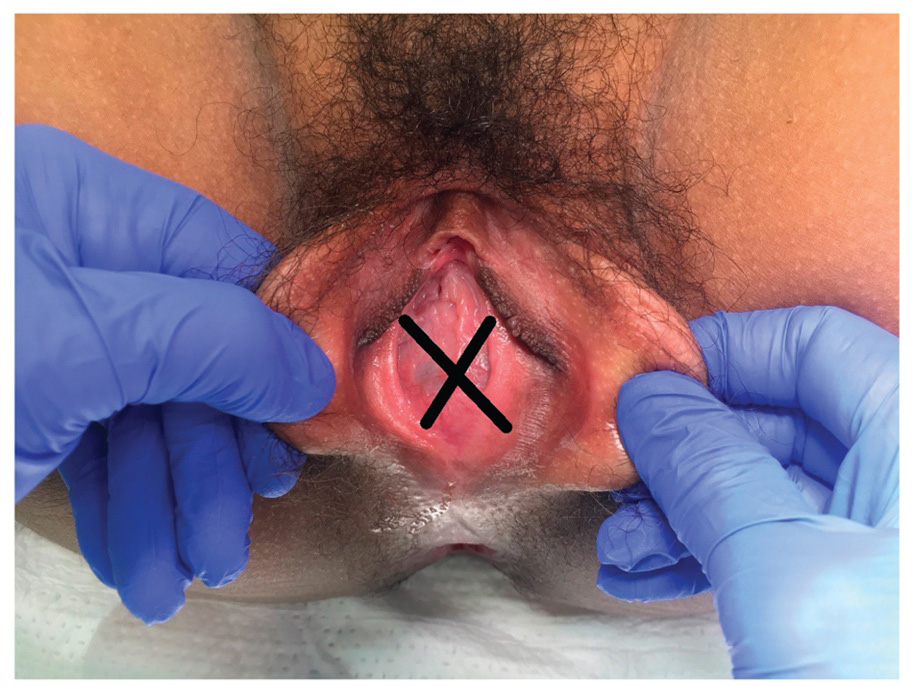
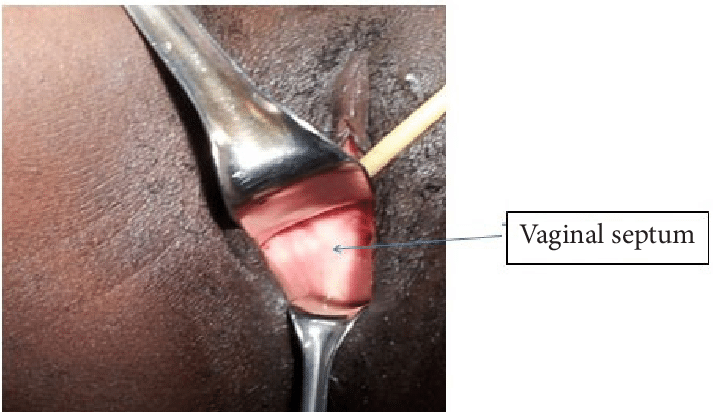
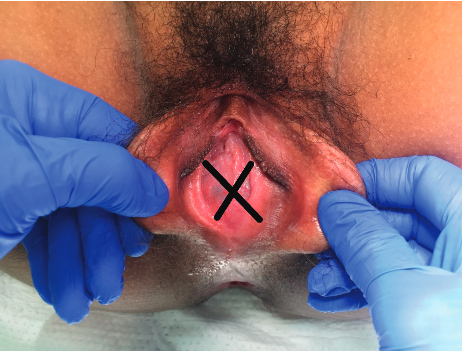
ปัญหาที่เกี่ยวกับเยื่อพรหมจารี(Hymenal problem) ที่เกิดจากความผิดแต่กำเนิด โดยความรุนแรงของความผิดปกติมีหลากหลาก ส่งผลให้อาการแสดงต่างกันเช่น ในกรณีที่เยื่อพรหมจารีไม่สลายไปเลย(Imperforated hymen)ผู้ป่วยจะมาด้วยอาการประจำเดือนไม่มาหลังจากเข้าสู่วัยสาว(Primary amenorrhea) ปวดท้องน้อย คลำได้ก้อนที่เกิดจากมดลูกหรือช่องคลอดขยายขนาดใหญ่จากการที่มีเลือดประจำเดือนคั่งอยู่ดังที่ได้กล่าวไปในปัญหาเรื่องก้อนในอุ้งเชิงกราน ในกรณีที่มีการสลายไปแต่สลายไปบางส่วนของเยื่อพรหมจารีลักษณะภายนอกจะเห็นได้หลากหลายเช่น Annular hymen, Septate hymen, Cribriform hymen ดังแสดงในภาพที่ 6 ผู้ป่วยมักจะมาปรึกษาด้วยปัญหาในการมีเพศสัมพันธ์หรือการใส่ผ้าอนามัยแบบสอด
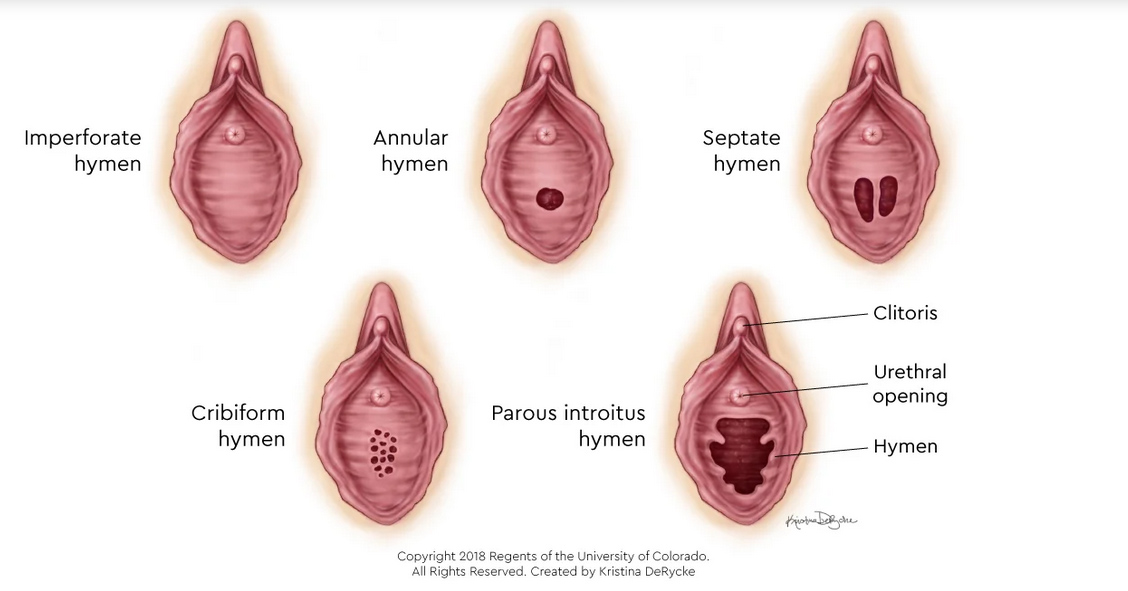
ภาพที่ 6 แสดงความผิดปกติของเยื่อพรหมจารี
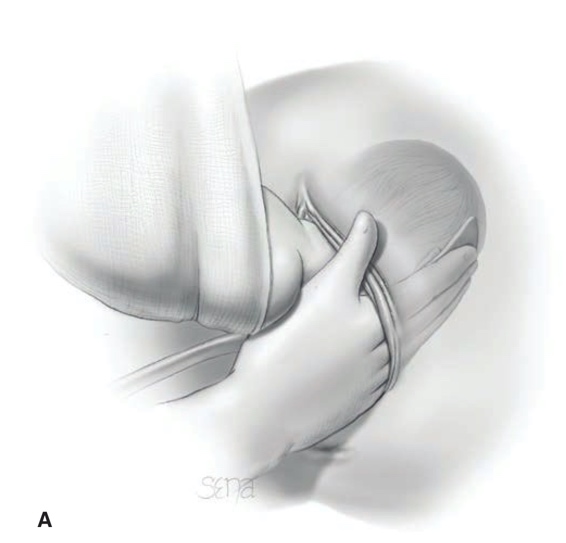
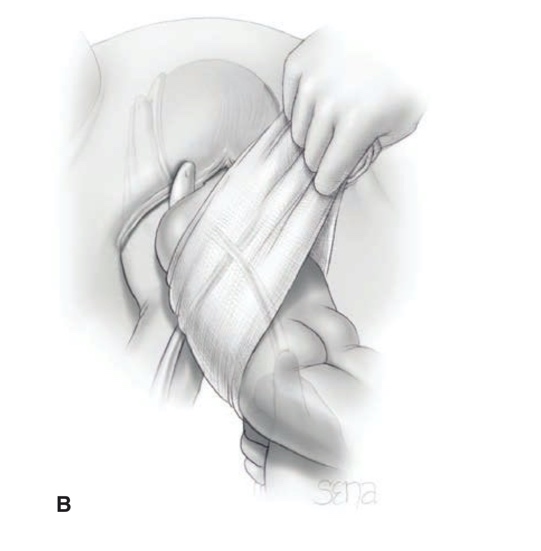
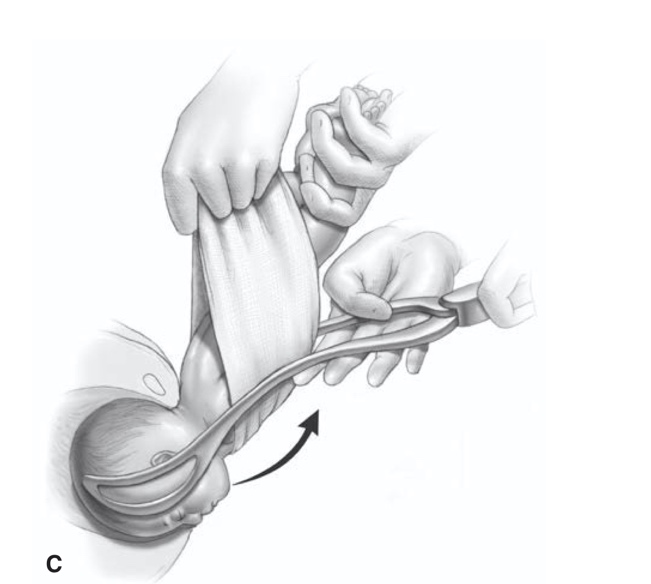
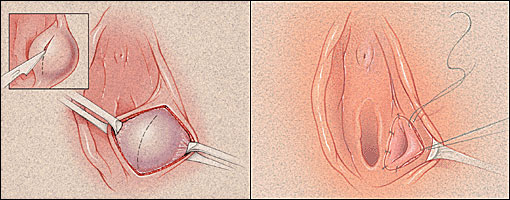
การรักษา Imperforated hymen และ Microperforated hymen จำเป็นต้องได้รับการผ่าตัดเพื่อระบายเลือดประจำเดือนและเปิดเยื่อพรหมจารีไว้ โดยเวลาที่ควรผ่าตัดตามหลักการคือก่อนที่จะเริ่มมีอาการปวดจากการคั่งของประจำเดือน และต้องเป็นช่วงที่เข้าสู่วัยรุ่นแล้วเนื่องจากเยื่อบุช่องคลอดต้องอาศัยฮอร์โมนเอสโตรเจน แต่โดยส่วนใหญ่ผู้ป่วยมักจะมาพบแพทย์ด้วยอาการปวดจากการคั่งของประจำเดือน,คลำได้ก้อน และมีอาการจากการที่ก้อนกดเบียดแล้ว ก่อนทำการผ่าตัดรักษาแพทย์จะต้องแจ้งให้ผู้ป่วยและผู้ปกครองทราบว่าเป็นหัตถการที่จำเป็นเนื่องจากจะต้องมีทางระบายของประจำเดือนและการผ่าตัดนี้ไม่มีผลต่อการมีบุตร หรือปัญหาในการมีเพศสัมพันธ์ในอนาคตของผู้ป่วย โดยการผ่าตัดควรทำในห้องผ่าตัดและมีแนวทางในการลงแผลผ่าตัดวิธีดั้งเดิมเรียกว่า Cruciate incision หรืออีกวิธีเรียกว่า U-shape incision ดังแสดงในรูปที่ 7
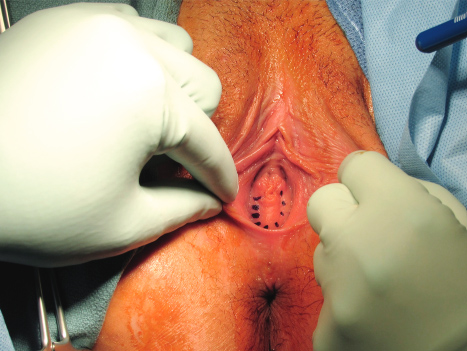
รูปที่ 7 แสดงวิธีการลงแผลผ่าตัด imperforated hymen(21)
ในกลุ่มที่เป็น Annular hymen หรือ Tight hymenal ring อาจไม่จำเป็นต้องผ่าตัดรักษาสามารถรักษาด้วยการขยายช่องคลอดด้วยตัวผู้ป่วยเองได้ แต่กรณีที่ต้องการผ่าตัดสามารถทำเป็นผู้ป่วยนอกโดยการฉีดยาชาเฉพาะที่และกรีดแผลเล็กๆที่ตำแหน่ง 6 กับ 8 นาฬิกาได้
ในกลุ่ม Septate hymen สามารถรักษาโดยการผ่าตัดแบบผู้ป่วยนอกได้ โดยใช้ยาชาเฉพาะที่ หากผู้ป่วยสามารถทนได้ โดยใช้ไหมละลายได้ผูกตำแหน่งด้านบนและด้านล่างของ septum จากนั้นทำการตัด septum ระหว่างไหมออกไป
แผลบริเวณอวัยวะเพศ(Genital ulcers) (1)
แผลบริเวณอวัยวะเพศในวันรุ่นอาจแบ่งได้ง่ายๆเป็นกลุ่มที่เกี่ยวข้องกับโรคติดต่อทางเพศสัมพันธ์ กับ กลุ่มที่ไม่ติดต่อทางเพศสัมพันธุ์ ดังนั้นแพทย์จะต้องซักประวัติเกี่ยวกับแผลให้ละเอียดและลักษณะของตุ่มหรือรอยโรคก่อนหน้าที่จะมาพบแพทย์ว่ามีหน้าตาเปลี่ยนแปลงไปอย่างไรบ้าง ซักปัจจัยความเสี่ยงที่จะติดโรคติดต่อทางเพศสัมพันธ์ รวมถึงอาการร่วมและโรคประจำตัวอื่นๆ การรักษาที่ได้รับก่อนหน้านี้ เป็นต้น
แผลอวัยวะเพศที่ไม่ใช่โรคติดต่อทางเพศสัมพันธ์ที่พบได้ในวัยรุ่นเช่น Vulva apthosis ส่วนกลุ่มที่เป็นโรคติดต่อทางเพศสัมพันธ์เช่น เริม(Herpes simplex), แผลริมอ่อน(Chancroid), แผลริมแข็ง(Chancre) โดยการรักษาจะแตกต่างกันออกไปในแต่ละโรค
หูดบริเวณอวัยวะเพศ (Genital wart)(1)
หูดบริเวณอวัยวะเพศเป็นปัญหาที่พบได้บ่อยของรอยโรคบริเวณอวัยวะเพศในวัยรุ่น ซึ่งเป็นโรคติดต่อทางเพศสัมพันธ์เกิดจาก Human papilloma virusโดยเฉพาะสายพันธุ์ 6 และ 11 โดยผู้ป่วยอาจจะไม่มีอาการร่วมใดๆ หรืออาจจะมีอาการคันบริเวณอวัยวะเพศ มีเลือดออกผิดปกติได้ การรักษามีให้เลือกหลายวิธี ไม่ว่าจะเป็นการจี้เย็น การใช้เลเซอร์ การใช้ยาทาเฉพาะที่ โดยการเลือกวิธีการรักษาขึ้นอยู่กับความรุนแรง จำนวน ตำแหน่งของรอยโรค ความสะดวกสบายของผู้ป่วย และควรแนะนำให้ฉีดวัคซีน Human papilloma virus ด้วยเพื่อลดโอกาสที่จะติดเชื้อสายพันธุ์อื่นเพิ่มเติม
ตกขาวผิดปกติ (Vaginal discharge)(1)
อาการตกขาวผิดปกติส่วนใหญ่เกิดจากการติดเชื้อในช่องคลอด โดยสาเหตุที่ทำให้เกิดอาการตกขาวผิดปกติในวัยรุ่นไม่ต่างกับในสตรีวัยเจริญพันธุ์ ที่พบได้บ่อยคือ การติดเชื้อราในช่องคลอด(Vaginal candidiasis), การติดเชื้อแบคทีเรียในช่องคลอด(Bacterial vaginosis), การติดเชื้อโปรตัวซัวในช่องคลอด(Trichomonas vaginitis) การที่มีปากมดลูกอักเสบจากเชื้อติดต่อทางเพศสัมพันธุ์ (Cervicitis) ซึ่งแพทย์จะวินิจฉัยแยกโรคได้จากการซักประวัติลักษณะของตกขาว สี กลิ่น อาการแสบช่องคลอด อาการคัน อาการปวดท้องน้อย หรือแม้แต่รอยโรคในอวัยวะเพศภายนอก การตรวจร่างกายดูลักษณะตกขาว ช่องคลอดและปากมดลูก ตรวจคลำภายในว่ามีการกดเจ็บปากมดลูกปีกมดลูกร่วมด้วยที่จะทำให้คิดถึงภาวะอุ้งเชิงกรานอักเสบร่วมด้วย แพทย์ควรวินิจฉัยให้ถูกต้องเนื่องจากยาที่ใช้ในการรักษาแตกต่างกัน คือ ใช้ยากลุ่มฆ่าเชื้อราเฉพาะที่(Tropical azole drug) ในคนไข้ที่ติดเชื้อราในช่องคลอด(Vaginal candidiasis) และ ยาฆ่าเชื้อกลุ่ม Metronidazole ในคนไข้กลุ่มที่ติดเชื้อแบคทีเรีย (Bacterial vaginosis) และติดเชื้อโปรตัวซัว (Trichomonas vaginitis)
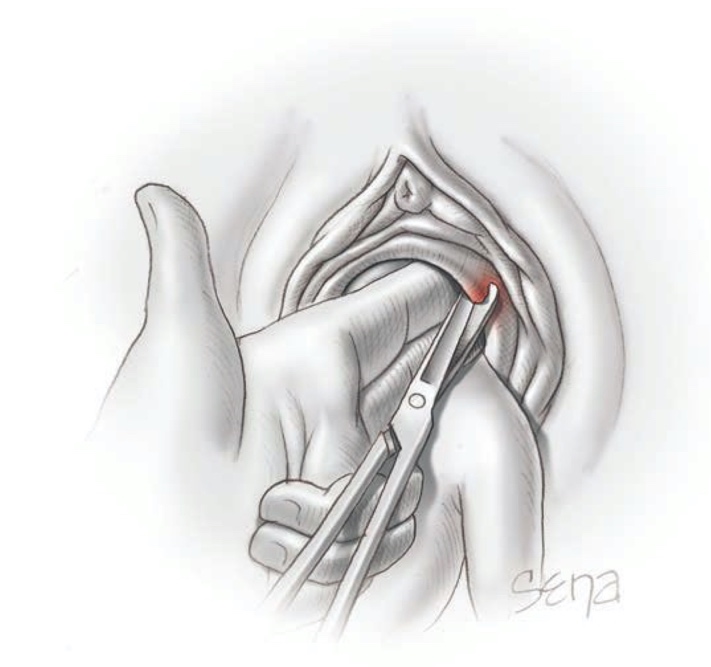
ฝีบริเวณต่อมบาร์โธลิน(Abscess of Bartholin gland)(1)
พบว่าเป็นสาเหตุของอาการเจ็บบริเวณอวัยวะเพศในวัยรุ่นได้บ่อย เกิดจากการติดเชื้อแบคทีเรียหลายตัว การรักษาหลักคือการกรีดระบายหนองร่วมกับเย็บปากถุงน้ำไว้ (Marsupialization) โดยทั่วไปหัตถการนี้สามารถระงับอาการปวดด้วยยาชาเฉพาะที่ได้ แต่ในวัยรุ่นบางรายอาจทนความเจ็บปวดไม่ได้ การทำหัตถการอาจต้องอาศัยการดมยาสลบ
รูปที่ 8 แสดงการทำ Marsupialization
เอกสารอ้างอิง
- Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020. 165-7 p.
- Hillard PJA. Menstruation in young girls: a clinical perspective. Obstetrics & Gynecology. 2002;99(4):655-62.
- Abulafia O, Sherer DM. Angiogenesis of the endometrium. Obstetrics & Gynecology. 1999;94(1):148-53.
- ACOG Committee Opinion no. 598: Committee on Adolescent Health Care: The initial reproductive health visit. Obstet Gynecol. 2014;123(5):1143-7.
- Cheewadhanaraks S, Peeyananjarassri K, Choksuchat C. Clinical diagnosis of hirsutism in Thai women. J Med Assoc Thai. 2004;87(5):459-63.
- Martin KA, Chang RJ, Ehrmann DA, Ibanez L, Lobo RA, Rosenfield RL, et al. Evaluation and treatment of hirsutism in premenopausal women: an endocrine society clinical practice guideline. The Journal of Clinical Endocrinology & Metabolism. 2008;93(4):1105-20.
- Wild RA. Ferriman Gallwey self-scoring: Performance assessment in women with the polycystic ovary syndrome: The University of Oklahoma Health Sciences Center; 2004.
- Rosenberg M, Waugh MS. Causes and consequences of oral contraceptive noncompliance. American journal of obstetrics and gynecology. 1999;180(2):S276-S9.
- Lockwood CJ, Schatz F, Krikun G. Angiogenic factors and the endometrium following long term progestin only contraception. Histology and histopathology. 2004.
- Oral E, Cağdaş A, Gezer A, Kaleli S, Aydin Y, Öçer F. Hematological abnormalities in adolescent menorrhagia. Archives of gynecology and obstetrics. 2002;266:72-4.
- James AH, Kouides PA, Abdul-Kadir R, Edlund M, Federici AB, Halimeh S, et al. Von Willebrand disease and other bleeding disorders in women: consensus on diagnosis and management from an international expert panel. American journal of obstetrics and gynecology. 2009;201(1):12. e1-. e8.
- Thorne J, James P, Reid R. Heavy menstrual bleeding: is tranexamic acid a safe adjunct to combined hormonal contraception? Contraception. 2018;98(1):1-3.
- Napolitano LM, Kurek S, Luchette FA, Corwin HL, Barie PS, Tisherman SA, et al. Clinical practice guideline: red blood cell transfusion in adult trauma and critical care. Critical care medicine. 2009;37(12):3124-57.
- Borzutzky C, Jaffray J. Diagnosis and management of heavy menstrual bleeding and bleeding disorders in adolescents. JAMA pediatrics. 2020;174(2):186-94.
- Screening and Management of Bleeding Disorders in Adolescents With Heavy Menstrual Bleeding: ACOG COMMITTEE OPINION, Number 785. Obstet Gynecol. 2019;134(3):e71-e83.
- Kantartzis KL, Sucato GS. Menstrual suppression in the adolescent. Journal of pediatric and adolescent gynecology. 2013;26(3):132-7.
- Miller L, Hughes JP. Continuous combination oral contraceptive pills to eliminate withdrawal bleeding: a randomized trial. Obstetrics & Gynecology. 2003;101(4):653-61.
- Obstetricians ACo, Gynecologists. Dysmenorrhea and endometriosis in the adolescent. ACOG Committee opinion no. 760. Obstet Gynecol. 2018;132(6):e249-e58.
- Bonde AA, Korngold EK, Foster BR, Fung AW, Sohaey R, Pettersson DR, et al. Radiological appearances of corpus luteum cysts and their imaging mimics. Abdominal Radiology. 2016;41:2270-82.
- Hazra A, Collison MW, Davis AM. CDC sexually transmitted infections treatment guidelines, 2021. JAMA. 2022;327(9):870-1.
- Diagnosis and Management of Hymenal Variants: ACOG Committee Opinion, Number 780. Obstet Gynecol. 2019;133(6):e372-e6.