การตั้งครรภ์ในวัยรุ่น (Teenage pregnancy)
พ.ญ.อุษมา ช้อนนาค
รศ.ดร.นพ. วีรวิทย์ ปิยะมงคล
คำจำกัดความ
การตั้งครรภ์ในวัยรุ่น หมายถึง การตั้งครรภ์ในสตรีที่มีอายุระหว่าง 10-19 ปี โดยถืออายุ ณ เวลาที่คลอดบุตร ซึ่งในบางการศึกษาจะแบ่งเป็นช่วงวัยรุ่นตอนต้น คือ อายุ 10-14 ปี และช่วงวัยรุ่น คืออายุ 15-19 ปี (1)
โดยปัจจัยเสี่ยงของการตั้งครรภ์ในวัยรุ่นนั้นเกิดจากปัจจัยหลายด้าน เช่น การคุมกำเนิดที่ไม่เหมาะสม การศึกษาต่ำ การที่เริ่มมีเพศสัมพันธ์เร็ว การเข้าถึงทางการแพทย์ไม่ดี ความเชื่อทางศาสนา หรือการที่มีประวัติครอบครัวตั้งครรภ์เมื่อวัยรุ่น
อุบัติการณ์
จากการเก็บข้อมูลทั่วโลกในปี พ.ศ.2558-2564 พบว่ามีสตรีวัยรุ่นที่อายุต่ำกว่า 18 ปีคลอดบุตรอยู่ประมาณ 15 เปอร์เซ็นต์ ซึ่งในประชากรกลุ่มนี้ประมาณ 90 เปอร์เซ็นต์เกิดขึ้นในประเทศที่กำลังพัฒนา (1,2)
สถานการณ์การตั้งครรภ์วัยรุ่นปัจจุบัน ข้อมูลของประเทศสหรัฐอเมริกาในปี พ.ศ. 2563 พบว่าอัตราการตั้งครรภ์ในกลุ่มประชากรวัยเจริญพันธ์นั้นลดลงอย่างต่อเนื่องตั้งแต่ปี พ.ศ.2550 และอัตราการตั้งครรภ์ในกลุ่มประชากรวัยรุ่นนั้นลดลงเช่นเดียวกัน ซึ่งมีอัตราการตั้งครรภ์อยู่ที่ 15.4 ต่อกลุ่มวัยรุ่นที่อายุ 15-19 ปี 1,000 ราย ซึ่งลดลง 8 เปอร์เซ็นต์เมื่อเทียบกับปีก่อนหน้า และลดลง 75 เปอร์เซ็นต์เมื่อเทียบกับปี พ.ศ. 2534 ที่พบว่ามีอัตราการตั้งครรภ์สูงที่สุดคือ 61.8 โดยพบว่ามีการตั้งครรภ์ซ้ำอย่างน้อยเป็นการตั้งครรภ์ครั้งที่สองในกลุ่มวัยรุ่นนี้ประมาณ 15 เปอร์เซ็นต์ (3)
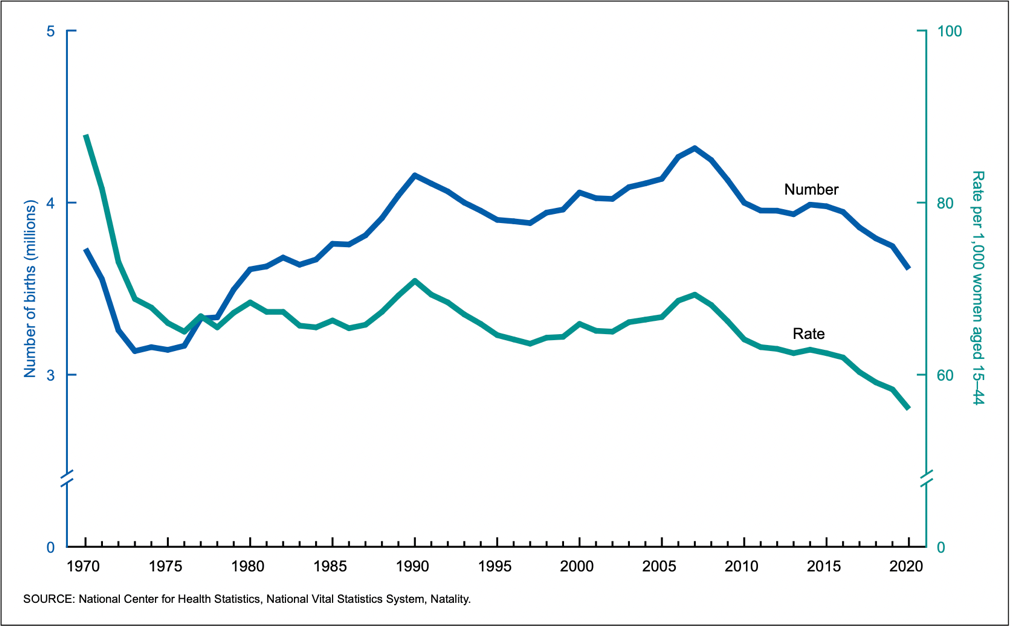
ภาพที่ 1: แสดงอัตราการคลอดบุตรในกลุ่มประชากรวัยเจริญพันธุ์ของประเทศสหรัฐอเมริกา (3)
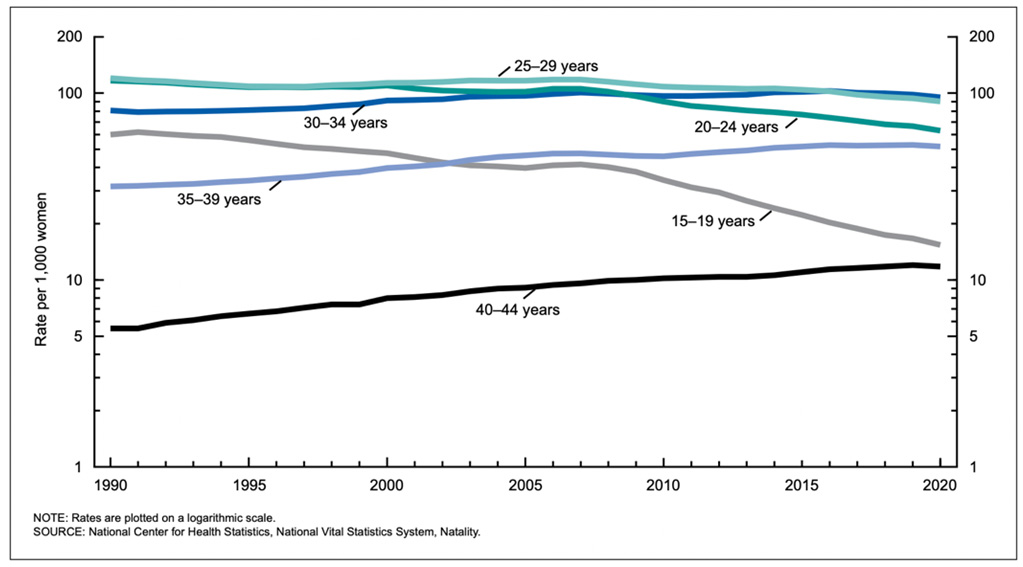
ภาพที่ 2: แสดงอัตราการคลอดบุตรในกลุ่มประชากรแต่ละช่วงอายุของประเทศสหรัฐอเมริกา (3)
สำหรับสถานการณ์ในประเทศไทย ข้อมูลของกรมอนามัยพบว่า การมีเพศสัมพันธ์ของวัยรุ่นมีแนวโน้มเพิ่มขึ้น และอายุที่เริ่มมีเพศสัมพันธ์น้อยลงไป ต่อ 1000 คน ในกลุ่มวัยรุ่นอายุ 15-19 ปี
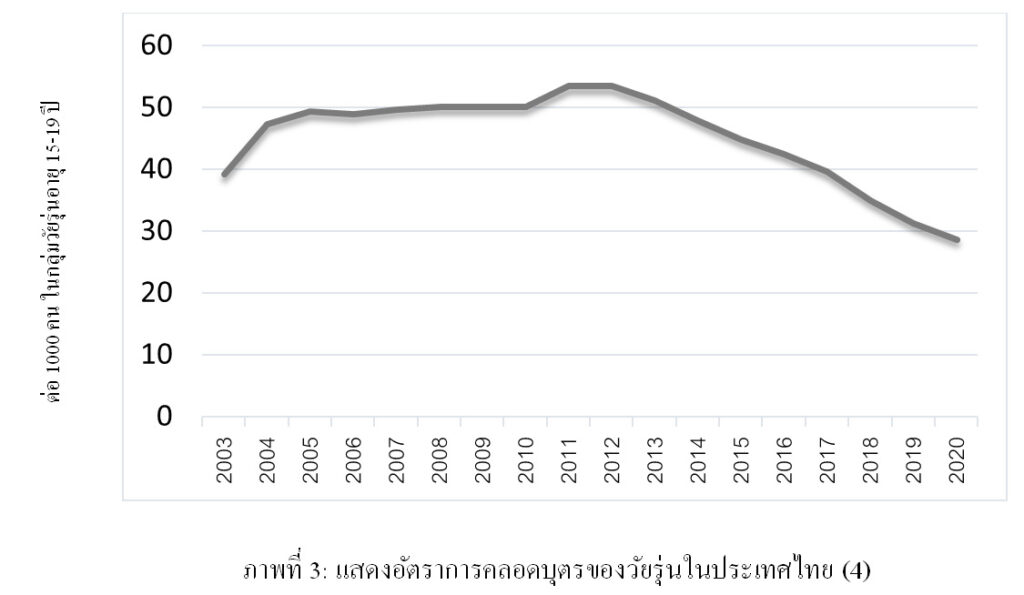
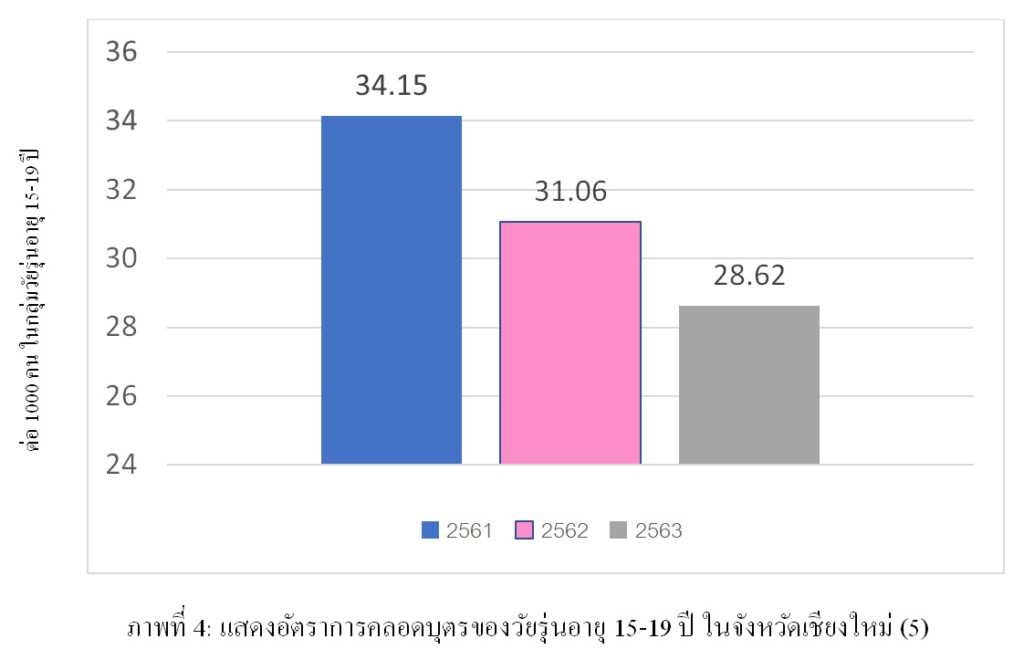
ข้อมูลจากกรมอนามัย ในปี พ.ศ.2563 (4) พบว่าอัตราการคลอดบุตรในกลุ่มตั้งครรภ์วัยรุ่นอยู่ที่ 28.7 ต่อวัยรุ่นอายุ 15-19 ปีจำนวน 1,000 ราย ซึ่งมีแนวโน้มลดลงเช่นเดียวกับแนวโน้มของโลก ซึ่งสาเหตุเกิดจากการที่วัยรุ่นมีการคุมกำเนิดอย่างมีประสิทธิภาพมากขึ้น และการสอนเกี่ยวกับเรื่องเพศให้กับวัยรุ่นมากขึ้น โดยข้อมูลในจังหวัดเชียงใหม่ในปี พ.ศ. 2563 พบว่าจำนวนหญิงตั้งครรภ์ในกลุ่มอายุ 15-19 ปี มีอัตราการคลอดอยู่ที่ 28.69 ต่อวัยรุ่นอายุ 15-19 ปีจำนวน 1,000 ราย ซึ่งมีจำนวนลดลงเมื่อเทียบจากปี พ.ศ. 2561 และปี พ.ศ. 2562 อยู่ที่ 16 และ 7.8 เปอร์เซ็นต์ตามลำดับ
ซึ่งเป็นสัญชาติไทยจำนวน 52.9% และเป็นสัญชาติอื่นร่วมกับกลุ่มชนเผ่าต่างๆ อีกจำนวน 47.1%
แม้ว่าอัตราการตั้งครรภ์ในกลุ่มวัยรุ่นจะลดลงเนื่องจาก การศึกษาที่ดีขึ้น การเข้าถึงการแพทย์ที่ดีขึ้น และการคุมกำเนิดที่มีประสิทธิภาพมากขึ้น แต่อย่างไรก็ตาม ปัญหาการตั้งครรภ์นั้นส่งผลกระทบต่อการใช้ชีวิตของวัยรุ่น โดยมีการวัดเป็น การสูญเสียปีสุขภาวะ หรือ Disability-Adjusted Life Years (DALY) ซึ่งเป็นการวัดการสูญเสียสุขภาวะเป็นจํานวนปี ชีวิตที่ปรับด้วยพิการ มีหน่วยเป็น DALY แทนจํานวนราย พบว่าการตั้งครรภ์ในกลุ่มวัยรุ่นนั้นเป็นสาเหตุ 1 ใน 5 อันดับของการสูญเสียปีสุขภาวะ และการเสียชีวิตของประชากรวัยรุ่นอายุ 15-19 ปี (2)
ผลกระทบต่อการตั้งครรภ์ต่อวัยรุ่น
ด้านมารดา
- ภาวะความดันโลหิตสูงระหว่างการตั้งครรภ์ (Pregnancy induced hypertension)
มีการศึกษาข้อมูลแบบ meta-analysis และ systemic review ขนาดใหญ่ เก็บข้อมูลจำนวน 70 งานวิจัย ผู้เข้าร่วมเป็นประชากรวัยรุ่นทั่วโลก จำนวน 291,247 ราย ตั้งแต่ปี พ.ศ. 2512 ซึ่งจากศึกษาข้อมูลนี้พบว่า การตั้งครรภ์ในวัยรุ่นนั้นเกิดภาวะครรภ์เป็นพิษขึ้น 6.7% ซึ่งมีความเกี่ยวเนื่องกับเศรษฐานะที่ยากจน(6) และมีงานวิจัยที่กล่าวถึงโอกาสการเกิดความดันโลหิตสูง ที่เพิ่มขึ้นในวัยรุ่นเมื่อเทียบกับสตรีตั้งครรภ์ที่อายุมากกว่า โดยมีการพูดถึงสาเหตุที่เกิดจากการเจริญของมดลูกไม่เต็มที่(7) การเจริญของเส้นเลือดและรกที่ไม่ดี ทำให้เพิ่มอัตราการเกิดความดันโลหิตสูงในวัยรุ่นขึ้น 2.29 เท่า(7) แต่อย่างไรก็ตามมีอีกหลายงานวิจัยที่พบว่าไม่ได้แตกต่างกัน (8)
- ภาวะโลหิตจาง (Anemia)
ภาวะโลหิตจาง เป็นปัญหาสำคัญที่พบได้อย่างกว้างขวาง จากการศึกษาแบบ meta-analysis เปรียบเทียบกับสตรีที่อายุมากกว่า 20 ปี พบว่า relative risk เป็น 2.57 (9) สำหรับประเทศกำลังพัฒนาพบว่ามีอุบัติการณ์ของภาวะโลหิตจางในทั้งสองกลุ่มเท่า ๆ กัน แต่ความรุนแรงต่างกัน โดยส่วนใหญ่เกิดจากภาวะทุพโภชนาการ โดยเฉพาะขาดธาตุเหล็ก folic acid การติดเชื้อมาลาเรีย การมีพยาธิในลำไส้ แต่ในประเทศไทยภาวะโรคเลือดจางธาลัสซีเมีย ก็เป็นอีกสาเหตุของภาวะซีดซึ่งอุบัติการณ์แตกต่างกันไปในแต่ละภูมิภาค(10)
- โรคติดต่อทางเพศสัมพันธ์ (sexual transmitted disease)
สำหรับในสตรีวัยรุ่นเป็นวัยที่มีพฤติกรรมทางเพศสม่ำเสมอ มีปัจจัยเสี่ยงต่อการติดเชื้อเอชไอวีและโรคติดต่อทางเพศสัมพันธ์อื่น ๆ เช่น ซิฟิลิส หนองใน เป็นต้น ได้มากขึ้น ทั้งนี้การตั้งครรภ์อาจส่งผลกระทบต่อสุขภาพมารดาและทารก และเพิ่มโอกาสการติดเชื้อจากแม่สู่ลูก ถ้าไม่ได้รับการดูแลรักษาอย่างเหมาะสม(11)
- การเกิดภาวะทุพลภาพและเสียชีวิตของมารดา (morbidity and mortality)
พบภาวะทุพพลภาพและการตายของมารดาในประเทศกำลังพัฒนาได้สูงกว่าในประเทศพัฒนาแล้ว ซึ่งพบในหญิงตั้งครรภ์วัยรุ่นได้มากกว่า สาเหตุเกิดจากการตกเลือดหลังคลอด การติดเชื้อในมดลูก และหากไม่ได้รับการฝากครรภ์จะพบอุบัติการณ์เหล่านี้ได้มากขึ้น(12) ปัจจัยส่งเสริมอื่นๆได้แก่ การมีเศรษฐสถานะต่ำ ระดับการศึกษา ความพร่องในการรับบริการสุขภาพ และการทำแท้งที่ไม่ปลอดภัย จากอุบัติการณ์พบว่าในกลุ่มวัยรุ่นที่ตั้งครรภ์อายุ 15-19 ปี มีการทำแท้งประมาณ 29% และจากการรวบรวมของสาธารณะสุขจังหวัดเชียงใหม่พบว่า การทำแท้งประมาณ 36% ในกลุ่มตั้งครรภ์วัยรุ่น(5)
ด้านทารก
- การคลอดก่อนกำหนด (preterm birth)
การตั้งครรภ์ในวัยรุ่นพบว่า เกิดการคลอดกำหนดมากขึ้น เปรียบเทียบกับหญิงตั้งครรภ์ที่อายุ 20-30 สัปดาห์ โดยเกิดจากหลากหลายสาเหตุ ซึ่งเชื่อว่าเกิดจากการเจริญเติบโตที่ไม่เต็มที่ของวัยรุ่น ซึ่งมีความเกี่ยวข้องกับการดูแลในระยะฝากครรภ์ที่น้อยกว่าปกติ และการฝากครรภ์ช้า(11)
- ทารกน้ำหนักน้อย (low birth weight)
ภาวะทารกน้ำหนักตัวน้อย เป็นผลเกี่ยวเนื่องมาจากภาวะการคลอดก่อนกำหนด ซึ่งในกลุ่มที่ตั้งครรภ์ในวัยรุ่น พบว่ามีอุบัติการณ์การเกิดทารกกลุ่ม extremely low birth weight (น้ำหนักตัวน้อยกว่า 1,000 กรัม) มากขึ้น(11)
- อัตราตายปริกำเนิด (stillbirth)
อัตราตายปริกำเนิดจะเพิ่มขึ้นในสตรีตั้งครรภ์วัยรุ่น จากรายงานส่วนใหญ่ในประเทศที่พัฒนาแล้วและกำลังพัฒนา มีรายงานพบว่าอัตราการเกิดการตายปริกำเนิด เพิ่มขึ้น 4 เท่า ในสตรีตั้งครรภ์วัยรุ่นอายุ 10-14 ปี และอัตราการเกิดการตายปริกำเนิด เพิ่มขึ้นร้อยละ 50 ในกลุ่มสตรีตั้งครรภ์วัยรุ่นอายุ 15-19 ปี(12) ซึ่งเป็นผลจากการคลอดก่อนกำหนด ทารกน้ำหนักน้อย(11)
การดูแลสตรีตั้งครรภ์วัยรุ่น
ระยะก่อนคลอด
ในช่วงระยะก่อนคลอด เป็นช่วงที่สามารถลดภาวะแทรกซ้อนที่จะเกิดขึ้นในการตั้งครรภ์ได้ ซึ่งคือการดูแลในช่วงฝากครรภ์ ให้ดี แต่ปัญหาที่พบคือการมาฝากครรภ์ช้าและการไม่มาฝากครรภ์ ซึ่งควรให้การดูแลดังนี้
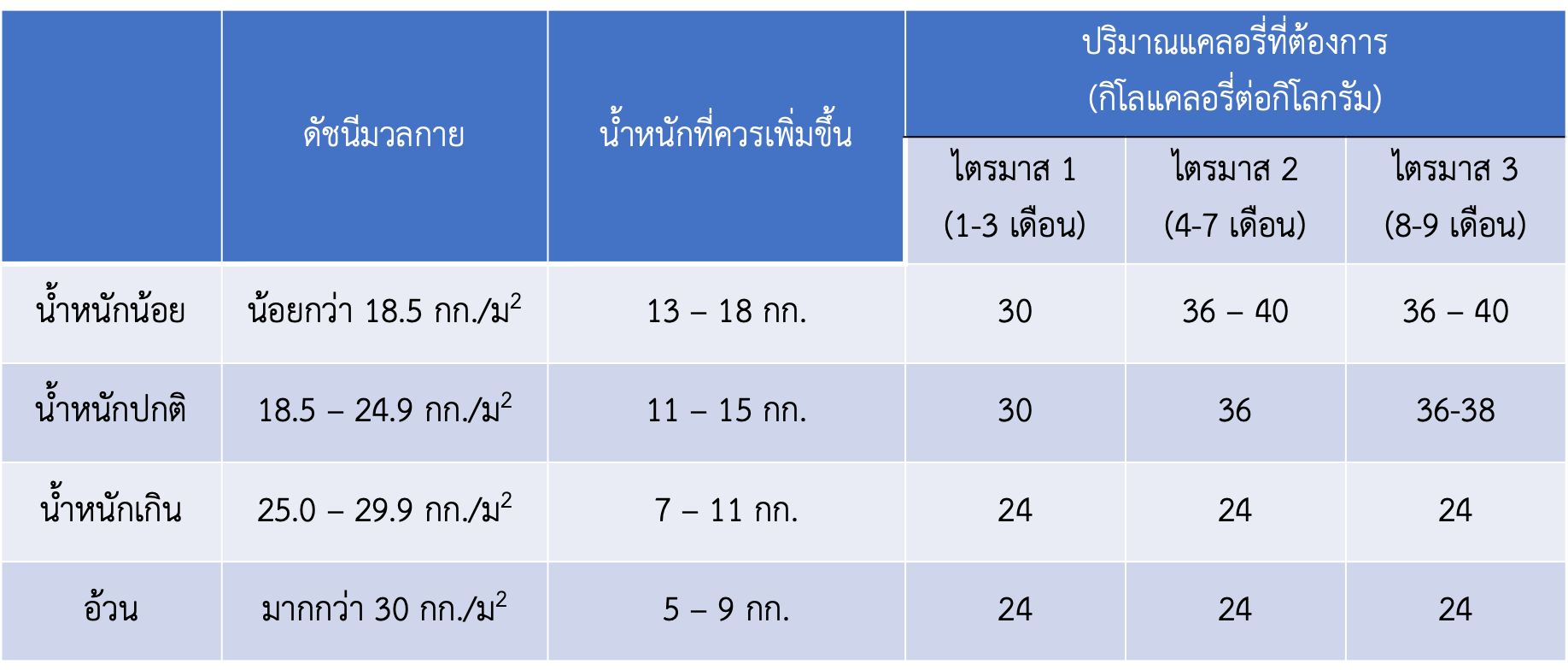
- การให้คำแนะนำเกี่ยวกับภาวะโภชนาการอย่างเหมาะสม เช่น การได้รับธาตุเหล็กที่เหมาะสม ซึ่งในหญิงตั้งครรภ์ควรได้รับธาตุเหล็กวันละ 27 มิลลิกรัม เพื่อลดการเกิดภาวะซีดระหว่างการตั้งครรภ์ และในกลุ่มวัยรุ่นควรได้รับแคลเซียม 1,300 มิลลิกรัมต่อวัน (14)
- การตรวจหาโรคติดต่อทางเพศสัมพันธ์ และการติดเชื้อเอชไอวี เพื่อที่จะให้การรักษาได้เร็วที่สุดและลดการติดเชื้อจากแม่สู่ลูก
- มีการคัดกรองเรื่องการใช้สารเสพติด การสูบบุหรี่ เพื่อลดความเสี่ยงต่อการเกิดภาวะแทรกซ้อนทางสูติศาสตร์ เช่น รกลอกตัวก่อนกำหนด คลอดก่อนกำหนด เป็นต้น เนื่องจากมีการรายงานว่าในกลุ่มสตรีตั้งครรภ์วัยรุ่นมีอัตราการสูบบุหรี่มากกว่าสตรีตั้งครรภ์ที่มีอายุมากกว่า (15)
- ติดตามการเจริญเติบโตของทารกทั้งจากการตรวจร่างกาย และการตรวจอัลตราซาวน์ติดตามน้ำหนัก
- การให้คำแนะนำเกี่ยวกับการนับลูกดิ้น การสังเกตอาการของการเจ็บครรภ์คลอด
- การดูแลสภาพจิตใจ ให้กำลังใจและคำปรึกษากับการเปลี่ยนแปลงทางร่างกายและจิตใจระหว่างการตั้งครรภ์
ระยะคลอด
การดูแลสตรีตั้งครรภ์วัยรุ่นในระยะคลอด ไม่แตกต่างจากสตรีตั้งครรภ์ทั่วไป จากการศึกษาส่วนใหญ่พบว่า ภาวะแทรกซ้อนในช่วงคลอดของสตรีตั้งครรภ์วัยรุ่นน้อยกว่าในผู้ใหญ่ ซึ่งมักเป็นภาวะแทรกซ้อนทางสูติกรรมในระหว่างการตั้งครรภ์ เช่น ภาวะความดันโลหิตสูง ภาวะโลหิตจาง เป็นต้น (8)
มีการรายงานเรื่องช่องทางคลอด(16) พบว่า ในสตรีตั้งครรภ์วัยรุ่นมีอัตราการไปผ่าตัดคลอดน้อยกว่าในสตรีตั้งครรภ์ผู้ใหญ่ ซึ่งข้อบ่งชี้ที่ทำให้ต้องไปผ่าตัดคลอดคือ การเกิดภาวะศีรษะของทารกไม่ได้สัดส่วนกับเชิงกรานมารดา (cephalopelvic disproportion) รองลงมาคือ การเกิดภาวะเครียดของทารกในครรภ์
ระยะหลังคลอด
- การให้คำแนะนำ และกระตุ้นให้สตรีวัยรุ่นเลี้ยงลูกด้วยน้ำนมมารดา
- การประเมินภาวะโภชนาการหลังคลอด เช่น การรับประทานธาตุเหล็กเสริม และการเลือกรับประทานอาหารที่มีคุณค่าทางโภชนาการเพียงพอ เนื่องภาวะซีดยังเป็นปัญหาต่อเนื่องจนถึงช่วงหลังคลอด และการให้นมทารก
- การสนับสนุนให้สตรีวัยรุ่นกลับไปเข้าสู่ระบบการศึกษา และส่งเสริมให้มีพฤติกรรมที่เหมาะสมตามวัย
- การดูแลและประเมินสภาพจิตใจเป็นระยะ เนื่องจากมีการศึกษาพบว่า ในสตรีตั้งครรภ์วัยรุ่นมีการเกิดภาวะซึมเศร้าหลังคลอดได้มากกว่าผู้ใหญ่ประมาณ 2 เท่า ซึ่งเกิดจากหลายปัจจัย เช่น สภาพแวดล้อม การยอมรับของคนในครอบครัวและสังคม การจัดการกับความเครียดที่ไม่เหมาะสม โดยอาการที่จะพบได้คือ มีความเครียดในการเลี้ยงดูบุตรมากขึ้น ไม่มีความสัมพันธ์ที่ดีกับทารก รู้สึกเหนื่อยง่ากว่ายปกติ และรู้สึกไร้ค่า เป็นต้น (17)
การป้องกันการตั้งครรภ์ในวัยรุ่น
จากการเก็บรวบรวมข้อมูลการตั้งครรภ์ในวัยรุ่น(3) พบว่า ประมาณ 85% ของการตั้งครรภ์ในวัยรุ่นเกิดจากการที่ไม่ได้วางแผน และข้อมูลจากกรมอนามัยประเทศไทย(4) พบว่าประมาณ 7.8% ของการตั้งครรภ์ในวัยรุ่นนั้นเป็นการตั้งครรภ์ซ้ำเป็นครรภ์ที่สอง เพราะฉะนั้นการคุมกำเนิดจึงเป็นการป้องกันที่สำคัญ
การป้องกันปัญหาการตั้งครรภ์ในวัยรุ่นนี้ ต้องอาศัยความร่วมมือจากหลายภาคส่วนทั้งภาครัฐ และภาคเอกชน เช่น มีการให้ความช่วยเหลือและเปิดโอกาสให้กับหญิงตั้งครรภ์กลับเข้าสู่ระบบการศึกษาอีกครั้ง สนับสนุนการเข้าถึงข้อมูลการคุมกำเนิด มีการให้ความรู้เกี่ยวกับเพศศึกษาที่เหมาะสม การสนับสนุนให้มีการคุมกำเนิดหลังคลอดหรือหลังแท้งแก่วัยรุ่น โดยการเยี่ยมบ้านหรือนัดตรวจติดตาม เพื่อลดโอกาสการตั้งครรภ์ซ้ำในวัยรุ่น
การคุมกำเนิด
การคุมกำเนิดมีหลากหลายวิธีการ แต่วิธีการที่เหมาะสมในวัยรุ่น ควรต้องใช้ง่าย ไม่ต้องพบแพทย์บ่อย สามารถคุมกำเนิดได้ระยะยาว ราคาถูก และปลอดภัย
ในคำแนะนำของ American College of Obstetrics and Gynecology (ACOG) แนะนำให้การคุมกำเนิดแบบกึ่งถาวร (Long-acting reversible contraception) เช่น การฝังยาคุมกำเนิด การใส่ห่วงคุมกำเนิด เป็นต้น ซึ่งสามารถคุมกำเนิดได้ระยะเวลานาน และควรเริ่มคุมกำเนิดทันทีหลังคลอด ซึ่งวิธีการนี้ไม่มีผลกระทบกับการให้นมบุตร อีกทั้งควรคุมกำเกิดด้วยวิธีการ dual method คือมีการใช้ถุงยางอนามัยร่วมด้วย เพื่อช่วยลดการติดต่อทางเพศสัมพันธ์ (18,19)
สำหรับประเทศไทยทางสำนักงานหลักประกันสุขภาพแห่งชาติให้สิทธิ์ “วัยรุ่นที่อายุต่ำกว่า 20 ปี สามารถเข้ารับบริการคุมกำเนิดและยุติการตั้งครรภ์อย่างปลอดภัยโดยไม่ต้องเสียค่าใช้จ่าย” ณ สถานบริการในเครือข่ายของสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) (20)
สรุป
ปัจจุบันอุบัติการณ์การตั้งครรภ์ในวัยรุ่นมีแนวโน้มลดลง เนื่องจากการสนับสนุนเรื่องของการคุมกำเนิดมากขึ้น และวัยรุ่นเข้าถึงข้อมูลเรื่องเพศศึกษาและการคุมกำเนิดที่มีประสิทธิภาพมากขึ้นเช่นกันอย่างไรก็ตาม การตั้งครรภ์ในวัยรุ่นมักเป็นการตั้งครรภ์ไม่พร้อม และโดยส่วนมากไม่ได้รับการดูแลครรภ์ที่เหมาะสม ทำให้เกิดภาวะแทรกซ้อนต่าง ๆ ทั้งต่อหญิงตั้งครรภ์และทารกในครรภ์ เช่น เกิดภาวะความดันโลหิตสูงระหว่างการตั้งครรภ์ได้ประมาณ 6.7% เกิดภาวะซีด มีโอกาสติดเชื้อโรคติดต่อทางเพศสัมพันธ์และเกิดภาวะทุพลภาพและเสียชีวิตของมารดาได้มากกว่าการตั้งครรภ์ในผู้ใหญ่ อีกทั้งพบการเพิ่มของอุบัติการณ์การคลอดก่อนกำหนด เพิ่มอัตราการตายปริกำเนิด เพิ่มขึ้นของทารกน้ำหนักตัวน้อย ซึ่งเป็นความเกี่ยวเนื่องมาจากการคลอดก่อนกำหนด
การดูแลสตรีตั้งครรภ์วัยรุ่นในระยะก่อนคลอดอย่างเหมาะสม จะช่วยลดภาวะแทรกซ้อนที่เกิดขึ้นได้ เช่น การได้รับการดูแลในเรื่องของโภชนการอย่างเหมาะสม สามารถช่วยลดการเกิดภาวะซีดได้ การคัดกรองเรื่องโรคติดต่อทางเพศสัมพันธ์ การคัดกรองเรื่องการใช้ยาเสพติด เป็นต้น ในระยะหลังคลอดควรมีการกระตุ้นเรื่องการให้นมบุตร การคุมกำเนิดอย่างเหมาะสม ซึ่งแนะนำเป็นการคุมกำเนิดชนิดกึ่งถาวร ร่วมกับการใช้ถุงยางอนามัย และประเมินสภาพจิตใจ เนื่องจากมีโอกาสเกิดการภาวะซึมเศร้าหลังคลอด
เนื่องจากการตั้งครรภ์เป็นปัญหาระดับประเทศ ดังนั้นการป้องกันและแก้ปัญหาการตั้งครรภ์ในวัยรุ่น ต้องอาศัยความร่วมมือจากหลายภาคส่วนเพื่อให้เกิดประสิทธิภาพที่สุด
เอกสารอ้างอิง
- Ganchimeg T, Ota E, Morisaki N, et al: Pregnancy and childbirth outcomes among adolescent mothers: a World Health Organization multicountry study. BJOG. 2014, 121 Suppl 1:40-8.
- UNICEF: Earlychild bearing. (2021). Acessed: May 10,2022
- Osterman, M. J. K., Hamilton, B. E., Martin, J. A., Driscoll, A. K., & Valenzuela, C.P. (2022). Births: Final data for 2020 (National Vital Statistics Reports Volume 70, Number 17). Centers for Disease Control and Prevention.
- ข้อมูลหญิงคลอด อายุ 15-19 ปี และข้อมูลประชากรกลางปี พ.ศ. 2553-2563 กองยุทธศาสตร์ และแผนงาน กระทรวงสาธารณสุข ประเทศไทย
- ข้อมูลจากรายงานงานอนามัยแม่และเด็ก (ก1ก2) ปี 2564 สำนักงานสาธารณะสุข จังหวัดเชียงใหม่
- Macedo, T. C. Prevalence of Preeclampsia and Eclampsia in Adolescent Pregnancy: A Systematic Review and Meta-Analysis of 291,247 Adolescents Worldwide since 1969.
- Brosens I, Muter J, Ewington L, Puttermans P, Petraglia F, Brosens JJ, Benagiano G: Adolescent preeclampsia: pathological drivers and clinical prevention. Reprod Sci. 2019, 26:159-71
- Zhang T, Wang H, Wang X, et al. The adverse maternal and perinatal outcomes of adolescent pregnancy: a cross sectional study in Hebei, China. BMC Pregnancy Childbirth. 2020;20(1):339.
- Scholl TO, Hediger ML, Belsky DH. Prenatal care and maternal health during adolescent pregnancy: a review and meta-analysis. J Adolesc Health 1994 Sep;15(6):444-56.
- Sekhar DL, Murray-Kolb LE, Kunselman AR, Weisman CS, Paul IM: Differences in risk factors for anemia between adolescent and adult women. J Womens Health (Larchmt). 2016, 25:505-13.
- Marvin-Dowle K, Kilner K, Burley VJ, Soltani H. Impact of adolescent age on maternal and neonatal outcomes in the Born in Bradford cohort. BMJ Open. 2018, 8:e016258.
- Conde-Agudelo A, Belizán JM, Lammers C. Maternal-perinatal morbidity and mortality associated with adolescent pregnancy in Latin America: cross-sectional study. Am J Obstet Gynecol. 2005, 192:342-9.
- Wilson RE, Alio AP, Kirby RS, Salihu HM. Young maternal age and risk of intrapartum stillbirth. Arch Gynecol Obstet. 2008, 278:231-6.
- Institute of Medicine (U.S.).Panel on Micronutrients IoMUSFaNB. Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and Zinc. Washington DC: National Academy Press; 2000.
- Australian institute of health and welfare. Teenage mothers in Australia 2015. Cat. No. PER 93. Canberra: AIHW, 2018
- Uzunov A, Bohiltea R, Munteanu O, Nemescu D, Cirstoiu M. A retrospective study regarding the method of delivery of adolescents in a Romanian Hospital. Exp Ther Med. Published online June 4, 2020.
- Goossens G, Kadji C, Delvenne V: Teenage pregnancy: a psychopathological risk for mothers and babies?. Psychiatr Danub. 2015, 27 Suppl 1:S499-503.
- Adolescent Pregnancy, Contraception, and Sexual Activity. Committee opinion number 699. ACOG. 2017 May; 129:e142-9
- Adolescent Pregnancy, Contraception, and Sexual Activity. Committee opinion number 710. ACOG. 2017 Aug; 130:e74-80
- กรมอนามัย กระทรวงสาธารณสุข ประเทศไทย


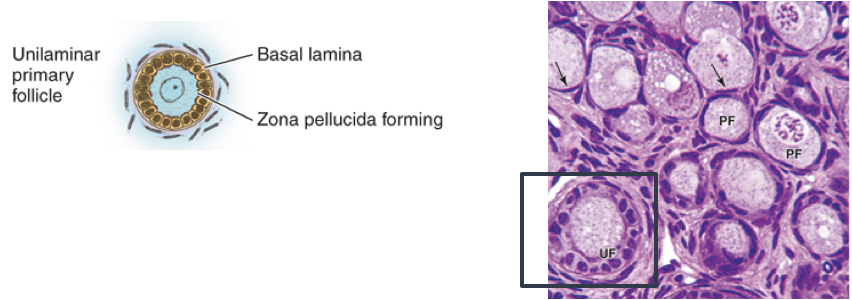
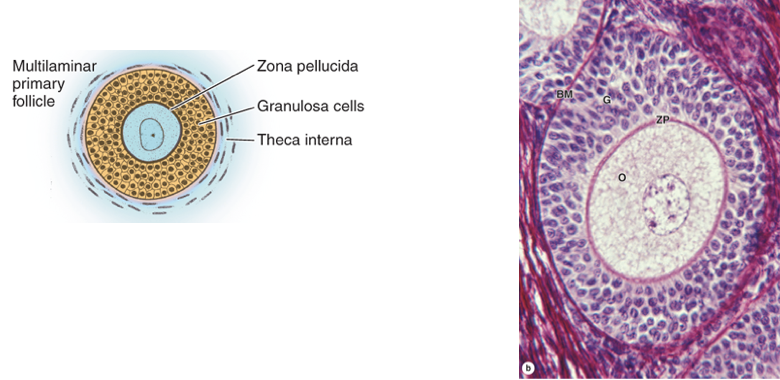
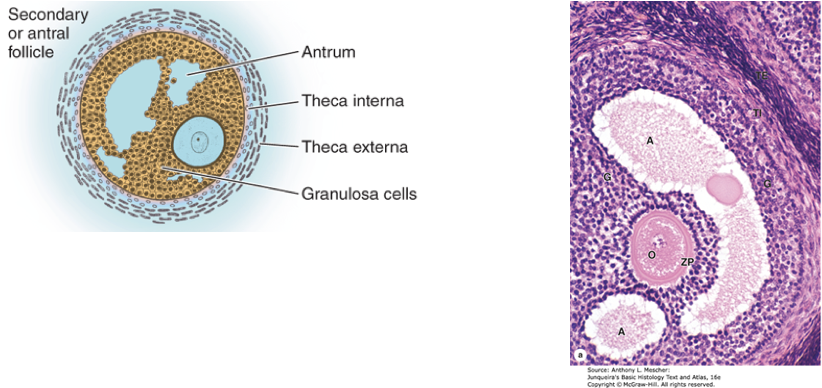
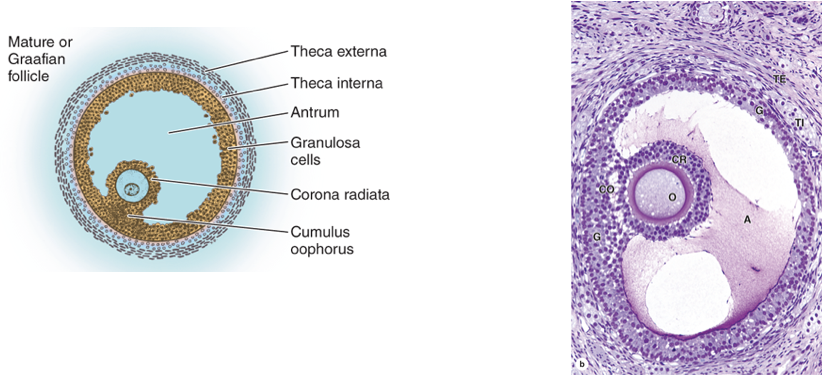
 รูปที่ 1 แสดงการพัฒนาของฟอลลิเคิลในแต่ละระยะ
รูปที่ 1 แสดงการพัฒนาของฟอลลิเคิลในแต่ละระยะ


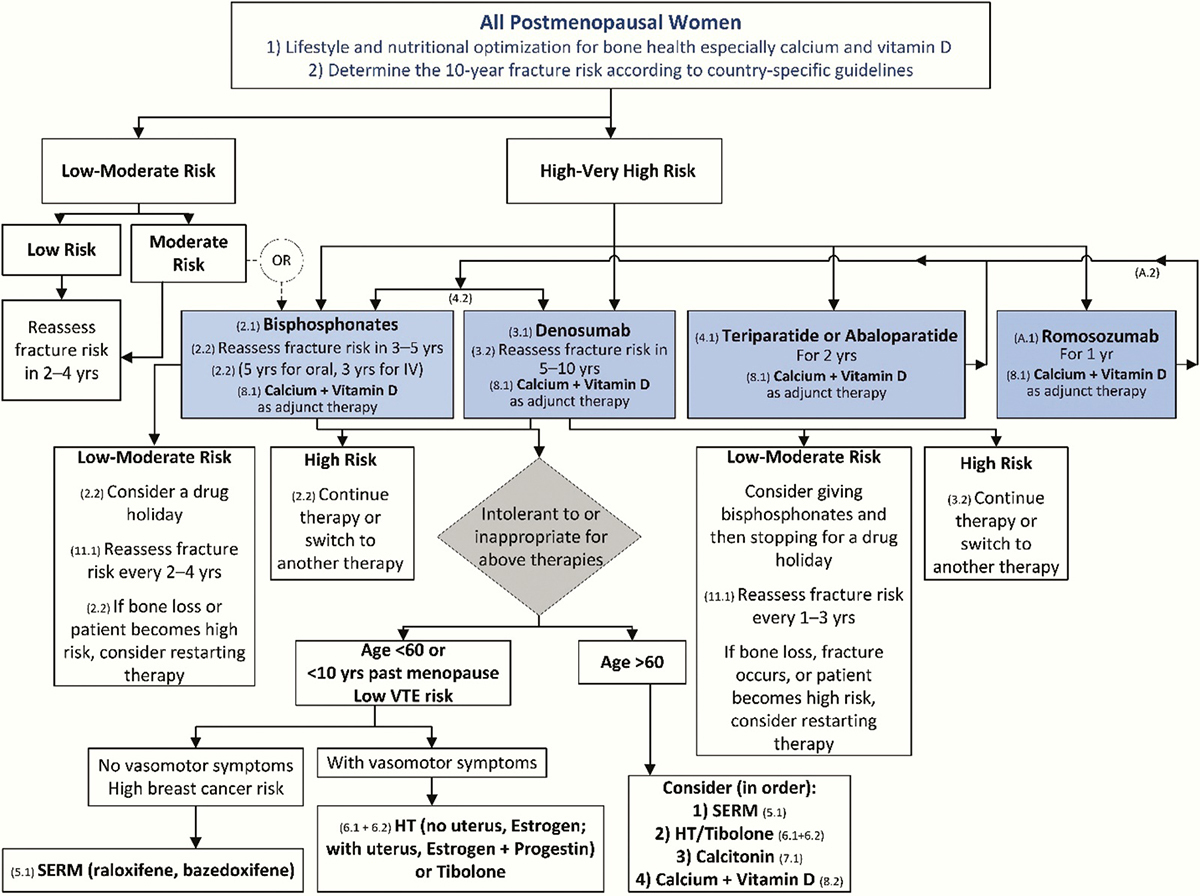
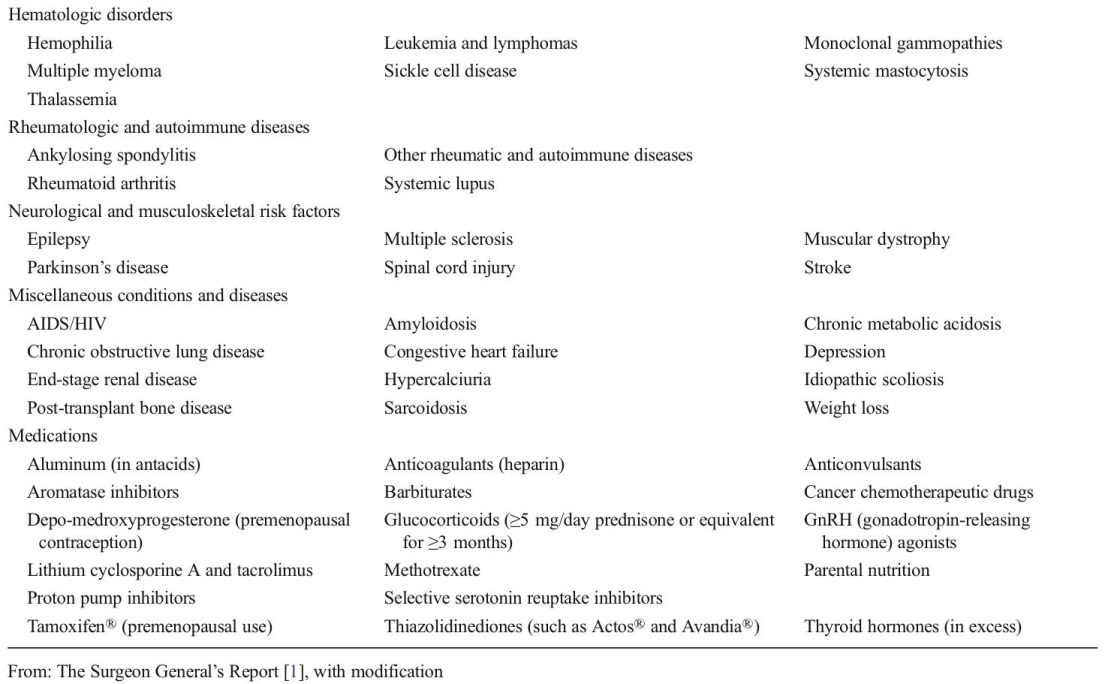 ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)
ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)