การผ่าตัดมดลูกผ่านกล้อง (Laparoscopic hysterectomy)
การผ่าตัดมดลูกผ่านกล้อง (Laparoscopic hysterectomy)
นพ. ยศกร พรเกษมศาสตร์
ผศ. นพ. มนัสวี มะโนปัญญา
บทนำ
การผ่าตัดมดลูก (hysterectomy) เป็นการผ่าตัดทางสูตินรีเวชที่พบได้บ่อยเป็นอันดับสองรองจากการผ่าตัดคลอด ที่ผ่านมามีการพัฒนาเทคนิคและวิธีการผ่าตัดเพื่อเพิ่มประสิทธิภาพและลดภาวะแทรกซ้อนของการตัดมดลูก โดยการผ่าตัดมดลูกผ่านกล้องเป็นหนึ่งในวิธีการผ่าตัดมดลูกที่ช่วยลดระยะเวลาการนอนโรงพยาบาล เจ็บแผลผ่าตัดน้อยและฟื้นตัวเร็ว
การผ่าตัดมดลูกผ่านกล้องถูกคิดค้นโดย Harry Reich และ John DeCaprio ในปี ค.ศ. 1989 หลังจากนั้นความนิยมในการผ่าตัดมดลูกผ่านกล้องเพิ่มมากขึ้นจากร้อยละ 0.5 ในปี ค.ศ. 1990 มาเป็นร้อยละ 25 ของการผ่าตัดมดลูกในปัจจุบัน
การผ่าตัดมดลูกวิธีต่างๆ และข้อดีข้อเสียของแต่ละวิธี
การผ่าตัดมดลูกสามารถทำได้ด้วยการผ่าตัดเปิดทางหน้าท้อง (abdominal hysterectomy) การผ่าตัดทางช่องคลอด (vaginal hysterectomy) และการผ่าตัดผ่านกล้อง (laparoscopic hysterectomy) จากการทบทวนวรรณกรรมอย่างเป็นระบบในปี ค.ศ. 2015 เปรียบเทียบการผ่าตัดมดลูกด้วยวิธีต่างๆ พบว่า [1]
- vaginal hysterectomy เทียบกับ abdominal hysterectomy
พบว่า vaginal hysterectomy มีระยะเวลาการนอนโรงพยาบาลสั้นกว่า สามารถกลับไปมีกิจวัตรประจำวันได้เร็วกว่า และมีความเจ็บปวดหลังผ่าตัดน้อยกว่า - vaginal hysterectomy เทียบกับ laparoscopic hysterectomy
พบว่า vaginal hysterectomy มีระยะเวลาในการผ่าตัดสั้นกว่า และค่าใช้จ่ายในการรักษาน้อยกว่า โดยไม่พบความแตกต่างของการบาดเจ็บของทางเดินปัสสาวะ - laparoscopic hysterectomy เทียบกับ abdominal hysterectomy
พบว่า laparoscopic hysterectomy มีระยะเวลาการนอนโรงพยาบาลสั้นกว่า สามารถกลับไปมีกิจวัตรประจำวันได้เร็วกว่า มีการติดเชื้อของแผลที่น้อยกว่า แต่พบว่าใช้ระยะเวลาในการผ่าตัดมากกว่าและมีโอกาสเกิดการบาดเจ็บต่อทางเดินปัสสาวะมากกว่า
จากข้อมูลดังกล่าวสมาคมสูติศาสตร์และนรีเวชวิทยาวิทยาลัยอเมริกัน (ACOG; American College of Obstetricians and Gynecologists) จึงแนะนำ vaginal hysterectomy เป็นวิธีแรก หากในกรณีที่ไม่สามารถทำ vaginal hysterectomy ได้ เช่น มีรอยโรคอื่นที่ไม่สามารถผ่าตัดผ่านช่องคลอดได้, มีภาวะอ้วน หรือไม่มีภาวะมดลูกหย่อนร่วมด้วย แนะนำ laparoscopic hysterectomy เป็นทางเลือกถัดมา [2]
ข้อบ่งชี้และข้อห้ามในการผ่าตัดมดลูกผ่านกล้อง
ข้อบ่งชี้ในการผ่าตัดมดลูกผ่านกล้องเหมือนกับในกรณีผ่าตัดมดลูกด้วยวิธีอื่นๆ และในผู้ป่วยมะเร็งนรีเวชบางรายสามารถผ่าตัดมดลูกผ่านกล้องได้โดยมีข้อพิจารณาดังนี้
ในมะเร็งเยื่อบุโพรงมดลูกมีรายงานการศึกษาแบบสุ่มเปรียบเทียบพบว่ากลุ่มผู้ป่วยมะเร็งเยื่อบุโพรงมดลูกระยะที่ I ถึง IIA (FIGO 1988) ที่ได้รับการผ่าตัดผ่านกล้องมีภาวะแทรกซ้อนหลังการผ่าตัดต่ำกว่าและระยะเวลาการพักฟื้นสั้นกว่าการผ่าตัดเปิดหน้าท้อง โดยที่ผลลัพธ์ของการรักษาไม่ต่างกัน [3, 4]
ในมะเร็งรังไข่ระยะต้น (early stage ovarian cancer) ยังไม่มีการศึกษาการศึกษาแบบสุ่มเปรียบเทียบแต่จากรายงานการศึกษาข้อมูลแบบย้อนหลังพบว่าการผ่าตัดผ่านกล้องมีผลลัพธ์ของการรักษาไม่ต่างจากการผ่าตัดเปิดหน้าท้อง ถึงแม้ว่าการผ่าตัดผ่านกล้องมีโอกาสในการเกิดการแตกของก้อนขณะผ่าตัดได้สูงกว่า [5, 6]
ในมะเร็งปากมดลูกมีรายงานการศึกษาแบบสุ่มเปรียบเทียบในกลุ่มผู้ป่วยระยะ IA ที่มีการลุกล้ำหลอดน้ำเหลือง (lymphovascular space invasion; LVSI) ถึง IB1 (FIGO 2008) ที่ต้องได้รับการผ่าตัดมดลูกแบบถอนรากถอนโคน (radical hysterectomy) พบว่าการผ่าตัดผ่านกล้องมีอัตราการรอดชีพโดยปราศจากโรคและอัตราการรอดชีพรวมต่ำกว่าการผ่าตัดแบบเปิดหน้าท้อง [7] จากข้อมูลดังกล่าวข้างต้นในกรณีที่ต้องตัดมดลูกแบบถอนรากถอนโคนจึงแนะนำให้เลือกผ่าตัดแบบเปิดหน้าท้องร่วมกับการดูแลผู้ป่วยผ่าตัดตามแนวทางส่งเสริมการฟื้นตัวหลังผ่าตัด (enhanced recovery after surgery; ERAS) [8]
ข้อห้ามของการผ่าตัดมดลูกผ่านกล้องนั้นมีดังนี้
- มีโรคประจำตัวหรือภาวะทางอายุรกรรมที่ไม่สามารถทนต่อการเพิ่มความดันในช่องท้องจากการใส่ก๊าซ (pneumoperitoneum) หรือการอยู่ในท่าที่ศีรษะอยู่ต่ำ (Trendelenburg position)
- ทราบอยู่ก่อนว่าเป็นมะเร็งของมดลูกหรือรังไข่ที่ไม่สามารถเอาชิ้นเนื้อออกมาได้โดยก้อนไม่แตกหรือต้องทำการย่อยชิ้นเนื้อ (morcellation)
- แพทย์ผู้ผ่าตัดหรือสถานพยาบาลยังไม่มีความพร้อมสำหรับการผ่าตัดผ่านกล้อง
ในกรณีที่มีประวัติสงสัยพังผืดในช่องท้องหรือมีมดลูกขนาดใหญ่ไม่ได้เป็นข้อห้ามในการผ่าตัดผ่านกล้อง แต่อาจทำให้การผ่าตัดมีข้อจำกัดหรือผ่ายากขึ้น โดยผู้ป่วยที่มีพังผืดในช่องท้องมีโอกาสในการเกิดการบาดเจ็บอวัยวะในช่องท้องได้มากขึ้น และกรณีที่มีพังผืดบริเวณหลังมดลูกอาจทำให้โยกขยับมดลูกยาก อย่างไรก็ตามการผ่าตัดผ่านกล้องสามารถเห็นรอยโรคได้ชัดเจนกว่าการผ่าตัดทางหน้าท้อง สำหรับมดลูกที่มีขนาดใหญ่กว่า 14 สัปดาห์หรือมีการโตออกด้านข้างอาจทำให้การจี้หรือผูกหลอดเลือด uterine หรือการหาท่อไตเป็นไปได้ยากขึ้น [9]
ขั้นตอนในการผ่าตัดมดลูกผ่านกล้อง (total laparoscopic hysterectomy) [10, 11]
-
การจัดท่าผู้ป่วย
จัดท่าผู้ป่วยให้อยู่ในท่า low lithotomy โดยให้บั้นท้ายของผู้ป่วยเลยขอบเตียงประมาณ 3-4 เซนติเมตร เนื่องจากขณะผ่าตัดจะมีการปรับเตียงให้ศีรษะต่ำทำให้มีการเคลื่อนตัวของผู้ป่วยเล็กน้อย ซึ่งหากมีการเคลื่อนจนขอบเตียงพ้นบั้นท้ายของคนไข้จะทำให้การโยกขยับมดลูกทำได้ยากและส่งผลทำให้การผ่าตัดยากขึ้น นอกจากนั้นควรยึดตัวผู้ป่วยให้ติดกับเตียงเพื่อป้องกันไม่ให้ตัวของผู้ป่วยเกิดการเคลื่อนระหว่างการผ่าตัดโดยเฉพาะในรายที่มีภาวะอ้วน
การจัดขาหยั่งแนะนำให้ใช้ boot stirrups ซึ่งจะไม่มีการกดทับบริเวณ common peroneal nerve ปรับ stirrups ให้มุมระหว่างลำตัวและข้อสะโพกอยู่ที่ 170 องศา เนื่องจากการงอมากขึ้นจะเกิดการกดทับเส้นประสาท obturator มุมงอของข้อเข่าควรอยู่ใน 90-120 องศา การงอมากเกินไปจะทำให้การไหลเวียนเลือดกลับสู่หัวใจช้าลงและเพิ่มการเกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ (venous thromboembolism; VTE) ได้ ส่วนการเหยียดเข่ามากเกินไปจะเพิ่มการบาดเจ็บต่อเส้นประสาท sciatic มุมกางของข้อสะโพก (hip abduction) มุมระหว่างต้นขาด้านในทั้งสองข้างควรอยู่ที่ 90 องศาหรือน้อยกว่า กรณีข้อสะโพกกางมากเกินไปจะเกิดการบาดเจ็บต่อเส้นประสาท obturator ได้
การจัดแขนของผู้ป่วย ให้แขนอยู่แนบลำตัว เนื่องการกางแขนมีโอกาสบาดเจ็บต่อ brachial plexus เพิ่มขึ้น
-
การใส่อุปกรณ์สำหรับการโยกขยับมดลูก (uterine manipulator)
อุปกรณ์สำหรับการโยกขยับมดลูกมีความสำคัญในการผ่าตัด โดยมีส่วนของแกนที่ทำหน้าที่เพื่อปรับเปลี่ยนแกนของมดลูกขณะผ่าตัด และมีส่วนของ cervical cup ที่ทำหน้าที่ในการครอบบริเวณของปากมดลูกเพื่อใช้ในขั้นตอนการตัดช่องคลอด ในกรณีผ่าตัดเนื่องจากมะเร็งปากมดลูกควรหลีกเลี่ยงการใช้อุปกรณ์สำหรับการโยกขยับมดลูกเพื่อลดโอกาสการนำเซลล์มะเร็งเข้าสู่ช่องท้อง โดยเครื่องมือที่ใช้มีอยู่หลากหลายชนิดตามลักษณะการใช้งานและความถนัดของแพทย์ผู้ผ่าตัด ดังแสดงในรูปที่ 1
-
- Hohl uterine manipulator: เป็นชนิดที่ใช้บ่อยที่สุด มีความแข็งแรงสูง และสามารถนำมาใช้ซ้ำได้ แต่อาจไม่เหมาะในกรณีที่ช่องคลอดแคบ
- Valtchev uterine manipulator: มีข้อดีในการที่มีการแยกแกนของมดลูก สามารถ anti-flex ตัวมดลูกได้ แต่ไม่เหมาะในกรณีที่มดลูกใหญ่เนื่องจากแกนมีความยาวไม่มาก
- RUMI uterine manipulator: ใช้ในกรณีต้องการฉีดสีดูท่อนำไข่ และในกรณีที่มดลูกและปากมดลูกขนาดเล็ก เนื่องจากส่วนของแกนมีขนาดเล็ก
ก.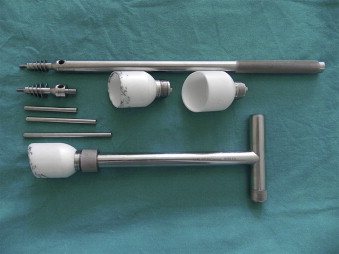
ข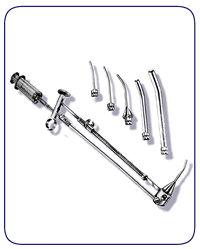
ค.
รูปที่ 1: แสดงอุปกรณ์สำหรับการโยกขยับมดลูกชนิด Hohl uterine manipulator (ก.) Valtchev uterine manipulator (ข.) และ RUMI uterine manipulator (ค.)
ที่มา: (ก). Ali , A. (2013). The Hohl uterine manipulator [image]. Https://www.sciencedirect.com/science/article/pii/S221026121300309X#fig0005
(ข) Artisan medical devices. Valtchev uterine manipulator mobilizer [image]. https://artisanmed.com/product/valtchev-uterine-manipulator-mobilizer/
(ค) CooperSurgical. RUMI II System with Koh-efficient technology [image]. https://www.coopersurgical.com/detail/rumi-ii-system-with-koh-efficient-technology/
-
การเข้าช่องท้องและการกำหนดตำแหน่ง primary และ ancillary trocar
เริ่มต้นด้วยการใส่สายยางทางปากหรือจมูกเพื่อลดการโป่งขยายของกระเพาะอาหาร จัดท่าผู้ป่วยให้อยู่ในแนวราบ จากนั้นเข้าช่องท้องบริเวณฐานของสะดือ โดยสามารถเลือกใช้ได้ทั้ง veress needle, direct, optical trocar และ open (Hasson) entry ขึ้นกับประสบการณ์ของแพทย์ผู้ทำผ่าตัดเป็นสำคัญ ในกรณีที่ใช้ veress needle ควรจับเครื่องมือทำมุม 45 องศากับผนังหน้าท้องเพื่อหลีกเลี่ยงการบาดเจ็บต่อหลอดเลือด aorta แต่ในกรณีที่ผู้ป่วยอ้วนมากควรจับเครื่องมือทำมุม 90 องศา จากนั้นจึงทำการทดสอบเพื่อยืนยันตำแหน่งของปลาย veress needle ด้วยวิธี gas insufflation test เมื่อยืนยันได้ว่าปลายเข็มเข้าสู่ช่องท้องจึงเริ่มใส่ก๊าซ CO2 เมื่อความดันในช่องท้องสูงถึง 20-30 มิลลิเมตรปรอทจึงใช้ primary trocar แทงเข้าช่องท้องต่อไป โดยทั่วไปแนะนำให้ใช้ trocar ขนาดเส้นผ่านศูนย์กลาง 10-12 มิลลิเมตร ในกรณีที่มดลูกมีขนาดใหญ่ถึงระดับสะดือหรือสงสัยว่ามีพังผืดบริเวณสะดือควรเข้าช่องท้องด้วยวิธี open entry (Hasson technique) บริเวณสะดือ หรือเปลี่ยนตำแหน่งการเข้าช่องท้องให้สูงกว่าสะดือประมาณ 10 เซนติเมตร (Lee-Huang point) หรือตำแหน่ง Palmer’s point ซึ่งอยู่ใต้ต่อชายโครงด้านซ้ายแทน [12]
เมื่อสามารถเข้าช่องท้องได้สำเร็จควรสำรวจอวัยวะที่อยู่ใต้ต่อตำแหน่งการแทง trocar โดยเฉพาะอย่างยิ่ง ลำไส้ และหลอดเลือด เพื่อมองหาร่องรอยการบาดเจ็บหรือฉีกขาดจากการแทง veress needle หรือ trocar จากนั้นจึงลดแรงดันของก๊าซ CO2 ให้เหลือประมาณ 12 ถึง 15 มิลลิเมตรปรอท พร้อมกับปรับเตียงผ่าตัดให้ศีรษะต่ำ (Trendelenburg position) จากนั้นจึงพิจารณากำหนดตำแหน่งการแทง ancillary trocars โดยมักใช้ ancillary trocars ขนาดเส้นผ่านศูนย์กลาง 5 มิลลิเมตร จำนวนทั้งสิ้น 3 อัน โดย 2 อันวางในตำแหน่งเหนือต่อ anterior superior iliac spine ทั้งสองข้าง และขยับเข้าด้านในราว 2 นิ้วมือ แต่ยังอยู่ด้านนอกต่อหลอดเลือด inferior epigastric vessels และ trocar อีก 1 อัน วางในตำแหน่งเหนือต่อกระดูกหัวหน่าวหรือบริเวณด้านข้างของผนังหน้าท้อง (left or right lateral aspect) ให้ห่างจาก trocar ที่อยู่ตำแหน่งซ้ายหรือขวาล่างราว 8 เซนติเมตร โดยในขณะที่แทงควรใช้กล้องส่องจากในช่องท้องเพื่อเลี่ยงการโดน inferior epigastric artery และไฟจากกล้องจะส่องบริเวณผิวหนังเพื่อเลี่ยงการโดนหลอดเลือดบริเวณชั้นใต้ผิวหนัง
-
การตรวจประเมินพยาธิสภาพในช่องท้อง
ก่อนจะเริ่มตัดมดลูกควรตรวจดูอวัยวะในช่องท้องทั้งหมด โดยเริ่มทำการสำรวจบริเวณตับและกระบังลม ตามมาด้วยการตรวจประเมินพยาธิสภาพภายในอุ้งเชิงกราน เริ่มตั้งแต่ pelvic sidewall ทั้งสองข้าง ซึ่งบ่อยครั้งอาจต้องทำการเลาะตัดพังผืดที่ยึดเกาะระหว่าง rectosigmoid กับ pelvic sidewall ทางด้านซ้ายออกก่อน เพื่อให้สามารถมองเห็น pelvic brim, infundibulopelvic ligament และท่อไต ได้อย่างชัดเจน ถัดมาจึงทำการตรวจประเมินบริเวณมดลูก ovarian fossa รังไข่ และท่อนำไข่ทั้งสองข้าง ตรวจหารอยโรคบริเวณ cul-de-sac และกระเพาะปัสสาวะ รวมทั้งมองหาท่อไตทั้งซ้ายและขวา
-
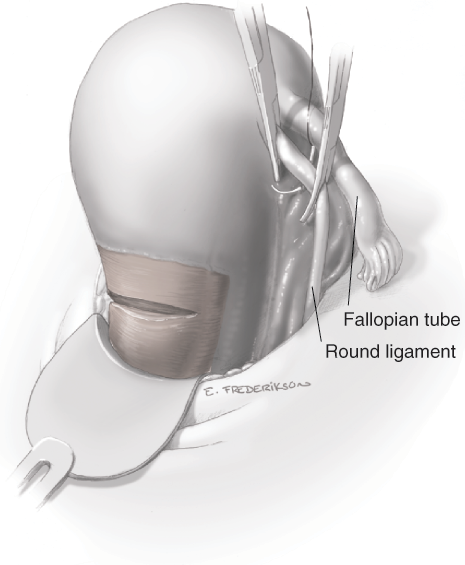
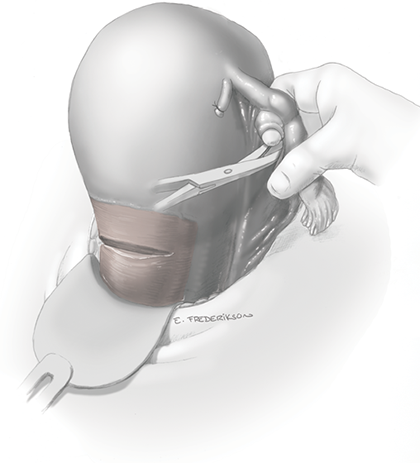
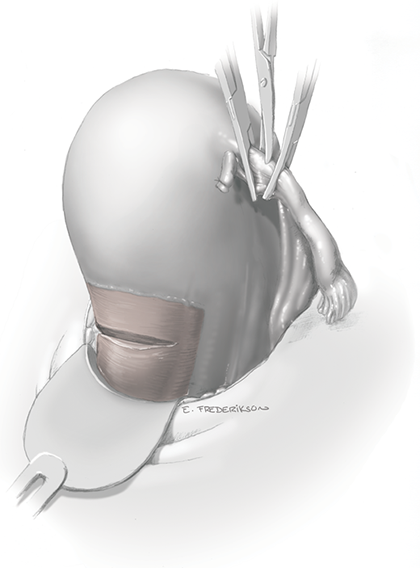
การจี้ตัด round ligament
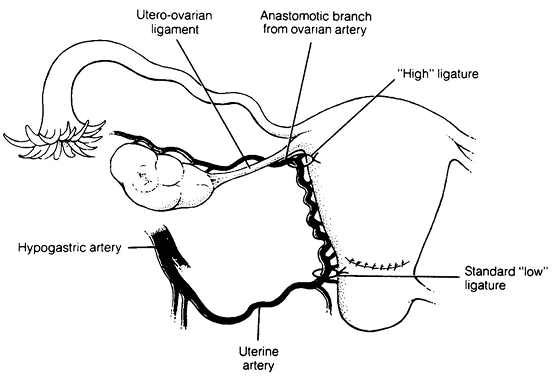
จากนั้นเริ่มการผ่าตัดโดยการตัด round ligament โดยให้ผู้ช่วยผ่าตัดคนที่ 2 โยกมดลูกไปทางด้านตรงข้ามกับที่จะตัด round ligament ผู้ผ่าตัดและผู้ช่วยผ่าตัดคนที่ 1 ใช้ atraumatic grasper จับบริเวณ uterine cornu และ round ligament ด้านนอกต่อที่จะตัด และยกขึ้นเพื่อเลี่ยงการบาดเจ็บต่ออวัยวะด้านใต้ จากนั้นผู้ผ่าตัดใช้จี้ไฟฟ้าและกรรไกรตัด round ligament ในตำแหน่ง 1/3 จากผนังอุ้งเชิงกราน จากนั้นตัดบริเวณ anterior leaf ของ board ligament ซึ่งอยู่ระหว่างหลอดเลือดของ adnexa และหลอดเลือด iliac vessels ซึ่งเป็นบริเวณที่ไม่มีหลอดเลือดมาเลี้ยง (avascular triangle) และควรหลีกเลี่ยงการตัดชิดมดลูกมากเกินไปซึ่งมี uterine vessel plexus อยู่ ดังแสดงในรูปที่ 2
ก.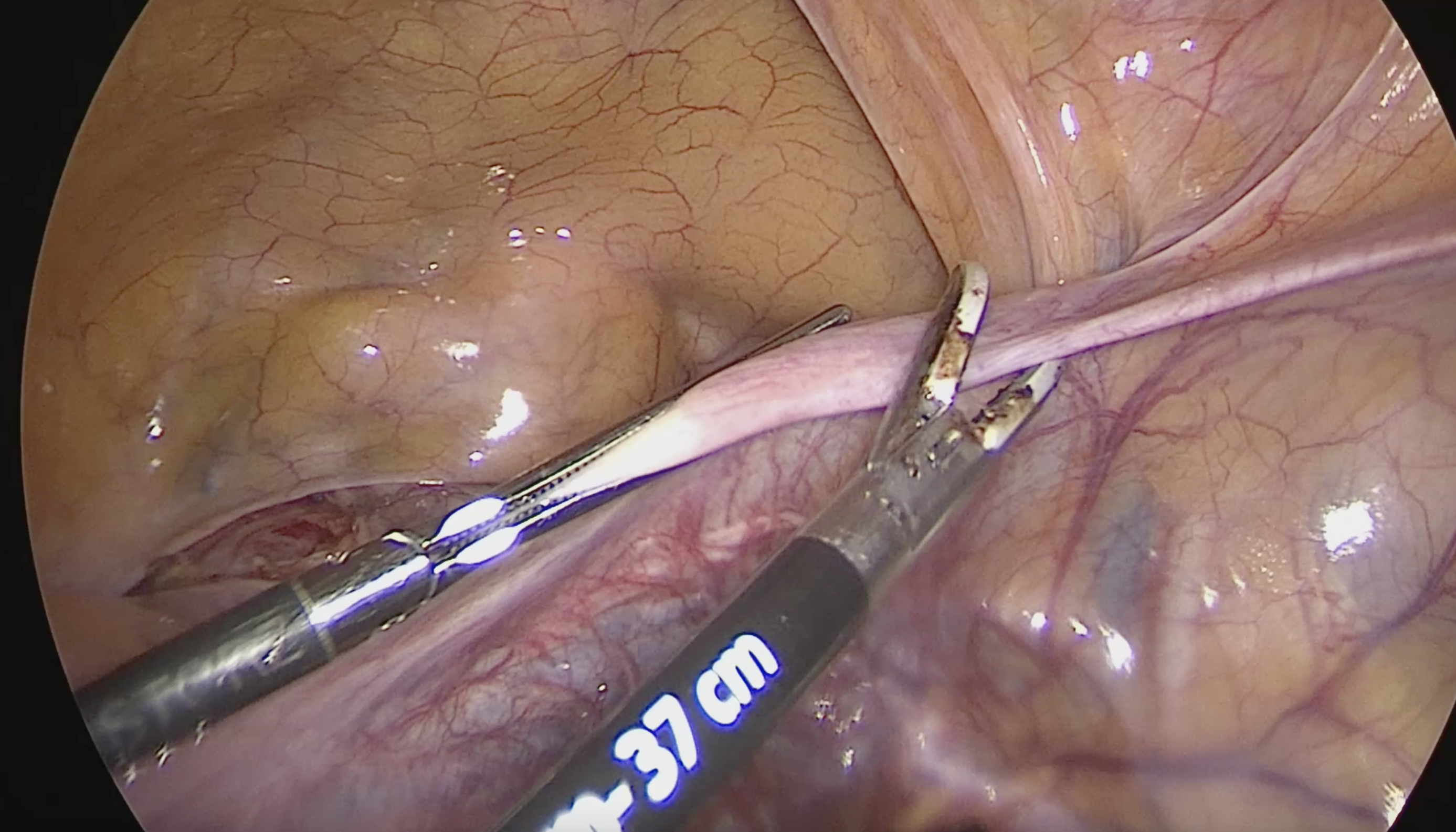
ข.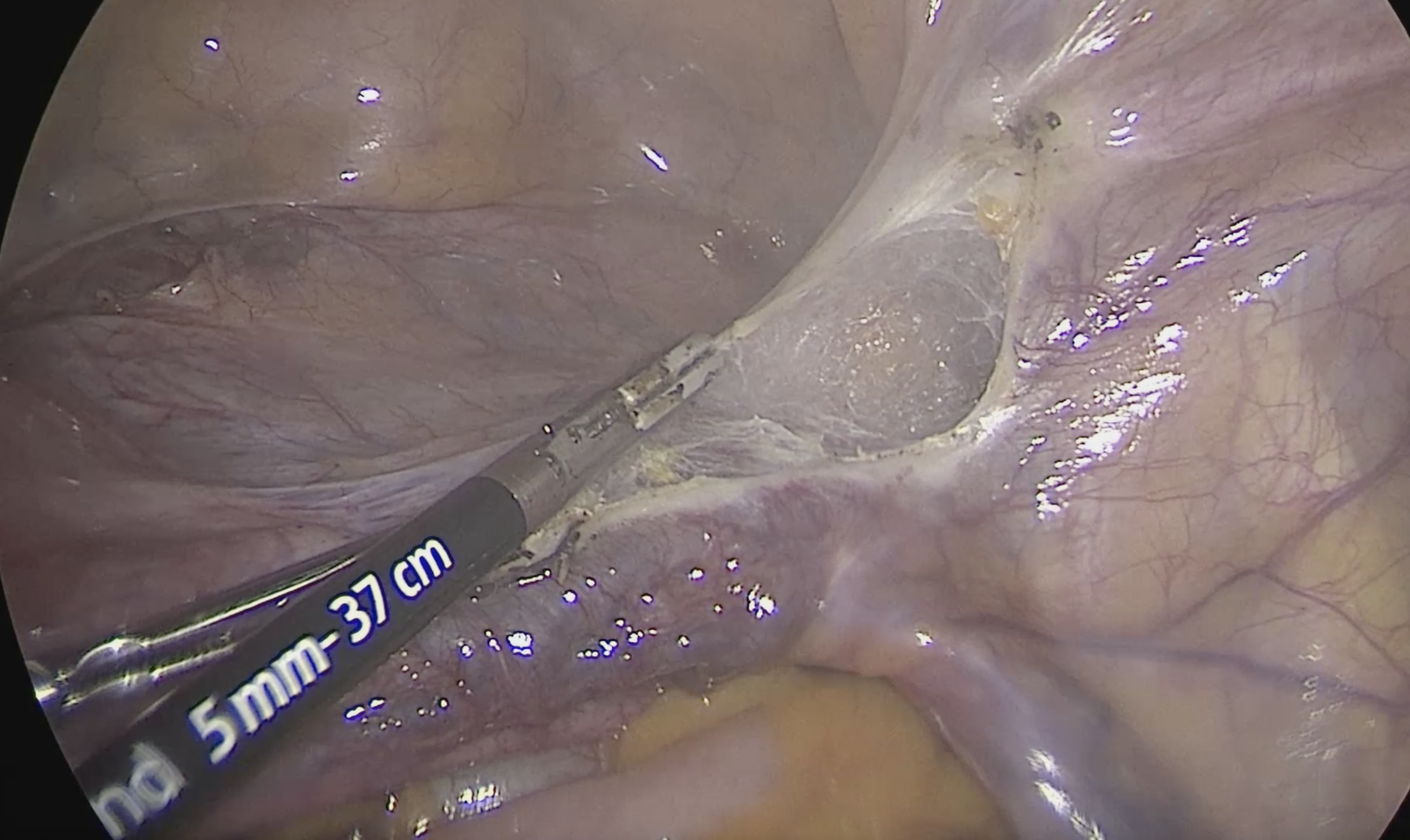
รูปที่ 2: แสดงการจี้ตัด round ligament ด้านขวา (ก.) และตัดบริเวณ board ligament ตามแนวเส้นประ (ข.)
ที่มา: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
-
การหาท่อไต
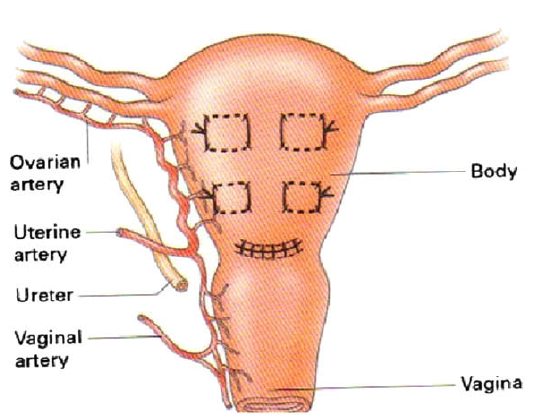
เนื่องจากท่อไต (ureter) เป็นอวัยวะที่อยู่ในส่วนของ retroperitoneal space มีโอกาสเกิดการบาดเจ็บได้ขณะผ่าตัด โดยตำแหน่งที่บาดเจ็บได้บ่อยที่สุดคือบริเวณที่ท่อไตเข้าสู่ pelvic cavity บริเวณ bifurcation ของหลอดเลือด common iliac artery ซึ่งการบาดเจ็บจะเกิดในขั้นตอนการตัด infundibulo-pelvic ligament และตำแหน่งที่มีโอกาสเกิดการบาดเจ็บรองงมาคือตำแหน่งที่ท่อไตใกล้บริเวณมดลูกมากที่สุด 1.0-1.5 เซนติเมตร โดยจะอยู่ใกล้บริเวณที่ท่อไตทอดตัวอยู่ใต้หลอดเลือด uterine artery ซึ่งมีโอกาสเกิดการบาดเจ็บขณะทำ uterine artery ligation ดังนั้นก่อนการทำหัตถการดังกล่าว ควรระบุตำแหน่งของท่อไตเพื่อลดโอกาสการบาดเจ็บ โดยวิธีในการระบุตำแหน่งสามารถทำได้ดังนี้
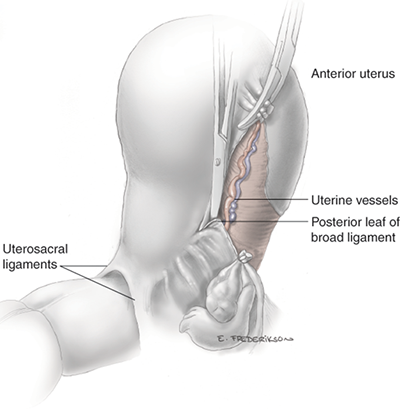
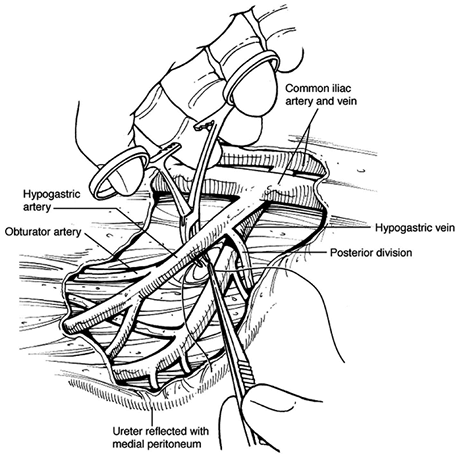
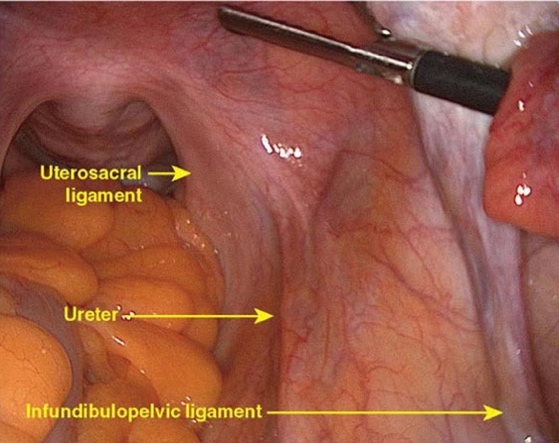
บริเวณ pelvic brim ก่อนตัด infundibulo-pelvic ligament ทำได้ 2 วิธี ได้แก่ transperitoneal คือดูบริเวณ posterior leaf broad ligament[13] หรือ retroperitoneal โดยการเปิด posterior leaf ของ broad ligament ขนานไปกับแนวของ infundibulo-pelvic ligament ไปจนเกือบ paracolic glutter หลังจากนั้นไล่ตามจาก external iliac artery ขึ้นไปทางศีรษะ จะพบ bifurcation ของ common iliac artery โดยท่อไตจะทอดตัวอยู่เหนือ bifurcation นี้ ซึ่งวิธีนี้เป็นการหาแบบ posterior approach [14] หรือจะทำการหาท่อไตแบบ lateral approach ด้วยการเข้าสู่ pararectal space ซึ่งจะเห็นท่อไตทอดอยู่ใต้ต่อ infundibulo-pelvic ligament ดังแสดงในรูปที่ 3
บริเวณใกล้ต่อมดลูกระบุตำแหน่งท่อไตโดยการเปิด anterior broad ligament เข้าหา vesicouterine junction เพื่อเข้า paravesical space หลังจากนั้นเมื่อพบหลอดเลือด uterine artery จะพบท่อไตทอดใต้หลอดเลือด uterine artery
ก.
ข.
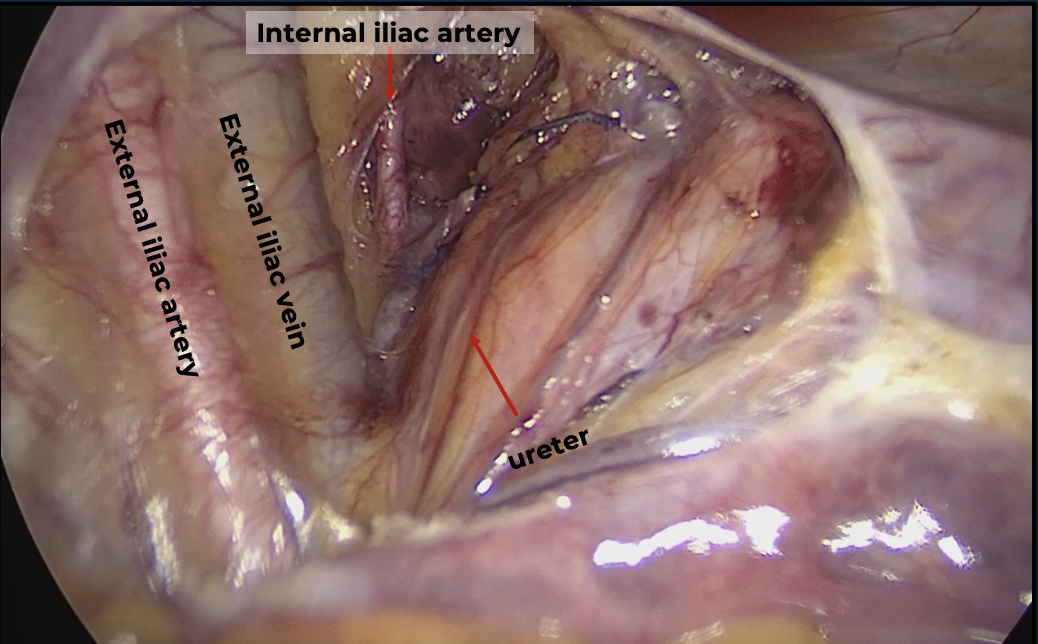
รูปที่ 3: แสดงการระบุท่อไตแบบ transperitoneal (ก.) และการระบุท่อไตผ่าน retroperitoneal แบบ lateral approach (ข.)
ที่มา: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
-
การจี้ตัดแยก adnexa
ในกรณีไม่ต้องการตัดรังไข่ ให้จี้ตัดแยกบริเวณ broad ligament (mesometrium) ระหว่าง round ligament และท่อนำไข่ออกจากกัน โดยให้เลาะชิดกับ round ligament มากกว่า หลังจากนั้นจี้ไฟฟ้าและตัดบริเวณท่อนำไข่ใกล้กับ uterine cornu โดยเว้นระยะห่างกับ uterine cornu เล็กน้อยเพื่อป้องกันการหดตัวของหลอดเลือดเข้าไปในมดลูกซึ่งจะยากต่อการห้ามเลือด หลังจากนั้นจึงทำการจี้ไฟฟ้าและตัดบริเวณ ovarian ligament แต่ถ้าต้องการตัดท่อนำไข่ออกด้วยให้จี้ตัด mesosalpinx ชิดด้านท่อนำไข่ ควรทำด้วยความระมัดระวัง ไม่ให้เกิด thermal injury ต่อรังไข่และ infundibulopelvic ligament โดยเริ่มทำการจี้ตัดจาก distal end หรือ proximal end ก็ได้
ในกรณีต้องการตัดปีกมดลูก หลังจากหาท่อไตและเลาะแยกให้ห่างจาก infundibulopelvic ligament แล้วให้เจาะเปิด window บริเวณ posterior leaf ของ broad ligament ตรงที่บางและไม่มีหลอดเลือด จากนั้นใช้ bipolar หรือ vascular sealing device ชนิดอื่นจี้ที่บริเวณ infundibulo-pelvic ligament ให้สนิทแล้วจึงตัด โดยวางเครื่องมือให้ชิดกับรังไข่ เพื่อไม่ให้ความร้อนกระจายไปยังท่อไต และควรทำมุม 90 องศากับหลอดเลือด ในกรณีที่ไม่ได้เปิด window สามารถจี้ตัดโดยต้องยก infundibulo-pelvic ligament ให้ห่างจากท่อไตและต้องมองเห็นท่อไตตลอดเวลา นอกจากนี้อาจเลือกวิธีการผูก infundibulopelvic ligament ก่อนทำการจี้ตัด เพื่อลดความเสี่ยงของการสูญเสียเลือดระหว่างผ่าตัดได้
ในกรณีที่ต้องการตัดปีกมดลูกแต่ก้อนมีขนาดใหญ่ อาจจะทำการตัดท่อนำไข่และ ovarian ligament ก่อน หลังจากเมื่อตัดมดลูกและนำมดลูกออกแล้ว จึงกลับมาตัดบริเวณปีกมดลูกอีกครั้ง เพื่อไม่ให้ปีกมดลูกบดบังหรือกีดขวางบริเวณที่จะทำการตัดมดลูก แต่มีข้อห้ามในการทำวิธีนี้ในกรณีที่เป็นมะเร็งมดลูก, รังไข่ หรือมีเยื่อบุโพรงมดลูกหนาตัวผิดปกติ[13]
-
การตัดเปิด vesicouterine peritoneal reflection และเลาะแยกกระเพาะปัสสาวะ
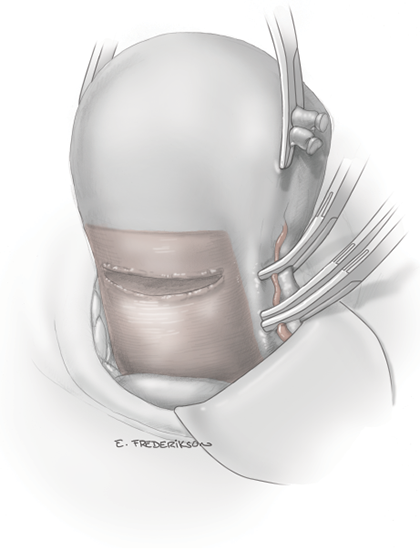
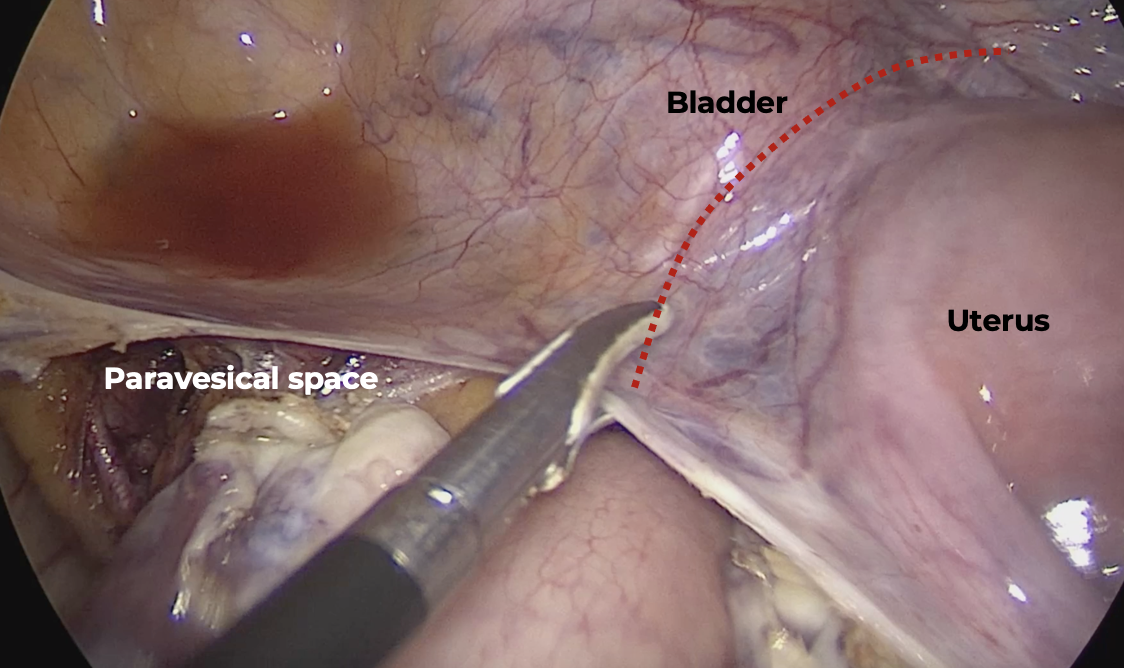
หลังจากตัดปีกมดลูกแล้ว ก่อนที่จะทำการทำจี้ตัดหลอดเลือด uterine artery ควรที่จะทำการเลาะแยกกระเพาะปัสสาวะออกจากตัวมดลูกก่อน เพื่อลดการบาดเจ็บของท่อไตและกระเพาะปัสสาวะขณะทำจี้ตัดหลอดเลือด uterine artery โดยการตัด vesicouterine peritoneal reflection เพื่อเข้าสู่ vesicouterine space และ vesicovaginal space ตามลำดับ สามารถทำได้โดยใช้ atraumatic forceps ช่วยจับกระเพาะปัสสาวะยกขึ้นและจี้ตัด peritoneum บริเวณเหนือกว่า vesicouterine fold เล็กน้อย หลังจากนั้นจึงเลาะแยกกระเพาะปัสสาวะออกจากมดลูกส่วนล่างจนพ้นแนว cervico-vaginal junction ในกรณีที่มีพังผืดเกาะแน่นระหว่างกระเพาะปัสสาวะและมดลูกส่วนล่างสามารถเลาะแยกกระเพาะปัสสาวะออกโดยการจี้ตัด anterior leaf ของ board ligament ทางด้านข้างเข้ามายัง vesicouterine peritoneal reflection เพื่อเข้าสู่ paravesical space ดังแสดงในรูปที่ 4 ก. และเลาะแยกท่อไตและกระเพาะปัสสาวะส่วน bladder pillar ออกไปก่อนที่จะเข้าสู่ vesicovaginal space
-
การจี้ตัดหลอดเลือด uterine
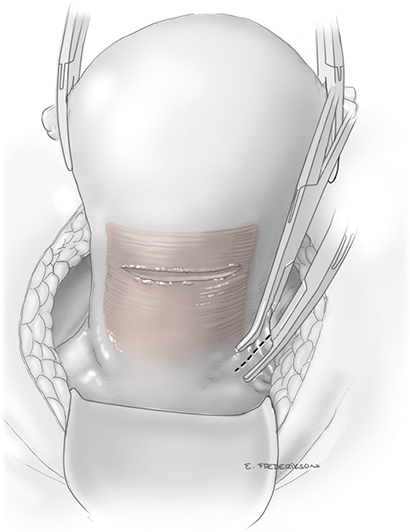
หลอดเลือด uterine artery เป็นแขนงที่มาจากหลอดเลือด internal iliac artery และเข้ามาเลี้ยงมดลูก ด้วย ascending branch ตรงระดับคอมดลูก (uterine isthmus) การจี้ตัดหลอดเลือด uterine เริ่มจากการเลาะแยก loose areolar tissue รอบๆหลอดเลือดออก (skeletonization) เพื่อให้เห็น uterine artery ได้ชัดเจนและจี้หลอดเลือดได้ดีที่สุดดังแสดงในรูปที่ 4 ข. จากนั้นใช้จี้ไฟฟ้าชนิด bipolar จี้หลอดเลือด uterine artery และ vein ในระดับคอมดลูก ควรวางเครื่องมือให้ทำมุมตั้งฉากกับหลอดเลือดและก่อนจี้ควรมองหาตำแหน่งของท่อไตอีกครั้งเพื่อความปลอดภัย จากนั้นจึงทำการตัดหลอดเลือดโดยตัดจนถึงชั้นของ pericervical fascia นอกจากนี้ในระหว่างที่ทำการจี้ตัดหลอดเลือด uterine artery แพทย์ผู้ทำผ่าตัดควรทำการจี้หลอดเลือดด้านข้างของมดลูกในตำแหน่งที่สูงขึ้นไปด้วยเพื่อลด retrograde bleeding
ก.
ข.
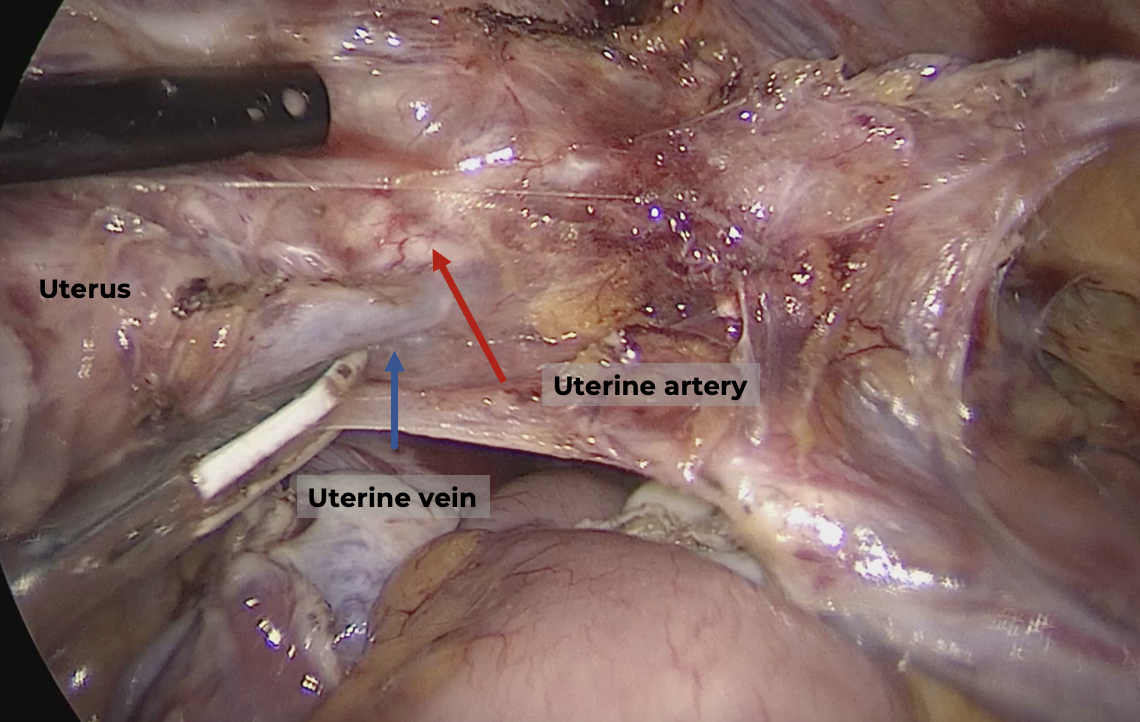
รูปที่ 4: แสดงการเลาะแยกกระเพาะปัสสาวะจากด้านข้างผ่าน paravesical space และตัด vesicouterine peritoneal reflection ตามแนวเส้นประสีแดงเพื่อเข้าสู่ vesicouterine space และ vesicovaginal space ตามลำดับ (ก.) และการเลาะแยก loose areolar tissue รอบๆหลอดเลือดออก (skeletonization) เพื่อให้เห็น uterine artery และ vein ก่อนจี้ตัด (ข.)
ที่มา: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
-
การจี้ตัด cardinal และ uterosacral ligament
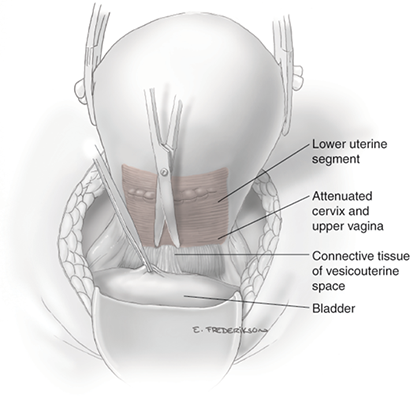
หลังจากตัดหลอดเลือด uterine ทั้ง 2 ข้างแล้วให้ทำการตัด cardinal ligament โดยตัดให้ชิดกับปากมดลูกด้านในต่อขั้วหลอดเลือด uterine ที่ตัดแล้ว ภายหลังจากการตัดเปิด posterior leaf ของ broad ligament และเลาะแยกท่อไตออกไปทางด้านข้างแล้ว จะสามารถทำการจี้ตัด uterosacral ligament ตรงตำแหน่ง insertion ได้อย่างปลอดภัย แต่ในกรณีที่มี obliteration of cul-de-sac จาก endometriosis หรือพยาธิสภาพอื่น การตัด uterosacral ligament อาจจะทำได้ยากและมีความเสี่ยงในการบาดเจ็บต่อลำไส้ตรงได้ แนะนำให้ตัดเปิด rectouterine peritoneal reflection เพื่อเข้าสู่ rectovaginal space หรือใช้เทคนิคการตัดมดลูกแบบ intrafascial hysterectomy แทน และถ้าท่อไตถูกดึงเข้ามาติดกับ uterosacral ligament ให้ใช้วิธีการเข้าทางด้านข้างจาก pararectal space เพื่อเลาะแยกท่อไตออกไปทางด้านข้างโดยเข้าสู่ medial pararectal space (Okabayashi’s space) เสียก่อนจึงจะจี้ตัด uterosacral ligament ดังแสดงในรูปที่ 5
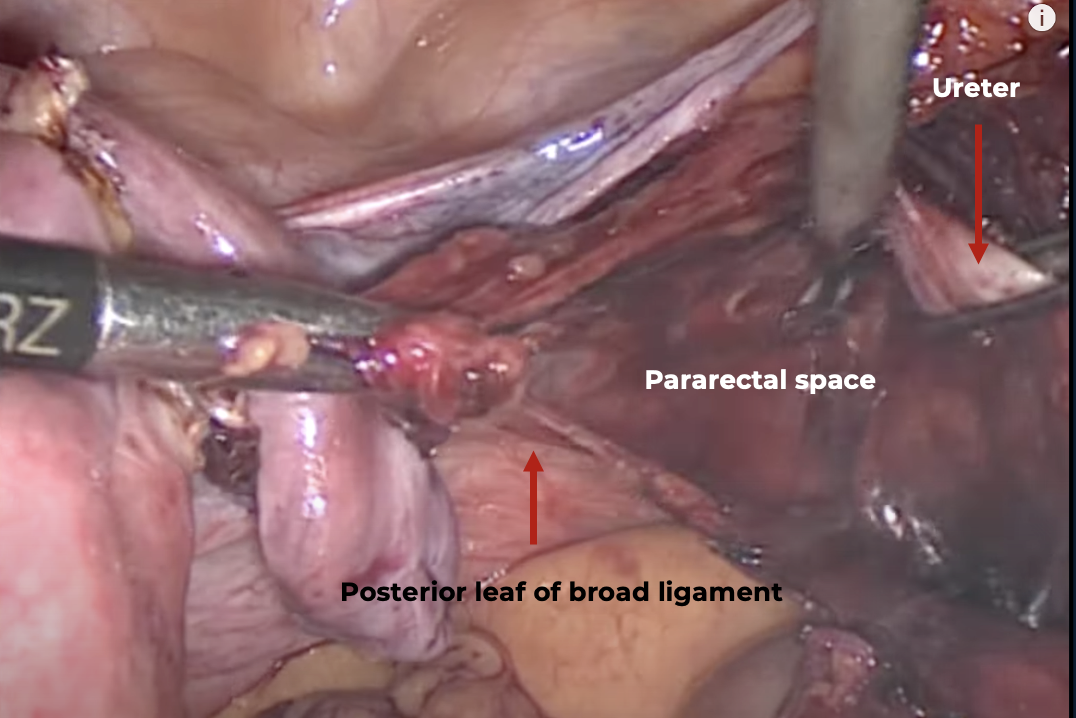
รูปที่ 5: แสดงการเลาะแยกท่อไตด้านขวาออกไปทางด้านข้างโดยเข้าสู่ medial pararectal space ก่อนจะตัด uterosacral ligament
ที่มา: Surgical Guide. Advanced surgical techniques for TLH: Pararectal space
. 2023 July 20 [cited 2023 July 22]. Available from:https://www.youtube.com/watch?v=SaaK0XOuDds&list=PLjwkhEvjsctJz5snFMZP4kiJj0_Bt05qG&index=8
-
การตัดแยกมดลูกออกจากช่องคลอด (colpotomy)
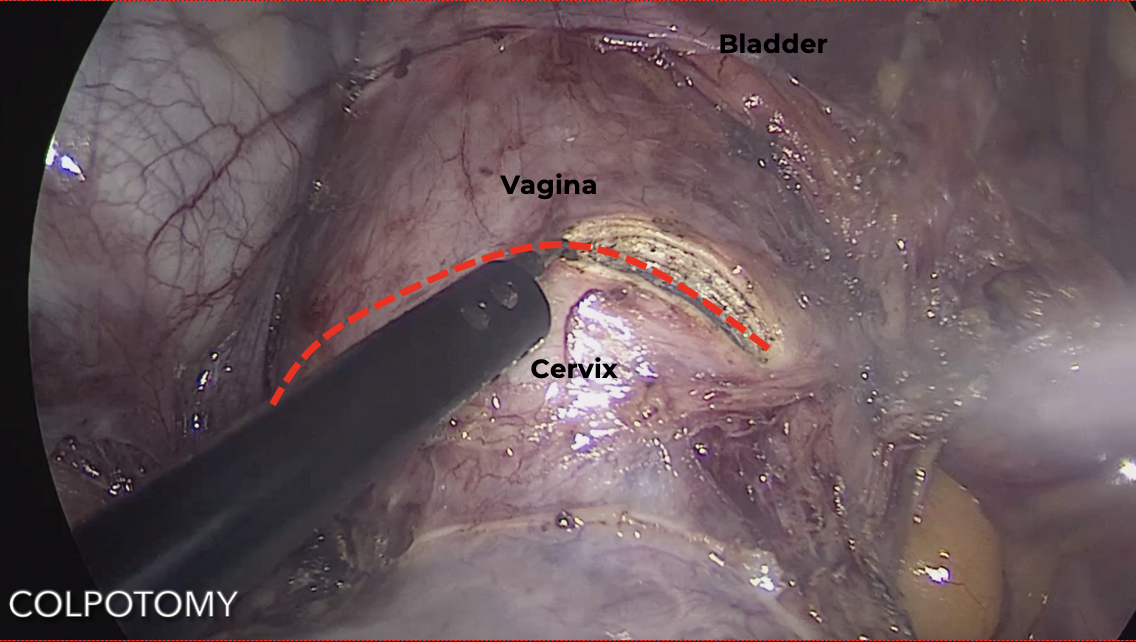
ขั้นตอนสุดท้ายก่อนนำมดลูกออกคือการตัดแยกปากมดลูกกับช่องคลอด สามารถทำได้ด้วยการใช้ colpotomizer หรือ vaginal tube ที่มีขนาดเส้นรอบวงที่สามารถครอบโดยรอบปากมดลูกได้พอดี ซึ่งขอบของอุปกรณ์จะช่วยดันให้ vaginal fornix โป่งนูนเป็นสันและทำให้ท่อไตและลำไส้ใหญ่ออกห่างจากบริเวณที่จะตัดมากขึ้น จากนั้นจึงใช้จี้ไฟฟ้าชนิด monopolar hook ตัดไปตามขอบของ vaginal tube โดยรอบ vaginal fornices ด้วยความระมัดระวัง ดังแสดงในรูปที่ 6 ก. และไม่ควรจี้เนื้อเยื่อจนไหม้เกรียมเพื่อป้องกันการเกิดเนื้อตายซึ่งจะมีผลกระทบต่อการหายของแผลที่ช่องคลอดและมีโอกาสเกิด vaginal cuff dehiscence
-
การนำมดลูกออกจากช่องท้อง (uterine extraction)
หลังจากตัดมดลูกแล้วหากมดลูกมีขนาดไม่ใหญ่มากและผู้ป่วยเคยผ่านการคลอดบุตรมาก่อน สามารถนำมดลูกออกทางช่องคลอดได้โดยไม่ยาก แต่ในกรณีที่มดลูกมีขนาดใหญ่หรือช่องคลอดมีขนาดเล็กจะมีความจำเป็นที่ต้องลดขนาดมดลูกลงเสียก่อนโดยใช้วิธีการหั่นหรือบดชิ้นเนื้อ (morcellation) แต่ควรทำโดยที่มดลูกอยู่ภายในถุง morcellation bag ไม่ว่าจะเอามดลูกออกทางช่องคลอดหรือหน้าท้อง เพื่อป้องกันการกระจายของชิ้นเนื้อในช่องท้องและการปนเปื้อนของชิ้นเนื้อที่อาจจะมีส่วนของมะเร็งอยู่
-
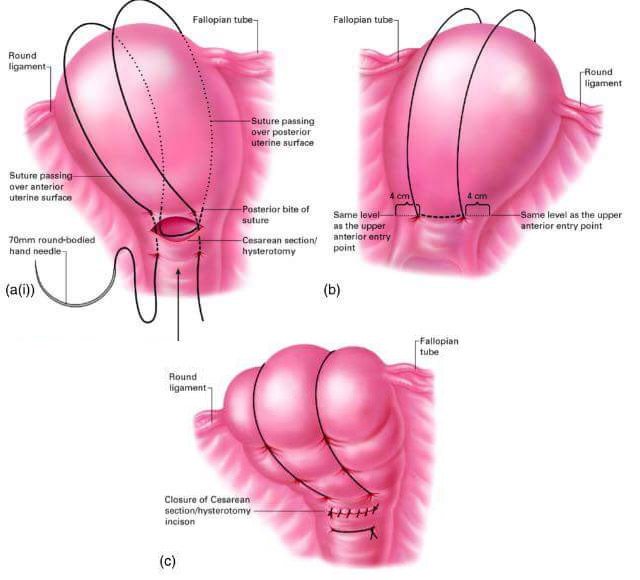
การเย็บปิดยอดช่องคลอด (vaginal cuff closure)
สามารถทำได้ทั้งการเย็บผ่านการส่องกล้องทางหน้าท้องหรือเย็บทางช่องคลอด โดยการเย็บผ่านการส่องกล้องมีข้อดีคือสามารถเห็นอวัยวะข้างเคียงได้ชัดทำให้โอกาสบาดเจ็บต่ออวัยวะข้างเคียงขณะเย็บน้อยกว่า แนะนำให้เย็บยอดช่องคลอดด้วย delayed absorbable suture แบบ interrupted หรือ continuous ก็ได้ ดังแสดงในรูปที่ 6ข. โดยเริ่มจากบริเวณมุมและควรเย็บรวบ uterosacral ligament เพื่อเป็นการเสริมความแข็งแรงของการยึดพยุงบริเวณยอดช่องคลอด แต่ต้องระมัดระวังไม่ให้เกิดอันตรายต่อท่อไตที่อยู่ใกล้เคียง จากนั้นจึงเย็บยอดช่องคลอดส่วนที่เหลือแบบ full thickness โดยต้องเย็บให้ถึง mucosa ของผนังช่องคลอดพร้อมทั้งเย็บรวบ pubocervical และ rectovaginal fascia ร่วมด้วย
ก.
ข.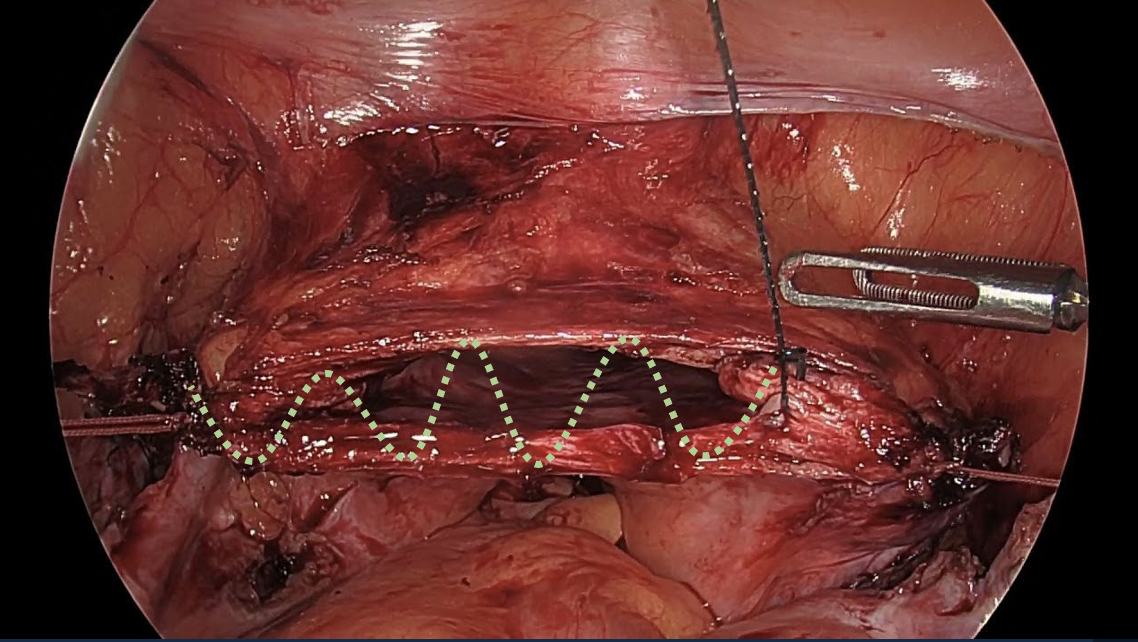
รูปที่ 6: แสดงการตัดแยกมดลูกออกจากช่องคลอด โดยใช้ monopolar hook จี้ตัดบนขอบ colpotomizer ตามแนวเส้นประสีแดง (ก.) และการเย็บยอดช่องคลอดด้วย delayed absorbable suture แบบ continuous ตามแนวเส้นประสีเขียว (ข.)
ที่มา: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
-
การล้างทำความสะอาดและตรวจหาตำแหน่งที่มีเลือดออก
ล้างทำความสะอาดในช่องท้องและอุ้งเชิงกราน สำรวจบริเวณตอของหลอดเลือดและ ligament ต่างๆ เพื่อเก็บกวาดลิ่มเลือดและสารน้ำที่ค้างอยู่ และตรวจหาตำแหน่งที่ยังคงมีเลือดออกพร้อมทั้งใช้จี้ไฟฟ้าจี้หยุดเลือด ทั้งนี้ในขณะที่สำรวจควรลดแรงดันก๊าซในช่องท้องให้เหลือเพียง 9 มิลลิเมตรปรอท นอกจากนี้ควรตรวจสอบว่ามีการบาดเจ็บของลำไส้ ท่อไต กระเพาะปัสสาวะหรืออวัยวะภายในช่องท้องร่วมด้วยหรือไม่
-
การดึง trocars ออกจากผนังหน้าท้อง และเย็บปิดบาดแผล
ขั้นตอนสุดท้ายก่อนการสิ้นสุดการผ่าตัดเป็นการดึง trocars ออกจากท้องของคนไข้ แนะนำให้ดึง ancillary trocars ออกจากผนังหน้าท้องพร้อมกับการใช้กล้องส่องตามดูบริเวณรูแผล เพื่อตรวจหาและจี้หยุดเลือดในตำแหน่งที่อาจยังมีเลือดออก ในกรณีการผ่าตัดผู้ป่วยมะเร็งนรีเวชแนะนำในการดูดสารน้ำและก๊าซในช่องท้องออกก่อนดึง trocars ออกก่อน เพื่อป้องกันการเกิด port-site metastasis รวมทั้งอาจใช้ povidone-iodine ป้ายบริเวณรูแผล[6] จากนั้นเย็บปิดบาดแผลโดยควรเย็บปิดชั้นของ rectus fascia ด้วยหากรูแผลนั้นๆ เกิดจาก trocar ขนาดเส้นผ่านศูนย์กลางตั้งแต่ 10 มิลลิเมตรขึ้นไป
ภาวะแทรกซ้อนของการผ่าตัดมดลูกผ่านกล้อง
การบาดเจ็บต่อหลอดเลือด (Vascular complication)
ภาวะที่แทรกซ้อนที่เกิดขึ้นกับหลอดเลือดมีอุบัติการณ์ไม่สูงแต่เมื่อเกิดขึ้นแล้วส่งผลกระทบที่รุนแรง ทั้งนี้การผ่าตัดมดลูกผ่านกล้องมักจะเกิดขึ้นได้ในขณะเข้าสู่ช่องท้องหรือแทง ancillary trocar โดยเส้นเลือดที่มักจะได้รับการบาดเจ็บในขณะเข้าสู่ช่องท้องหรือแทง primary trocar ในตำแหน่งสะดือคือหลอดเลือด common iliac artery ด้านขวา aorta หรือ mesenteric artery และขณะที่แทง ancillary trocar มักจะได้รับบาดเจ็บต่อหลอดเลือด superficial epigastric และ inferior epigastric
การจัดการกับการบาดเจ็บต่อหลอดเลือดมีหลายวิธี ได้แก่ การกดเพื่อห้ามเลือด การจี้ห้ามเลือดด้วยจี้ไฟฟ้า การหนีบด้วย clip และการผูกหรือเย็บซ่อมแซมหลอดเลือด โดยการเลือกใช้วิธีไหนนั้นพิจารณาจาก ชนิดของหลอดเลือดและขนาดของหลอดเลือดเป็นสำคัญ
ภาวะแทรกซ้อนที่เกิดขึ้นกับเส้นประสาท (Nerve complication)
การบาดเจ็บต่อเส้นประสาทที่เกิดขึ้นส่วนใหญ่เป็นการบาดเจ็บชนิด compression หรือ contusion ซึ่งสัมพันธ์จัดท่าผู้ป่วยและใช้อุปกรณ์ป้องกันที่ไม่เหมาะสมทำให้เกิดการกดทับหรือยืดเส้นประสาทจนตึงเกินไป รวมถึงระยะเวลาในการผ่าตัดที่นานเกินไป มีการบาดเจ็บของเส้นประสาทบางตำแหน่งที่เกิดจากการบาดเจ็บโดยตรงจากการผ่าตัด โดยเส้นประสาทที่มีโอกาสได้รับการบาดเจ็บในระหว่างการผ่าตัดผ่านกล้องทางนรีเวชมีดังต่อไปนี้
Femoral neuropathy ที่เกิดจากการผ่าตัดผ่านกล้องสัมพันธ์กับการงอ (flexion) หรือกาง (abduction) ของข้อสะโพกมากเกินไปจะเกิดแรงกดต่อ femoral nerve ทำให้อาการชาบริเวณต้นขาด้านใน (anteromedial of thigh) ร่วมกับมีการอ่อนแรงของกล้ามเนื้อที่ควบคุมต้นขาและข้อเข่าทำให้ข้อเข่าไม่มั่นคง (knee joint instability) และไม่สามารถยกต้นขาถ้าอยู่ในท่านอนหงายได้ ดังนั้นในการจัดท่าผู้ป่วยมุมงอของข้อสะโพกกับลำตัวไม่ควรงอเกิน 90 องศาและมุมกางของข้อสะโพกเมื่อเทียบกับแนวกลางลำตัวไม่ควรเกิน 45 องศา
Obturator neuropathy มักเกิดจากการบาดเจ็บโดยตรงจากการผ่าตัดเลาะต่อมน้ำเหลืองในอุ้งเชิงกราน หรืออาจจะเกิดจากการที่มีการงอของข้อสะโพกมากเกินไปในขณะผ่าตัดโดยเฉพาะถ้ามีระยะเวลาการผ่าตัดที่ยาวนาน ทำให้มีอาการชาบริเวณต้นขาด้านใน (anteromedial of thigh) ร่วมกับมีอาการอ่อนแรงของมัดกล้ามเนื้อที่ทำหน้าที่กางข้อสะโพก (adduction)
Sciatic neuropathy เกิดจากการมีแรงดึงของเส้นประสาทมากในขณะที่มีการงอของข้อสะโพกร่วมกับการเหยียดของข้อเข่าหรือมีการบิดออก (external rotation) ของข้อสะโพกมากเกินไป
Brachial plexus injury เกิดขึ้นได้ในกรณีที่ผู้ป่วยอยู่ในท่า steep Trendelenburg และมีการเลื่อนของตัวผู้ป่วยขึ้นไปทางด้านศีรษะของผู้ป่วยและทำให้เกิดการยืดเหยียด (outstretched) ของแขนมากจนเกินไปหรือเกิดจากการที่มีการจัดวางอุปกรณ์ดันไหล่ (shoulder brace) อยู่ในตำแหน่งที่ชิดกับแนวกลางลำตัวผู้ป่วยมากเกินไป ทำให้เกิดการอ่อนแรงของกล้ามเนื้อส่วนต้นแขนหรือที่เรียกว่า “Erb palsy” ส่วนการบาดเจ็บของ lower root เกิดจากการที่กลุ่มเส้นประสาทถูกกดเบียดจากกระดูกไหปลาร้า (clavicle) และกระดูกซี่โครงซี่แรก ซึ่งจะเกิดขึ้นในกรณีที่ผู้ป่วยอยู่ในท่ากางแขนและมุมระหว่างแขนกับลำตัวของผู้ป่วยมากกว่า 90 องศา ทำให้เกิดการอ่อนแรงของกล้ามเนื้อแขนและมือหรือที่เรียกว่า “Klumpke paralysis” ดังนั้นในการจัดท่าผู้ป่วยสำหรับการผ่าตัดเพื่อป้องกันการเกิดการบาดเจ็บต่อกลุ่มเส้นประสาท brachial plexus ควรเก็บแขนผู้ป่วยแนบไว้ข้างลำตัวทั้งสองข้าง แต่ถ้าหากจำเป็นต้องจัดท่าใหผู้ป่วยกางแขนควรให้มุมระหว่างแขนกับลำตัวกางน้อยกว่า 90 องศาและจัดให้มือของผู้ป่วยอยู่ในท่าหงาย
ภายหลังการผ่าตัดถ้าหากพบว่ามีการบาดเจ็บของเส้นประสาทควรทำการปรึกษาอายุรแพทย์ระบบประสาทหรือแพทย์เวชศาสตร์ฟื้นฟูเพื่อให้การวินิจฉัยและวางแผนในการทำกายภาพบำบัดต่อไป
ภาวะแทรกซ้อนที่เกิดกับทางเดินปัสสาวะ (Urinary tract complication)
การบาดเจ็บต่อกระเพาะปัสสาวะมักจะเกิดบริเวณ dome ของกระเพาะปัสสาวะ เกิดขึ้นได้เกือบทุกขั้นตอนของการผ่าตัด ตั้งแต่การแทง ancillary trocar บริเวณเหนือหัวหน่าว การเลาะแยกกระเพาะปัสสาวะออกจากมดลูกส่วนล่าง การตัดผนังช่องคลอด หากวินิจฉัยได้ตั้งแต่ในขณะผ่าตัดสามารถแก้ไขได้ด้วยการเย็บซ่อมแซมด้วย delayed absorbable suture ขนาด 2/0 หรือ 3/0 และใส่สายสวนปัสสาวะค้างไว้ 7-10 วัน
การบาดเจ็บต่อท่อไตเกิดขึ้นได้บ่อยที่สุดตรงตำแหน่งท่อไตส่วนต้นบริเวณที่ทอดผ่าน pelvic brim ในขณะที่ทำการตัด infundibulopelvic ligament รองลงมาเป็นตำแหน่งท่อไตส่วนล่างบริเวณที่ลอดใต้หลอดเลือดแดง uterine โดยอาจจะมีสาเหตุจากความร้อน (thermal injury) หรือจากการเย็บผูกเพื่อห้ามเลือดซึ่งอาจจะเกิดขึ้นผูกโดนท่อไตไปด้วย (partial ligation) หรือเกิดขึ้นในระหว่างการตัด cardinal ligament นอกจากการบาดเจ็บที่เกิดขึ้นจะทำให้เกิดการฉีกขาดของท่อไตแล้ว อาจจะทำให้เกิดการตีบ (stenosis) หรืออุดกั้น (obstruction) ของท่อไต รวมทั้งอาจเกิดรอยรั่วเชื่อมต่อระหว่างท่อไตกับช่องคลอดได้ ในกรณีที่วินิจฉัยว่ามีการบาดเจ็บของท่อไตในได้ในขณะที่ทำการผ่าตัด การแก้ไขสามารถทำได้ด้วยการเย็บซ่อมแซมหรือตัดต่อขึ้นอยู่กับว่ามีการบาดเจ็บต่อท่อไตในลักษณะใด
ภาวะแทรกซ้อนที่เกิดกับกระเพาะอาหารและลำไส้ (Gastrointestinal complications)
การบาดเจ็บต่อทางเดินอาหารสามารถเกิดขึ้นได้ในหลายขั้นตอนของการผ่าตัด เช่น การแทง Verres needle หรือ trocar, การเลาะพังผืด (adhesiolysis), การเลาะแยกเนื้อเยื่อ (dissection), การตัดหรือผูกเส้นเลือดที่มาเลี้ยงลำไส้ทำให้ขาดเลือด หรือการบาดเจ็บจากความร้อน จากการใช้เครื่องตัดจี้ด้วยไฟฟ้า (electrosurgical equipment) ในขณะผ่าตัด
โดยทั่วไปเมื่อเกิดการบาดเจ็บต่อกระเพาะอาหารควรจะทำการเย็บซ่อมแซม 2 ชั้นและหลังผ่าตัดควรใส่สาย nasogastric เอาไว้จนกว่าการเคลื่อนไหวของลำไส้หลังผ่าตัดกลับมาเป็นปกติ ในกรณีที่การบาดเจ็บเกิดจากการแทง trocar ขนาดเล็กแผลที่กระเพาะอาหารจะสมานตัวได้เองอย่างรวดเร็ว จึงไม่ต้องเย็บซ่อมแซมแต่ให้การรักษาแบบอนุรักษ์โดยใส่สาย nasogastric เอาไว้อย่างน้อย 48 ชั่วโมง
การให้การดูแลรักษาการบาดเจ็บต่อลำไส้ขึ้นอยู่กับตำแหน่ง ขนาด กลไกการบาดเจ็บและระยะเวลาตั้งแต่ได้รับบาดเจ็บจนวินิจฉัยได้ ในกรณีที่สามารถให้การวินิจฉัยได้ในขณะผ่าตัดเมื่อเกิดการบาดเจ็บและมีรูรั่วของลำไส้เล็ก (enterotomy) หรือลำไส้ใหญ่ (colotomy) ควรทำการเย็บซ่อมแซมแบบ interrupted stitch แต่ถ้ามีการฉีกขาดของลำไส้มากกว่าร้อยละ 50 ของเส้นรอบวงของลำไส้หรือมีการบาดเจ็บหลายตำแหน่งอาจจะพิจารณาทำการตัดลำไส้ในส่วนที่ได้รับบาดเจ็บออก (segmental resection) และเย็บต่อลำไส้ส่วนที่เหลือเข้าด้วยกันหรือเอาลำไส้มาเปิดที่ผนังหน้าท้อง (colostomy) เป็นการชั่วคราวถ้ามีการบาดเจ็บรุนแรงหรือเสี่ยงต่อการติดเชื้อในช่องท้อง
หลังการผ่าตัดมีโอกาสในการเกิดไส้เลื่อนบริเวณตำแหน่งที่แทง (port-site herniation) โดยส่วนใหญ่เกิดจาก trocar ที่มีขนาดใหญ่กว่า 10 มม. การป้องกัน port-site herniation ทำได้โดยการเลือกใช้ trocar ขนาดเล็กสุดเท่าที่จะเป็นไปได้ และควรเย็บปิด fascia ในกรณีที่ trocar มีขนาดใหญ่กว่า 5 มิลลิเมตร [15]
การแยกของยอดช่องคลอด (Vaginal cuff dehiscence)
การผ่าตัดมดลูกผ่านกล้องมีโอกาสในการเกิดการแยกของยอดช่องคลอดได้มากเมื่อเทียบกับการผ่าตัดมดลูกด้วยวิธีอื่น โดยพบอุบัติการณ์ร้อยละ 0.14-4.1 [16] เชื่อว่าสาเหตุเกิดจากภาพที่เห็นผ่านกล้องในระหว่างผ่าตัดจะเป็นภาพกำลังขยายทำให้ผู้ผ่าตัดอาจจะเย็บช่องคลอดแล้วตักเนื้อเยื่อช่องคลอดน้อยกว่าที่ควรจะเป็น หรืออาจเกิดจากการที่การผ่าตัดส่องกล้องใช้อุปกรณ์จี้ไฟฟ้าเพื่อตัดบริเวณช่องคลอดทำให้มีการตายของเนื้อเยื่อและการสมานแผลช่องคลอดไม่ดี จากการทบทวนวรรณกรรมอย่างเป็นระบบพบว่าการวัสดุเย็บชนิด barbed suture และ non-barbed suture มีการแยกของยอดช่องคลอดไม่ต่างกัน (OR 0.38; 95% CI, 0.13-1.10) [17] ในกรณีที่ใช้วัสดุเย็บชนิด barbed suture การเย็บยอดช่องคลอด 2 ชั้น (vaginal mucosa และ vaginal muscularis) มีโอกาสการแยกของช่องคลอดน้อยกว่าการเย็บชั้นเดียว (full vaginal thickness) [18]
สรุป
ปัจจุบันมีแนวโน้มที่ผู้ป่วยมีความต้องการในการตัดมดลูกผ่านกล้องมากขึ้น ดังนั้นสูตินรีแพทย์ควรมีความรู้ความเข้าใจถึงข้อบ่งชี้และข้อห้ามเพื่อที่จะเลือกผู้ป่วยที่เหมาะสมสำหรับการผ่าตัด ทราบขั้นตอนการตัดมดลูกผ่านกล้องรวมถึงภาวะแทรกซ้อนที่อาจจะเกิดขึ้นได้ เพื่อผลลัพธ์ของการผ่าตัดรักษาที่ดีและเกิดประโยชน์แก่ผู้ป่วยสูงสุด
เอกสารอ้างอิง
- Aarts JWM, Nieboer TE, Johnson N, et al. Surgical approach to hysterectomy for benign gynaecological disease. Cochrane Database of Systematic Reviews. 2015(8).
- Committee Opinion No 701: Choosing the Route of Hysterectomy for Benign Disease. Obstet Gynecol. 2017;129(6):e155-e9.
- Walker JL, Piedmonte MR, Spirtos NM, et al. Recurrence and survival after random assignment to laparoscopy versus laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group LAP2 Study. J Clin Oncol. 2012;30(7):695-700.
- Walker JL, Piedmonte MR, Spirtos NM, et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol. 2009;27(32):5331-6.
- Kong Q, Wei H, Zhang J, et al. Comparison of the survival outcomes of laparoscopy versus laparotomy in treatment of early-stage ovarian cancer: a systematic review and meta-analysis. Journal of Ovarian Research. 2021;14(1):45.
- Ramirez PT, Frumovitz M, Abu-Rustum NR. Principles of gynecologic oncology surgery. Philadelphia, PA: Elsevier Philadelphia, PA; 2019.
- Ramirez PT, Frumovitz M, Pareja R, et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med. 2018;379(20):1895-904.
- National Comprehensive Cancer Network. Cervical cancer (Version 1.2023) 2023 [Available from: https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf.
- พงษ์เกษม วรเศรษฐสิน, ดำรง ตรีสุโกศล. การผ่าตัดมดลูกผ่านกล้อง = Total laparoscopic hysterectomy & radical hysterectomy : a comprehensive surgical guide. พิมพิ์ครั้งที่ 1 ed. กรุงเทพมหานคร: ภาควิชาสูติศาสตร์-นรีเวชวิทยา คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย 2560.
- ทัศน์วรรณ รังรักษ์ศิริวร. Basic steps in Total Laparoscopic Hysterectomy. In: พงษ์เกษม วรเศรษฐสิน, ดำรง ตรีสุโกศล, editors. การผ่าตัดมดลูกผ่านกล้อง = Total laparoscopic hysterectomy & radical hysterectomy : a comprehensive surgical guide. กรุงเทพมหานคร: ภาควิชาสูติศาสตร์-นรีเวชวิทยา คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย 2560. p. 31-8.
- พงษ์เกษม วรเศรษฐิน. Retroperitoneal & surgical planes for total laparoscopic hysterectomy. In: พงษ์เกษม วรเศรษฐสิน, ดำรง ตรีสุโกศล, editors. การผ่าตัดมดลูกผ่านกล้อง = Total laparoscopic hysterectomy & radical hysterectomy : a comprehensive surgical guide. กรุงเทพมหานคร: ภาควิชาสูติศาสตร์-นรีเวชวิทยา คณะแพทยศาสตร์จุฬาลงกรณ์มหาวิทยาลัย; 2560. p. 39-50.
- Thepsuwan J, Huang K-G, Wilamarta M, et al. Principles of safe abdominal entry in laparoscopic gynecologic surgery. Gynecology and Minimally Invasive Therapy. 2013;2(4):105-9.
- Handa VL, Van Le L. Te Linde’s operative gynecology. Twelfth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020.
- Puntambekar S, Nanda SM, Parikh K. Anatomy of the Ureter. In: Puntambekar S, Nanda SM, Parikh K, editors. Laparoscopic Pelvic Anatomy in Females: Applied Surgical Principles. Singapore: Springer Singapore; 2019. p. 183-208.
- Pulle MV, Siddhartha R, Dey A, et al. Port site hernia in laparoscopic surgery: Mechanism, prevention and management. Current Medicine Research and Practice. 2015;5(3):130-7.
- Cronin B, Sung VW, Matteson KA. Vaginal cuff dehiscence: risk factors and management. Am J Obstet Gynecol. 2012;206(4):284-8.
- Uccella S, Zorzato PC, Kho RM. Incidence and Prevention of Vaginal Cuff Dehiscence after Laparoscopic and Robotic Hysterectomy: A Systematic Review and Meta-analysis. J Minim Invasive Gynecol. 2021;28(3):710-20.
- Peters A, Ali R, Miles S, et al. Two-Layer Compared With One-Layer Vaginal Cuff Closure at the Time of Total Laparoscopic Hysterectomy to Reduce Complications. Obstetrics & Gynecology. 2021;138(1):59-65.