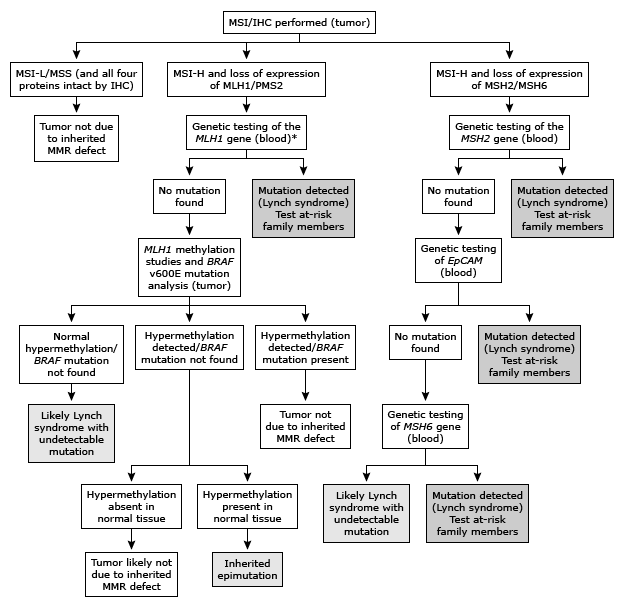
หัตถการพื้นฐานทางนรีเวช (Basic Gynecologic Procedures)
หัตถการพื้นฐานทางนรีเวช (Basic Gynecologic Procedures)
พญ.สุจิณันฐ์ นันทาภิวัธน์
อ.นพ.มนัสวี มะโนปัญญา
การทำหัตถการทางนรีเวชมีหลายชนิด ทั้งนี้ มีหัตถการพื้นฐานที่นักศึกษาแพทย์ควรเรียนรู้ และแพทย์ทั่วไปสามารถเรียนรู้และฝึกปฏิบัติได้ด้วยตัวเองจึงได้รวบรวมวิธีการทำหัตถการพื้นฐานทางนรีเวชโดยมีรายละเอียดขั้นตอนการปฏิบัติ ข้อบ่งชี้ และข้อห้าม เพื่อให้ง่ายต่อการศึกษา ดังนี้
การดูดมดลูกด้วยเครื่องมือสุญญากาศมือถือ (Manual Vacuum Aspiration)
เครื่องดูดมดลูกสุญญากาศมี 2 ชนิดคือ
- เครื่องดูดไฟฟ้า (Electric Vacuum Aspiration – EVA)
- เครื่องดูดมือถือ (Manual Vacuum Aspiration – MVA)
ข้อบ่งชี้ (Indication)
- เพื่อยุติการตั้งครรภ์ตามข้อบ่งชี้ในกรณีที่อายุครรภ์ไม่เกิน 14 สัปดาห์
- เพื่อการรักษาในผู้ป่วยที่มีภาวะดังต่อไปนี้
- มีเลือดออกจากโพรงมดลูกปริมาณมาก หรือไม่ตอบสนองต่อการรักษาด้วยยา
- แท้งไม่ครบ (Incomplete abortion) หรือแท้งค้าง (Missed abortion)
- ตั้งครรภ์ไข่ปลาอุก (Molar pregnancy) ในกรณีที่ขนาดมดลูกโตไม่เกิน 12 สัปดาห์
- มีชิ้นส่วนของรกหรือถุงการตั้งครรภ์ตกค้างหลังคลอด
- เพื่อการวินิจฉัยโรคในผู้ป่วยที่มีเลือดออกผิดปกติจากโพรงมดลูก
การทำแท้งที่อายุครรภ์น้อยที่เลือกใช้เครื่องมือทางศัลยกรรม (Surgical Termination of Pregnancy Surgical Abortion – STOP) องค์การอนามัยโลก(1)แนะนำว่าการยุติการตั้งครรภ์ทางศัลยกรรมที่ปลอดภัยควรทำโดยการ “ดูดมดลูก” โดยใช้เครื่องดูดสุญญากาศ (Vacuum Aspiration) แทนการ “ขูดมดลูก” โดยใช้เหล็กแหลม (Dilatation and Curettage with Sharp Curette) ให้ใช้ Dilatation and Curettage เมื่อไม่มีเครื่องดูดสุญญากาศเท่านั้น

รูปที่ 1 ข้อแนะนำสำหรับการทำหัตถการในการทำแท้ง
ข้อห้ามโดยเด็ดขาด (Absolute contraindication)
- สัญญาณชีพไม่คงที่
- มีติดเชื้อในอุ้งเชิงกรานที่ยังควบคุมไม่ได้
ข้อห้ามโดยอนุโลม (Relative contraindication)
- ผู้ป่วยมีโรคหรือภาวะทางอายุรกรรมอื่นร่วมที่ยังไม่สามารถควบคุมโรคได้ อาทิเช่น
- ความดันโลหิตสูงที่ยังควบคุมความดันโลหิตได้ไม่ดี
- โรคเบาหวานที่ยังควบคุมระดับน้ำตาลได้ไม่ดี
- ผู้ป่วยที่มีปัญหาเกี่ยวกับการแข็งตัวของเลือด รับประทานยาหรือสมุนไพรที่มีผลต่อการแข็งตัวของเลือด
ขั้นตอนการขูดมดลูกด้วยเครื่องดูดสุญญากาศมือถือ (Manual vacuum aspiration: MVA)
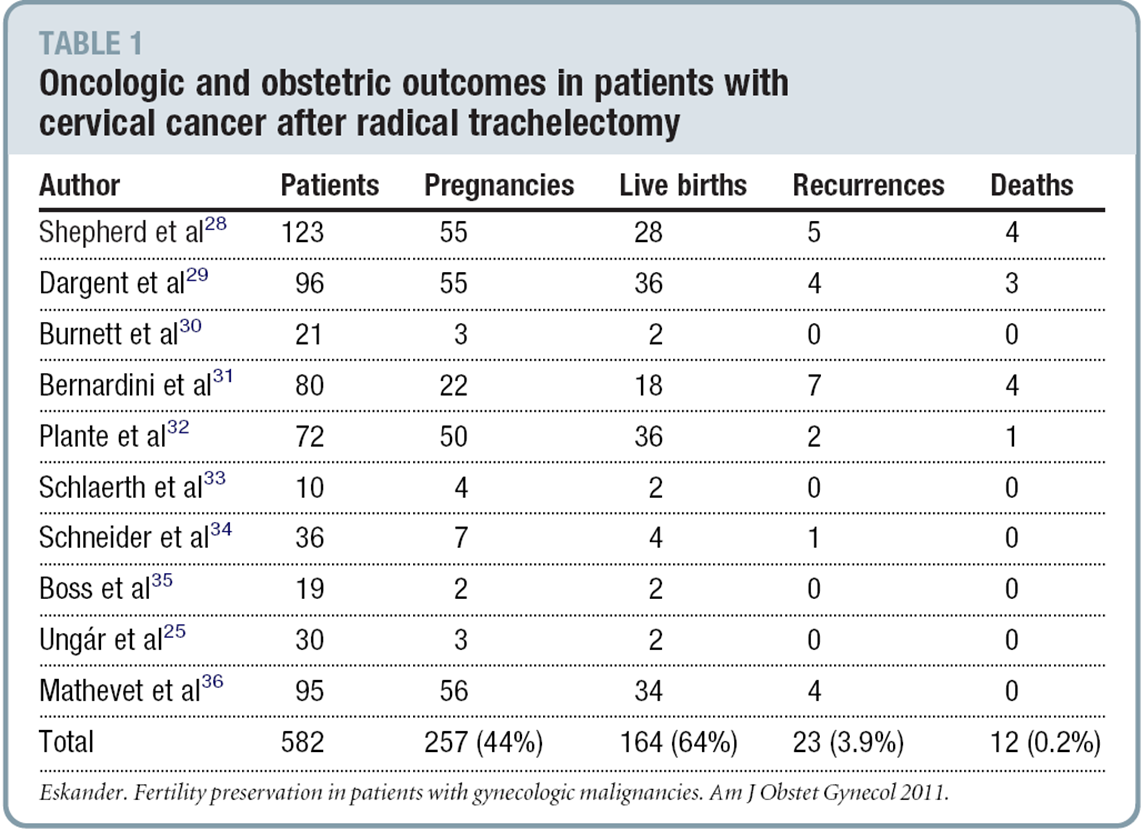
การเตรียม
1. เตรียมเครื่องมือและอุปกรณ์ (2)

รูปที่ 2 อุปกรณ์ในการทำ MVA
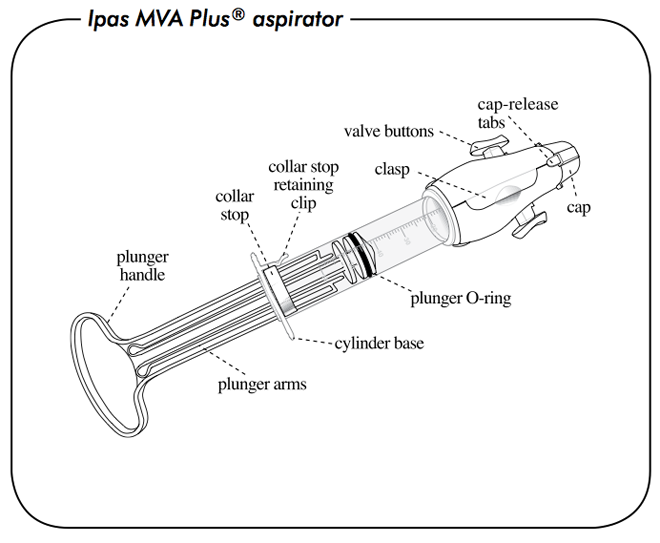
รูปที่ 3 การประกอบอุปกรณ์ MVA
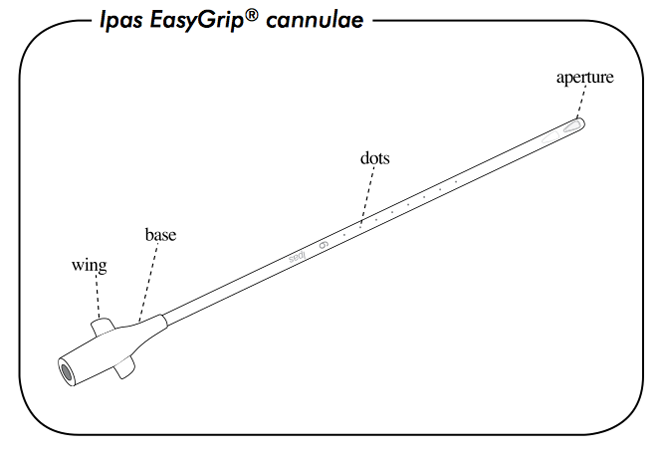
รูปที่ 4 Cannulae
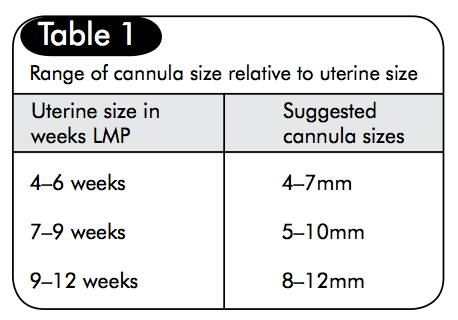
รูปที่ 5 ขนาด cannulaeที่เหมาะสมกับแต่ละอายุครรภ์
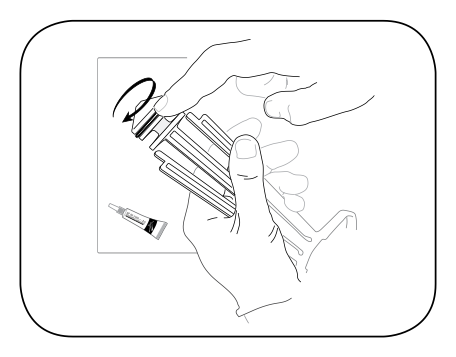
รูปที่ 6 ต่อ plunger O-ring เข้ากับ plunger สามารถเติมน้ำมันเพื่อเพิ่มความหล่อลื่น
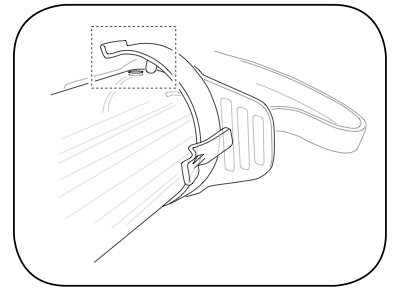
รูปที่ 7 สอด plunger เข้าไปใน cylinder ที่ต่อกับ collar stop
ที่มา : Performing Uterine Evacuation with the Ipas MVA Plus® Aspirator and IpasEasyGrip® Cannulae: Instructional Bookletavailable from
http://www.iawg.net/resources/RH%20Kit%208%20-%20Ipas%20MVA%20instructional%20booklet.pdf.
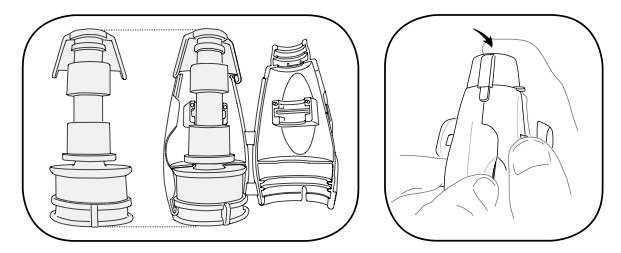
รูปที่ 8 ประกอบ valve liner cap adapter เข้าด้วยกัน
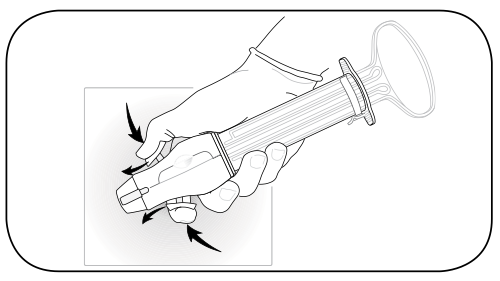
รูปที่ 9 กด valve ลงไปและดันไปข้างหน้าเพื่อ lock
2. เตรียมผู้รับการตรวจ
3. เตรียมผู้ตรวจ
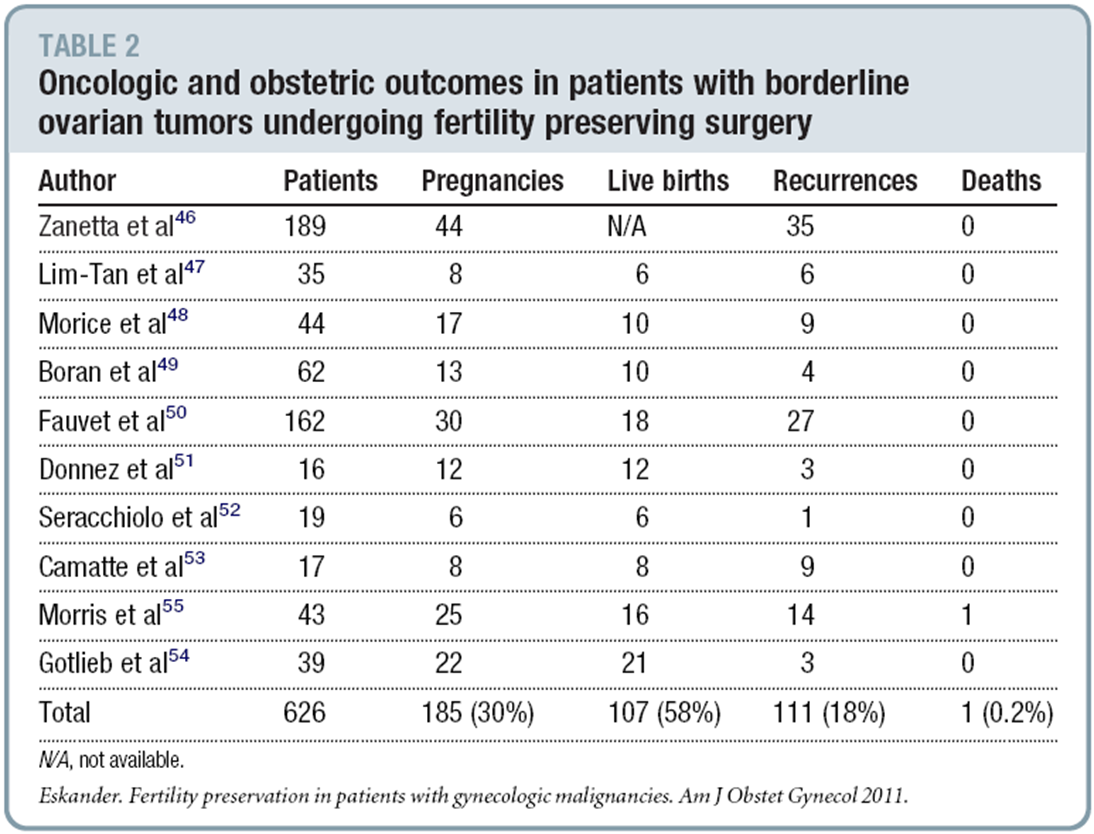
การปฏิบัติ
- พิจารณาเลือกวิธีระงับปวดหรือยาสลบตามความเหมาะสม โดยอาจเป็นยาแก้ปวด Pethidine 50 mg ร่วมกับ Valium 10 mg ทางหลอดเลือดดำ หรือทำ Para-cervical block โดยการใช้ยาชา 1% Lidocaine without epinephrine 10 ml ต่อกับ Spinal needle เบอร์ 20
- ใช้น้ำยาฆ่าเชื้อทำความสะอาดบริเวณอวัยวะสืบพันธุ์ภายนอก
- ปูผ้าปราศจากเชื้อ
- ตรวจภายในเพื่อประเมินขนาดและตำแหน่งของมดลูก
- ถ่างขยายช่องคลอดด้วย Bivalve speculum
- ทำความสะอาดบริเวณช่องคลอดและปากมดลูกด้วยน้ำยาฆ่าเชื้อ
- ประเมินรูปากมดลูก ถ้ามีขนาดเล็กต้องทำการถ่างขยายปากมดลูก โดยHegar dilator
- สอด canulaผ่านปากมดลูกอย่างนุ่มนวลจนถึง Fundus จากนั้นถอยออกมาเล็กน้อย
- การดูด (suction)
- เมื่อดูดเสร็จให้ปล่อย valve button และดึงเครื่องมือออก
- ปลด plunger ออกและเท content ใน cylinder ใส่ภาชนะที่เตรียมไว้
- ในกรณียังเหลือ content ค้างในโพรงมดลูกให้ทำการขูดมดลูกด้วย sharp curette หรือใช้ ring forceps ใส่เข้าไปคีบเอาเนื้อเยื่อในโพรงมดลูกออกมา อาจทำการตรวจ ultrasound ซ้ำ เพื่อความแน่ใจ
- เอาเครื่องมือออก
- การส่งตรวจทางพยาธิวิทยา
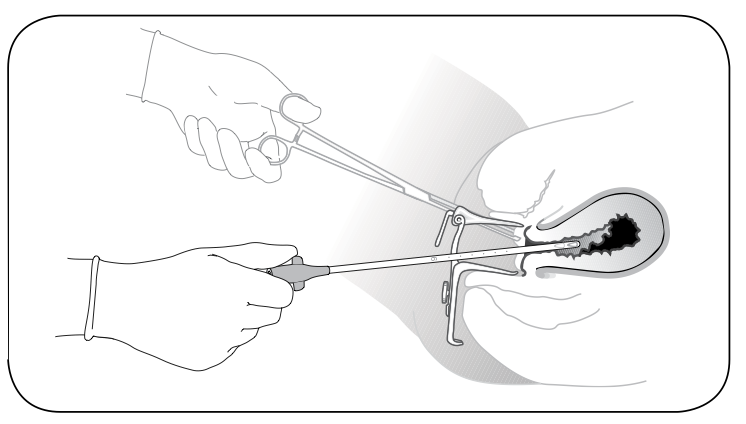
รูปที่ 10 สอด cannula ผ่านปากมดลูกอย่างนุ่มนวล
ที่มา: Performing Uterine Evacuation with the Ipas MVA Plus® Aspirator and IpasEasyGrip® Cannulae: Instructional Bookletavailable from
http://www.iawg.net/resources/RH%20Kit%208%20-%20Ipas%20MVA%20instructional%20booklet.pdf
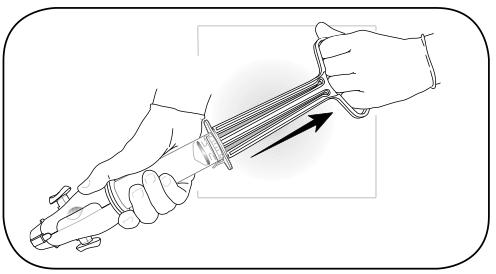
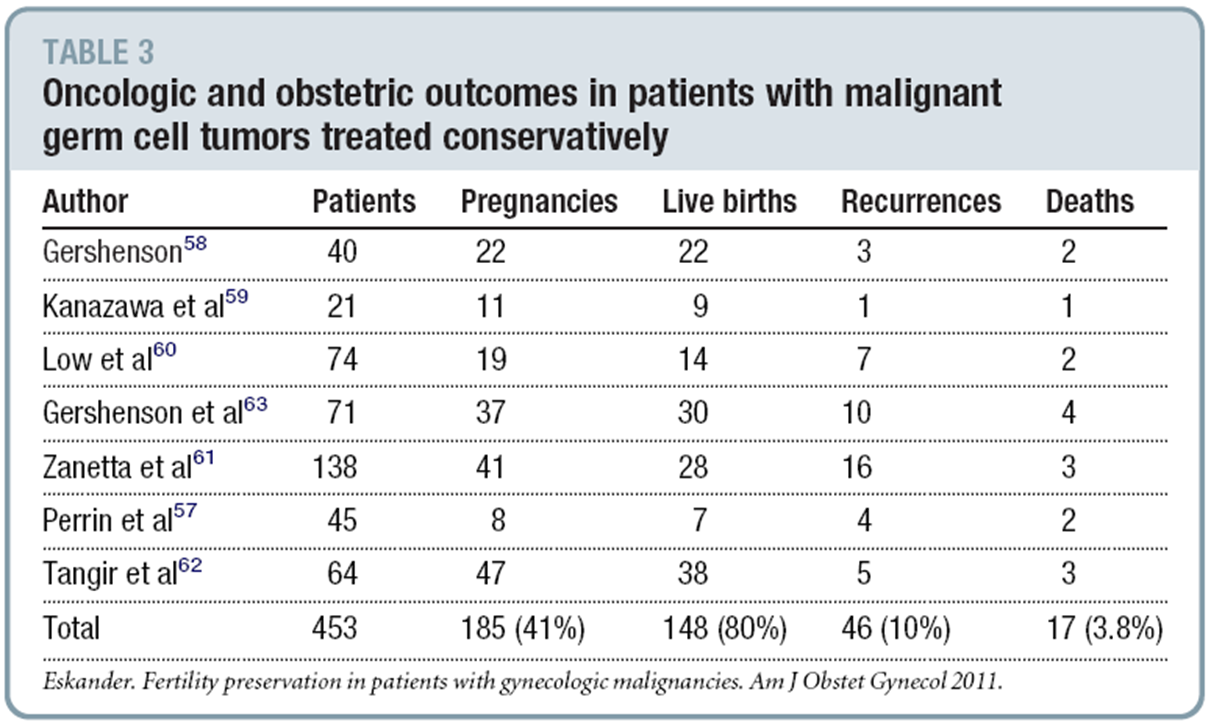
รูปที่ 11 ดึง plunger จน arm กางออก ดึงต่อจนถึง cylinder base
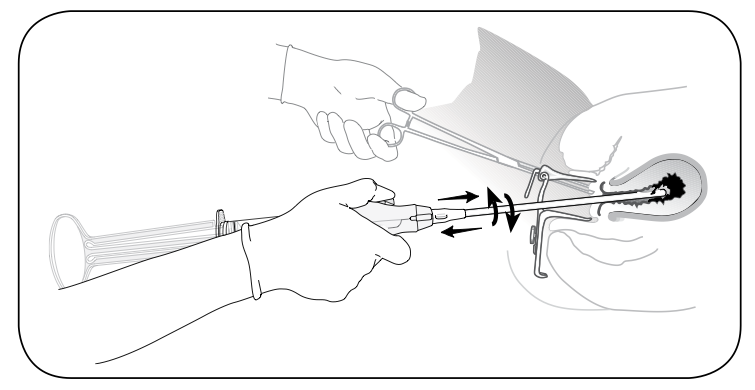
รูปที่ 12 ดูด content ในโพรงมดลูก โดยหมุน cylinder ไปแต่ล่ะด้าน 180 องศา ร่วมกับค่อยๆเลื่อน cannula เข้า-ออก พร้อมกันไป
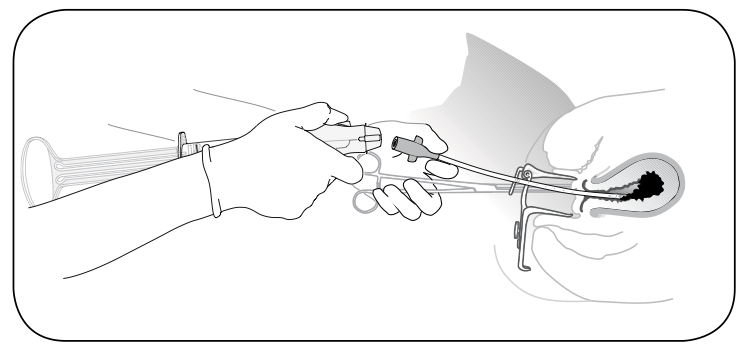
รูปที่ 13 เมื่อดูดเสร็จให้ปล่อย valve button และดึงเครื่องมือออก
ที่มา: Performing Uterine Evacuation with the IpasMVA Plus® Aspirator and IpasEasyGrip® Cannulae: Instructional Bookletavailable from
http://www.iawg.net/resources/RH%20Kit%208%20-%20Ipas%20MVA%20instructional%20booklet.pdf
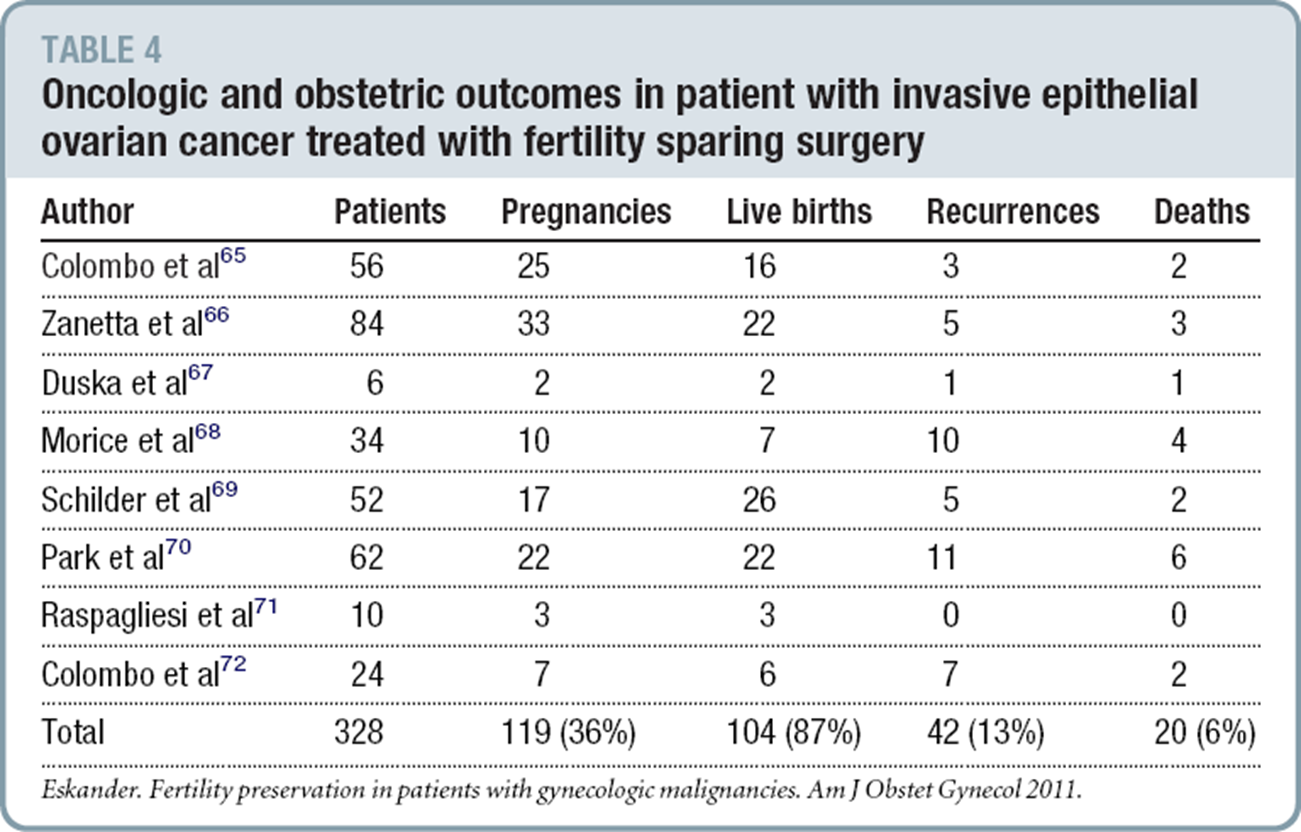
การตัดติ่งเนื้อที่ปากมดลูก (Cervical Polypectomy)
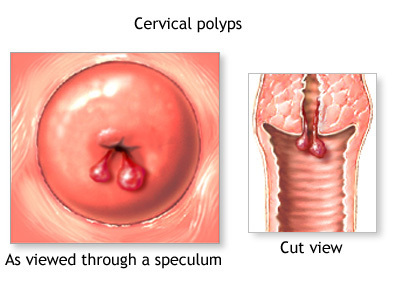
รูปที่ 14 ภาพติ่งเนื้อที่ปากมดลูก
ที่มา: Linda J. Vorvick M. cervical polypavailable from http://www.nlm.nih.gov/medlineplus/ency/article/001494.htm (3)
ข้อบ่งชี้ (Indication)
ผู้ป่วยที่มีติ่งเนื้อที่ปากมดลูกหรือติ่งเนื้อที่ยื่นออกมาจากปากมดลูก
ข้อห้าม (Contraindication)
- ห้ามทำหัตถการการตัดติ่งเนื้อที่ยื่นออกมาจากปากมดลูกในผู้ป่วยที่มีปัญหาเกี่ยวกับการแข็งตัวของเลือด หรือรับประทานสมุนไพรที่มีผลต่อการแข็งตัวของเลือด
- ห้ามทำหัตถการการตัดติ่งเนื้อที่ยื่นออกมาจากปากมดลูกในหญิงตั้งครรภ์ ยกเว้นกรณีที่สงสัยว่าเป็น โรคที่ร้ายแรง เช่น มะเร็งปาดมดลูก
ขั้นตอนการทำ Cervical polypectomy
การเตรียม
- เตรียมเครื่องมือเเละอุปกรณ์
- เตรียมผู้รับการตรวจ
- เตรียมผู้ตรวจ
การปฏิบัติ
- ใช้น้ำยาฆ่าเชื้อทำความสะอาดบริเวณอวัยวะสืบพันธุ์ภายนอก
- ถ่างขยายช่องคลอดด้วย Bivalve speculum
- ประเมินขนาดขั้วของติ่งเนื้อ โดยใช้ไม้พันสำลีหรือ Ring forceps ช่วยขยับติ่งเนื้อเพื่อให้เห็นขั้วได้ชัดขึ้น
- ทำความสะอาดบริเวณช่องคลอดและปาดมดลูกด้วยน้ำยาฆ่าเชื้อ
- ถ้าเป็น cervical หรือ endocervical polyp ที่ขั้วมีขนาดเล็ก ให้จับติ่งเนื้อด้วย ring forceps และทำการหมุนบิดขั้วพร้อมกับออกแรงดึงเล็กน้อย จนกระทั่งติ่งเนื้อหลุดออกมา ถ้าขั้วมีขนาดใหญ่ต้องทำหัตถการในห้องผ่าตัด และผูกขั้วด้วย absorbable suture แล้วตัดแทนการบิดขั้ว หรือทำการตัดในขณะทำ Hysteroscopy(4)
- นำติ่งเนื้อวางไว้บนผ้ากอซหรือส่งให้ผู้ช่วย
- ใช้ผ้ากอซหรือสำลีเช็ดบริเวณฐานของขั้วที่ตัดออกไป ถ้ามีเลือดออกให้ทำการกดห้ามเลือดไว้ชั่วครู่ กรณีที่เลือดไม่หยุดไหล สามารถใช้ Monsel’s solution หรือ silver nitrate ป้ายบริเวณแผลเพื่อทำการห้ามเลือด
- ถอด Bivalve speculum ออกจากช่องคลอด
- ส่งชิ้นเนื้อตรวจทางพยาธิวิทยา
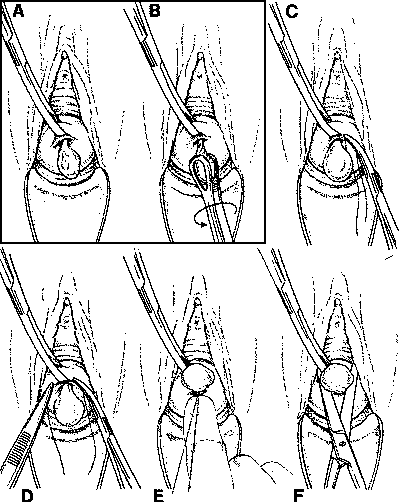
รูปที่ 15 A-B การบิดขั้วติ่งเนื้อขนาดเล็กด้วย ring forceps C-F การผูกและตัดขั้วของติ่งเนื้อ
ที่มา: Essential elements of obstetric care at first referral level.World Health Organization Geneva; 1991 (5)
ภาวะแทรกซ้อน
- เลือดออกจากขั้วของติ่งเนื้อ
- การติดเชื้อ
การให้คำแนะนำผู้ป่วยหลังทำหัตถการ
- อาจมีเลือดออกหรือคราบน้ำยาห้ามเลือดออกจากช่องคลอดได้เล็กน้อยภายหลังจากการทำหัตถการ
- ห้ามสวนล้างช่องคลอด ใช้ผ้าอนามัยแบบสอด หรือมีเพศสัมพันธ์เป็นเวลาอย่างน้อย 1 สัปดาห์
- กรณีที่มีอาการดังต่อไปนี้ให้กลับมาพบแพทย์
- มีเลือดออกมาก
- มีตกขาวมีกลิ่นหรือมีลักษณะคล้ายหนอง
- มีอาการปวดท้องน้อย
- มีไข้
- ให้มาฟังผลชิ้นเนื้อทางพยาธิวิทยาตามวันและเวลาที่นัด
การตัดชิ้นเนื้อที่ปากมดลูก(Cervical punch biopsy)
ข้อบ่งชี้ (Indication)
ผู้ป่วยที่มีรอยโรคหรือพยาธิสภาพที่ปากมดลูก และต้องการผลการตรวจทางพยาธิวิทยา เพื่อช่วยในการวินิจฉัยและวางแผนการรักษา
ข้อห้าม (Contraindication)
- ห้ามทำหัตถการตัดชิ้นเนื้อที่ปากมดลูกในหญิงตั้งครรภ์ ยกเว้น กรณีสงสัยว่าเป็นโรคร้ายแรง เช่น มะเร็งปากมดลูก
- ห้ามทำหัตถการตัดชิ้นเนื้อที่ปากมดลูกในผู้ป่วยที่มีปัญหาเกี่ยวกับการแข็งตัวของเลือด หรือรับประทานยาหรือสมุนไพรที่มีผลต่อการแข็งตัวของเลือด
ขั้นตอนการทำ Cervical punch biopsy
การเตรียม
- เตรียมเครื่องมือและอุปกรณ์
- เตรียมผู้รับการตรวจ
- เตรียมผู้ตรวจ
รูปที่ 16 ภาพ cervical punch biopsy
รูปที่ 17 ภาพ cervical punch biopsy
ที่มา: Chughtai MA. CERVICAL Biopsy Punch Forcesp available from :http://lebord.en.ecplaza.net/cervical-biopsy-punch-forcesp–81418-2188880.html (6)
การปฏิบัติ
- ใช้น้ำยาฆ่าเชื้อทำความสะอาดบริเวณอวัยวะสืบพันธุ์ภายนอก
- ถ่างขยายช่องคลอดด้วย Bivalve speculum
- เลือกตำแหน่งที่จะตัดให้เหมาะสม ถ้ามองไม่เห็นรอยโรคชัดเจน ให้ทำการตรวจเพิ่มเติมด้วยกล้องกำลังขยายสูงทางช่องคลอด (colposcopy) โดยชโลม acetic acid บริเวณปากมดลูกและช่องคลอด ร่วมกับการตรวจด้วยน้ำยาฆ่าเชื้อ
- .ทำความสะอาดบริเวณช่องคลอดและปากมดลูกด้วยน้ำยาฆ่าเชื้อ
- ใช้ Biopsy forceps ตัดชิ้นเนื้อที่ปากมดลูกบริเวณที่เลือกไว้ และให้ติดเนื้อดีด้วย โดยใส่ปลาย Biopsy forceps ด้านที่ลึกกว่าเข้าไปใน cervical os(7)
- นำชิ้นเนื้อวางไว้บนผ้ากอซหรือส่งให้ผู้ป่วย
- ใช้ผ้ากอซหรือไม้พันสำลี เพื่อดูปริมาณเลือดที่ออก ถ้ามีเลือดออกให้ทำการกดห้ามเลือดไว้ชั่วครู่ ถ้าเลือดไม่หยุดไหล สามารถใช้ Monsel’s solution ป้ายบริเวณแผลเพื่อทำการห้ามเลือด ในกรณีที่เลือดออกค่อนข้างมากหรือไม่มี Monsel’s solution อาจใช้ผ้ากอซหรือ Tampon ใส่เข้าไปในช่องคลอดให้แน่นไว้ประมาณ 6-24 ชั่วโมง ถ้าเลือดออกไม่หยุด ควรเย็บด้วย absorbable suture
- ถอด Bivalve speculum ออกจากช่องคลอด
- ส่งชิ้นเนื้อตรวจทางพยาธิวิทยา
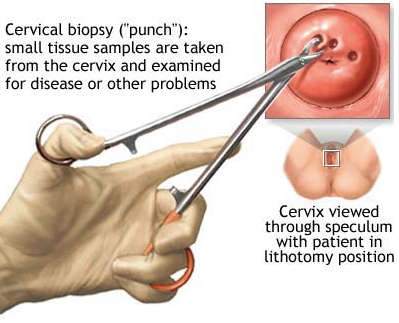
รูปที่ 18 ใช้ cervical punch biopsy forceps ตัดชิ้นเนื้อที่ปากมดลูก โดยด้านที่ลึกกว่าเข้าไปใน cervical os
ที่มา: Chen Y-B. Cervical biopsyavailable from : http://health.allrefer.com/health/cervical-cancer-cervical-biopsy.html (8)
ภาวะแทรกซ้อน
- เลือดออกจากแผลที่ตัดชิ้นเนื้อ
- การติดเชื้อ
การให้คำแนะนำหลังทำหัตถการ
- อาจมีเลือดออกหรือคราบน้ำยาห้ามเลือดออกจากช่องคลอดได้เล็กน้อยภายหลังจากการทำหัตถการ
- ห้ามสวนล้างช่องคลอด ใช้ผ้าอนามัยแบบสอด หรือมีเพศสัมพันธ์เป็นเวลาอย่างน้อย 1 สัปดาห์
- ให้เอาผ้ากอซออกในรายที่ใส่ไว้ภายใน 24 ชั่วโมง หลังทำหัตถการ
- กรณีที่มีอาการดังต่อไปนี้ให้กลับมาพบแพทย์
- มีเลือดออกมาก
- มีตกขาวมีกลิ่นหรือมีลักษณะคล้ายหนอง
- มีอาการปวดท้องน้อย
- มีไข้.ให้มาฟังผลชิ้นเนื้อทางพยาธิวิทยาตามวันและเวลาที่นัด
- ให้มาฟังผลชิ้นเนื้อทางพยาธิวิทยาตามวันและเวลาที่นัด
การผ่าและเย็บปากถุงน้ำบาร์โธลิน(Bartholin’s Marsupialization)
ข้อบ่งชี้ (Indication)
- ผู้ป่วยที่มีถุงน้ำบาร์โธลินที่มีอาการปวดหรือมีขนาดโตขึ้นเรื่อยๆ
- ผู้ป่วยเป็นฝีของต่อมบาร์โธลิน
ข้อห้าม (Contraindication)
ผู้ป่วยที่มีถุงน้ำบาร์โธลินที่มีขนาดเล็กและไม่มีอาการ
ขั้นตอนการทำ Bartholin’s marsupialization
การเตรียม
- เตรียมเครื่องมือและอุปกรณ์
- ประเมินผู้รับการตรวจ
- เตรียมผู้รับการตรวจ
- เตรียมผู้ตรวจ
การปฏิบัติ
- ใช้น้ำยาฆ่าเชื้อทำความสะอาดบริเวณที่จะทำการผ่าตัดและอวัยวะสืบพันธ์ภายนอก
- สวมปลอกขาและปูผ้าช่องปราศจากเชื้อ
- ตรวจคลำดูถุงน้ำบาร์โธลินเพื่อประเมินตำแหน่งและขนาดให้ชัดเจน
- ฉีดยาชา 1-2% Lidocaine ใต้ผิวชั้น mucosa บริเวณกลางถุงน้ำและบริเวณขอบรอบๆ ถุงน้ำเป็นรัศมีประมาณ 2 เซนติเมตรจากขอบ และทำการทดสอบว่าชาหรือไม่ก่อนลงมือ
- แหวก Labia minoraด้วยนิ้วหัวแม่มือและนิ้วชี้ของมือซ้าย เพื่อให้เห็นบริเวณถุงน้ำชัดเจน
- ใช้มีดกรีดจากบริเวณส่วนกลางของถุงน้ำทางด้าน mucosa ของช่องคลอดที่คลุมต่อมบาร์โธลินและอยู่หน้าต่อ hymenal ring เพียงเล็กน้อย โดยกรีดในแนวตรงจากด้านบนลงด้านล่างจนทะลุผนังของถุงน้ำ แล้วขยายบริเวณปากถุงไปทางด้านบนและด้านล่าง ให้แผลมีความยาวประมาณ 2-3 เซนติเมตร เพื่อให้น้ำในถุงออกให้หมดและเพียงพอให้มีการเปิดของปากแผลหลังผ่าตัดหรือกรีดเป็นรูปวงรี (elliptical incision) ที่ mucosa ให้มีความกว้างช่วงกลางประมาณ 1-1.5 เซนติเมตร และยาว 2-3 เซนติเมตร ร่วมกับตัดเอาส่วนหนังด้านบนองถุงน้ำออกบางส่วนเพื่อลดโอกาสการปิดปากแผลเร็วกว่ากำหนด(4)
- ล้างทำความสะอาดภายในถุงด้วย normal saline solution หรือน้ำยาฆ่าเชื้อ ในกรณีที่ผู้ป่วยอายุมากกว่า 40 ปีให้สำรวจผนังภายในถุงให้ละเอียดว่ามีก้อนหรือรอยโรคหรือไม่ เนื่องจากมีโอกาสที่จะเป็นมะเร็งของต่อมบาร์โธลินได้ ในกรณีที่สงสัยให้ตัดผนังของถุงน้ำส่งตรวจทางพยาธิวิทยาร่วมด้วย
- นำผนังด้านในของถุงน้ำมาเย็บกับ mucosa ของช่องคลอดทั้งด้านบน ด้านล่าง และด้านข้างแบบ Interrupted stitch ด้วย Delayed absorbable suture เบอร์ 3-0 หรือ 4-0 แล้วดูแลให้เลือดที่ออกจากขอบแผลหยุดเรียบร้อย ถ้ายังมีเลือดออกที่บริเวณใดให้เย็บซ่อมแซมเพิ่มเติมจนเลือดหยุด
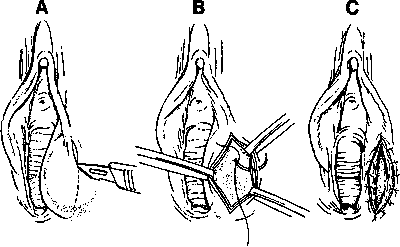
รูปที่ 19 ใช้มีดกรีดในแนวตรงจากบนลงล่าง B-Cขยายปากถุงเพื่อระบายหนองออก และเย็บผนังด้านในถุงน้ำกับ mucosa ของช่องคลอด
ที่มา : Essential elements of obstetric care at first referral level.World Health Organization Geneva; 1991 (5)
ภาวะแทรกซ้อน
- มีเลือดออกจากแผลที่ผ่าตัด (มีโอกาสเกิดขึ้นน้อยกว่าร้อยละ 5)
- การติดเชื้อ (มีโอกาสเกิดขึ้นน้อยกว่าร้อยละ 5)
- การกลับเป็นซ้ำ (มีโอกาสกลับเป็นซ้ำร้อยละ 10-15)
การให้คำแนะนำหลังทำหัตถการ
- นั่งแช่ในน้ำอุ่น (Warm sitz baths) ภายหลังทำหัตถการอย่างน้อย 3-5 วัน
- งดมีเพศสัมพันธ์ประมาณ 3-4 สัปดาห์ หรือจนกว่าจะกลับมาตรวจติดตามแล้วแพทย์ประเมินว่าแผลหายดีแล้ว
- ให้รับประทานยาปฏิชีวนะและยาแก้ปวดให้ครบตามที่แพทย์สั่ง
- ในกรณีที่มีอาการดังต่อไปนี้ให้กลับมาพบแพทย์
- มีเลือดออกจากแผล
- มีแผลบวมอักเสบ
- มีอาการปวดมากขึ้นกว่าเดิม
- มีไข้ขึ้นสูง
- มีหนองไหลออกมาจากช่องคลอด
- ให้มาตรวจดูแผลหลังผ่าตัด 1 สัปดาห์ตามที่แพทย์นัด
เอกสารอ้างอิง
- Organization WH. Safe abortion: technical and policy guidance for health systems. 2012.
- Nina Frankel MA. Performing Uterine Evacuation with the Ipas MVA Plus® Aspirator and Ipas EasyGrip® Cannulae: Instructional Booklet 2007. Available from: http://www.iawg.net/resources/RH%20Kit%208%20-%20Ipas%20MVA%20instructional%20booklet.pdf.Accessed December 5, 2014
- Linda J. Vorvick M. Cervical polyps 1997-2014 [updated 03 December 2014 cited 2014 5]. Available from: http://www.nlm.nih.gov/medlineplus/ency/article/001494.htm.Accessed December 5, 2014
- DeCherney A, Nathan L, Goodwin TM, Laufer N, Roman A. Current diagnosis & treatment obstetrics & gynecology: McGraw Hill Professional; 2012.
- Organization WH, Fathalla M. Essential elements of obstetric care at first referral level: World Health Organization Geneva; 1991.
- Chughtai MA. CERVICAL Biopsy Punch Forcesp 1996 [cited 2014 5]. Available from: http://lebord.en.ecplaza.net/cervical-biopsy-punch-forcesp–81418-2188880.html.Accessed December 5, 2014
- The Johns Hopkins University TJHH, and Johns Hopkins Health System. Cervical Biopsy [cited 2014 5]. Available from: http://www.hopkinsmedicine.org/healthlibrary/test_procedures/gynecology/cervical_biopsy_92,P07767/.Accessed December 5, 2014
- Chen Y-B. Cervical biopsy 2003 [updated 12/27/2009 cited 2014 5]. Available from: http://health.allrefer.com/health/cervical-cancer-cervical-biopsy.html.Accessed December 5, 2014