Cervical cancer in pregnancy
จุฑามาศ อาภรณ์พัฒนา
อาจารย์ที่ปรึกษา
บทนำ
มะเร็งที่เกิดในสตรีตั้งครรภ์มีหลายชนิด แต่ที่พบบ่อย 3 อันดับแรก เป็น มะเร็งเต้านม มะเร็งปากมดลูก และมะเร็งต่อมไทรอย์ โดยพบเป็น สัดส่วนร้อยละ 16.2, 13.5 และ 10.6 ตามลำดับ (รูปที่ 1) ในบทความนี้จะขอกล่าวถึงมะเร็งปากมดลูกที่พบใน สตรีตั้งครรภ์ ซึ่งมีอุบัติการณ์โดยเฉลี่ย 0.8 – 1.5 รายต่อการเกิด 10,000 คน (1-3) ปัจจุบันตรวจพบมะเร็งปากมดลูกในสตรีตั้งครรภ์และหลังคลอดร้อยละ 1-3 โดยครึ่งหนึ่งของผู้ป่วยตรวจพบในระยะก่อนคลอด อีกครึ่งหนึ่งวินิจฉัยจากการตรวจภายในช่วง 12 เดือนหลังคลอด ทั้งนี้มีการตรวจคัดกรองมะเร็งปากมดลูกในหญิงตั้งครรภ์มากขึ้นจึงทำให้ตรวจพบได้ในระยะแรกๆ และบางรายรอยโรครุนแรงขึ้นได้จากการตั้งครรภ์ (6)
ยังไม่มีข้อมูลชัดเจนจากการศึกษาวิจัยแบบสุ่ม (randomization) ที่มีจำนวนผู้ป่วยมากพอ เพื่อหาข้อสรุปในการดูแลผู้ป่วยมะเร็งปากมดลูกขณะตั้งครรภ์ ดังนั้นแนวทางการรักษาจึงใช้แนวทางเดียวกับมะเร็งปากมดลูกในสตรีไม่ได้ตั้งครรภ์ โดยพิจารณาเป็นรายๆไป ขึ้นกับระยะของโรค ความต้องการในการตั้งครรภ์ของผู้ป่วยและญาติ ชนิดของเซลล์มะเร็ง รวมถึงความเสี่ยงที่โรคจะพัฒนามากขึ้นจากการตั้งครรภ์และการรักษาที่ล่าช้า เป็นต้น
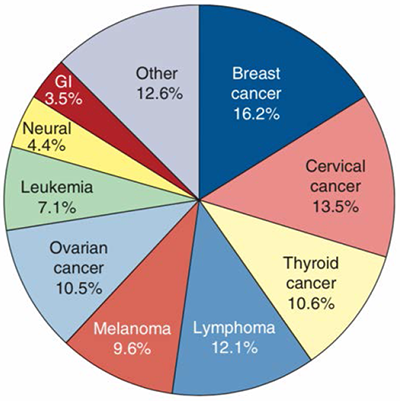
รูปที่ 1 แสดงอุบัติการณ์ของโรคมะเร็งในสตรีตั้งครรภ์และในช่วง 12 เดือนหลังคลอดของสตรีตั้งครรภ์ 4.85 ล้านคนใน California cancer registry (data from Smith,2003)
ที่มา willium25ed,neoplastic disorder,page1160
อาการและอาการแสดงของโรค
อาการและอาการแสดงของมะเร็งปากมดลูกในหญิงตั้งครรภ์ขึ้นอยู่กับระยะและขนาดของรอยโรค ส่วนใหญ่ผู้ป่วยในระยะ IA และประมาณครึ่งหนึ่ง ของผู้ป่วยระยะ IB มักจะไม่มีอาการ แต่ตรวจพบจากการคัดกรองเซลล์ปากมดลูก (PAP smear) ขณะมาฝากครรภ์ ส่วนอีกครึ่งหนึ่ง ของระยะ IB จะมีอาการเลือดออกผิดปกติทางช่องคลอดหรือมีตกขาวผิดปกติ ผู้ป่วยที่มีระยะของโรคมากกว่า IB มักจะมีอาการปวดท้องน้อยราวลงขา ปวดเอว ซีดเรื้อรัง หายใจเหนื่อย ซึ่งเป็นอาการที่พบได้ในสตรีตั้งครรภ์จึงอาจทำให้การวินิจฉัยล่าช้าได้
เนื่องจากปากมดลูกในสตรีตั้งครรภ์จะมีการเปลี่ยนแปลงได้ตามฮอร์โมน เช่น ectropion, stroma edema, cervical ripening, cervical decidual reaction ซึ่งอาจจะมีลักษณะคล้ายรอยโรคของมะเร็งปากมดลูก ดังนั้นหากพบรอยโรคที่สงสัยแนะนำให้ตัดชิ้นเนื้อไปตรวจพยาธิวิทยา
การวินิจฉัย
ปัจจุบันการตรวจเซลล์บริเวณปากมดลูกเพื่อคัดกรองมะเร็งปากมดลูกเป็นส่วนหนึ่งในการประเมินสตรีตั้งครรภ์ที่มาฝากครรภ์ครั้งแรก หรือมีอาการเลือดออกทางช่องคลอดผิดปกติ ซึ่งพบว่ามีอุบัติการณ์การตรวจพบเซลล์ปากมดลูกผิดปกติร้อยละ 5-8 สูงเท่าๆกับในสตรีที่ไม่ได้ตั้งครรภ์ หากพบรอยโรคหรือสงสัยควรตัดชิ้นเนื้อไปตรวจพยาธิวิทยา หรือ ควรส่งปรึกษาแพทย์ทางมะเร็งนรีเวช ทั้งนี้ไม่แนะนะให้ตรวจ endocervical curettage ในสตรีตั้งครรภ์เพราะอาจทำให้เกิดการแท้งบุตรได้
สำหรับแนวทางการดูแลสตรีตั้งครรภ์ที่มีผลคัดกรองมะเร็งปากมดลูกผิดปกติ อ้างอิงจาก the American Society for Colposcopy and Cervical Pathology (ASCCP) guideline 2014 (7) มีดังนี้
- สตรีอายุต่ำกว่า 20 ปี : มีโอกาสติดเชื้อ HPV ได้มาก มีเพียงเล็กน้อยที่มีการเปลี่ยนแปลงของปากมดลูกในระยะก่อนเป็นมะเร็งเป็น Atypical squamous cells of undetermined significance (ASCUS), Low-grade squamous intraepithelial lesion (LSIL) พบว่า ร้อยละ 90 สามารถหายได้และมีโอกาสกลายไปเป็นมะเร็งต่ำมาก(8) ดังนั้นแนะนำให้ตรวจ PAP smear อีกครั้งหลังคลอด หรือพิจารณาทำ colposcopy ในระหว่างตั้งครรภ์
- สตรีอายุมากกว่า 20 ปี : หากตรวจพบ ASC-US กลุ่มนี้จะมีความเสี่ยงในการเกิด CIN 3 (cervical intraepithelial neoplasia) ในเวลา 5 ปี อยู่ร้อยละ 2.6 แนวทางการรักษาเหมือนสตรีทั่วไป หรือนัดตรวจ colposcopy หลังคลอด 6 สัปดาห์ได้ กรณีตรวจพบ LSIL (5-year CIN3 risk 5.2 %) แนะนำให้นัด colposcopy ทันที หรือ 6 สัปดาห์หลังคลอด หลังจากนั้นให้ตรวจติดตามการรักษาแบบสตรีทั่วไป (7, 9)
- กรณีผลตรวจ cytology เป็น atypical squamous cell cannot be excluded high grade squamous intraepithelial lesion (ASC-H) มี 5-year progression to CIN 3+ ร้อยละ 16 แนะนำให้ทำ colposcopy ทันทีในขณะตั้งครรภ์
- กรณีตรวจพบ high-grade squamous intraepithelial lesions (HSIL) มีโอกาสหายได้เองร้อยละ 48 – 70 หลังคลอด แต่พบว่าร้อยละ 89 คงอยู่จนถึงหลังคลอด และพัฒนาไปเป็นมะเร็งปากมดลูกขณะตั้งครรภ์ได้ร้อยละ 0 – 0.4 (10, 11). แนะนำให้ทำ colposcopy ทันทีในขณะตั้งครรภ์
- กรณีตรวจพบ Atypical glandular cells (AGC) แนะนำให้ทำ colposcopy ทันทีในขณะตั้งครรภ์ หลีกเลี่ยงการทำ endocervical curettage และ endometrial biopsy
ตารางที่ 1 สรุปแนวทางในการดูแลสตรีตั้งครรภ์ที่ตรวจพบผล Pap test ผิดปกติระยะก่อนเป็นมะเร็ง
|
Abnormality |
Women aged 25+ years |
Women aged 21- 34 years |
|
NILM/HPV positive |
Repeat PAP in 1 year; colposcopy if current PAP is 2nd NILM/HPV positive |
Not applicable |
|
ASC-US HPV positive
HPV negative HPV unknown |
Colposcopy preferred; deferral of colposcopy until 6 weeks PP acceptable Routine screening Repeat cytology 1 years; colposcopy if current PAP is 2nd ASC-US |
Repeat PAP in 1 years
Routine screening
|
|
LSIL |
Colposcopy preferred; deferral of colposcopy until 6 weeks PP acceptable |
Repeat PAP in 1 years |
|
ASC-H HSIL SCCA AGC AIS adenoCA |
Colposcopy during pregnancy |
|
Colposcopy
การตรวจ colposcopy ในหญิงตั้งครรภ์ ทำได้ค่อนข้างยากต้องอาศัยความชำนาญในการตรวจเพื่อแยกความผิดปกติจากมะเร็ง หรือเป็นเพียงการเปลี่ยนแปลงของปากมดลูกในขณะตั้งครรภ์เท่านั้น เช่น มีการเพิ่มขึ้นของหลอดเลือดทำให้ immature metaplastic epithelium ทำปฏิกิริยากับ acetic acid มากขึ้นกว่าปกติ ทำให้ดูคล้ายกับ dysplastic lesion หรือมี squamocolumnar junction ออกมาด้านนอกของปากมดลูก (eversion/ectropion) ดังภาพที่ 2 รวมถึงภาวะ cervical decidualization ซึ่งเกิดจากการเพิ่มขึ้นของระดับฮอร์โมน progesterone ทำให้มีการเปลี่ยนแปลงของ stromal tissues บริเวณต่าง ๆ เพื่อให้เหมาะสมในการตั้งครรภ์ จึงอาจพบลักษณะของปากมดลูกบวมแดงมากขึ้นได้ดังรูปที่ 3 พบว่าการเปลี่ยนแปลงที่ปากมดลูกจะค่อยๆหายไปได้เองหลังคลอด อย่างไรก็ตามหากพบรอยโรคที่สงสัยเป็นมะเร็งปากมดลูก ควรตัดชิ้นเนื้อส่งตรวจพยาธิวิทยา (biopsy) จากการศึกษาในหญิงตั้งครรภ์พบว่าการตัดชิ้นเนื้อเพียงเล็กน้อยในระหว่างตั้งครรภ์อาจมีโอกาสเกิดภาวะแทรกซ้อนได้ ร้อยละ 0.6 (12, 13) แต่ไม่มีรายงานภาวะแทรกซ้อนที่รุนแรงถึงชีวิต (14) แต่หากมีเลือดออกมากสามารถใช้ monsel solution ทาหรือเย็บจุดที่เลือดออกได้ สำหรับการทำ endocervical curettage ไม่แนะนำให้ทำในระหว่างตั้ง กรณีผลพยาธิวิทยาไม่พบความผิดปกติของปากมดลูกแนะนำให้ทำ colposcopy อีกครั้งหลังคลอดแล้วมากกว่า 6 สัปดาห์
กรณีที่ colposcopy ในอายุครรภ์น้อยเกินไปทำให้แปลผลไม่ชัดเจน (unsatisfactory) ให้นัดมา colposcopy ซ้ำใน 6 – 12 สัปดาห์ เพราะตำแหน่ง transformation zone จะ migrate ออกมาด้านนอกบริเวณ ectocervix
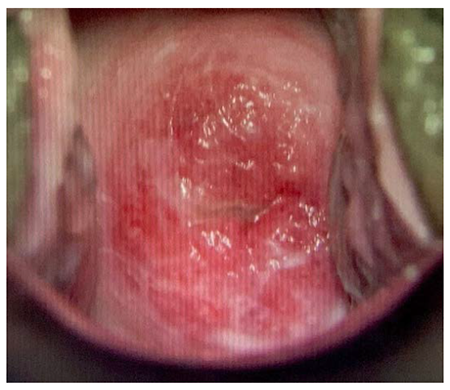
รูปที่ 2 Cervical ectropion ภาพcolposcopeของผู้ป่วยในรพ.มหาราชนครเชียงใหม่
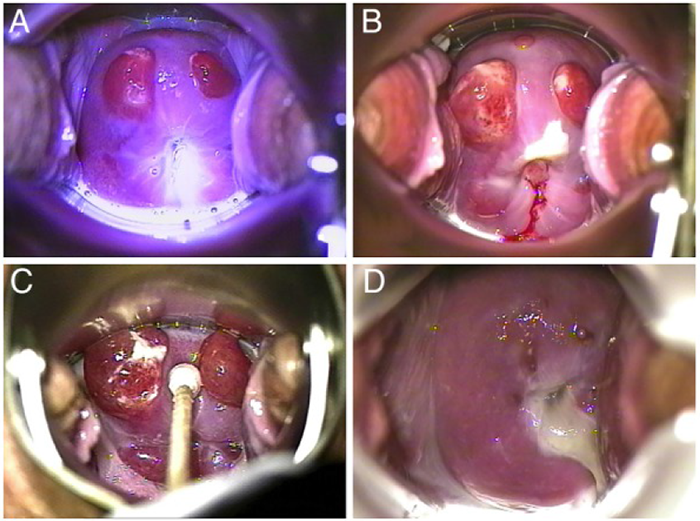
รูปที่ 3 Cervical decidualization A: 12wk, B: 21wk and C: 25wk, spontaneously resolving in D: 8 wk PP
ที่มา Cervical deciduosis imitating dysplasia;BMJ.case Rep 2015 Sep;22 2015, van Diepen DA (5)
ระยะของโรค (staging)
ตารางที่ 2 การแบ่งระยะของมะเร็งปากมดลูกตามข้อกำหนดของสหพันธ์สูติศาสตร์และนารีเวชวิทยานานาชาติ (FIGO) พ.ศ. 2561 (4)
|
ระยะ |
รายละเอียดของแต่ละระยะ |
|
|
|
|
I |
มะเร็งจำกัดอยู่ภายในปากมดลูกเท่านั้น การลุกลามไปที่ตัวมดลูกไม่นำมากำหนดระยะของมะเร็งปากมดลูก |
|
IA |
มะเร็งระยะลุกลามที่ตรวจพบโดยการตรวจด้วยกล้องจุลทรรศน์เท่านั้น มีการลุกลามลงไปในชั้นสโตรมา (stroma) ความลึก < 5 มม. |
|
IA1 |
การลุกลามลงไปในสโตรมามีความลึก < 3 มม. |
|
IA2 |
การลุกลามลงไปในสโตรมามีความลึก ≥ 3 มม. แต่ < 5 มม. |
|
IB |
มะเร็งจำกัดอยู่ในปากมดลูก หรือรอยโรคมีขนาดใหญ่กว่าระยะ IA ( ≥ 5 มม.) |
|
IB1 |
ขนาดของก้อนมะเร็งที่มองเห็นใหญ่ที่สุด > 2 ซม. และ มีความลึก ≥ 5 มม. |
|
IB2 |
ขนาดของก้อนมะเร็งที่มองเห็นใหญ่ที่สุด ≥ 2 ซม. แต่ < 4 ซม. |
|
IB3 |
ขนาดของก้อนมะเร็งที่มองเห็นใหญ่ที่สุด ≥ 4 ซม. |
|
II |
มะเร็งลุกลามออกนอกปากมดลูกแต่ไม่ถึงผนังด้านข้างอุ้งเชิงกราน ลุกลามผนังช่องคลอดแต่ลงมาไม่ถึงส่วนล่าง 1 ใน 3ของช่องคลอด |
|
IIA |
มะเร็งลุกลาม 2 ใน 3 ด้านบนของผนังช่องคลอด แต่ไม่ถึงผนังด้านข้างของอุ้งเชิงกราน |
|
IIA1 |
ขนาดของก้อนมะเร็งที่มองเห็นใหญ่สุด < 4 ซม. |
|
IIA2 |
ขนาดของก้อนมะเร็งที่มองเห็นใหญ่สุด ≥ 4 ซม. |
|
IIB |
มะเร็งมีการลุกลามพารามีเทรียม แต่ไม่ถึงผนังด้านข้างอุ้งเชิงกราน |
|
III |
มะเร็งลุกลามถึงส่วนล่าง 1 ใน 3 ของช่องคลอด และ/หรือ ลุกลามผนังด้านข้างของอุ้งเชิงกราน และ/หรือมีภาวะไตบวมน้ำ (hydronephrosis) หรือ ไตไม่ทำงาน (nonfunctioning kidney)s และ/หรือมะเร็งลุกลามต่อมน้ำเหลืองบริเวณอุ้งเชิงกรานหรือต่อมน้ำเหลืองพาราเอออร์ติก |
|
IIIA |
มะเร็งลุกลามไม่ถึงผนังด้านข้างอุ้งเชิงกรานแต่ลงมาถึงส่วนล่าง 1 ใน 3 ของช่องคลอด |
|
IIIB |
มะเร็งลุกลามถึงผนังด้านข้างของอุ้งเชิงกราน และ/หรือ มีภาวะไตบวมน้ำหรือไตไม่ทำงาน (โดยที่ไม่มีสาเหตุอื่น) |
|
IIIC |
มะเร็งลุกลามถึงต่อมน้ำเหลืองบริเวณอุ้งเชิงกราน และ/หรือ ต่อมน้ำเหลืองพาราเอออร์ติก |
|
IIIC1 |
มะเร็งลุกลามถึงต่อมน้ำเหลืองบริเวณอุ้งเชิงกรานเท่านั้น |
|
IIIC2 |
มะเร็งลุกลามถึงต่อมน้ำเหลืองพาราเอออร์ติก |
|
IV |
มะเร็งลุกลามออกไปนอกอุ้งเชิงกราน หรือลุกลามเยื่อบุกระเพาะปัสสาวะหรือไส้ตรง ภาวะเยื่อบุบวมบุลลัส (Bullous edema) ไม่ถือว่าเป็นระยะ IV |
|
IVA |
มะเร็งแพร่กระจายไปยังอวัยวะข้างเคียง เช่น กระเพาะปัสสาวะและลำไส้ตรง |
|
IVB |
มะเร็งแพร่กระจายไปยังอวัยวะห่างไกลเช่น ปอด และต่อมน้ำเหลืองในช่องท้อง |
การตรวจร่างกายเป็นส่วนสำคัญในการประเมินระยะของโรคจึงควรตรวจอย่างละเอียดโดยบอกลักษณะของ primary tumor, uterus, vagina, parametrium, groin, right upper quadrant, supraclavicular nodes หากไม่สามารถบอกรายละเอียดเหล่านี้ได้แนะนำให้ยาสลบขณะตรวจ (under anesthesia)
สำหรับการตรวจทางรังสีวิทยา (imaging study) ตามแนวทาง FIGO staging ในสตรีที่ไม่ได้ตั้งครรภ์สามารถใช้ chest and skeletal radiographs, intravenous pyelogram (IVP) และ barium enema. ส่วนการตรวจ computed tomographic (CT) studies, magnetic resonance imaging (MRI), positron emission tomography (PET), and lymphangiograms ไม่ได้ใช้ประเมินระยะของโรคแต่อาจช่วยในการวางแผนรักษาได้. สำหรับสตรีตั้งครรภ์มีคำแนะนำในการตรวจประเมินดังนี้ (15)
- Chest x-ray (with abdominal shielding) ควรทำในผู้ป่วยที่มีระยะโรคมากกว่า microscopic cervical cancer (IA) เพื่อหารอยโรคที่กระจายไปปอด
- Radiographic imaging of the urinary tract เช่น ultrasound หรือ MRI เพื่อประเมินระบบทางเดินปัสสาวะ ในผู้ป่วยระยะ IB1 ที่มีก้อนใหญ่, IB2, advanced disease หรือมะเร็งปากมดลูกชนิด adenocarcinoma, small cell carcinoma
- Ultrasound หรือ MRI ยังช่วยในการประเมินการกระจายไปตับ, อุ้งเชิงกรานข้างเคียง หรือช่องท้อง โดยที่ MRI มีข้อดีกว่าในการบอกรายละเอียด tumor volume, parametrium involvement หรือ การกระจายต่อมน้ำเหลือง
การส่งตรวจทางรังสีส่วนใหญ่มีค่ารังสีน้อยกว่า 0.1 cGy ซึ่งไม่มีผลต่อทารกทั้งในระยะช่วงปฏิสนธิและขณะตั้งครรภ์ แต่อย่างไรก็ตามควรส่งตรวจเท่าที่จำเป็น
ในผู้ป่วยบางรายที่มีความเสี่ยงสูงของการกระจายโรคไปที่ต่อมน้ำเหลือง อาจพิจารณาทำ surgical staging lymphadenectomy ผ่านทาง extraperitoneal หรือ laparoscope หาก lymph node positive ควรทำการรักษาให้เร็วที่สุด สำหรับกรณี endoscopy เช่น proctoscopy หรือ cystoscopy ทำกรณีที่จำเป็นโดยผู้เชี่ยวชาญเท่านั้น
แนวทางในการดูแลรักษา
สำหรับมะเร็งปากมดลูกในสตรีตั้งครรภ์แบ่งการรักษาออกเป็น ระยะก่อนลุกลาม (preinvasive disease) และ ระยะลุกลาม (invasive disease) ดังนี้
• Preinvasive disease
โดยส่วนใหญ่แล้วในกลุ่มระยะก่อนเป็นมะเร็งจะสามารถเฝ้าติดตามอาการ และนัดตรวจรักษา (definitive therapy) หลังคลอด 6-8 สัปดาห์ได้ (16) กรณีเป็น high-grade lesion มีความเสี่ยงจะพัฒนาไปเป็น invasive disease น้อยมากประมาณร้อยละ 0 – 0.4 (17, 18)
นอกจากนั้นรอยโรคอาจจะหายไปเองหลังคลอดได้ สำหรับแนวทางดูแลรักษา หากเป็น CIN 2,3 แนะนำตรวจ colposcopy หลังจากผล cytology ไม่ต่ำกว่า 12 สัปดาห์ และพิจารณาตัดชิ้นเนื้อบริเวณที่สงสัย สำหรับแนวทางการคลอดพบว่าไม่มีผลกระทบต่อการลุกลามของโรคจึงเป็นไปตามข้อบ่งชี้ของทางสูติศาสตร์เป็นหลัก
• Invasive disease
สำหรับการดูแลในระยะนี้ต้องคำนึงถึง ความต้องการในการตั้งครรภ์ต่อ ความเสี่ยงในการลุกลามของโรคหากให้การรักษาที่ล่าช้ารวมถึงระยะเวลาและวิธีการคลอด ซึ่งต้องอาศัยการตัดสินใจร่วมกันระหว่างผู้ป่วย ญาติ และทีมผู้เชี่ยวชาญในการรักษา
สำหรับผู้ป่วยที่ต้องการยุติการตั้งครรภ์หลังได้รับการวินิจฉัยมะเร็งปากมดลูกมีแนวทางในการดูแลดังนี้
- ระยะ early-stage disease แนะนำให้ radical hysterectomy with fetus in situ และพิจารณาเก็บรังไข่ไว้เท่าที่ทำได้
- ระยะ advanced disease ให้ทำการรักษาตามแนวทางของสตรีไม่ตั้งครรภ์ (concurrent chemoradiation) แนะนำให้นำทารก (evacuation) ออกมาก่อนเริ่มให้ยาเคมีบำบัดและรังสีรักษา มีโอกาสน้อยที่จะ spontaneous abortion ออกเอง แต่หากทำไม่ได้ให้รอหลังจากให้ยาเคมีบำบัดครบ
หากตัดสินใจตั้งครรภ์ต่อแต่พบว่ามีการกระจายไปต่อมน้ำเหลืองมากขึ้น รอยโรคมีการลุกลามกระจายมากขึ้นขณะตั้งครรภ์ แนะนำให้รักษามารดาโดยไม่คำนึงถึงอายุครรภ์
สำหรับผู้ป่วยที่เลือกจะตั้งครรภ์ต่อหลังได้รับการวินิจฉัยมะเร็งปากมดลูกนั้น มีแนวทางในการดูแลรักษาขึ้นกับอายุครรภ์ ชนิดของเซลล์มะเร็ง ระยะของโรค ความสามารถในการเกิดรอดของทารกโดยอาศัยการดูแลร่วมกันของผู้เชี่ยวชาญหลายๆด้าน
แนวทางดูแลรักษาจำแนกตามอายุครรภ์ และระยะของโรคมะเร็งปากมดลูกตาม FIGO 2018
กรณีอายุครรภ์น้อยกว่า 22-25 สัปดาห์
แนะนำให้เลาะต่อมน้ำเหลืองในอุ้งเชิงกราน (pelvic lymphadenectomy) ในกรณีที่เป็นระยะ IA1 ที่มี LVSI ขึ้นไป ซึ่งพบว่าไม่เพิ่มภาวะแทรกซ้อนในการตั้งครรภ์ หลังจากนั้นดูแลตามแนวทางต่อไปนี้
- Negative node involvement: ให้รักษาตามระยะของโรคที่จะกล่าวต่อไป
- Positive node involvement: แสดงถึงการพยากรณ์ของโรคที่แย่ (advance disease) แนะนำให้รักษาด้วย definitive therapy เลยแต่หากผู้ป่วยต้องการตั้งครรภ์ต่อนั้นสามารถให้ทางเลือกในการทำ neoadjuvant chemotherapy และพิจารณาคลอดให้เร็วที่สุดในช่วงอายุครรภ์ที่ทารกเกิดรอดได้
Stage IA1
สามารถรักษาด้วยวิธีการ conization ได้ซึ่งเป็นการตัดปากมดลูกเป็นรูปกรวย มีโอกาสเกิดการตกเลือดร้อยละ 5-15 , แท้งได้ร้อยละ 15 (19, 20) โดยความเสี่ยงจะแปรผันกับอายุครรภ์ที่มากขึ้นและปริมาณชิ้นเนื้อที่ตัดออก สำหรับช่วงเวลาที่เหมาะสมในการทำคือช่วงไตรมาสที่ 2 หรืออายุครรภ์ 14-20 สัปดาห์ ไม่แนะนำทำ ช่วง 4 สัปดาห์ก่อนคลอดเนื่องจากมีโอกาสเสียเลือดมากได้จากปากมดลูกที่บางลง หลังจากทำ conization หากผลพยาธิเป็น IA1 ควรตรวจภายในและ colposcopy ทุกไตรมาสตลอดการตั้งครรภ์
สำหรับวิธีการคลอดระยะนี้หากผลพยาธิ margin negative สามารถคลอดทางช่องคลอดได้ ไม่ได้เพิ่มความเสี่ยงของการลุกลาม แต่ไม่แนะนำให้ตัด episiotomy หากไม่จำเป็น(21) หาก margin positive แนะนำผ่าตัดคลอดทางหน้าท้อง
Definitive treatment
- กรณีที่ยังต้องการมีบุตรในอนาคต (preserve future fertility) หาก conization margin negative ไม่ต้องรักษาเพิ่มเติม ให้ตรวจคัดกรองอย่างใกล้ชิดเฝ้าระวังการเกิดโรคซ้ำ แต่หาก margin positive แนะนำทำ conization ซ้ำ 6-8 สัปดาห์หลังคลอด
- กรณีไม่ต้องการมีบุตรแล้ว และไม่มี LVSI แนะนำ extrafascial hysterectomy หรือทำ cesarean hysterectomy ได้แต่ต้องชั่งระหว่างภาวะแทรกซ้อนที่จะเกิดขึ้นด้วย แต่หาก มี LVSI ด้วย แนะนำทำ radical hysterectomy เป็นต้น
Stage IA2 – IB1
ระยะ IA2 – IB1 ขนาดของรอยโรคขนาดเล็กไม่เกิน 2 cm พบว่าโอกาสกระจายไป parametrium น้อยกว่าร้อยละ 1 (22) แนะนำรักษาโดยการทำ simple trachelectomy หรือ large conization มากกว่า radical trachelectomy เนื่องจากเพิ่มอากาสแท้งได้ร้อยละ 32 (23)
Definitive treatment
- กรณีที่ยังต้องการมีบุตรในอนาคต (preserve future fertility) พิจารณาทำ radical trachelectomy (with lymphadenectomy) หลังคลอด 6 – 8 สัปดาห์ และพิจารณาทำ cerclage บริเวณ uterine isthmus ในครรภ์ต่อไป
- กรณีไม่ต้องการมีบุตรแล้ว ทำ radical hysterectomy อาจจะทำพร้อมการผ่าตัดคลอดไปเลยหรือทำหลังจากนั้นได้
Stage IB2, IB3, II or higher
หากตรวจไม่พบการกระจายไปยังต่อมน้ำเหลืองสามารถให้การรักษาเป็น neoadjuvant chemotherapy คู่ไปกับการตั้งครรภ์ได้ แต่หากพบมะเร็งลุกลามไปต่อมน้ำเหลืองแนะนำยุติการตั้งครรภ์มากกว่า จากการศึกษา (23)พบว่าการให้ยาเคมีบำบัดชนิด platinum-based ทุกสามสัปดาห์จนกระทั่งอายุครรภ์ 33 สัปดาห์ มีการตอบสนองโดยรวม (overall response rate) ร้อยละ 90 และมี complete response rate ร้อยละ 62.5 หากติดตามไปครบสองปีพบว่า อัตราการอยู่รอด ของ stage IB1 ร้อยละ 94, stage IB2 ร้อยละ 70, stage >IB ร้อยละ 70 เป็นต้น(23) ปัจจุบันนิยมให้ neoadjuvant chemotherapy ทุกสามสัปดาห์ตั้งแต่ไตรมาสที่ 2 จนถึง อายุครรภ์ 34-35 สัปดาห์ รวม 6 cycles และพิจารณาคลอดตอนอายุครรภ์ 37 สัปดาห์ ควรให้ยาเคมีบำบัดครบก่อนคลอด 3 สัปดาห์เพื่อให้ไขกระดูกมารดากลับมาทำงานปกติและมีการขับยาออกจากทารกในครรภ์และรกแล้ว แนะนำให้ตรวจภายในทุกครั้งที่มารับยาเคมีบำบัดเพื่อติดตามการลุกลามของโรค
ยาเคมีบำบัดที่ใช้ยังไม่ได้มีการศึกษาที่ชัดเจนในสตรีตั้งครรภ์ว่าปลอดภัยต่อทารก มีบางรายงานภาวะ fetal ototoxicity, transient neutropenia ในทารกแรกคลอด แต่ก็ยังไม่สรุปแน่ชัดว่าเกิดจากยา cisplatin ปัจจุบันยังนิยมใช้ carboplatin / cisplatin, paclitaxel ในการรักษามะเร็งปากมดลูก ส่วนยาที่ไม่แนะนำให้ใช้เลยเนื่องจากยังไม่มีข้อมูลว่าปลอดภัยในสตรีตั้งครรภ์ คือ gemcitabine, vinorelbine, topotecan, bavacizumab เป็นต้น(23)
กรณีอายุครรภ์มากกว่า 22-25 สัปดาห์ : ไม่ควรทำ lymphadenectomy เนื่องจากมดลูกมีขนาดใหญ่ทำได้ยาก แนะนำรักษาตามระยะของโรคดังนี้
Stage IA – IB1
เป็นระยะที่ขนาดของรอยโรคไม่เกิน 2 cm สามารถชะลอการรักษาออกไปช่วง 6-8 สัปดาห์ หลังคลอดได้ (delay treatment ) ไม่เพิ่มการลุกลามของตัวโรค(24, 25)
Stage > IB1
ขนาดของรอยโรคมากกว่า 2 cm ยังไม่มีการศึกษาที่แน่ชัดในการชะลอการรักษา (delayed treatment) ผู้เชี่ยวชาญมะเร็งนรีเวชแนะนำว่าควรให้การรักษาในผู้ป่วยที่มีรอยโรคขนาดมากกว่า 4 cm หรือสงสัยว่าจะมีการกระจายไปต่อมน้ำเหลือง(26) แต่หากผู้ป่วยยืนยันจะตั้งครรภ์ต่อแนะนำให้ยาเคมีบำบัดควบคู่ไปจนกระทั่งคลอด และตรวจติดตามเช่นเดียวกับ early stage ดังที่กล่าวไปแล้ว
การตรวจติดตามการรักษาระหว่างตั้งครรภ์
- Stage IA1 แนะนำตรวจภายใน และ colposcopy ทุกไตรมาส
- Advanced stage แนะนำให้ตรวจภายในทุก 3-4 สัปดาห์หรือทุกครั้งที่ได้ยาเคมีบำบัด และทำ MRI without gadolinium เพื่อติดตามการลุกลามของโรค รวมถึงฝากครรภ์ในกลุ่มความเสี่ยงสูงกับผู้เชี่ยวชาญทางด้านเวชศาสตร์มารดาและทารก (maternal-fetal medicine) เพื่อติดตามสุขภาพทารกในครรภ์อย่างใกล้ชิด
ช่วงเวลาและวิธีการที่เหมาะสมในการคลอด
สำหรับเวลาและวิธีการคลอดที่เหมาะสมของแต่ละคนขึ้นกับอายุครรภ์ ระยะของโรค การลุกลามมากขึ้นของโรค ส่วนใหญ่แนะนำให้คลอดหลังอายุครรภ์ 37 สัปดาห์ขึ้นไป หากไม่มีข้อบ่งชี้อื่น ๆทางสูติกรรม ในระยะต้น (IA1-IA2) ที่มี margin negative สามารถคลอดทางช่องคลอดได้ โดยหลีกเลี่ยงการตัด episiotomy เนื่องจากมีรายงานการเกิด การลุกลามของเซลล์มะเร็งไปที่แผล episiotomy หลังจากการคลอดทางช่องคลอดเป็นต้น(27) สำหรับผู้ป่วยที่มีระยะโรคมากกว่า IA2 จะมีรอยโรคขนาดใหญ่ มีโอกาสขัดขวางช่องทางคลอด และการตกเลือดหลังคลอดได้จึงแนะนำให้ผ่าตัดคลอดทั้งหมด
Outcome
สำหรับพยากรณ์โรคมะเร็งปากมดลูกในสตรีตั้งครรภ์จากการศึกษาส่วนใหญ่ในปัจจุบันที่ยังมีข้อมูลที่จำกัดนั้น พบว่าไม่แตกต่างจากในสตรีที่ไม่ได้ตั้งครรภ์เมื่อเทียบตามระยะของโรค
จาก retrospective studies หลายรายงาน ยังไม่พบว่าโรคมะเร็งปากมดลูกมีผลต่อการตั้งครรภ์ชัดเจน แต่ส่วนใหญ่พบว่าสตรีที่พบเป็นมะเร็งปากมดลูกในช่วงตั้งครรภ์หรือหลังคลอดมีอัตราการเกิดทารกน้ำหนักตัวน้อย มากกว่า
สรุป
ปัจจุบันแนะนำตรวจคัดกรอกมะเร็งปากมดลูกในหญิงตั้งครรภ์ทุกราย หากตรวจพบว่ามีการเปลี่ยนแปลงของเซลล์ผิดปกติแนะนำตรวจติดตามดังตารางที่ 3 หากตรวจพบเป็นมะเร็งปากมดลูกแนะนำปรึกษาทีมแพทย์หลากหลายสาขาในการดูแลรักษาผู้ป่วยเช่น ผู้เชี่ยวชาญด้านมะเร็งนรีเวช ด้านเวชศาสตร์มารดาและทารก แพทย์เชี่ยวชาญทางด้านทารกแรกคลอด รวมถึงจิตแพทย์ และวางแผนแนวทางการรักษาร่วมกับผู้ป่วยและญาติด้วย โดยแนวทางในการดูแลรักษาผู้ป่วยตาม FIGO 2018 ดังนี้
เอกสารอ้างอิง
- Smith LH, Dalrymple JL, Leiserowitz GS, Danielsen B, Gilbert WM. Obstetrical deliveries associated with maternal malignancy in California, 1992 through 1997. American journal of obstetrics and gynecology. 2001;184(7):1504-13.
- Duggan B, Muderspach LI, Roman LD, Curtin JP, Morrow C. Cervical cancer in pregnancy: reporting on planned delay in therapy. Obstetrics and gynecology. 1993;82(4 Pt 1):598-602.
- Demeter A, Sziller I, Csapó Z, Szánthó A, Papp Z. Outcome of pregnancies after cold-knife conization of the uterine cervix during pregnancy. European journal of gynaecological oncology. 2002;23(3):207-10.
- Oncology FCoG. FIGO staging for carcinoma of the vulva, cervix, and corpus uteri. International Journal of Gynecology & Obstetrics. 2014;125(2):97-8.
- van Diepen DA, Hellebrekers B, van Haaften A-M, Natté R. Cervical deciduosis imitating dysplasia. Case Reports. 2015;2015:bcr2015210030.
- Zemlickis D, Lishner M, Degendorfer P, Panzarella T, Sutcliffe SB, Koren G. Maternal and fetal outcome after invasive cervical cancer in pregnancy. Journal of clinical oncology. 1991;9(11):1956-61.
- Massad LS, Einstein MH, Huh WK, Katki HA, Kinney WK, Schiffman M, et al. 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors. Journal of Lower Genital Tract Disease. 2013;17:S1-S27.
- Moscicki A-B, Shiboski S, Hills NK, Powell KJ, Jay N, Hanson EN, et al. Regression of low-grade squamous intra-epithelial lesions in young women. The Lancet. 2004;364(9446):1678-83.
- Darragh TM, Colgan TJ, Cox JT, Heller DS, Henry MR, Luff RD, et al. The lower anogenital squamous terminology standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Archives of pathology & laboratory medicine. 2012;136(10):1266-97.
- Kaplan KJ, Dainty LA, Dolinsky B, Rose GS, Carlson J, McHale M, et al. Prognosis and recurrence risk for patients with cervical squamous intraepithelial lesions diagnosed during pregnancy. Cancer Cytopathology: Interdisciplinary International Journal of the American Cancer Society. 2004;102(4):228-32.
- Ahdoot D, Van Nostrand KM, Nguyen NJ, Tewari DS, Kurasaki T, DiSaia PJ, et al. The effect of route of delivery on regression of abnormal cervical cytologic findings in the postpartum period. American journal of obstetrics and gynecology. 1998;178(6):1116-20.
- Hacker NF, Berek JS, Lagasse LD, Charles EH, Savage EW, Moore JG. Carcinoma of the cervix associated with pregnancy. Obstetrics & Gynecology. 1982;59(6):735-47.
- Kohan S, Beckman E, Bigelow B, Klein S, Douglas G. The role of colposcopy in the management of cervical intraepithelial neoplasia during pregnancy and postpartum. The Journal of reproductive medicine. 1980;25(5):279-84.
- Economos K, Perez NV, Delke I, Collado M, Tancer ML. Abnormal cervical cytology in pregnancy: a 17-year experience. Obstetrics and gynecology. 1993;81(6):915-8.
- Practice CoO. Committee opinion No. 723: guidelines for diagnostic imaging during pregnancy and lactation. Obstetrics and gynecology. 2017;130(4):e210.
- Ackermann S, Gehrsitz C, Mehlhorn G, Beckmann M. Management and course of histologically verified cervical carcinoma in situ during pregnancy. Acta obstetricia et gynecologica Scandinavica. 2006;85(9):1134-7.
- Yost NP, Santoso JT, McIntire DD, Iliya FA. Postpartum regression rates of antepartum cervical intraepithelial neoplasia II and III lesions. Obstetrics & Gynecology. 1999;93(3):359-62.
- Paraskevaidis E, Koliopoulos G, Kalantaridou S, Pappa L, Navrozoglou I, Zikopoulos K, et al. Management and evolution of cervical intraepithelial neoplasia during pregnancy and postpartum. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2002;104(1):67-9.
- Averette HE, Nasser N, Yankow SL, Little WA. Cervical conization in pregnancy: Analysis of 180 operations. American Journal of Obstetrics & Gynecology. 1970;106(4):543-9.
- Hannigan EV, Atkinson W, Becker S. Cone biopsy during pregnancy. Obstetrics and gynecology. 1982;60(4):450-5.
- Van Calsteren K, Vergote I, Amant F. Cervical neoplasia during pregnancy: diagnosis, management and prognosis. Best Practice & Research Clinical Obstetrics & Gynaecology. 2005;19(4):611-30.
- Herod J, Decruze S, Patel R. A report of two cases of the management of cervical cancer in pregnancy by cone biopsy and laparoscopic pelvic node dissection. BJOG: An International Journal of Obstetrics & Gynaecology. 2010;117(12):1558-61.
- Amant F, Halaska MJ, Fumagalli M, Steffensen KD, Lok C, Van Calsteren K, et al. Gynecologic cancers in pregnancy: guidelines of a second international consensus meeting. International Journal of Gynecologic Cancer. 2014;24(3):394-403.
- Karam A, Feldman N, Holschneider CH. Neoadjuvant cisplatin and radical cesarean hysterectomy for cervical cancer in pregnancy. Nature Reviews Clinical Oncology. 2007;4(6):375.
- Method MW, Brost BC, editors. Management of cervical cancer in pregnancy. Seminars in surgical oncology; 1999: Wiley Online Library.
- Germann N, Haie-Meder C, Morice P, Lhomme C, Duvillard P, Hacene K, et al. Management and clinical outcomes of pregnant patients with invasive cervical cancer. Annals of oncology. 2003;16(3):397-402.
- Baloglu A, Uysal D, Aslan N, Yigit S. Advanced stage of cervical carcinoma undiagnosed during antenatal period in term pregnancy and concomitant metastasis on episiotomy scar during delivery: a case report and review of the literature. International Journal of Gynecologic Cancer. 2007;17(5):1155-9.


