ภาวะเยื่อบุโพรงมดลูกหนาตัว (Endometrial hyperplasia)
พญ. กานต์ทอง ศิริวัฒน์
ผศ. นพ..มนัสวี มะโนปัญญา
ภาวะเยื่อบุโพรงมดลูกหนาตัว (endometrial hyperplasia) เป็นการเจริญผิดปกติของทั้งต่อม (gland) และสโตรมา (stroma) ที่ประกอบกันขึ้นเป็นเยื่อบุโพรงมดลูก โดยลักษณะทางจุลพยาธิวิทยาจะพบว่ามีการเพิ่มขึ้นของต่อมในเยื่อบุโพรงมดลูกจนมีอัตราส่วนของต่อมต่อสโตรมาสูงกว่าปกติ และอาจจะมีเซลล์เยื่อบุที่มีลักษณะผิดปกติ (atypia) ร่วมด้วย ทั้งนี้ปัจจัยเสี่ยงที่ทำให้เกิดภาวะเยื่อบุโพรงมดลูกหนาตัวจำแนกได้ดังนี้(1)
- ปัจจัยที่ปรับเปลี่ยนไม่ได้ ได้แก่ อายุมากกว่า 35 ปี, เชื้อชาติคอเคเซียน, มีประวัติภาวะเยื่อบุโพรงมดลูกหนาตัวในครอบครัว
- ลักษณะประจำเดือน ได้แก่ อยู่ในวัยหมดระดู, เริ่มมีประจำเดือนเร็วหรือหมดประจำเดือนช้า, มีระยะก่อนหมดประจำเดือน (perimenopause) ยาวนาน, ไม่เคยตั้งครรภ์มาก่อน
- โรคแทรกซ้อนอื่น ๆ ได้แก่ ภาวะอ้วน, โรคเบาหวาน, ภาวะถุงน้ำรังไข่หลายใบ (polycystic ovary syndrome; PCOS), กลุ่มโรค hereditary non-polyposis colon cancer (Lynch syndrome) และมะเร็งที่สร้างฮอร์โมน เช่น มะเร็งรังไข่ชนิด granulosa cell
- สาเหตุจากการให้ยาหรือฮอร์โมน เช่น การได้รับยาในกลุ่ม selective estrogen receptor modulators (SERMs) เช่น Tamoxifen หรือ Raloxifen เป็นเวลานาน, การได้รับฮอร์โมนทดแทนกลุ่มเอสโตรเจนเพียงอย่างเดียว, การได้รับฮอร์โมนเอสโตรเจนจากแหล่งภายนอกร่างกาย
- ปัจจัยอื่น ๆ ได้แก่ การสูบบุหรี่ และการกลายพันธุ์ของยีน เป็นต้น
จะเห็นได้ว่าปัจจัยต่าง ๆ ที่กล่าวมาข้างต้นโดยส่วนใหญ่เกี่ยวข้องกับการที่เยื่อบุโพรงมดลูกได้รับการกระตุ้นด้วยฮอร์โมนเอสโตรเจนในร่างกายที่มีระดับสูงอยู่เป็นเวลานาน โดยไม่มีฮอร์โมนโปรเจสเตอโรนหรือมีอยู่ในระดับที่ไม่เพียงพอต่อการเปลี่ยน prolferative endometrium เป็น secretory endometrium ตามรอบประจำเดือนหรือที่เรียกภาวะนี้ว่า “unopposed estrogen stimulation” ซึ่งจะทำให้เกิดภาวะเยื่อบุโพรงมดลูกหนาตัวและเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกตามมาได้
ทั้งนี้มะเร็งเยื่อบุโพรงมดลูกจำแนกออกเป็น 2 ชนิดใหญ่ ๆ ตามพยาธิกำเนิด ได้แก่ ชนิดที่เกี่ยวข้องกับฮอร์โมนเอสโตรเจน (type I หรือ estrogen dependent) และชนิดที่ไม่เกี่ยวข้องกับฮอร์โมนเอสโตรเจน (type II หรือ non-estrogen dependent) โดยชนิดแรกจะมีลักษณะทางพยาธิวิทยาเป็นแบบ endometrioid adenocarcinoma และสัมพันธ์กับภาวะเยื่อบุโพรงมดลูกหนาตัว มักพบในสตรีวัยหมดระดูหรือมีภาวะอ้วน ในขณะที่ชนิดที่ 2 จะสัมพันธ์กับภาวะเยื่อบุโพรงมดลูกฝ่อและมีพยากรณ์โรคไม่ดีเมื่อเทียบกับชนิดที่ 1 โดยปัจจัยเสี่ยงในการเกิดมะเร็งเยื่อบุโพรงมดลูกแสดงในตารางที่ 1
ตารางที่ 1 ปัจจัยเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก
|
ปัจจัยเสี่ยง |
ความเสี่ยงสัมพัทธ์ (เท่า) |
|
ไม่เคยตั้งครรภ์มาก่อน |
2-3 |
|
หมดประจำเดือนช้า |
2-4 |
|
น้ำหนัก 21-50 ปอนด์ |
3 |
|
น้ำหนักมากกว่า 50 ปอนด์ |
10 |
|
โรคเบาหวาน |
2-8 |
|
การได้รับฮอร์โมนเอสโตรเจนเพียงชนิดเดียว |
4-8 |
|
มีประวัติได้รับการรักษาด้วยยา Tamoxifen |
2-3 |
|
ภาวะเยื่อบุโพรงมดลูกหนาชนิด atypical endometrial hyperplasia |
8-29 |
|
กลุ่มโรค hereditary non-polyposis colon cancer (Lynch syndrome) |
20 |
ที่มา : ดัดแปลงจาก Berek and Novak’s Gynecology, 16th edition, Lippincott Williams and Wilkins, 2019, Chapter 37 page no: 1003
แต่เดิมการแบ่งชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวอ้างอิงตามระบบของระบบขององค์การอนามัยโลกหรือที่เรียกว่า World Health Organization (WHO) system ที่จัดทำขึ้นในปี ค.ศ.1994 ซึ่งแบ่งภาวะเยื่อบุโพรงมดลูกหนาตัวออกเป็น 4 ชนิดตามลักษณะทางพยาธิวิทยา ได้แก่ simple hyperplasia, complex hyperplasia (adenomatous), simple atypical hyperplasia และ complex atypical hyperplasia (adenomatous with atypia) ต่อมาองค์กร American College of Obstetrics and Gynecology และ Society of Gynecologic Oncology ได้เสนอให้ใช้ระบบ endometrial intraepithelial neoplasia (EIN) system ซึ่งสามารถทำนายการเกิดมะเร็งเยื่อบุโพรงมดลูกได้ดีและเป็นประโยชน์ต่อการวางแผนการดูแลรักษาผู้ป่วยมากกว่า แต่ไม่ค่อยได้รับความนิยมในกลุ่มพยาธิแพทย์ และในปี ค.ศ. 2014 องค์การอนามัยโลกได้ปรับปรุงเกณฑ์การจำแนกใหม่ (WHO 2014 classification) ซึ่งได้ปรับจากเกณฑ์เดิมและผนวกระบบ EIN เข้ามาเพื่อลดการสับสนและง่ายต่อการสื่อสารในวงกว้าง ทำให้ระบบนี้เป็นที่ยอมรับและนิยมใช้มากกว่า โดยระบบนี้ได้จำแนกภาวะเยื่อบุโพรงมดลูกหนาตัวออกเป็น 2 ชนิด ดังนี้ (2, 3)
ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ
เยื่อบุโพรงมดลูกที่มี nonatypical endometrial hyperplasia ลักษณะตรวจพบด้วยตาเปล่าจะมีการหนาตัวของเยื่อบุโพรงมดลูกโดยทั่วๆ หรืออาจมีลักษณะเป็น polypoid apparance หน้าตัดสีขาวหรือสีน้ำตาลอ่อน ลักษณะจุลพยาธิวิทยาของภาวะเยื่อบุโพรงมดลูกหนาชนิดนี้จะมีจำนวนของต่อมในเยื่อบุโพรงมดลูก (endometrial gland) เพิ่มมากขึ้นและอยู่กันอย่างหนาแน่น (croweded) โดยกินพื้นที่มากกว่าร้อยละ 50 ของเยื่อบุโพรงมดลูก ทำให้อัตราส่วนของต่อมต่อสโตรมา (gland-to-stoma ratio) มากกว่า 1 ขนาดของต่อมจะมีความหลากหลายร่วมกับมี cystic dilatation หรือ irregular luminal contour ลักษณะของต่อมมีแบบแผนการเรียงตัวเป็น round และ tubular pattern หรืออาจเรียงตัวกันอย่างไม่เป็นระเบียบแบบแผน อย่างไรก็ตามจะไม่มีลักษณะ atypia ของต่อม เซลล์เยื่อบุผิวจะมีการเรียงตัวซ้อนกันเป็นแบบ pseudostratification, มี mitotically active หรือมีการยืดออกของเซลล์คอลัมนาร์คล้ายกับที่พบในช่วง mid หรือ late proliferative phase ของรอบเดือนปกติ ขนาดของเซลล์อาจจะโตขึ้นเล็กน้อยและนิวเคลียสจะมีลักษณะที่ยืดออก chromatin กระจายสม่ำเสมอและจะเห็น nucleolus ไม่ชัด ที่สำคัญคือลักษณะของเซลล์ที่อยู่ในบริเวณที่มีต่อมอยู่กันอย่างหนาแน่นจะไม่แตกต่างจากบริเวณที่ต่อมมีจำนวนปกติ โดยผู้ป่วยส่วนใหญ่จะอยู่ในวัยใกล้หมดระดู (perimenopause) และไม่ค่อยมีอาการหรืออาจจะมาด้วยเลือดออกผิดปกติจากโพรงมดลูก ทั้งนี้ภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้จะไม่สัมพันธ์กับการกลายพันธุ์ของยีนและมีโอกาสพัฒนาเป็นมะเร็งเยื่อบุโพรงมดลูกน้อยกว่าร้อยละ 5 (ค่าความเสี่ยงสัมพัทธ์ 1.01-1.03)(3)
ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติ
ภาวะ atypical endometrial hyperplasia (AEH) หรือ endometrial intraepithelial neoplasia (EIN) ลักษณะตรวจพบด้วยตาเปล่าจะมีลักษณะหนาตัวกว่าปกติ โดยอาจจะพบติ่งเนื้อ (polypoid apparance) ร่วมอยู่ด้วยได้ประมาณร้อยละ 40 หน้าตัดมีสีน้ำตาลอ่อน ลักษณะทางจุลพยาธิวิทยาจะมีความผิดปกติของต่อมเยื่อบุโพรงมดลูกเช่นเดียวกับกลุ่ม nonatypical endometrial hyperplasia แต่จะพบ nuclear atypia ร่วมด้วย โดยนิวเคลียสจะมีขนาดใหญ่ขึ้น (neclear enlargement) และรูปร่างหลากหลาย (pleomorphism) เช่น กลมขึ้น (rounding) แนวการเรียงตัวของเซลล์หรือนิวเคลียสไม่เป็นไปในทิศทางเดียวกัน (loss of polarity) มี chromatin จับตัวกันเป็นเม็ด และเห็นนิวคลีโอไล (nucleoli) เมื่อตรวจเพิ่มเติมด้วยการย้อมอิมมูโน (immunohistochemistry) ส่วนใหญ่จะพบว่าย้อมติด ER และ PR แต่ส่วนหนึ่งจะย้อมไม่ติด PTEN และ PAX2 โดยคิดเป็นร้อยละ 44 และ 71 ตามลำดับ ซึ่งสามารถใช้ในการแยก AH/EIN ออกจาก nonatypical endometrial hyperplasia ผู้ป่วยส่วนใหญ่จะอยู่ในวัยหมดระดู และสัมพันธ์กับกับการกลายพันธุ์ของยีน เช่น PAX2, PTEN, KRAS และ CTNNB1(3) ทั้งนี้ภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้มีโอกาสพัฒนาเป็นมะเร็งเยื่อบุโพรงมดลูกสูงถึงร้อยละ 60 (ค่าความเสี่ยงสัมพัทธ์ 14-45)(3)
อาการและอาการแสดง
- เลือดออกผิดปกติจากช่องคลอด โดยพบว่าร้อยละ 75-90 ของผู้ป่วยจะมีเลือดออกจากโพรงมดลูก (4, 5) ผู้ป่วยจะมาด้วยเลือดออกในวัยหมดระดู (postmenopausal bleeding) หรือมีลักษณะที่ผิดปกติของรอบเดือน คือ ระยะเวลาระหว่างรอบสั้นเกินไปหรือระยะเวลาในแต่ละรอบมากเกินไป แต่จะไม่สัมพันธ์กับปริมาณประจำเดือนที่ผิดปกติ
- ไม่มีอาการแต่ตรวจพบเซลล์ผิดปกติจากการตรวจคัดกรองมะเร็งปากมดลูก โดยความไวของการตรวจแบบ conventional Pap smear และ liquid-based cytology อยู่ที่ร้อยละ 40-50 และ 50-60 ตามลำดับ(6)
ข้อบ่งชี้ในการตรวจหาภาวะเยื่อบุโพรงมดลูกหนาตัว
- สตรีวัยหมดระดูที่มีเลือดออกผิดปกติจากช่องคลอด (postmenopausal bleeding)
- สตรีอายุ 45 ปีขึ้นไปที่ยังไม่หมดประจำเดือน แต่มีเลือดออกผิดปกติทางช่องคลอด(7)
- สตรีอายุน้อยกว่า 45 ปีที่ยังไม่หมดประจำเดือนและมีเลือดออกผิดปกติทางช่องคลอด แต่มีปัจจัยเสี่ยงร่วมด้วย เช่น ดัชนีมวลกาย (body mass index) มากกว่า 30 กิโลกรัม/ตารางเมตร(8) , มีภาวะไข่ไม่ตกเรื้อรัง, ได้รับฮอร์โมนเอสโตรเจนเป็นเวลานาน, เคยรักษาอาการเลือดออกผิดปกติด้วยยาแล้วอาการไม่ดีขึ้น และมีกลุ่มโรคที่มีความเสี่ยงสูงในการเป็นมะเร็งเยื่อบุโพรงมดลูก เช่น กลุ่มโรค Lynch syndrome หรือ Cowden syndrome
- สตรีที่มีผลการตรวจคัดกรองมะเร็งปากมดลูกผิดปกติผลเป็น Atypical glandular cells (AGC)
- สตรีกลุ่มเสี่ยงสูงที่จะเป็นมะเร็งเยื่อบุโพรงมดลูก เช่น กลุ่มโรค Lynch syndrome
วิธีการตรวจเพื่อวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัว
การวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัวควรเริ่มด้วยการตรวจร่างกายและตรวจภายใน เพื่อแยกสาเหตุของเลือดออกผิดปกติจากโพรงมดลูกด้วยสาเหตุอื่นออกไปก่อน แล้วจึงทำการตรวจเพื่อวินิจฉัยเพิ่มเติม โดยมีแนวทางดังนี้
1) การเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ (endometrial sampling) เป็นวิธีการหลักในการวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัว โดยการเก็บตัวอย่างเยื่อบุโพรงมดลูกจะใช้อุปกรณ์ขนาดเล็ก (รูปที่ 1) ใส่เข้าไปในโพรงมดลูกเพื่อดูดเอาเยื่อบุโพรงมดลูกส่งตรวจ วิธีการนี้มีข้อดี คือ ค่าใช้จ่ายไม่สูง, สามารถทำได้ง่ายและมีความไว (sensitivity) ในการวินิจฉัยโรคสูง โดยความไวในการวินิจฉัยภาวะเยื่อบุมดลูกหนาตัวสูงถึงร้อยละ 81 และความไวในการวินิจฉัยมะเร็งเยื่อบุโพรงมดลูกในสตรีวัยเจริญพันธุ์และในหญิงวัยหมดประจำเดือนสูงถึงร้อยละ 91 และ 99.6 ตามลำดับ อย่างไรก็เก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจนั้นมักจะสุ่มได้ชิ้นเนื้อเพียงร้อยละ 50 ของโพรงมดลูกเท่านั้น หากในรายที่ยังไม่ได้รับการวินิจฉัยหรือได้ชิ้นเนื้อไม่เพียงพอและยังสงสัยว่าจะมีพยาธิสภาพที่เยื่อบุโพรงมดลูกให้พิจารณาเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจซ้ำหรือทำการขูดมดลูก (dilatation and curettage) เพิ่มเติม หรืออาจจะทำการตรวจด้วยการส่องกล้องตรวจโพรงมดลูกเพื่อวินิจฉัย (diagnostic hysteroscopy) และตัดชิ้นเนื้อโดยตรงร่วมกับการขูดมดลูกเพื่อนำชิ้นเนื้อส่งตรวจเพิ่มเติม (3)

รูปที่ 1 แสดงตัวอย่างอุปกรณ์ที่ใช้ในการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ
ที่มา Hong Kong College of Obstetricians and Gynaecologists guideline on investigations of premenopausal women with abnormal uterine bleeding. Hong Kong medical journal. 2020;26(6):520-5
2) การตรวจด้วยคลื่นความถี่สูงทางช่องคลอด (transvaginal ultrasonography) เพื่อแยกพยาธิสภาพที่ทำให้มีเลือดออกผิดปกติจากโพรงมดลูกจากสาเหตุอื่นออกไปก่อน หากไม่พบว่ามีพยาธิสภาพใด ๆ การวัดความหนาของเยื่อบุโพรงมดลูกก็สามารถใช้ตรวจประเมินเป็นลำดับแรกในสตรีวัยหมดระดูที่มีเลือดออกผิดปกติจากโพรงมดลูกได้ อย่างไรก็ตามการตรวจนี้มีเกณฑ์สำหรับมะเร็งเยื่อบุโพรงมดลูกแต่ไม่มีเกณฑ์จำเพาะสำหรับภาวะเยื่อบุโพรงมดลูกหนาตัว โดยถ้าตรวจพบว่าเยื่อบุโพรงมดลูกมีความหนาน้อยกว่าหรือเท่ากับ 4 มิลลิเมตรจะมีค่าทำนายผลลบถูกต้อง (negative predictive value) สำหรับมะเร็งเยื่อบุโพรงมดลูกสูงมากกว่าร้อยละ 99 อย่างไรก็ตามในผู้ป่วยที่มีความเสี่ยงร่วมอื่น ๆ หรือยังคงมีเลือดออกอย่างต่อเนื่อง หรือเป็นซ้ำควรได้รับการตรวจเพิ่มเติมด้วยการเก็บชิ้นเนื้อจากโพรงมดลูกส่งตรวจ(9) นอกจากนี้ในกรณีที่ทำการดูดชิ้นเนื้อโพรงมดลูกส่งตรวจเป็นลำดับแรกและได้ชิ้นเนื้อไม่เพียงพอ การตรวจด้วยคลื่นความถี่สูงทางช่องคลอดยังคงมีประโยชน์ในการใช้ร่วมประเมินความเสี่ยงเพิ่มเติม(triage) ถ้าหากได้ทำการตรวจด้วยคลื่นความถี่สูงทางช่องคลอดแล้วพบว่าเยื่อบุโพรงมดลูกบางโอกาสที่ผู้ป่วยจะเป็นมะเร็งเยื่อบุโพรงมดลูกไม่มากนัก(10) ดังนั้นสามารถหลีกเลี่ยงการตรวจวินิจฉัยด้วยวิธีอื่น ๆ เพิ่มเติมในผู้ป่วยกลุ่มนี้
รูปที่ 2 แสดงการวัดความหนาของเยื่อบุโพรงมดลูกจากการตรวจด้วยคลื่นความถี่สูงทางช่องคลอด โดยการวัดความหนาของเยื่อโพรงมดลูกในแนว anterior-posterior ในส่วนที่หนาที่สุดจากภาพถ่าย long-axis transvaginal view ของมดลูก
ที่มา: ACOG Committee Opinion No. 734: The Role of Transvaginal Ultrasonography in Evaluating the Endometrium of Women With Postmenopausal Bleeding. Obstetrics and gynecology. 2018;131:e124-e9.
3) การขูดมดลูก (dilatation and curettage) วิธีนี้มีประสิทธิภาพในการวินิจฉัยภาวะเทียบเท่ากับการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ สามารถใช้เป็นทางเลือกในการวินิจฉัยและวิธีนี้ยังมีประสิทธิภาพดีกว่าในการวินิจฉัยมะเร็งเยื่อบุโพรงมดลูก ซึ่งมักจะพบร่วมด้วยได้สูงถึงร้อยละ 37 ในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิด complex atypical hyperplasia(11) ซึ่งเหมาะที่จะใช้ในการตรวจเพิ่มเติมก่อนที่จะให้การรักษาในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิด atypical endometrial hyperplasia ที่ยังต้องการมีบุตรหรือไม่ต้องการตัดมดลูกออก นอกจากนี้การขูดมดลูกยังมีข้อบ่งชี้ในผู้ป่วยที่ไม่สามารถทนต่อการทำ office endometrial sampling ได้เพราะความเจ็บปวดหรือวิตกกังวล หรือในกรณีที่ผู้ป่วยมีภาวะปากมดลูกตีบและจำเป็นต้องถ่างขยายปากมดลูก หรือในรายที่เนื้อเยื่อไม่เพียงพอต่อการตรวจทางพยาธิวิทยาดังที่ได้กล่าวไปข้างต้น
4) การส่องกล้องโพรงมดลูกเพื่อวินิจฉัย (diagnostic hysteroscopy) ร่วมกับการตัดชิ้นเนื้อส่งตรวจ ถือเป็นวิธีทางเลือกนอกเหนือจากการขูดมดลูกด้วยข้อบ่งชี้ดังที่ได้กล่าวไปข้างต้น ข้อดีของวิธีนี้คือสามารถมองเห็นและสามารถเลือกตัดชิ้นเนื้อในโพรงมดลูกจากบริเวณที่สงสัยว่าจะมีพยาธิสภาพได้โดยตรง และยังช่วยในการวินิจฉัยพยาธิสภาพอื่น ๆ ที่เป็นสาเหตุของเลือดออกผิดปกติจากโพรงมดลูกที่ไม่ได้รับการวินิจฉัยด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจตั้งแต่แรก เช่น ติ่งเนื้อของเยื่อบุโพรงมดลูก (endometrial polyp) เป็นต้น(3)
การรักษาภาวะเยื่อบุโพรงมดลูกหนาตัว
ข้อพิจารณาในการเลือกวิธีการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวนั้นขึ้นอยู่กับปัจจัยหลัก 2 ประการ คือ ชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวและความต้องการในการธำรงภาวะการเจริญพันธุ์ของผู้ป่วย โดยแนวทางในการดูแลรักษาสตรีที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวได้แสดงไว้ในแผนภูมิของรูปที่ 3 ทั้งนี้รายละเอียดของการดูแลรักษาในแต่ละวิธีมีดังนี้
1) การสังเกตอาการ (expectant management)
การสังเกตอาการโดยที่ไม่ต้องให้การรักษาเพิ่มเติมสามารถทำได้ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) ที่อยู่ในวัยเจริญพันธุ์ที่มีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำและต้องมีรอบเดือนมาสม่ำเสมอ ในผู้ป่วยกลุ่มนี้หากไม่มีอาการเลือดออกผิดปกติจากโพรงมดลูกก็ไม่จำเป็นต้องตรวจติดตามด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ(12) และเมื่อตรวจติดตามในผู้ป่วยกลุ่มนี้พบว่าภาวะเยื่อบุโพรงมดลูกหนาตัวสามารถหายได้เองร้อยละ 75-100(3)
2) การให้ยาฮอร์โมนกลุ่มโปรเจสติน (progestin therapy)
การให้ยาฮอร์โมนกลุ่มโปรเจสตินเป็นวิธีการรักษาที่มีประสิทธิภาพในการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ โดยรูปแบบของยาฮอร์โมน, ช่องทางการให้ยาและวิธีการบริหารยามีความหลากหลายดังแสดงรายละเอียดในตารางที่ 2 ทั้งนี้การให้ยาฮอร์โมนกลุ่มโปรเจสติน มีข้อห้ามในกลุ่มผู้ป่วยที่เป็นโรคหลอดเลือดผิดปกติหรือโรคหลอดเลือดสมอง, โรคตับ, เป็นมะเร็งเต้านมชนิดที่ตรวจพบ progesterone receptor, มีเลือดออกจากช่องคลอดผิดปกติไม่ทราบสาเหตุ, ต้องการมีบุตร หรือแพ้ยาฮอร์โมนกลุ่มโปรเจสติน สำหรับยาฮอร์โมนกลุ่มโปรเจสตินสามารถใช้เพื่อวัตถุประสงค์หลัก 2 ประการ คือ
- ให้เพื่อการรักษา (treatment) โดยการให้ยาฮอร์โมนกลุ่มโปรเจสตินเป็นระยะเวลา 3-6 เดือน และติดตามผลการตอบสนองต่อการรักษาด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ
- ให้เพื่อป้องกันการกลับเป็นซ้ำ (maintenance) หลังจากให้การรักษาจนครบแล้วติดตามการรักษาด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจและพบว่าผลปกติแล้ว จึงพิจารณาให้ยาฮอร์โมนกลุ่มโปรเจสตินต่อในกลุ่มผู้ป่วยที่มีความเสี่ยงสูงและยังมีรอบเดือนที่ผิดปกติ โดยมีระยะเวลาให้ยาต่อเนื่องอีก 1-2 ปี
ตารางที่ 2 การให้ยาฮอร์โมนกลุ่มโปรเจสติน (progestin therapy) เพื่อรักษาภาวะเยื่อบุโพรงมดลูกหนาตัว
|
ชนิดยาฮอร์โมน |
ขนาดยาและการบริหารยา |
ผลลัพธ์การรักษา อัตราการหาย (ร้อยละ) |
|
Levonorgestrel-Intrauterine device (LNG-IUD) |
52 มิลลิกรัมใน steroid resurvoir ใส่ในโพรงมดลูกนาน 1-5 ปี |
90-100(13, 14) |
|
Medroxyprogesterone acetate |
รับประทานทุกวัน วันละ 10-20 มิลลิกรัม หรือให้เป็นรอบ รอบละ 12-14 วันต่อเดือน |
80-90 |
|
Megestrol acetate |
รับประทานทุกวัน 40-200 มิลลิกรัมต่อวัน |
90.0(15) |
|
Depot medroxyprogesterone |
150 มิลลิกรัม ฉีดเข้ากล้าม ทุก 3 เดือน |
91 |
|
Micronized vaginal progesterone |
ชนิดครีมใส่ในช่องคลอดทุกวัน 45-90 มิลลิกรัม ชนิดเม็ดสอดช่องคลอดทุกวันปริมาณ 100-200 มิลลิกรัม หรือให้เป็นรอบ รอบละ 12-14 วันต่อเดือน |
90.5(16) |
ที่มา : ดัดแปลงจาก Trimble CL, Method M, Leitao M, Lu K, Ioffe O, Hampton M, et al. Management of endometrial precancers. Society of Gynecologic Oncology Clinical Practice Committee. Obstet Gynecol 2012;120:1160–75.
โดยรายละเอียดของยาฮอร์โมนกลุ่มโปรเจสตินแต่ละชนิด มีดังนี้
- Levonorgestrel–Intrauterine devices ( IUD) เช่น Mirena® เป็นห่วงคุมกำเนิดที่ออกฤทธิ์ต่อเยื่อบุโพรงมดลูกโดยตรง โดยจะมีการปล่อยฮอร์โมนออกมา 20 ไมโครกรัมต่อวันและมีระยะเวลาการใช้งานได้ยาวนานถึง 5 ปีนับตั้งแต่เริ่มใส่ จากการศึกษาพบว่ามีประสิทธิภาพสูงกว่ายาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทาน (17) ทำให้ปัจจุบันการรักษาด้วยห่วงคุมกำเนิดชนิดนี้ได้รับการแนะนำเป็นทางเลือกแรกในการรักษาภาวะเยื่อมุมดลูกหนาตัว แต่หากผู้ป่วยปฎิเสธการใส่ห่วงคุมกำเนิด หรือใส่ห่วงคุมกำเนิดไม่ได้จากการที่มีโพรงมดลูกผิดรูปหรือปากมดลูกตีบตัน อาจพิจารณาให้เป็นยาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทานแทน
- Medroxyprogesterone acetate (MPA) การบริหารยาสามารถทำได้ 2 รูปแบบ คือ แบบต่อเนื่อง (continuous) โดยให้รับประทานทุกวัน วันละ 10-20 มิลลิกรัม หรือให้เป็นรอบ (cyclical) รอบละ 12-14 วันต่อเดือน ขนาดยาที่สามารถให้ได้มากที่สุด คือ 100-200 มิลลิกรัมต่อวัน(3) ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) ที่ต้องการรักษาด้วยยากลุ่มฮอร์โมนชนิดรับประทาน แนะนำให้ใช้ยาชนิดนี้เป็นทางเลือกแรก โดยให้รับประทานเป็นระยะเวลานาน 3-6 เดือน ทั้งนี้จากการวิจัยเชิงรักษาแบบสุ่มพบว่าการให้ยา MPA แบบต่อเนื่องจะมีประสิทธิภาพสูงกว่าการให้แบบเป็นรอบ โดยมีอัตราการหาย (regression rate) ร้อยละ 96 ในกลุ่มที่ให้แบบต่อเนื่องและร้อยละ 69 ในกลุ่มที่ให้เป็นรอบ(18)
- Megestrol acetate การบริหารยาให้รับประทานแบบต่อเนื่อง 40-200 มิลลิกรัมต่อวัน ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบมีเซลล์ผิดปกติ (atypical endometrial hyperplasia) ที่ต้องการรักษาด้วยยากลุ่มฮอร์โมนชนิดรับประทาน แนะนำให้ใช้ยาชนิดนี้เป็นทางเลือกแรก โดยแนะนำให้รับประทานเป็นระยะเวลานาน 3-6 เดือน และมีอัตราการหายสูงถึงร้อยละ 90 และไม่พบการกลับเป็นซ้ำ(15)
- Micronized progesterone โดยทั่วไปจะมียาในรูปแบบครีมและเป็นเม็ดสำหรับสอดช่องคลอดการบริหารยาทั้ง 2 รูปแบบให้ใส่หรือสอดช่องคลอดทุกวัน (continuous) โดยชนิดครีมที่มีความเข้มข้นร้อยละ 4 หรือ 8 ให้ใส่ในช่องคลอด 45-90 มิลลิกรัมต่อวัน และชนิดเม็ดให้สอดช่องคลอดปริมาณ 100-200 มิลลิกรัมต่อวัน หรือให้เป็นรอบ (cyclical) รอบละ 12-14 วันต่อเดือน โดยมีการศึกษาพบว่ามีอัตราการหายสูงถึงร้อยละ 80-95 (16, 19) แต่ยังไม่สูงเท่ากับการใช้ห่วงอนามัยชนิดปล่อยฮอร์โมน (Levonorgestrel–Intrauterine devices)(20) อย่างไรก็ตามจำนวนผู้ป่วยในการศึกษายังไม่มากนัก ดังนั้นอาจจะพิจารณาให้การรักษาด้วยความระมัดระวังและติดตามการตอบสนองต่อการรักษาอย่างใกล้ชิด
- Depot medroxyprogesterone (DMPA) เป็นยาฮอร์โมนกลุ่มโปรเจสตินที่ออกฤทธิ์นาน ในบางการศึกษาพบว่าสามารถใช้เป็นทางเลือกรองจากการใช้แบบห่วงคุมกำเนิดได้ และมีการวิจัยเชิงรักษาแบบสุ่มในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) พบว่าการรักษาด้วย DMPA 150 มิลลิกรัมเป็นเวลา 3 เดือน มีประสิทธิภาพสูงกว่าการรักษาด้วย Norethindrone acetate โดยสามารถทำให้เยื่อบุโพรงมดลูกกลับมาเป็นปกติได้สูงถึงร้อยละ 91 เทียบกับร้อยละ 66 (21)
นอกจากนี้เริ่มการศึกษาการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวด้วยยากลุ่มฮอร์โมนโปรเจสตินกลุ่มใหม่ เช่น dienogest พบว่ามีอัตาราการหายสูงถึงร้อยละ 96.9(22) ซึ่งในอนาคตหากมีการศึกษาวิจัยรองรับมากขึ้นอาจใช้เป็นทางเลือกในการรักษาได้
3) การตัดมดลูก (hysterectomy)
การผ่าตัดเอามดลูกออกเป็นการรักษาแบบถาวร โดยแนะนำให้ตัดมดลูกออกทั้งหมด (total hysterectomy) ทั้งนี้การผ่าตัดสามารถทำได้ทั้งแบบเปิดหน้าท้อง, ผ่าตัดผ่านกล้องหรือผ่าตัดทางช่องคลอด โดยวิธีการนี้แนะนำให้เป็นทางเลือกแรกสำหรับผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติหรือผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติแต่เข้าสู่วัยหมดระดูแล้ว และเป็นทางเลือกรองในสตรีวัยเจริญพันธุ์ที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติแต่ไม่ต้องการธำรงค์ภาวะการเจริญพันธุ์ ข้อบ่งชี้อื่น ๆ ในการให้การรักษาด้วยการตัดมดลูก ได้แก่ การรักษาด้วยกลุ่มยาฮอร์โมนไม่สัมฤทธิ์ผลภายในระยะเวลา 12 เดือน, ยังมีอาการเลือดออกผิดปกติอยู่, มีการกลับเป็นซ้ำ, พยาธิสภาพรุนแรงขึ้นภายหลังการรักษา หรือผู้ป่วยปฎิเสธการติดตามอาการ
ทั้งนี้ไม่แนะนำให้ตัดรังไข่ในกลุ่มผู้ป่วยที่อยู่วัยเจริญพันธุ์ หรือทำการเลาะต่อมน้ำเหลือง (lymphadenectomy) รวมถึงการผ่าตัดเพื่อกำหนดระยะโรคเพิ่มเติม เพราะจะเพิ่มความเสี่ยงในการเกิดภาวะแทรกซ้อนจากการผ่าตัดโดยไม่จำเป็น โดยมะเร็งเยื่อบุโพรงมดลูกที่พบร่วมด้วยมักจะมีลักษณะทางพยาธิวิทยาเป็นชนิดไม่รุนแรง (low-grade) อยู่ในระยะเริ่มต้นและมีโอกาสแพร่กระจายไปยังต่อมน้ำเหลืองน้อย แต่หากผลการตรวจทางพยาธิวิทยาเป็นชนิดรุนแรง (high-grade) หรือลุกลามเข้าไปในกล้ามเนื้อมดลูกลึก (deep mypmetrial invasion) สามารถทำการผ่าตัดเพิ่มเติมเพื่อตัดรังไข่และกำหนดระยะของโรคได้ในภายหลัง
นอกจากการให้การดูแลรักษาตามแนวทางในแต่ละวิธีแล้วสิ่งสำคัญที่ต้องทำควบคู่กันไปด้วย คือ การกำจัดปัจจัยเสี่ยงหรือปัจจัยสนับสนุนที่ทำให้เกิดภาวะ “unopposed estrogen” เช่น การช่วยทำให้ไข่ตกในกลุ่มโรคถุงน้ำรังไข่หลายใบ, การลดน้ำหนัก เป็นต้น
แนวทางการรักษาโดยจำแนกตามชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัว
1) ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ
สตรีวัยเจริญพันธุ์
ในกลุ่มผู้ป่วยที่มีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำ และมีรอบเดือนมาสม่ำเสมออาจพิจารณาสังเกตอาการและติดตามการรักษาได้ แต่หากมีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกสูงให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินดังรายละเอียดที่ได้กล่าวไปข้างต้น มีการศึกษาพบว่าค่ามัธยฐานของระยะเวลาที่เยื่อบุโพรงมดลูกจะกลับมาเป็นปกติอยู่ที่ 6 เดือน(23) อย่างไรก็ตามแม้จะยังไม่มีข้อสรุปที่ชัดเจนเกี่ยวกับระยะเวลาที่ต้องให้การรักษาแต่แนะนำให้รักษาต่อเนื่องนานอย่างน้อย 6 เดือน ทั้งนี้ควรเลือกยากลุ่มที่มีประสิทธิภาพในการคุมกำเนิดร่วมด้วย และในสตรีที่ต้องการตั้งครรภ์เมื่อเยื่อบุโพรงมดลูกกลับมาเป็นปกติแต่ยังมีภาวะไข่ไม่ตก (anovulation) ให้พิจารณากระตุ้นให้มีการตกไข่ (ovulation induction) การประเมินการตอบสนองต่อการรักษาแนะนำให้ทำทุก 3-6 เดือนภายหลังการรักษาด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจ โดยองค์กร Royal College of Obstetricians and Gynaecologists (RCOG) ร่วมกับ British Society for Gynaecological Endoscopy (BSGE) แนะนำให้ตรวจติดตามต่อจนครบ 1 ปี แต่ในผู้ป่วยที่มีความเสี่ยงในการกลับเป็นซ้ำสูง เช่น ดัชนีมวลกายมากกว่า 35 กิโลกรัม/ตารางเมตร ให้พิจารณาติดตามด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจปีละครั้ง และให้ยาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทานต่อเนื่อง 1-2 ปี ทั้งนี้ในกลุ่มสตรีวัยเจริญพันธุ์ที่ไม่ต้องการธำรงภาวะการเจริญพันธุ์สามารถแนะนำให้รับการรักษาด้วยการตัดมดลูกในกรณีดังต่อไปนี้
- มีการพัฒนาเป็นเยื่อบุโพรงมดลูกหนาชนิดที่มีเซลล์ผิดปกติในระหว่างการรักษา
- เยื่อบุโพรงมดลูกยังไม่กลับมาปกติภายหลังให้การรักษาเป็นระยะเวลานาน 12 เดือน
- มีการกลับเป็นซ้ำของภาวะเยื่อบุโพรงมดลูกหนาตัวหลังรักษาด้วยฮอร์โมนกลุ่มโปรเจสติน
- มีอาการเลือดออกผิดปกติจากโพรงมดลูกอย่างต่อเนื่อง
- ปฏิเสธการตรวจติดตามด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจหรือการรักษาด้วยยาฮอร์โมนกลุ่มโปรเจสติน
ในกรณีที่ได้รับการรักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินเป็นระยะเวลานาน 6 เดือนและยังพบว่ามีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดที่ไม่มีเซลล์ผิดปกติอยู่ สามารถเพิ่มขนาดยาโปรเจสตินและติดตามซ้ำได้ แต่ถ้าหากเพิ่มขนาดยาแล้วเยื่อบุโพรงมดลูกยังไม่กลับมาเป็นปกติหรือมีความผิดปกติรุนแรงขึ้นอาจพิจารณาตัดมดลูก
สตรีวัยหมดระดู
ให้พิจารณาตัดมดลูกและรังไข่ทั้งสองข้างเป็นทางเลือกแรก แต่หากมีข้อห้ามในการผ่าตัดหรือไม่ต้องการผ่าตัดให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินและติดตามการรักษาเช่นเดียวกับสตรีวัยเจริญพันธุ์(3)
2) ภาวะเยื่อบุโพรงมดลูกหนาตัว แบบมีเซลล์ผิดปกติ
แนวทางในการดูแลรักษาสตรีที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้มีวัตถุประสงค์สำคัญ คือ การวินิจฉัยให้ได้ว่ามีรอยโรคที่พัฒนาไปเป็นมะเร็งเยื่อบุโพรงมดลูกร่วมด้วยหรือไม่ และให้การรักษาเพื่อป้องกันไม่ให้พัฒนาไปเป็นมะเร็งเยื่อบุโพรงมดลูกในอนาคต ผู้เชี่ยวชาญบางท่านหรือบางองค์กรแนะนำให้มีการขูดมดลูกหรือส่องกล้องโพรงมดลูกเพิ่มเติม(10) อย่างไรก็ตามยังมีโอกาสที่หลังจากที่ได้ทำการผ่าตัดเรียบร้อยแล้วจะได้รับการวินิจฉัยว่าเป็นมะเร็งเยื่อบุโพรงมดลูกจากผลการตรวจทางพยาธิวิทยาในภายหลัง ทั้งนี้แนวทางการผ่าตัดในผู้ป่วยแต่ละกลุ่มมีข้อแนะนำดังนี้(3)
สตรีวัยหมดระดู
แนะนำให้ตัดมดลูกและรังไข่ออกทั้งสองข้าง
สตรีวัยหมดระดูที่มีข้อห้ามในการผ่าตัด หรือ สตรีวัยเจริญพันธุ์ที่ต้องการธำรงภาวะการเจริญพันธุ์
ให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินเป็นทางเลือกแรก ภายหลังจากที่ให้ข้อมูลและคำปรึกษาแก่ผู้ป่วย ทั้งนี้ผู้ป่วยต้องทราบถึงโอกาสที่จะประสบความสำเร็จจากการรักษาและยอมรับความเสี่ยงต่าง ๆ ที่อาจจะเกิดขึ้น อาทิ เช่น เป็นมะเร็งเยื่อบุโพรงมดลูกในระยะที่สูงกว่าระยะที่ 1 ร้อยละ 2, พบมะเร็งรังไข่ร่วมด้วยร้อยละ 4, โอกาสเสียชีวิตร้อยละ 0.5 เป็นต้น
หลังจากนั้นให้ติดตามผลการรักษาด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจในอีก 3 เดือน ถ้ายังพบว่ามีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติอยู่ ให้พิจารณาเพิ่มขนาดยาและตรวจติดตามซ้ำในอีก 3 เดือนถัดไป หากยังไม่ตอบสนองต่อการรักษาให้พิจารณาตัดมดลูก แต่ถ้าผลการตรวจพบว่าเยื่อบุโพรงมดลูกกลับมาเป็นปกติให้ตรวจติดตามต่อทุก 3 เดือน และถ้าผลการตรวจปกติ 2 ครั้งติดต่อกันให้เลื่อนระยะเวลาการตรวจติดตามเป็นทุก 6 เดือนจนครบ 2 ปี หลังจากนั้นควรตรวจติดตามทุกปี และถ้าหากยังไม่มีแผนจะมีบุตรในระยะเวลาอันใกล้ให้ใช้ยาฮอร์โมนกลุ่มโปรเจสตินต่ออย่างต่อเนื่องเป็นระยะเวลาอย่างน้อย 1-2 ปี แต่ในกรณีที่ต้องการมีบุตรทันทีภายหลังจากสิ้นสุดการรักษาก็สามารถที่จะหยุดยาได้ และเมื่อมีบุตรเพียงพอแล้วให้พิจารณาตัดมดลูกและรังไข่ทั้งสองข้างในภายหลัง
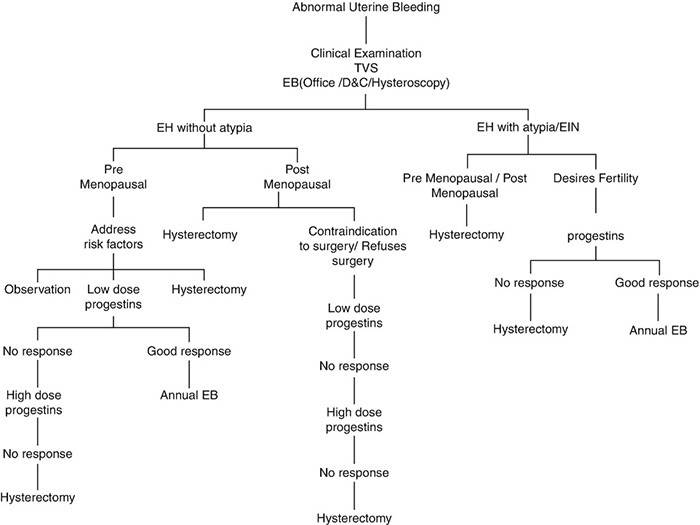
รูปที่ 3 แผนภูมิแสดงแนวทางการรักษาภาวะเยื่อบุมดลูกหนาตัวผิดปกติ
ที่มา ปรับปรุงจากTherapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016
สรุป
ภาวะเยื่อบุโพรงมดลูกหนาตัวถูกจำแนกเป็นชนิดที่มีเซลล์ผิดปกติและชนิดที่ไม่มีเซลล์ผิดปกติ โดยข้อพิจารณาในการเลือกวิธีการรักษานั้นขึ้นอยู่กับปัจจัยหลัก 2 ประการ คือ ชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวและความต้องการในการธำรงภาวะการเจริญพันธุ์ของผู้ป่วย ทั้งนี้การดูแลรักษามีเป้าหมายเพื่อแก้ไขภาวะเลือดออกผิดปกติจากโพรงมดลูกและป้องกันการพัฒนากลายเป็นมะเร็งเยื่อบุโพรงมดลูกในอนาคต โดยแพทย์ผู้ดูแลควรทราบพยาธิกำเนิด พยากรณ์โรค และแนวทางการรักษา เพื่อที่จะให้การดูแลผู้ป่วยได้อย่างถูกต้องและเหมาะสม
เอกสารอ้างอิง
- Sanderson PA, Critchley HO, Williams AR, Arends MJ, Saunders PT. New concepts for an old problem: the diagnosis of endometrial hyperplasia. Hum Reprod Update. 2017;23:232-54.
- Sobczuk K, Sobczuk A. New classification system of endometrial hyperplasia WHO 2014 and its clinical implications. Prz Menopauzalny. 2017;16:107-11.
- Auclair M-H, Yong PJ, Salvador S, Thurston J, Colgan TJ, Sebastianelli A. Guideline No. 390-Classification and Management of Endometrial Hyperplasia. Journal of Obstetrics and Gynaecology Canada. 2019;41:1789-800.
- ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstetrics and gynecology. 2005;106:413-25.
- Amant F, Mirza MR, Koskas M, Creutzberg CL. Cancer of the corpus uteri. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. 2018;143 Suppl 2:37-50.
- Schorge JO, Hossein Saboorian M, Hynan L, Ashfaq R. ThinPrep detection of cervical and endometrial adenocarcinoma: a retrospective cohort study. Cancer. 2002;96:338-43.
- Practice bulletin no. 128: diagnosis of abnormal uterine bleeding in reproductive-aged women. Obstetrics and gynecology. 2012;120:197-206.
- Wise MR, Gill P, Lensen S, Thompson JM, Farquhar CM. Body mass index trumps age in decision for endometrial biopsy: cohort study of symptomatic premenopausal women. American journal of obstetrics and gynecology. 2016;215:598.e1-.e8.
- ACOG Committee Opinion No. 734: The Role of Transvaginal Ultrasonography in Evaluating the Endometrium of Women With Postmenopausal Bleeding. Obstetrics and gynecology. 2018;131:e124-e9.
- Bakour SH, Khan KS, Gupta JK. Controlled analysis of factors associated with insufficient sample on outpatient endometrial biopsy. Bjog. 2000;107:1312-4.
- Rakha E, Wong SC, Soomro I, et al. Clinical outcome of atypical endometrial hyperplasia diagnosed on an endometrial biopsy: institutional experience and review of literature. Am J Surg Pathol. 2012;36:1683-90.
- Reed SD, Voigt LF, Newton KM, et al. Progestin therapy of complex endometrial hyperplasia with and without atypia. Obstetrics and gynecology. 2009;113:655-62.
- Gallos ID, Shehmar M, Thangaratinam S, Papapostolou TK, Coomarasamy A, Gupta JK. Oral progestogens vs levonorgestrel-releasing intrauterine system for endometrial hyperplasia: a systematic review and metaanalysis. Am J Obstet Gynecol. 2010;203:547.e1-10.
- Luo L, Luo B, Zheng Y, Zhang H, Li J, Sidell N. Oral and intrauterine progestogens for atypical endometrial hyperplasia. Cochrane Database Syst Rev. 2018;12:Cd009458.
- Gal D, Edman CD, Vellios F, Forney JP. Long-term effect of megestrol acetate in the treatment of endometrial hyperplasia. Am J Obstet Gynecol. 1983;146:316-22.
- Affinito P, Di Carlo C, Di Mauro P, Napolitano V, Nappi C. Endometrial hyperplasia: efficacy of a new treatment with a vaginal cream containing natural micronized progesterone. Maturitas. 1994;20:191-8.
- Perino A, Quartararo P, Catinella E, Genova G, Cittadini E. Treatment of endometrial hyperplasia with levonorgestrel releasing intrauterine devices. Acta Europaea fertilitatis. 1987;18:137-40.
- Orbo A, Vereide A, Arnes M, Pettersen I, Straume B. Levonorgestrel-impregnated intrauterine device as treatment for endometrial hyperplasia: a national multicentre randomised trial. Bjog. 2014;121:477-86.
- Marra C, Penati C, Ferrari L, Cantù MG, Bargossi L, Fruscio R. Treatment of simple and complex endometrial non-atypical hyperplasia with natural progesterone: response rate to different doses. Gynecol Endocrinol. 2014;30:899-901.
- Tasci Y, Polat OG, Ozdogan S, Karcaaltincaba D, Seckin L, Erkaya S. Comparison of the efficacy of micronized progesterone and lynestrenol in treatment of simple endometrial hyperplasia without atypia. Arch Gynecol Obstet. 2014;290:83-6.
- Nooh AM, Abdeldayem HM, Girbash EF, Arafa EM, Atwa K, Abdel-Raouf SM. Depo-Provera Versus Norethisterone Acetate in Management of Endometrial Hyperplasia Without Atypia. Reproductive sciences (Thousand Oaks, Calif). 2016;23:448-54.
- Uysal G, Acmaz G, Madendag Y, et al. The Efficacy of Dienogest in the Treatment of Simple Endometrial Hyperplasia without Atypia. Gynecol Obstet Invest. 2018;83:151-5.
- Gunderson CC, Fader AN, Carson KA, Bristow RE. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: a systematic review. Gynecol Oncol. 2012;125:477-82.
- Lee JHS, Cheng EOL, Choi KM, Ngu SF, Cheung RYK. 2020 Hong Kong College of Obstetricians and Gynaecologists guideline on investigations of premenopausal women with abnormal uterine bleeding. Hong Kong medical journal = Xianggang yi xue za zhi. 2020;26(6):520-5.
- Chandra V, Kim JJ, Benbrook DM, Dwivedi A, Rai R. Therapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016;27(1).


