Hereditary Cancer Syndromes and Risk Assessment
กลุ่มอาการมะเร็งทางพันธุกรรมและการประเมินความเสี่ยง
พญ. อัญญาวีร์ อภิโชติธิวัฒน์
อ.นพ. มนัสวี มะโนปัญญา
บทนำ
กลุ่มอาการมะเร็งทางพันธุกรรมเป็นกลุ่มอาการที่มีความบกพร่องทางพันธุกรรมแล้วก่อให้เกิดมะเร็งบางชนิด ผู้ป่วยมักเริ่มมีอาการแสดงตั้งแต่อายุน้อยเมื่อเทียบกับผู้ป่วยที่ไม่ได้เกิดจากความบกพร่องทางพันธุกรรม สาเหตุเกิดจากกลายพันธุ์ของยีนส์ทำให้มีการแบ่งตัวของเซลล์ที่ผิดปกติและก่อให้เกิดมะเร็งของหลายๆ อวัยวะตามมา มะเร็งทางนรีเวช เช่น มะเร็งเยื่อบุโพรงมดลูกร้อยละ 3-5 และมะเร็งรังไข่ร้อยละ 8-13 เกิดจากควาบกพร่องทางพันธุกรรม(1) ซึ่งมะเร็งเหล่านี้พบได้ในหลายกลุ่มโรคดังแสดงรายละเอียดในตารางที่ 1 และการถ่ายทอดทางพันธุกรรมนี้มักมีถ่ายทอดในรูปแบบยีนส์เด่น
ตารางที่ 1 แสดงลักษณะการแสดงออกของกลุ่มโรคที่สัมพันธ์กับมะเร็งเต้านมและรังไข่ที่มา : ดัดแปลงจาก(2)
{tabulizer:style[gr.alterora.elemental_1_blue_violet.css]}
|
กลุ่มอาการ |
มะเร็งเต้านม |
มะเร็งรังไข่ |
มะเร็งเยื่อบุโพรงมดลูก |
มะเร็งลำไส้ |
มะเร็งอื่นๆ |
|
HBOC |
x |
x |
|
|
|
|
Lynch |
x |
x |
x |
กระเพาะอาหาร,ทางเดินปัสสาวะ,ทางเดินน้ำดี, ตับอ่อน, glioblastoma |
|
|
Li-Fraumeni |
x |
|
|
|
กล้ามเนื้อ, กระดูก, สมอง, ต่อมหมวกไต |
|
Cowden |
x |
|
x |
x |
ไทรอยด์, benign harmatoma |
|
Peutz-Jeghers |
x |
x |
|
x
harmatoma |
ปากมดลุก, ตับอ่อน, กระเพราะอาหาร |
การประเมินกลุ่มเสี่ยง
ในสตรีที่สงสัยว่าอาจจะเป็นกลุ่มอาการมะเร็งทางพันธุกรรม ควรเริ่มต้นด้วยการประเมินเบื้องต้นว่าอยู่ในกลุ่มเสี่ยงหรือไม่ดยการซักประวัติส่วนตัวและประวัติมะเร็งในครอบครัว รวมถึงประวัติและหลักฐานทางการแพทย์ต่างๆ หากพบว่าเข้าเกณฑ์กลุ่มเสี่ยงดังแสดงรายละเอียดในตารางที่ 2 ให้ส่งตรวจทางพันธุกรรมเพิ่มเติมเพื่อค้นหาว่ามีการกลายพันธุ์ของยีนส์ที่ก่อให้เกิดมะเร็งหรือไม่ ในสตรีที่ยังไม่เป็นมะเร็งจะได้ทำการตรวจคัดกรองเพื่อป้องกันก่อนที่จะเกิดมะเร็ง แต่ถ้าหากเป็นมะเร็งแล้วจะได้ทำการตรวจคัดกรองและป้องกันมะเร็งที่อาจจะเกิดในอวัยวะอื่น นอกจากนี้ยังมีประโยชน์ต่อญาติใกล้ชิดที่อาจจะมีความบกพร่องทางพันธุกรรมแบบเดียวกัน
ตารางที่ 2 แสดงเกณฑ์การส่งตรวจและประเมินความเสี่ยงทางพันธุกรรม[1] (1)

หลักการประเมินความเสี่ยงและให้คำปรึกษาทางพันธุกรรม
การประเมินความเสี่ยงกลุ่มอาการมะเร็งพันธุกรรม เกี่ยวข้องกับการวิเคราะห์พงศาวลีครอบครัว เพื่อประเมินว่าภายในครอบครัวมีลักษณะการเกิดของโรคมะเร็งเป็นแบบอุบัติใหม่หรือมีการถ่ายทอดทางพันธุกรรมมาจากรุ่นก่อน การประเมินความเสี่ยงยังหมายรวมถึงความเสี่ยงของปัจเจกบุคคลที่อาจเป็นปัจจัยส่งเสริมหรือเป็นสาเหตุหลักที่ทำให้เกิดมะเร็งได้ ซึ่งพงศาวลีครอบครัวควรมีการปรับปรุงให้ทันเหตุการณ์อยู่เสมอหากมีข้อมูลเพิ่มเติม เช่น การวินิจฉัยโรคในสมาชิกรายอื่นของครอบครัว เป็นต้น
โดยการซักประวัติมะเร็งในครอบครัวควรประกอบด้วยข้อมูลในประเด็นต่างๆ ดังนี้
- ญาติลำดับที่ 1: พี่น้อง, ลูก, พ่อแม่
- ญาติลำดับที่ 2 : ปู่ย่าตายาย ลุงป้าน้าอา หลาน ลูกพี่ลูกน้อง พี่น้องต่างมารดา/บิดา
- ญาติทางมารดา หรือ บิดา
- เชื้อสาย European Jews
- ในรายที่เป็นมะเร็ง ควรทราบอายุที่ได้รับการวินิจฉัย, ชนิดของมะเร็ง
- ผลการตรวจมะเร็งทางพันธุกรรมของญาติคนอื่นๆที่เคยได้รับการตรวจ
การให้คำปรึกษาทางพันธุกรรมเป็นส่วนประกอบที่สำคัญของกระบวนการประเมินความเสี่ยงโรคมะเร็ง ควรให้คำปรึกษาและทำความเข้าใจกับผู้ป่วยก่อนที่จะทำการส่งตรวจทางพันธุกรรมเพิ่มเติม โดยครอบคลุมประเด็นดังต่อไปนี้
- วิธีการตรวจและค่าใช้จ่ายในการตรวจ
- ผลการตรวจและการแปลผล
- ทางเลือกในการดูแลหากพบว่าผู้ป่วยมีความบกพร่องทางพันธุกรรมที่อาจก่อให้เกิดมะเร็งทางพันธุกรรม เช่น การตรวจติดตาม การให้ยาป้องกัน การผ่าตัดลดความเสี่ยง
กลุ่มอาการมะเร็งทางพันธุกรรมที่ก่อให้เกิดมะเร็งทางนรีเวช
1. Hereditary Breast/Ovarian Cancer Syndrome (HBOC)
การกลายพันธุ์ของยีนส์ BRCA1 และ BRAC2 ในกลุ่มอาการ HBOC เป็นสาเหตุของการเกิดมะเร็งประมาณร้อยละ 10 ของผู้ป่วยมะเร็งรังไข่ และเป็นสาเหตุของการเกิดมะเร็งร้อยละ 3 ถึง 5 ของผู้ป่วยมะเร็งเต้านม โดย BRCA1/BRCA2 เป็น tumor suppressor gene ที่ทำหน้าที่ถอดรหัสโปรตีนที่ช่วยซ่อมแซม DNA และควบคุม cell-cycle checkpoint ในกรณีที่เกิด DNA damage(4) พบว่ารูปแบบการเปลี่ยนแปลงของสารพันธุกรรม BRCA1/BRCA2 แตกต่างกันได้ถึง 1200 ถึง 1300 แบบ แต่จะก่อให้เกิดโรคหรือไม่นั้นขึ้นกับว่ามีปัจจัยกระตุ้นหรือส่งเสริมอื่นหรือไม่ตามทฤษฎี Two-Hit Hypothesis(5)
ประชากรทั่วไปประมาณ 1 ใน 300 รายถึง 1 ใน 800 รายมีการกลายพันธุ์ของยีนส์ BRCA1 หรือ BRCA2 แต่ในบางกลุ่มประชากรมีพบว่ามีการกลายพันธุ์ได้สูงและมีรูปแบบเฉพาะเช่น เชื้อชาติ Ashkenazi Jew
ยีนส์กลายพันธุ์ของ BRCA1/BRCA2 สามารถถ่ายทอดไปสู่รุ่นลูกได้มาก แต่โอกาสที่จะเกิดมะเร็งของผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA1/BRCA2 มีความแตกต่างกันในแต่ละบุคคลดังแสดงรายละเอียดในตารางที่ 3
ตารางที่ 3 แสดงความเสี่ยงการเกิดมะเร็งเต้านมและรังไข่ที่สัมพันธ์กับการกลายพันธุ์ของ BRCA genes(1)
{tabulizer:style[gr.alterora.elemental_1_blue_violet.css]}
|
BRCA1 |
BRCA2 |
BRCA1/BRCA2 |
|
|
ความเสี่ยงการเกิดมะเร็งรังไข่ |
39-46% |
12-20% |
|
|
ความเสี่ยงของการเกิดมะเร็งเต้านมตลอดชีวิต |
65-74% |
||
|
ความเสี่ยงที่จะเกิดโรคมะเร็งรังไข่ภายใน10 ปีหลังการเกิดมะเร็งเต้านม |
12.7% |
6.8% |
|
|
ความเสี่ยงสะสมสำหรับมะเร็งเต้านมเมื่ออายุ 70 ปี |
57% |
49% |
|
|
ความเสี่ยงสะสมสำหรับมะเร็งรังไข่เมื่ออายุ 70 ปี |
40%, |
18%, |
|
ที่มา : ดัดแปลงจากGenetic/familial high-risk assessment: breast and ovarian, version 2.2015. Journal of the National Comprehensive Cancer Network
มะเร็งรังไข่ชนิดเยื่อบุผิวที่พบในผู้ป่วยกลุ่มอาการ HBOC ส่วนมากเป็นเซลล์ชนิด high-grade Serous adenocarcinoma และมีส่วนน้อยที่เป็นชนิด endometrioid adenocarcinoma หรือ clear cell(7) แต่ไม่มีรายงานการพบเซลล์พบชนิด mucinous adenocarcinoma หรือ low malignancy potential ovarian tumor นอกจากนี้ในกลุ่มผู้ป่วย HBOC มีโอกาสเกิดมะเร็งของท่อนำไข่และมะเร็งเยื่อบุช่องท้องเพิ่มขึ้น(8) ในผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA ร้อยละ 4.5 ถึง 9 เมื่อทำการผ่าตัดรังไข่และท่อนำไข่เพื่อลดความเสี่ยงจะตรวจพบมะเร็งโดยการตรวจทางพยาธิวิทยาโดยที่ยังไม่ปรากฏอาการหรือตรวจพบมะเร็งมาก่อน อย่างไรก็ตามในผู้ป่วยมะเร็งรังไข่ที่เป็น HBOC มีอัตราการรอดชีวิตและตอบสนองต่อการรักษาด้วยยาเคมีบำบัดดีกว่ากลุ่มผู้ป่วยที่ไม่มีการกลายพันธุ์ของยีนส์ BRCA(14) จากการศึกษาพบว่าร้อยละ 16 ถึง 21 ของผู้ป่วยทั่วไปและร้อยละ 9 ของผู้ปวยที่ไม่มีประวัติครอบครัวเป็น HBOC มาก่อนที่ได้รับการวินิจฉัยว่าเป็นมะเร็งรังไข่ชนิด high-grade serous, มะเร็งท่อนำไข่หรือมะเร็งปฐมภูมิของเยื่อบุช่องท้องเมื่อทำการตรวจทางพันธุกรรมพบว่ามีการกลายพันธุ์ยีนส์ BRCA1/BRCA2 ดังนั้นอาจจะมีความจำเป็นในการตรวจหาการกลายพันธุ์ของยีนส์ BRCA1/BRCA2 ในผู้ป่วยทุกรายที่เป็นมะเร็งกลุ่มนี้
การตรวจทางพันธุกรรมจะเริ่มจากบุคคลในครอบครัวที่เป็นมะเร็งรังไข่หรือมะเร็งเต้านมตั้งแต่อายุน้อย โดยตรวจดูการเรียงตัวของ BRCA genes ทั้งหมด เมื่อตรวจพบว่าส่วนไหนมีการกลายพันธุ์จะตรวจหาเฉพาะการกลายพันธุ์บริเวณนั้นในสมาชิกครอบครัวคนอื่นๆ เพื่อประเมินว่ามีโอกาสเป็นกลุ่มอาการมะเร็งทางพันธุกรรมหรือไม่ แต่ในกรณีที่ไม่สามารถเริ่มตรวจจากรายที่เป็นมะเร็งการตรวจทางพันธุกรรมจะมีประโยชน์ในรายที่มีความเสี่ยงสูงตามเกณฑ์ที่แสดงรายละเอียดในตารางที่ 4 หากตรวจพบว่ามีความผิดปกติของยีนส์ผู้ป่วยก็ควรได้รับการดูแลเช่นเดียวกับรายที่เป็น HBOC โดยแนวทางการตรวจคัดกรองกลุ่มอาการ HBOC แสดงรายละเอียดดังแผนภูมิที่ 1
ตารางที่ 4 แสดงเกณฑ์วินิจฉัยในการพิจารณาส่งตรวจหาความผิดปกติของ BRCA genes (3[2] )

แผนภูมิที่ 1 แสดงการประเมินส่งตรวจทางพันธุกรรมและผลลัพธ์ที่ได้(3)
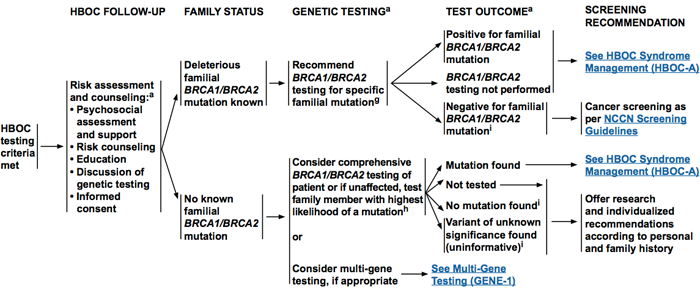
ที่มา : Genetic/familial high-risk assessment: breast and ovarian, version 1.2014. Journal of the National Comprehensive Cancer Network, 12(9), 1326-1338
ข้อแนะนำในการตรวจคัดกรองมะเร็งเต้านมและการผ่าตัดเพื่อลดความเสี่ยง
การตรวจคัดกรองมะเร็งเต้านมให้พิจารณาตามช่วงอายุโดยมีข้อแนะนำดังนี้ (3)
- อายุ 18 ถึง 25 ปี: แนะนำตรวจคลำเต้านมด้วยตนเองทุกเดือนและตรวจโดยแพทย์ปีละ 2 ครั้ง
- อายุ 25 ถึง 29 ปี: ควรได้รับการตรวจ MRI เต้านมหรือ ทำ mammogram ทุก 1 ปี
- อายุ 30 ปีขึ้นไปถึง 75 ปี: ควรตรวจ MRI เต้านมร่วมกับ Mammogram ทุกปี
- อายุเกิน 75 ปี: ให้พิจารณาเป็นรายๆ ไป
จากการศึกษาพบว่าการรับประทานยา Tamoxifen ในกลุ่มผู้ป่วยที่มีการกลายพันธุ์ของยีนส์ BRCA2 จะช่วยลดความเสี่ยงการเป็นมะเร็งเต้านมลงประมาณร้อยละ 62 แต่จะไม่ลดความเสี่ยงในกลุ่มที่มีการกลายพันธุ์ของยีนส์ BRCA1 (9) และจากการศึกษาติดตามผู้ป่วยที่มีความเสี่ยงปานกลางถึงสูงและผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA ที่ได้รับการผ่าตัด bilateral risk-reduction mastectomy (RRM) เป็นเวลา 13 ถึง 14 ปีพบว่าสามารถลดการเกิดมะเร็งเต้านมได้ถึงร้อยละ 90
ข้อแนะนำในการตรวจคัดกรองมะเร็งรังไข่และการผ่าตัดเพื่อลดความเสี่ยง
ปัจจุบันการตรวจคัดกรองมะเร็งรังไข่ยังได้ผลไม่เป็นที่น่าพอใจและพบว่าไม่ช่วยลดอัตราการเสียชีวิต แต่ในสตรีที่ตรวจพบการกลายพันธุ์ของยีนส์อาจจะพิจารณาเริ่มตรวจคัดกรองด้วยการทำ Transvaginal ultrasound เมื่ออายุ 30 ถึง 35 ปีและ/หรือตรวจวัดระดับซีรั่ม CA-125 ขึ้นกับดุลยพินิจแพทย์ผู้ดูแล
จากการศึกษาพบว่าในสตรีทั่วไปที่ใช้ยารับประทานยาคุมกำเนิดเป็นระยะเวลานาน (มากกว่า 3 ถึง 6 ปี) จะช่วยลดโอกาสการเกิดมะเร็งรังไข่เมื่อเทียบกับกลุ่มที่เคยใช้ ดังนั้นผู้เชี่ยวชาญบางท่านจึงแนะนำให้ใช้ยาคุมกำเนิดเพื่อลดความเสี่ยงการเป็นมะเร็งรังไข่ แต่ทั้งนี้การรับประทานยาเม็ดคุมกำเนิดอาจจะเพิ่มความเสี่ยงในการเกิดมะเร็งเต้านมของผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA ได้ นอกจากนี้การมีบุตรหลายคนอาจช่วยลดความเสี่ยงของการเกิดมะเร็งเต้านมได้
มีศึกษาขนาดใหญ่พบว่าการผ่าตัด Risk-reducing salpingo-oophorectomy (RRSO) ในผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA1/BRCA2 จะลดความเสี่ยงของการเกิดมะเร็งทางนรีเวชที่สัมพันธ์กับการกลายพันธุ์ของยีนส์ BRCA1 ได้ถึงร้อยละ 85 เทียบกับกลุ่มที่ไม่ได้รับการผ่าตัด โดยแนะนำให้ทำการผ่าตัดเมื่ออายุ 40 ปีหรือเมื่อมีบุตรตามต้องการแล้ว ในบางการศึกแนะนำให้ผ่าตัดในผู้ที่มีการกลายพันธ์ของยีนส์ BRCA1 ในช่วงอายุที่น้อยกว่า BRCA2 เมื่ออายุครบ 35 และ 40 ปีตามลำดับ
นอกจากนี้ยังพบว่า การผ่าตัด RRSO ยังช่วยลดการเกิดมะเร็งเต้านมในผู้ที่มีการกลายพันธุ์ของยีนส์ BRCA ได้ประมาณร้อยละ 40-70 แต่ต้องทำการผ่าตัดในช่วงวัยก่อนหมดประจำเดือน ทั้งนี้อาจเป็นเพราะระดับฮอร์โมนที่มากระตุ้นเต้านมมีปริมาณลดลงหลังผ่าตัดรังไข่ออกไป และพบว่าการให้ฮอร์โมนทดแทนหลังผ่าตัดรังไข่ไม่ได้เพิ่มโอกาสการเป็นมะเร็งเต้านม
องค์กร National Comprehensive Cancer Network ได้แนะนำให้ผู้ที่ทราบว่ามีการกลายพันธ์ของยีนส์ BRCA1/BRCA2 เข้ารับการผ่าตัด RRSO ในช่วงอายุระหว่าง 35 ถึง 40 ปีที่ไม่ต้องการมีบุตรเพิ่มแล้ว โดยให้ตัดเนื้อเยื่อรังไข่และท่อนำไข่ทั้งหมดออก ขณะทำการผ่าตัดให้ส่งตรวจน้ำล้างเยื่อบุช่องท้อง สำรวจเยื่อบุช่องท้อง และส่งตรวจทางพยาธิวิทยาอย่างละเอียดทุกรายเพื่อตรวจหามะเร็งที่ซ่อนเร้น(3) สำหรับการตัดมดลูกนั้นให้พิจารณาเป็นรายบุคคลเพราะการผ่าตัดเอาท่อนำไข่และรังไข่ออกก็เพียงพอสำหรับลดความเสี่ยงการเกิดมะเร็งและใช้ระยะเวลาในการผ่าตัดและการดูแลหลังผ่าตัดที่สั้นกว่า แต่ในผู้ที่รับประทานยา Tamoxifen การผ่าตัดเอามดลูกออกก็จะช่วยลดการเกิดมะเร็งมดลูกได้
2. Lynch syndromes(Hereditary Nonpolyposis Colorectal Cancer)
Lynch syndrome เป็นสาเหตุที่พบได้มากที่สุดของการเกิดโรคมะเร็งเยื่อบุโพรงมดลูกและมะเร็งลำไส้ใหญ่ ชนิดที่ถ่ายทอดทางกรรมพันธุ์ ส่วนมะเร็งรังไข่พบรองลงมาเป็นอันดับสอง (1) การถ่ายทอดทางพันธุกรรมเป็นแบบ ยีนส์เด่น (autosomal dominant) ที่มีการส่งผ่านได้ดีโดยมีความชุกมากถึง 1 ต่อ 600 ถึง 1 ต่อ 3,000 กลุ่มอาการนี้เกิดจากความผิดปกติของกระบวนการ DNA mismatch repair เนื่องจากไม่สามารถสร้างโปรตีนที่ช่วยในการซ่อมแซม DNA ได้ส่งผลให้เกิดภาวะ genomic instability ทำให้เซลล์ผิดปกติและพัฒนาเป็นมะเร็งตามมา โดยยีนส์ที่เกี่ยวข้องกับ Lynch syndrome ได้แก่ MLH1, MSH2, MSH6 และ PMS2 (10)
ผู้ป่วยที่มาพบแพทย์ด้วยมะเร็งเยื่อบุโพรงมดลูกและมะเร็งลำไส้ใหญ่ตรวจพบว่าเป็นLynch syndrome ร้อยละ 2.3 และร้อยละ 2.2 ตามลำดับ นอกจากนนี้ยังมีมะเร็งอื่นๆ ที่เกี่ยวข้องกับ Lynch syndrome ซึ่งได้แก่ มะเร็งกระเพาะอาหาร มะเร็งลำไส้เล็ก มะเร็งของตับ และทางเดินน้ำดี มะเร็งของกรวยไตและท่อปัสสาวะ มะเร็งเต้านม มะเร็งของสมอง และเนื้องอกของต่อมไขมันที่ผิวหนัง (11) โดยจะตรวจพบในช่วงอายุที่น้อยกว่าผู้ป่วยมะเร็งที่ไม่ได้เกิดจากความบกพร่องทางพันธุกกรม ในผู้ป่วยหญิงอายุน้อยกว่า 50 ปีพบว่าร้อยละ 5 ถึง 9 ของผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกและร้อยละ 5 ถึง 7 ของผู้ป่วยที่เป็นมะเร็งลำไส้ใหญ่จะตรวจพบ mismatch repair geneและในกลุ่มสูงอายุก็ยังพบอุบัติการณ์ของมะเร็งสูงเมื่อเทียบกับประชากรทั่วไป โดยความเสี่ยงของการเกิดมะเร็งขึ้นกับชนิด mismatch repair mutation ในผู้ป่วยรายนั้น ทั้งนี้การช่วงอายุในการเกิดมะเร็งที่แต่ละอวัยวะนั้นแตกต่างกัน โดยการศึกษาแบบย้อนหลังพบว่าผู้ป่วยมะเร็งเยื่อบุโพรงมดลูกมากกว่าครึ่งเกิดมะเร็งลำไส้ใหญ่ตามมาในภายหลังโดยมีช่วงห่างของระยะเวลาเฉลี่ยประมาณ 11 ปีซึ่งอาจจะเป็นโอกาสที่ดีในการตรวจคัดกรองและป้องกันการเกิดมะเร็งชนิดอื่นที่จะเกิดตามมา
มะเร็งเยื่อบุโพรงมดลูกที่สัมพันธ์กับ Lynch syndrome พบได้ในผู้ป่วยที่อายุน้อยกว่าในประชากรทั่วไป (อายุเฉลี่ย 47-49 ปี) เช่นเดียวกับมะเร็งรังไข่ (อายุเฉลี่ย 42–49 ปี) และพบว่าอยู่ในระยะเริ่มต้นมากกว่า นอกจากนี้ยังพบว่าสัดส่วนของเซลล์มะเร็งเป็นชนิด endometrioid และ clear cell มากกว่ามะเร็งรังไข่ที่พบทั่วไปและมีรายงานว่าร้อยละ 22 ของมะเร็งรังไข่ที่พบร่วมกับมะเร็งเยื่อบุโพรงมดลูกมีสาเหตุมาจาก Lynch syndrome
การประเมินความเสี่ยงและความบกพร่องทางพันธุกรรม
มีหลายหลักเกณฑ์ที่ใช้ในการวินิจฉัย Lynch syndrome ที่สามารถใช้ในการระบุ ความเสี่ยงของการเป็น Lynch syndrome ได้แก่ The Amsterdam criteria และ revised Amsterdam criteria แต่มีความไวไม่เพียงพอที่จะนำมาใช้ในเวชปฏิบัติ จึงมีการพัฒนา Bethesda guideline ขึ้นมาซึ่งมีความไวมากขึ้นแต่ความจำเพาะต่ำ เกณฑ์ดังกล่าวใช้สำหรับคัดผู้ป่วยที่ควรได้รับการตรวจ mismatch repair gene system ดังมีรายละเอียดในตารางที่ 5
ตารางที่ 5 Bethesda guideline ที่ใช้ในการประเมินความเสี่ยงของ Lynch syndrome[ดัดแปลงมาจาก (12)] 2004 Bethesda Guideline เพื่อระบุผู้ที่ควรได้รับการตรวจทางพันธุกรรมในโรค Lynch syndromes
- ผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกหรือมะเร็งลำไส้ ก่อนอายุ 50 ปี
- ผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกหรือรังไข่ ร่วมกับมีมะเร็งลำไส้ หรือ มะเร็งที่อาจพบใน Lynch syndrome โดยไม่คำนึงถึงอายุ
- ผู้ป่วยมะเร็งลำไส้ที่ทางพยาธิพบว่ามะเร็งมีการรุกรานของเซลล์ Lympocyte, peritumoral lymphocyte, Crohn-like lymphocytic reaction, Mucinous/signet ring differentiation, medullary growth pattern ที่วินิจฉัยก่อนอายุ 60 ปี
- ผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกหรือมะเร็งลำไส้ ที่มีญาติลำดับที่ 1 เป็นมะเร็งจาก Lynch syndromes และวินิจฉัยก่อนอายุ 50 ปี
- ผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกหรือมะเร็งลำไส้ ที่มีญาติลำดับที่ 1 หรือ 2 มากกว่าเท่ากับ 2 คนเป็นมะเร็งจาก Lynch syndrome โดยไม่คำนึงถึงอายุ
วิธีการตรวจดูว่าระบบ mismatch repair ทำงานผิดปกติหรือไม่นั้น มี 2 วิธี คือ direct germline DNA testing และ tumor testing โดยใช้ immunohistochemistry หรือ microsatellite instability testing โดยการตรวจ direct germline DNA testing จะดู sequence ของ DNA และตรวจหาบริเวณที่มีการจัดเรียง DNA ผิดปกติไปของ mismatch repair genes โดยเริ่มจากนำชิ้นเนื้อที่เป็นมะเร็งไปย้อมพิเศษทาง immunohistochemistry หาก mismatch repair protein มีครบทุกตัวสามารถตัดโรค Lynch syndromes ออกไปได้ แต่หากมีการขาดหายของโปรตีนก็ต้องตรวจ germline DNA ต่อ เพื่อดูว่ามีการกลายพันธุ์ของยีนส์หรือไม่ หากมีการกลายพันธุ์ก็จะวินิจฉัยว่าเป็น Lynch syndromes ดังแผนภูมิที่ 2
แผนภูมิที่ 2 แสดงการตรวจและการแปรผลทางพันธุกรมมในโรค Lynch syndrome(11)
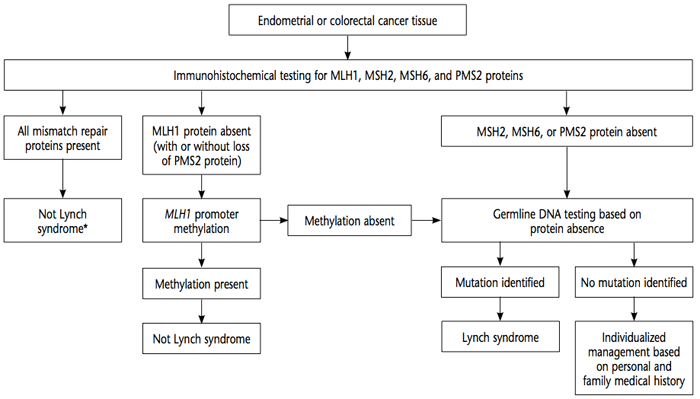
ที่มา : American College of Obstetricians and Gynecologists. (2014). ACOG Practice Bulletin No. 147: Lynch Syndrome. Obstetrics and gynecology, 124(5), 1042
การลดความเสี่ยงในการเกิดมะเร็งเยื่อบุโพรงมดลูกและมะเร็งรังไข่
มะเร็งเยื่อบุโพรงมดลูกที่สัมพันธ์กับ Lynch syndrome อาจเกิดขึ้น 10-15 ปีก่อนอายุเฉลี่ยในประชากร ทั่วไป และมักเกิดขึ้นในช่วงวัยก่อนหมดประจำเดือนในปัจจุบันยังไม่มีวิธีการคัดกรองมะเร็งเยื่อบุมดลูกและมะเร็งรังไข่ที่ประสิทธิภาพและคุ้มค่าแม้จะทำการคัดกรองในกลุ่มความเสี่ยงสูงก็ตามแต่ก็มีข้อแนะนำว่าควรทำการตรวจชิ้นเนื้อจากเยื่อบุโพรงมดลูกทุกๆ 1-2 ปี ตั้งแต่อายุ 30-35 ปีขึ้นไปหรือในรายที่มีประวัติเลือดออกผิดปกติทางช่องคลอด สำหรับมะเร็งรังไข่นั้นยังไม่มีข้อแนะนำเรื่องการคัดกรองในผู้ป่วย Lynch syndrome ที่ชัดเจนการตรวจคัดกรองมะเร็งลำไส้ร่วมกับมะเร็งเยื่อบุโพรงมดลูกโดยการให้ยาสลบชนิดอ่อนก็เป็นที่ยอมรับในผู้ป่วย Lynch syndrome เช่นกัน
มีศึกษาถึงการใช้ยาเม็ดคุมกำเนิดและฮอร์โมนโปรเจสตินเพื่อป้องกันมะเร็งเยื่อบุโพรงมดลูกที่สัมพันธ์กับ Lynch syndrome แต่ยังมีข้อมูลเกี่ยวกับประสิทธิภาพค่อนข้างน้อย
การผ่าตัดเพื่อการป้องกันมะเร็งโดยการตัดมดลูกและรังไข่ทั้งสองข้างออก เป็นทางเลือกในการลดความเสี่ยงการเกิดมะเร็งในผู้หญิงที่เป็น Lynch syndrome ที่ไม่ต้องการมีบุตรแล้ว โดยสามารถอัตราการเกิดมะเร็งเยื่อบุโพรงมดลูกจากร้อยละ 33 เป็นร้อยละ 0 อย่างมีนัยสำคัญ เช่นเดียวกับมะเร็งรังไข่ที่ตรวจติดตามเป็นเวลา 11 ปี มีอัตราการเกิดมะเร็งลดลงเป็นร้อยละ 0 อย่างมีนัยสำคัญเมื่อเทียบกับร้อยละ 5.5 ในกลุ่มที่ไม่ได้รับการผ่าตัด โดยทั่วไปควรพิจารณาทำการผ่าตัดในช่วงอายุ 40 ถึง 45 ปี(13) และก่อนที่จะทำการตัดมดลูกควรทำการตรวจส่องกล้องลำไส้และตรวจตัวอย่างเนื้อเยื่อเยื่อบุโพรงมดลูกก่อน หลังจากตัดมดลูกออกมาแล้วควรทำการเปิดตรวจโพรงมดลูกทุกราย ในกรณีที่ผู้ป่วยต้องการเก็บรังไข่เอาไว้แนะนำให้ตัดท่อนำไข่ทั้งสองข้างออกด้วย
3. Li-Fraumeni Syndrome
เป็นโรคถ่ายทอดทางพันธุกรรมแบบยีนส์เด่นที่พบได้น้อยมาก โดยมีโอกาสเสี่ยงในการเกิดมะเร็งในหลายๆ อวัยวะ ซึ่งได้แก่ มะเร็งกระดูกและเนื้อเยื่อเกี่ยวพัน มะเร็งลำไส้ มะเร็งต่อมหมวกไต มะเร็งเม็ดเลือและต่อมน้ำเหลือง มะเร็งสมองและมะเร็งเต้านมโดยคิดเป็นร้อยละ 1 ของมะเร็งเต้านมที่มีการถ่ายทอดทางพันธุกรรม
เกิดจากการกลายพันธุ์ของเซลล์ต้นกำเนิดตำแหน่ง tumor suppressor gene TP53 ที่ควบคุมวงจรของเซลล์และการสลายตัวเองของเซลล์มีการถ่ายทอดไปสู่รุ่นถัดไปได้มาก และมีความเสี่ยงการเกิดเป็นมะเร็งชนิดต่างๆ ดังที่กล่าวมาสูงถึงร้อยละ 90 เมื่ออายุ 60 ปี
4. Cowden Syndromes
เป็นโรคถ่ายทอดทางพันธุกรรมแบบยีนส์เด่น เกิดจากการกลายพันธุ์ของ PTEN gene ที่ทำหน้าที่ ควบคุมวงจรของเซลล์ เป็นโรคที่พบได้น้อยมาก ประมาณ 1 ใน 200,000 คน ทำให้เกิดเนื้องอกทั้งที่เป็นมะเร็ง และไม่ใช่มะเร็งของหลายอวัยวะ ได้แก่ เต้านม ไทรอยด์ เยื่อบุโพรงมดลูก นอกจากเนื้องอกแล้วจะมีความผิดปกติ ของระบบผิวหนังและเยื่อบุร่างกายได้ เช่น Trichilemmomas, oral papillomas, mucocutaneous neuromas, palmoplantar keratoses, penile pigmentation, lipomas and vascular anomalies โดยความเสี่ยงตลอดชีวิตของการเป็นมะเร็งเต้านมและมะเร็งเยื่อบุโพรงมดลูกอยู่ที่ร้อยละ 25 ถึง 50 และร้อยละ 5 ถึง 10 ตามลำดับ
เอกสารอ้างอิง
- American College of Obstetricians and Gynecologists. (2009). ACOG Practice Bulletin No. 103: Hereditary breast and ovarian cancer syndrome. Obstetrics and gynecology, 113(4), 957.
- American College of Obstetricians and Gynecologists. (2015). ACOG Committee Opinion No. 634: Hereditary cancer syndromes and risk assessment . Obstetrics and gynecology, 125(6), 1538.
- Daly, M. B., Pilarski, R., Axilbund, J. E., Buys, S. S., Crawford, B., Friedman, S., … & Kohlmann, W. (2014). Genetic/familial high-risk assessment: breast and ovarian, version 1.2014. Journal of the National Comprehensive Cancer Network, 12(9), 1326-1338.
- Gudmundsdottir K, Ashworth A. The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability. Oncogene 2006;25:5864–74. (Level III)
- Knudson AG Jr. Mutation and cancer: statistical study of retinoblastoma. Proc Natl Acad Sci U S A 1971;68:820–3. (Level III)
- Whittemore AS, Gong G, Itnyre J. Prevalence and contri- bution of BRCA1 mutations in breast cancer and ovarian cancer: results from three U.S. population-based case- control studies of ovarian cancer. Am J Hum Genet 1997;60:496–504. (Level III)
- Boyd J, Sonoda Y, Federici MG, Bogomolniy F, Rhei E, Maresco DL, et al. Clinicopathologic features of BRCA- linked and sporadic ovarian cancer. JAMA 2000;283: 2260–5. (Level II-3)
- Levine DA, Argenta PA, Yee CJ, Marshall DS, Olvera N, Bogomolniy F, et al. Fallopian tube and primary peri- toneal carcinomas associated with BRCA mutations. J Clin Oncol 2003;21:4222–7. (Level III)
- King MC, Wieand S, Hale K, Lee M, Walsh T, Owens K, et al. Tamoxifen and breast cancer incidence among women with inherited mutations in BRCA1 and BRCA2: National Surgical Adjuvant Breast and Bowel Project (NSABP-P1) Breast Cancer Prevention Trial. National Surgical Adjuvant Breast and Bowel Project. JAMA 2001;286:2251–6. (Level I)
- Kuiper RP, Vissers LE, Venkatachalam R, Bodmer D, Hoenselaar E, Goossens M, et al. Recurrence and vari- ability of germline EPCAM deletions in Lynch syndrome. Hum Mutat 2011;32:407–14. (Level II-3) [PubMed]^
- American College of Obstetricians and Gynecologists. (2014). ACOG Practice Bulletin No. 147: Lynch Syndrome. Obstetrics and gynecology, 124(5), 1042.
- Umar, A., Boland, C. R., Terdiman, J. P., Syngal, S., de la Chapelle, A., Rüschoff, J., … & Hamilton, S. R. (2004). Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. Journal of the National Cancer Institute, 96(4), 261-268.
- Schmeler KM, Lynch HT, Chen LM, Munsell MF, Soliman PT, Clark MB, et al. Prophylactic surgery to reduce the risk of gynecologic cancers in the Lynch syndrome. N Engl J Med 2006;354:261–9. (Level II-2) [PubMed]
- Alsop K, Fereday S, Meldrum C, et al. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer: a report from the Australian Ovarian Cancer Study Group. J Clin Oncol 2012;30:2654-2663


