ภาวะไม่มีระดู (Primary Amenorrhea)
จัดทำโดย: นพ .พีรเดช บูรณวรฐิติกุล
อาจารย์ที่ปรึกษา: รศ.พญ.ทวิวัน พันธศรี
กระบวนการเกิดประจำเดือนในผู้หญิง
ในกระบวนการพัฒนาสู่วัยหนุ่มสาวของเด็กหญิงนั้นจะเริ่มจาก adrenarche ก่อนเป็นอย่างแรก โดยจะเริ่มที่อายุ 7-8 ปี โดยมาพร้อมๆกับ growth spurt เป็นช่วงที่ต่อมหมวกไตชั้น Zona reticularis มีการผลิต Dehydroepiandrosterone sulfate ( DHEAS ) , Androstenedione, ( ADD ) ซึ่งเป็น adrenal androgen มากขึ้น ต่อมา estrogen ที่มากขึ้นส่งผลให้เริ่มมีการพัฒนาของเต้านมเกิดขึ้น (Thelarche) ตามมาด้วยการเจริญของขนบริเวณหัวหน่าว (Pubarche) หลังจากนั้นถ้ามีปริมาณฮอร์โมน estrogen ที่เหมาะสมทำให้มีการพัฒนาของ endometrium (endometrium proliferation) ส่งผลให้เกิดประจำเดือนครั้งแรก ( Menarche ) โดย menarche จะเกิดหลังช่วงที่เริ่มมี puberty ประมาณ 2-3 ปีโดยประมาณ(1) รูปที่ 1 แสดงลำดับของ pubertal milestones ตามปกติของเด็กผู้หญิง
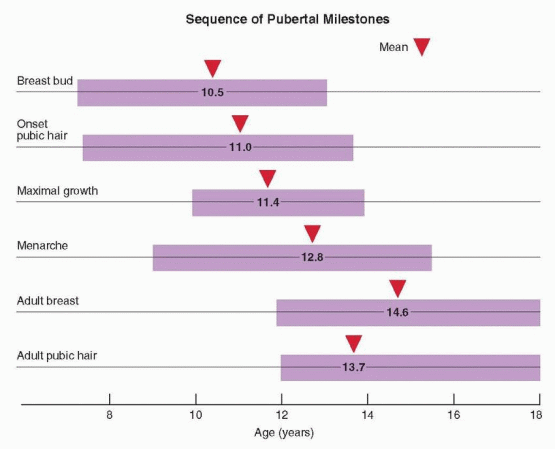
รูปที่ 1 แสดงลำดับ pubertal miles stone ของเพศหญิง
จาก Taylor HS, Fritz MA, Pal L, Seli E. Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition ed. Philadelphia, PA: Wolters Kluwer Philadelphia, PA; 2020.
การเกิดประจำเดือนแบบปกติได้นั้น ประกอบด้วยกลไกลที่ซับซ้อน อาศัยการทำงานของระบบต่างๆหลายอย่าง กล่าวคือ เริ่มจากระบบประสาทส่วนกลางคือ Hypothalamus ต้องสามารถหลั่ง Hormone GnRH ได้ โดยปกติจะหลั่งแบบเป็น Pulsatile หลังจากนั้น GnRH จะไปออกฤทธิ์กระตุ้น anterior Pituitary ส่งผลให้หลั่ง gonadotropin ซึ่งประกอบ FSH, LH ออกมาจาก anterior pituitary หลังจากนั้น Gonadotropin จะไปกระตุ้นรังไข่ให้เกิดการเจริญเติบโตของ follicle ใน ovary (Ovarian Follicle) ส่งผลให้เกิดกระบวนการตกไข่
(ovulation) ตามมา โดยรังไข่ที่ทำงานได้ตามปกตินั้นจะหลั่ง estrogenปริมาณมากก่อนที่จะตกไข่ หลังตกไข่ follicle จะถูกเปลี่ยนเป็น corpus luteum ซึ่งทำหน้าที่หลั่ง progesterone แทนที่ estrogen ในช่วงหลังตกไข่ progesterone จะทำหน้าที่เตรียมพร้อม endometrium ให้เหมาะกับการฝังตัวของตัวอ่อน แต่ถ้าหากไม่มีการตั้งครรภ์เกิดขึ้น ปริมาณ estrogen และ progesterone จะต่ำลงอย่างมากส่งผลให้เกิดการสลายตัวของ endometrium เกิดภาวะ vasoconstriction ของ spiral artery เกิด shedding of endometrium หลุดลอกออกมาเป็นประจำเดือนในแต่ละรอบ โดยประจำเดือนที่เกิดขึ้นนั้นจะออกมาได้ตามปกติต้องอาศัยช่องทางออกที่ปกติด้วย กล่าวคือต้องไม่มีความผิดปกติ อุดตันของช่องทางระบบสืบพันธุ์ (outflow tract) เช่น มดลูก ปากมดลูก ช่องคลอด เยื่อพรหมจรรย์ (Hymen) (1, 2)
ดังนั้นถ้าหากส่วนประกอบส่วนใดเกิดความผิดปกติไป ไม่ว่าจะเป็น Hypothalamus, Pituitary, ovaries, uterus, outflow tract จะส่งผลให้เกิดภาวะประจำเดือนที่มาผิดปกติ รูปที่ 2 นี้แสดงกลไกการทำงานของระบบอวัยวะต่างๆที่ทำงานกันอย่างเป็นระบบทำให้เกิดประจำเดือนตามปกติ (1)
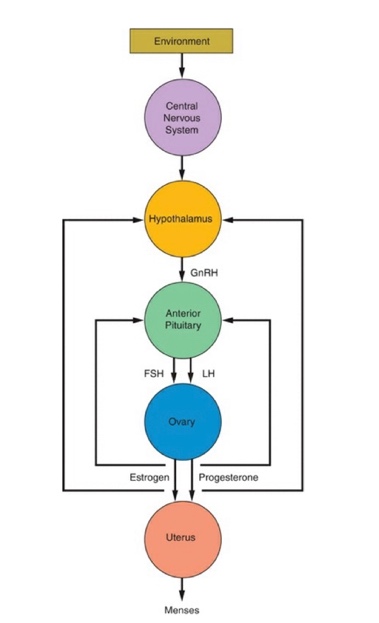
รูปที่ 2 กลไกลทำให้เกิดประจำเดือนตามปกติ ซึ่งอาศัยการทำงานของ hypothalamus, anterior pituitary, Ovary และ uterus
(Taylor HS, Fritz MA, Pal L, Seli E. Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition ed. Philadelphia, PA: Wolters Kluwer Philadelphia, PA; 2020.)
นิยามของภาวะไม่มีระดู (Primary Amenorrhea)
ใน Berek & Novak’s gynecology 16 th edition (2) นิยามภาวะไม่มีระดู ไว้ดังนี้
- ไม่มีประจำเดือนจนถึงอายุ 13 ปี โดยยังไม่มีมีการพัฒนาของ secondary sex characteristic
- ไม่มีประจำเดือนถึงอายุ 15 ปี โดยมีพัฒนาการของ secondary sex characteristic แล้ว
- ส่วนในหนังสือ Speroff’s clinical gynecologic endocrinology and infertility 9 th edition นิยามไว้ดังนี้
- ไม่มีประจำเดือนจนถึงอายุ 14 ปี โดยยังไม่มีมีการพัฒนาของ secondary sex characteristic
- ไม่มีประจำเดือนจนถึงอายุ 16 ปี โดยไม่ต้องคำนึงว่าจะมีการการพัฒนาของ secondary sex characteristic หรือไม่
ซักประวัติและตรวจร่างกายในผู้ป่วยที่มาด้วย Amenorrhea (1)
จะกล่าวโดยรวม รวมถึงภาวะขาดประจำเดือน (secondary amenorrhea) ด้วย
History Taking (1, 3)
- ประวัติประจำเดือน: ประจำเดือนขาดหรือไม่ ประวัติสงสัยโอกาสที่จะตั้งครรภ์
- Cryptomenorrhea symptoms: เป็นกลุ่มอาการที่เกิดจากประจำเดือนที่สร้างออกมานั้นไม่สามารถออกมาทางช่องคลอดตามปกติได้เนื่องจากมีปัญหาการอุดตันของช่องทางภายนอก (outflow tract obstruction) ส่งผลให้มีเกิดการอุดตันของประจำเดือนที่อยู่เหนือต่อจุดอุดตันนั้น อาการที่พบได้เช่น ไม่เคยมีประจำเดือนก่อนหน้านี้ มีปวดท้องน้อยเรื้อรัง อาจคลำได้ก้อนที่บริเวณหน้าท้อง
- Onset of amenorrhea
- ประวัติการทำหัตการขูดมดลูก การผ่าตัด uterine surgery ที่ involved endometrium
- abnormal weight gain / weight loss
- อาการที่บ่งชี้ถึงภาวะ androgen เกิน ( hyperandrogenism ) : เช่น มีสิวมากขึ้น ผิวมัน ขนแบบเพศชายขึ้นตามร่างกาย
- น้ำนมไหลจากเต้านม ( Galactorrhea )
- ภาวะ Psychological stress
- อาการของภาวะ estrogen ต่ำ: hot flush , night sweat อาจบ่งชี้ถึงภาวะ premature ovarian insufficiency
- อาการทางระบบประสาทที่ผิดปกติ : ปวดศีรษะ, ชัก, คลื่นไส้อาเจียน มองเห็นผิดปกติ
- ประวัติการคุมกำเนิดก่อนหน้า
- ยาประจำตัวที่ใช้
Physical Examination (1, 3)
- ส่วนสูง น้ำหนัก ดัชนีมวลกาย ( BMI )
- Sign of hyperthyroidism, hypothyroidism
- Sign of insulin resistance: Acanthosis nigicran
- Sign of hyper androgen: hirsutism, acne, virilization
- Breast exam: milky discharge
- Tanner staging: breast and pubic hair
- Abdomen: suprapubic mass , ovarian mass
- External genitalia / lower genital tract : pubic hair , clitoromegaly , ambiguous genitalia , vaginal patency , cervix
- Atrophic appearance of external genitalia / loss of rugosity of vagina : sign of premature ovarian insufficiency
Approach to Primary Amenorrhea
การ approach primary amenorrhea มีหลากหลายวิธี แต่การ approach ที่ได้รับการนิยมอีกรูปแบบหนึ่งจะแบ่งผู้ป่วยออกเป็น สี่ประเภท จำแนกโดยแยกว่า ผู้ป่วยมีมดลูกหรือไม่ และ มีการพัฒนาของ secondary sex characteristic ปกติหรือไม่ (3)ซึ่งสามารถประเมินได้จากการมีพัฒนาการของเต้านมซึ่งเป็นสัญญานแรกของการมีพัฒนาทางเพศขั้นที่สองที่ปกติ ดังนั้นจะสามารถแบ่งผู้ป่วยออกเป็นสี่กลุ่มได้ดังนี้
- มีพัฒนาการของเต้านมปกติแต่ไม่มีมดลูก
- มีพัฒนาการของเต้านมปกติและมีมดลูก
- ไม่มีพัฒนาการของเต้านมตามปกติแต่มีมดลูก
- ไม่มีพัฒนาการของเต้านมตามปกติและไม่มีมดลูก
ซึ่งการส่งการสืบค้นเพิ่มเติมจะแตกต่างกันไปในผู้ป่วยแต่ละกลุ่ม ผู้ป่วยที่มีพัฒนาการของเต้านมปกติและมีมดลูกตามปกติจะใช้แนวทางสืบค้นเหมือนผู้ป่วยที่มาด้วยภาวะขาดระดู (Secondary Amenorrhea) แต่จำเป็นต้องแยกโรคที่ส่งผลให้มีภาวะ Cryptomenorrhea ออกไปก่อนซึ่งประวัติที่ทำให้สงสัยภาวะนี้เช่น Primary Amenorrhea , cyclic pelvic pain , palpable abdominal mass รูปนี้แสดงแนวทางการ approach ผู้ป่วยที่มาด้วยปัญหา Primary Amenorrhea (1, 3)
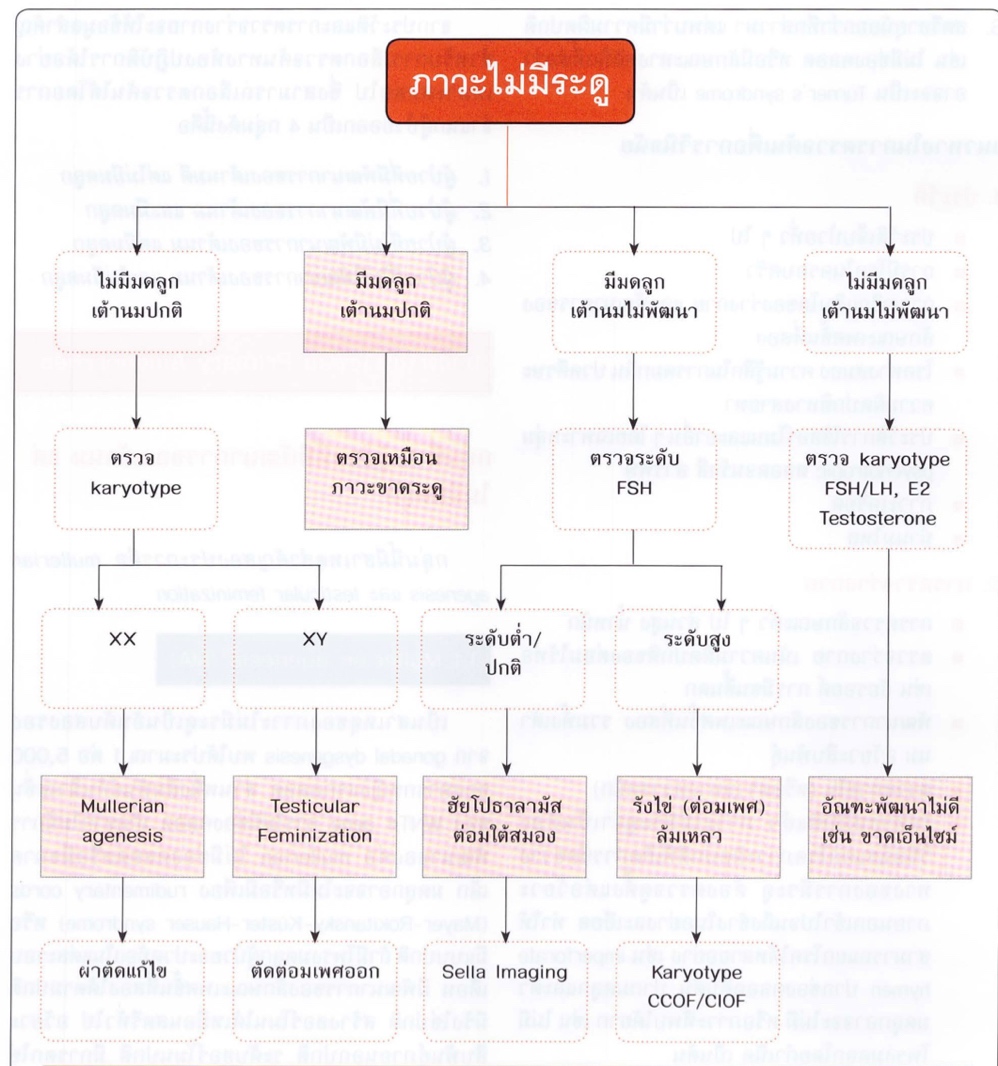
รูปที่ 3 แสดงแนวทางการประเมินสาเหตุของผู้ป่วยที่มาด้วยภาวะไม่มีประจำเดือน
จาก ธีระ ทองสง นรีเวชวิทยา ฉบับสอบบอร์ด เชียงใหม่: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่; 2016.
Cryptomenorrhea
จะสงสัยในผู้ป่วยที่มาด้วย Primary Amenorrhea , cyclic pelvic pain , palpable abdominal mass โดยสาเหตุที่เป็นไปได้ในผู้ป่วยกลุ่มนี้เช่น imperforated hymen , transverse vaginal septum ,vaginal agenesis และ Mullerian agenesis ในบางราย เป็นต้น (3)
-
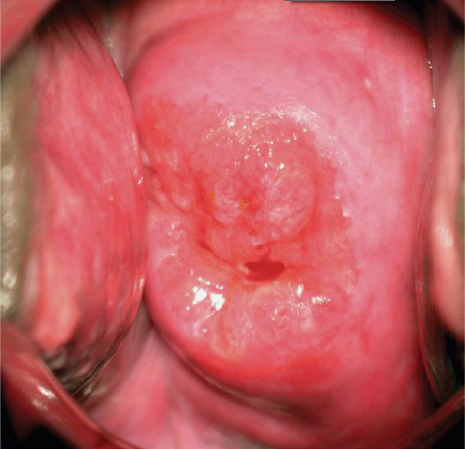
Imperforated Hymen
โดยปกติ hymen เป็น structure ที่พัฒนามาจาก urogenital sinus โดยเกิดจาก invagination ของ posterior wall of urogenital sinus โดยปกติจะสลายหายไปในภายหลังเองในช่วง perinatal period ภาวะที่เกิดจากเยื่อพรหมจรรย์ไม่สลายไปตามปกตินั้นจะส่งผลให้เกิดการอุดตันของประจำเดือน ภาวะนี้ endometrium ซึ่งทำงานได้ตามปกติสร้างประจำเดือนออกมาทุกๆเดือนแต่ว่าเนื่องจากช่องทางถูกอุดตันด้วย imperforated hymen ทำให้เกิดการสะสมของประจำเดือนที่ค้างในทุกเดือน เกิดการอุดตันเกิดขึ้น ทำให้มีอาการปวดท้องน้อยเรื้อรังจากประจำเดือนที่สะสมมากขึ้น ประจำเดือนจะสะสมค้างอยู่ในช่องคลอด (Hematocolpos ) และถ้ามีปริมาณมากประจำเดือนจะท้นไปสะสมที่บริเวณมดลูก ( Hematometra ) ส่งผลให้ในบางรายอาจคลำได้ก้อนที่บริเวณหน้าท้อง มดลูกมีขนาดใหญ่ บางรายมีภาวะปัสสาวะไม่ออก ( acute urinary retention ) จาก hematocolpos ที่ไปกดเบียด urethra ถ้าวินิจฉัยได้ล่าช้าจะส่งผลให้เกิด severe endometriosis (4)
ตรวจร่างกายในภาวะ imperforated hymen จะพบว่า ไม่พบ vaginal orifice, อาจคลำได้ก้อนที่ท้อง ตรวจ perineum พบ bulging blue perineum membrane มี prominent bulging หากมีการเบ่ง
การรักษา ภาวะ imperforated hymen เป้าหมายก็คือลดอาการปวดท้องเรื้อรัง และที่สำคัญคือป้องกันภาวะ endometriosis ที่จะส่งผลต่อ infertility ของผู้ป่วยในอนาคตอีกด้วย ดังนั้นจึงควรรักษาทันทีที่สามารถวินิจฉัยโรคได้เลย(4) (1, 3)
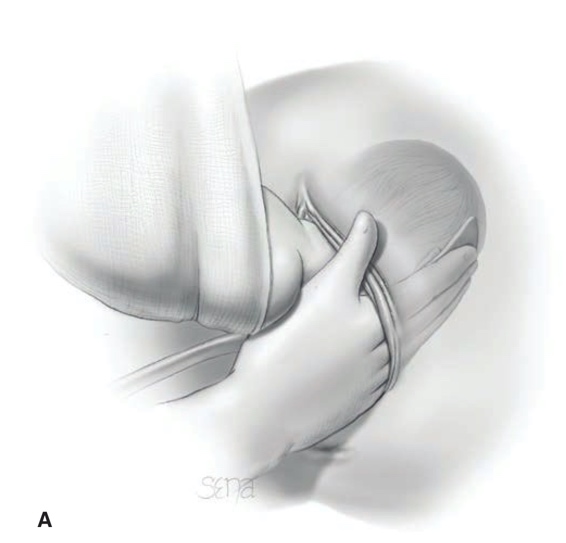
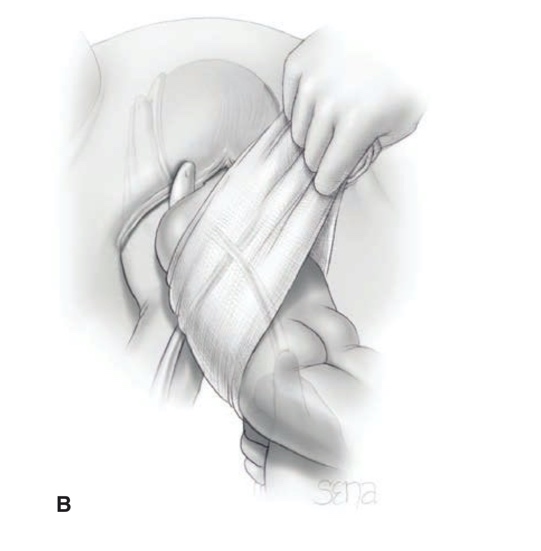
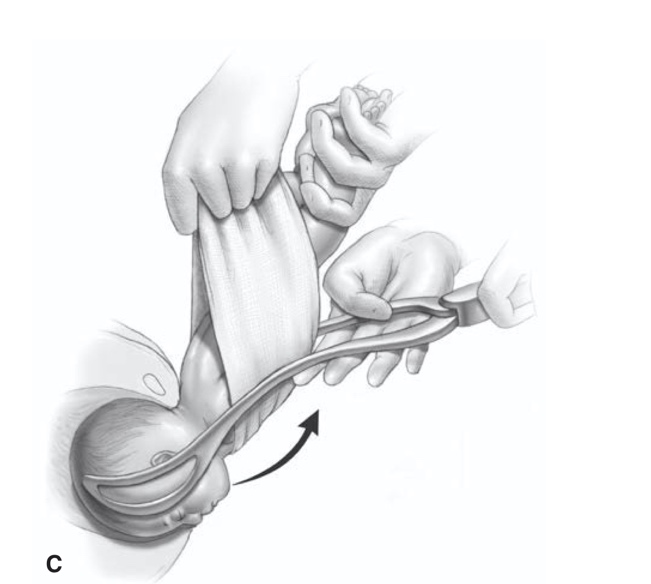
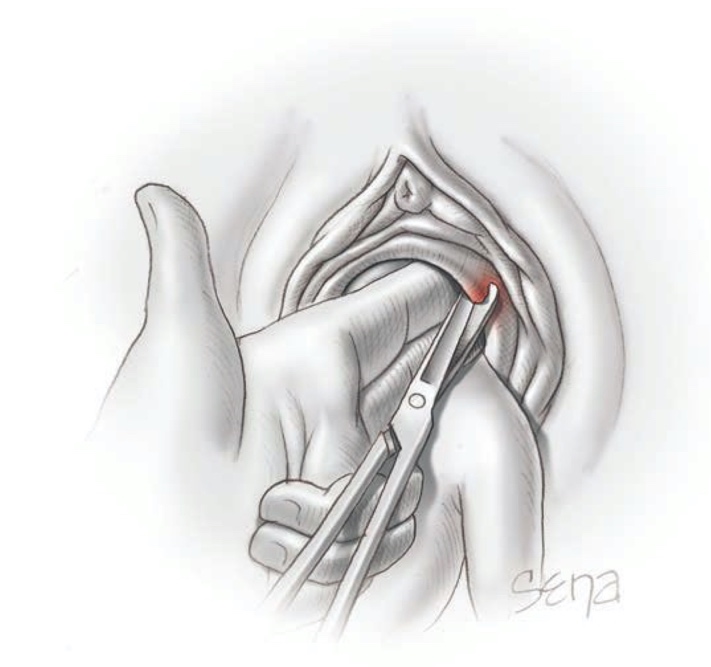
การรักษาที่เป็น gold standard ของโรคนี้คือ “Cruciate Incision” เป็นหัตการที่กรีด incision เป็นรูปกากบาทดังรูป โดยกรีดตำแหน่งที่มี bulging มากที่สุดเพื่อระบายเลือดที่ค้างออกมา ดังรูปที่ 4
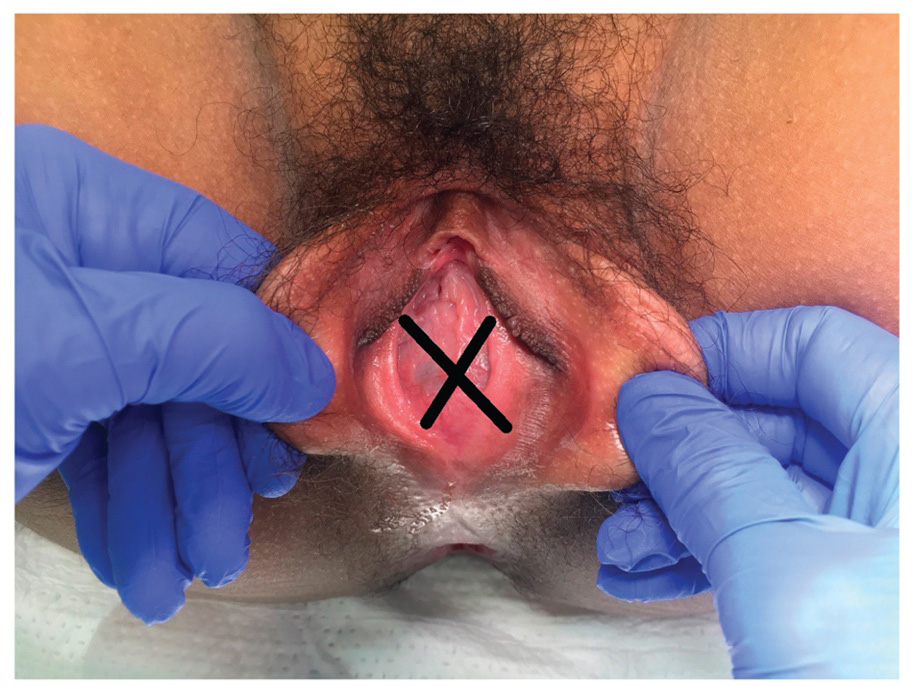
รูปที่ 4 แสดงภาวะ imperforated hymen และตำแหน่งที่กรีด cruciate incision
จาก Management of Acute Obstructive Uterovaginal Anomalies: ACOG Committee Opinion, Number 779. Obstet Gynecol. 2019;133(6):e363-e71.
ในรายที่ไม่ต้องการทำ cruciate incision ( ในบางความเชื่อที่เชื่อว่า hymen เป็นสัญลักษณ์ของ virginity ) ทางรักษาทางเลือกอีกวิธีคือ “sterile punctured of hymen “ ทำได้โดยเจาะรูตรงกลาง hymen จากนั้นใส่ Foley Cath ค้างไว้นานประมาณ 2 สัปดาห์เพื่อระบายเลือดที่ออกไว้ให้หมด และทา estrogen cream บริเวณ hymen ring เพื่อ promote epithelization (1)
-
Transverse vaginal septum
เป็นภาวะที่ช่องคลอดไม่เกิด canalization of vaginal plate ในช่วง embryogenesis ซึ่งปกติจะเกิด canalization of vaginal lumen สมบูรณ์เมื่ออายุครรภ์ครบ 20 สัปดาห์ โดยผู้ป่วยที่เป็นโรคนี้จะมีอาการของ cryptomenorrhea จาก obstructed menstruation (5)
ตรวจร่างกายจะพบ vaginal orifice ตามปกติ แต่ว่ามี ความยาวช่องคลอดที่สั้น (short vaginal length ) ตรวจไม่พบ cervix ตรวจภายในมดลูกอาจโตได้จาก hematometra แยกจาก imperforated hymen ได้โดยในโรคนี้ถ้าเบ่ง ( valsava ) จะไม่มี bulging of membrane ออกมา (1) รูปที่ 5 แสดงลักษณะของ Transverse vaginal septum
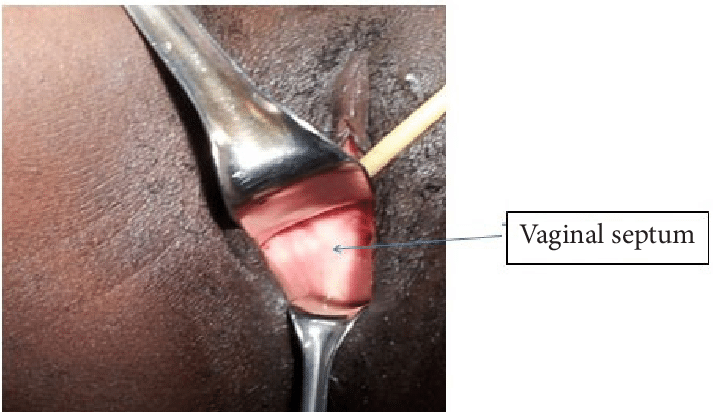
รูปที่ 5 แสดงลักษณะ Transverse vaginal septum
จาก https://www.researchgate.net/figure/Transverse-vaginal-septum_fig1_275038825
การส่งตรวจวินิจฉัยเพิ่มเติมด้วย ultrasound ทางหน้าท้องจะตรวจพบ hydrosalpinx , hematocolpos และ hematometra อาจพิจารณาส่ง MRI pelvis เพิ่มเติมหากต้องการ รายละเอียดของ anatomy ที่ชัดเจนมากขึ้น (1)
การรักษาโรค เป็นการผ่าตัด Excision of septum or atresia segment โดยจะผ่าตัดนำส่วนที่อุดตันนั้นออก ส่งผลให้ vaginal lumen โล่งทำให้สามารถมีประจำเดือนตามปกติได้ หลังจากนำเนื้อ vaginal lumen ส่วนนี้ออกแล้ว ในบางรายอาจต้องใช้ vaginal graft เพื่อต่อความยาวส่วนนี้เพิ่มเติม หลังผ่าตัดจำเป็นต้องใส่ vaginal dilator เพื่อป้องกันช่องคลอดอุดตันหลังผ่าตัดด้วย (1)
-
Cervical Artesia
เป็นภาวะที่ cervix อุดตัน ทำให้ไม่สามารถระบายประจำเดือนที่สร้างมากจาก endometrium ได้ โรคนี้เป็นภาวะที่รักษาได้ยากที่สุดในกลุ่มโรค outflow tract obstruction อื่นๆ ในอดีตมักรักษาด้วยการตัดมดลูกออก (hysterectomy) แต่ปัจจุบัน มีการรักษาที่เป็น gold standard สำหรับโรคนี้คือ laparoscopic uterovaginal anastomosis โดยจะมีข้อดีคือสามารถ preserve fertility ของผู้ป่วยไว้ได้ (1, 2)
ภาวะไม่มีประจำเดือน ที่มีพัฒนาการของเต้านมปกติแต่ไม่มีมดลูก
ในกลุ่มนี้จะประกอบด้วยสองโรคคือ Mullerian agenesis และ androgen insensitivity syndrome โดยทั้งสองโรคนี้จะสามารถแยกจากกันโดยง่ายด้วย การส่ง karyotype (3)
-
Mullerian Agenesis( Mayer-Rokitansky-Küster-Hauser syndrome)
สาเหตุเกิดจากการเจริญผิดปกติของ Mullerian structure ในช่วง embryological development ส่งผลให้ไม่มีการสร้าง Mullerian structure ตามปกติ ดังนั้นผู้ป่วยโดยส่วนใหญ่จะไม่มีระบบท่อสืบพันธุ์ที่พัฒนามาจาก Mullerian structure เช่น uterus , cervix, upper part of vagina สาเหตุของ Mullerian structure ที่เจริญผิดปกตินี้ เชื่อว่าเกิดจาก mutation ของ gene ที่เกี่ยวข้องกับการสร้าง Anti-Mullerian Hormone receptor ในบางการศึกษาพบว่าอาจเกิดจาก Mutation ของ GALT gene ( galactose-1-phosphate uridylyltransferase ) ส่งผลให้เกิด galactose metabolism exposure ของทารกในครรภ์ ซึ่งเชื่อว่ามีผลไปรบกวน Mullerian development โรคนี้โดยส่วนใหญ่เป็น sporadic case แต่ในบางรายจะสัมพันธ์กับ Chromosomal Translocation (1-3)
ใน Mullerian Agenesis จะตรวจพบ normal secondary sex characteristic ตรวจภายในจะพบ blinded pouch vagina เนื่องจาก upper part of vagina ไม่พัฒนา ไม่พบ cervix at vaginal apex ovary ของผู้ป่วยมักจะทำงานได้ตามปกติแต่ว่าจะมีตำแหน่งที่ผิดปกติจากเดิม กล่าวคือมักจะมีตำแหน่งที่สูงกว่าปกติ และจะมี inguinal hernia ได้บ่อย Mullerian Agenesis สามารถแบ่งได้ 2 ชนิด ดังนี้ (1)
- Type A: Symmetrical rudimentary uteri and normal fallopian tubes
- Type B: Asymmetrical rudimentary uteri and normal fallopian tubes
พบว่า type B จะมีความรุนแรงของโรคมากกว่า เนื่องจากมักสัมพันธ์กับ associated anomaly ได้บ่อย ใน Mullerian Agenesis จะมี associated anomaly ที่พบร่วมกันได้คือ
- urologic anomaly (15-40% ) : renal agenesis, ectopic/horse shoe kidney ,duplication of collecting system
- skeletal malformation: vertebrae , ribs, pelvis , scoliosis
ดังนั้นควรส่งตรวจวินิจฉัยเพิ่มเติมเพื่อสืนค้นภาวะเหล่านี้ด้วย โดยแนะนำให้ส่ง renal ultrasound และ plain spinal x-rays(1) โรคนี้เป็นภาวะที่ต้องแยกจาก androgen insensitivity syndrome โดยวินิจฉัยแยกโรคได้ด้วยการส่ง karyotype ในผู้ป่วย Mullerian agenesis จะมี karyotype 46 XX (1)
การรักษา Mullerian Agenesis : เป้าหมายของการรักษาคือสร้างช่องคลอดที่สามารใช้งานได้ สามารถมีเพศสัมพันธ์ได้ตามปกติ การรักษามาตรฐานคือใช้เครื่องมือสอดทางช่องคลอดเพื่อขยายช่องคลอด (progressive vaginal dilatation ) เป็นการรักษาที่มีประสิทธิภาพสูงในการสร้างช่องคลอดที่ใช้งานได้ขึ้นมาใหม่ (neovagina) โดยจะสร้าง functional vagina โดยใช้เวลาประมาณ 3- 6 เดือน โดยต้องสอดใส่ในช่องคลอดจนเกิดความรู้สึกไม่สะดวกสบายปานกลาง โดยทำประมาณ 20-30 นาทีต่อวัน การรักษาทางเลือกอื่นคือการผ่าตัดเพื่อสร้างช่องคลอดใหม่ที่สามารถใช้งานได้ขึ้นมาเอง โดยจะสงวนไว้ให้กับผู้ป่วยที่ไม่ยินยอม ไม่สะดวกที่จะใช้ vaginal progressive dilatation โดยการผ่าตัดที่เป็น gold standard คือ Mc Indoe vaginoplasty (1, 2, 5-7)
-
androgen insensitivity syndrome
เป็นภาวะความผิดปกติที่ ผู้ป่วยมี genotype 46 XY แต่แสดงลักษณะภายนอก ( phenotype ) เป็นผู้หญิง เนื่องจาก androgen ที่มีในกระแสเลือดไม่สามารถออกฤทธิ์ทำให้เกิดลักษณะของเพศชายได้ โดยเป็นภาวะ male pseudohermaphrodite ชนิดหนึ่ง โดยเชื่อว่ากลไกที่ทำให้ androgen ออกฤทธิ์ไม่ได้นั้นเกิดจาก mutation ที่ยีนส์ที่ควบคุมการสร้าง androgen receptor ซึ่งอยู่ในโครโมโซม X แขนยาว ส่งผลให้ androgen receptor อวัยวะปลายทางออกฤทธิ์ไม่ได้ ไม่เกิด masculinization of genitalia เป็นผู้ชายดังนั้น อวัยวะเพศภายนอกจึงพัฒนาไปเป็นผู้หญิง รายที่เป็น complete form of AIS จะมีชื่อเรียกอีกชื่อว่า testicular feminization (1, 3)
ผู้ป่วย AIS มี Y chromosome ดังนั้น SRY gene จะทำให้ gonad เจริญเป็น testes สร้าง Anti – Mullerian hormone ตามปกติ ส่งผลให้ยับยั้งการเจริญของ Mullerian structure ซึ่งเป็นระบบท่อของผู้หญิง ทางกลับกันเนื่องจากผู้ป่วยมี androgen insensitivity ทำให้ testosterone ออกฤทธิ์ไม่ได้ส่งผลให้ไม่เกิดการกระตุ้นการพัฒนาของ Wolffian duct จึงไม่มีระบบท่อสืบพันธุ์ของเพศชายเช่นกัน กล่าวคือในผู้ป่วย AIS จะไม่มีระบบท่อสืบพันธุ์ของทั้งชายและหญิงเลย testes ในผู้ป่วย AIS จะไม่สามารถทำงานสร้าง sperm ได้ตามปกติ อีกทั้งยังเกิดภาวะ undescended testes ซึ่งถ้าปล่อยไว้จะส่งผลให้มีความเสี่ยงเป็นมะเร็งอัณฑะตามมา (1, 3)
ตรวจร่างกายในผู้ป่วย complete AIS จะพบลักษณะ breast development ได้เนื่องจาก testosterone ในเลือดสามารถมี peripheral conversion เป็น estrogen ที่ออกฤทธิ์ได้ แต่ว่ามีความผิดปกติเล็กน้อย เช่น มี glandular tissue เพียงเล็กน้อยเท่านั้น , small nipples , pale Areola ซึ่งเป็นผลจากการขาดฮอร์โมน progesterone ผู้ป่วยมักจะมีลักษณะ สูงผิดปกติ มือและเท้าใหญ่ labia minora ไม่ค่อยเจริญมากนัก ตรวจร่างกายพบ blind pouch vagina เนื่องจากไม่มีการเจริญของ upper part of vagina ซึ่งเป็นส่วนหนึ่งของ Mullerian structure pubic hair และ axillary hair ของผู้ป่วยจะไม่เจริญหรือเจริญได้น้อยมากจากผลของ androgen insensitivity ซึ่งจะเรียกว่าผู้ป่วยมี “asymmetrical secondary sexual development” กล่าวคือมีการพัฒนาของเต้านม แต่ว่า pubic hair เจริญได้ไม่ดี โดยในส่วนนี้สามารถใช้วินิจฉัยแยกโรคจาก Mullerian agenesis ได้โดย Mullerian agenesis จะมีการพัฒนาของ pubic hair และ axillary hair ตามปกติ(1, 2) รูปที่ แสดงผู้ป่วย AIS จะสังเกตเห็นว่ามีพัฒนาการของเต้านม แต่ไม่มีขนบริเวณอวัยวะเพศ(2)
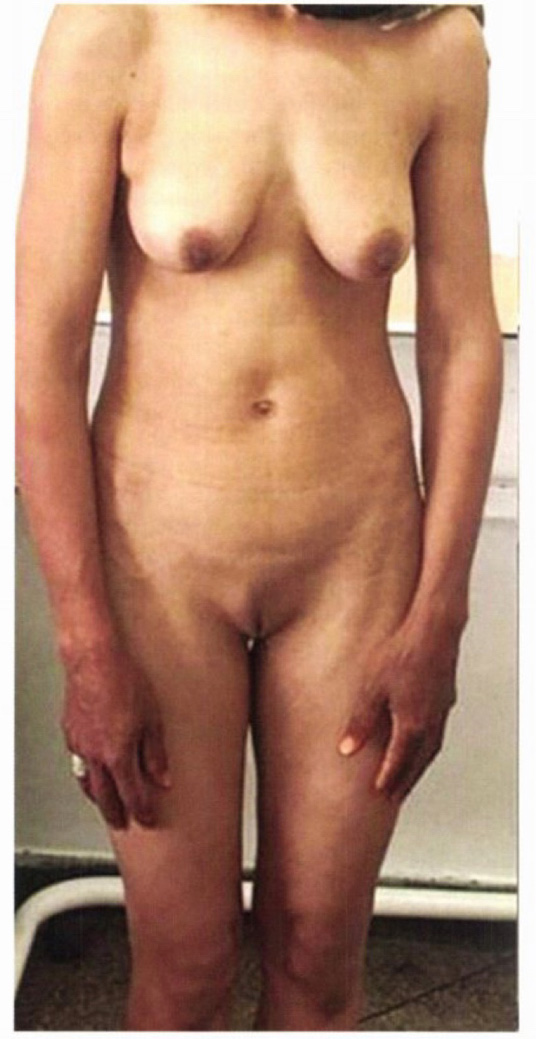
รูปที่ 6 แสดง Asymmetrical secondary sex characteristic development ในผู้ป่วย Androgen Insensitivity syndrome
จาก Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020.
ในรายที่เป็น Incomplete AIS androgen ยังพอออกฤทธิ์ได้บ้างเพียงเล็กน้อยส่งผลให้มีลักษณะของความเป็นบุรุษเพศได้อยู่บ้าง เช่นจะตรวจพบอวัยวะเพศกำกวม ( ambiguous genitalia ) enlarged clitoris และมีการเจริญของ pubic hair ได้บ้าง (1, 2)
การส่งตรวจเพื่อสืบค้นเพิ่มเติม ควรส่ง karyotype เพื่อยืนยันการวินิจฉัย ระดับ testosterone level จะสูงกว่าในผู้หญิงปกติเล็กน้อย มีระดับ serum LSH ที่สูง (1)
การรักษา AIS จะแบ่งการรักษาเป็นสองประเด็นดังนี้
- สร้างช่องคลอดที่สามารถใช้งานได้ ( functional vagina creation): รายละเอียดจะเหมือนกับโรค Mullerian agenesis ที่เคยกล่าวไว้แล้ว(1)
- ความเสี่ยงที่จะเป็นมะเร็งรังอัณฑะ: เนื่องจาก undescended testes ใน AIS จะเพิ่มความเสี่ยง gonadoblastoma 2-5 % จึงมีข้อบ่งชี้ผ่าตัด Gonadectomy โดยในรายที่มี complete AIS สามารถรอผ่าตัดจนพ้นช่วงวัย puberty ไปแล้วได้ แนะนำผ่าตัดที่อายุ 16-18 ปี แต่ถ้าเป็นผู้ป่วยที่เป็น Incomplete AIS แนะนำให้ผ่าตัดให้เร็วที่สุดเนื่องจากการผ่าตัดที่ช้าออกไปจะส่งผลให้เกิดมี virilization ซึ่งเป็นภาวะที่ไม่พึงประสงค์ในอนาคตได้เนื่องจากช่วงหลัง puberty พบว่า androgen สามารถออกฤทธิ์ได้ดีมากขึ้นในช่วงหลัง(1, 2)
ภาวะมีพัฒนาการของเต้านมปกติและมีมดลูก
จะสืบค้นเหมือนกับ secondary amenorrhea จะไม่กล่าวถึงรายละเอียด ณ ที่นี้
ภาวะไม่มีประจำเดือนที่ไม่มีพัฒนาการของเต้านมตามปกติแต่มีมดลูก
ภาวะนี้ใน Berek Novak 16th edition ใช้นิยามว่า primary amenorrhea without secondary sex characteristic กล่าวคือผู้ป่วยมีมดลูกตามปกติแต่ว่าไม่มีการพัฒนาของ secondary sex characteristic(2) ซึ่งประเมินได้จาก breast development ซึ่งเป็น สัญญาณแรกของ secondary sexual development in female เป็น sign of estrogen exposure in puberty โดยจะแบ่งผู้ป่วยเป็นสองกลุ่ม โดยจำแนกได้ดังนี้ (3)
- hypogonadotropic hypogonadism : low to normal FSH
- hypergonadotropic hypogonadism : high FSH
-
hypogonadotropic hypogonadism
เป็นภาวะที่มี hypogonadism คือมี low level of Gonadotropin hormone (Low FSH , LH) ซึ่งเป็นผลมาจากการทำงานผิดปกติของระบบประสาทส่วนกลางไม่ว่าจะเป็น การทำงานผิดปกติของ hypothalamus ในการหลั่ง GnRH หรือเกิดจากความผิดปกติของ anterior pituitary ในการหลั่ง FSH, LH ท้ายที่สุดความผิดปกติดังกล่าวนี้จะส่งผลให้มี low level FSH , LH ทำให้ ovary ไม่ถูกกระตุ้นตามมา สุดท้าย ovarian follicle ไม่ถูกกระตุ้นส่งผลให้ไม่มีประจำเดือนในที่สุด โดยสาเหตุของภาวะ hypogonadotropic hypogonadism มีดังนี้ (2)
- physiologic delay of puberty ( constitutional delayed of puberty)
เป็นสาเหตุที่พบได้บ่อยที่สุดของ hypogonadotropic hypogonadism และยังเป็นสาเหตุที่พบได้บ่อยที่สุดของภาวะ delayed puberty อีกด้วย ซึ่งถือเป็น normal variant ที่เกิดจาก delayed reactivation of GnRH pulse generator ส่งผลให้มี low FSH , LH อยู่ผู้ป่วยจึงเข้าสู่ภาวะ puberty ได้ช้า ส่งผลให้มีประจำเดือนล่าช้ากว่าปกติตามมา (1, 2)
เกิดจาก GnRH Neuron ใน hypothalamus มีความผิดปกติของ differentiation และ migration to hypothalamus ในช่วง embryonic development ส่งผลให้เกิดภาวะ GnRH deficiency ตามมา
โรคนี้มีความสัมพันธ์สามารถถ่ายทอดทางพันธุกรรมได้หลากหลายทั้ง X-linked recessive , autosomal dominant , autosomal recessive โดย มียีนที่เกี่ยวข้องกับโรคนี้คือ FGFR1 ,KAL1 ,KAL2 ในผู้ป่วยชายที่เป็นโรคนี้จะมี triad คือ ดมกลิ่นไม่ได้ (Anosmia), hypogonadism และ color blindness
ผู้ป่วยจะมีความผิดปกติของร่างกายในส่วนอื่นอีกด้วยเช่น cleft lip/cleft palate , cerebellar ataxia , deafness, abnormal thirst and vasopressin release และ unilateral renal agenesis(1-3)
ผู้ป่วยจะมาพบแพทย์ด้วยปัญหา primary amenorrhea , delayed puberty ผู้ป่วยจะมี normal pubic hair development เต้านมจะเจริญได้น้อยมาก มักมีร่างกายที่สูงและมือเท้าโต (eunuchoid habitus) มีปัญหาดมกลิ่นได้ไม่ดีหรือไม่ได้กลิ่นเลย (hypoanosmia/anosmia) มีภาวะตาบอดสี (color blindness ) รูปที่ 7 แสดงผู้ป่วย Kallman syndrome ที่มีลักษณะของ eunuchoid habitus เต้านมไม่พัฒนา มี pubic hair development (2)
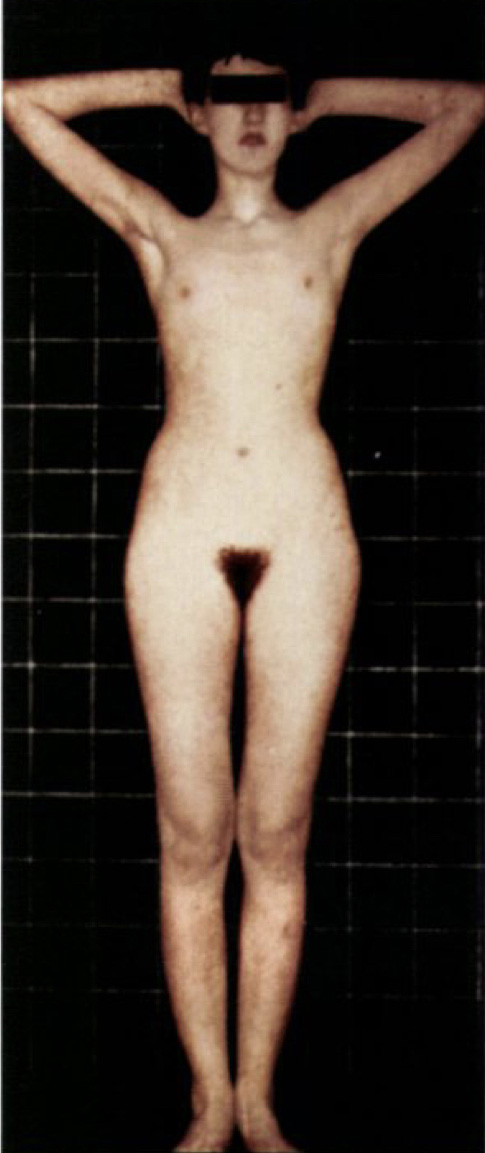
รูปที่ 7 ผู้ป่วย Kallman Syndrome
จาก Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020.
การรักษาภาวะนี้จะเป็นการให้ฮอร์โมน estrogen และ progestin เสริมเพื่อให้เข้าสู่ภาวะ puberty(1, 2)
เกิดจาก mutation ของยีนที่เกี่ยวข้องกับการสร้างหรือส่งสัญญาณของ GnRH receptor ส่งผลให้เกิดความผิดปกติของการทำงานของ GnRH โดยเชื่อว่ามีกลไกลหลายอย่างที่ทำให้เกิดการทำงานผิดปกติดังกล่าว เช่น prevention of GnRH binding , interfere signal transduction และ ป้องกัน GnRH stimulation (2)
เป็นความผิดปกติที่ FSH ต่ำเพียงอย่างเดียว ในขณะที่ปริมาณของ LH อยู่ในระดับที่ปกติ ระดับ FSH ที่ต่ำส่งผลให้ follicular development ผิดปกติไปทำให้มี hypoestrogenism รวมทั้งทำให้ theca cell production of androgen น้อยลง ทำให้ระดับ androgen ต่ำมากด้วย ส่งผลให้มี delayed puberty และ primary amenorrhea ตามมา(2)
-
disorder of anterior pituitary gland
ความผิดปกติของ anterior pituitary ส่งผลให้หลั่ง Gonadotropin ออกมาได้น้อยกว่าปกติ สาเหตุส่วนใหญ่เกิดจาก Sellar /Parasellar mass ไปกดเบียดบริเวณ anterior pituitary ทำให้ anterior pituitary โดนกดเบียดจนแบน ไม่สามารถทำงานได้ เกิดภาวะ hypopituitarism คือฮอร์โมนจาก pituitary ทำงานผิดปกติไป เรียกโรคนี้ว่า Empty sellar syndrome (1)
Sellar/Parasellar mass ที่ไปกดเบียด anterior pituitary ที่พบได้บ่อยที่สุดคือ benign Adenoma สาเหตุก้อนอื่นๆที่พบได้ เช่น Craniopharyngioma , Meningioma , Glioma เป็นต้น non neoplastic mass เช่น Cyst, Tuberculosis , Sarcoidosis , Internal carotid artery aneurysm(1)
เป็นความผิดปกติที่เกิดจากมี mass หรือ CSF fluid ไปกดเบียด anterior pituitary ส่งผลให้ anterior pituitary แบนลง เสียความสามารถในการหลั่งฮอร์โมนตามปกติไป(1) เกิด hypopituitarism บางรายเกิด hypogonadism จากการที่หลั่ง GnRH ได้น้อยลงส่งผลให้เกิด amenorrhea(1) ตามมาได้ empty sellar syndrome เป็นคำ misnomer เนื่องจาก sellar region ไม่ได้ว่างเปล่าจริงๆ แต่ที่จริงแล้วมี CSF fluid แทรกเข้าไปกดเบียดอยู่ใน sellar region แต่จาก MRI brain จะพบลักษณะ empty sellar
Empty sellar syndrome แบ่งได้เป็นสองชนิด
- Primary empty sellar syndrome: เป็น defect ของ diaphragmic sellar ที่ทำให้ CSF ไหลผ่านมากดเบียด anterior pituitary
- Secondary empty sellar syndrome: เป็น emptysellar syndrome ที่เกิดจากสาเหตุอื่นโดยเกี่ยวข้องกับ anterior pituitary gland เช่น Pituitary infarction / hemorrhage , หลังการผ่าตัดหรือฉายรังสีของ pituitary adenoma เป็นต้น (1)
hypergonadotropic hypogonadism
เป็น hypogonadism ที่เกิดจากการทำงานของรังไข่ผิดปกติที่ไม่สามารถสร้าง estrogen ได้เพียงพอที่จะทำให้เกิด secondary sex characteristic ดังนั้นปริมาณฮอร์โมน estrogen ที่ลดลงจึงไป positive feed back กระตุ้น anterior pituitary ให้หลั่ง FSH LH ออกมาเพิ่มเติมเพื่อตอบสนองต่อภาวะ estrogen ที่ต่ำผิดปกติ ความผิดปกติของผู้ป่วยในกลุ่มนี้จะเกิดจาก ovarian failure (1)
ความผิดปกติของผู้ป่วย hypergonadotropic hypogonadism จะแบ่งแยกได้สองแบบตามผลของ karyotype ดังนี้
- chromosome incompetent ovarian failure (CIOF): เป็นผู้ป่วยที่มี chromosome ผิดปกติ คือผู้ป่วยที่เป็นโรค Turner syndrome
- chromosome competent ovarian failure (CCOF) : เป็นผู้ป่วยที่มี normal karyotype
Chromosome incompetent ovarian failure (CIOF)
เป็นโรคที่มีความผิดปกติของ โครโมโซม X ที่หายไป หรือในบางรายเกิดจาก chromosome deletion , ring chromosome , isochromosome โดยปกติการพัฒนาของรังไข่ที่สมบูรณ์ต้องอาศัยความสมบูรณ์ของโครโมโซม X ทั้งสองโครโมโซม หากมีแขนใดแขนหนึ่งของโครโมโซม X ผิดปกติไปจะส่งผลให้รังไข่ฝ่อเสมอ(3) ในรายที่มีความผิดปกติ classic phenotype คือ มีรูปร่างเตี้ย( short stature) absent sexual development จาก streak ovaries ที่ไม่สามารถสร้างฮอร์โมนเพศได้ส่งผลให้เกิดภาวะไม่มีประจำเดือนตามมา , webbed neck , low set ears , posterior hair line , wide spread nipples , Cubitus Vulgus (1-3) ดังรูปที่ 8
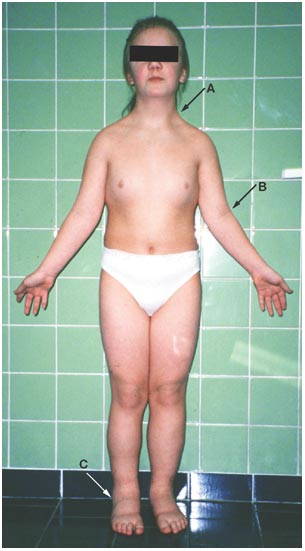
รูปที่ 8 แสดงผู้ป่วย Classic Phenotype ของ Turner Syndrome
จาก Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020.
ถ้าหากผู้ป่วยไม่ได้มีลักษณะ classic phenotype ดังกล่าวข้างต้น จะมาพบแพทย์ด้วยปัญหา primary amenorrhea และ delayed puberty โดยเฉพาะอย่างยิ่ง Turner syndrome ที่เกิดจากกระบวณการ Mosaicism มักจะไม่ได้มีลักษณะ classic phenotype ของ Turner syndrome ครบทั้งหมดก็ได้
5% ของผู้ป่วยจะสามารถเข้าสู่ภาวะ puberty ได้ตามปกติ และมีประจำเดือนตามมาได้ (1, 3)
ในรายที่มี Y chromosome แฝงอยู่ด้วย จะเพิ่มความเสี่ยงของ Gonadoblastoma 20-30 %
ผู้ป่วย Turner syndrome จะมีโรคร่วมต่างๆหลายประการดังนี้ (1)
- cardiovascular system: bicuspid aortic valve , coarctation of aorta , mitral valve prolapse , aortic aneurysm, aortic dissection
- renal anomalies : horshoe kidney , renal agenesis , pelvic kidney
- autoimmune disease : Thyroiditis , autoimmune hepatitis, thrombocytopenia, celiac disease
- hearing loss
ดังนั้นจึงแนะนำให้ทำการตรวจสืบค้นหาโรคร่วมดังกล่าวในผู้ป่วยที่มีภาวะ Turner syndrome ด้วยทุกราย (1)
ผู้ป่วย Turner syndrome จะมีระดับสติปัญญาที่ปกติ การตั้งครรภ์ในผู้ป่วย Turner syndrome ถือว่าเป็น relative contraindication เนื่องจากจะมีอัตราเสี่ยงอัตราการเสียชีวิตของมารดาด้วยสาเหตุของ cardiovascular system เพิ่มขึ้นสูงมากเป็น 100 เท่าของการตั้งครรภ์ปกติ อีกทั้งการตั้งครรภ์ของผู้ป่วยนั้นจะเสี่ยงที่จะมี sex chromosome aneuploidy , หรือ abortion ได้มากขึ้น (1)
การรักษาผู้ป่วย Turner syndrome ในแง่ของ delayed puberty จะรักษาด้วยการให้ low dose estrogen โดยอายุที่เหมาะสมที่ยังสามารถรักษาได้อย่างมีประสิทธิภาพคือก่อน 15 ปี เพื่อหวังผลที่จะมี sex maturation ที่สมบูรณ์ภายใน 2-3 ปี โดยสามารถเพิ่มขนาดของ estrogen ขึ้นเรื่อยๆทีละน้อยๆ ทุก 3-6 เดือน(1)
ในผู้ป่วยที่มี Y chromosome ร่วมด้วยมีข้อบ่งชี้ผ่าตัด gonadectomy เพื่อที่จะป้องกัน ความเสี่ยงที่จะเป็น Gonadoblastoma ในอนาคต ประเด็นการรักษาอื่นเช่น โรคร่วมที่พบให้พิจารณาปรึกษาแพทย์ผู้เชี่ยวชาญรักษาตามแต่ละโรคต่อไป (1)
chromosome competent ovarian failure (CCOF)
- Swyer syndrome (XY gonadal dysgenesis)
ในเพศชาย โดยปกติ SRY gene (Sex Determining region y) จะทำหน้าที่กระตุ้นให้ต่อมเพศเจริญเติบโตเป็นอัณฑะและสร้างลักษณะทางเพศของผู้ชายต่อไป แต่ในผู้ป่วยกลุ่มโรคนี้เป็นภาวะที่ SRY gene ไม่ทำงานตามปกติ เนื่องจากเกิด mutation ของ SRY gene ที่อยู่บนโครโมโซม Y แขนสั้น ( Yp11.3 ) ทำให้ SRY gene ทำงานไม่ได้ ส่งผลให้ต่อมเพศที่จะพัฒนาเป็นอัณฑะฝ่อไปตั้งแต่ช่วงแรก (Streak gonads) ซึ่ง streak gonad of testes นี้จะไม่พัฒนา ไม่สามารถสร้าง androgen ได้ ส่งผลให้ไม่มี testosterone ไปกระตุ้นการสร้าง Wolffian duct ส่งผลให้ระบบท่อสืบพันธุ์ของผู้ชายไม่พัฒนา อีกทั้งระดับ testosterone ที่ต่ำจะไม่สามารถ masculinize external genitalia ให้เป็นผู้ชายได้ ดังนั้น external genitalia ของผู้ป่วยจึงเป็นลักษณะของผู้หญิงแทน เนื่องจาก streak gonad ของผู้ป่วยจะไม่สามารถผลิต anti Mullerian hormone ได้ ส่งผลให้ไม่สามารถยังยั้ง การเจริญของ Mullerian system ส่งผลให้เกิดการสร้างระบบท่อสืบพันธ์ของผู้หญิงตามมา ทำให้ผู้ป่วยมีมดลูก และช่องคลอดตามปกติเหมือนผู้หญิง ไม่ได้มีลักษณะ blind pouch vagina และเนื่องจากระดับ hormone เพศทุกตัวจะต่ำหมดส่งผลให้มีปัญหา delayed puberty ตามมา (1, 3)
Swyer syndrome เป็นภาวะ male pseudo hermaphroditism ชนิดหนึ่ง คือเป็นผู้ป่วยที่มี chromosome XY แต่มี phenotype เป็นผู้หญิง จะมาด้วยภาวะไม่มีประจำเดือน และ delayed sexual maturation
Streak gonad ของผู้ป่วยส่งผลให้เพิ่มความเสี่ยงของ gonadoblastoma ดังนั้นการรักษาจึงจำเป็นต้องผ่าตัด gonadectomy เร็วที่สุดที่สามารถวินิจฉัยได้ (1)
FMR1 premutation
เกิดจากการมี mutation ของ ยีน FMR1 ซึ่งอยู่บนโครโมโซม X ตำแหน่ง Xq27.3 ที่มี CGG repeat 55-200 ชุด ซึ่งโดยปกติจะมี 30 ชุด ( แต่ถ้ามีมากกว่า 200 ชุด จะส่งผลให้เกิดโรค Fragile X syndrome ) ซึ่ง premutation ของยีนนี้จะส่งผลให้เกิดภาวะ premature ovarian insufficiency ตามมา(1, 3)
resistant ovarian syndrome
Gonadotropin ที่หลั่งจากต่อมใต้สมองส่วนหน้าไม่สามารถออกฤทธิ์ที่ follicle ในรังไข่ได้ตามปกติ ซึ่งกลไกที่เป็นไปได้ของภาวะดังกล่าวอาจเกิดจาก mutation ของยีนที่เกี่ยวข้องกับการสร้าง FSH receptor , การส่งสัญญาณที่ผิดปกติของ gonadotropin ผู้ป่วยจะมีระดับ gonadotropin level ที่ปกติ (1, 3)
Autoimmune Disorder (Autoimmune oophoritis)
เป็นภาวะที่ร่างกายสร้าง antibody ต่อต่อมต่างๆหลายอย่างพร้อมกัน (Autoimmune polyendocrine syndrome : APS) โดนเฉพาะ antibody ต่อต่อหมวกไต โดยมักจะเกี่ยวข้องกับภาวะ adrenal insufficiency , hypoparathyroidism , Type I DM ซึ่งเป็นผลของ antibody ต่ออวัยวะต่างๆดังกล่าว
เมื่อส่งพยาธิวิทยาของเนื้อรังไข่จะพบลักษณะ lymphocytic invasion ล้อมรอบ secondary and antral follicle แต่ในทางปฏิบัติไม่จำเป็นต้องส่งพยาธิวิทยาของเนื้อรังไข่เพื่อวินิจฉัย แต่การวินิจฉัยภาวะนี้สามารถยืนยันได้ด้วยการส่ง 21- hydroxylase antibody ถ้าให้ผลเป็นบวกจะสามารถวินิจฉัยภาวะนี้ได้ (1, 3)
Rare Enzyme deficiency
เอนไซม์ที่จำเป็นเกี่ยวข้องกับการสังเคราะห์ฮอร์โมนเพศ ถ้ามีความผิดปกติของเอนไซม์บางตัว จะส่งผลให้สังเคราะห์ estrogen ได้ลดลงส่งผลให้ เกิดภาวะ ovarian failure ต่อไปนี้จะเป็นความผิดปกติของเอนไซม์ดังกล่าวที่พบได้
- congenital lipoid adrenal hyperplasia
ในกระบวนการสังเคราะห์ steroid โดยปกติ cholesterol จะถูกนำเข้า mitochondria โดยใช้ protein ที่อยู่ ตัวช่วยชื่อว่า Steroidogenic acute regulatory protein (StAR )หลังจากนั้น Cholesterol จะถูกเปลี่ยนเป็น Pregnenolone ด้วยเอนไซม์ P450 SCC ต่อไป (2)
ผู้ป่วยโรคนี้จะมีความผิดปกที่ cholesterol ไม่สามารถเปลี่ยนไปเป็น pregnenolone ได้ตามปกติ โรคนี้ถ่ายทอดทางพันธุกรรมแบบ autosomal recessive สาเหตุเกิดจาก ความผิดปกติของ StAR protein ที่เกิดภาวะ mutation หรือ ในบางรายพบว่าขาดเอนไซม์ P450 SCC ส่งผลให้ระดับ aldosterone ปลายทางลดลงนำไปสู่
hyponatremia , hyperkalemia , acidosis ผู้ป่วยจะมี phenotype เป็นผู้หญิงไม่ว่าจะมี genotype XX หรือ XY เนื่องจากขาด testosterone (2)
ผู้ป่วยมี mutation ของ CYP17 gene ซึ่งจะเกี่ยวข้องกับการสังเคราะห์เอนไซม์ 17 alpha-hydroxylase และ 17,20 Lyase mutation ดังกล่าวส่งผลให้เอนไซม์สองชนิดนี้ทำงานผิดปกติไป สังเคราะห์ estrogen และ testosterone ได้ลดลง มีระดับ gonadotropin level ที่มากขึ้น
Cortisol level ที่ลดลง จะส่งผลให้ผู้ป่วยมี ACTH มากขึ้น มีระดับ mineralocorticoid สูงขึ้น ทำให้มีดูดโซเดียมกลับเข้ากระแสเลือดมากขึ้น เกิด hypertension ตามมา และเสียโพแพทสเซียมไปทางปัสสาวะมากขึ้นส่งผลให้เกิด hypokalemia (2)
เป็นความผิดปกติที่เกิดจาก mutation ของยีน CYP19A1 ที่สัมพันธ์กับการสร้างเอนไซม์ aromatase ซึ่งเอนไซม์นี้โดยปกติจะมีหน้าที่เปลี่ยน androgen ไปเป็น estrogen ดังนั้นถ้าเกิดความผิดปกติดังกล่าวส่งผลให้ไม่มีการทำงานของ aromatase ส่งผลให้ androgen เปลี่ยนไปเป็น estrogen ไม่ได้ ทำให้เกิดภาวะ androgen ที่คั่งมากเกินไปในกระแสเลือด fetus ที่เป็นโรคนี้ ส่งผลให้ androgenที่สูงใน fetal circulation ไหลท้นเข้าสู่ placental circulation แต่เนื่องจาก placenta ไม่มี aromatase enzyme เช่นกัน ดังนั้น androgen จะไหลเข้าสู่ maternal circulation เกิดลักษณะของความเป็นบุรุษเพศในแม่ที่กำลังตั้งครรภ์อยู่ ( maternal virilization during pregnancy ) (2)
ทารกที่เป็นโรคนี้จะตรวจพบ clitoromegaly , ambiguous genitalia มาด้วยปัญหา primary amenorrhea , ไม่มีการพัฒนาของเต้านมเกิดขึ้น และจะมีลักษณะของบุรุษเพศ ( virilization ) มากขึ้นในภายหลัง (1, 2)
Galactosemia
เป็นสาเหตุของ premature ovarian insufficiency ที่พบได้น้อยมากๆ ถ่ายทอดทางพันธุกรรมแบบ autosomal recessive เกิดจากความผิดปกติของการเมตาบอลิซึมของกลูโคลส โดยมีความผิดปกติของเอนไซม์ในกระบวณการเมตาบอลิซึมของกลูโคลส คือ Galactose-1-Phosphate Uridylyltransferase (GALT) ผู้ป่วยโรคนี้จะมีเอนไซม์ GALT น้อยกว่าปกติ (2)
ผู้ป่วยจะมีอาการตั้งแต่ช่วงแรกเกิด หลังจากได้รับประทาน cow milk feeding จะมี jaundice , vomiting, failure to thrive ผลจาก galactose metabolite ที่ไม่สมบูรณ์ สารดังกล่าวจะเป็นพิษต่อ germ cell จะรบกวนกระบวนการ germ cell migration และ gonadal survival ผู้ป่วยจะมี primordial follicle เหลือเพียงเล็กน้อยเท่านั้น ส่งผลให้เกิดภาวะ premature ovarian insufficiency ตามมา(1, 3)
ภาวะไม่มีระดู ผู้ป่วยไม่มีพัฒนาการของเต้านมและไม่มีมดลูก
กลุ่มผู้ป่วยนี้จะพบได้น้อยมาก สาเหตุที่เป็นได้เช่น ผู้ป่วยมี genotype 46 XY และมีความผิดปกติของเอนไซม์ในการสังเคราะห์ฮอร์โมนเพศ เช่น P450SCC deficiency หรือ 17 alpha-hydroxylase และ 17,20 Lyase deficiency ผู้ป่วยกลุ่มนี้จะไม่มีมดลูกเนื่องจากว่า มีโครโมโซม Y ที่มี SRY gene ที่ทำงานได้ปกติทำให้ gonad เจริญเติบโตไป testes และสร้าง anti Mullerian hormone ไปยับยั้งการสร้าง Mullerian structure
ส่วนสาเหตุอื่นของความผิดปกติในกลุ่มนี้ คือ โรค 5- alpha reductase deficiency (3)
- 5- alpha reductase deficiency
เป็นผู้ป่วยที่ genotype 46 XY ที่มีความผิดปกติในการสร้างเอนไซม์ 5- alpha reductase deficiency เมื่อขาดเอนไซม์ดังกล่าว testosterone จะไม่ถูกเสริมฤทธิ์จาก 5- alpha reductase deficiency ส่งผลให้ไม่สามารถ masculinize external genitalia ให้เป็นแบบผู้ชายได้สมบูรณ์ แต่ว่าด้วยผลของ testosterone ที่มีฤทธิ์ masculinization ได้เพียงเล็กน้อยจะส่งผลให้มี ambiguous genitalia (1)
ผู้ป่วยจะมีลักษณะภายนอกเป็นผู้หญิง เป็น male pseudohermaphrodites ประเภทหนึ่ง AMH จาก testes จะหลั่งออกมาเพื่อยับยั้งการเจริญเติบโตของ Mullerian duct ทำให้ไม่มีระบบท่อสืบพันธุ์ของเพศหญิง ไม่มีมดลูก testosterone ของผู้ป่วยยังสามารถทำงานได้ตามปกติ จะไปกระตุ้นการเจริญเติบโตของ Wolffian duct ทำให้ระบบท่อสืบพันธุ์เป็นแบบเพศชาย (1)
ลักษณะภายนอกของผู้ป่วยจะเป็นผู้หญิงที่มีภาวะ virilization มีการเจริญเติบโตของขนตามตัวแบบเพศชาย
( male hair growth pattern ) มีการพัฒนาของกล้ามเนื้อแบบผู้ชาย เสียงทุ้มต่ำ เต้านมเจริญเติบโตได้ไม่ดี ลักษณะดังกล่าวต้องวินิจฉัยแยกโรคจาก incomplete androgen insensitivity ที่จะสามารถมีลักษณะของบุรุษเพศในช่วงหลัง puberty ได้ โดยสามารถแยกจากกันได้โดยในผู้ป่วย 5- alpha reductase deficiency จะไม่มีพัฒนาการของเต้านมเหมือนในผู้ป่วย incomplete androgen insensitivity เนื่องจาก ในผู้ป่วย incomplete androgen insensitivity syndrome นั้น testosterone จะมี peripheral conversion เปลี่ยนเป็น Estrogen ทำให้เกิดพัฒนาการของเต้านมได้ (1)
เอกสารอ้างอิง
- Taylor HS, Fritz MA, Pal L, Seli E. Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition ed. Philadelphia, PA: Wolters Kluwer Philadelphia, PA; 2020.
- Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition ed. Philadelphia: Wolters Kluwer Philadelphia; 2020.
- ธีระ ทองสง นรีเวชวิทยา ฉบับสอบบอร์ด เชียงใหม่: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่; 2016.
- Management of Acute Obstructive Uterovaginal Anomalies: ACOG Committee Opinion, Number 779. Obstet Gynecol. 2019;133(6):e363-e71.
- Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.
- ACOG Committee Opinion No. 728: Müllerian Agenesis: Diagnosis, Management, And Treatment. Obstet Gynecol. 2018;131(1):e35-e42.
- Thompson JD, Rock JA, Te Linde RW, Mattingly RF. Te Linde’s operative gynecology. 7th ed. Philadelphia: Lippincott Philadelphia; 1992.