Hereditary gynecologic cancer
กลุ่มอาการมะเร็งทางนรีเวชที่ถ่ายทอดทางพันธุกรรม
แพทย์หญิงชญานิษฐ์ คุณานุกุลวัฒนา
ผู้ช่วยศาสตราจารย์นายแพทย์ฉลอง ชีวเกรียงไกร
บทนำ (Introduction)
กลุ่มอาการมะเร็งทางนรีเวชที่ถ่ายทอดทางพันธุกรรม (Hereditary gynecologic cancer)
มีสาเหตุมาจากการกลายพันธุ์ของยีนแต่กำเนิด (germline mutations) ส่งผ่านมาทางพันธุกรรม ถ่ายทอดจากพ่อแม่สู่ลูก โดยมักถ่ายทอดผ่านยีนเด่น (Autosomal dominant) และทำให้เกิดโรคมะเร็งได้ในขณะที่อายุยังน้อย ซึ่งผู้ที่มีความผิดปกติของยีนที่แสดงออกของกลุ่มอาการเหล่านี้จะเพิ่มความเสี่ยงในการเกิดมะเร็งได้มากขึ้น 6 – 60 เท่า เมื่อเทียบกับคนปกติ 1 หลักการสำคัญที่จะป้องกันการเกิดโรคมะเร็งที่ถ่ายทอดทางพันธุกรรมได้คือ การประเมินหาความเสี่ยงในผู้ที่มียีนกลายพันธ์และบุคคลในครอบครัวซึ่งมีโอกาสเสี่ยงสูงที่จะเกิดโรคมะเร็ง เพื่อส่งต่อให้พบกับผู้เชี่ยวชาญด้านมะเร็งพันธุศาสตร์เพื่อประเมินความเสี่ยง ให้ความรู้และปรึกษาแนวทางการป้องกัน 2
กลุ่มอาการมะเร็งทางนรีเวชที่ถ่ายทอดทางพันธุกรรมที่พบได้บ่อย ได้แก่ Hereditary breast and ovarian cancer syndrome, Lynch syndrome, Cowden syndrome, Peutz-Jeghers syndrome, Li-Fraumeni syndrome
ยีนและโครโมโซมที่เกิดการกลายพันธุ์ และกลุ่มโรคมะเร็งที่สามารถเกิดขึ้นได้ แสดงไว้ตามตารางดังแนบ
| Syndrome | Gene | Chromosome | Predominant cancers |
| Hereditary breast/ovarian cancer | BRCA1
BRCA2 |
17q21
13q12 |
Breast, Ovary, Fallopian tube, Peritoneal, Pancreatic, Prostate |
| Lynch syndrome | MLH1
MSH2 MSH6 PMS2 EPCAM |
3p22.2
2p21-16 2p16 7p22 2p21 |
Colon, Endometrium, Ovary, Urinary tract |
| Cowden syndrome | PTEN | 10q23 | Breast, Thyroid, Endometrial |
| Li–Fraumeni syndrome | TP53 | 17p13 | Breast, Soft tissue sarcoma, Leukemia, Brain |
| Peutz–Jeghers syndrome | STK11 | 19p13 | Colon, Breast, Gastric, Ovarian SCTAT |
ทฤษฎี Knudson’s two-hit hypothesis
คือทฤษฎีที่อธิบายการเกิดมะเร็งที่ถ่ายทอดทางพันธุกรรม ผู้ป่วยที่มียีนผิดปกติที่ถ่ายทอดมาจากพ่อหรือแม่ จะมีความผิดปกติของยีน 1 allele จากทั้งหมด 2 allele ในทุกเซลล์ของร่างกายอยู่แล้วที่ได้รับการถ่ายทอดมาทางพันธุกรรม เรียกว่า 1st Hit และเมื่อมีปัจจัยอื่นๆ มากระตุ้นให้เกิดความผิดปกติของยีนอีก 1 allele หรือ 2nd Hit ก็จะทำให้มีการแสดงออกของโรคมะเร็งได้ ซึ่งเกิดขึ้นได้ง่ายกว่า และเร็วกว่าเมื่อเทียบกับคนปกติ โดยที่คนปกติที่ต้องมีปัจจัยมากระตุ้นให้เกิดความผิดปกติของยีนทั้ง 2 allele จึงจะเกิดโรคมะเร็งได้ ซึ่งเกิดขึ้นได้ยากกว่า และใช้ระยะเวลานานกว่าในการเกิดมะเร็ง 3
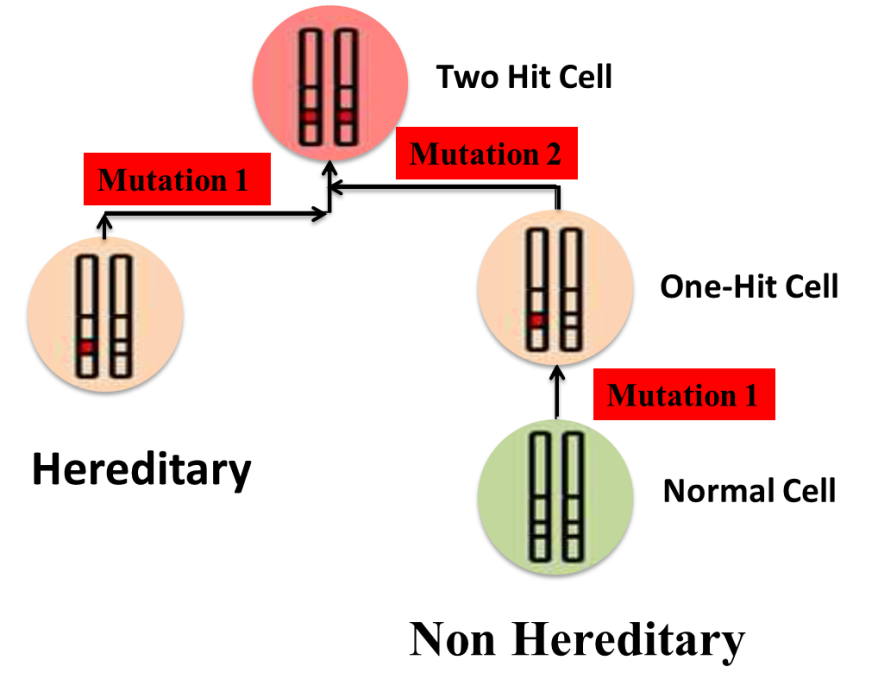
รูปที่ 1 แสดงถึงทฤษฎี Two-hit hypothesis 4
(ที่มา: Somaira N, Khaled A, Asef A, Alexandros GG. Breast Cancer- It’s All in the DNA. In: Mehmet G, editor. A Concise Review of Molecular Pathology of Breast Cancer. Rijeka: IntechOpen; 2015. p. Ch. 1.)
Hereditary Breast and Ovarian Cancer Syndrome (HBOCs)
Hereditary Breast and Ovarian Cancer Syndrome (HBOCs) คือกลุ่มโรคมะเร็งทางพันธุกรรมที่แสดงออกหลักโดยการเกิดโรคมะเร็งเต้านมหรือมะเร็งรังไข่ หรือสามารเกิดพร้อมกันทั้งคู่ โดย HBOCs เกิดจาก germline mutation ของยีน BRCA1 และ BRCA2 ซึ่งเป็น Tumor suppressor gene ทำหน้าที่สร้างโปรตีนที่เกี่ยวกับการซ่อมแซม DNA อุบัติการณ์ในการตรวจพบ HBOCs คือ 1:500 ในประชากรทั่วไป และ 1:40 ในประชากรที่มีเชื้อสาย Ashkenazi jewish
ในผู้ป่วยที่มี BRCA mutation พบว่ายังมีความเสี่ยงในการเกิดมะเร็งชนิดอื่นๆ ได้อีก เช่น
- มะเร็งต่อมลูกหมาก (Prostate cancer)
- มะเร็งตับอ่อน (Pancreatic cancer) พบว่ามีความเสี่ยงเพิ่มมากขึ้น 3 เท่า ใน BRCA2 carriers
- มะเร็งผิวหนัง ชนิด Melanoma
- มะเร็งโพรงมดลูก (Uterine cancer : Uterine papillary serous cancer) แต่ยังมีข้อมูลการศึกษาไม่แน่ชัด
ความเสี่ยงในการเกิดมะเร็งของผู้ป่วยที่มี BRCA gene mutation 5
| Gene | Breast cancer | Epithelial ovarian cancer | Pancreatic and other cancer |
| BRCA1 | Absolute risk > 60%
Male breast cancer Absolute risk 0.2-1.2% by age 70 y |
Absolute risk 39-58% | Pancreatic cancer
Absolute risk ≤ 5% Prostate cancer Absolute risk 7-26% |
| BRCA2 | Absolute risk: >60%
Male breast cancer Absolute risk 1.8-7.1% by age 70 y |
Absolute risk 13-29% | Pancreatic cancer
Absolute risk 5-10% Prostate cancer Absolute risk 19-61% |
ความเสี่ยงในการเกิดมะเร็งรังไข่ (Risk of ovarian cancer)
ความเสี่ยงในการเกิดมะเร็งรังไข่ ( Ovarian cancer ) รวมถึงมะเร็งท่อนำไข่ ( Fallopian tube cancer ) และมะเร็งปฐมภูมิของเยื่อบุช่องท้อง ( Primary peritoneal carcinoma ) เมื่ออายุ 70 ปี พบว่ามีโอกาสเกิดขึ้นได้ 39-46% ใน BRCA1 mutation และ 10-27% ใน BRCA2 mutation 6 โดยการเกิดมะเร็งรังไข่ในผู้ป่วย BRCA mutation พบว่าจะมีลักษณะทางพยาธิสภาพ ( Pathology ) ที่จำเพาะ ได้แก่ Serous, Endometrioid และ Clear cell cancer จากข้อมูลไม่พบว่ามีลักษณะทาง pathology ของ Mucinous และ Borderline ovarian tumor ในผู้ป่วย BRCA mutation 7
ความเสี่ยงในการเกิดมะเร็งเต้านม (Risk of Breast cancer)
ความเสี่ยงในการเกิดมะเร็งเต้านมเมื่ออายุ 70 ปี พบว่า เกิดขึ้นได้ประมาณ 45-85% และพบว่ายังมีความเสี่ยงที่จะเกิดมะเร็งรังไข่ตามมาได้ โดยความเสี่ยงในระยะเวลา 10 ปีหลังจากเป็นมะเร็งเต้านม ใน BRCA1 mutation คือ 12.7% และ 6.8% ใน BRCA2 mutation ลักษณะของมะเร็งเต้านมที่พบในผู้ป่วย BRCA mutation carrier พบว่า ใน BRCA1 mutation มักสัมพันธ์กับ Triple-negative breast cancer (ER, PR, HER2/neu : Negative) ซึ่งมีการพยากรณ์โรคที่แย่กว่า ER and PR positive breast cancer ที่พบใน BRCA2 mutation 8
การให้คำปรึกษาในการตรวจทางพันธุศาสตร์ (Genetic counseling)
การให้คำปรึกษาในการตรวจทางพันธุศาสตร์เพื่อตรวจหาการกลายพันธุ์ของยีนส์ BRCA1 และ BRCA2 แนะนำให้ตรวจในผู้หญิงทุกคนที่เป็นมะเร็งรังไข่ชนิด Epithelial และแนะนำเป็นรายบุคคลในรายที่มีประวัติเป็นมะเร็งเต้านม หรือมะเร็งรังไข่ รวมไปถึงคนที่มีประวัติคนในครอบครัวเป็นมะเร็งเต้านม หรือมะเร็งรังไข่
สำหรับผู้ที่ควรได้รับการให้คำปรึกษาในการตรวจทางพันธุศาสตร์ (Genetic testing) มีดังต่อไปนี้ 9
Women affected with ≥ 1 of the following
-
- Epithelial ovarian, tubal, or peritoneal cancer
- Breast cancer at age ≤ 45 years
- Breast cancer and have a close relative with breast cancer at age ≤ 50 years or close relative with epithelial ovarian, tubal, or peritoneal cancer at any age
- Breast cancer at age ≤ 50 years with limited or unknown family history
- Breast cancer and have ≥ 2 close relatives with breast cancer at any age
- Breast cancer and have ≥ 2 close relatives with pancreatic cancer or aggressive prostate cancer (Gleason score ≥ 7)
- Two breast cancer primaries, with first diagnosed before age 50 years
- Triple-negative breast cancer at age ≤ 60 years
- Breast cancer and Ashkenazi Jewish ancestry at any age
- Pancreatic cancer and have ≥ 2 close relatives with breast cancer; ovarian, tubal, or peritoneal cancer; pancreatic cancer; or aggressive prostate cancer (Gleason score ≥ 7)
Women unaffected with cancer, but with ≥ 1 of the following
-
- 1st degree or several close relatives that meet ≥ 1 of the aforementioned criteria
- Close relative carrying known BRCA1 or BRCA2 mutation
- Close relative with male breast cancer
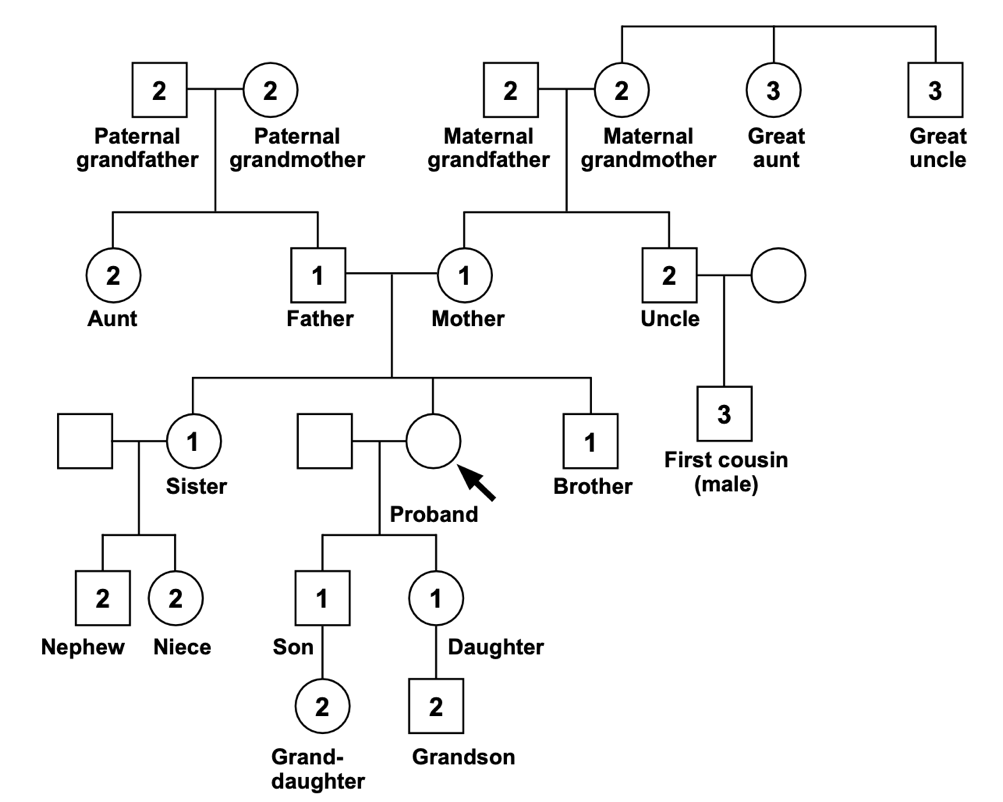
รูปที่ 2 แสดงถึงการเรียงลำดับพงศาวลี (Pedigree) 5
ญาติสายตรงลำดับที่ 1 (1st degree relatives) หมายถึง พ่อ แม่ พี่ น้อง และลูก
ญาติสายตรงลำดับที่ 2 (2nd degree relatives) หมายถึง ปู่ ย่า ตา ยาย พี่น้องของพ่อและแม่ (ลุง ป้า น้า อา) หลาน
ญาติสายตรงลำดับที่ 3 (3rd degree relatives) หมายถึง ลูกพี่ลูกน้อง และพี่น้องของปู่ ย่า ตา ยาย
(ที่มา: Daly MB, Pal T, Berry MP, Buys SS, Dickson P, Domchek SM, et al. Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2021;19(1):77-102.)
การให้คำปรึกษาก่อนเข้ารับการตรวจทางพันธุศาสตร์ (Pretest genetic counseling)
- การเรียงลำดับพงศาวลี (Detailed pedigree)
- การประเมินความเสี่ยงของสมาชิกในครอบครัว เพื่อหาว่าบุคคลใดที่ควรเข้ารับการตรวจทางพันธุศาสตร์ (Risk assessment)
- การแจ้งข้อมูลให้ผู้ป่วยทราบก่อนเข้ารับการตรวจ (Informed consent) ได้แก่ ข้อมูลความรู้เบื้องต้น ข้อดี ข้อเสียและข้อจำกัดของการตรวจ รวมไปถึงผลการตรวจว่าจะแปลผลออกมาในรูปแบบใดได้บ้าง เพื่อที่จะได้วางแผนการจัดการต่อไป รวมไปถึงการแจ้งผลที่อาจจะกระทบได้ต่อสมาชิกในครอบครัว
การให้คำปรึกษาหลังจากเข้ารับการตรวจทางพันธุศาสตร์ (Posttest genetic counseling)
แจ้งผลการตรวจ การแปลผล (Results) ให้คำปรึกษาแนวทางการจัดการ (Management options) เช่น การเข้ารับการตรวจคัดกรองอย่างเคร่งครัด (Intensive screening) หรือการจัดการเพื่อลดความเสี่ยงในการเกิดมะเร็ง (Risk reduction interventions) รวมไปถึงการพูดคุยเกี่ยวกับการแจ้งสมาชิกในครอบครัวที่มีความเสี่ยง เพื่อให้คำปรึกษาในการเข้ารับการตรวจเพิ่มเติม และสิ่งสำคัญอีกอย่างคือการประเมินสภาพจิตใจของผู้ที่เข้ารับการตรวจทางพันธุศาสตร์ในแต่ละคน หลังจากที่ได้รับการแจ้งผลการตรวจ 2
การตรวจคัดกรอง (Screening)
การตรวจคัดกรองมะเร็งเต้านม (Breast cancer screening) 5
ผู้หญิงที่ตรวจพบว่ามีการกลายพันธุ์ของยีน BRCA1 และ BRCA2 แนะนำให้ตรวจคัดกรองดังนี้
1. ตรวจเต้านมด้วยตนเองเป็นประจำทุกเดือน เริ่มตั้งแต่อายุ 18 ปี
2. ช่วงอายุ 25-29 ปี
- เข้ารับการตรวจเต้านมโดยแพทย์ทุก 6-12 เดือน
- เข้ารับการตรวจเต้านมด้วย MRI with contrast หรือ Mammogram ทุกปี โดย MRI with contrast จะมี Sensitivity และ Specificity ที่ดีกว่าการใช้ Mammogram (Sensitivity 92%, Specificity 87%) แต่หากไม่สามารถเข้ารับการตรวจได้สามารถใช้การตรวจ Mammogram คัดกรองแทนได้
3. ช่วงอายุ 30-75 ปี
- แนะนำให้เข้ารับการตรวจทั้ง MRI with contrast และ Mammogram ทุกปี
4. ช่วงอายุมากกว่า 75 ปี
- แนะนำให้เข้ารับวิธีการผ่าตัด เพื่อป้องกันการเกิดโรคมะเร็ง
ผู้ชายที่ตรวจพบว่ามีการกลายพันธุ์ของยีน BRCA1 และ BRCA2 แนะนำให้ตรวจคัดกรองดังนี้
เริ่มตั้งแต่อายุ 35 ปี
- ตรวจเต้านมด้วยตนเองเป็นประจำทุกเดือน
- เข้ารับการตรวจเต้านมโดยแพทย์ทุกปี
- เข้ารับการตรวจเต้านมด้วย Mammogram ทุกปี เริ่มที่อายุ 50 ปี หรือ 10 ปีก่อนหน้าของอายุผู้ชายในครอบครัวที่เป็นมะเร็งเต้านม โดยใช้อายุที่ถึงก่อนเป็นหลัก
การตรวจคัดกรองมะเร็งรังไข่และท่อนำไข่ (Ovary and fallopian tube cancer screening)
ยังไม่มีคำแนะนำในการใช้ การตรวจคัดกรองด้วยวิธีตรวจสารชีวเคมี CA-125 หรือการตรวจอัลตราซาวน์ผ่านทางช่องคลอด ให้เป็นการตรวจคัดกรองมะเร็งรังไข่และท่อนำไข่ในผู้ที่มียีน BRCA mutation เนื่องจากการศึกษาพบว่าไม่สัมพันธ์กับการเพิ่ม Survival rate หรือลด Mortality rate 10
ถึงแม้ว่าจะไม่มีข้อมูลประโยชน์แน่ชัด แต่มีคำแนะนำให้ทำการตรวจสารชีวเคมี CA-125 ร่วมกับการตรวจอัลตราซาวน์ผ่านทางช่องคลอด ทุก 6 เดือน ในผู้ที่มียีน BRCA mutation ที่ยังไม่ได้เข้ารับการผ่าตัด โดยให้เริ่มทำในช่วงที่อายุเข้าเกณฑ์ผ่าตัด เป็นการคัดกรองเบื้องต้นไปจนกระทั่งเข้ารับการผ่าตัด โดยต้องทำอัลตราซาวน์ด้วยแพทย์ผู้เชี่ยวชาญด้านการอัลตราซาวน์เท่านั้น 11
Risk reducing agents (การลดความเสี่ยงด้วยการใช้ยา)
มะเร็งรังไข่และท่อนำไข่ (Ovary and fallopian tube cancer)
การใช้ยาคุมกำเนิด (Oral contraceptive pills) ช่วยลดโอการเกิดมะเร็งรังไข่ได้มาก ในผู้หญิงที่มีการกลายพันธุ์ของยีน BRCA1, BRCA2 สัมพันธ์กับระยะเวลาที่ใช้ยา โดยพบว่า ยิ่งใช้ยาเป็นระยะเวลานาน จะยิ่งช่วยลดโอกาสในการเกิดมะเร็งได้ จากการศึกษาพบว่าการใช้ยาคุมกำเนิดระยะเวลาทุก 10 ปี สามารถช่วยลดการเกิดมะเร็งรังไข่ได้ 36% โดยไม่ได้เพิ่มความเสี่ยงในการเกิดมะเร็งเต้านมให้สูงขึ้น 1
มะเร็งเต้านม (Breast cancer)
Tamoxifen and raloxifene (SERM) ลดโอกาสในการเกิดมะเร็งเต้านมที่มี Estrogen receptor positive ซึ่งพบมากใน BRCA2 mutation (65-80%) พบได้น้อยใน BRCA1 mutation (10-25%) ทำให้ผลลัพธ์ในการลดความเสี่ยงการเกิดมะเร็งเต้านมดีกว่า ใน BRCA2 mutation และ Tamoxifen ยังช่วยลดโอกาสการเกิดมะเร็งเต้านมในอีกข้างด้วย โดยสามารถลดความเสี่ยงลงได้ 45-60% โดยพบว่าในผู้ป่วยที่เป็น BRCA associated breast cancer มีโอกาสในการการเกิดมะเร็งเต้านมอีกข้าง ในระยะเวลา 10 ปี คือ 40% และตลอดชีวิตคือ 83% ใน BRCA1 mutation และ 62% ใน BRCA2 mutation และเมื่อเทียบกันระหว่าง Tamoxifen และ Raloxifene พบว่า Tamoxifen มีความสามารถในการลดความเสี่ยงได้ดีกว่าการใช้ Raloxifene 1
ผลข้างเคียงจากการใช้ยา 12
| Tamoxifen | Raloxifene |
| Vasomotor symptoms | Vasomotor symptoms |
| Vaginal symptoms (discharge, itching, dryness, and dyspareunia) | Leg cramps |
| Thromboembolic events | Dyspareunia |
| Endometrial cancer | Weight gain |
Exemestane (Aromatase inhibitor)
พบว่าช่วยป้องกันการเกิดมะเร็งเต้านมในผู้หญิงที่อยู่ในวัยหมดประจำเดือน และสามารถช่วยลดโอการเกิดมะเร็งเต้านมในเต้านมอีกข้างนึง สำหรับผู้ป่วยมะเร็งเต้านมที่มีการกลายพันธุ์ของยีน BRCA1, BRCA2 แต่จากการศึกษายังมีข้อมูลไม่มากพอในการสนับสนุน 5
Risk reducing surgery (การลดความเสี่ยงด้วยการผ่าตัด)
Bilateral Salpingo-Oophorectomy
การผ่าตัดรังไข่และท่อนำไข่สามารถช่วยลดโอกาสในการเกิดโรคมะเร็งทางนรีเวชได้ประมาณ 80% 13 และช่วยลดโอกาสในการเกิดมะเร็งเต้านมได้ 68% 14 และป้องกันไม่ให้เกิดมะเร็งรังไข่ในผู้ป่วยมะเร็งเต้านมที่มีการกลายพันธุ์ของยีน BRCA ได้ สำหรับการผ่าตัด หากทำในช่วงเวลาที่ยังไม่เข้าสู่วัยหมดประจำเดือน สามารถช่วยลดโอกาสในการเกิดมะเร็งเต้านมที่มี Estrogen receptor positive ได้ ซึ่งส่วนมากพบในผู้ป่วยที่มีการกลายพันธุ์ของยีน BRCA2
สำหรับช่วงอายุที่เหมาะสมในการผ่าตัดคือ หลังจากที่มีบุตรเพียงพอแล้ว หรือช่วงอายุ 35 – 40 ปี ใน BRCA1 mutation carrier แต่ใน BRCA2 mutation carrier สามารถรอได้จนถึงช่วงอายุ 40 – 45 ปี เนื่องจากพบว่า โอกาสในการเกิดมะเร็งรังไข่ก่อนอายุ 50 ปี ใน BRCA1 mutation carrier คือ 10-21% และใน BRCA2 mutation carrier คือ 2-3% 5 และอุบัติการณ์สูงสุดในการเกิดมะเร็งรังไข่ใน BRCA1 mutation carrier คือช่วงอายุ 50 – 59 ปี และ อายุ 60 – 69 ปี ใน BRCA2 mutation carrier
บทบาทของการผ่าตัดท่อนำไข่เพียงอย่างเดียว (Salpingectomy) ยังไม่ได้เป็นที่แนะนำ เนื่องจากไม่มีผลช่วยลดการเกิดมะเร็งเต้านม แต่การผ่าตัดท่อนำไข่ออกเพียงอย่างเดียวก่อนแล้วค่อยผ่าตัดรังไข่อีกครั้งอาจจะพิจารณาได้ในรายที่ยังไม่เข้าสู่วัยหมดประจำเดือน 8
อาการไม่พึงประสงค์จากการผ่าตัด (Adverse effects) 10
– Early menopause : Vasomotor symptoms, Decreased sexual function
– Surgery complications : Wound infection. Bladder perforation, Small bowel obstructionม Uterine perforation
Bilateral Mastectomy
การผ่าตัดเต้านมช่วยลดความเสี่ยงในการเกิดมะเร็งเต้านมได้ 90% แต่เนื่องจากการผ่าตัดเต้านมอาจจะมีผลกระทบต่อสภาพร่างกายและจิตใจได้ เช่น การมีความคิดติดลบต่อรูปลักษณ์ของตัวเอง ความพึงพอใจทางเพศลดลง การผ่าตัดเสริมเต้านมจึงเป็นอีกทางเลือกนึงให้แก่ผู้ป่วยเพื่อช่วยลดผลกระทบ 15
อาการไม่พึงประสงค์จากการผ่าตัด (Adverse effects) 10
– อาการไม่พึ่งประสงค์ระยะสั้น พบได้ 3 – 59% ได้แก่ อาการที่เกิดขึ้นหลังจากการผ่าตัดได้ เช่น การติดเชื้อ การคั่งของก้อนเลือด และเนื้อเยื่อขาดเลือดหลังการผ่าตัด (Flap necrosis)
– อาการไม่พึงประสงค์ระยะยาว พบได้ 64 – 87% ได้แก่ ความรู้สึกปวด ชา ติดเชื้อ และบวม
การผ่าตัดเต้านมอีกข้างเพื่อป้องกันการเกิดมะเร็งเต้านมซ้ำ (Contralateral prophylactic mastectomy) ในผู้ป่วยมะเร็งเต้านมที่มีการกลายพันธุ์ของยีน BRCA ถือเป็นข้อแนะนำ เนื่องจากโอกาสเสี่ยงใน 20 ปี ที่จะเกิดการเป็นมะเร็งซ้ำในเต้านมอีกข้าง สำหรับ BRCA1 mutation carriers คือ 40% และ 26% ใน BRCA2 mutation carriers โดยความเสี่ยงจะสัมพันธ์กับอายุที่วินิจฉัยว่าเป็นมะเร็งเต้านม โดยความเสี่ยงจะเพิ่มสูงขึ้นหากวินิจฉัยมะเร็งเต้านมเมื่ออายุน้อยกว่า 40 ปี 16
Lynch syndrome
เกิดจาก germline mutation ของยีนส์ MLH1, MSH2, MSH6, PMS2 ทำให้เพิ่มความเสี่ยงในการเกิดมะเร็งลำไส้ได้ โดยความเสี่ยงตลอดชีวิตของผู้หญิงที่มียีนกลายพันธุ์นี้ คือ 40 – 60% และ 80% ในผู้ชาย 17 และในผู้หญิงจะเพิ่มความเสี่ยงต่อการเกิดมะเร็งโพรงมดลูกได้อีก 40 – 60% และความเสี่ยงในการเกิดมะเร็งรังไข่ 5 – 10% รวมไปถึงความเสี่ยงในการเกิดมะเร็งอื่นๆ เช่น กระเพาะอาหาร ลำไส้เล็ก กรวยไต ท่อไต และสมอง เป็นต้น 1
ในอุบัติการณ์การเกิดมะเร็งโรงมดลูกทั้งหมดนั้น พบว่าเป็น Lynch syndrome ได้ประมาณ 2.3% และในผู้ป่วย Lynch syndrome จะมีโอกาสเกิดมะเร็งโพรงมดลูกในช่วงอายุที่ต่ำกว่าคนปกติทั่วไป คือ ช่วงอายุประมาณ 47 ปี และสำหรับ Lynch syndrome จะเพิ่มความเสี่ยงในการเกิดมะเร็ง 2 ชนิดในช่วงเวลาเดียวกัน โดยตรวจพบอีกชนิดภายใน 6 เดือนหลังจากพบชนิดแรก (Synchronous cancer) หรือ หลังจาก 6 เดือนที่พบชนิดแรก (Metachronous cancer) ก็ได้ พบว่า 51% จะตรวจพบมะเร็งทางนรีเวชก่อน และ 49% ที่ตรวจพบมะเร็งลำไส้ก่อน 18
การประเมินความเสี่ยง (Risk assessment) 1
การประเมินหาความเสี่ยง Lynch syndrome จะใช้ Bethesda guideline 2004 โดยพบว่าผู้ที่มีความเสี่ยงเข้าเกณฑ์ดังต่อไปนี้ ควรส่งตรวจเพื่อหาความผิดปกติของยีน
| 2004 Bethesda Guidelines
(Modified to include Endometrial cancer as sentinel cancer) |
|
การตรวจคัดกรอง (Screening) 5
ในผู้หญิงที่เป็น Lynch syndrome แนะนำให้ตรวจคัดกรองดังนี้
1. ตรวจด้วยวิธีการส่องกล้องตรวจลำไส้ใหญ่ (Colonoscopy) ทุก 1-2 ปี
- เริ่มที่อายุ 20-25 ปี หรือ 2-5 ปีก่อนอายุของสมาชิกในครอบครัวที่ถูกวินิจฉัยว่าเป็นมะเร็ง
2. เก็บชิ้นเนื้อโพรงมดลูกเพื่อส่งตรวจ (Endometrial biopsy) ทุก 1-2 ปี
- เริ่มที่อายุ 30-35 ปี
3. บันทึกรอบประจำเดือนอย่างสม่ำเสมอ เฝ้าระวังภาวะเลือดออกผิดปกติ
สำหรับการตรวจคัดกรองมะเร็งลำไส้ในประชากรปกติ พบว่าในกลุ่มที่จัดว่าเป็นความเสี่ยงระดับปานกลาง คือ
- Age ≥45 years
- No personal history of adenoma or sessile serrated polyp/sessile serrated lesion (SSP/SSL)
- No personal history of inflammatory bowel disease (IBD)
- No personal history of high-risk CRC genetic syndromes
- No personal history of cystic fibrosis
- No personal history of childhood cancer
- Negative family history for confirmed advanced adenoma (ie, high-grade dysplasia, ≥1 cm, villous or tubulovillous histology) or an advanced SSP/SSL (≥1 cm, any dysplasia) in 1st-degree relatives
- Negative family history for CRC in 1st, 2nd, or 3rd-degree relatives
ควรได้รับการตรวจคัดกรองด้วยวิธีการส่องกล้องตรวจลำไส้ใหญ่ (Colonoscopy) ทุก 10 ปี ไปจนถึงอายุ 75 ปี 19
การป้องกัน (Prevention)
การป้องกันโดยใช้ยา (Chemoprevention) 20
การใช้ยาเพื่อป้องกันไม่ให้เกิดภาวะผนังเยื่อบุโพรงมดลูกหนาตัว โดยใช้
- 150-mg depot medroxyprogesterone acetate
- 30-micrograms ethinyl estradiol/0.3-mg norgestrel OCP
สำหรับ Levonorgestrel intrauterine device ยังอยู่ในระหว่างการศึกษาข้อมูลอยู่
การป้องกันโดยการผ่าตัด (Risk reducing surgery)
การผ่าตัดมดลูกและรังไข่ (Hysterectomy and bilateral salpingo-oophorectomy) สามารถทำในช่วงอายุที่มีบุตรเพียงพอแล้ว เนื่องจากอุบัติการณ์ในการเกิดมะเร็งเมื่ออายุ 40 ปี สำหรับมะเร็งโพรงมดลูกคือ < 2% และ มะเร็งรังไข่ < 1% 17 โดยจากการศึกษาพบว่าการผ่าตัดมดลูกและรังไข่ออกจะทำให้เสียค่าใช้จ่ายน้อยที่สุดและเพิ่มคุณภาพชีวิตที่เหลืออยู่ได้มากกว่า 21
Cowden syndrome
เกิดจาก germline mutation ของยีนส์ PTEN ที่ควบคุมเกี่ยวกับวงจรการทำงานของเซลล์ อุบัติการณ์พบได้ 1 : 200,000 ทำให้มีความเสี่ยงในการเกิดทั้งเนื้องอกและมะเร็งได้ เช่น ติ่งเนื้อในลำไส้ โรคไทรอยด์ แผลที่เยื่อบุผิว (mucocutaneous lesions) และมะเร็งเต้านม มะเร็งไทรอยด์ มะเร็งลำไส้ใหญ่และมะเร็งโพรงมดลูก ความเสี่ยงในการเกิดมะเร็งโพรงมดลูกคือ 19 – 28% 22 แนะนำให้เฝ้าระวังและรีบทำการตรวจหาสาเหตุ หากมีภาวะเลือดออกผิดปกติจากช่องคลอด สำหรับบทบาทของการอัลตราซาวน์และการตัดชิ้นเนื้อโพรงมดลูกตรวจ ยังไม่มีข้อมูลสนับสนุนมากพอในขณะนี้ 5
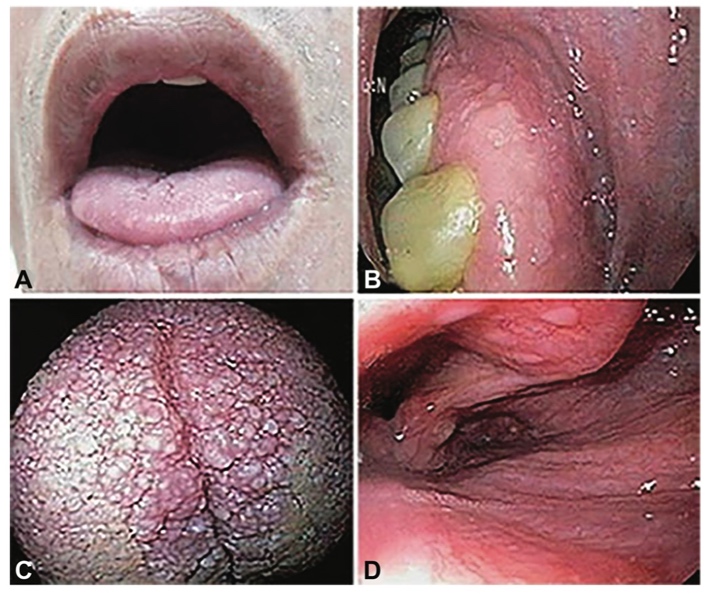
รูปที่ 3 แสดงถึงรอยโรคบริเวณเยื่อบุผิวบริเวณที่ต่างๆที่มีความจำเพาะต่อ Cowden syndrome 2
(Pathognomonic mucocutaneous lesions)
A : รอยโรคที่มีสีน้ำตาลเข้มถึงดำที่บริเวณริมฝีปาก (Black and dark brown pigmentation on lips)
B : รอยโรคตุ่มนูนบริเวณเหงือกในช่องปาก (Papillomas on gingiva)
C : รอยโรคบริเวณลิ้น (Papillomas with cobblestone appearance on tongue)
D : รอยโรคบริเวณฝาปิดกล่องเสียง (Whitish papillomas on epiglottis)
(ที่มา: Hereditary Cancer Syndromes and Risk Assessment: ACOG COMMITTEE OPINION, Number 793. Obstet Gynecol. 2019;134(6):e143-e9.)
LI-FRAUMENI SYNDROME
เกิดจาก germline mutation ของยีนส์ TP53 ทำให้เกิดมะเร็งเต้านมเมื่ออายุน้อยได้ มะเร็งเนื้อเยื่ออ่อน (Soft tissue sarcoma) มะเร็งกระดูก (Bone sarcoma) , เนื้องอกในสมองและต่อมหมวกไตชั้นนอก เป็นต้น 23
แนะนำให้ทำการตรวจคัดกรองด้วย MRI Breast โดยเริ่มตั้งแต่อายุ 20-25 ปี แต่ยังไม่มีคำแนะนำในการตรวจคัดกรองมะเร็งทางนรีเวช 1
PEUTZ-JEGHERS SYNDROME
เกิดจาก germline mutation ของยีนส์ STK11 ผู้ป่วยมักมีอาการแสดงของ ติ่งเนื้อในลำไส้ รอยโรคสีเข้มบริเวณริมฝีปากและในช่องปาก โดยมีความเสี่ยงในการเกิดมะเร็งลำไส้และมะเร็งเต้านมเพิ่มสูงขึ้น สำหรับความเสี่ยงในการเกิด เนื้องอกรังไข่ ชนิด Sex cord-stromal tumor with annular tubules (SCTAT) of ovary, มะเร็งปากมดลูก ( Adenoma malignum of cervix ) ซึ่งพบได้น้อย มีลักษณะเป็นก้อน cystic อยู่บริเวณ Endocervix มะเร็งชนิดนี้เป็นชนิดที่ดุร้าย และมี histology เป็นแบบ Well differentiate 24 สำหรับการตรวจคัดกรอง แนะนำให้ทำการตรวจคัดกรองมะเร็งปากมดลูก (Liquid-based cytology) ประจำปี โดยเริ่มตั้งแต่อายุ 25 ปีขึ้นไป 25
เอกสารอ้างอิง
- Chi DS, Berchuck A, Dizon DS, Yashar CM. Principles and practice of gynecologic oncology. Seventh edition ed. Philadelphia: Wolters Kluwer Health Philadelphia; 2017.
- Hereditary Cancer Syndromes and Risk Assessment: ACOG COMMITTEE OPINION, Number 793. Obstet Gynecol. 2019;134(6):e143-e9.
- Knudson AG, Jr. Mutation and cancer: statistical study of retinoblastoma. Proc Natl Acad Sci U S A. 1971;68(4):820-3.
- Somaira N, Khaled A, Asef A, Alexandros GG. Breast Cancer- It’s All in the DNA. In: Mehmet G, editor. A Concise Review of Molecular Pathology of Breast Cancer. Rijeka: IntechOpen; 2015. p. Ch. 1.
- Daly MB, Pal T, Berry MP, Buys SS, Dickson P, Domchek SM, et al. Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2021;19(1):77-102.
- Antoniou A, Pharoah PD, Narod S, Risch HA, Eyfjord JE, Hopper JL, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 2003;72(5):1117-30.
- Lakhani SR, Manek S, Penault-Llorca F, Flanagan A, Arnout L, Merrett S, et al. Pathology of ovarian cancers in BRCA1 and BRCA2 carriers. Clin Cancer Res. 2004;10(7):2473-81.
- Practice Bulletin No 182: Hereditary Breast and Ovarian Cancer Syndrome. Obstet Gynecol. 2017;130(3):e110-e26.
- Lancaster JM, Powell CB, Chen LM, Richardson DL. Society of Gynecologic Oncology statement on risk assessment for inherited gynecologic cancer predispositions. Gynecol Oncol. 2015;136(1):3-7.
- Nelson HD, Fu R, Goddard K, Mitchell JP, Okinaka-Hu L, Pappas M, et al. U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews. Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer: Systematic Review to Update the US Preventive Services Task Force Recommendation. Rockville (MD): Agency for Healthcare Research and Quality (US); 2013.
- Sessa C, Balmaña J, Bober SL, Cardoso MJ, Colombo N, Curigliano G, et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Ann Oncol. 2023;34(1):33-47.
- Warner E, Plewes DB, Hill KA, Causer PA, Zubovits JT, Jong RA, et al. Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination. Jama. 2004;292(11):1317-25.
- Rebbeck TR, Kauff ND, Domchek SM. Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl Cancer Inst. 2009;101(2):80-7.
- Kauff ND, Domchek SM, Friebel TM, Robson ME, Lee J, Garber JE, et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol. 2008;26(8):1331-7.
- Meijers-Heijboer H, van Geel B, van Putten WL, Henzen-Logmans SC, Seynaeve C, Menke-Pluymers MB, et al. Breast cancer after prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med. 2001;345(3):159-64.
- 16. Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips KA, Mooij TM, Roos-Blom MJ, et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. Jama. 2017;317(23):2402-16.
- Bonadona V, Bonaïti B, Olschwang S, Grandjouan S, Huiart L, Longy M, et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. Jama. 2011;305(22):2304-10.
- Lu KH, Dinh M, Kohlmann W, Watson P, Green J, Syngal S, et al. Gynecologic cancer as a “sentinel cancer” for women with hereditary nonpolyposis colorectal cancer syndrome. Obstet Gynecol. 2005;105(3):569-74.
- Benson AB, Venook AP, Al-Hawary MM, Azad N, Chen YJ, Ciombor KK, et al. Rectal Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022;20(10):1139-67.
- Lu KH, Loose DS, Yates MS, Nogueras-Gonzalez GM, Munsell MF, Chen LM, et al. Prospective multicenter randomized intermediate biomarker study of oral contraceptive versus depo-provera for prevention of endometrial cancer in women with Lynch syndrome. Cancer Prev Res (Phila). 2013;6(8):774-81.
- Yang KY, Caughey AB, Little SE, Cheung MK, Chen LM. A cost-effectiveness analysis of prophylactic surgery versus gynecologic surveillance for women from hereditary non-polyposis colorectal cancer (HNPCC) Families. Fam Cancer. 2011;10(3):535-43.
- Tan MH, Mester JL, Ngeow J, Rybicki LA, Orloff MS, Eng C. Lifetime cancer risks in individuals with germline PTEN mutations. Clin Cancer Res. 2012;18(2):400-7.
- McBride KA, Ballinger ML, Killick E, Kirk J, Tattersall MH, Eeles RA, et al. Li-Fraumeni syndrome: cancer risk assessment and clinical management. Nat Rev Clin Oncol. 2014;11(5):260-71.
- Young RH, Welch WR, Dickersin GR, Scully RE. Ovarian sex cord tumor with annular tubules: review of 74 cases including 27 with Peutz-Jeghers syndrome and four with adenoma malignum of the cervix. Cancer. 1982;50(7):1384-402.
- Beggs AD, Latchford AR, Vasen HF, Moslein G, Alonso A, Aretz S, et al. Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut. 2010;59(7):975-86.

