Conception: Fertilization and early embryogenesis
นพ. อภินันท์ งามจำรัส
อาจารย์ที่ปรึกษา: ผศ. พญ. อุบล แสงอนันต์
การปฏิสนธิเป็นกระบวนการเริ่มแรกของชีวิต เป็นกระบวนการที่มีความซับซ้อนของการทำงานระหว่างอวัยวะสืบพันธุ์ สารเคมีและการเปลี่ยนแปลงระดับเซลล์ โดยเป้าประสงค์หลักเพื่อสร้างตัวอ่อนที่สมบูรณ์และมีความพร้อมในการพัฒนาเป็นทารกต่อไป ความผิดปกติในขั้นตอนต่าง ๆ แม้เพียงเล็กน้อยอาจส่งผลต่อโอกาสการมีบุตรหรือการตั้งครรภ์ที่ผิดปกติ ดังนั้นหากมีความเข้าใจถึงกระบวนการเหล่านี้และปัจจัยที่เกี่ยวข้อง ย่อมเป็นประโยชน์ต่อแพทย์ในการให้การดูแลหรือให้คำปรึกษาแก่ผู้ป่วยอย่างเหมาะสม
ตัวอ่อน (zygote) คือเซลล์ที่เกิดจากการปฏิสนธิระหว่างเซลล์สืบพันธุ์เพศชาย (อสุจิ) และเซลล์สืบพันธุ์หญิง(ไข่) โดยเซลล์สืบพันธุ์ของทั้งสองเพศมีความแตกต่างกันทั้งในแง่ของโครงสร้าง การทำงาน รวมถึงกระบวนการพัฒนา ความต่างเหล่านี้ล้วนส่งผลต่อกันตลอดกระบวนการปฏิสนธิ
การพัฒนาของเซลล์สืบพันธุ์
primordial germ cells (PGCs) ถือกำเนิดจากจาก yolk sac เดินทางผ่าน allantois เข้าไปในตัวอ่อน และแทรกเข้าไปสู่ genital ridge จากนั้นจึงจะพัฒนาไปเป็นต่อมเพศในอนาคต ทั้งหมดนี้เกิดในช่วงอายุครรภ์ประมาณ 4 – 6 สัปดาห์1
ขณะที่อายุครรภ์ 6 สัปดาห์ ต่อมเพศทั้งชายและหญิงจะมีลักษณะเหมือนกัน เรียกว่า indifferent gonads และจะเริ่มมีการแยกเป็นเพศชายและหญิง ตั้งแต่อายุครรภ์ 8 สัปดาห์จนสมบูรณ์ที่อายุครรภ์ 14 สัปดาห์ โดยการสร้างอัณฑะของเพศชายจะถูกกำหนดภายใต้อิทธิพลของ SRY gene บน Y chromosome ซึ่งหากไม่มี Y chromosome ต่อมเพศจะมีการพัฒนาการตาม default pathway ไปเป็นรังไข่โดยอัตโนมัติ
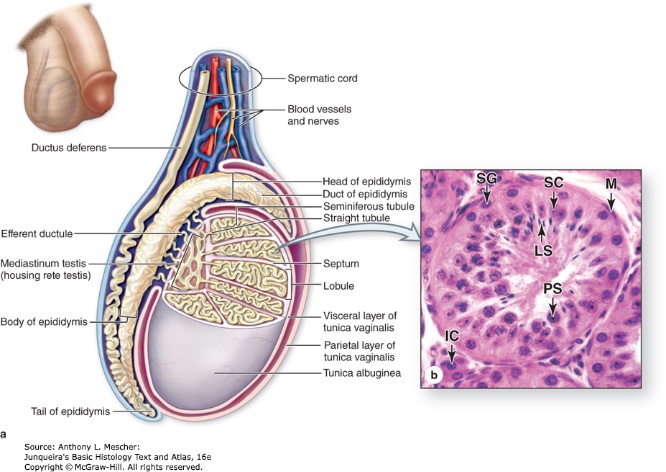
รูปที่ 1 แสดงลักษณะภายในของอัณฑะ
จาก Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
เซลล์สืบพันธุ์เพศชาย มีการเจริญและพัฒนาอย่างต่อเนื่องตลอดชีวิต โดยเริ่มตั้งแต่โดยที่ PGCs จะเจริญเป็น spermatogonia และ mesoderm จะเจริญเป็น Leydig cell สร้าง testosterone ส่งผลให้ wolffian duct พัฒนาเป็น epididymis, vas deferens และ seminal vesicle และถูกเปลี่ยนเป็น dihydrotestosterone (DHT) ทำให้อวัยวะเพศภายนอกเป็นลักษณะของเพศชายที่สมบูรณ์ ส่วนที่เจริญเป็น Sertoli cell จะสร้าง anti-mullerian hormone (AMH) ทำให้ mullerian duct ฝ่อไป
โดยกระบวนการสร้างเซลล์สืบพันธุ์เพศชายเกิดขึ้นภายใน seminiferous tubule ซึ่งเป็นท่อขดไปมาอยู่ภายในอัณฑะ (มีความยาวถึง 200 เมตร) จากนั้นจะเดินทางผ่าน rete testis เพื่อเข้าไปใน efferent duct ที่ต่อไปยัง epididymis และเข้าสู่ vas deferens
เซลล์ต้นกำเนิดของตัวอสุจิ เรียกว่า spermatogonia (2n) ที่อยู่ในส่วนของ seminiferous tubule นั้นจะแทรกอยู่ระหว่าง Sertoli cells ซึ่งมี tight junction ยึดติดกัน ทำให้แยกจากระบบไหลเวียนโลหิตและระบบภูมิคุ้มกันต่อร่างกายโดยสิ้นเชิง เรียกว่า blood-testis barrier ซึ่งทำหน้าที่ป้องกันการรุกรานทำลายเซลล์ที่อยู่ภายใน seminiferous tubules 2, 3
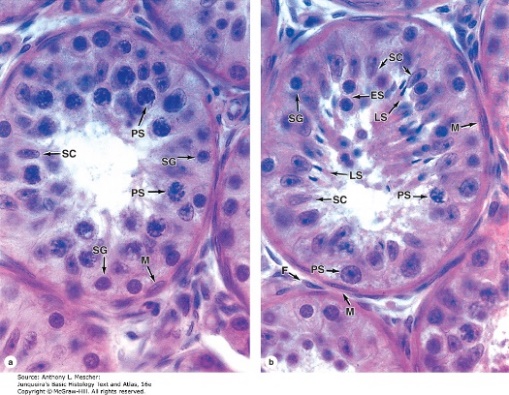
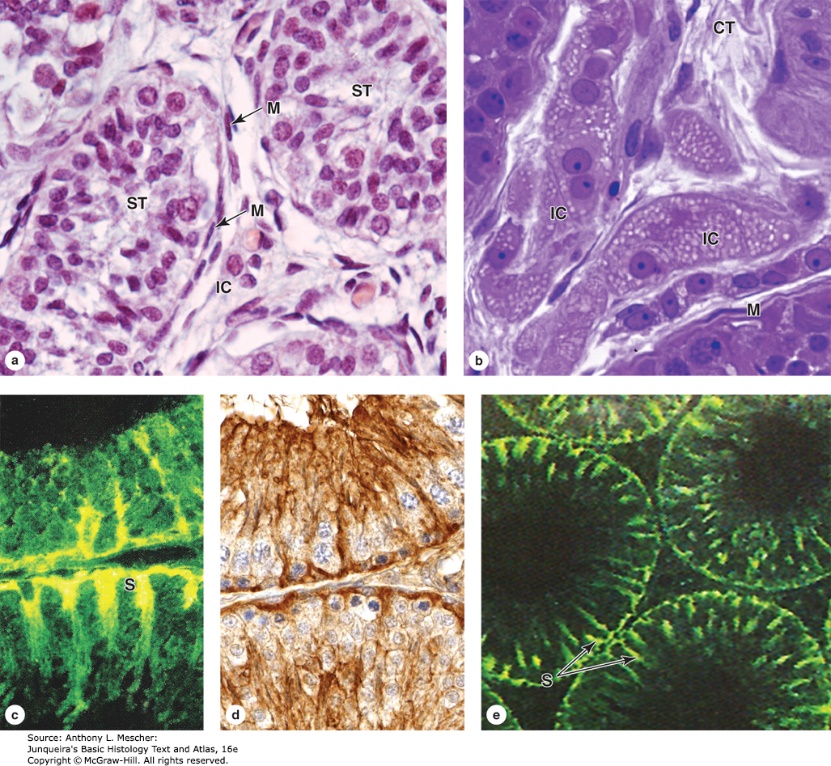
รูปที่ 2 แสดงภาพจากกล้องจุลทรรศน์ของโครงสร้างเซลล์ภายใน seminiferous tubules
จาก Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
Spermatogenesis
เป็นกระบวนการแบ่งตัวของเซลล์สืบพันธุ์เพศชาย จาก diploid cells (2n) ให้กลายเป็น haploid cells (n) เพื่อที่จะรอไปปฏิสนธิกับเซลล์สืบพันธุ์เพศหญิงต่อไป กระบวนการนี้เริ่มต้นขึ้นเมื่อเข้าวัยเจริญพันธุ์ โดย spermatogonia (2n) จะทำการแบ่งตัวแบบ mitosis ได้เป็นเซลล์ primary spermatocyte (2n) โดยเป็นระยะที่เซลล์มีขนาดใหญ่ที่สุดและพบได้มากที่สุด4 เซลล์ระยะนี้จะเข้าสู่การแบ่งตัวและค้างอยู่ที่ระยะ prophase ของ Meiosis I เป็นเวลาประมาณ 3 สัปดาห์ก่อนจะแบ่งตัวต่อจนจบ meiosis I ได้เป็น Secondary spermatocyte จากนั้นจะเกิดการแบ่งตัว meiosis II ต่อทันทีจนจบกลายเป็น spermatids (n)
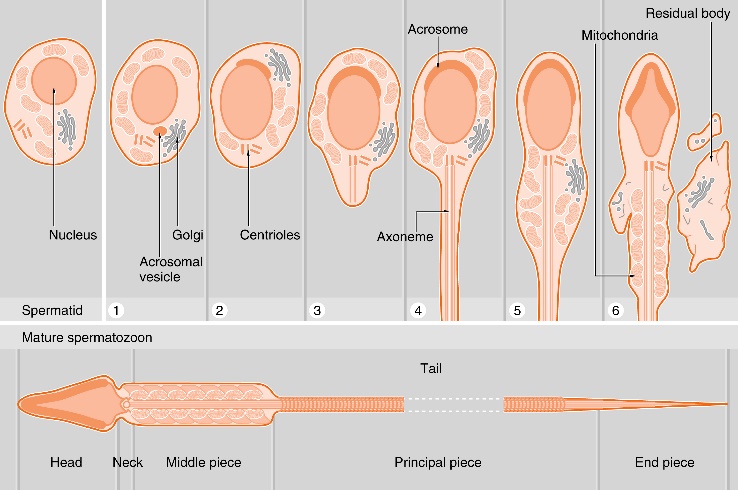
รูปที่ 3 แสดงกระบวนการ spermiogenesis และโครงสร้างของ spermatozoa
จาก Wheater’s Functional Histology, 5th ed., Edinburgh, 2007, Churchill Livingstone.
Spermiogenesis
เป็นระยะที่ไม่มีการแบ่งตัวเกิดขึ้นหากแต่เป็นการเปลี่ยนแปลงทางโครงสร้างของ spermatids กลายเป็น spermatozoa ซึ่งเป็นเซลล์สืบพันธุ์เพศชายระยะสมบูรณ์ที่พร้อมต่อกระบวนการปฏิสนธิ โดยมีการเปลี่ยนแปลงหลัก ๆ คือการสร้าง acrosome บริเวณที่ชิดกับ nucleus ของ spermatid ซึ่งบรรจุ hydrolytic enzyme (ได้แก่ hyaluronidase และ acrosin) ที่จำเป็นต่อกระบวนการปฏิสนธิกับไข่ การยืดยาวออกของ flagellum กลายเป็นส่วนหางของอสุจิ จะมีส่วนสำคัญต่อการเคลื่อนที่ของตัวอสุจิ ส่วนบริเวณ mid piece จะมีการรวมกันของ mitochondria ทำหน้าที่เป็นแหล่งพลังงานของตัวอสุจิ4
การหลั่งน้ำเชื้อหรือน้ำกาม (semen) ไม่ได้มีเฉพาะตัวอสุจิเท่านั้น แต่ยังต้องประกอบไปด้วยสารคัดหลั่งอื่น ที่ล้วนมีส่วนช่วยให้กระบวนการสืบพันธุ์สมบูรณ์มากยิ่งขึ้น สารเหล่านี้สร้างมาจากต่อมที่อยู่ในระบบอวัยวะสืบพันธุ์เพศชาย ประกอบด้วย 3 ต่อมดังนี้
- seminal vesicles: สร้างสารคัดหลั่งที่มีลักษณะเหนียวหนืด สีเหลืองอ่อน เป็นองค์ประกอบหลักของน้ำเชื้อที่หลั่งออกมา (ร้อยละ 70) ประกอบด้วยสารหลัก ๆ คือ fructose ซึ่งเป็นแหล่งพลังงานหลักของตัวอสุจิ รวมถึงprostaglandins ที่มีส่วนช่วยกระตุ้นการหดตัวของมดลูกในระหว่างการเดินทางของอสุจิเข้าไปในอวัยวะสืบพันธุ์เพศหญิง2
- prostate glands: มีสารหลายชนิดที่ช่วยในการเคลื่อนที่ของอสุจิระหว่างที่เข้าไปในอวัยวะสืบพันธุ์เพศหญิงได้แก่ prostate specific antigen (PSA), seminal relaxin และ fibrinolysin
- bulbourethral glands: สร้างมูกใส ๆ ทำหน้าที่หล่อลื่น ชะล้างสิ่งสกปรกในท่อปัสสาวะเพื่อเตรียมพร้อมสำหรับการหลั่งของน้ำอสุจิ 3, 4
โดยเฉลี่ยต่อการหลั่งน้ำเชื้อแต่ละครั้งจะมีอสุจิประมาณ 60 ถึง 100 ล้านตัวต่อน้ำเชื้อ 1 มิลลิลิตร หากมีจำนวน spermatozoa น้อยกว่า 20 ล้านตัวต่อน้ำเชื้อ 1 มิลลิลิตร หรือมีอสุจิที่เคลื่อนที่ได้น้อยกว่าร้อยละ 50 หรือมี อสุจิรูปร่างปกติน้อยกว่าร้อยละ 60 มักจะก่อให้เกิดภาวะมีบุตรยาก (infertility)5
- เซลล์สืบพันธุ์เพศหญิง มีการเจริญและพัฒนาภายในรังไข่ เริ่มพัฒนามาจาก PGCs ในระยะเริ่มต้นเฉกเช่นเดียวกับเพศชาย1 แต่มีการพัฒนาเปลี่ยนแปลงไปเป็นเซลล์ที่แตกต่างกันโดยสิ้นเชิง อันเป็นผลของสารพันธุกรรมและฮอร์โมนที่ต่างกันตั้งแต่ระยะตัวอ่อน ปลายทางของการพัฒนาก็เพื่อสร้างเซลล์ไข่ (oocyte) ที่สมบูรณ์และพร้อมต่อการปฏิสนธิต่อไป
ภายในรังไข่สามารถแบ่งเป็น 2 ชั้นหลัก ๆ คือ ชั้นรอบนอก (outer cortex) ซึ่งเป็นที่อยู่ของ ovarian follicles จำนวนมากในระยะการเจริญที่แตกต่างกัน และชั้นใน (inner medulla) เป็นชั้นเยื่อเกี่ยวพันหลวม ๆ ที่มีหลอดเลือดเข้ามาเลี้ยงรังไข่ ผ่านทาง hilum ทั้งนี้ไม่ได้มีเส้นแบ่งที่ชัดเจนระหว่างโซนทั้งสอง3, 6
ovarian follicles ประกอบ 2 ส่วนคือ oocyte กับ follicular cells ที่อยู่ล้อมรอบ ซึ่งทั้ง 2 ส่วนมีการเจริญอย่างสอดคล้องสัมพันธ์กันตลอด ovarian cycle โดย oocyte ในระยะแรกเรียกว่า oogonia เกิดจากการ differentiate ของ PGCs ที่เคลื่อนตัวมาอยู่บริเวณ gonadal ridge เริ่มแรกจะมีการแบ่งตัวแบบ mitosis อย่างต่อเนื่อง จนกระทั่งเมื่ออายุครรภ์ประมาณ 8 สัปดาห์ จะเริ่มแบ่งตัวแบบ meiosis แล้วหยุดเจริญในระยะ prophase I เรียกว่า primary oocyte และหยุดอยู่ระยะนี้จนกว่าจะมีการตกไข่ เชื่อว่าเกิดจาก oocyte maturation inhibitor (OMI)7 ที่สร้างมาจาก granulosa cells รอบ ๆ เซลล์ไข่ ซึ่ง OMI จะผ่านเข้ามาทาง gap junctions จนกระทั่งเมื่อมีการตกไข่เกิดขึ้นจากการชักนำของluteinizing hormone (LH) ที่เพิ่มขึ้นอย่างฉับพลัน ส่วนของ gap junction นี้จะถูกทำลาย ทำให้สาร OMI ไปออกฤทธิ์ยับยั้งการแบ่งตัวของ oocyte ไม่ได้ จึงเกิดการแบ่งตัวของ oocyte ต่อไปจนจบ meiosis I (meiotic resumption) และกลายเป็น secondary oocytes ที่อยู่ในระยะ metaphase of meiosis II หากไข่ได้รับการปฏิสนธิ จะมีการแบ่งตัวต่อจนจบระยะ meiosis II ได้เป็น haploid ovum (n) ที่พร้อมรวมเข้ากับ haploid male gamete (n) กลายเป็นตัวอ่อนต่อไป6, 7
Folliculogenesis:
เป็นกระบวนการพัฒนาของเซลล์ follicles เกิดขึ้นอย่างต่อเนื่องตั้งแต่การมีประจำเดือนครั้งแรกจนกระทั่งหมดประจำเดือน โดยสัมพันธ์อย่างใกล้ชิดกับ oocyte maturation โดยสามารถแบ่งระยะการเจริญของ follicles ได้หลายระยะตามจำนวนชั้นของ epithelial cells, การพัฒนาของ theca cells และ antrum อาจแบ่งออกเป็น 2 ช่วงใหญ่คือ preantral และ antral follicles6
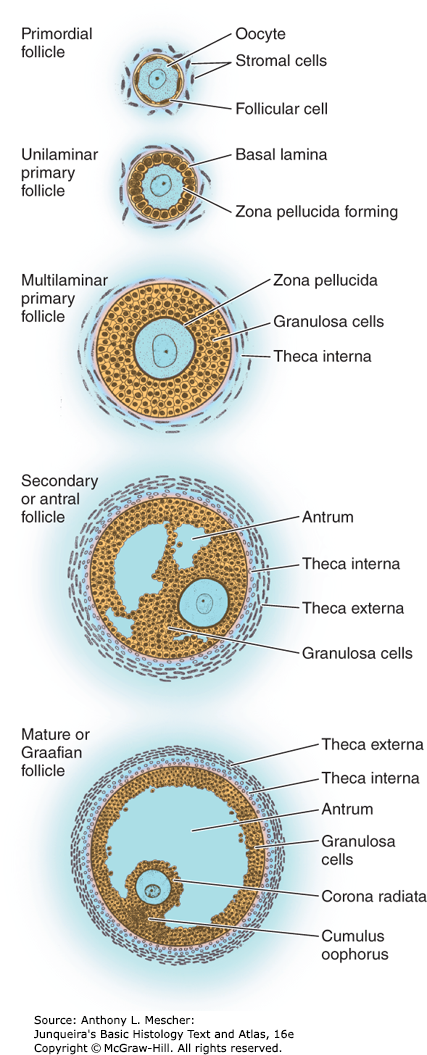
รูปที่ 4 แสดงกระบวนการ folliculogenesis
จาก Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
Preantral follicles ประกอบด้วย
- primordial follicle คือ primary oocyte ที่ล้อมรอบด้วย เซลล์รูปร่างแบนแค่ชั้นเดียว
- primary follicle: เมื่อเริ่มเข้าสู่วัยเจริญพันธุ์ เซลล์รูปร่างแบนจะเปลี่ยนรูปร่างเป็นทรงคล้ายลูกบาศก์ และเรียกชื่อใหม่ว่า granulosa cells (ถือเป็นสัญญาณแรกของการเกิด follicular recruitment) เซลล์เหล่านี้มีตัวรับของ follicle-stimulating hormone (FSH) มีการสร้าง cortical granules ขึ้นภายใน plasma membrane ของเซลล์ไข่, มีการสร้าง extracellular matrix capsule เกิดเป็น zona pellucida มาห่อหุ้มรอบเซลล์ไข่
- secondary follicles: มีการเพิ่มจำนวนชั้นและตัวรับ FSH ของ granulosa cells ส่วนของ stromal cells ที่อยู่รอบนอกชิดกับ granulosa cell มีการพัฒนาไปเป็น theca cells ซึ่งจะมีตัวรับ LH และสร้างฮอร์โมน androgen ได้ (ส่วนใหญ่คือ androstenedione: ADD) จากนั้นจะถูกส่งผ่านเข้าสู่ granulosa cell เพื่อเปลี่ยนเป็น estrogen เรียกกระบวนการนี้ว่า aromatization นอกจากนี้มีการสร้างหลอดเลือดมากขึ้นในชั้นนี้ ทำให้เลือดสามารถมาเลี้ยง follicle และนำพา FSH และ LH เข้ามาออกฤทธิ์ได้ ฮอร์โมน estrogen ที่ถูกสร้งขึ้นจะออกฤทธิ์ทั้งแบบเฉพาะที่ ในการกระตุ้นการเติบโตของ follicles และแบบเข้าสู่กระแสเลือดทำให้การแสดงออกของ female secondary sex characteristic อีกด้วย5, 7
Antral follicles ประกอบด้วย
- tertiary follicle: granulosa cells จะเริ่มมีการหลั่งสารน้ำเข้าไปในช่องว่างตรงกลางของฟองไข่ เกิดเป็นส่วนที่เรียกว่า antrum ส่วนของ theca cells จะมีการแยกชั้นเป็น theca interna ชั้นที่สร้าง steroid hormone และ theca externa ที่มีส่วนประกอบของ fibroblast และ smooth muscle cells เมื่อเริ่มมีการสะสมของเหลวมากขึ้น จะทำให้สามารถแยก granulosa cells ที่อยู่ล้อมรอบเซลล์ไข่ได้เป็นหลายกลุ่มตามตำแหน่งที่อยู่ของเซลล์เหล่านั้น ได้แก่ corana radiata คือชั้นในสุดที่ติดแน่นอยู่กับ oocyte ส่วนที่เป็น mural (membranous) granulosa คือกลุ่มเซลล์ที่อยู่รอบนอกติดกับ follicular wall และส่วนของ cumulus oophorous เป็นเสมือนก้านที่เชื่อมอยู่ระหว่าง corona radiata และ mural granulosa
- preovulatory follicle (Graafian follicles): ก็คือระยะที่มี LH surge มากระตุ้นทำให้ primary oocyte เกิดการแบ่งตัวแบบ meiosis I อย่างสมบูรณ์กลายเป็น secondary oocyte (metaphase II) ที่พร้อมสำหรับการตกไข่เพื่อรอการปฏิสนธิต่อไป
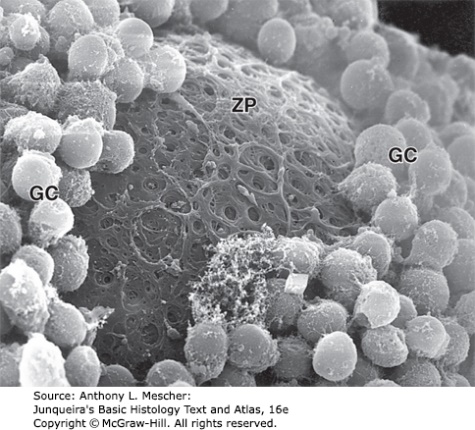
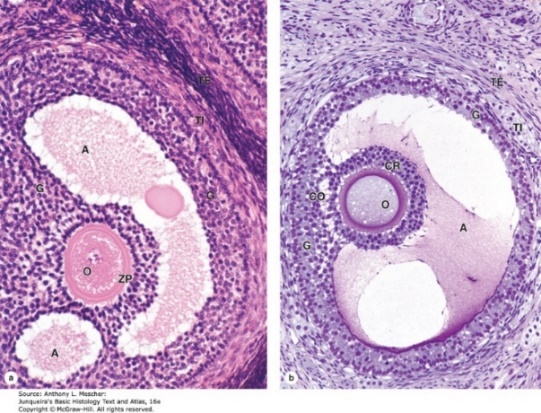
รูปที่ 5 แสดงภาพจากกล้องจุลทรรศน์อิเล็กตรอนของ zona pellucida และ granulosa cells(ซ้าย) และแสดงส่วนประกอบของเซลล์ไข่ในระยะก่อนตกไข่ (ขวา)
จาก Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
Corpus luteum:
ภายหลังการตกไข่ granulosa cells และ theca interna ที่เหลืออยู่จะเกิดการเปลี่ยนแปลงทั้งทางโครงสร้างและหน้าที่ เป็นเนื้อเยื่อพิเศษที่สามารถสร้างฮอร์โมนได้ (specialized endocrine tissue) โดยตอบสนองต่ออิทธิพลของ LH ในการสร้าง progesterone เป็นหลักแทนที่ estrogen ซึ่งหากมีการปฏิสนธิและการตั้งครรภ์เกิดขึ้น trophoblast จะสร้าง human chorionic gonadotropin (hCG) ซึ่งมีหน้าที่ในการออกฤทธิ์เสมือน LH ในการคงไว้ของ corpus luteum เพื่อคงระดับของ progesterone ให้เหมาะสมต่อการตั้งครรภ์ในช่วงแรก จนกระทั่งประมาณสัปดาห์ที่ 5-10 ของการตั้งครรภ์ รกจะทำหน้าที่สร้าง progesterone ได้แทน corpus luteum จะฝ่อสลายและกลายเป็น corpus albicans ในที่สุด7
อวัยวะสืบพันธุ์เพศหญิงที่มีความสำคัญและเกี่ยวข้องกับการปฏิสนธิ ได้แก่
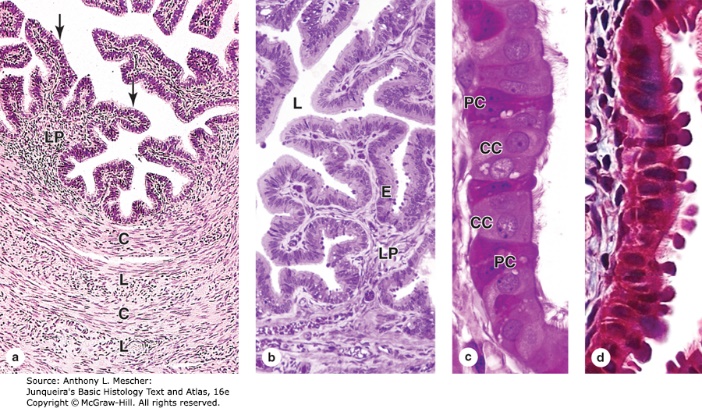
รูปที่ 6 แสดงลักษณะพื้นผิวและเซลล์ที่เป็นองค์ประกอบของท่อนำไข่
จาก Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
- ท่อนำไข่ (fallopian tubes or oviducts): ท่อนำไข่มีหน้าที่สำคัญต่อกระบวนการปฏิสนธิเนื่องจากมีหน้าที่ในการนำพา secondary oocyte ที่ตกในแต่ละรอบเดือนเดินทางเพื่อเข้าสู่โพรงมดลูกโดยตำแหน่งที่ไข่ได้รับการปฏิสนธิโดยทั่วไปจะเกิดขึ้นบริเวณ ampulla ของท่อนำไข่ ผนังของท่อนำไข่ประกอบด้วยชั้น muscularis ซึ่งเป็นชั้นกล้ามเนื้อเรียบที่มีบทบาทสำคัญในกระบวนการเคลื่อนที่ของไข่ไปสู่ uterus และชั้น mucosa ที่มีเซลล์ 2 ชนิดเป็นองค์ประกอบคือ ciliated cells ที่หน้าที่พัดโบกของเหลวของท่อนำไข่เข้าสู่ มดลูกและ secretory peg cells ทำหน้าที่สร้างสารหลายชนิดที่จำเป็นต่อการอยู่รอดของทั้งเซลล์ไข่และอสุจิ รวมถึงสารที่จำเป็นต่อกระบวนการ capacitation ของอสุจิก่อนการปฏิสนธิอีกด้วย2, 3, 6
- มดลูก: เป็นอวัยวะที่สำคัญต่อการตั้งครรภ์เนื่องจากเป็นอวัยวะที่เป็นที่ฝังตัวของตัวอ่อนและเกิดการเจริญเติบโตในการตั้งครรภ์ปกติ มดลูกประกอบด้วย 3 ชั้นได้แก่ชั้นนอกสุดคือ perimetrium เป็นลักษณะของเนื้อเยื่อเกี่ยวพันที่ถูกปกคลุมแนบชิดไปกับ mesothelium ชั้นกลางคือ myometrium เป็นชั้นของกล้ามเนื้อเรียบที่ทำหน้าที่หดรัดตัวเพื่อให้เกิดกระบวนการคลอดโดยสมบูรณ์ ชั้นในสุดคือ endometrium ที่สามารถแบ่งได้เป็น 2 ชั้น คือ functional layer เป็นชั้นที่เซลล์อยู่กันอย่างหลวม ๆ เป็นชั้นหลักที่เกิดการเปลี่ยนแปลงในแต่ละรอบเดือนและเป็นชั้นที่ฝังตัวของตัวอ่อนในระยะแรก อีกชั้นคือ basal layer เป็นชั้น endometrium ที่มีความสามารถในการแบ่งตัวเพื่อสร้างเซลล์ให้กับชั้น functional layer ที่จะหลุดลอกไปในแต่ละรอบเดือน ทั้งสองชั้นนี้แตกต่างกันนอกจากเรื่องโครงสร้างแล้วยังเป็นเรื่องหลอดเลือดที่มาเลี้ยงโดยชั้น functional จะถูกเลี้ยงด้วย spiral artery แต่ชั้น basal จะถูกเลี้ยงโดย straight artery โดยหลอดเลือดทั้งสองเป็นแขนงของ arcuate artery3, 6
- ปากมดลูก: มีการเปลี่ยนแปลงอย่างมากเมื่อเกิดการตั้งครรภ์ โดยพบว่าอิทธิพลของ progesterone ส่งผลต่อความหนืดของมูกบริเวณปากมดลูก โดยในระยะตกไข่มูกจะมีน้ำเป็นองค์ประกอบหลัก ทำให้มีลักษณะเป็นของเหลวที่เหมาะต่อการเคลื่อนที่ของอสุจิและจะข้นหนืดขึ้นเรื่อย ๆ จนหากเกิดการตั้งครรภ์จะมีความหนืดมากขึ้นเป็นพิเศษเพื่ออุดกั้นบริเวณปากมดลูก ทำหน้าที่ปกป้องสภาวะที่เหมาะสมของมดลูกให้คงที่เกือบตลอดการตั้งครรภ์6
การปฏิสนธิ (fertilization)
ในที่นี้จะกล่าวถึงอวัยวะสืบพันธุ์เพศหญิงในบริบทที่เกี่ยวข้องกับกระบวนการปฏิสนธิและการตั้งครรภ์ในระยะแรกเท่านั้น
กระบวนการปฏิสนธิกล่าวอีกนัยหนึ่งคือการรวมกันของ 2 haloid cells เพื่อสร้าง 1 diploid cell กระบวนการจึงนี้เริ่มตั้งแต่การเดินทางของอสุจิและไข่ในระยะ secondary oocyte จากต่างสถานที่โดยเกิดเหตุการณ์สำคัญดังนี้
การเดินทางของอสุจิ (sperm transportation)
- หลังจากกระบวนการ spermatogenesis และ spermiogenesis ที่เกิดขึ้นใน seminiferous tubule อสุจิจะได้รับการพัฒนาต่อเนื่องและกักเก็บใน epididymis เพื่อให้เกิดความสมบูรณ์มากขึ้น (epididymal maturation) เพื่อรอการหลั่งน้ำอสุจิ (ejaculation) ขณะที่มีเพศสัมพันธ์
- วัตถุประสงค์หลักของ epididymal maturation เกิดขึ้นเพื่อทำให้อสุจิ มีประสิทธิภาพมากที่สุด โดยการเพิ่มความสามารถในการเคลื่อนที่และความสามาถในการจับกับ zona pellucida และ penetrate oocyte
- มีการเคลือบสารบนผิวเซลล์หลายชนิดที่เกิดขึ้นระหว่างอสุจิที่อยู่ใน epididymis โดยหนึ่งในสารสำคัญนั้นก็คือ Beta-defensin 126 ซึ่งเชื่อว่าทำให้ plasma membrane ของอสุจิมีความเหมาะสมในการคงตัวอยู่ในมูกบริเวณปากมดลูก แต่ในขณะเดียวกันก็ต้องสามารถเคลื่อนที่ผ่านมูกเหล่านั้นได้ด้วย8
- ระยะเวลาตั้งแต่เริ่มต้นไปถึงส่วนท้ายของ epididymis จะใช้เวลาประมาณ 72 วัน จึงจะเกิดความสมบูรณ์ของอสุจิ (sperm maturation) 3, 5, 8
- Capacitation: เป็นกระบวนการสำคัญที่จำเป็นต้องเกิดเพื่อให้อสุจิมีความสามารถในการปฏิสนธิ โดยกระบวนการนี้เริ่มต้นจาก albumin และ lipid transfer protein-1 (LTP-1) ซึ่งเป็นสารที่พบได้มากในท่อนำไข่ จะดึง cholesterol ออกจาก plasma membrane ของอสุจิทำให้ membrane permeability เพิ่มมากขึ้นมีการไหลเข้าเซลล์ของ calcium ion ที่อยู่ภายนอกเซลล์ (เชื่อว่าเกิดจากอิทธิพลของ progesterone และความเป็นกรดด่างที่ต่างกันระหว่างบริเวณต่าง ๆ ของอวัยวะสืบพันธุ์เพศหญิง)9 ทำให้เกิดการ phosphorylation ของ protein หลายชนิดที่สำคัญต่อการเปลี่ยนแปลงสารเคลือบผิวเซลล์ของอสุจิ ทำให้สามารถจับเข้ากับ zona pellucida และเจาะเข้าเซลล์ไข่ได้10 โดยกระบวนการ capacitation จะเริ่มเกิดเมื่ออสุจิเข้าสู่ปากมดลูกแต่จะเกิดจนเสร็จสมบูรณ์ขณะอยู่ในสภาวะเป็นด่างของท่อนำไข่ ซึ่งพบได้ในระยะกึ่งกลางของรอบเดือน
- หลังสิ้นสุดกระบวนการ capacitation จะทำให้อสุจิมีคุณลักษณะ 3 อย่างดังนี้
- มีความสามารถในการจับกับ zona pellucida ได้
- มีความสามารถในการเกิด acrosomal reaction ซึ่งเป็นกระบวนการที่เกิดขึ้นเพื่อทำให้ plasma membrane ของอสุจิรวมเข้ากับเซลล์ไข่ได้
- สามารถเคลื่อนไหวแบบ hyperactivated mobility ซึ่งทำให้อสุจิเคลื่อนที่เข้าหาเซลล์ไข่ได้เร็วและตรงตำแหน่งมากขึ้น อีกทั้งยังเป็นการลดโอกาสการถูกดักจับระหว่างเดินทางผ่านมดลูกและท่อนำไข่2 8
การเดินทางของเซลล์ไข่ (oocyte transportation)
- หลังจากเกิดการตกไข่ secondary oocyte (metaphase of meiosis II) จะถูกล้อมรอบด้วย zona pellucida, corona pellucida และ cumulus oophorous
- ส่วนปลายของท่อนำไข่ที่เรียกว่า fimbriae ซึ่งมีลักษณะเป็นปากแตรจะทำการโบกพัดนำเซลล์ไข่ที่ตกจากรังไข่เข้าสู่ท่อนำไข่ โดยมีปลายทางคือไปยังมดลูก 11 โดยกระบวนการโบกพักเซลล์ไข่ของ fimbriae นี้สัมพันธ์กับการมีอยู่ของ follicular cumulus cells
- การจะสามารถเกิดการตั้งครรภ์ได้นั้นไม่เพียงแต่ต้องการท่อนำไข่ที่ไม่ตัน แต่ยังต้องการส่วนประกอบอื่น ๆ ของท่อนำไข่ที่จำเป็นต่อการปฏิสนธิและการเดินทางของตัวอ่อน ได้แก่
- muscular contractility: ชั้นกล้ามเนื้อเรียนของท่อนำไข่ จะเกิดการหดตัวแบบ peristalsis เพื่อนำเซลล์ไข่เดินทางไปในทิศทางเข้าสู่มดลูก
- ciliary motion: การพัดโบกของ cilia แบบสอดคล้องและไปในทิศทางเดียวกัน (Synchronously unidirectional movement)
- tubal fluid ซึ่งเป็นสารคัดหลั่งที่อุดมไปด้วยโปรตีนและ growth factor หลายชนิด ซึ่งเป็นสารสำคัญสำหรับการเกิดกระบวนการเดินทางและฝังตัวของตัวอ่อน
- จะพบเซลล์ไข่ในส่วน ampulla ของท่อนำไข่ภายในระยะเวลาประมาณ 15-20 นาทีหลังเกิดการตกไข่ แต่เซลล์ไข่จะใช้เวลาในท่อนำไข่ ทั้งสิ้นประมาณ 80 ชั่วโมง เชื่อว่าเป็นไปเพื่อการชะลอไม่ให้เซลล์ไข่ที่ได้รับการปฏิสนธิเกิดการฝังตัวที่ผนังมดลูกเร็วเกินไป (non-receptive state of endometrium)8
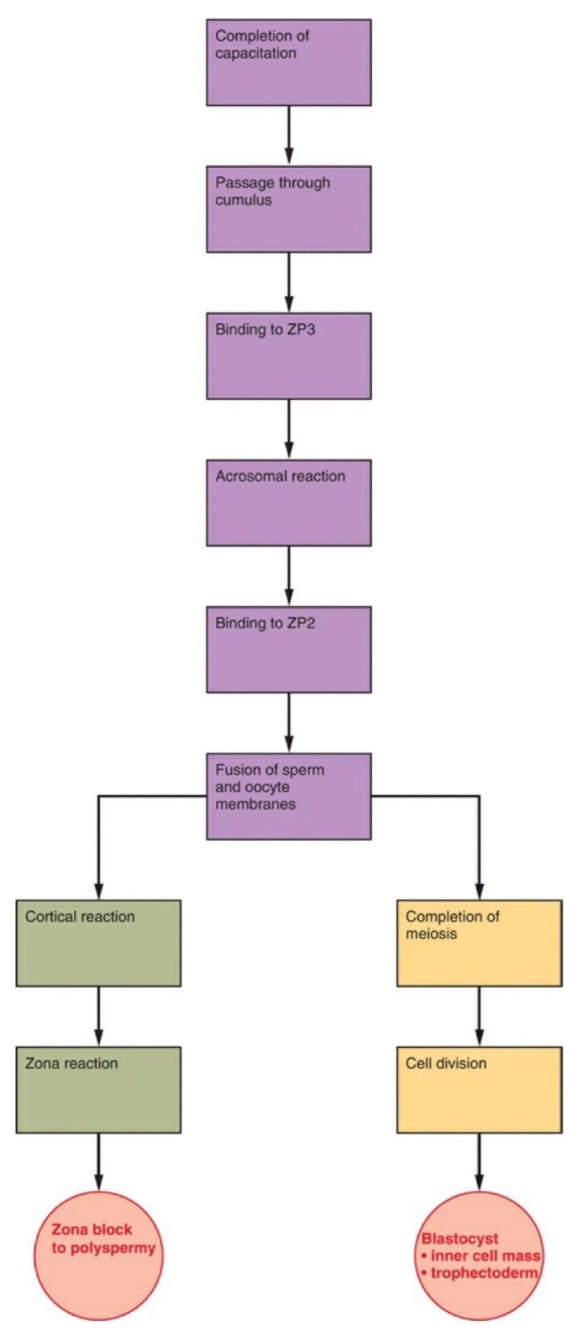
รูปที่ 7 แสดงภาพรวมของลำดับเหตุการณ์การปฏิสนธิ
จาก Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition. ed. Philadelphia, PA: Wolters Kluwer; 2020.
กลไกการปฏิสนธิของอสุจิและไข่
- การตั้งครรภ์โดยส่วนใหญ่จะเกิดขึ้นหากมีเพศสัมพันธ์ในช่วง 3 วันก่อนการตกไข่
- เชื่อว่ามีการดึงดูดกันระหว่างอสุจิและเซลล์ไข่ ที่เรียกว่า chemotactic responsiveness ซึ่งต้องอาศัยการเปลี่ยนแปลงของอสุจิที่ผ่านกระบวนการ capacitation แล้ว
- ชั้น zona pellucida ของเซลล์ไข่มีบทบาทสำคัญ 2 ประการระหว่างกระบวนการปฏิสนธิคือเป็นที่อยู่ของ ligands ที่จำเพาะต่อตัวรับของอสุจิ ได้แก่ สารประเภทไกลโคโปรตีนที่สร้างจากเซลล์ไข่ คือ ZP1, ZP2, ZP3 และ ZP4 นอกจากนี้ทำให้เกิดการหนาตัวขึ้นของชั้น zona pellucida (zona reaction or zona hardening) เพื่อป้องกันการเกิดภาวะปฏิสนธิโดยอสุจิมากกว่า 1 ตัว (polyspermy) โดยพบว่า ZP3 เป็น ligand ที่พบมากที่สุดในมนุษย์และเป็นตัวหลักที่ทำให้อสุจิจับกับ zona pellucida อยู่ได้ นอกจากนี้การจับกันระหว่าง ZP3 และเอนไซม์บนผิวเซลล์ของอสุจินั้น ยังนำมาซึ่งการเกิดกระบวนการ acrosome reaction ของตัวอสุจิด้วย 8
- Acrosome reaction เป็นกระบวนการ exocytosis ชนิดหนึ่งเป็นการประสานรวมกันระหว่าง inner surface ของเยื่อหุ้มเซลล์ของอสุจิและ outer acrosomal membrane ทำให้มีการปลดปล่อยสารที่เก็บอยู่ภายใน acrosome ได้แก่ hyaluronidase และ acrosin ซึ่งมีหน้าที่หลักในการทำให้อสุจิสามารถเคลื่อนที่ผ่านชั้นที่ล้อมรอบ oocyte เพื่อจะเกิดการรวมกันของอสุจิและเซลล์ไข่ในท้ายที่สุด โดยอาศัยการเพิ่มขึ้นของ calcium ion ภายในเซลล์, การลดลงของ hydrogen ion และการเพิ่มขึ้นของ pH 2, 12
- บนผิวเซลล์ของอสุจิยังมีโปรตีนอีกหลายชนิดที่มีผลต่อการรวมกันของอสุจิกับเซลล์ไข่ เช่น PH-20/SPAM1 ที่มีส่วนต่อการจับกับ zona pellucida, PH-30/Fertilin ซึ่งมีส่วนต่อการผสานรวมกับเซลล์ไข่
- บนเซลล์ไข่มี integrin ซึ่งทำหน้าที่เป็น fusion molecules โดยสามารถจับกับ fibronectin ที่อยู่บนผิวอสุจิ (หลัง epididymal maturation/capacitation) และ vitronectin (หลังกระบวนการ capacitation และ acrosome reaction)
- ถึงแม้จะไม่มีโปรตีนตัวใดตัวหนึ่งที่สำคัญที่สุดต่อการผสมกันระหว่างอสุจิและเซลล์ไข่ แต่เชื่อว่าการที่อสุจิผ่านกระบวนการเติบโตและเปลี่ยนแปลงระหว่างรอปฏิสนธิ ล้วนส่งผลให้การปฏิสนธิเกิดได้อย่างมีประสิทธิภาพที่สุด13
- เมื่อเกิดการผสานรวมกันของอสุจิและ oocyte membrane จะทำให้เกิดการเพิ่มขึ้นของ calcium ion ภายในเซลล์ไข่ทำให้เกิด 2 เหตุการณ์ คือ
- Cortical reaction: เป็นกระบวนการ exocytosis ของ cortical granule ที่อยู่บริเวณรอบ ๆ ผิวของเซลล์ไข่ ทำให้เกิดการเปลี่ยนแปลงของ Zona pellucida โดยมีการเปลี่ยนแปลงโครงสร้างโปรตีนทำให้มีการแน่นขึ้นและมีการเปลี่ยนแปลงโครงสร้างของ Glycoprotein ทำให้ไม่เหมาะต่อการเป็น ligand ของ sperm receptor ได้อีก เพื่อป้องกันการเกิดการปฏิสนธิซ้อน ซึ่งอาจทำให้มีความผิดปกติของตัวอ่อนได้ กระบวนการนี้เรียกว่า Zona reaction ซึ่งเกิดจากการจับกันของ sperm receptor กับ ZP2 ตามหลังกระบวนการ acrosome reaction1, 2, 8
- Metabolic activation of oocyte คือการเกิดการแบ่งตัวแบบ meiosis โดยสมบูรณ์ของ secondary oocyte เพื่อสร้างชุดโครโมโซมที่พร้อมจะรวมเข้ากับสารพันธุกรรมของเซลล์สืบพันธุ์เพศชายกลายเป็นตัวอ่อนและเริ่มต้นกระบวนการแบ่งตัวต่อไป
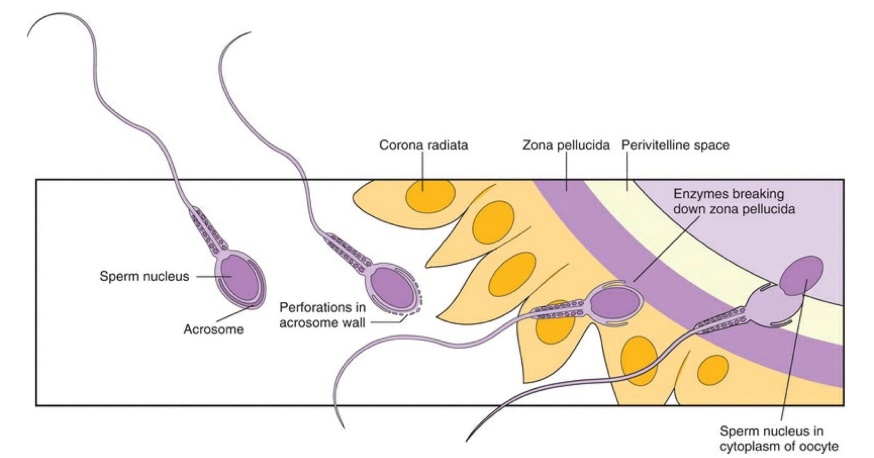
รูปที่ 8 แสดงภาพการเข้ารวมกันของเซลล์สืบพันธุ์
จาก Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition. ed. Philadelphia, PA: Wolters Kluwer; 2020.
การฝังตัวของตัวอ่อนและการพัฒนาของตัวอ่อนระยะแรก (implantation and early embryogenesis)
หลังจากการปฏิสนธิเสร็จสิ้นจนได้เป็นตัวอ่อน ตัวอ่อนก็จะเริ่มแบ่งตัวแบบ mitosis เพื่อเพิ่มจำนวนเซลล์ โดยพบว่าการแบ่งตัว 2 ครั้งแรกอาศัยสารตั้งต้นที่มาจากเซลล์ของฝ่ายหญิงเป็นหลัก ได้แก่ โปรตีนและ mRNA (maternal legacy) จนกระทั่งเข้าสู่การแบ่งตัวรอบที่ 3 คือระยะจาก 4 เป็น 8 เซลล์ 11, 14 จึงจะเป็นการเริ่มใช้สารต่าง ๆ ที่มาจากตัวอ่อนเองซึ่งเรียกว่าการมี embryonic genome activation (EGA) แม้ว่าตัวอ่อนจะเกิดจากการรวมกันของสารพันธุกรรมของทั้งฝ่ายชายและฝ่ายหญิงก็ตาม แต่ก็พบว่าการพัฒนาแต่ละช่วงอาศัยการแสดงออกของยีนที่ไม่เท่ากัน กล่าวคือการพัฒนาเนื้อเยื่อนอกตัวอ่อนอาศัยปัจจัยเด่นที่ถ่ายทอดมาจากฝ่ายชาย แต่การพัฒนาเนื้อเยื่อตัวอ่อนอาศัยปัจจัยเด่นที่มาจากฝ่ายหญิง (imprinting)14, 15
เซลล์แต่ละเซลล์ที่เกิดจากการแบ่งตัวของตัวอ่อน เรียกว่า blastomere เมื่อการแบ่งตัวเกิดขึ้นต่อเนื่องจนกระทั่งประมาณวันที่ 3 – 4 หลังการปฏิสนธิจะแบ่งตัวจนเป็นระยะ morula (ระยะที่มีเซลล์ 16 blastomeres ขึ้นไป) และเริ่มเคลื่อนที่เข้าสู่โพรงมดลูก หลังจากนั้นจะมีการสะสมสารน้ำบริเวณตรงกลางของตัวอ่อน และมีการเคลื่อนที่ของเซลล์ไปอยู่ 2 บริเวณคือ บริเวณรอบนอก (trophectoderm: TE) ซี่งจะพัฒนาต่อไปเป็น trophoblast ซึ่งพัฒนาต่อไปกลายเป็นรก และกลุ่มเซลล์ตรงกลาง (inner cell mass: ICM) จะเจริญต่อไปเป็นตัวอ่อนหรือทารก เราเรียกระยะที่มีสารน้ำในเซลล์ตัวอ่อนและพบเซลล์ 2 ลักษณะดังกล่าว ว่า blastocyst ซึ่งแม้ว่ากลุ่มเซลล์เหล่านี้จะมีความต่างของ gene expression ตั้งแต่แรก แต่จะสามารถแยกความต่างภายนอกได้เมื่อมีเซลล์ประมาณ 58 เซลล์ (53 TE และ 5 ICM) ซึ่งตรงกับประมาณวันที่ 5 หลังการปฏิสนธิ จนกระทั่งเข้าสู่ระยะ 107 cells ตัวอ่อนที่อยู่ในระยะ blastocyst จะแตกตัวออกมาจาก zona pellucida เรียกว่า hatching blastocyst เมื่อออกมาทั้งหมดแล้ว zona pellucida จะถูกทำให้สลายไปโดยอิทธิพลของสารคัดหลั่งที่อยู่ในโพรงมดลูก การแยกตัวออกจาก zona pellucida อย่างสมบูรณ์นั้น เรียกว่า hatched blastocyst ทั้งนี้ก็เพื่อให้ blastocyst สามารถหลั่ง cytokine และ hormone ต่าง ๆ เพื่อให้พร้อมจะเกิดการฝังตัวในที่สุด8, 11, 16
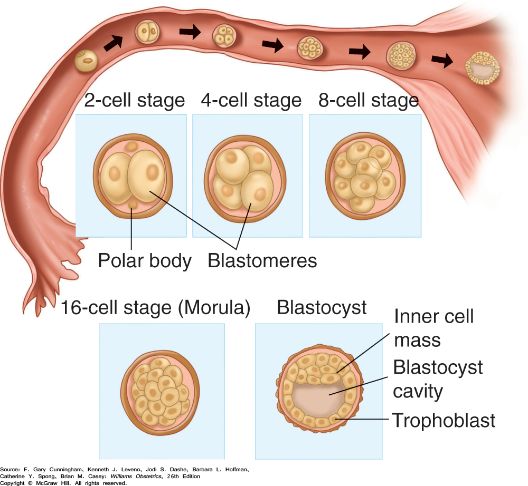
รูปที่ 9 แสดงภาพการแบ่งตัวของตัวอ่อนระยะแรก
จาก Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022
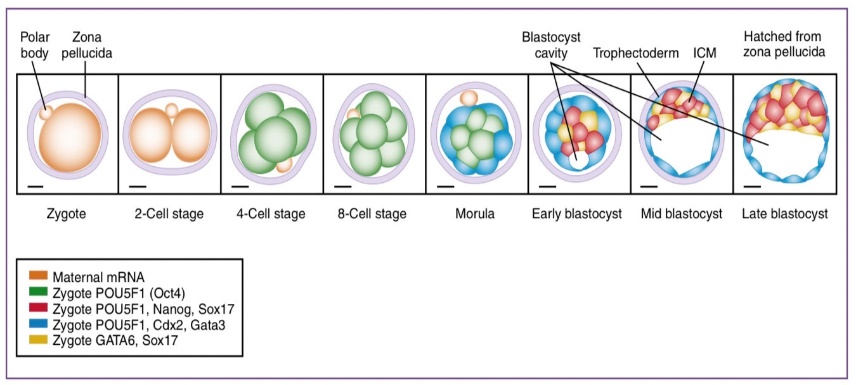
รูปที่ 10 แสดงลักษณะของ transcription factor ที่ส่งผลต่อการเปลี่ยนแปลงหน้าที่ของเซลล์ในระยะ blastocyst
Creasy and Resnik’s maternal-fetal medicine: principles and practice. Amsterdam: Elsevier; 2022.
Decidua
หลังจากตกไข่ เยื่อบุโพรงมดลูกซึ่งอยู่ในระยะ secretory phase จะเกิดการเปลี่ยนแปลงรูปร่างเพื่อรอรับการฝังตัวของตัวอ่อนโดย เกิดมีการยื่นของ apical cell surface เข้าสู่โพรงมดลูก (luminal protrusion) ซึ่งการยื่นของเซลล์นี้เรียกว่า pinopodes ทังนี้ก็เพื่อรอรับการฝังตัวของ blastocyst หน้าที่สำคัญที่สุดของการเกิด pinopodes คือการขจัดสารต้านการยึดเกาะของ blastocyst และ endometrium (adhesion-inhibiting mucin)3, 8 การฝังตัวจะมีโอกาสสำเร็จมากที่สุดหากเยื่อบุโพรงมดลูกอยู่ในระยะนี้ เรียกว่า endometrium receptivity ซึ่งถือว่าเป็น window of implantation โดยที่ในสตรีที่มีรอบเดือนมาสม่ำเสมอทุก 28 วัน ระยะนี้จะอยู่ที่ประมาณวันที่ 20 – 24 ของรอบเดือน
หากมีการฝังตัวของตัวอ่อนเกิดขึ้นจะเกิดการเปลี่ยนแปลงทางโครงสร้างและหน้าที่โดยจะลดการแบ่งตัวของ endometrial stroma และ epithelial cells แต่เปลี่ยนเป็นเซลล์ที่มีหน้าที่หลักคือการหลั่งสารที่จำเป็นต่อการฝังตัวและการอยู่รอดของตัวอ่อนในระยะเริ่มแรก เรียกกระบวนการเปลี่ยนแปลงนี้ว่า decidualization และเซลล์ที่เกิดขึ้นใหม่เรียกว่า decidua (specialized secretory cells) กระบวนการนี้อาศัยการกระตุ้นจาก progesterone (P4) และ estradiol (E2) รวมทั้ง factor ที่สร้างจาก blastocyst
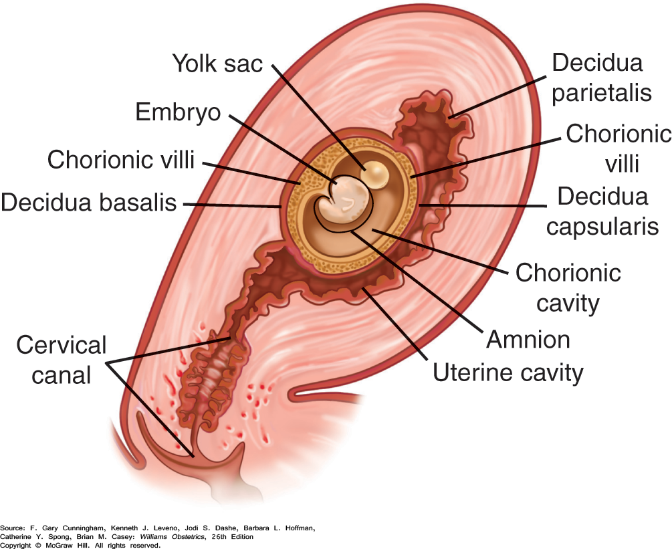
รูปที่ 11 ภาพแสดงพัฒนาของ decidua ไปเป็นเนื้อเยื่อรอบตัวอ่อน
จาก Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022
decidua สามารถแบ่งได้เป็น 3 ส่วนตามบริเวณที่อยู่คือ decidua basalis ระหว่าง blastocyst ที่ฝังตัวกับ myometrium, decidua capsularis อยู่ด้านนอกของ blastocyst ที่กำลังฝังตัวกับ uterine lumen และ decidua parietalis คือส่วนที่ปกคลุมโพรงมดลูกในส่วนอื่นๆที่เหลือ
นอกจากนี้ใน decidua ยังมีเซลล์ทางระบบภูมิคุ้มกันซึ่งทำหน้าที่พิเศษและมีความสำคัญอย่างยิ่งต่อการฝังตัวและการตั้งครรภ์ได้แก่ regulatory T-cells, decidual macrophage และ decidual NK cells โดยเซลล์ ต่าง ๆ เหล่านี้มีบทบาทร่วมกันในการทำให้ระบบภูมิคุ้มกันของมารดาไม่มองว่าตัวอ่อนคือสิ่งแปลกปลอมและไม่เกิดการทำลายตัวอ่อนขึ้น อีกทั้งยังมีส่วนในกระบวนการ trophoblast invasion และการสร้างหลอดเลือดในกระบวนการพัฒนาของรกอีกด้วย
Implantation
การฝังตัวของตัวอ่อนโดยปกติจะเกิดขึ้นประมาณวันที่ 6 -7 หลังเกิดการปฏิสนธิ โดยตำแหน่งที่เกิดการฝังตัวที่พบได้บ่อยที่สุด คือบริเวณผนังมดลูกด้านหลังส่วนบน (posterior-upper) การฝังตัวเกิดขึ้นจากการตอบสนองต่อกันระหว่าง receptive endometrium และ blastocyst ที่หลุดออกมาจาก zona pellucida แล้วโดย blastocyst จะสร้างสาร interleukin-1alpha (IL-1α) และ IL-1β ร่วมกับ hCG ทำให้เยื่อบุโพรงมดลูกตอบสนองโดยมีการสร้าง leukemia inhibitory factor (LIF) และ follistatin ซึ่งมีผลต่อการเกิด decidualization นอกจากนี้ยังมีการสร้าง colony-stimulating factor 1 (CSF-1) ที่จะมีผลในกระบวนการทางภูมิคุ้มกันและการสร้างหลอดเลือดที่จำเป็นต่อการฝังตัว
กระบวนการฝังตัวสามารถแบ่งได้เป็น 3 ระยะ คือ
- Apposition: เมื่อ blastocyst เคลื่อนที่เข้ามาใกล้กับผนังของมดลูก ก็จะทำการกระตุ้นให้ epithelium ของ เยื่อบุโพรงมดลูกมีการสร้าง heparin-biding epidermal growth factor (HB-EGF) ทำให้เส้นเลือดที่อยู่ในโพรงมดลูกในบริเวณที่จะเกิดการฝังตัวมี permeability เพิ่มขึ้น นับเป็นการเปลี่ยนแปลงแรกของร่างกายมารดาในการตอบสนองต่อกระบวนการฝังตัวของตัวอ่อน และเมื่อมีการเริ่มสัมผัสกันของ blastocyst และผนังมดลูก เซลล์ของ blastocyst จะเชื่อมเข้ากับเซลล์เยื่อบุโพรงมดลูกและ form junctional complex ขึ้นต่อเนื่องไปกับกระบวนการ adhesion
- Adhesion: คือการยึดติดกันระหว่างเซลล์ของ blastocyst โดยอาศัย cellular adhesion molecules (CAMs) โดยเฉพาะ integrin ซึ่งเป็น receptor ของสารหลายชนิดใน extracellular matrix ของ decidua เช่น laminin และ fibronectin โดยพบว่าทั้งเยื่อบุโพรงมดลูกและ blastocyst ต่างก็มีการแสดงออกของ integrin ในรูปแบบที่ต่าง ๆ กันเพื่อสอดคล้องกับตำแหน่งและระยะเวลาของการฝังตัวมากที่สุด integrin ไม่ได้เป็นแค่ตัวช่วยยึดเซลล์จากภายนอกเท่านั้นแต่ยังสามารถกระตุ้น intracellular signaling pathways ที่จะทำให้เกิดการสร้างสารช่วยให้การ adhesion ดีขึ้นอีกด้วย8, 16
- Invasion or migration: เมื่อ blastocyst ยึดติดกับผนังมดลูกแล้วก็จะเริ่มทำการแทรกตัวเข้าไปฝังอยู่ใน decidua โดย cytotrophoblast สร้างสาร urokinase plasminogen activator และ matrix metalloproteinases หลายตัวเพื่อย่อย extracellular matrix ของ decidua เป้าประสงค์หลักคือการรุกรานเข้าไปเปลี่ยนแปลงโครงสร้างของหลอดเลือดในมดลูก (uterine arteriole) โดยเปลี่ยนให้กลายเป็นหลอดเลือดที่ขนาดใหญ่ขึ้นและมีความต้านทานลดลงเพื่อให้มั่นใจได้ว่าจะมีเลือดมาเลี้ยงตัวอ่อนได้อย่างเพียงพอตลอดการตั้งครรภ์ (uteroplacental circulation)
ทั้งนี้กระบวนการฝังตัวของตัวอ่อนต้องเป็นไปอย่างเหมาะสมและพอเหมาะ เพราะหากเกิดการฝังตัวที่มากเกินไปอาจทำให้มีปัญหาระหว่างตั้งครรภ์หรือคลอดได้ สารตัวหลักที่มีบทบาทในการจำกัดการฝังตัวคือ decidual TGF-β ซึ่งสามารถกระตุ้นการสร้าง plasminogen activator inhibitor-1 และ tissue inhibitors of metalloproteinases (TIMPs) ซึ่งจะลดการสร้างสารกลุ่ม mettaloproteinases ทำให้การสลาย extracellular matrix ลดลง อีกทั้ง TGF-β ยังสามารถยับยั้งการแสดงออกของ integrin และส่งผลต่อการ differentiate ของ cytotrophoblast ให้กลายเป็น non-invasive syncytiotrophoblast ทำให้การฝังตัวเกิดขึ้นอย่างเหมาะสม8, 16
แม้ว่ากระบวนการฝังตัวของตัวอ่อนจะอาศัยสารเคมีที่เกี่ยวข้องหลายชนิด แต่พบว่าในความเป็นจริงเป็นเรื่องยากมากที่จะแยกสารแต่ละชนิดในแต่ละระยะออกจากกันอย่างชัดเจน เนื่องจากสารเหล่านี้โดยส่วนใหญ่จะมีการแสดงออกอยู่ทั้งบน decidua และ implanting blastocyst อีกทั้งการเกิดเหตุการณ์ต่าง ๆ เกิดต่อเนื่องกันไม่ได้มีระยะเวลาหรือขอบเขตชัดเจน จึงเป็นเรื่องง่ายกว่าที่จะมองสารเหล่านี้ว่าเป็นเพียงตัวช่วยทำให้การฝังตัวเกิดขึ้นอย่างมีประสิทธิภาพมากที่สุด8
หลังจากการฝังตัวเกิดขึ้นอย่างสมบูรณ์กลุ่มเซลล์ ICM จะพัฒนาต่อไปกลายเป็นเนื้อเยื่อของตัวอ่อน และ trophoblast จะพัฒนาต่อกลายเป็นเนื้อเยื่อรกซึ่งการตั้งครรภ์ที่ปกติจะไม่สามารถเกิดขึ้นได้อย่างสมบูรณ์หากปราศจากขั้นตอนต่าง ๆ ที่ซับซ้อนเหล่านี
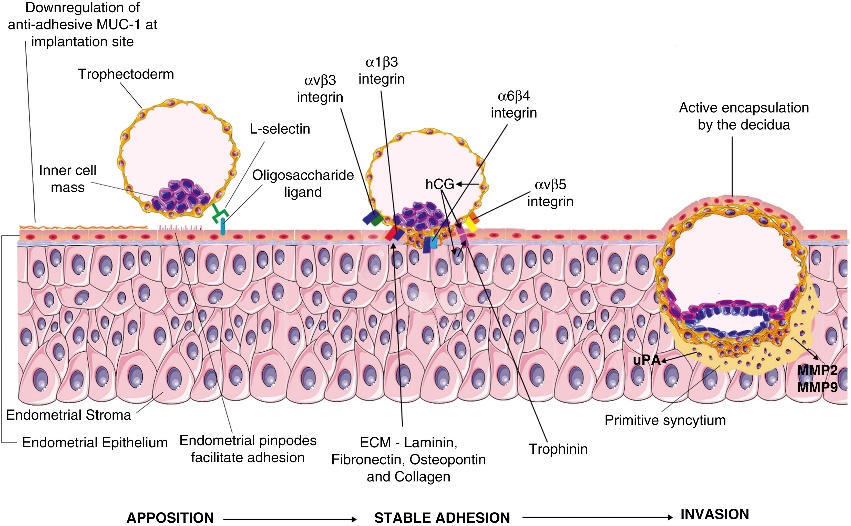
รูปที่ 12 ภาพแสดงสารสำคัญที่เกี่ยวข้องกับกระบวนการฝังตัวของตัวอ่อน
จาก Human embryology and developmental biology. Sixth edition. ed. St. Louis, Mo.: Elsevier; 2019
บทสรุป
กระบวนการปฏิสนธิและการฝังตัวของตัวอ่อนเป็นกระบวนการที่มีความละเอียดซับซ้อนและต้องใช้ความเข้าใจในความสัมพันธ์ของสารต่าง ๆ ทั้งจากระบบอวัยวะสืบพันธุ์เพศชายและเพศหญิง ความผิดพลาดหรือไม่สมบูรณ์ในบางขั้นตอนอาจทำให้เกิดปัญหาต่อการตั้งครรภ์ ผู้เขียนหวังเป็นอย่างยิ่งว่าหากท่านสามารถทำความเข้าใจกระบวนการเหล่านี้จะนำมาซึ่งองค์ความรู้ในการประยุกต์ใช้ ให้คำแนะนำหรือการรักษาที่ถูกต้อง นับว่าเป็นการพัฒนาคุณภาพชีวิตผู้ที่ประสบปัญหาการมีบุตรยาก ซึ่งเป็นปัญหาที่สำคัญที่สุดอย่างหนึ่งของทางสูตินรีเวช
เอกสารอ้างอิง
- Schoenwolf GC, Bleyl SB, Brauer PR, et al. Larsen’s human embryology. Sixth edition. ed. Philadelphia, PA: Elsevier; 2021.
- Boron WF, Boulpaep EL. Medical physiology. Third (3) edition. ed. Philadelphia, PA: Elsevier; 2017.
- Koeppen BM, Stanton BA, Hall JM, Swiatecka-Urban A. Berne & Levy physiology. Eighth edition. ed. Philadelphia, PA: Elsevier; 2024.
- Mescher AL. The Male Reproductive System. Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
- White BA, Harrison JR, Mehlmann L. Endocrine and reproductive physiology. 5th edition. ed. St. Louis, Mo.: Elsevier; 2019.
- Mescher AL. The Female Reproductive System. Junqueira’s Basic Histology Text and Atlas, 16e. New York, NY: McGraw Hill; 2021.
- Berek JS, Berek DL, Berek JS, Novak ER. Berek & Novak’s gynecology. Sixteenth edition. ed. Philadelphia: Wolters Kluwer; 2020.
- Taylor HS, Fritz MA, Pal L, et al. Speroff’s clinical gynecologic endocrinology and infertility. Ninth edition. ed. Philadelphia, PA: Wolters Kluwer; 2020.
- Puga Molina LC, Luque GM, Balestrini PA, et al. Molecular Basis of Human Sperm Capacitation. Frontiers in Cell and Developmental Biology. 2018;6.
- Jin SK, Yang WX. Factors and pathways involved in capacitation: how are they regulated? Oncotarget. 2017;8(2):3600-27.
- Carlson BM, Kantaputra PN. Human embryology and developmental biology. Sixth edition. ed. St. Louis, Mo.: Elsevier; 2019.
- Yanagimachi R. Mammalian Sperm Acrosome Reaction: Where Does It Begin Before Fertilization? Biology of Reproduction. 2011;85(1):4-5.
- Tumova L, Zigo M, Sutovsky P, et al. Ligands and Receptors Involved in the Sperm-Zona Pellucida Interactions in Mammals. Cells. 2021;10(1).
- Lockwood CJ. Creasy and Resnik’s maternal-fetal medicine : principles and practice. Amsterdam: Elsevier; 2022.
- บรรณาธิการ ธีระ ทองสง สูติศาสตร์ sixth ed. Chiang Mai, Thailand: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ 2021.
- Cunningham FG, Leveno KJ, Dashe JS, et al. Implantation and Placental Development. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.