Medical Nutrition Therapy in Pregnancy with Gestational Diabetes Mellitus
Medical Nutrition Therapy in Pregnancy with Gestational Diabetes Mellitus
โภชนบำบัดทางการแพทย์ในสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์
นพ.ศิรวิทย์ ทองสุก
อาจารย์ที่ปรึกษา รศ.พญ.เฟื่องลดา ทองประเสริฐ
โภชนบำบัดทางการแพทย์ หรือ medical nutritional therapy (MNT) คือ กระบวนการวางแผนการปรับเปลี่ยนอาหารให้เหมาะสมกับผู้ป่วยที่เป็นเบาหวานโดยขึ้นอยู่กับความสามารถในการควบคุมระดับน้ำตาลในเลือด รูปแบบการใช้ชีวิตประจำวัน และปัจจัยต่าง ๆ ที่แตกต่างกันไปในแต่ละบุคคล เป็นต้น ซึ่งสตรีตั้งครรภ์ที่ได้รับการวินิจฉัยว่ามีภาวะเบาหวานขณะตั้งครรภ์นั้นควรต้องได้รับคำแนะนำทางด้านโภชนาการกับนักโภชนากรเพื่อให้ได้เป้าหมายดังนี้(1)
- ควบคุมระดับน้ำตาลในเลือดให้ได้ตามเป้าหมาย
- ป้องกันการเกิดภาวะคีโตนในเลือดสูง
- ได้รับสารอาหารที่ครบถ้วนเพียงพอต่อความต้องการของมารดาและทารกในครรภ์
- น้ำหนักมารดาขึ้นตามเกณฑ์ของดัชนีมวลกาย
- ทารกในครรภ์และหลังคลอดมีสุขภาพที่ดี
จากการศึกษาแบบ meta-analysis พบว่าการให้คำแนะนำด้านโภชนบำบัดทางการแพทย์ให้แก่สตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ช่วยลดระดับน้ำตาลหลังอดอาหาร (fasting glucose) ได้ 24.07 มก/ดล และลดระดับน้ำตาลหลังรับประทานอาหาร (postprandial glucose) ได้ 27.78 มก/ดล ซึ่งถือว่าลดได้อย่างมากและมีนัยสำคัญทางสถิติ นอกจากนี้ยังช่วยลดความต้องการการรักษาด้วยยา ทารกแรกคลอดมีน้ำหนักน้อยกว่า และลดอัตราการเกิดภาวะทารกน้ำหนักเกินเมื่อเปรียบเทียบกับกลุ่มควบคุม(2) นอกจากนี้ข้อแนะนำขององค์กรต่าง ๆ เช่น the Australasian Diabetes in Pregnancy Society (ADIPS), the American Dietetic Association (ADA)(3), the Canadian Diabetes Association (CDA), the National Institute for Health and Care Excellence (NICE)(4) และสมาคมโรคเบาหวานแห่งประเทศไทย(5) แนะนำให้ MNT เป็นทางเลือกแรกในการดูแลรักษาภาวะเบาหวานขณะตั้งครรภ์ และ MNT ควรทำโดยนักกำหนดอาหาร (dietitian) หรือบุคลากรที่มีความเชี่ยวชาญและประสบการณ์ในการรักษาภาวะเบาหวานขณะตั้งครรภ์ (a qualified professional with experience in the management of GDM)(6)
ความสำคัญของภาวะเบาหวานขณะตั้งครรภ์
ภาวะเบาหวานขณะตั้งครรภ์ (gestational diabetes mellitus; GDM) เป็นภาวะแทรกซ้อนทางอายุรศาสตร์ที่พบได้บ่อยในเวชปฏิบัติ โดยเฉพาะอย่างยิ่งสตรีตั้งครรภ์ที่มีภาวะอ้วน ทั้งนี้เนื่องจากในปัจจุบันโลกได้มีการพัฒนาไปมากในด้านการอุปโภคบริโภค โดยเฉพาะทางด้านอุตสาหกรรมอาหาร ไม่ว่าจะเป็นการแปรรูปอาหารต่าง ๆ การยืดอายุอาหารได้นานขึ้น และมีความสะดวกสบายในการเข้าถึงแหล่งอาหารได้มากขึ้นโดยเฉพาะอย่างยิ่งอาหารฟาสต์ฟู้ดย่อมส่งผลต่อสุขภาพตามมาอย่างแน่นอน จากการเก็บรวบรวมสถิติในปี ค.ศ. 2015 ทั่วโลกมีสตรีตั้งครรภ์มีภาวะเบาหวานจำนวน 199.5 ล้านคน และคาดว่าปี ค.ศ. 2030 อาจเพิ่มจำนวนสูงขึ้นถึง 313.3 ล้านคน(7)ในประเทศไทยจากการเก็บรวบรวมข้อมูลในปี ค.ศ. 2016 พบภาวะเบาหวานในสตรีตั้งครรภ์ร้อยละ 16.2(8)
การที่สตรีตั้งครรภ์มีภาวะเบาหวานเกิดขึ้นนั้นย่อมส่งผลต่อการตั้งครรภ์และทารกในครรภ์ทั้งในระยะสั้นและระยะยาว ตัวอย่างผลกระทบต่อมารดา เช่น เบาหวานเข้าจอประสาทตา โรคไตจากเบาหวาน ครรภ์เป็นพิษ ติดเชื้อง่าย และมีความเสี่ยงที่จะเป็นเบาหวานชนิดที่ 2 ในอนาคตด้วย ส่วนผลกระทบต่อทารก เช่น ภาวะแท้ง คลอดก่อนกำหนด มีความผิดปกติทางกายภาพ ภาวะทารกตัวโต ภาวะตายในครรภ์ไม่ทราบสาเหตุ เป็นต้น(9) อย่างไรก็ตามภาวะเบาหวานขณะตั้งครรภ์เป็นภาวะที่สามารถตรวจพบได้จากการประเมินความเสี่ยงร่วมกับการตรวจคัดกรองโดยใช้น้ำตาลกลูโคส 50 กรัม(10) ซึ่งหากตรวจพบภาวะเบาหวานขณะตั้งครรภ์ได้เร็วก็จะสามารถให้การดูแลรักษาได้อย่างถูกต้องเพื่อลดภาวะแทรกซ้อนที่อาจเกิดขึ้นได้ดังตัวอย่างข้างต้น นำมาซึ่งการคลอดที่ปลอดภัยทั้งมารดาและทารก(11) เป้าหมายของการดูแลสตรีตั้งครรภ์ที่มีภาวะเบาหวานนั้นคือการควบคุมระดับน้ำตาลให้อยู่ในเกณฑ์ปกติซึ่งสตรีตั้งครรภ์ส่วนใหญ่จะสามารถควบคุมได้ด้วยการปรับเปลี่ยนพฤติกรรมและควบคุมอาหาร(12)
ดังนั้นสตรีตั้งครรภ์ที่ได้รับการวินิจฉัยว่ามีภาวะเบาหวานขณะตั้งครรภ์ควรได้รับแนะนำในการปฏิบัติตัวเพื่อปรับเปลี่ยนพฤติกรรมและบริโภคอาหารในปริมาณและสัดส่วนที่เหมาะสม อย่างไรก็ตามการควบคุมอาหารที่เคร่งครัดหรือจำกัดปริมาณมากเกินไปอาจนำไปสู่การเกิดภาวะคีโตนในร่างกายสูง ภาวะน้ำตาลต่ำในสตรีตั้งครรภ์ หรือเกิดภาวะการเจริญเติบโตของทารกในครรภ์ช้ากว่าเกณฑ์ได้(13) ดังนั้นการให้ความรู้ความเข้าใจที่ถูกต้องแก่สตรีตั้งครรภ์มีภาวะเบาหวานจึงเป็นเรื่องสำคัญ
ในปัจจุบันมีการศึกษาและการใช้โภชนบำบัดทางการแพทย์มาช่วยในการให้ความรู้แก่สตรีตั้งครรภ์ที่มีภาวะเบาหวาน จากหลายการศึกษาพบว่าการใช้โภชนบำบัดทางการแพทย์ร่วมกับการออกกำลังกายและการตรวจวัดระดับน้ำตาลเป็นประจำ สามารถช่วยลดภาวะแทรกซ้อนในมารดาและในทารกได้ระหว่างตั้งครรภ์ได้ทั้งในเชิงระยะสั้นและระยะยาว (ตารางที่1)(14) แต่อย่างไรก็ตามการตระหนักถึงความสำคัญของภาวะเบาหวานระหว่างตั้งครรภ์ของสตรีตั้งครรภ์และครอบครัวก็เป็นปัจจัยนึงที่ส่งผลต่อประสิทธิภาพของการรักษาเช่นกัน
ตารางที่ 1 แสดงภาวะแทรกซ้อนต่อมารดาและทารกในสตรีที่มีภาวะเบาหวานระหว่างตั้งครรภ์
| ระยะเวลา | ภาวะแทรกซ้อนต่อมารดา | ภาวะแทรกซ้อนต่อทารก |
| ระยะสั้น |
|
|
| ระยะยาว |
|
|
ข้อแนะนำในการใช้โภชนบำบัดการทางแพทย์ในสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์
จากที่กล่าวไปข้างต้นการใช้โภชนบำบัดการทางแพทย์มาร่วมใช้ในการให้คำแนะนำเกี่ยวกับการบริโภคอาหารที่เหมาะสมแก่สตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์นั้นจึงมีความจำเป็นเพื่อลดการเกิดภาวะแทรกซ้อนทั้งต่อมารดาและทารก โดยมีคำแนะนำเกี่ยวกับพลังงานและสารอาหารในแต่ละประเภทดังนี้(14)
- ปริมาณพลังงาน (calories intake) (6, 15, 16)
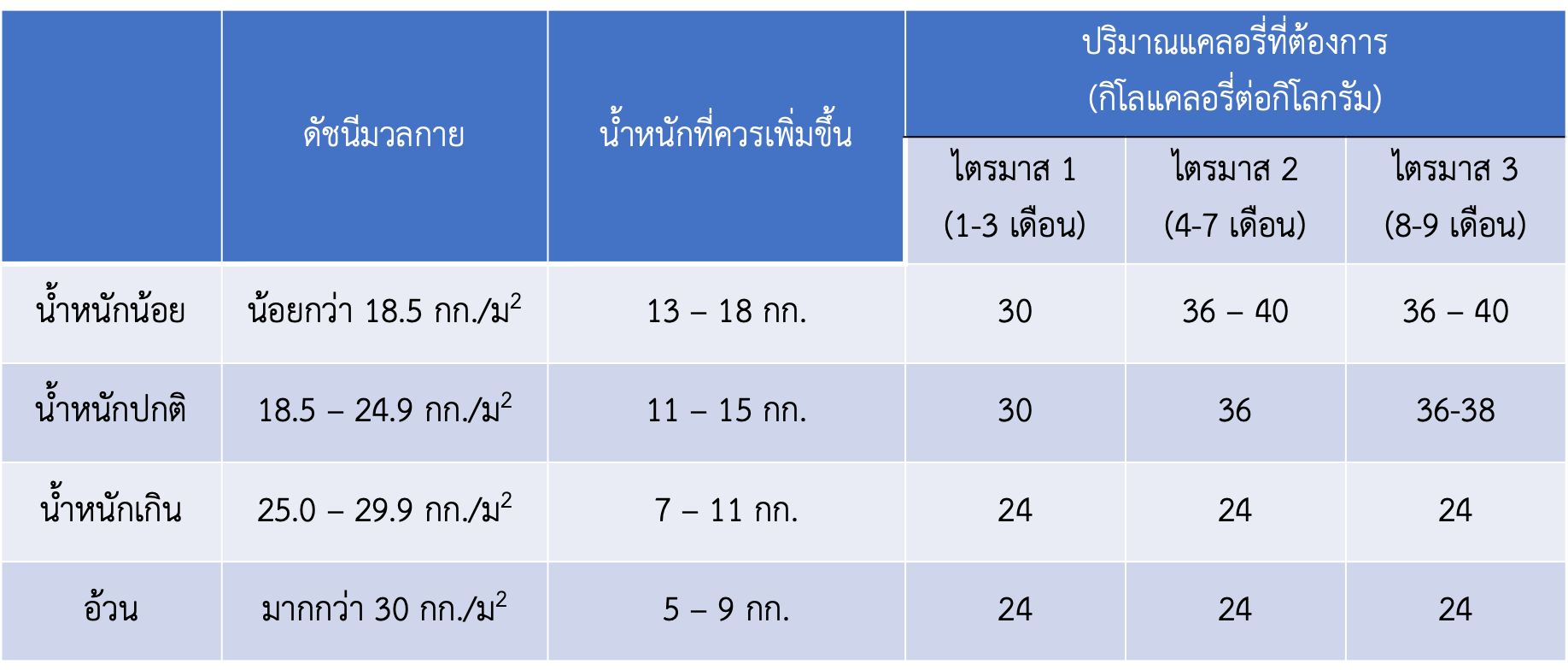
แม้ว่ามีข้อมูลการศึกษาที่จำกัดในการระบุปริมาณพลังงาน (แคลอรี่) ที่เหมาะสมที่สตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ควรได้รับ แต่มีข้อมูลชัดเจนว่าไม่แนะนำให้มีการลดน้ำหนักในสตรีตั้งครรภ์ เนื่องจากการควบคุมและการจำกัดอาหารอย่างเข้มงวดนั้นอาจจะส่งผลต่อการเปลี่ยนไปใช้กรดไขมันปริมาณมาก ซึ่งส่งผลให้เกิดภาวะคีโตนสูงในร่างกายและส่งผลต่อการพัฒนาทางด้านสมองของทารกในอนาคตได้ นอกจากนี้การเพิ่มน้ำหนักระหว่างตั้งครรภ์ให้เหมาะสมตามอายุครรภ์แต่ละไตรมาสเป็นสิ่งที่ควรแนะนำให้สตรีตั้งครรภ์ทุกรายรวมไปถึงสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ด้วย ปริมาณพลังงานที่สตรีตั้งครรภ์ควรได้รับและน้ำหนักที่ควรเพิ่มขึ้นแสดงในตารางที่ 2
ตารางที่ 2 แสดงปริมาณพลังงานที่สตรีตั้งครรภ์ควรได้รับและน้ำหนักที่ควรเพิ่มขึ้นในแต่ละไตรมาส
-
คาร์โบไฮเดรต (carbohydrate) (17-19)
การควบคุมการบริโภคอาหารประเภทคาร์โบไฮเดรตถือเป็นเรื่องที่ยอมรับในสตรีตั้งครรภ์มีภาวะเบาหวานระหว่างตั้งครรภ์ เนื่องจากมีหลายการศึกษาสนับสนุนว่าการควบคุมอาหารจำพวกอาหารประเภทคาร์โบไฮเดรตสามารถลดภาวะเบาหวานในระยะยาวของสตรีตั้งครรภ์และลดภาวะการเกิดทารกตัวโตและการตายคลอดได้อย่างมีนัยสำคัญ จากการศึกษาของ Jovanovic-Peterson พบว่าการจำกัดคาร์โบไฮเดรตสำหรับการรักษาสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ลดความเสี่ยงต่อการกำเนิดทารกตัวโต (20) แต่ในปีค.ศ. 2018 มีการศึกษาการวิเคราะห์อภิมาน (meta-analysis) จากการศึกษาวิจัยจำนวน 18 การศึกษาพบว่าการเลือกรับประทานอาหารที่มีประโยชน์และปรับเปลี่ยนพฤติกรรมการรับประทานอาหารโดยที่ไม่ได้จำกัดการรับประทานอาหารประเภทคาร์โบไฮเดรตก็สามารถช่วยลดระดับน้ำตาลหลังอาหารในเลือดและน้ำหนักทารกได้ โดยชนิดของอาหารประเภทคาร์โบไฮเดรตที่แนะนำคือ คาร์โบไฮเดรตเชิงซ้อน เช่น ข้าวกล้อง ข้าวซ้อมมือ ขนมปังโฮลวีต เป็นต้น ซึ่งมีผลการศึกษาพบว่า สามารถลดระดับน้ำตาลในเลือดได้ดีกว่าเมื่อเปรียบเทียบกับการจำกัดปริมาณคาร์โบไฮเดรต(18)โดยสมาคมโรคเบาหวานประเทศสหรัฐอเมริกา (the american diabetes association, ADA) แนะนำให้สตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ได้รับปริมาณคาร์โบไฮเดรตอย่างน้อย 175 กรัมต่อวันซึ่งคิดเป็นประมาณร้อยละ 35-50 ของปริมาณแคลอรี่ทั้งหมด(7)
การแบ่งมื้ออาหาร มีหลายการศึกษาสนับสนุนการแบ่งอาหารออกเป็นหลาย ๆ มื้อ เนื่องจากพบว่าการกระจายมื้ออาหารนั้นสามารถควบคุมระดับในตาลในกระแสเลือดมารดาซึ่งส่งผลต่อทารกเช่นเดียวกันได้ดีกว่าการไม่แบ่งมื้ออาหาร แต่ทั้งนี้จะแบ่งเป็นกี่มื้อนั้นขึ้นอยู่กับหลาย ๆ ปัจจัย เช่น ดัชนีมวลกายของสตรีตั้งครรภ์ น้ำหนักที่เพิ่มขึ้นระหว่างตั้งครรภ์ ระดับน้ำตาลในเลือดทั้งก่อนและหลังอาหาร การเกิดภาวะคีโตนในเลือด เป็นต้น โดยคำแนะนำทั่วไปมักจะแบ่งมื้ออาหารออกเป็น 3 มื้อหลัก คือ มื้อเช้า กลางวัน และมื้อเย็น โดยแบ่งอัตราส่วนของอาหารประเภทคาร์โบไฮเดรตที่ต้องบริโภคต่อวันในแต่ละมื้อเป็นร้อยละ เช่น ร้อยละ 10-20 ในมื้อเช้า, ร้อยละ 20-30 ในมื้อกลางวัน และร้อยละ 30-40 ในมื้อเย็น ตามลำดับ และบริโภคอาหารประเภทคาร์โบไฮเดรตประมาณร้อยละ 5-10 ในมื้ออาหารว่างอีก 3 มื้อต่อวัน จากอัตราส่วนการแบ่งมื้ออาหารดังกล่าวจะเห็นได้ว่าในมื้อเช้ามีอัตราส่วนของการบริโภคอาหารประเภทคาร์โบไฮเดรตน้อยที่สุดเมื่อเทียบกับมื้ออื่น ๆ เนื่องจากในช่วงเช้าโดยทั่วไปร่างกายจะมีการผลิตฮอร์โมนคอร์ติซอล (cortisol) ซึ่งจะส่งผลเพิ่มระดับน้ำตาลในเลือดค่อนข้างมาก ดังนั้นการลดปริมาณคาร์โบไฮเดรตลงประมาณ 15-30 กรัม จะช่วยลดภาวะน้ำตาลในเลือดสูงของสตรีตั้งครรภ์ที่มีภาวะหวานได้
อาหารประเภทค่าดัชนีน้ำตาลต่ำ (low glycemic index food) การรับประทานอาหารประเภทค่าดัชนีน้ำตาลต่ำเป็นอีกทางเลือกหนึ่งที่แนะนำในสตรีตั้งครรภ์ที่มีภาวะเบาหวาน การแบ่งชนิดของอาหารตามค่าดัชนีน้ำตาลต่ำนั้นเป็นการจัดลำดับอาหารกลุ่มแป้งหรือคาร์โบไฮเดรตว่ามีผลต่อระดับน้ำตาลในเลือดมากน้อยเพียงใดหลังจากที่กินอาหารชนิดนั้น ๆ ไปแล้ว 1-2 ชั่วโมง โดยกำหนดค่าดัชนีน้ำตาล (glycemic index; GI) เป็นระดับตั้งแต่ 0-100 อาหารที่มีค่าดัชนีน้ำตาลสูง (high glycemic index) หรือมีค่าดัชนีน้ำตาลมากกว่า 70 จะถูกดูดซึมได้เร็วและทำให้ระดับน้ำตาลในเลือดขึ้นสูงและเร็วกว่าอาหารที่มีค่าดัชนีน้ำตาลต่ำ (low glycemic index) หรือมีมีค่าดัชนีน้ำตาลน้อยกว่า 55 ซึ่งจะถูกย่อยช้าและกลูโคสถูกดูดซึมเข้าไปในกระแสเลือดอย่างช้า ๆ ทำให้ระดับน้ำตาลในเลือดขึ้นช้ากว่าและคงอยู่ในกระแสเลือดนานไปด้วย ชนิดของอาหารตามค่าดัชนีน้ำตาลแสดงในตารางที่ 3
ตารางที่ 3 แสดงชนิดของอาหารตามค่าดัชนีน้ำตาล
| อาหารชนิดดัชนีน้ำตาลต่ำ
(< 55) |
อาหารชนิดดัชนีน้ำตาลกลาง
(55-69) |
อาหารชนิดดัชนีน้ำตาลสูง
(70-100) |
| นม โยเกิร์ต นมถั่วเหลือง นมอัลมอนด์ น้ำมันมะกอก ข้าวกล้อง สตรอว์เบอร์รี แอปเปิล ชมพู่ แก้วมังกร แครอท มะเขือเทศ ข้าวโพด บรอกโคลี ดอกกะหล่ำ มันหวานต้ม เป็นต้น | กล้วย สับปะรด ลูกเกด น้ำส้ม น้ำผึ้ง เป็นต้น | ข้าวขัดสี ขนมปังขาว น้ำนมข้าว แตงโม มันฝรั่ง บะหมี่กึ่งสำเร็จรูป เค้ก คุ้กกี้ ของหวาน ลูกอม และน้ำหวาน เป็นต้น |
จากการศึกษาของ Grant และคณะพบว่าการรับประทานอาหารที่มีค่าดัชนีน้ำตาลต่ำสามารถนำไปปรับใช้ในชีวิตประจำวันได้ง่ายและช่วยควบคุมระดับน้ำตาลหลังรับประทานอาหารให้ได้ตามเป้าหมายมากกว่ากลุ่มควบคุม(21) การศึกษาของ Mahajan และคณะพบว่าการรับประทานอาหารที่มีค่าดัชนีน้ำตาล สามารถช่วยให้ผลลัพธ์ของการตั้งครรภ์ต่อมารดาและทารกดี และยังทำให้สตรีตั้งครรภ์สามารถนำไปปฏิบัติได้อย่างต่อเนื่องในระยะยาวโดยไม่เกิดภาวะเครียดจากการควบคุมอาหารมากเกินไป(22) การศึกษาของ Louie และคณะพบว่าการรับประทานอาหารที่มีค่าดัชนีน้ำตาลต่ำสามารถควบคุมระดับน้ำตาลในเลือดได้ดีกว่าการรับประทานอาหารที่มีค่าดัชนีน้ำตาลปานกลาง (moderate glycemic index)(23) นอกจากนี้การรับประทานอาหารที่มีค่าดัชนีน้ำตาลต่ำยังช่วยลดการใช้อินซูลินระหว่างตั้งครรภ์โดยไม่ทำให้ผลลัพธ์การตั้งครรภ์แย่ลง(24) และช่วยลดระดับไขมันในเลือดอีกด้วย(25)
อาหารประเภทกากใย (fiber) สมาคมโรคเบาหวานประเทศสหรัฐอเมริกา (the american diabetes association, ADA) แนะนำให้บริโภคอาหารประเภทกากใยอย่างน้อย 28 กรัมต่อวัน เนื่องจากอาหารประเภทกากใยสามารถควบคุมระดับน้ำตาลในเลือดหลังอาหารได้ดี มีการศึกษาพบว่าการบริโภคอาหารประเภทกากใยประมาณ 80 กรัมต่อวัน สามารถลดภาวะแทรกซ้อนจากการตั้งครรภ์ได้โดยเฉพาะอย่างยิ่งภาวะทารกตัวโต และมีผลต่อระบบทางเดินอาหารน้อย(26) ตัวอย่างอาหารที่มีกากใยสูง เช่น ธัญพืช ผัก ผลไม้ เป็นต้น
-
โปรตีน (protein)(14)
โปรตีนเป็นประเภทอาหารที่ความสำคัญอย่างมากต่อการเจริญเติบโตและพัฒนาการของทารกในครรภ์ สมาคมโรคเบาหวานประเทศสหรัฐอเมริกา (the american diabetes association, ADA) แนะนำว่าสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์ควรบริโภคโปรตีนอย่างน้อย 71 กรัมต่อวัน จากการศึกษาวิจัยความต้องการของโปรตีนของสตรีตั้งครรภ์ในแต่ละช่วงอายุครรภ์พบว่ามีการต้องการของโปรตีนเพิ่มขึ้นเมื่ออายุครรภ์เพิ่มขึ้นจากปริมาณ 1.2 กรัม/กิโลกรัม/วัน ที่อายุครรภ์ 16 สัปดาห์ เพิ่มเป็น 1.52 กรัม/กิโลกรัม/วัน เมื่ออายุครรภ์มากกว่านั้น ตัวอย่างอาหารประเภทโปรตีนที่แนะนำในสตรีตั้งครรภ์ เช่น ไข่ ถั่วเหลือง ถั่ว เนื้อที่ไร้มัน โดยเฉพาะอย่างยิ่งอาหารทะเลและปลา ซึ่งอุดมไปด้วยเหล็ก โปรตีน โอเมกาสาม (omega 3) ซึ่งช่วยส่งเสริมเกี่ยวกับการพัฒนาสมองของทารกในครรภ์ด้วย แต่ทั้งนี้อาหารทะเลอาจจะต้องเลือกรับประทานอย่างระมัดระวังเนื่องจากอาจมีโลหะหนักปนมากับอาหารทะเล(27) ซึ่งส่งผลเสียต่อทั้งมารดาและทารกได้
-
ไขมัน (fat)
การบริโภคอาหารประเภทไขมันนั้นแนะนำให้บริโภคเท่าที่จำเป็นโดยคิดเป็นร้อยละ 20-35 ของพลังงานทั้งหมดต่อวัน และไม่แนะนำให้บริโภคอาหารที่มีกรดไขมันอิ่มตัว (saturated fatty acid) และกรดไขมันทรานส์ (trans fatty acid) จากที่ได้กล่าวไปข้างต้นว่าควรบริโภคอาหารประเภทคาร์โบไฮเดรตในปริมาณที่เหมาะสมโดยไม่จำกัดปริมาณมากเกินไป ซึ่งจะทำให้สตรีตั้งครรภ์ปรับเปลี่ยนพฤติกรรมไปบริโภคอาหารประเภทไขมันแทนในปริมาณที่มากขึ้น และการบริโภคอาหารที่มีไขมันสูงปริมาณมากนั้นจะส่งผลทำให้เกิดภาวะดื้อต่ออินซูลินตามมา นอกจากนี้มีการศึกษาพบว่าการมีระดับไตรกลีเซอไรด์ (triglyceride) และกรดไขมันอิสระ (free fatty acid) ในเลือดสูงมีความสัมพันธ์กับการเกิดภาวะทารกตัวโต เนื่องจากไตรกลีเซอไรด์และกรดไขมันอิสระสามารถส่งผ่านรกไปหาทารกได้(28)
อาหารประเภท DASH (Dietary Approaches to Stop Hypertension) เป็นการรับประทานอาหารที่ช่วยให้ผู้ที่มีภาวะความดันโลหิตสูงสามารถควบคุมความดันโลหิตได้ดียิ่งขึ้น โดยจะเน้นการกินผัก ผลไม้ ธัญพืช และเนื้อสัตว์ไม่ติดมัน ซึ่งจากการศึกษาพบว่าการรับประทานอาหารประเภท DASH นั้นสามารถลดระดับไตรกลีเซอไรด์และกรดไขมันอิสระในเลือดลงได้ รวมถึงลดระดับน้ำตาลสะสม (HbA1c) ลดความดันโลหิต และช่วยลดภาวะดื้อต่ออินซูลินได้ด้วย(29)
-
วิตามินและแร่ธาตุ (vitamins and minerals)(30, 31)
ภาวะตั้งครรภ์นั้นถือเป็นช่วงเวลามีความต้องการวิตามินและแร่ธาตุสูงเมื่อเทียบกับช่วงเวลาอื่น ๆ ในชีวิต โดยเฉพาะอย่างยิ่งกรดโฟลิค (folic acid) ซึ่งแนะนำให้สตรีตั้งครรภ์ทุกรายได้รับอย่างน้อย 0.4 มิลลิกรัมต่อวัน และ 4 มิลลิกรัมต่อวันในสตรีตั้งครรภ์ที่เคยมีลูกเป็นโรคในกลุ่ม neural tube defects (NTDs) เนื่องจากมีความจำเป็นต่อการเจริญเติบโตของเซลล์ต่าง ๆ รวมถึงการพัฒนาการด้านสมองของทารกในครรภ์ โดยแนะนำให้รับประทานก่อนการตั้งครรภ์อย่างน้อย 1 เดือนจนถึงประมาณอายุครรภ์ 12 สัปดาห์
วิตามินซีและอี (vitamin C and E) จะมีส่วนช่วยในการต้านอนุมูลอิสระ คล้ายกับการทำลายสารพิษหรือของเสียที่เกิดขึ้นในตัวทารก และพบว่าวิตามันซีและอียังช่วยลดการเกิดภาวะครรภ์เป็นพิษได้อีกด้วย (เพิ่ม reference)
วิตามินดี (vitamin D) จากการศึกษาของ Asemmi และคณะศึกษาเปรียบเทียบระดับน้ำตาลในเลือดระหว่างกลุ่มที่ได้รับวิตามินดีกับกลุ่มควบคุมพบว่ากลุ่มที่ได้รับวิตามินดี 50,000 IU ปริมาณ 2 โดส เป็นระยะเวลา 6 สัปดาห์สามารถลดระดับน้ำตาลในเลือดก่อนอาหาร และลดภาวะดื้อต่ออินซูลินได้อย่างมีนัยสำคัญ(32)
แคลเซียม (calcium) มีความจำเป็นอย่างมากในระยะตั้งครรภ์เนื่องจากมีประโยชน์ต่อการสร้างกระดูกของมารดาและทารกโดยแนะนำให้บริโภคอย่างน้อย 900-1000 มิลลิกรัมต่อวัน และรับประทานพร้อมกับมื้ออาหารเพื่อประสิทธิภาพในการดูดซึม
-
สารอาหารประเภทอื่น ๆ
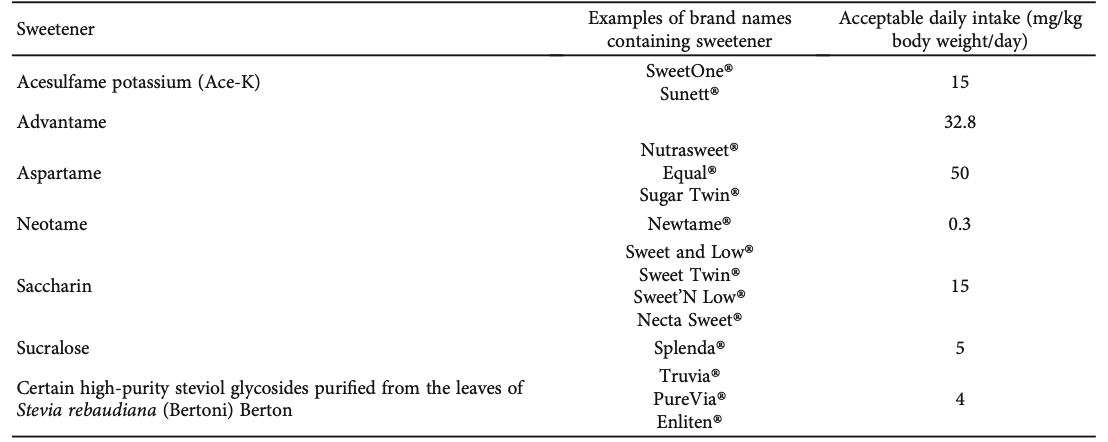
สารทดแทนความหวาน (sweeteners) สตรีตั้งครรภ์สามารถบริโภคสารทดแทนความหวานที่ผ่านการรับรองจากองค์กรอาหารและยาประเทศสหรัฐอเมริกา (United states food and drug administration, US-FDA) ได้ แต่ควรบริโภคในปริมาณที่เหมาะสม โดยชนิดของสารทดแทนความหวานที่ได้รับการรับรองว่าสามารถใช้ได้และปลอดภัยต่อมารดาและทารก เช่น Aspartame, Sucralose, Neotame, Advantame, Xylitol, Sorbitol และ Stevia เป็นต้น ดังแสดงในตารางที่ 4
ตารางที่ 4 แสดงชนิดของสารทดแทนความหวานและปริมาณที่แนะนำให้บริโภคต่อวันในสตรีตั้งครรภ์ที่มีภาวะเบาหวานขณะตั้งครรภ์(33)
คาเฟอีน (caffeine) ในสตรีตั้งครรภ์ที่มีภาวะเบาหวานนั้นสามารถบริโภคได้แต่ควรจำกัดปริมาณไม่เกิน 200 มิลลิกรัมต่อวัน
- อาหารที่ควรหลีกเลี่ยง
- ไม่กินเนื้อสัตว์ติดมัน เช่น หมูสามชั้น คอหมู หนังไก่ หนังเป็ด ไส้กรอก เป็นต้น
- ไม่กินขนมที่มีรสหวาน เช่น ไอศกรีม หวานเย็น ช็อคโกแลต หมากฝรั่ง ลูกอม เยลลี่ เป็นต้น
- ไม่ดื่มเครื่องดื่มรสหวาน เช่น น้ำอัดลม ชาเย็นน้ำปั่น น้ำผลไม้รสเปรี้ยว
- ไม่กินขนม เช่น เค้ก พายโดนัท
- ไม่เติมเครื่องปรุงรสเค็ม เช่น น้ำปลา ซีอิ๊วดำ แมกกี้
- ไม่เติมน้ำตาลในอาหาร
- ไม่กินของหมักดอง
- ไม่ดื่มเครื่องดื่มแอลกอฮอล์
การติดตามระดับน้ำตาลและเป้าหมายของระดับน้ำตาลในเลือด(7)
การติดตามระดับน้ำตาลด้วยตัวเอง (self-monitoring of blood glucose; SMBG) เป็นสิ่งที่สตรีตั้งครรภ์สามารถทำได้เองที่บ้าน ทำได้โดยการเจาะเลือดปลายนิ้วเพื่อตรวจระดับน้ำตาลก่อนรับประทานอาหาร และที่ 1 หรือ 2 ชั่วโมงหลังรับประทานอาหาร โดยเป้าหมายของระดับน้ำตาลไม่ควรสูงกว่า 95, 140, 120 มก/ดล ตามลำดับ หรืออาจตรวจติดตามโดยการนัดเจาะเลือดในสถานพยาบาลอย่างสม่ำเสมอ เช่น ทุก 2-4 สัปดาห์ เป็นต้น ขึ้นอยู่กับระดับการควบคุมน้ำตาลในเลือด และหากไม่สามารถควบคุมระดับน้ำตาลในเลือดให้ได้ตามเป้าหมาย ควรปรึกษาอายุรแพทย์ผู้เชี่ยวชาญด้านต่อมไร้ท่อ
นอกจากนี้การบันทึกอาหารที่รับประทานในสมุดบันทึกอาหาร (food record form) เป็นรูปแบบของการวัดผลของการควบคุมอาหารเพื่อที่จะได้ทราบถึงชนิดและปริมาณอาหารที่บริโภคกับผลลัพธ์ที่ได้จากการตรวจติดตามระดับน้ำตาลในเลือด ส่งผลให้สตรีตั้งครรภ์สามารถปรับเปลี่ยนพฤติกรรมให้ได้ผลลัพธ์ตามเป้าหมายอย่างทันท่วงที
เอกสารอ้างอิง (References)
1. Bantle JP, Wylie-Rosett J, Albright AL, Apovian CM, Clark NG, Franz MJ, et al. Nutrition recommendations and interventions for diabetes: a position statement of the American Diabetes Association. Diabetes care. 2008;31:S61-S78.
2. Hernandez TL, Brand-Miller JC. Nutrition therapy in gestational diabetes mellitus: time to move forward. Diabetes Care. 2018;41(7):1343-5.
3. Rudland VL, Price SA, Hughes R, Barrett HL, Lagstrom J, Porter C, et al. ADIPS 2020 guideline for pre‐existing diabetes and pregnancy. Australian and New Zealand Journal of Obstetrics and Gynaecology. 2020;60(6):E18-E52.
4. Lazzerini M, Armocida B, Valente EP, Berdzuli N. Antenatal screening practices in the WHO European Region: a mixed methods study. Journal of Global Health. 2020;10(2).
5. แนวทางเวชปฏิบัติสำหรับโรคเบาหวาน ส. 2560.
6. Moreno-Castilla C, Mauricio D, Hernandez M. Role of medical nutrition therapy in the management of gestational diabetes mellitus. Current diabetes reports. 2016;16(4):22.
7. Association AD. 14. Management of diabetes in pregnancy: Standards of Medical Care in Diabetes—2021. Diabetes Care. 2021;44(Supplement 1):S200-S10.
8. ประภัทร วานิชพงษ์พันธุ์ ตเ. ตำราสูติศาสตร์. กรุงเทพมหานคร: กรุงเทพฯ ภาควิชาสูติศาสตร์-นรีเวชวิทยา คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล; 2560.
9. Cunningham FG, Leveno KJ, Bloom SL, Dashe JS, Hoffman BL, Casey BM, et al. Obstetrícia de Williams-25: McGraw Hill Brasil; 2021.
10. Mellitus GD. ACOG practice bulletin. ACOG: Washington, DC, USA. 2018.
11. Cao X, Wang Z, Yang C, Mo X, Xiu L, Li Y, et al. Comprehensive intensive therapy for Chinese gestational diabetes benefits both newborns and mothers. Diabetes technology & therapeutics. 2012;14(11):1002-7.
12. Dornhorst A, Nicholls JS, Probst F, Paterson CM, Hollier KL, Elkeles RS, et al. Calorie restriction for treatment of gestational diabetes. Diabetes. 1991;40(Supplement 2):161-4.
13. Magee MS, Knopp RH, Benedetti TJ. Metabolic effects of 1200-kcal diet in obese pregnant women with gestational diabetes. Diabetes. 1990;39(2):234-40.
14. Vasile FC, Preda A, Ștefan AG, Vladu MI, Forțofoiu M-C, Clenciu D, et al. An Update of Medical Nutrition Therapy in Gestational Diabetes Mellitus. Journal of Diabetes Research. 2021;2021.
15. Kleinwechter H, Schäfer-Graf U, Bührer C, Hoesli I, Kainer F, Kautzky-Willer A, et al. German Association for Gynaecology and Obstetrics. Gestational diabetes mellitus (GDM) diagnosis, therapy and follow-up care: Practice Guideline of the German Diabetes Association (DDG) and the German Association for Gynaecologyand Obstetrics (DGGG). Exp Clin Endocrinol Diabetes. 2014;122(7):395-405.
16. Qian M, Wu N, Li L, Yu W, Ouyang H, Liu X, et al. Effect of Elevated Ketone Body on Maternal and Infant Outcome of Pregnant Women with Abnormal Glucose Metabolism During Pregnancy. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 2020;13:4581.
17. Jovanovic-Peterson L, Peterson CM. Dietary manipulation as a primary treatment strategy for pregnancies complicated by diabetes. Journal of the American College of Nutrition. 1990;9(4):320-5.
18. Yamamoto JM, Kellett JE, Balsells M, Garcia-Patterson A, Hadar E, Solà I, et al. Gestational diabetes mellitus and diet: a systematic review and meta-analysis of randomized controlled trials examining the impact of modified dietary interventions on maternal glucose control and neonatal birth weight. Diabetes Care. 2018;41(7):1346-61.
19. Louie JC-Y, Flood V, Turner N, Everingham C, Gwynn J. Methodology for adding glycemic index values to 24-hour recalls. Nutrition. 2011;27(1):59-64.
20. Jovanovic-Peterson L, Peterson CM, Reed GF, Metzger BE, Mills JL, Knopp RH, et al. Maternal postprandial glucose levels and infant birth weight: the Diabetes in Early Pregnancy Study. American journal of obstetrics and gynecology. 1991;164(1):103-11.
21. Grant SM, Wolever TM, O’Connor DL, Nisenbaum R, Josse RG. Effect of a low glycaemic index diet on blood glucose in women with gestational hyperglycaemia. Diabetes research and clinical practice. 2011;91(1):15-22.
22. Mahajan A, Donovan LE, Vallee R, Yamamoto JM. Evidenced-based nutrition for gestational diabetes mellitus. Current diabetes reports. 2019;19(10):1-10.
23. Louie JCY, Markovic TP, Perera N, Foote D, Petocz P, Ross GP, et al. A randomized controlled trial investigating the effects of a low–glycemic index diet on pregnancy outcomes in gestational diabetes mellitus. Diabetes care. 2011;34(11):2341-6.
24. Moses RG, Barker M, Winter M, Petocz P, Brand-Miller JC. Can a low–glycemic index diet reduce the need for insulin in gestational diabetes mellitus?: A randomized trial. Diabetes care. 2009;32(6):996-1000.
25. Ma W-J, Huang Z-H, Huang B-X, Qi B-H, Zhang Y-J, Xiao B-X, et al. Intensive low-glycaemic-load dietary intervention for the management of glycaemia and serum lipids among women with gestational diabetes: a randomized control trial. Public Health Nutrition. 2015;18(8):1506-13.
26. Reece E, Hagay Z, Gay L, Oconnor T, DeGennaro N, Homko C, et al. A RANDOMIZED CLINICAL-TRIAL OF A FIBER-ENRICHED DIABETIC DIET VS THE STANDARD AMERICAN-DIABETES-ASSOCIATION RECOMMENDED DIET IN THE MANAGEMENT OF DIABETES-MELLITUS IN PREGNANCY. Journal of Maternal-Fetal Investigation. 1995;5(1):8-12.
27. Storelli M, Marcotrigiano G. Fish for human consumption: risk of contamination by mercury. Food Additives & Contaminants. 2000;17(12):1007-11.
28. DiPietro L, Buchner DM, Marquez DX, Pate RR, Pescatello LS, Whitt-Glover MC. New scientific basis for the 2018 US Physical Activity Guidelines. Journal of sport and health science. 2019;8(3):197.
29. Asemi Z, Samimi M, Tabassi Z, Esmaillzadeh A. The effect of DASH diet on pregnancy outcomes in gestational diabetes: a randomized controlled clinical trial. European journal of clinical nutrition. 2014;68(4):490-5.
30. Blumer I, Hadar E, Hadden DR, Jovanovič L, Mestman JH, Murad MH, et al. Diabetes and pregnancy: an endocrine society clinical practice guideline. The journal of clinical endocrinology & Metabolism. 2013;98(11):4227-49.
31. Fu Z-m, Ma Z-z, Liu G-j, Wang L-l, Guo Y. Vitamins supplementation affects the onset of preeclampsia. Journal of the Formosan Medical Association. 2018;117(1):6-13.
32. Asemi Z, Tabassi Z, Samimi M, Fahiminejad T, Esmaillzadeh A. Favourable effects of the Dietary Approaches to Stop Hypertension diet on glucose tolerance and lipid profiles in gestational diabetes: a randomised clinical trial. British journal of nutrition. 2013;109(11):2024-30.
33. Food U, Administration D. Additional information about high-intensity sweeteners permitted for use in food in the United States. US Food and Drug Administration: Silver Spring, MD, USA. 2018.


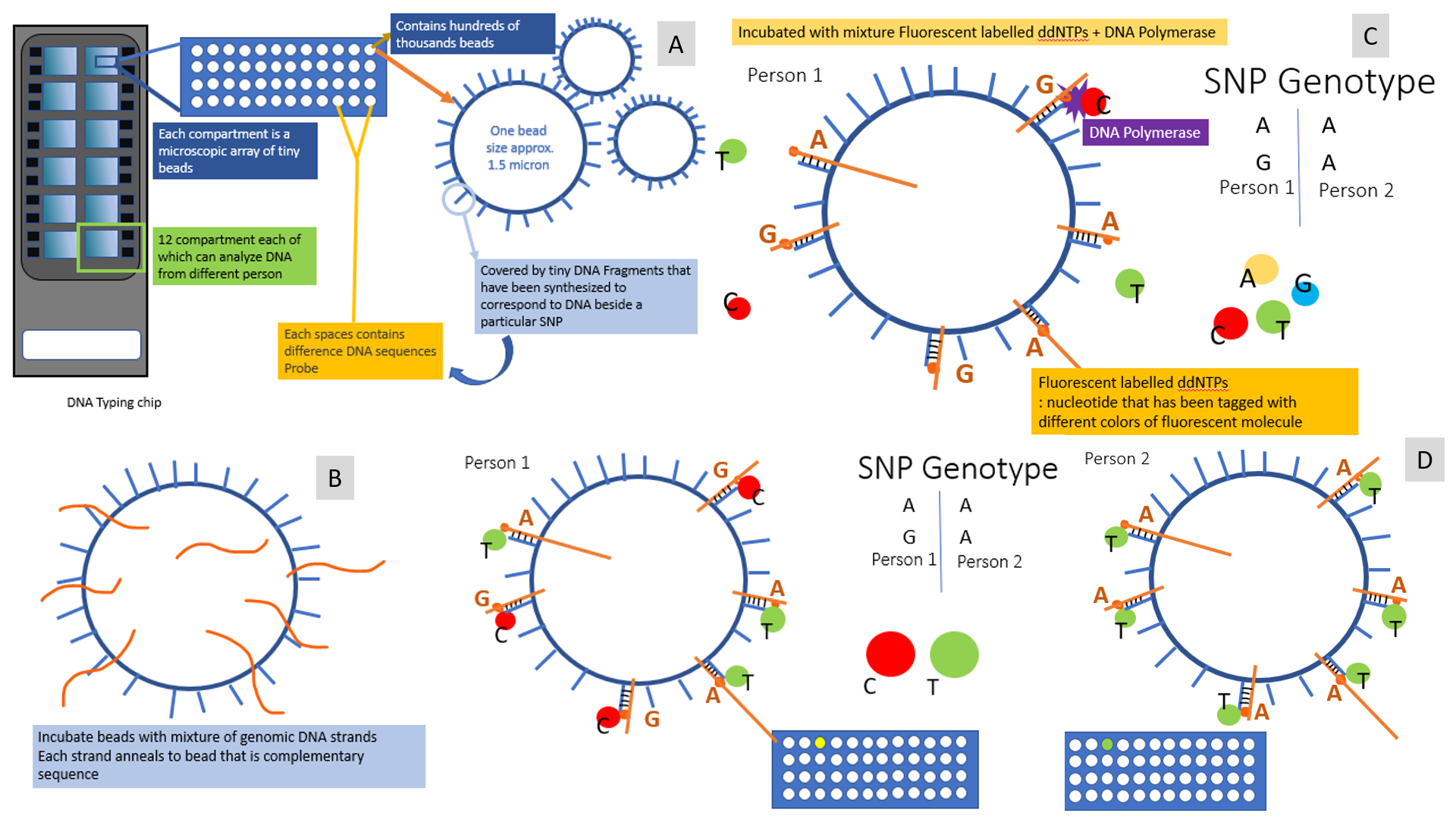
 รูปที่ 3 ภาพแสดง Chromosomal microarray analysis
รูปที่ 3 ภาพแสดง Chromosomal microarray analysis