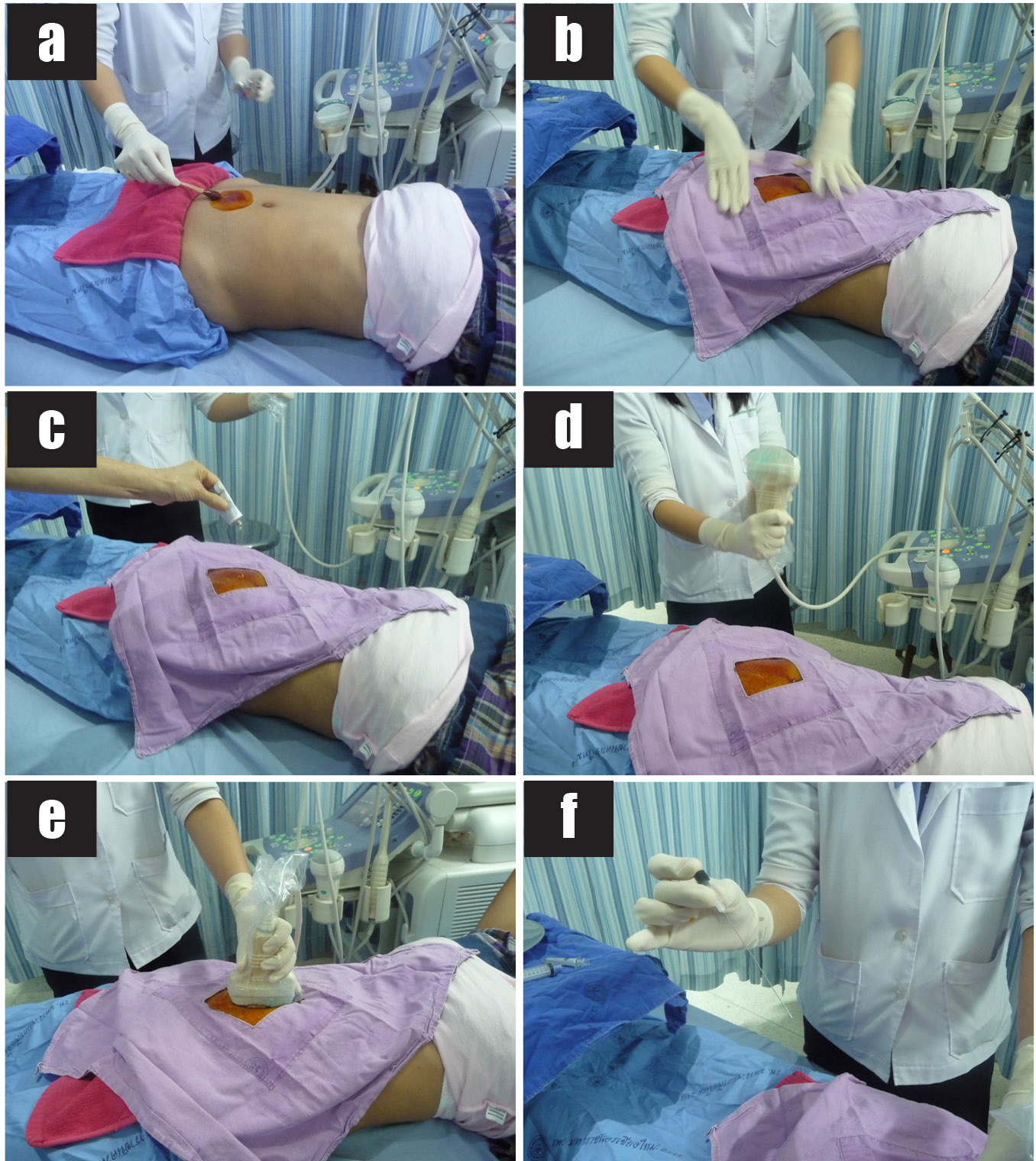
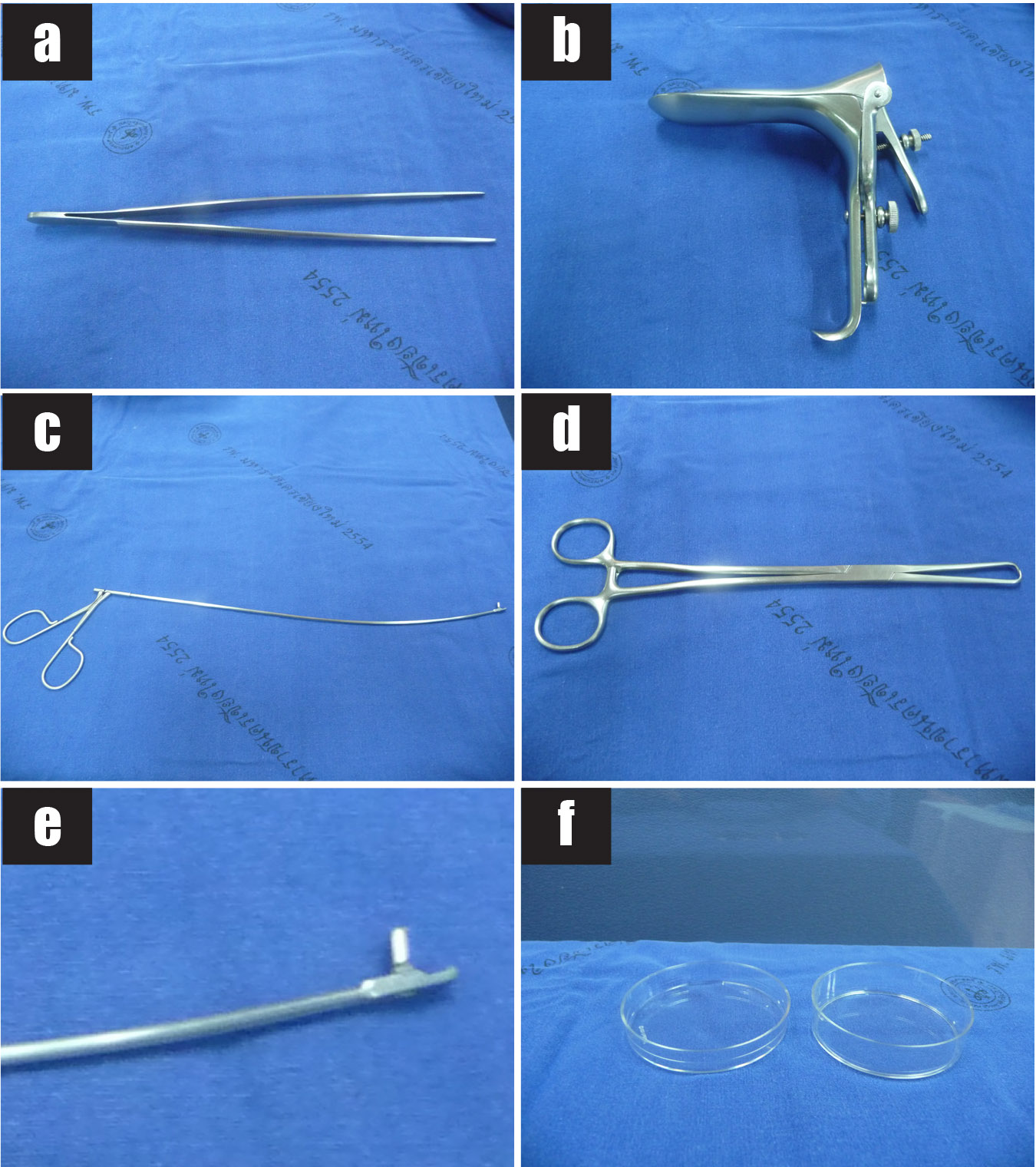
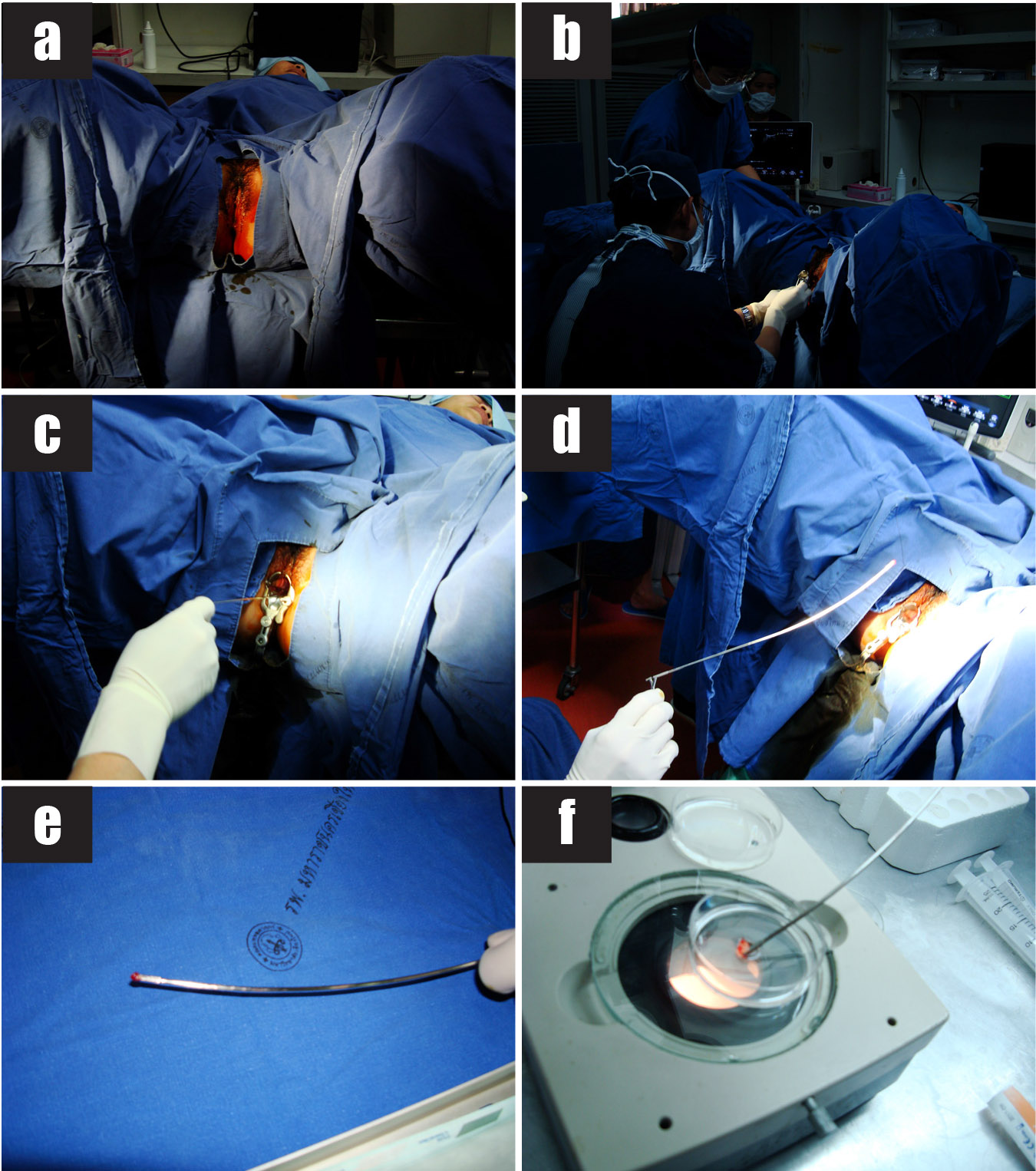
Invasive prenatal diagnosis in multiple pregnancies
หัตถการการวินิจฉัยก่อนคลอดในครรภ์แฝด : Invasive prenatal diagnosis in multiple pregnancies
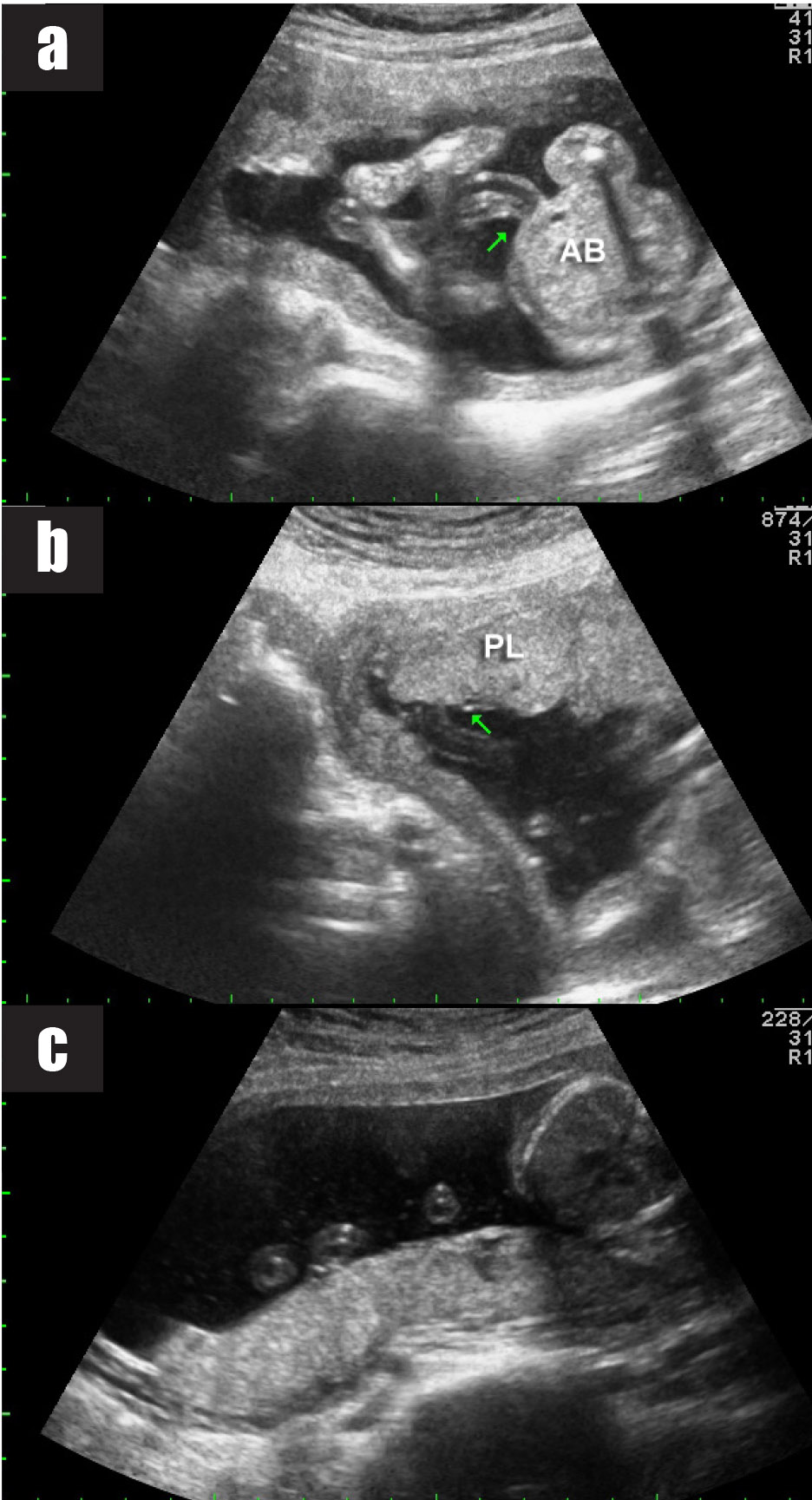
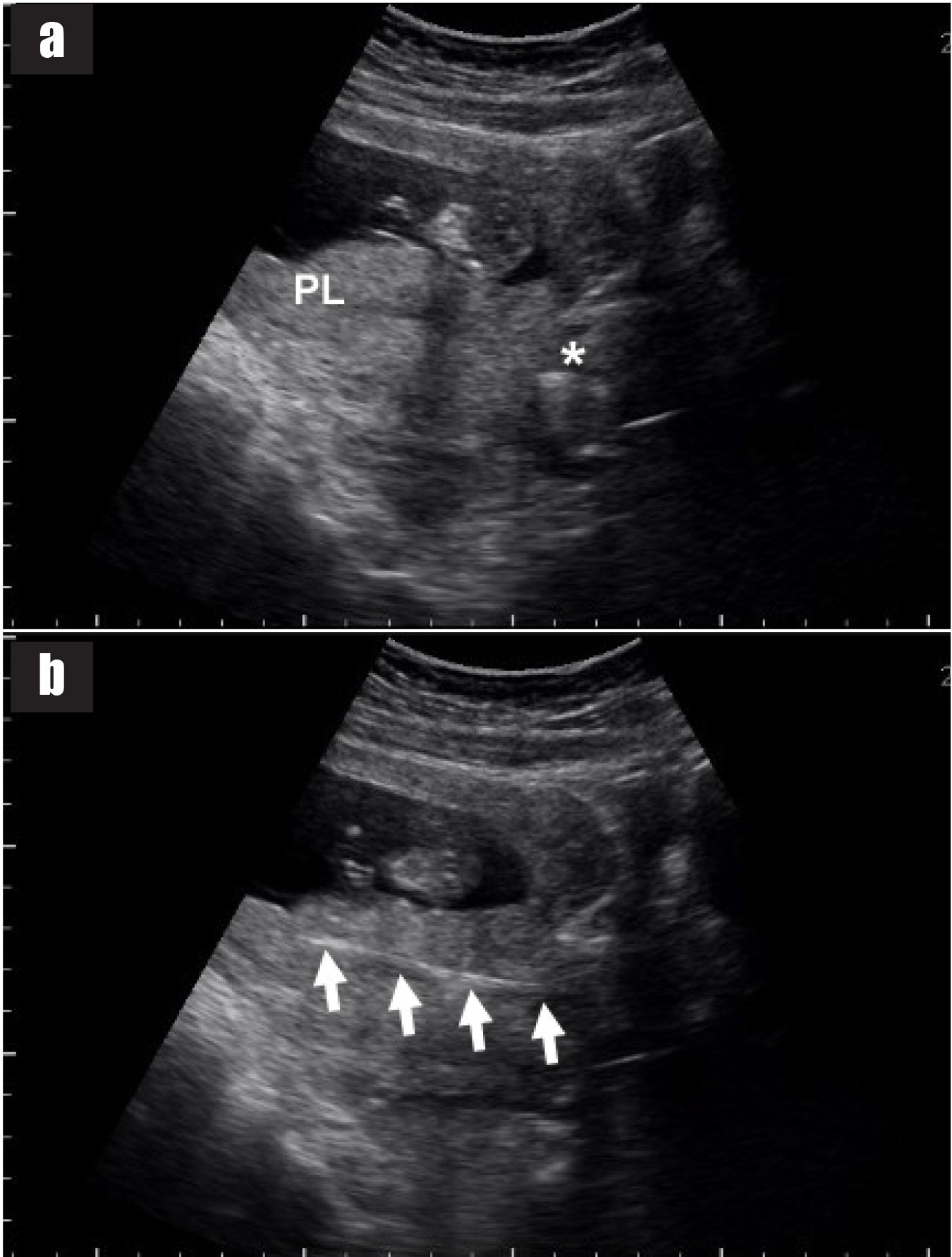
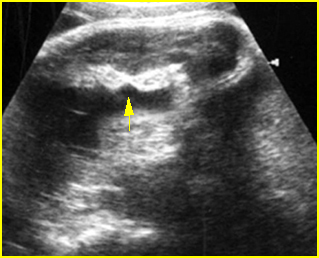
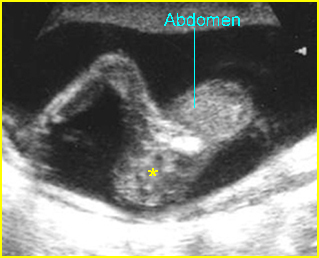
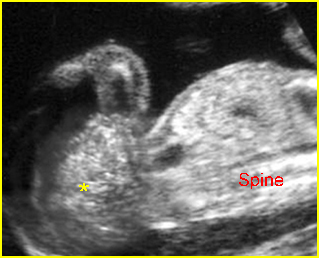
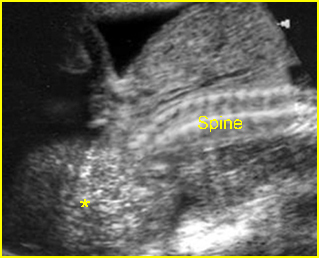
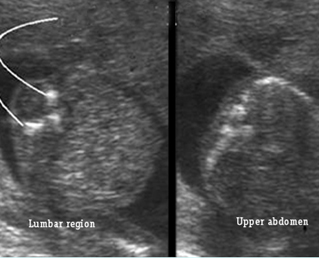
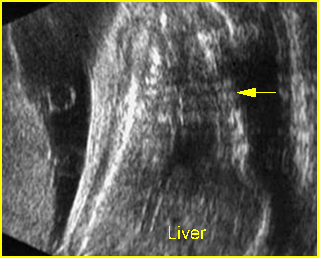
การวินิจฉัยก่อนคลอดในการตั้งครรภ์แฝด มีความจำเป็นต้องทราบ chorionicity ก่อนการทำหัตถการเพื่อกำหนดจำนวนครั้งของการเก็บตัวอย่างเซลล์ทารกในครรภ์ การตรวจอัลตราซาวด์สามารถประเมินจำนวนรก, ตำแหน่งการเกาะของรก (placental implantation sites), ความหนาของเยื่อกั้น (intertwin membrane / dividing membrane) และการพบ lambda sign (twin peak sign) ในการตั้งครรภ์ dichorionic placentas ซึ่งมีความแตกต่างจาก T sign (non-peaked sign) ในการตั้งครรภ์ monochorionic placenta นอกจากนี้การกำหนดตำแหน่งของทารกในครรภ์ให้แม่นยำก่อนการทำหัตถการการวินิจฉัยก่อนคลอดยังมีความสำคัญหากจำเป็นต้องยุติการตั้งครรภ์ในทารกคนใดคนหนึ่ง
-
การเจาะชิ้นเนื้อรกในครรภ์แฝด
การเก็บตัวอย่างชิ้นเนื้อรกในครรภ์แฝดสามารถทำได้โดยการใช้เข็มเจาะผ่านทางหน้าท้องมารดา (transabdominal CVS) หรือ การดูดเก็บหรือคีบตัดชิ้นเนื้อรกโดยใช้อุปกรณ์สอดผ่านทางปากมดลูก (transcervical CVS) หรือทำทั้ง 2 วิธีร่วมกัน โดยอาจเก็บชิ้นเนื้อรก 1 หรือ 2 ครั้ง โดยใช้ข้อพิจารณาดังนี้
- เก็บตัวอย่างชิ้นเนื้อรก 1 ตัวอย่างจากรกที่มีลักษณะของ monochorionic twins เช่น พบรกเดียว ไม่มีเยื่อกั้นระหว่างทารกทั้งสองคน หรือเยื่อกั้นบางและพบ non-peaked sign หรือ T sign
- เก็บตัวอย่างชิ้นเนื้อรก 2 ตัวอย่างจากรกที่มีลักษณะของ dichorionic twins เช่น พบสองรกแยกจากกันชัดเจน โดยเทคนิคในการเจาะชิ้นเนื้อรกไม่แตกต่างจากการทำหัตถการในครรภ์เดี่ยว แต่อาจเลือกใช้ช่องทางที่แตกต่างกันในเก็บตัวอย่างรก เช่น ทำหัตถการ transabdominal CVS เพื่อเก็บตัวอย่างชิ้นเนื้อรกที่เกาะด้านหน้าของทารกคนหนึ่ง ร่วมกับทำหัตถการ transcervical CVS เพื่อเก็บตัวอย่างชิ้นเนื้อรกที่เกาะด้านหลังของทารกอีกคนหนึ่ง เพื่อลดโอกาสการปนเปื้อนของตัวอย่างชิ้นเนื้อรกระหว่างทารกทั้งสองคน (cross-contamination)
- เก็บตัวอย่างชิ้นเนื้อรก 2 ตัวอย่างจากรกที่มีลักษณะไม่แน่นอน (uncertain chorionicity) เช่น พบรกที่มีลักษณะเชื่อมกัน (fused placentas) โดยเลือกเก็บตัวอย่างชิ้นเนื้อรกในตำแหน่งใกล้สายสะดือเกาะของทารกแต่ละคน หรือเลือกตำแหน่งชายรกห่างจากจุดที่รกเชื่อมกัน เพื่อลดโอกาสเสี่ยงต่อการเก็บตัวอย่างชิ้นเนื้อรกจากทารกคนเดิม 2 ครั้ง ทั้งนี้การแทงเข็มหรือสอดเครื่องมือเพื่อตัดชิ้นเนื้อรกไม่ควรสอดผ่านรกของทารกคนหนึ่งเพื่อไปยังรกของทารกอีกคน
การเจาะชิ้นเนื้อรกในครรภ์แฝดพบว่าให้ผลการวินิจฉัยผิดพลาดได้บ่อยกว่าการเจาะน้ำคร่ำในครรภ์แฝด เกิดจากการเก็บตัวอย่างชิ้นเนื้อรกจากทารกคนเดิม 2 ครั้ง (พบร้อยละ 0.6 – 0.8)[1-5] การปนเปื้อนระหว่างตัวอย่างชิ้นเนื้อรก และผลการวินิจฉัยที่ไม่สามารถสรุปผลได้ (ผลการวินิจฉัยที่ไม่แน่นอนพบร้อยละ 5 ของจำนวนตัวอย่างชิ้นเนื้อรก และร้อยละ 0.3 ของจำนวนตัวอย่างน้ำคร่ำ) ทำให้จำเป็นต้องตรวจวินิจฉัยด้วยหัตถการอื่นเพิ่มเติม[6] อย่างไรก็ตามการเจาะชิ้นเนื้อรกมีข้อดีกว่าการเจาะน้ำคร่ำในการทำหัตถการที่อายุครรภ์น้อยกว่า จึงสามารถให้การวินิจฉัยและเลือกยุติการตั้งครรภ์ได้เร็วกว่าหากตรวจพบทารกผิดปกติ
การสูญเสียทารกจากการเจาะชิ้นเนื้อรกในครรภ์แฝด
จากการศึกษาแบบ systematic review ในปีค.ศ. 2012 พบว่ามีรายงานการศึกษาเกี่ยวกับการเจาะชิ้นเนื้อรกในครรภ์แฝดจำนวน 9 รายงาน มีอัตราการสูญเสียทารกตลอดการตั้งครรภ์เท่ากับร้อยละ 3.84 อัตราการสูญเสียทารกก่อนอายุครรภ์ 20 สัปดาห์เท่ากับร้อยละ 2.75 และอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์เท่ากับร้อยละ 3.44 โดยไม่พบความแตกต่างของอัตราการสูญเสียทารกในครรภ์ระหว่างการทำหัตถการ transabdominal CVS และ transcervical CVS จากรายงานการศึกษานี้ได้ประเมินว่าการเจาะชิ้นเนื้อรกเพิ่มอัตราการสูญเสียทารกในครรภ์ร้อยละ 1 จาก background risk[5]
-
การเจาะน้ำคร่ำในครรภ์แฝด
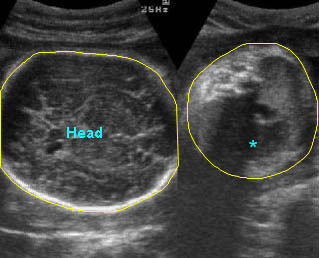
การเจาะน้ำคร่ำในครรภ์แฝดสามารถทำได้หลายเทคนิคสรุปได้ดังตารางที่ 1 การเลือกใช้เทคนิควิธีใดขึ้นอยู่กับความถนัดของผู้ทำหัตถการ และข้อจำกัดของแต่ละหัตถการดังนี้
2.1 Dye as a marker, double needles technique[7]
เทคนิคนี้ใช้การแทงเข็ม spinal needle สองครั้งไปยังถุงน้ำคร่ำสองถุงในเวลาที่ต่างกัน โดยหลังจากดูดเก็บตัวอย่างน้ำคร่ำจากถุงน้ำคร่ำถุงแรก ผู้ทำหัตถการฉีดสี (methylene blue หรือ indigo carmine) ที่ละลายใน sterile water ปริมาณ 2 – 3 ซีซีเข้าไปในถุงน้ำคร่ำถุงแรกแล้วจึงถอนเข็มออก จากนั้นจึงเจาะน้ำคร่ำและเก็บตัวอย่างน้ำคร่ำจากถุงที่สองซึ่งควรมีลักษณะใสตามปกติ หากน้ำคร่ำที่เก็บได้มีสีที่ฉีดปนเปื้อนมาด้วย บ่งชี้ว่าน้ำคร่ำที่ได้มาจากถุงน้ำคร่ำถุงแรก อย่างไรก็ตามน้ำคร่ำที่ปนเปื้อนสีอาจเกิดจาก การเจาะน้ำคร่ำใน monoamniotic twins หรือการฉีดสีที่เข้มข้นมากเกินไปใน monochorionic-diamniotic twins ทำให้เกิดการซึมผ่านของสีไปยังถุงน้ำคร่ำอีกถุง จากรายงานการศึกษาในปี 1992 พบอัตราการเจาะได้น้ำคร่ำปนเปื้อนสีร้อยละ 3.5[8] จากการเจาะน้ำคร่ำในครรภ์แฝดคนที่สอง อย่างไรก็ตามเทคนิควิธีนี้ใช้ลดลงอย่างมากในปัจจุบัน เนื่องจากเทคโนโลยีการตรวจอัลตราซาวด์ให้ภาพเคลื่อนไหวที่มีความละเอียดและความคมชัดสูง จึงมีความถูกต้องแม่นยำในการเจาะน้ำคร่ำในครรภ์แฝดโดยไม่จำเป็นต้องใช้การฉีดสี
การเลือกชนิดของสีที่ใช้ฉีดเข้าถุงน้ำคร่ำ
สีที่ใช้ฉีดเข้าถุงน้ำคร่ำมีสองชนิดได้แก่ methylene blue และ indigo carmine แม้ว่า methylene blue จะถูกเลือกใช้ในระยะเริ่มแรกของการเจาะน้ำคร่ำในครรภ์แฝด แต่มีรายงานว่าสัมพันธ์กับทารกพิการแต่กำเนิดในครรภ์ ได้แก่ ภาวะ small bowel atresia สูงถึงร้อยละ 19[8, 9] นอกจากนี้ยังพบภาวะ neonatal hemolytic anemia และทารกเสียชีวิตในครรภ์ได้[10, 11] ผลของ methylene blue ที่มีต่อลำไส้เล็กของทารกในครรภ์เชื่อว่าเกิดจากการกระตุ้นให้ sympathetic nerves ที่เลี้ยง mesentery vessels หลั่งสาร norepineprine และ dopamine ทำให้เกิดภาวะ localized vasoconstriction หรืออาจเกิดจากการที่ทารกกลืนน้ำคร่ำที่ปนเปื้อน methylene blue ซึ่งส่งผลต่อ endothelial cells ของลำไส้เล็ก
การใช้ indigo carmine ในการเจาะน้ำคร่ำในครรภ์แฝดพบว่าไม่สัมพันธ์กับภาวะทารกพิการแต่กำเนิดในครรภ์[12, 13] (มีรายงานการเกิดภาวะ jejunal atresia หนึ่งรายภายหลังการใช้ indigo carmine)[8] อย่างไรก็ตาม indigo carmine ทำให้เกิดภาวะ mild vasoconstrictive effect ได้หากฉีดเข้าเส้นเลือด จึงอาจจำเป็นต้องตรวจติดตามด้วยอัลตราซาวด์เพื่อค้นหาภาวะทารกพิการแต่กำเนิดหลังการฉีดสีเข้าถุงน้ำคร่ำ
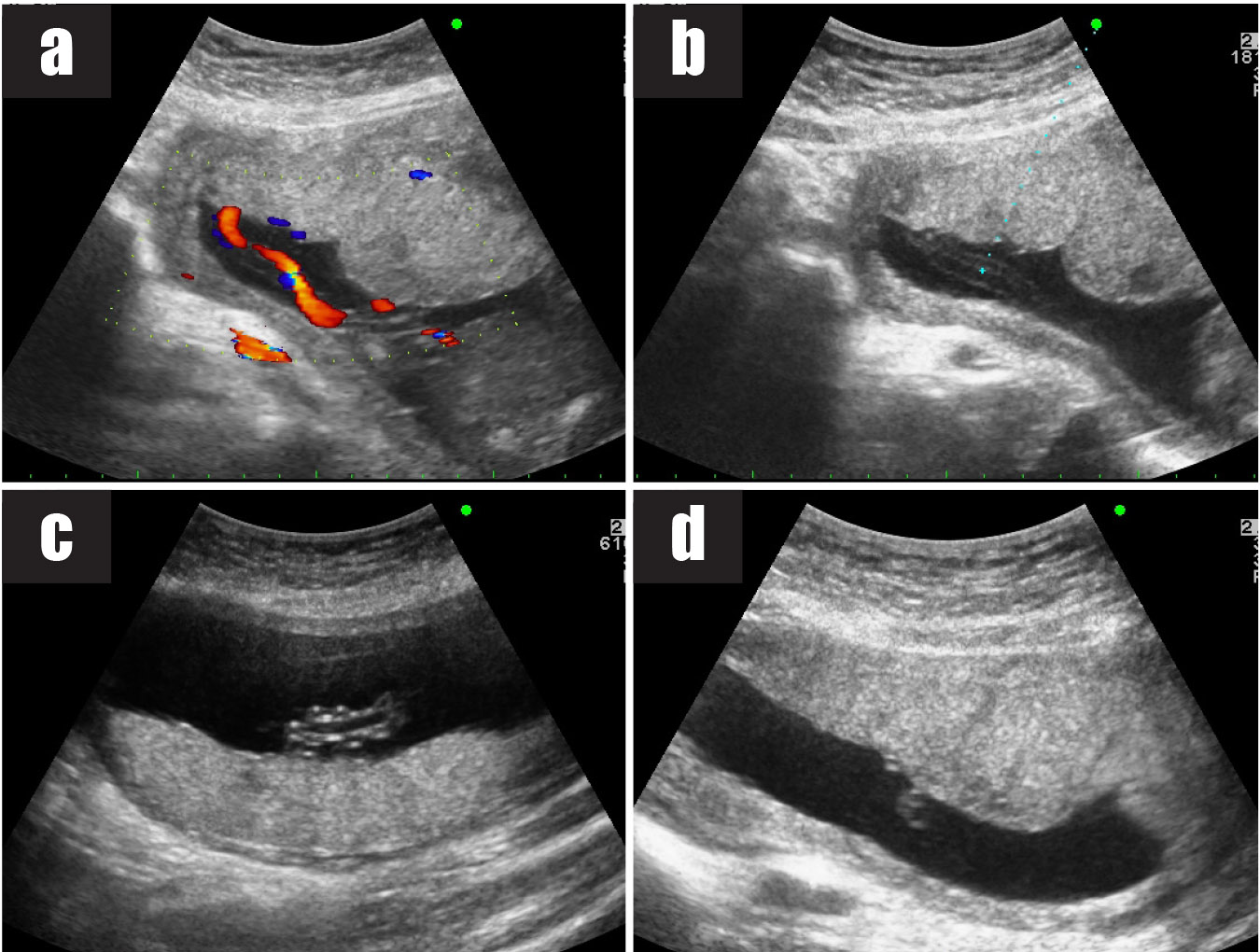
2.2 Dye-free, single needle technique[14]
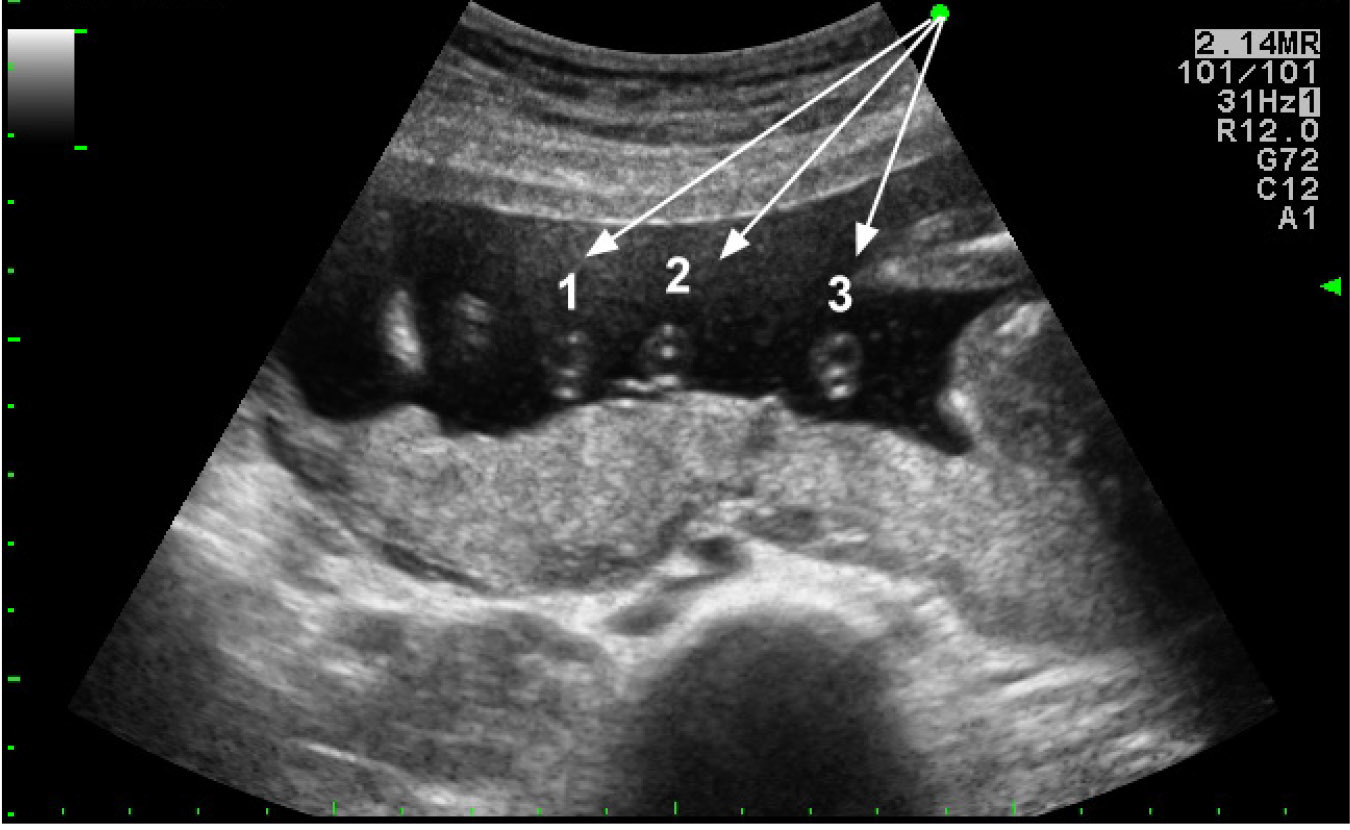
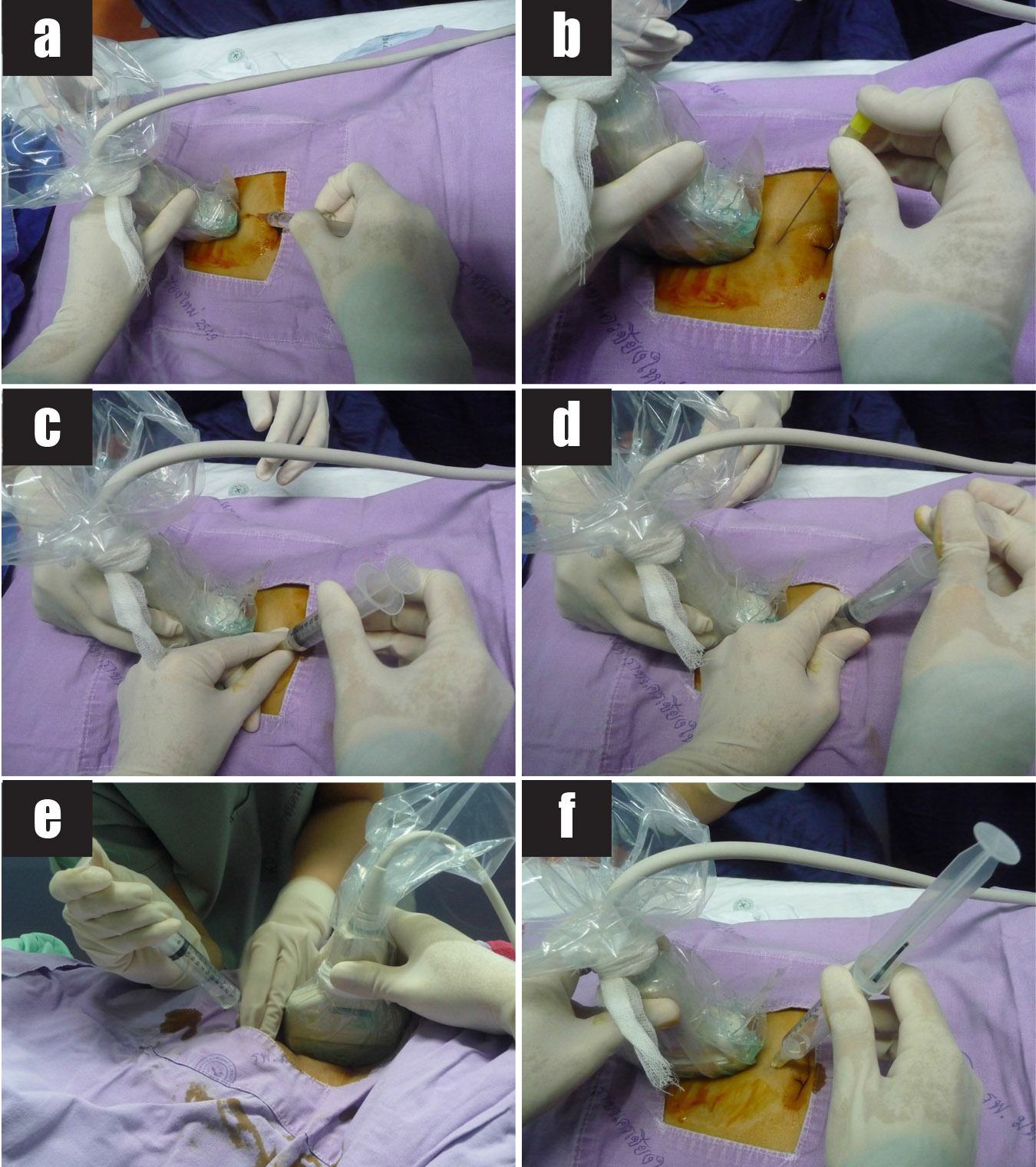
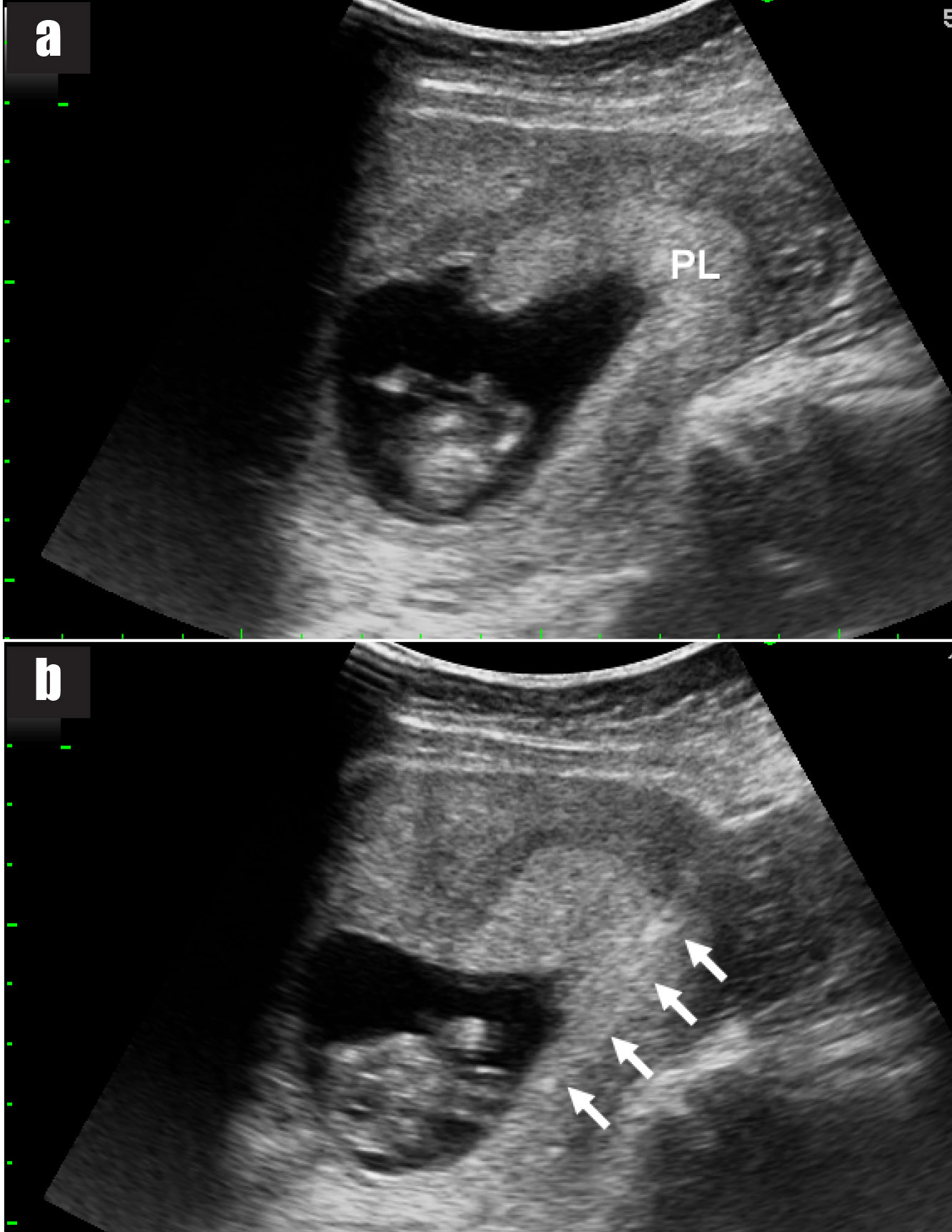
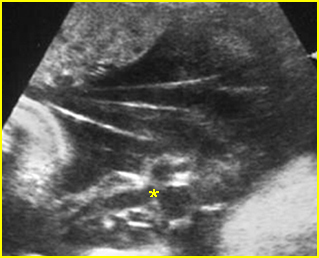
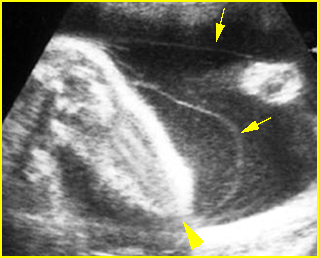
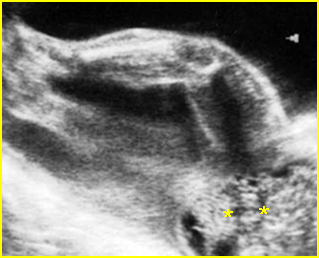
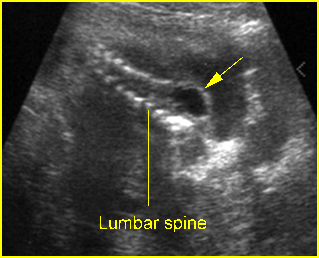
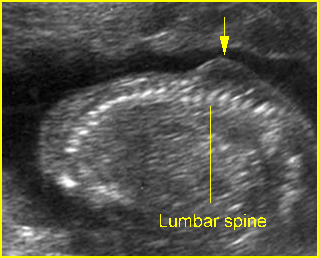
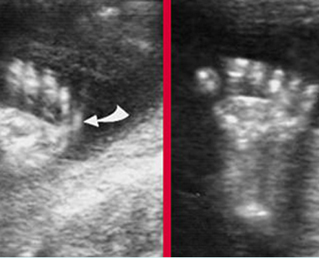
เทคนิคนี้ใช้ spinal needle เพียงอันเดียวในการเจาะดูดน้ำคร่ำสองถุง โดยผู้ทำหัตถการแทงเข็ม spinal needle เข้าไปในถุงน้ำคร่ำถุงแรกในตำแหน่งที่ใกล้กับ intertwin membrane หลังจากดูดเก็บตัวอย่างน้ำคร่ำจากถุงน้ำคร่ำถุงแรกแล้ว ให้ใส่ stylet กลับคืนและล็อคให้เข้าที่ จากนั้นแทงเข็มทะลุผ่าน intertwin membrane เข้าไปยังถุงน้ำคร่ำถุงที่สอง (ดูจากภาพอัลตราซาวด์) ดูดน้ำคร่ำ 1 ซีซีแรกทิ้งเพื่อป้องกันการปนเปื้อน แล้วจึงดูดเก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจ
ข้อจำกัดของเทคนิคนี้ได้แก่ การปนเปื้อนเซลล์จากถุงน้ำคร่ำถุงแรกไปยังตัวอย่างน้ำคร่ำถุงที่สอง และโอกาสเกิดภาวะ pseudo-monoamniotic twins ได้หากรูเข็มบน intertwin membrane ขยายกว้างออก ทำให้เกิดภาวะ umbilical cord entanglement ตามมาได้
2.3 Dye-free, dual needles technique[15]
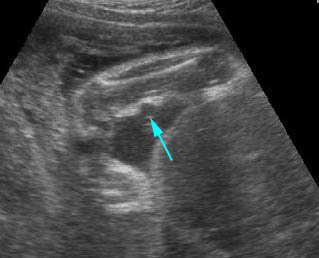
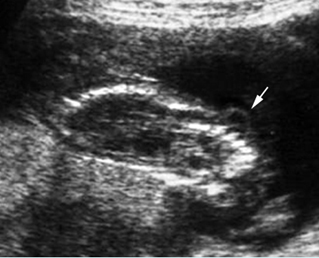
เทคนิคนี้ใช้การแทงเข็ม spinal needle สองครั้งไปยังถุงน้ำคร่ำสองถุงในเวลาเดียวกันภายใต้การตรวจอัลตราซาวด์ตลอดเวลา โดยผู้ทำหัตถการแทงเข็ม spinal needle เข้าไปในถุงน้ำคร่ำถุงแรกและดูดเก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจ จากนั้นแทงเข็ม spinal needle อันที่สองเข้าไปในถุงน้ำคร่ำที่สอง (ขณะที่เข็ม spinal needle อันแรกยังอยู่ในตำแหน่งเดิม) และดูดเก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจ โดยภาพอัลตราซาวด์ต้องเห็นเข็ม spinal needle ทั้งสองอันอยู่ในถุงน้ำคร่ำคนละถุง
ข้อจำกัดของเทคนิคนี้ได้แก่ การทำหัตถการต้องอาศัยผู้ทำหัตถการมากกว่าหนึ่งคน (multiple operators) และการแทงเข็ม spinal needle สองอันเข้าสู่ถุงน้ำคร่ำในเวลาเดียวกันเพิ่มความเจ็บปวดแก่สตรีตั้งครรภ์มากกว่าวิธีอื่น
2.4 Dye-free, double needles technique[16]
เทคนิคนี้ใช้การแทงเข็ม spinal needle สองครั้งไปยังถุงน้ำคร่ำสองถุงในเวลาที่ต่างกัน (คล้ายกับเทคนิคที่ 1 แต่ไม่ฉีดสีเข้าถุงน้ำคร่ำ) โดยผู้ทำหัตถการแทงเข็ม spinal needle เข้าไปในถุงน้ำคร่ำถุงแรกและดูดเก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจแล้วถอนเข็มออก จากนั้นใช้เข็ม spinal needle อันใหม่เจาะถุงน้ำคร่ำถุงที่สองในตำแหน่งใหม่และเก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจ
ข้อจำกัดของเทคนิคนี้ได้แก่ การแทงเข็ม spinal needle เข้าถุงน้ำคร่ำถุงเดิมซึ่งพบร้อยละ 3.5 ของการเจาะน้ำคร่ำในครรภ์แฝดทั้งหมด[8] อย่างไรก็ตามภาวะดังกล่าวสามารถป้องกันได้ด้วยการเลือกตำแหน่งที่จะลงเข็ม โดยเลือกตำแหน่งบนหน้าท้องที่ห่างกันพอสมควร เลือกแอ่งน้ำคร่ำที่อยู่ใกล้ตัวทารกแต่ละคนที่ต้องการเก็บตัวอย่าง และเห็น intertwin membrane ชัดเจนจากภาพอัลตราซาวด์ขณะแทงเข็ม spinal needle ดังนั้นการทำหัตถการภายใต้เครื่องอัลตราซาวด์ที่มีคุณภาพสูง และผู้ทำหัตถการที่มีทักษะความชำนาญมีส่วนช่วยให้การทำหัตถการประสบความสำเร็จ โดยเทคนิคนี้เป็นเทคนิคมาตรฐานที่โรงพยาบาลมหาราชนครเชียงใหม่เลือกใช้ในการเจาะน้ำคร่ำในครรภ์แฝด
| ตารางที่ 1 เปรียบเทียบข้อแตกต่างของ 4 เทคนิคที่ใช้เจาะน้ำคร่ำในครรภ์แฝด | ||||
| ข้อแตกต่าง | Dye marker, Double needles | Dye-free, Single needle | Dye-free, Dual needles | Dye-free, Double needles |
| – การฉีดสี | 🗸 | 🗴 | 🗴 | 🗴 |
| – จำนวนเข็มที่ใช้ | 2 | 1 | 2 | 2 |
| – ลำดับการแทงเข็ม | ตามลำดับ | พร้อมกัน | ตามลำดับ | |
| – การแทงเข็มทะลุเยื่อกั้น | 🗴 | 🗸 | 🗴 | 🗴 |
การเจาะน้ำคร่ำใน monochorionic twins
การเจาะน้ำคร่ำเพื่อตรวจวินิจฉัยก่อนคลอดใน monozygotic twins ไม่มีความจำเป็นในการเจาะดูดน้ำคร่ำสองครั้งเพื่อเก็บตัวอย่างน้ำคร่ำจากทารกทั้งสองคน เนื่องจากผลการตรวจวินิจฉัยของทารกทั้งสองคนจะเหมือนกันในทางทฤษฏี อย่างไรก็ตามมีบางเหตุผลสนับสนุนการเจาะน้ำคร่ำจากทารกทั้งสองคนดังนี้
- แม้ว่าการตรวจอัลตราซาวด์ในยุคปัจจุบันจะให้ภาพที่มีความชัดเจนมากกว่ายุคก่อน แต่การแยกลักษณะการตั้งครรภ์แฝดจาก chorionicity ว่าเป็น monozygotic twins หรือ dizygotic twins อาจทำได้ยากในบางราย การตรวจอัลตราซาวด์พบรกเดียว (monochorion placenta) อาจเกิดจาก fused dichorionic placentas ของ dizygotic twins การเจาะน้ำคร่ำจากถุงน้ำคร่ำถุงเดียวจึงไม่สามารถให้การวินิจฉัยทารกอีกคนได้
- ภาวะ early mitotic nondisjunction อาจทำให้ monozygotic twins มีผลโครโมโซมที่แตกต่างกันได้ ตัวอย่างเช่น ทารกเพศชายที่มีโครโมโซม 46, XY อาจสูญเสียโครโมโซม Y ระหว่างการแบ่งตัว ทำให้ทารกอีกคนมีโครโมโซม 45, XO ซึ่งมีลักษณะของเพศหญิง[17, 18] การเจาะน้ำคร่ำจึงให้ผลการตรวจวินิจฉัยที่แตกต่างกันแม้จะเป็น monozygotic twins อย่างไรก็ตามภาวะนี้พบน้อยมาก
การสูญเสียทารกจากการเจาะน้ำคร่ำในครรภ์แฝด
อัตราการสูญเสียทารกตลอดการตั้งครรภ์ภายหลังการเจาะน้ำคร่ำในครรภ์แฝดพบว่าเพิ่มขึ้นร้อยละ 1 จากอัตราการสูญเสียทารกครรภ์แฝดที่ไม่ได้รับการเจาะน้ำคร่ำ (background risk) แม้ว่ายังไม่มีการศึกษาวิจัยชนิด randomized controlled trial เปรียบเทียบอัตราการสูญเสียทารกจากการทำหัตถการ มีเพียงการศึกษาวิจัยชนิด systematic review ที่รวบรวมรายงานการศึกษาเกี่ยวกับการเจาะน้ำคร่ำในครรภ์แฝดจำนวน 7 รายงาน พบว่าอัตราการสูญเสียทารกตลอดการตั้งครรภ์เท่ากับร้อยละ 3.07 อัตราการสูญเสียทารกก่อนอายุครรภ์ 20 สัปดาห์เท่ากับร้อยละ 2.25 อัตราการสูญเสียทารกก่อนอายุครรภ์ 24 สัปดาห์เท่ากับร้อยละ 2.54 และอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์เท่ากับร้อยละ 1.70 เมื่อเปรียบเทียบกับครรภ์แฝดที่ไม่ได้รับการเจาะน้ำคร่ำพบว่าครรภ์แฝดที่ได้รับการเจาะน้ำคร่ำมีโอกาสเสี่ยงต่อการสูญเสียทารกก่อนอายุครรภ์ 24 สัปดาห์เพิ่มขึ้น 1.81 เท่า นอกจากนี้ยังไม่พบความแตกต่างของอัตราการสูญเสียทารกในครรภ์ระหว่างการทำหัตถการโดยใช้เทคนิค single needle และ double needles[5]
รายงานการศึกษาจากหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ในครรภ์แฝดที่ได้รับการเจาะน้ำคร่ำเพื่อวินิจฉัยก่อนคลอดระหว่างอายุครรภ์ 16 – 20 สัปดาห์ จำนวน 87 ราย พบว่าอัตราความสำเร็จในการเจาะน้ำคร่ำเท่ากับร้อยละ 100[19] โดยพบอัตราการสูญเสียทารกในครรภ์และอัตราการคลอดก่อนกำหนด (รวม background risk) แสดงดังตารางที่ 2 และตารางที่ 3
| ตารางที่ 2 แสดงอัตราการสูญเสียทารกในครรภ์ในสตรีตั้งครรภ์แฝดที่ได้รับการเจาะน้ำคร่ำเพื่อวินิจฉัยก่อนคลอดระหว่างอายุครรภ์ 16 – 20 สัปดาห์จำนวน 87 ราย[19] | |
| อัตราการสูญเสียทารกในครรภ์ | ร้อยละ |
|
5.17 |
|
1.15 |
|
3.45 |
| ตารางที่ 3 แสดงอัตราการคลอดก่อนกำหนดในสตรีตั้งครรภ์แฝดที่ได้รับการเจาะน้ำคร่ำเพื่อวินิจฉัยก่อนคลอดระหว่างอายุครรภ์ 16 – 20 สัปดาห์จำนวน 87 ราย[19] | |
| อัตราการคลอดก่อนกำหนด | ร้อยละ |
|
36.24 |
|
2.30 |
|
8.04 |
|
28.16 |
-
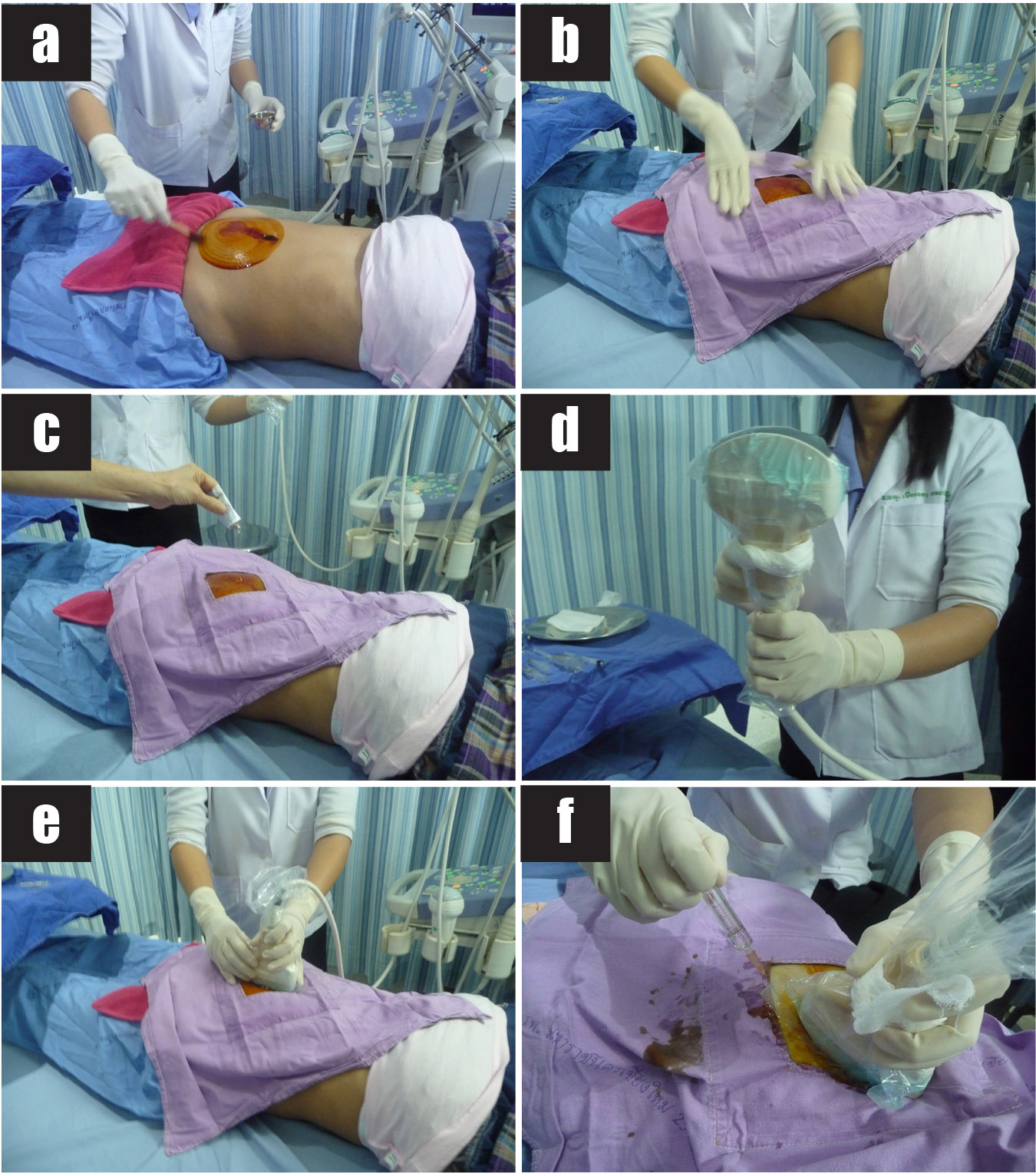
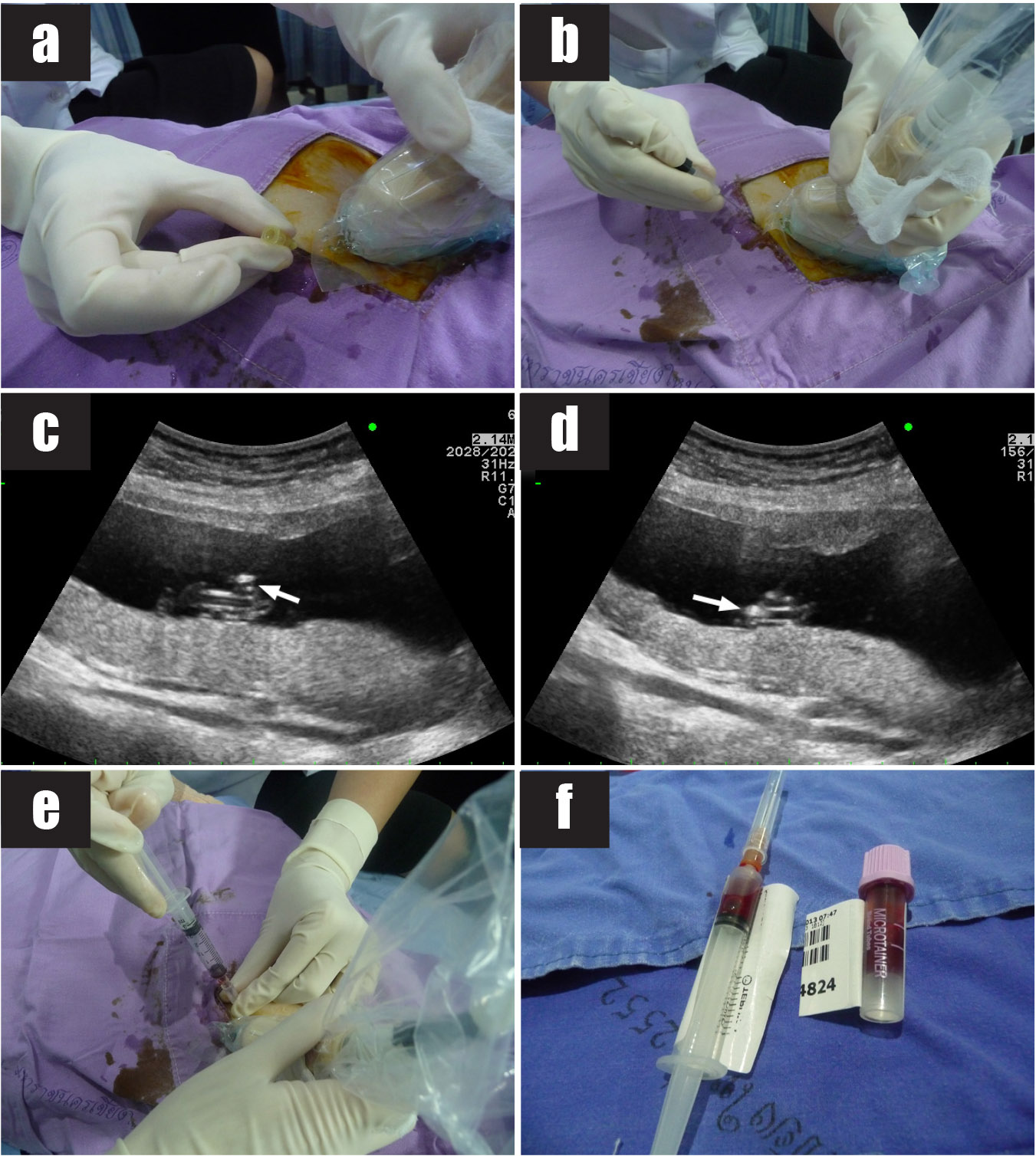
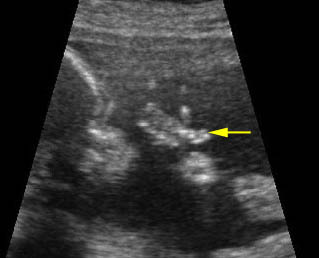
การเจาะเลือดสายสะดือทารกในครรภ์แฝด
แม้ว่าเทคนิคในการเจาะเลือดสายสะดือทารกในครรภ์จะไม่แตกต่างกัน แต่การเจาะเลือดสายสะดือทารกในครรภ์แฝดมีความยากกว่าการเจาะเลือดสายสะดือทารกในครรภ์เดี่ยว และการทำหัตถการวินิจฉัยก่อนคลอดในครรภ์แฝดวิธีอื่นๆ เนื่องจากมีความจำกัดในการเลือกตำแหน่งหรือการเข้าถึงสายสะดือทารกที่เหมาะสมในทารกแต่ละคน การเจาะเลือดสายสะดือทารกคนที่สองอาจทำไม่ได้หากทารกคนแรกอยู่ด้านบนและเบียดทารกคนที่สองให้อยู่ลึกลงไปจากผนังหน้าท้องมารดา การเจาะเลือดสายสะดือทารกในครรภ์แฝดยังเพิ่มโอกาสเสี่ยงต่อการสูญเสียทารกในครรภ์มากกว่าหัตถการอื่น จากรายงานการศึกษาการทำหัตถการก่อนปีค.ศ. 2000 พบว่าอัตราการสูญเสียทารกภายใน 2 สัปดาห์หลังการทำหัตถการเท่ากับร้อยละ 8.2 – 12.1[20, 21]
รายงานการศึกษาจากหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ในครรภ์แฝดที่ได้รับการเจาะเลือดสายสะดือทารกในครรภ์เพื่อวินิจฉัยก่อนคลอดระหว่างอายุครรภ์ 18 – 22 สัปดาห์ จำนวน 30 ราย พบว่าอัตราความสำเร็จในการเจาะน้ำคร่ำเท่ากับร้อยละ 98.3 เวลาเฉลี่ยที่ใช้ในการทำหัตถการของทารกแต่ละคนเท่ากับ 8.2 นาที และเวลาเฉลี่ยที่ใช้ในการทำหัตถการของทารกทั้งสองคนเท่ากับ 16.2 นาที โดยพบอัตราการสูญเสียทารกในครรภ์ตลอดการตั้งครรภ์ (รวม background risk) เท่ากับร้อยละ 9.5[22] เมื่อศึกษาเปรียบเทียบครรภ์แฝดและครรภ์เดี่ยวที่ได้รับการเจาะเลือดสายสะดือทารกในครรภ์ระหว่างอายุครรภ์ 18 – 22 สัปดาห์ พบว่าอัตราการสูญเสียทารกภายใน 2 สัปดาห์หลังการเจาะเลือดสายสะดือทารกในครรภ์แฝดเท่ากับร้อยละ 1.4 ไม่แตกต่างจากอัตราการสูญเสียทารกภายหลังการเจาะเลือดสายสะดือทารกในครรภ์เดี่ยวที่พบร้อยละ 1.1[23] ดังแสดงในตารางที่ 4 ซึ่งแตกต่างจากอัตราการสูญเสียทารกภายใน 2 สัปดาห์หลังการทำหัตถการจากรายงานการศึกษาก่อนปีค.ศ. 2000[20, 21] เนื่องจากเทคโนโลยีด้านการตรวจอัลตราซาวด์ที่พัฒนามากขึ้นในปัจจุบัน และประสบการณ์ของผู้ทำหัตถการที่มีความเชี่ยวชาญเพิ่มมากขึ้นตามจำนวนหัตถการที่สะสม ทำให้การเจาะเลือดสายสะดือทารกในครรภ์แฝดมีความเสี่ยงน้อยมากไม่ต่างไปจากครรภ์เดี่ยว
| ตารางที่ 4 เปรียบเทียบการเจาะเลือดสายสะดือทารกในครรภ์เดี่ยว (ทารกจำนวน 336 ราย) และครรภ์แฝด (ทารกจำนวน 112 ราย)[23] | |||
| ข้อเปรียบเทียบ | ครรภ์เดี่ยว | ครรภ์แฝด | P value |
|
98.8 | 97.3 | 0.001 |
|
6.3 | 8.1 | 0.02 |
|
6.0 | 13.0 | 0.001 |
|
28.8 | 34.8 | 0.37 |
|
1.4 | 1.1 | 0.42 |
References
1. Wapner RJ, Johnson A, Davis G, Urban A, Morgan P, Jackson L. Prenatal diagnosis in twin gestations: a comparison between second-trimester amniocentesis and first-trimester chorionic villus sampling. Obstet Gynecol 1993;82:49-56.
2. Pergament E, Schulman JD, Copeland K, Fine B, Black SH, Ginsberg NA, et al. The risk and efficacy of chorionic villus sampling in multiple gestations. Prenat Diagn 1992;12:377-384.
3. De Catte L, Liebaers I, Foulon W. Outcome of twin gestations after first trimester chorionic villus sampling. Obstet Gynecol 2000;96:714-720.
4. Brambati B, Tului L, Guercilena S, Alberti E. Outcome of first-trimester chorionic villus sampling for genetic investigation in multiple pregnancy. Ultrasound Obstet Gynecol 2001;17:209-216.
5. Agarwal K, Alfirevic Z. Pregnancy loss after chorionic villus sampling and genetic amniocentesis in twin pregnancies: a systematic review. Ultrasound Obstet Gynecol;40:128-134.
6. van den Berg C, Braat AP, Van Opstal D, Halley DJ, Kleijer WJ, den Hollander NS, et al. Amniocentesis or chorionic villus sampling in multiple gestations? Experience with 500 cases. Prenat Diagn 1999;19:234-244.
7. Elias S, Gerbie AB, Simpson JL, Nadler HL, Sabbagha RE, Shkolnik A. Genetic amniocentesis in twin gestations. Am J Obstet Gynecol 1980;138:169-174.
8. van der Pol JG, Wolf H, Boer K, Treffers PE, Leschot NJ, Hey HA, et al. Jejunal atresia related to the use of methylene blue in genetic amniocentesis in twins. Br J Obstet Gynaecol 1992;99:141-143.
9. Nicolini U, Monni G. Intestinal obstruction in babies exposed in utero to methylene blue. Lancet 1990;336:1258-1259.
10. Kidd SA, Lancaster PA, Anderson JC, Boogert A, Fisher CC, Robertson R, et al. Fetal death after exposure to methylene blue dye during mid-trimester amniocentesis in twin pregnancy. Prenat Diagn 1996;16:39-47.
11. Cragan JD. Teratogen update: methylene blue. Teratology 1999;60:42-48.
12. Pruggmayer MR, Jahoda MG, Van der Pol JG, Baumann P, Holzgreve W, Karkut G, et al. Genetic amniocentesis in twin pregnancies: results of a multicenter study of 529 cases. Ultrasound Obstet Gynecol 1992;2:6-10.
13. Cragan JD, Martin ML, Khoury MJ, Fernhoff PM. Dye use during amniocentesis and birth defects. Lancet 1993;341:1352.
14. Jeanty P, Shah D, Roussis P. Single-needle insertion in twin amniocentesis. J Ultrasound Med 1990;9:511-517.
15. Bahado-Singh R, Schmitt R, Hobbins JC. New technique for genetic amniocentesis in twins. Obstet Gynecol 1992;79:304-307.
16. Antsaklis A, Souka AP, Daskalakis G, Kavalakis Y, Michalas S. Second-trimester amniocentesis vs. chorionic villus sampling for prenatal diagnosis in multiple gestations. Ultrasound Obstet Gynecol 2002;20:476-481.
17. Schmid O, Trautmann U, Ashour H, Ulmer R, Pfeiffer RA, Beinder E. Prenatal diagnosis of heterokaryotypic mosaic twins discordant for fetal sex. Prenat Diagn 2000;20:999-1003.
18. Nieuwint A, Van Zalen-Sprock R, Hummel P, Pals G, Van Vugt J, Van Der Harten H, et al. ‘Identical’ twins with discordant karyotypes. Prenat Diagn 1999;19:72-76.
19. Supadilokluck S, Tongprasert F, Tongsong T, Wanapirak C, Piyamongkol W, Sirichotiyakul S, et al. Amniocentesis in twin pregnancies. Arch Gynecol Obstet 2009;280:207-209.
20. Cox WL, Forestier F, Capella-Pavlovsky M, Daffos F. Fetal blood sampling in twin pregnancies. Prenatal diagnosis and management of 19 cases. Fetal Ther 1987;2:101-108.
21. Antsaklis A, Daskalakis G, Souka AP, Kavalakis Y, Michalas S. Fetal blood sampling in twin pregnancies. Ultrasound Obstet Gynecol 2003;22:377-379.
22. Tongprasert F, Tongsong T, Wanapirak C, Sirichotiyakul S, Piyamongkol W. Cordocentesis in multifetal pregnancies. Prenat Diagn 2007;27:1100-1103.
23. Srisupundit K, Wanapirak C, Piyamongkol W, Sirichotiyakul S, Tongsong T. Comparisons of outcomes after cordocentesis at mid-pregnancy between singleton and twin pregnancies. Prenat Diagn;31:1066-1069.