Cervical cancer in pregnancy: มะเร็งปากมดลูกในสตรีตั้งครรภ์
Cervical cancer in pregnancy: มะเร็งปากมดลูกในสตรีตั้งครรภ์
พญ.ณัฏฐา ยศชนะ
รศ.พญ. ประภาพร สู่ประเสริฐ ที่ปรึกษา
บทนำ
มะเร็งปากมดลูกในสตรีตั้งครรภ์เป็น มะเร็งที่พบพบได้บ่อยรองลงมาจาก มะเร็งเต้านม(1) มีอุบัติการณ์ 0.1-12 ต่อ 10000 การตั้งครรภ์(2) โดยระบาดวิทยาของมะเร็งปากมดลูกปัจจุบันมีแนวโน้มเปลี่ยนแปลงไปเนื่องจากมีการฉีดวัคซีนป้องกันมะเร็งปากมดลูกอย่างแพร่หลายมากขึ้นโดยเฉพาะในเด็กวัยเรียน ทำให้ช่วงอายุที่ถูกวินิจฉัยมะเร็งปากมดลูกเปลี่ยนแปลงไปจาก 25-29 ปีในช่วงปี ค.ศ 2011-2015 เป็น 55-59 ปี ในช่วงปี ค.ศ 2013-2040 ดังนั้นอุบัติการณ์ของมะเร็งปาดมดลูกในสตรีตั้งครรภ์จึงมีแนวโน้มลดลง (2)
อย่างไรก็ตามสตรีตั้งครรภ์เป็นกลุ่มผู้ป่วยที่มีความพิเศษในการวินิจฉัยดูแลรักษา เนื่องจากยังไม่มีข้อมูลชัดเจนจากการศึกษาวิจัยแบบสุ่ม การดูแลจึงจะอ้างอิงจากแนวทางการรักษาเดียวกับสตรีที่ไม่ตั้งครรภ์และข้อมูลที่มีศึกษาอยู่ในปัจจุบัน โดยจำเป็นต้องพิจารณาเป็นรายๆ ขึ้นอยู่กับความต้องการในการตั้งครรภ์ ชนิดของเซลล์มะเร็ง ระยะของโรค ความพร้อมในการดูแลผู้ป่วยแบบองค์รวม
การเปลี่ยนแปลงทางสรีรวิทยาในระหว่างการตั้งครรภ์
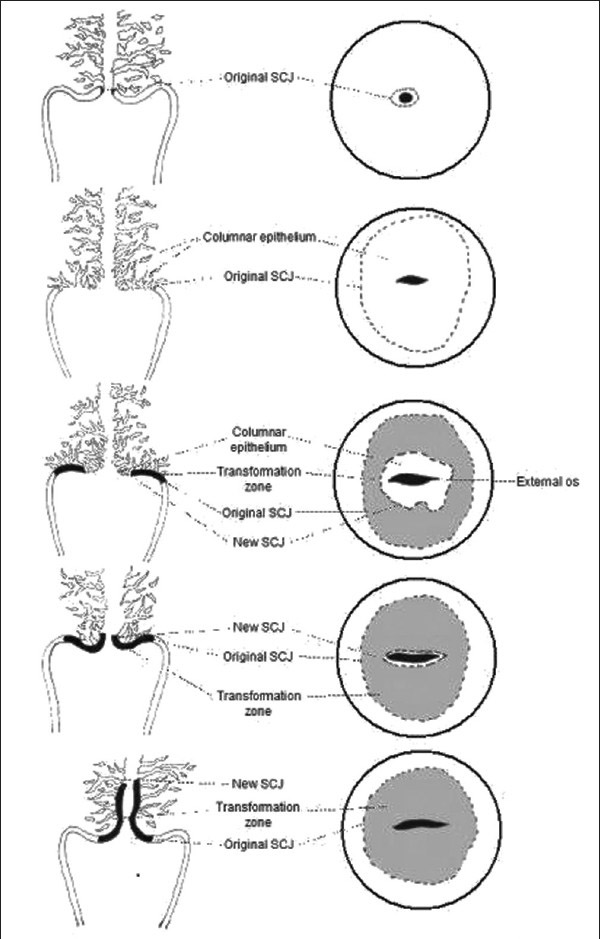
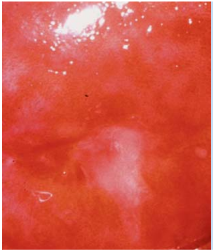
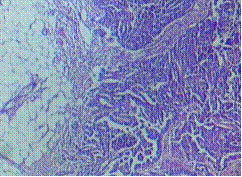
ในช่วงการตั้งครรภ์จะมีการเปลี่ยนแปลงของปากมดลูกคือปากมดลูกจะนุ่มและคล้ำขึ้น ต่อมปากมดลูกมีการขยายตัว(hypertrophy)และแบ่งตัว(hyperplasia) มีการสร้างมูกเหนียวมากขึ้น การแบ่งตัวของ columnar cervical gland ทำในปากมดลูกมีลักษณะแดงคล้ายกำมะหยี่และเลือดออกง่ายเรียกว่า eversion (3) ดังรูปที่ 1
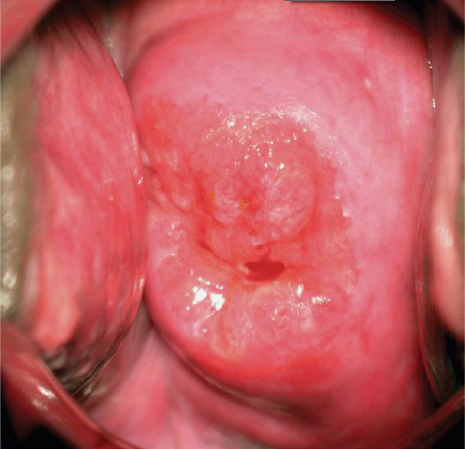
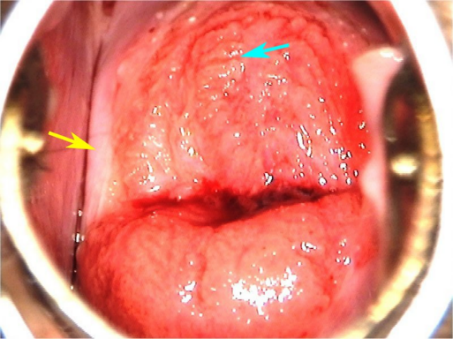
รูปที่1 แสดง cervical eversion (ตามลูกศร)
ที่มา Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Williams Obstetrics, 26e. Maternal physiology. New York, NY: McGraw Hill; 2022. p. 53.
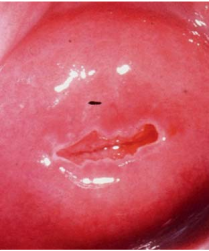
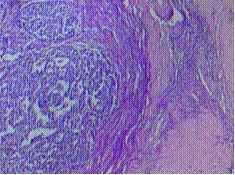
นอกจากนี้เซลล์ต่อมที่ถูกกระตุ้นด้วยเอสโตรเจนจะแบ่งตัวมากจนเซลล์มีขนาดและรูปร่างใหญ่ขึ้น เรียกว่า Arias-Stella reaction(3) หากมีการตรวจคัดกรองมะเร็งปากมดลูกระหว่างการตั้งครรภ์ จะทำให้มีการสับสนกับ Atypical glandular cells ได้ จึงต้องอาศัยพยาธิแพทย์ที่เชี่ยวชาญและมีประสบการณ์ในการแปลผล ดังรูปที่ 2
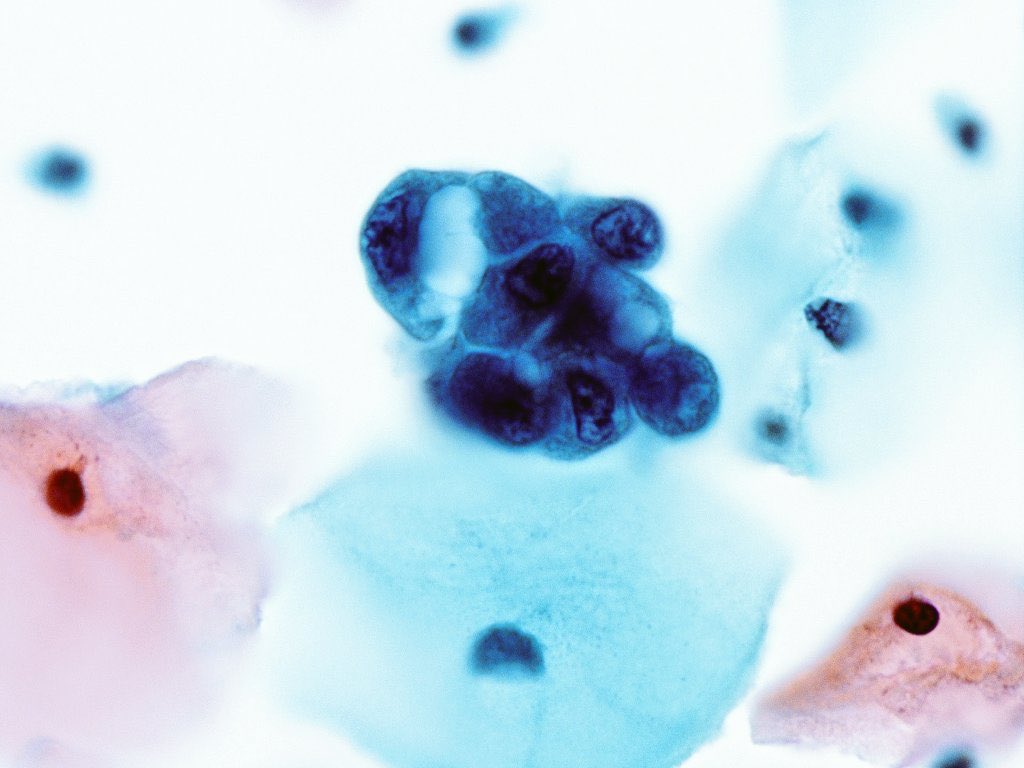
รูปที่ 2 Arias-Stella reaction
ที่มา Ylagan LR. The PAP smear. In: Gattuso P, Reddy VB, Masood S, editors. Differential Diagnosis in Cytopathology. 2nd ed. Cambridge: Cambridge University Press; 2014. p. 1–39.
การวินิจฉัยมะเร็งปากมดลูกในสตรีตั้งครรภ์
อาการแสดง
มะเร็งปากมดลูกในระยะเริ่มแรก มักไม่มีอาการผิดปกติใดๆ แต่จะตรวจพบจากการตรวจคัดกรองมะเร็งปากมดลูก อาการแสดงของมะเร็งปาดมดลูกในสตรีตั้งครรภ์ไม่ได้แตกต่างจากสตรีทั่วไป จึงอาจถูกละเลยได้เนื่องจากอาการแสดงส่วนใหญ่จะพบได้ในภาวะปกติของสตรีตั้งครรภ์เช่น มีเลือดออกจากช่องคลอด อาการปวดบริเวณอุ้งเชิงกราน อาการปวดหลัง ปัสสาวะบ่อย เป็นต้น
อาการแสดงที่พบในมะเร็งปากมดลูกได้แก่ เลือดออกทางช่องคลอด เลือดออกช่องคลอดหลังมีเพศสัมพันธ์ ตกขาวผิดปกติ เจ็บขณะมีเพศสัมพันธ์ ตรวจพบลักษณะของปากมดลูกที่ผิดปกติ หากมีการลุกลามของมะเร็งไปอวัยวะในอุ้งเชิงกรานข้างเคียง จะมีอาการปัสสาวะเป็นเลือด กลั้นปัสสาวะไม่ได้ ขาบวมมีการขับถ่ายอุจจาระปัสสาวะที่ผิดปกติไป หรือหากเป็นระยะลุกลาม จะมีอาการปวดกระดูก, อ่อนเพลีย เบื่ออาหารหรือ น้ำหนักลดได้(4)
ดังนั้นในสตรีตั้งครรภ์ที่มีประวัติเลือดออกผิดปกติทางช่องคลอดทุกรายควรได้รับการตรวจภายในโดยการใส่อุปกรณ์ถ่างขยายช่องคลอด (speculum) เพื่อดูลักษณะผิดปกติของปากมดลูก และหากมีพยาธิสภาพที่สงสัยควรส่งต่อให้กับสูตินรีแพทย์ประเมินต่อไป
การตรวจคัดกรองมะเร็งปากมดลูกในสตรีตั้งครรภ์
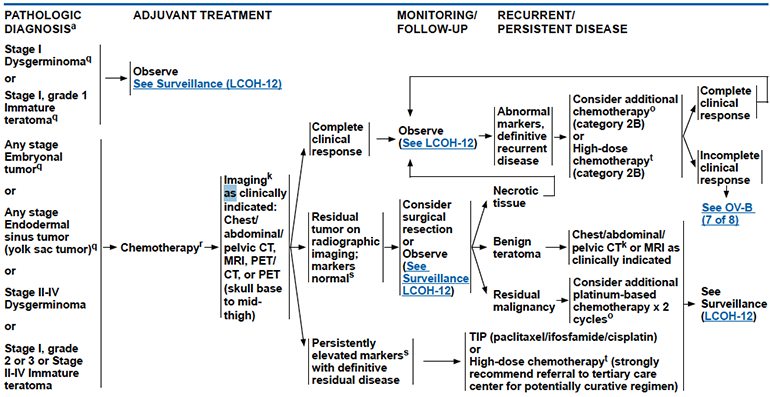
การตั้งครรภ์ไม่ได้เป็นข้อห้ามในการตรวจคัดกรองมะเร็งปากมดลูก และถ้าพบว่า ผลการตรวจคัดกรองมะเร็งปากมดลูกมีความผิดปกติสามารถประเมินเพื่อติดตามการรักษา หรือพิจารณาส่องกล้องปากมดลูกด้วยกล้องคอลโปสโคป ตามแนวทางของ The American Society for Colposcopy and Cervical Pathology (ASCCP) ปี 2019 เรื่อง Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors (5) เหมือนสตรีทั่วไป ดังรูปที่ 3
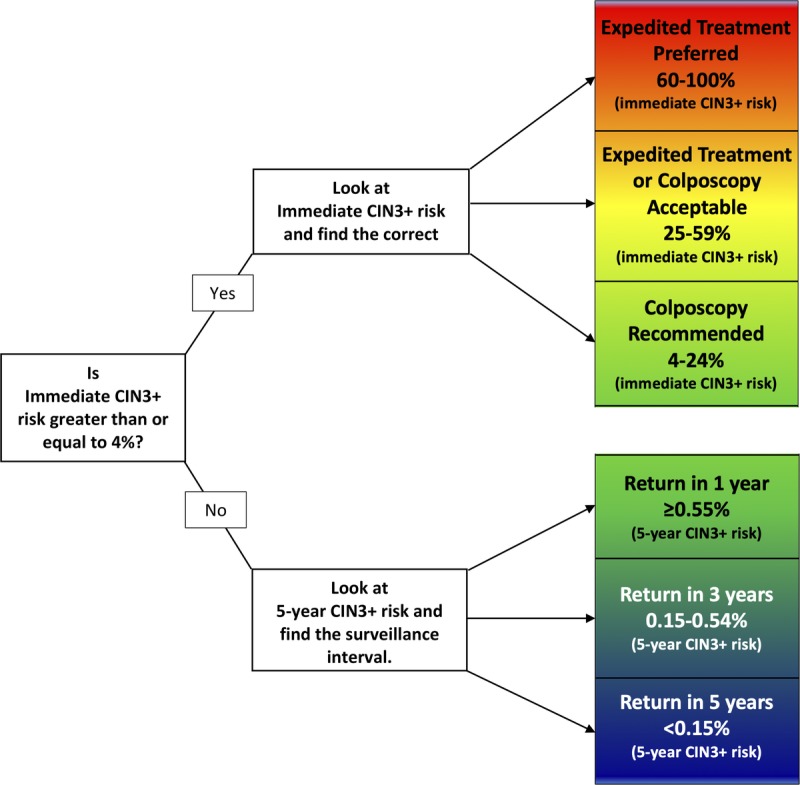
รูปที่ 3 แสดงแนวทางการติดตามรักษา Abnormal cervical screening
ที่มา 2019 The American Society for Colposcopy and Cervical Pathology (ASCCP) Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors
การส่องกล้องขยายตรวจดูบริเวณปากมดลูกด้วยกล้องคอลโปสโคป
การส่องกล้องปากมดลูกด้วยกล้องคอลโปสโคปปลอดภัยและสามารถทำได้ในสตรีตั้งครรภ์ ควรพิจารณาทำในกรณีที่ความเสี่ยง CIN3+ เกินกว่าหรือเท่ากับร้อยละ 4 ตามข้อแนะนำของ 2019 ASCCP Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors จุดประสงค์หลักในการส่องกล้องปากมดลูกด้วยกล้องคอลโปสโคปในสตรีตั้งครรภ์คือ การมองหารอยโรคที่มีลักษณะเหมือนมะเร็งปากมดลูกระยะลุกลาม เพื่อพยายามลดการตัดชิ้นเนื้อปากมดลูกที่ไม่จำเป็นในระหว่างการตั้งครรภ์เนื่องจากปากมดลูกของสตรีตั้งครรภ์เลือดออกง่าย(5)
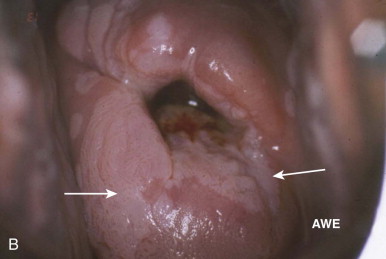
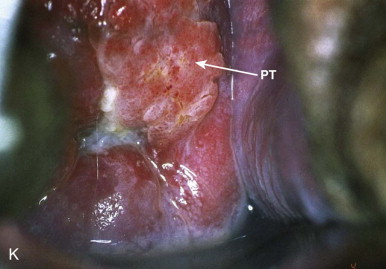
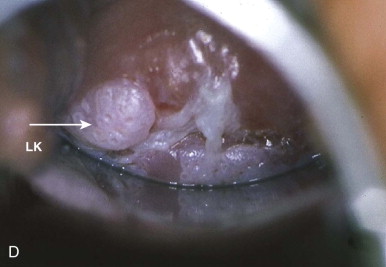
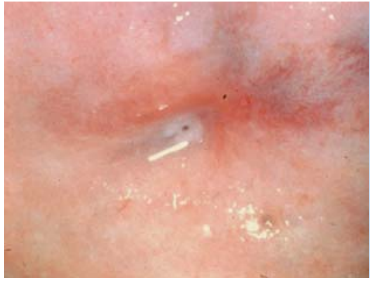
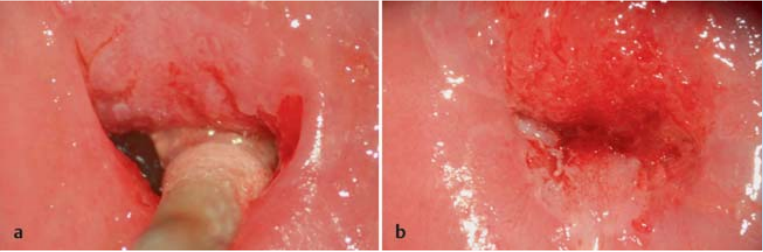
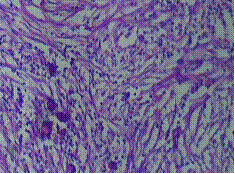
การส่องกล้องปากมดลูกด้วยกล้องคอลโปสโคปในสตรีตั้งครรภ์จำเป็นต้องทำโดยแพทย์ผู้เชี่ยวชาญและมีประสบการณ์เนื่องจากต้องแยกความผิดปกติของปากมดลูกกับการเปลี่ยนแปลงทางสรีรวิทยาในช่วงการตั้งครรภ์ได้ การส่องกล้องปากมดลูกในช่วงอายุครรภ์น้อยเกินไปอาจจะแปลผลได้ไม่ชัดเจนเนื่องจาก transformation zone ไม่ชัด ปากมดลูกจะเลือดออกง่าย มีมูกบริเวณปากมดลูกปริมาณมาก ดังรูปที่ 4 นอกจากนี้ผนังช่องคลอดจะมีการย้วยมากกว่าปกติ อาจจำเป็นต้องใช้อุปกรณ์เสริมเช่น ใช้ถุงมือหรือถุงยางอนามัยตัดปลายสวมปลาย speculum หรือใช้ vaginal retractor เพื่อดันผนังช่องคลอดออกไปทำให้มองเห็นปากมดลูกได้ชัดเจนขึ้น ดังรูปที่ 5 และ 6
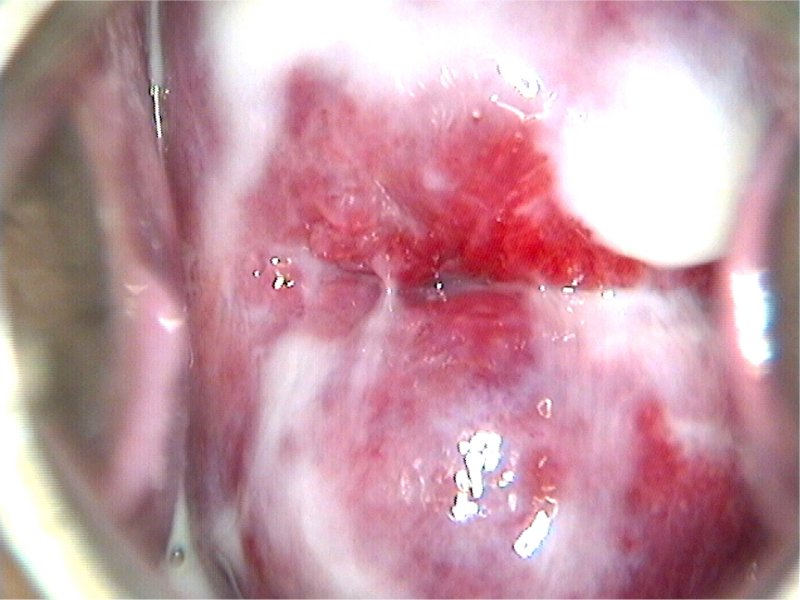
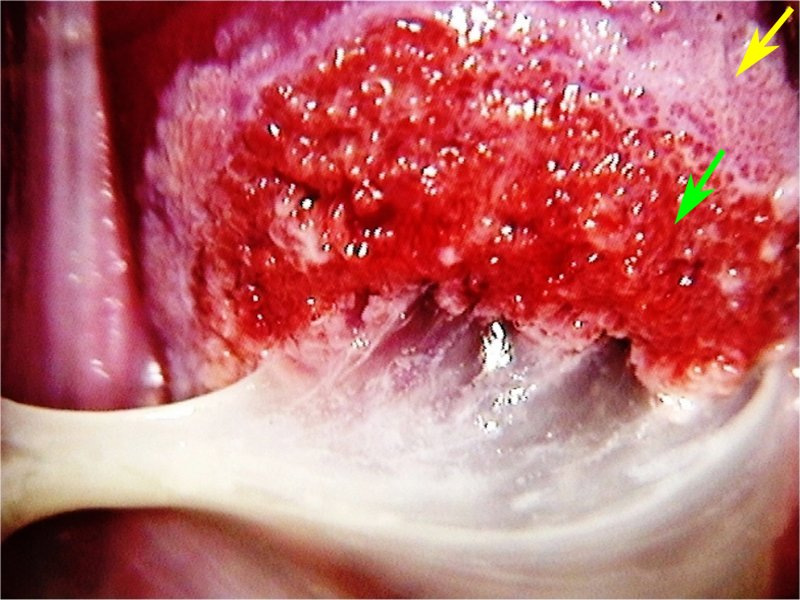
รูปที่ 4 แสดงปากมดลูกของหญิงตั้งครรภ์ที่มีมูกบริเวณปากมดลูกปริมาณมาก
ที่มา Dr Partha Basu. Dr Rengaswamy Sankaranarayanan. Atlas of colposcopy: principles and practice. International agency research of cancer WHO. [Internet]. 2023 [cited2023 Aug 3]. Available from : https://screening.iarc.fr/atlascolpo.php

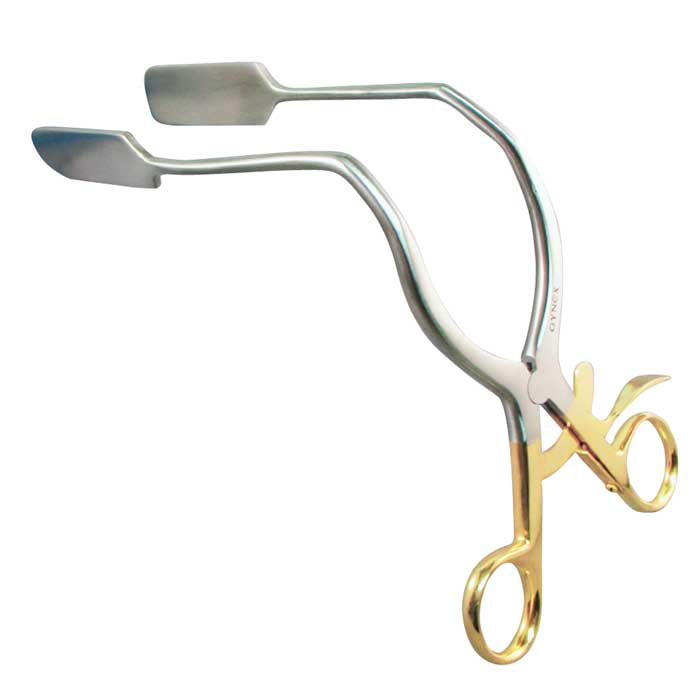
รูปที่ 5, 6 แสดงภาพการใช้ถุงมือตัดปลายสวมปลาย speculum, vaginal retractor ตามลำดับ
ที่มา Teresa M. Darragh, MD. Colposcopy in pregnancy. [Internet]. 2013 [cite2023 Aug 3]. Available from : https://asccp.org%2FAssets%2F997bf127-5ca5-42e9-8d21-089ec7f54aba%2F636114480824400000%2F07-colpo-pregnancy-pdf-pdf&usg=AOvVaw1trDtrenhuGZwj1FGbAcUh&opi=89978449
การตัดชิ้นเนื้อปากมดลูก(biopsy)ไปตรวจ สามารถทำได้ในสตรีตั้งครรภ์เมื่อมีรอยที่รุนแรงสงสัยมะเร็ง และต้องมีความพร้อมในอุปกรณ์ในการช่วยห้ามเลือด หากมีเลือดออกมากสามารถใช้น้ำยา monsel solution ป้าย หรืออาจใส่ผ้ากดอัดห้ามเลือดในช่องคลอด (vaginal packing) ช่วย สำหรับการขูดภายในปากมดลูก (endocervical curettage) ไม่แนะนำให้ทำในขณะการตั้งครรภ์(6)
ระยะของโรค (staging)
การแบ่งระยะของโรคมะเร็งปากมดลูกในสตรีตั้งครรภ์ใช้เหมือนกับสตรีที่ไม่ตั้งครรภ์ ตาม FIGO 2018 (7) ดังตารางที่ 1
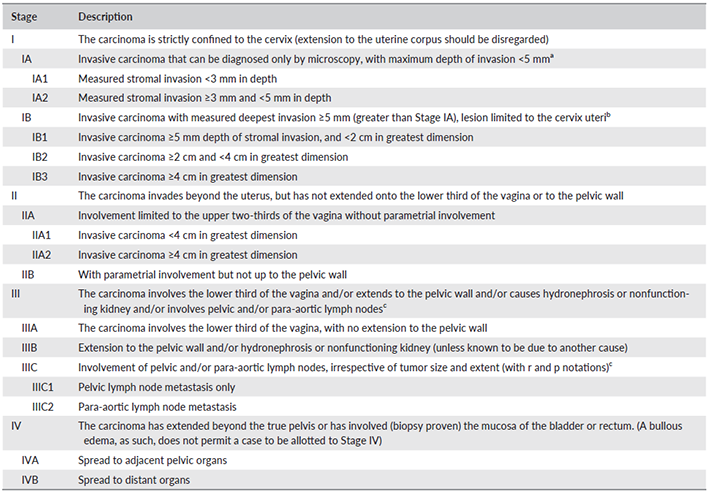
ตารางที่ 1 แสดงระยะของโรคอ้างอิงตาม FIGO 2018
ที่มา Salib MY, Russell JHB, Stewart VR, Sudderuddin SA, Barwick TD, Rockall AG, et al. 2018 FIGO Staging Classification for Cervical Cancer: Added Benefits of Imaging. RadioGraphics. 2020;40(6):1807-22.
การส่งตรวจทางรังสีวิทยา
Magnetic Resonance Imaging (MRI)
การส่งตรวจภาพถ่ายอุ้งเชิงกรานด้วย MRI ถือว่าเป็นทางเลือกแรกที่ช่วยในการกำหนดระยะของโรคมะเร็งปากมดลูกในสรีตั้งครรภ์ สามารถทำได้ในทุกอายุครรภ์ โดยไม่จำเป็นต้องใช้สารทึบรังสี เนื่องจากสารทึบรังสีสามารถผ่านรกและเข้าไปสู่น้ำคร่ำได้ และการกำหนดระยะโรคมะเร็งปากมดลูกสามารถทำได้โดยไม่ต้องฉีดสารทึบรังสี(9) การแปลผลอาจทำได้ยากกว่า เนื่องจากเส้นเลือดดำในอุ้งเชิงกรานจะมีขนาดใหญ่ขึ้นในสตรีตั้งครรภ์ทำให้การประเมินขนาดของต่อมน้ำเหลืองผิดได้ นอกจากนี้คุณภาพของภาพถ่ายอาจจะถูกรบกวนจากการขยับของทารกในครรภ์ อาจต้องการอาศัยรังสีแพทย์ที่มีความเชี่ยวชาญและประสบการณ์ในการอ่านผล(10) แต่หากจำเป็นต้องใช้สารทึบรังสีสามารถใช้ Gadolinium contrast ได้เนื่องจากยังไม่มีรายงานว่ามีผลต่อทารกในครรภ์
Computer tomography (CT)
Computer tomography ควรหลีกเลี่ยงในสตรีตั้งครรภ์เนื่องจากรังสีเอกเรย์มีผลต่อทารกในครรภ์ อาจพิจารณาทำในกรณีที่ไม่สามารถทำ MRI ได้ CT อาจจะจำเป็นในกรณีที่ต้องการประเมินรอยโรคระยะลุกลาม เช่นสงสัยมะเร็งลุกลามไปที่ปอดหรือเยื่อหุ้มปอด แพทย์จำเป็นต้องชั่งน้ำหนักระหว่างประโยชน์ในการตรวจเพื่อประเมินระยะของโรคและความเสี่ยงของรังสีเอกซเรย์ต่อทารกในครรภ์ หากจำเป็นต้องทำ CT ควรจำกัดระยะเวลาที่ทำและปริมาณรังสีที่ใช้ให้น้อยที่สุดที่เพียงพอในการประเมินรอยโรค และพิจารณาใช้แผ่นกันรังสีบริเวณท้องด้วย(11)
Ultrasound
Ultrasound สามารถทำได้อย่างปลอดภัยไม่มีผลต่อสตรีตั้งครรภ์และทารกในครรภ์ อาจใช้ช่วยในการกำหนดระยะของโรคมะเร็งปากมดลูก เช่นการประเมินการขยายขนาดของกรวยไตในกรณีที่มะเร็งลุกลามจนทำให้เกิดการอุดตันของระบบทางเดินปัสสาวะทำให้กรวยไตมีขนาดใหญ่ขึ้น แต่ต้องคำนึงไว้ว่าในสตรีตั้งครรภ์ที่ขนาดมดลูกโตขึ้นอาจจะมีการกดเบียดท่อไตทำให้มีกรวยไตขยายได้เล็กน้อยอยู่แล้ว
Radiographs
Chest radiographs ควรทำเพื่อประเมินรอยโรคลุกลามไปปอด เนื่องจากรังสีที่ใช้มีผลต่อทารกในครรภ์น้อย สามารถพิจารณาทำ Chest radiographs ในสตรีตั้งครรภ์เมื่อมีข้อบ่งชี้เหมือนสตรีที่ไม่ตั้งครรภ์ โดยพิจารณาใช้แผ่นกันรังสีบริเวณท้องด้วย
Laparoscopic lymphadenectomy
การผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองอุ้งเชิงกรานมาประเมินว่ามีมะเร็งลุกลามไปหรือไม่ มีความสำคัญในการพิจารณารักษาในกรณีที่หญิงตั้งครรภ์ถูกวินิจฉัยว่าเป็นมะเร็งปากมดลูกระยะที่ 1 และต้องการตั้งครรภ์ต่อ(pregnancy preservation) โดยแนะนำให้ทำในช่วงอายุครรภ์น้อยกว่า 22 สัปดาห์ เนื่องจากหากทำในช่วงที่อายุครรภ์มากกว่า 22 สัปดาห์ จำนวนต่อมน้ำเหลืองที่เลาะได้จะมีปริมาณน้อย ขนาดมดลูกที่โตขึ้นจะทำให้การผ่าตัดยากและมีความเสี่ยงจากการผ่าตัดมากกว่า (12)
หากมีการลุกลามไปต่อมน้ำเหลืองควรยุติการตั้งครรภ์และรับการรักษาโดยเร็ว แต่หากไม่มีการลุกลามไปต่อมน้ำเหลืองสามารถตั้งครรภ์ต่อไปได้และทำการรักษามะเร็งปากมดลูกหลังคลอดได้
สำหรับการทำ sentinel lymph node dissection ในสตรีตั้งครรภ์ ยังมีข้อมูลไม่เพียงพอ จึงยังไม่แนะนำให้ทำในสตรีตั้งครรภ์(13)
การรักษารอยโรคระยะก่อนลุกลามในสตรีตั้งครรภ์
จากข้อมูลที่มีรายงานในปัจจุบัน 2 ใน 3ของสตรีตั้งครรภ์ที่เป็น Low-grade squamous intraepithelial lesion (LSIL) รอยโรคหายได้เอง มีเพียงส่วนน้อยที่รอยโรคพัฒนาต่อ 1 ใน 2 ของสตรีตั้งครรภ์ที่เป็น High-grade squamous intraepithelial lesion (HSIL) รอยโรคหายได้เอง จึงสามารถสรุปได้ว่าการตั้งครรภ์ไม่ได้มีผลทำให้รอยโรคระยะก่อนลุกลามพัฒนาเป็นมะเร็งได้เร็วขึ้น(14)
สรีตั้งครรภ์ที่ผลตรวจคัดกรอง (cytology) เป็น atypical squamous cell of undetermined significant (ASCUS) หรือ LSIL สามารถทำการส่องกล้องปากมดลูกในช่วงตั้งครรภ์ หรือ เลื่อนการส่องกล้องปากมดลูกไปเป็น 6 สัปดาห์หลังคลอดได้(6) โดยการส่องกล้องปากมดลูกหลังคลอดไม่แนะนำให้ทำในช่วงเร็วกว่า 4 สัปดาห์หลังคลอด(5)
สตรีตั้งครรภ์ที่ผลตรวจคัดกรอง (cytology) เป็น HSIL ควรได้รับการส่องกล้องปากมดลูกและตัดชิ้นเนื้อไปตรวจในช่วงการตั้งครรภ์(6) หากผลชิ้นเนื้อเป็น cervical intraepithelial neoplasia 2,3 (CIN2,3) หรือ adenocarcinoma in situ ควรตรวจติดตามสตรีตั้งครรภ์ด้วยการส่องกล้องปากมดลูก และ age-based testing ทุก 12-24 สัปดาห์(5) และทำการตัดชินเนื้อปากมดลูกซ้ำในกรณีที่รอยโรครุนแรงขึ้นจากการส่องกล้อง หรือสงสัยรอยโรคระยะลุกลาม การตัดปากมดลูกหรือการจี้ปากมดลูกเพื่อรักษารอยโรค CIN2,3 ในระหว่างการตั้งครรภ์ไม่ควรทำ แต่การตัดปากมดลูกจะทำในกรณีที่สงสัยว่าเป็นรอยโรคระยะลุกลามเพื่อวินิจฉัยมะเร็งปากมดลูกในสตรีตั้งครรภ์เป็นหลัก(6)
การรักษามะเร็งปากมดลูกในสตรีตั้งครรภ์
ระยะ IA1 ที่ไม่มี lymph-vascular space invasion(LVSI)
สามารถรักษาได้ด้วยการตัดปากมดลูกเป็นรูปกรวย (conization) โดยมีโอกาสแท้งได้ร้อยละ 15 หลังทำหัตถการ(15) ช่วงอายุครรภ์ที่เหมาะสมในการรักษาด้วยการตัดปากมดลูกคือ 14-20 สัปดาห์ ควรทำในห้องผ่าตัดที่มีความพร้อมในการห้ามเลือดและสตรีตั้งครรภ์ควรได้รับยาระงับความเจ็บปวดอย่างเหมาะสม การตัดปากมดลูกไม่ควรตัดลึกจนเกินไปเพราะอาจโดนส่วนของถุงน้ำคร่ำได้ มีรายงานว่าการตัดปากมดลูกลึกมากกว่า 1 เซนติเมตรมีโอกาสเกิดน้ำเดินและคลอดก่อนกำหนด(16)
การตัดปากมดลูกเป็นรูปกรวยควรทำให้ได้ชิ้นเนื้อเป็นชิ้นเดียว เนื่องจากจะประเมินขอบเขตและความลึกของมะเร็งได้ดีกว่า หากผลชิ้นเนื้อรายงานว่าพบรอยโรคบริเวณขอบชิ้นเนื้อ อาจพิจารณาตัดปากมดลูกอีกครั้งได้ หลังจากตัดปากมดลูกพิจารณาเย็บปากมดลูกเพื่อป้องกันการคลอดก่อนกำหนดและช่วยหยุดเลือดจากตัดปากมดลูกได้ หลังจากตัดปาดมดลูกควรติดตามผู้ป่วยด้วยการตรวจภายในและส่องกล้องปากมดลูกทุกไตรมาส(17)
การพิจารณช่องทางคลอดสามารถคลอดทางช่องคลอดได้หากผลชิ้นเนื้อจากการตัดปาดมดลูกแบบกรวยไม่พบรอยโรคบริเวณขอบชิ้นเนื้อ และผ่าตัดคลอดตามข้อบ่งชี้ทางสูติศาสตร์(6)
ระยะ IA1 ที่มี Lymph-vascular space invasion(LVSI), IA2 และ IB1
การรักษามาตรฐานในระยะนี้ของสตรีที่ไม่ตั้งครรภ์คือ การผ่าตัดมดลูกแบบกว้างและเลาะต่อมน้ำเหลืองอุ้งเชิงกราน(Radical hysterectomy with bilateral pelvic lymphadenectomy; RHPL) โดยอาจพิจารณาตัดรังไข่สองข้างขึ้นอยู่กับความเสี่ยงของการกระจายของมะเร็งไปรังไข่ หากสรีตั้งครรภ์ไม่ต้องการตั้งครรภ์ต่อสามารถยุติการตั้งครรภ์และผ่าตัดมดลูกตามมาตรฐานได้เลย(RHPL with fetus in situ)
ในกรณีที่สตรีตั้งครรภ์ต้องการตั้งครรภ์ต่อและอายุครรภ์น้อยกว่า 22 สัปดาห์ พิจารณาทำ laparoscopic lymphadenectomy
-หากพบว่ามีการกระจายไปต่อมน้ำเหลืองแนะนำให้รักษาด้วยการให้ยาเคมีบำบัดในช่วงที่ตั้งครรภ์(neoadjuvant chemotherapy) และรักษาตามมาตรฐานหลังคลอด หรือ แนะนำให้ยุติการตั้งครรภ์และผ่าตัดมดลูกตามมาตรฐาน(RHPL with fetus in situ)
-หากไม่พบการกระจายไปต่อมน้ำเหลืองสามารถรักษาด้วยการผ่าตัดปากมดลูก(simple trachelectomy)หรือการตัดปากมดลูกแบบกรวย(conization) หรือ ติดตามไปในช่วงตั้งครรภ์และรักษาตามมาตรฐานหลังคลอดได้ สำหรับการผ่าตัดปากมดลูกแบบกว้าง(radical trachelectomy)ไม่แนะนำให้ทำในสตรีตั้งครรภ์เนื่องจากมีความเสี่ยงต่อการตั้งครรภ์ และมีโอกาสแท้งสูงถึงร้อยละ 33 และเสียเลือดมาก(6)
ในกรณีที่สตรีตั้งครรภ์ต้องการตั้งครรภ์ต่อและอายุครรภ์มากกว่า 22 สัปดาห์ สามารถรักษาด้วยการให้ยาเคมีบำบัดในช่วงที่ตั้งครรภ์(neoadjuvant chemotherapy)และรักษาตามมาตรฐานหลังคลอด หรือ ติดตามไปในช่วงตั้งครรภ์และรักษาตามมาตรฐานหลังคลอด(6)
ระยะ IB2
กรณีที่สตรีตั้งครรภ์ไม่ต้องการตั้งครรภ์ต่อสามารถยุติการตั้งครรภ์และทำการผ่าตัดตามมาตรฐาน(Radical hysterectomy and pelvic lymphadenectomy with fetus in situ)
ในกรณีที่สตรีตั้งครรภ์ต้องการตั้งครรภ์ต่อและอายุครรภ์น้อยกว่า 22 สัปดาห์ พิจารณา laparoscopic lymphadenectomy
-หากไม่พบการกระจายไปต่อมน้ำเหลืองสามารถรักษาด้วยให้ยาเคมีบำบัดในช่วงที่ตั้งครรภ์(neoadjuvant chemotherapy)และรักษาตามมาตรฐานหลังคลอด หรือ ติดตามไปในช่วงตั้งครรภ์และรักษาตามมาตรฐานหลังคลอดได้(18)
-หากพบว่ามีการกระจายไปต่อมน้ำเหลือง แนะนำให้ยุติการตั้งครรภ์และทำการรักษาตามมาตรฐาน เป็นหลัก การรักษาด้วยให้ยาเคมีบำบัดในช่วงที่ตั้งครรภ์(neoadjuvant chemotherapy)และรักษาตามมาตรฐานหลังคลอดอาจยอมรับได้
ในกรณีที่สตรีตั้งครรภ์ต้องการตั้งครรภ์ต่อและอายุครรภ์มากกว่า 22 สัปดาห์ สามารถรักษาด้วยการให้ยาเคมีบำบัดในช่วงที่ตั้งครรภ์(neoadjuvant chemotherapy)และรักษาตามมาตรฐานหลังคลอด
ระยะ IB3 and above
กรณีที่สตรีตั้งครรภ์ต้องการตั้งครรภ์ต่อแนะนำให้รักษาด้วยยาเคมีบำบัดในช่วงที่ตั้งครรภ์ การติดตามอาการเพียงอย่างเดียวโดยไม่ได้ให้ยาเคมีบำบัดไม่แนะนำ เนื่องจากมีโอกาสที่ตัวโรคจะลุกลามได้ ยังไม่มีหลักฐานชัดเจนเกี่ยวกับประโยชน์ในการทำ laparoscopic lymphadenectomy เมื่อทารกเจริญได้เพียงพอจนมีการพัฒนาของปอดสมบูรณ์ อาจพิจารณายุติการตั้งครรภ์และทำการรักษาผู้ป่วยต่อตามมาตรฐาน(19)
กรณีที่สตรีตั้งครรภ์ไม่ต้องการตั้งครรภ์ต่อ หากอยู่ในช่วงไตรมาสแรกสามารถรักษาด้วยการฉายแสงร่วมกับให้ยาเคมีบำบัดโดยมีทารกอยู่ในครรภ์ได้เลย (CCRT with fetus in utero) แต่หากอยู่ในช่วงไตรมาสที่สองแนะนำให้รักษาด้วยการฉายแสงร่วมกับให้ยาเคมีบำบัดหลังจาก hysterotomy หรือ feticide เพื่อลดโอกาสเสียเลือด และลดการกระทบทางจิตใจของสตรีตั้งครรภ์
การรักษามะเร็งปากมดลูกในสตรีตั้งครรภ์แบ่งตามอายุครรภ์และระยะของโรคสรุปคร่าวๆได้ตามรูปที่ 7
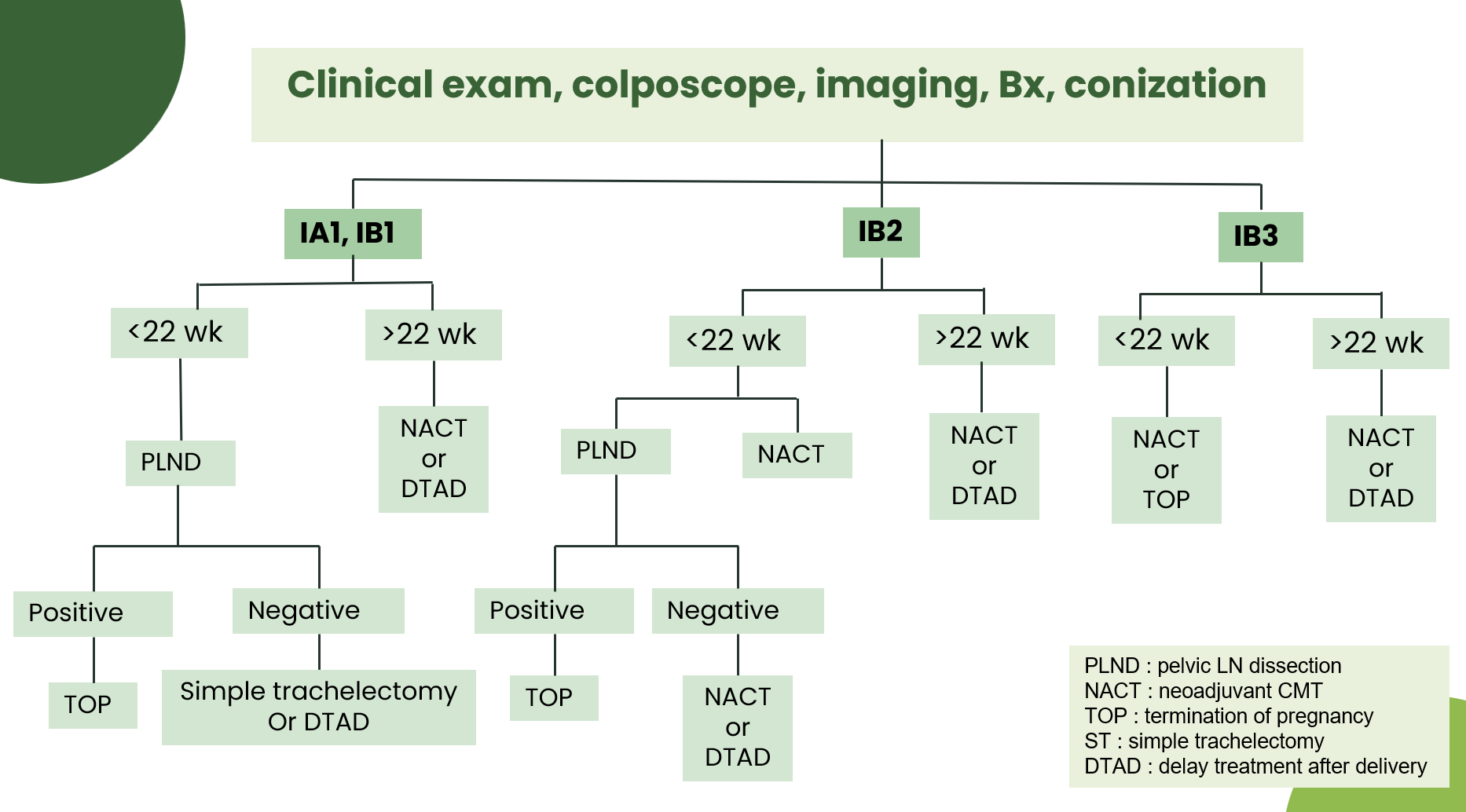
รูปที่ 7 แสดงแนวทางการรักษามะเร็งปากมดลูกในสตรีตั้งครรภ์
อ้างอิงจาก gynecologic cancer in pregnancy: guidelines based on third international consensus meeting, ESMO Guidelines, 2019 (20)
การรักษาด้วยยาเคมีบำบัด
การรักษาด้วยยาเคมีบำบัดในช่วงตั้งครรภ์เพื่อควบคุมตัวโรคเพื่อรอระยะเวลาให้ทารกในครรภ์โตเพียงพอและรักษาต่อตามมาตรฐานหลังคลอด จากการศึกษาที่ผ่านมาพบว่าการให้ยาเคมีบำบัดสามารถช่วยควบคุมระยะของโรคและสามารถพยุงการตั้งครรภ์ไปได้อายุครรภ์เฉลี่ย 33.2 สัปดาห์(6) โดยการตอบสนองหลังได้ยาเคมีบำบัด พบว่า complete response ร้อยละ 6.25, partial response ร้อยละ 62.5 , stable disease ร้อยละ 28.1
ในช่วงไตรมาสแรกไม่สามารถให้ยาเคมีบำบัดได้เนื่องจากมีผลต่อการพัฒนาอวัยวะของทารก ช่วงอายุครรภ์ที่สามารถให้ยาเคมีบำบัดได้คือหลัง 14 สัปดาห์ขึ้นไป (21) กลุ่มยาเคมีบำบัดที่มีประสิทธิภาพในการรักษามะเร็งปากมดลูกคือ platinum agents และ taxanes โดยแนะนำเป็น carboplatin ร่วมกับ paclitaxel มากกว่า cisplatin เนื่องจาก cisplatin มีผลข้างเคียงต่อไตและหูมากกว่า แม้ว่าสตรีตั้งครรภ์จะมีการเปลี่ยนแปลงทางสรีรวิทยาการกระจายตัวของยาเคมีบำบัดอาจจะเปลี่ยนแปลงเมื่อเทียบกับสตรีไม่ตั้งครรภ์ แต่ยังไม่มีรายงานว่าขนาดของยาเคมีบำบัดในสตรีทั่วไปนั้นไม่เพียงพอต่อการรักษามะเร็งในสตรีตั้งครรภ์(22) ความถี่ในการให้ยาเคมีบำบัดสามารถให้ได้ทั้ง ทุกสัปดาห์ และ ทุก 3 สัปดาห์
ระหว่างที่รักษาด้วยยาเคมีบำบัดจะต้องติดตามผู้ป่วยเฝ้าระวังผลข้างเคียงที่จะเกิดขึ้น ปรับยาบรรเทาอาการคลื่นไส้อาเจียนตามความเหมาะสม ทารกในครรภ์มีความเสี่ยงที่จะเกิดภาวะทารกโตช้าในครรภ์(Intrauterine growth restriction) มีความเสี่ยงคลอดก่อนกำหนด แพทย์ควรประเมินสุขภาพและน้ำหนักของทารกเพื่อเฝ้าระวังภาวะดังกล่าว
หากกำหนดอายุครรภ์ที่จะผ่าตัดคลอดได้แล้วควรหยุดยาเคมีบำบัดอย่างน้อย 3 สัปดาห์ก่อนผ่าตัด เพื่อให้ไขสันหลังของทารกและหญิงตั้งครรภ์เองกลับมาทำงาน ยาเคมีบำบัดจึงไม่ควรให้ในช่วงอายุครรภ์ 35 สัปดาห์ขึ้นไป เพื่อลดโอกาสของการคลอดก่อนกำหนดในช่วงที่เม็ดเลือดขาวของสตรีตั้งครรภ์ต่ำ(21)
การตรวจติดตามระหว่างตั้งครรภ์
ระยะที่ IA1 ควรได้รับการตรวจติดตามด้วยการตรวจภายในและส่องกล้องปากมดลูกทุกไตรมาส
สำหรับสตรีตั้งครรภ์ที่ได้รับการรักษาด้วยยาเคมีบำบัดในช่วงที่ตั้งครรภ์ควรได้รับการติดตามด้วยการตรวจภายในทุก 3-4สัปดาห์ หากสงสัยว่าตัวโรคลุกลามควรส่ง MRI เพื่อประเมิน และควรได้รับการประเมินสุขภาพน้ำหนักของทารกในครรภ์โดยสูติแพทย์เชี่ยวชาญมารดาและทารก(23)
Definitive treatment
สตรีตั้งครรภ์ที่เป็นมะเร็งปากมดลูกและต้องการตั้งครรภ์ต่อหลังจากที่คลอดบุตรแล้วจะต้องได้รับการรักษาตามมาตรฐานดังนี้
กรณีที่ผู้ป่วยยังต้องการมีบุตรอยู่(fertility sparing)
Stage IA1 margin negative: ไม่จำเป็นต้องรักษาเพิ่มเติม
Stage IA1 margin positive: หลังคลอดโดยการผ่าตัดคลอด จะต้องทำการตัดปากมดลูกแบบกรวยอีกครั้งหลังคลอด 6-8 สัปดาห์
Stage IA2 หรือ ขนาด tumor > 4 cm: ผ่าตัดปาดมดลูกแบบกว้างและเลาะต่อมน้ำเหลืองอุ้งเชิงกราน (Radical trachelectomy and pelvic lymphadenectomy)
กรณีที่ผู้ป่วยไม่ต้องการมีบุตรแล้ว (non-fertility sparing)
Stage IA1 without LVSI: Extrafascial hysterectomy
Stage IA1 with LVSI IA2, IB1: ผ่าตัดมดลูกแบบกว้างเลาะต่อมน้ำเหลืองอุ้งเชิงกราน (Radical hysterectomy and pelvic lymphadenectomy) โดยจะพร้อมกับการผ่าตัดคลอด หรือ หลังผ่าตัดคลอดก็ได้
การกำหนดระยะเวลาคลอดและช่องทางคลอด
สตรีตั้งครรภ์ที่ได้รับการรักษาด้วยการผ่าตัดปากมดลูก(simple trachelectomy) ควรคลอดโดยการผ่าตัดคลอดในช่วงที่ยังไม่เจ็บครรภ์คลอดเพื่อป้องกันการเกิดมดลูกแตกและเสียเลือดมาก(24) โดยการลงแผลบริเวณมดลูกเดิมแนะนำให้ลงแบบแนวตั้ง(classical incision)(25) แต่ปัจจุบันมีรายงานว่าสามารถลงแนวขวางได้หากมีการ form ของ lower uterine segment
สตรีที่ต้องการตั้งครรภ์ต่อและได้รับการรักษาด้วยยาเคมีบำบัดในช่วงตั้งครรภ์ ควรให้คลอดเมื่อทารกมีความสมบูรณ์ของปอด อาจพิจารณาที่อายุครรภ์ 34-36 สัปดาห์ โดยพิจารณาให้ corticosteroid ก่อนการคลอด แต่หากตัวโรคมะเร็งแย่ลงควรพิจารณาในคลอดเลย(12) โดยช่องทางคลอดแนะนำเป็นการผ่าตัดคลอดโดยการลงแผลแนวตั้ง(classical incision)
สำหรับการคลอดทางช่องคลอดสามารถทำได้ใน ระยะ IA1 และ IA2 ที่ margin negative โดยหลีกเลี่ยงการตัดฝีเย็บเนื่องจากมีรายงานว่ามีกระจายของเซลล์มะเร็งบริเวณแผลฝีเย็บ(6)
การให้นมบุตร(breast feeding)
กรณีที่ได้รับการรักษาด้วยยาเคมีบำบัดอยู่ถือว่าเป็นข้อห้ามในการให้นมบุตรเนื่องจาก เคมีบำบัดสามารถขับออกทางน้ำนมทำให้ เกิดภาวะเม็ดเลือดขาวต่ำในทารกได้ โดยระยะเวลาที่ปลอดภัยที่สามารถให้นมบุตรได้หลังได้ยาเคมีบำบัดคืออย่างน้อย 14 วัน
สรุป
มะเร็งปากมดลูกในสตรีตั้งครรภ์เป็นมะเร็งที่พบได้บ่อย แม้ว่าปัจจุบันแนวโน้มอุบัติการณ์ของโรคในสตรีวัยเจริญพันธุ์จะลดลงเนื่องจากมีการฉีดวัคซีนป้องกันมะเร็งปากมดลูกอย่างแพร่หลายขึ้น แต่สตรีตั้งครรภ์ในยุคปัจจุบันก็มีแนวโน้มอายุเพิ่มขึ้นเช่นกัน การดูแลผู้ป่วยต้องพิจารณาหลายปัจจัยทั้งระยะของโรค อายุครรภ์ ความต้องการมีบุตร ความพร้อมของทีมในการดูแลผู้ป่วย โดยแนวทางการรักษาอ้างอิงตามข้อมูลที่มีรายงานหลักฐานเชิงประจักษ์ในปัจจุบัน
เอกสารอ้างอิง
- Maggen C, Wolters VE, Cardonick E, Fumagalli M, Halaska MJ, Lok CA, et al. Pregnancy and cancer: the INCIP project. Current oncology reports. 2020;22:1-10.
- Castanon A, Landy R, Pesola F, Windridge P, Sasieni P. Prediction of cervical cancer incidence in England, UK, up to 2040, under four scenarios: a modelling study. The Lancet Public Health. 2018;3(1):e34-e43.
- Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Williams Obstetrics, 26e. Maternal physiology. New York, NY: McGraw Hill; 2022. p. 53.
- Pretorius R, Semrad N, Watring W, Fotheringham N. Presentation of cervical cancer. Gynecologic oncology. 1991;42(1):48-53.
- Perkins RB, Guido RS, Castle PE, Chelmow D, Einstein MH, Garcia F, et al. 2019 ASCCP risk-based management consensus guidelines for abnormal cervical cancer screening tests and cancer precursors. Journal of lower genital tract disease. 2020;24(2):102.
- Berek J, Hacker NF. Berek and Hacker’s Gynecologic Oncology: Wolters Kluwer Health; 2020.
- Grigsby PW, Massad LS, Mutch DG, Powell MA, Thaker PH, McCourt C, et al. FIGO 2018 staging criteria for cervical cancer: Impact on stage migration and survival. Gynecologic oncology. 2020;157(3):639-43.
- Salib MY, Russell JHB, Stewart VR, Sudderuddin SA, Barwick TD, Rockall AG, et al. 2018 FIGO Staging Classification for Cervical Cancer: Added Benefits of Imaging. RadioGraphics. 2020;40(6):1807-22.
- Webb JA, Thomsen HS, Morcos SK, org MoCMSCoESoURwe. The use of iodinated and gadolinium contrast media during pregnancy and lactation. European radiology. 2005;15:1234-40.
- Balleyguier C, Fournet C, Hassen WB, Zareski E, Morice P, Haie-Meder C, et al. Management of cervical cancer detected during pregnancy: role of magnetic resonance imaging. Clinical imaging. 2013;37(1):70-6.
- Morice P, Uzan C, Gouy S, Verschraegen C, Haie-Meder C. Gynaecological cancers in pregnancy. The Lancet. 2012;379(9815):558-69.
- Amant F, Berveiller P, Boere I, Cardonick E, Fruscio R, Fumagalli M, et al. Gynecologic cancers in pregnancy: guidelines based on a third international consensus meeting. Annals of Oncology. 2019;30(10):1601-12.
- Filippakis GM, Zografos G. Contraindications of sentinel lymph node biopsy: are there any really? World Journal of Surgical Oncology. 2007;5(1):1-11.
- Beharee N, Shi Z, Wu D, Wang J. Diagnosis and treatment of cervical cancer in pregnant women. Cancer medicine. 2019;8(12):5425-30.
- Averette HE, Nasser N, Yankow SL, Little WA. Cervical conization in pregnancy: Analysis of 180 operations. American journal of obstetrics and gynecology. 1970;106(4):543-9.
- Weinmann S, Naleway A, Swamy G, Krishnarajah G, Arondekar B, Fernandez J, et al. Pregnancy outcomes after treatment for cervical cancer precursor lesions: an observational study. PLoS One. 2017;12(1):e0165276.
- Botha MH, Rajaram S, Karunaratne K. Cancer in pregnancy. International Journal of Gynecology & Obstetrics. 2018;143:137-42.
- Zou W, Han Y, Zhang Y, Hu C, Feng Y, Zhang H, et al. Neoadjuvant chemotherapy plus surgery versus concurrent chemoradiotherapy in stage IB2-IIB cervical cancer: a systematic review and meta-analysis. PLoS One. 2019;14(11):e0225264.
- Cibula D, Raspollini MR, Planchamp F, Centeno C, Chargari C, Felix A, et al. ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer–Update 2023. Virchows Archiv. 2023:1-32.
- Howe T, Lankester K, Kelly T, Watkins R, Kaushik S. Cervical cancer in pregnancy: diagnosis, staging and treatment. The Obstetrician & Gynaecologist. 2022;24(1):31-9.
- Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. The lancet oncology. 2004;5(5):283-91.
- an Calsteren K, Verbesselt R, Ottevanger N, Halaska M, Heyns L, Van Bree R, et al. Pharmacokinetics of chemotherapeutic agents in pregnancy: a preclinical and clinical study. Acta obstetricia et gynecologica Scandinavica. 2010;89(10):1338-45.
- Karam A, Goff B, Ramin S. Cervical cancer in pregnancy. Up to date Literature review current through: Apr. 2013.
- Ma L-K, Cao D-Y, Yang J-X, Liu J-T, Shen K, Lang J-H. Pregnancy outcome and obstetric management after vaginal radical trachelectomy. European Review for Medical & Pharmacological Sciences. 2014;18(20).
- Knight L, Acheson N, Kay T, Renninson J, Shepherd J, Taylor M. Obstetric management following fertility-sparing radical vaginal trachelectomy for cervical cancer. Journal of Obstetrics and Gynaecology. 2010;30(8):784-9.