การเจาะน้ำคร่ำ : Amniocentesis
การเจาะน้ำคร่ำ หมายถึง การดูดเก็บน้ำคร่ำจากโพรงมดลูกโดยใช้เข็มเจาะผ่านทางหน้าท้องมารดา น้ำคร่ำที่ได้มีส่วนประกอบของเซลล์ทารกจึงสามารถนำมาตรวจวินิจฉัยโรคของทารกในครรภ์ได้โดยการเพาะเลี้ยงเซลล์ (cell culture) หรือการสกัด fetal DNA โดยจะได้ fetal DNA เฉลี่ยประมาณ 1.5 – 5 ไมโครกรัมต่อปริมาณน้ำคร่ำ 10 ซีซี[1]
ส่วนประกอบของน้ำคร่ำ
ในไตรมาสแรกของการตั้งครรภ์ น้ำคร่ำประกอบด้วยสารน้ำชนิด transudate ที่ซึมผ่านจากผิวหนังทารกที่ยังไม่มี keratin และสารน้ำชนิด transudate ที่ซึมผ่านจาก uterine decidua หรือ placenta surface ในระยะครึ่งหลังของการตั้งครรภ์หลังจากทารกสามารถขับปัสสาวะได้แล้ว ส่วนประกอบหลักของน้ำคร่ำ คือ ปัสสาวะของทารก (fetal urine) และ สารคัดหลั่งที่ขับจากปอดทารก (fetal lung fluid) นอกจากนี้ยังมีส่วนประกอบอื่นๆ ได้แก่สารน้ำชนิด transudate ที่ซึมผ่านจากผิวหนังทารกที่ยังไม่มี keratin, สารน้ำชนิด transudate จากรก เยื่อหุ้มทารก และสายสะดือ[2] โดยผิวหนังทารกจะเริ่มสร้าง keratin ได้ตั้งแต่ไตรมาสที่สาม ทำให้ไม่มีสารน้ำซึมผ่านในระยะหลังของการตั้งครรภ์ เซลล์ที่ได้จากน้ำคร่ำจึงเป็นเซลล์ที่มาจากตัวทารกเป็นส่วนใหญ่ แตกต่างจากเซลล์ที่ได้จากชิ้นเนื้อรกที่อาจพบ cell line ที่แตกต่างจากตัวทารกได้บ่อยกว่าจากกระบวนการ embryogenesis ระหว่างการแบ่งตัวของทารก รกและถุงน้ำคร่ำ
ปริมาณน้ำคร่ำ
ปริมาณน้ำคร่ำจะเพิ่มขึ้นเมื่ออายุครรภ์มากขึ้น โดยจะเพิ่มขึ้นในอัตรา 10 ซีซีต่อสัปดาห์ในไตรมาสแรก 50 – 60 ซีซีต่อสัปดาห์เมื่ออายุครรภ์ 19 – 25 สัปดาห์ จากนั้นอัตราการเพิ่มขึ้นของน้ำคร่ำจะไม่เปลี่ยนแปลงจนกระทั่งถึงอายุครรภ์ 34 สัปดาห์ (สร้างในอัตราคงที่) จึงจะค่อยๆ ลดลงจนถึงอัตรา 60 – 70 ซีซีต่อสัปดาห์เมื่ออายุครรภ์ 40 สัปดาห์ ดังนั้นปริมาณน้ำคร่ำจะค่อยๆ เพิ่มขึ้นจาก 10 ซีซีเมื่ออายุครรภ์ 8 สัปดาห์ เป็น 630 ซีซีเมื่ออายุครรภ์ 22 สัปดาห์ (ประมาณ 150 – 200 ซีซีเมื่ออายุครรภ์ 16 สัปดาห์) และ 770 ซีซีเมื่ออายุครรภ์ 28 สัปดาห์ หลังจากนั้นการเพิ่มขึ้นของปริมาณน้ำคร่ำจะค่อยๆ ช้าลงจนปริมาณน้ำคร่ำคงที่เมื่ออายุครรภ์ 30 – 36 สัปดาห์ หลังจากอายุครรภ์ 36 – 38 สัปดาห์ ปริมาณน้ำคร่ำจะค่อยๆ ลดลง และลดลงอย่างรวดเร็วเมื่ออายุครรภ์เลยกำหนด โดยมีปริมาณน้ำคร่ำเฉลี่ย 515 ซีซีเมื่ออายุครรภ์ 41 สัปดาห์[2]
ข้อบ่งชี้ในการทำหัตถการ
การเจาะน้ำคร่ำส่วนใหญ่ทำเพื่อการวินิจฉัยโรค และติดตามผลการรักษาดังแสดงในตารางที่ 1 การเจาะน้ำคร่ำยังสามารถทำเพื่อดูดน้ำคร่ำที่มีปริมาณมากเกินทิ้งเพื่อรักษาทารกในครรภ์ เช่น การตั้งครรภ์แฝดที่มีภาวะ twin-to-twin transfusion syndrome หัตถการนี้มีชื่อเรียกเฉพาะว่า amnioreduction ซึ่งจะไม่กล่าวถึงในบทนี้
จากสถิติการตรวจวินิจฉัยก่อนคลอดในปีพ.ศ. 2555 ของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบการเจาะน้ำคร่ำจำนวน 1288 รายโดยทุกรายมีข้อบ่งชี้ในการเจาะน้ำคร่ำเพื่อวินิจฉัยภาวะโครโมโซมผิดปกติของทารกในครรภ์ แบ่งเป็น มารดามีอายุมากกว่า 35 ปี (ร้อยละ 78.6), ผลการตรวจคัดกรองทารกกลุ่มอาการดาวน์อยู่ในกลุ่มเสี่ยงสูง (ร้อยละ 17.9), ผลการตรวจอัลตราซาวด์พบความผิดปกติของทารกในครรภ์ (ร้อยละ 1.5), เคยมีประวัติทารกผิดปกติในครรภ์ก่อน (ร้อยละ 1.2), มีประวัติโครโมโซมผิดปกติในครอบครัว (ร้อยละ 0.2), มารดามีความกังวลและต้องการเจาะน้ำคร่ำ (ร้อยละ 0.4) และภาวะ polyhydramnios (ร้อยละ 0.1)
| ตารางที่ 1: ข้อบ่งชี้ในการเจาะน้ำคร่ำ |
| เพื่อการวินิจฉัย หรือติดตามผลการรักษาทารกในครรภ์ |
|
| เพื่อการรักษาทารกในครรภ์ |
|
อายุครรภ์ที่เหมาะสมในการทำหัตถการ
การเจาะน้ำคร่ำเพื่อการวินิจฉัยก่อนคลอดมักทำตั้งแต่อายุครรภ์ 16 สัปดาห์ (15 – 18 สัปดาห์) เป็นต้นไป แม้ว่าจะมีรายงานการเจาะน้ำคร่ำในไตรมาสแรก (early amniocentesis) ก่อนอายุครรภ์ 15 สัปดาห์ แต่พบว่าเพิ่มความเสี่ยงต่อการเจาะไม่สำเร็จ (failed procedures) ร้อยละ 2 – 3[3, 4] เนื่องจากปริมาณน้ำคร่ำน้อยส่งผลให้การเพาะเลี้ยงเซลล์ไม่สำเร็จ (culture failure) และชั้น amnion และ chorion ยังไม่เชื่อมติดกันโดยสมบูรณ์ทำให้ขณะแทงเข็มผ่านชั้น amnion เกิดการดึงรั้งแยกออกจาก chorion (membrane tenting) ทำให้เจาะไม่ได้น้ำคร่ำ
จากการศึกษาเปรียบเทียบกับ Mid-trimester amniocentesis พบว่า early amniocentesis มีอัตราการสูญเสียทารก (fetal loss rate) เพิ่มขึ้นร้อยละ 1.7 (ร้อยละ 7.6 เทียบกับร้อยละ 5.9), อัตราการเกิดภาวะถุงน้ำคร่ำรั่ว (ruptured membranes) เพิ่มขึ้นร้อยละ 1.8 (ร้อยละ 3.5 เทียบกับร้อยละ 1.7), อัตราการเกิดภาวะ fetal talipes equinovarus (club foot) เพิ่มขึ้นร้อยละ1.2 (ร้อยละ 1.3 เทียบกับร้อยละ 0.1) ซึ่งเพิ่มเป็น 10 เท่าของประชากรทั่วไป (อัตราการเกิดภาวะนี้ในประชากรทั่วไปเท่ากับ 1 ใน 1000) โดยพบว่าสัมพันธ์กับการรั่วของถุงน้ำคร่ำหลังการทำหัตถการ[3]
เมื่อเปรียบเทียบกับ chorionic villus sampling พบว่า early amniocentesis มีอัตราการสูญเสียทารกเพิ่มขึ้นร้อยละ 3.0 (ร้อยละ 5.3 เทียบกับร้อยละ 2.3) และเพิ่มอัตราการเกิดภาวะ fetal talipes equinovarus ร้อยละ 1.07 (ร้อยละ 1.63 เทียบกับร้อยละ 0.56)[5] ดังนั้นการเจาะน้ำคร่ำก่อนอายุครรภ์ 15 สัปดาห์จึงถือว่าไม่ปลอดภัย ควรให้ทางเลือกแก่สตรีตั้งครรภ์ในการเจาะชิ้นเนื้อรกหรือเลื่อนการเจาะน้ำคร่ำออกไปจนกว่าจะอายุครรภ์มากกว่า 15 – 16 สัปดาห์
การเตรียมสตรีตั้งครรภ์ก่อนการทำหัตถการ
- ตรวจสอบข้อบ่งชี้ในการทำหัตถการ: สตรีตั้งครรภ์บางรายอาจมีข้อบ่งชี้มากกว่าหนึ่งอย่าง เช่น สตรีตั้งครรภ์อายุมากเสี่ยงต่อภาวะโครโมโซมผิดปกติของทารกในครรภ์และเป็นคู่เสี่ยงต่อการตั้งครรภ์ทารกเป็นโรคธาลัสซีเมียชนิดรุนแรง
- ตรวจสอบข้อห้ามในการทำหัตถการ: เช่น การติดเชื้อเอชไอวี (human immunocompromised virus; HIV infection), ภาวะเจ็บครรภ์คลอดก่อนกำหนด (preterm labor), ภาวะเลือดออกผิดปกติทางช่องคลอดที่ยังไม่ทราบสาเหตุ, มีแผลอักเสบติดเชื้อบริเวณผนังหน้าท้อง, ภาวะเกล็ดเลือดต่ำ หรือการแข็งตัวของเลือดผิดปกติ เป็นต้น
- การให้ข้อมูลแก่สตรีตั้งครรภ์ คู่สมรส และญาติ: อธิบายถึงความจำเป็นในการทำหัตถการ ภาวะแทรกซ้อน ความเสี่ยงต่อการสูญเสียทารกในครรภ์ ขั้นตอนในการทำหัตถการ การปฏิบัติตัวหลังการทำหัตถการ วิธีการและระยะเวลาในการแจ้งผลการตรวจ เปิดโอกาสให้สตรีตั้งครรภ์ซักถาม ให้เวลาตัดสินใจในการเลือกทำหรือไม่ทำหัตถการโดยไม่บังคับ และให้เซ็นต์ใบยินยอมการทำหัตถการ (informed consent form)
- การให้ anti-D immunoglobulin: สตรีตั้งครรภ์ที่มีผลตรวจหมู่เลือด Rh (D) เป็นลบ (Rh negative) ที่ยังไม่ถูกกระตุ้น และสามีมีผลตรวจหมู่เลือด Rh เป็นบวก (Rh positive) หรือไม่ทราบผลตรวจหมู่เลือดของสามี ควรได้รับ anti-D immunoglobulin เช่น RhoGAM 300 microgram หลังการทำหัตถการเพื่อป้องกันการเกิดภาวะ rhesus isoimmunization[6]
- การให้ยาปฏิชีวนะ (Antibiotic): ไม่จำเป็นต้องให้ยาปฏิชีวนะก่อนการทำหัตถการ แม้ว่าจะมีรายงานการให้ยาปฏิชีวนะเช่น amoxicillin/clavulanic acid หรือ azithromycin ก่อนการทำหัตถการ โดยพบว่าอัตราการสูญเสียทารกในกลุ่มที่ได้รับยาปฏิชีวนะต่ำกว่ากลุ่มที่ไม่ได้รับยาแต่ไม่มีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติและยังไม่มีหลักฐานเพียงพอที่จะเปลี่ยนแนวทางปฏิบัติ[7, 8]
- การให้ยาชาและยาระงับปวด (Anesthesia and analgesic drugs): ไม่จำเป็นต้องใช้ยาชาเฉพาะที่เช่น 1% lidocaine hydrochloride ฉีดเฉพาะตำแหน่งที่ต้องการเจาะเนื่องจากสตรีตั้งครรภ์ส่วนใหญ่มักทนอาการเจ็บจากการทำหัตถการที่ไม่ซับซ้อนได้ดี แต่อาจพิจารณาให้ในบางรายที่มีความกังวลสูง และอาจพิจารณาให้ยาระงับปวดหลังการทำหัตถการที่ใช้เวลานาน และมีอาการปวดมดลูกหรือผิวหนังบริเวณที่เจาะ
การเตรียมวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำ
วัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำอาจแตกต่างกันไปในแต่ละสถาบัน เช่น ขนาดของเข็ม spinal needle ที่ใช้เจาะ (บางสถาบันใช้เข็ม spinal needle ขนาด 20G หรือ 21G) หลอดทดลองที่ใช้เก็บตัวอย่างน้ำคร่ำเพื่อส่งตรวจทางห้องปฏิบัติการ (บางสถาบันใช้ centrifuged tube ขนาด 15 ซีซี) ถุงปราศจากเชื้อที่ใช้หุ้มหัวตรวจอัลตราซาวด์ (บางสถาบันใช้ถุงมือปราศจากเชื้อ) เป็นต้น ในตารางที่ 2 แสดงตัวอย่างการเตรียมวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
| ตารางที่ 2 แสดงการเตรียมวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำและตัวอย่างรูป | |
| วัสดุอุปกรณ์ | รูปที่ |
|
|
|
1a
1b 1c 1d |
|
2 |
|
3a
3b 3c 3d 3e 4a 4b 4c 4d 3f |
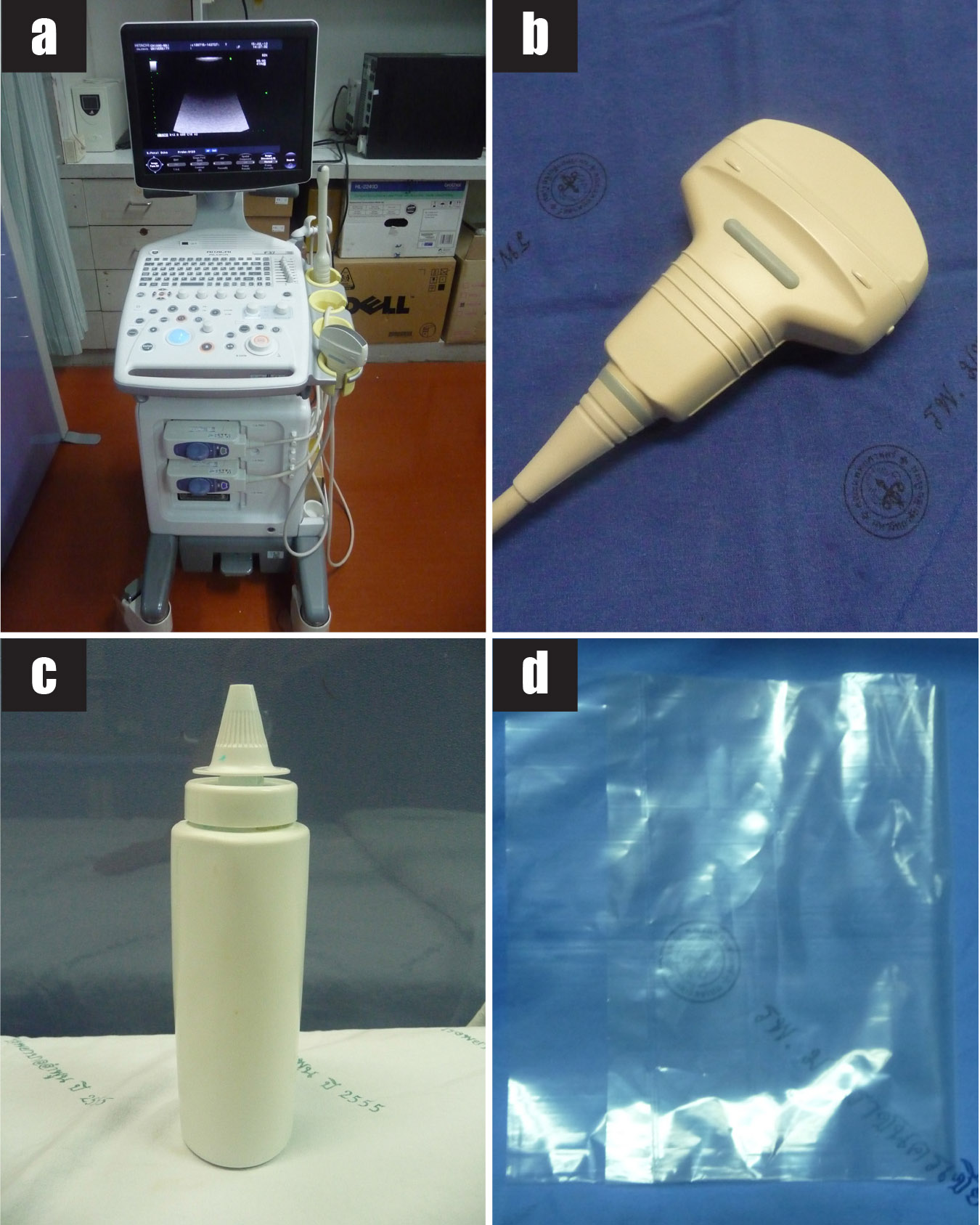
รูปที่ 1 แสดงวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำ
1a) เครื่องตรวจอัลตราซาวด์
1b) หัวตรวจอัลตราซาวด์ชนิด convex ความถี่ 3.5 MHz
1c) อัลตราซาวด์เจล
1d) ถุงพลาสติกใสปราศจากเชื้อ
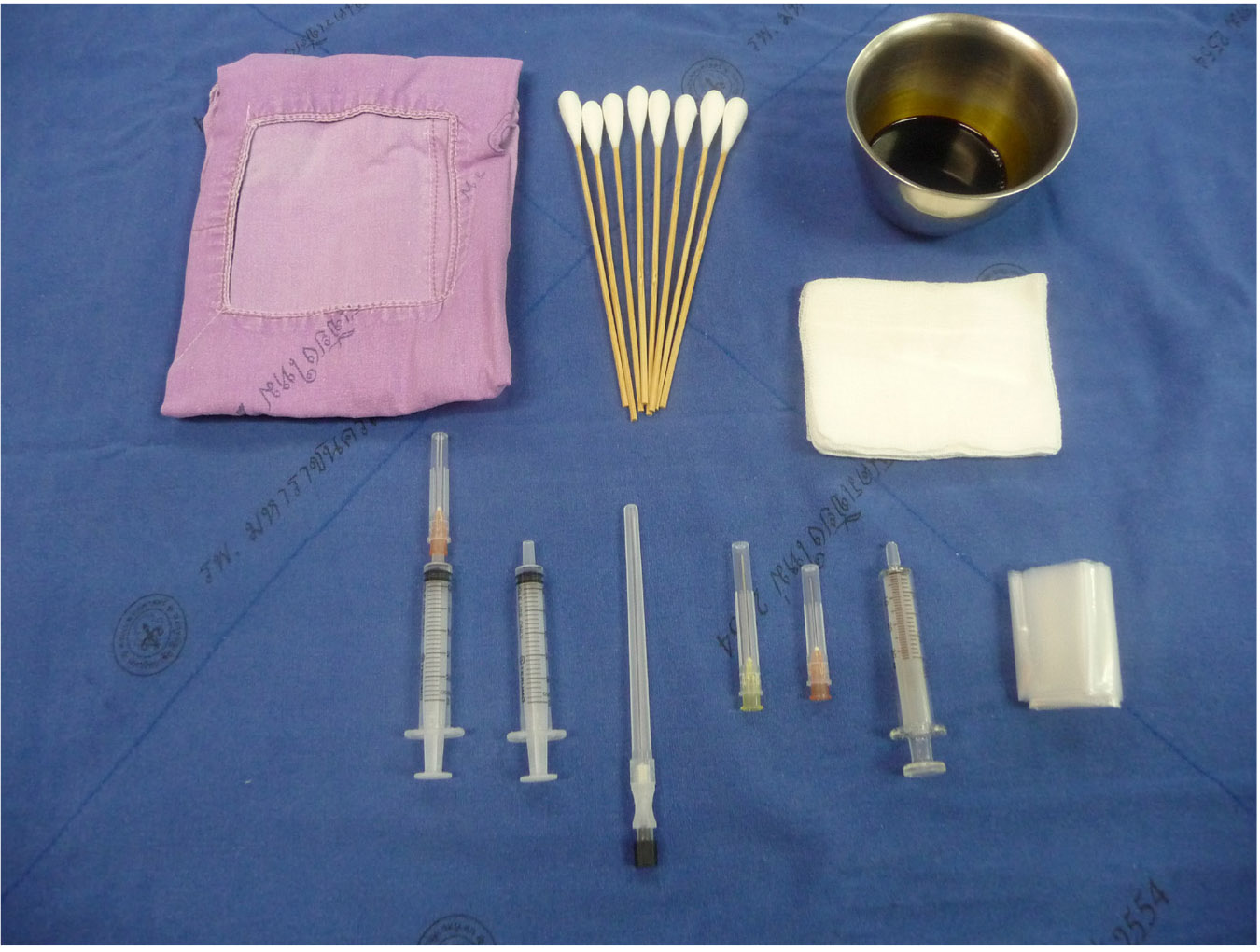
รูปที่ 2 แสดงชุดอุปกรณ์เจาะที่ใช้ในการเจาะน้ำคร่ำ
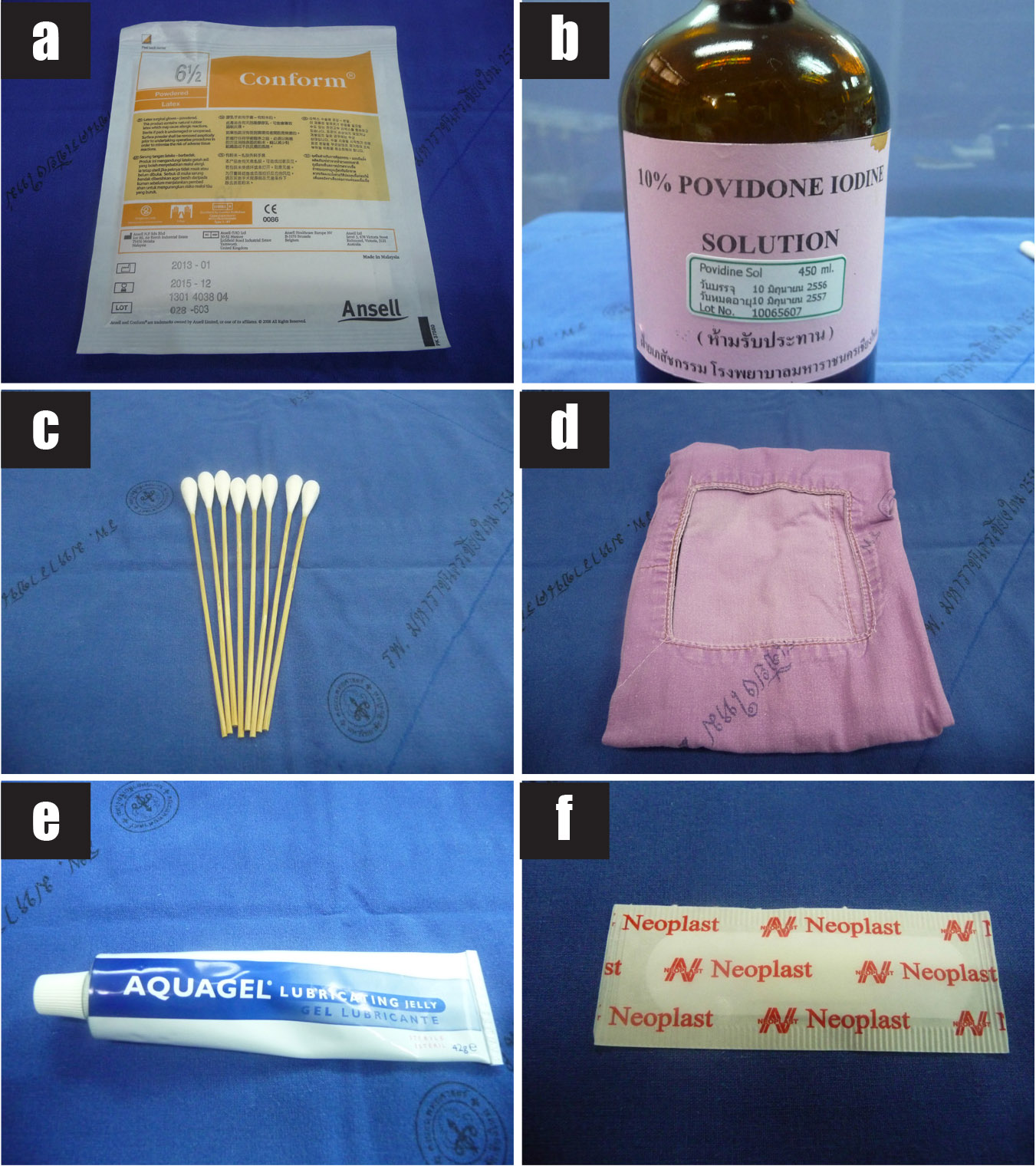
รูปที่ 3 แสดงวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำ
3a) ถุงมือปราศจากเชื้อ
3b) 10% povidone iodine solution
3c) ไม้พันสำลีสำหรับทำความสะอาดหน้าท้อง
3d) ผ้าช่อง
3e) อัลตราซาวด์เจลปราศจากเชื้อ
3f) พลาสเตอร์ปิดแผล
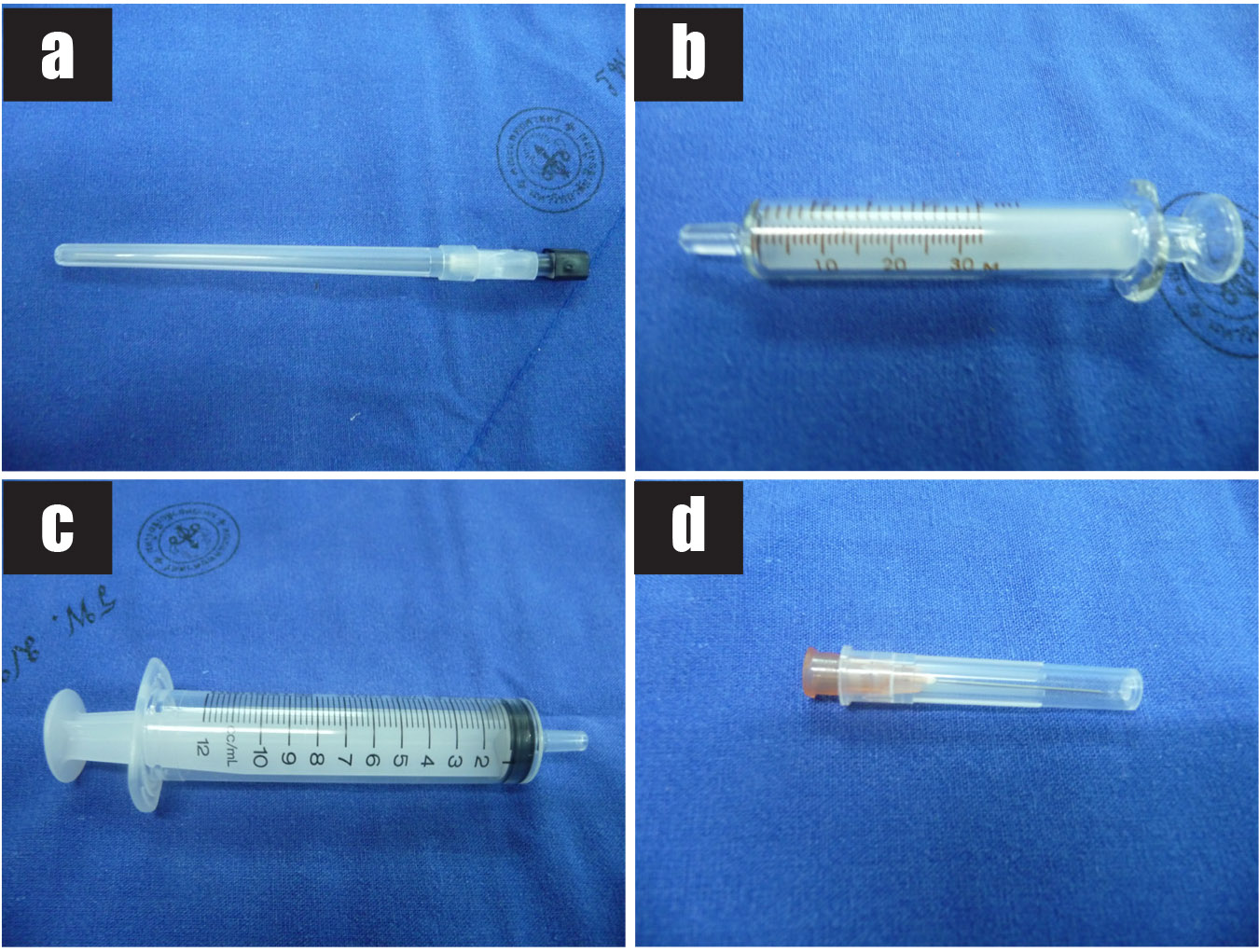
รูปที่ 4 แสดงวัสดุอุปกรณ์ที่ใช้ในการเจาะน้ำคร่ำ
4a) เข็ม spinal needle ขนาด 22G
4b) Syringe ขนาด 3 ซีซี (สำหรับดูดน้ำคร่ำทิ้ง)
4c) Syringe ขนาด 10 ซีซี
4d) เข็มฉีดยาขนาด 25G
ขั้นตอนการทำหัตถการ
- ให้สตรีตั้งครรภ์ปัสสาวะทิ้งให้หมดก่อนการทำหัตถการ และนอนหงายราบบนเตียงตรวจ
- ตรวจอัลตราซาวด์เพื่อประเมินจำนวนทารก วัดขนาดของทารกเพื่อประเมินอายุครรภ์ ตรวจหาความผิดปกติของทารก ตำแหน่งรกและสายสะดือ ปริมาณน้ำคร่ำ
- เลือกตำแหน่งแอ่งน้ำคร่ำ และแนวการลงเข็มที่เหมาะสมในการเจาะ โดยขึ้นอยู่กับปัจจัยหลายอย่าง ดังนี้
- เลือกแอ่งน้ำคร่ำที่มีขนาดใหญ่
- เลือกแอ่งน้ำคร่ำที่ไม่มีตัวทารกโดยเฉพาะอย่างยิ่งใบหน้า
- เลือกแอ่งน้ำคร่ำที่ไม่มีสายสะดือ
- หลีกเลี่ยงการลงเข็มผ่านรก หากหลีกเลี่ยงไม่ได้ควรเลือกลงเข็มผ่านรกส่วนที่บางที่สุด โดยลงเข็มห่างจากขอบรกและตำแหน่งที่สายสะดือเกาะ และอาจใช้ color Doppler ช่วยดูตำแหน่งเส้นเลือดขนาดใหญ่บนรก
- หลีกเลี่ยงการลงเข็มด้านบนสุดของมดลูก (เข็มอาจแทงผ่านลำไส้มารดา) ด้านล่างสุดของมดลูก (เข็มอาจแทงผ่านกระเพาะปัสสาวะมารดา) และด้านข้างทั้งสองข้างของมดลูก (เข็มอาจแทงผ่านเส้นเลือดที่เลี้ยงมดลูก)
- วัดระยะจากตำแหน่งแอ่งน้ำคร่ำที่เลือกเจาะถึงตำแหน่งที่จะลงเข็มบนผิวหนังหน้าท้อง หากใช้เข็ม spinal needle ขนาด 22G ความยาว 3.5 นิ้ว หรือ 9 เซนติเมตร (ไม่รวม hub) ระยะที่วัดได้ไม่ควรมากกว่า 8 เซนติเมตร เนื่องจากควรเผื่อระยะไว้ในกรณีที่มดลูกหดรัดตัวทำให้ระยะจากแอ่งน้ำคร่ำที่เลือกไว้เลื่อนออกไป
- เตรียมอุปกรณ์ด้วยเทคนิคปราศจากเชื้อ และแจ้งให้สตรีตั้งครรภ์ทราบว่ากำลังจะเริ่มทำหัตถการ
- เตรียมผู้ทำหัตถการ และผู้ช่วย 1 คน โดยล้างมือให้สะอาด สวมถุงมือปราศจากเชื้อ ยืนหรือนั่งในท่าที่ถนัดคนละด้านของเตียง โดยผู้ทำหัตถการเลือกอยู่ด้านที่สามารถแทงเข็มได้ถนัด และควรมีผู้ช่วยที่ทำหน้าที่เป็น circulating nurse จัดหาอุปกรณ์ที่ต้องการได้ทันทีอีก 1 คน (ไม่จำเป็นต้องสวมถุงมือปราศจากเชื้อ)
- ทำความสะอาดหน้าท้องสตรีตั้งครรภ์ด้วยน้ำยาฆ่าเชื้อ เช่น 10% povidone iodine solution (รูปที่ 5a) ปูผ้าช่องบริเวณที่ต้องการเจาะ (รูปที่ 5b) และหล่อลื่นด้วยอัลตราซาวด์เจลปราศจากเชื้อ (รูปที่ 5c)
- หุ้มหัวตรวจอัลตราซาวด์ที่ใส่อัลตราซาวด์เจลแล้วด้วยถุงพลาสติกใสปราศจากเชื้อ ผูกหรือรัดปากถุงไว้ไม่ให้เลื่อนหลุด (รูปที่ 5d)
- ตรวจอัลตราซาวด์ซ้ำเพื่อยืนยันตำแหน่งของแอ่งน้ำคร่ำ (รูปที่ 5e) เนื่องจากทารกอาจดิ้นมาอยู่ในตำแหน่งของแอ่งน้ำคร่ำที่เลือกไว้ หากตรวจพบว่าทารกดิ้นมาก ควรรอจนกว่าทารกจะนิ่งพอที่จะทำหัตถการได้อย่างปลอดภัย
- ผู้ทำหัตถการใช้เข็ม spinal needle เจาะผ่านผนังหน้าท้อง โดยจุดที่แทงเข็มควรห่างจากหัวตรวจอัลตราซาวด์ประมาณ 1 เซนติเมตร ผ่านผนังหน้าท้อง มดลูก ถุงน้ำคร่ำ มุ่งตรงไปยังตำแหน่งของแอ่งน้ำคร่ำที่เลือกไว้ (รูปที่ 6a)
- การจับเข็มที่ถูกต้อง (รูปที่ 5f) ควรจับเข็มโดยใช้นิ้วหัวแม่มือและนิ้วกลางจับด้านข้างของ hub นิ้วชี้วางด้านบนของ stylet ซึ่งล็อคให้เข้าที่ โดยหันด้าน bevel เข้าหาด้านข้างของหัวตรวจอัลตราซาวด์
- การทำมุมของเข็มกับหน้าท้อง ควรปรับภาพอัลตราซาวด์ให้เห็นตำแหน่งของแอ่งน้ำคร่ำที่ต้องการเจาะ วัดมุมระหว่างแนวราบกับแนวจากผิวหนังที่คาดว่าจะลงเข็มจนถึงแอ่งน้ำคร่ำที่เลือกไว้ และแทงเข็มโดยทำมุมกับแนวราบตามแนวที่คาดไว้ (อ่านเพิ่มเติมในบทที่ 7 การฝึกปฏิบัติการทำหัตถการการวินิจฉัยก่อนคลอด)
- เทคนิคการแทงเข็ม
-
-
- Needle guide technique คือการใช้อุปกรณ์ที่ล็อคติดกับหัวตรวจอัลตราซาวด์สำหรับแทงเข็มผ่าน โดยภาพอัลตราซาวด์จะแสดงทิศทางของเข็มที่ผ่านตาม guide ข้อดีของการใช้วิธีนี้คือ ทิศทางในการแทงเข็มมีความแม่นยำสูง ช่วยให้เจาะได้สำเร็จในหัตถการที่ยาก เช่น น้ำคร่ำน้อย หรือสตรีตั้งครรภ์อ้วนมากๆ และมีประโยชน์ในผู้ทำหัตถการที่ยังไม่มีประสบการณ์ แต่ข้อเสียคือไม่สามารถเปลี่ยนตำแหน่งที่ต้องการเจาะได้ใน needle guide แบบดั้งเดิม แต่ในปัจจุบัน needle guide บางรุ่นสามารถถอดออกเพื่อปรับเป็น freehand technique ได้[9]
- Freehand technique คือการแทงเข็มโดยไม่ใช้อุปกรณ์ช่วย ทั้งสองมือสามารถเคลื่อนไหวได้อิสระในการเลื่อนเปลี่ยนตำแหน่งที่ต้องการเจาะ เช่นในกรณีทารกขยับตัวมาบดบังแนวการลงเข็ม หรือมดลูกหดรัดตัวทำให้แนวของเข็มเปลี่ยนไป เป็นเทคนิคที่ยากกว่าการใช้ needle guide จำเป็นต้องอาศัยการฝึกฝนเพื่อให้มือทั้งสองข้างสัมพันธ์กัน จนสามารถปรับทิศทางของเข็ม (ด้วยมือขวา) เข้าหาตำแหน่งแอ่งน้ำคร่ำที่เห็นจากภาพอัลตราซาวด์ (ด้วยมือซ้าย)
-
-
- การแทงเข็มขณะกำลังผ่านชั้น amnion เข้าสู่โพรงน้ำคร่ำ ควรแทงโดยใช้แรงและความเร็วพอเหมาะ (ต้องฝึกฝน) หากแทงช้าอาจทำให้ amnion ถูกดึงรั้งแยกออกจาก chorion ได้ (amniotic membrane tenting) และเมื่อเข็มเข้าสู่โพรงน้ำคร่ำแล้วต้องระมัดระวังไม่ให้ปลายเข็มเลื่อนไปถูกรก หรือตัวทารกที่อยู่ข้างเคียง และควรปรับภาพอัลตราซาวด์ให้เห็นแนวเข็มตลอดเวลา(รูปที่ 6b)
- ถอด stylet ออก ดูว่ามีน้ำคร่ำตามขึ้นมาอยู่ใน hub หรือไม่ ถ้ามีให้ใช้ syringe ขนาด 3 ซีซี ดูดน้ำคร่ำปริมาณ 1 – 2 ซีซี แรกทิ้งเพื่อป้องกันการปนเปื้อนเซลล์มารดา (รูปที่ 6c) หากไม่มีน้ำคร่ำตามขึ้นมาอยู่ใน hub (dry tap) ปลายเข็มอาจอยู่ใน amniochorionic space หรือปลายเข็มอาจอยู่ชิดกับสายสะดือหรือตัวทารก ให้ขยับเข็มตามภาพที่เห็นจากจออัลตราซาวด์ (ใส่ stylet และล็อคให้เข้าที่ก่อน) และทดลองดูดน้ำคร่ำอีกครั้งจนกว่าจะได้น้ำคร่ำ หากจำเป็นต้องลงเข็มบนผิวหนังหน้าท้องในตำแหน่งใหม่ ไม่ควรลงเข็มมากกว่า 2 ครั้งในการเจาะน้ำคร่ำแต่ละครั้ง หากยังเจาะไม่ได้ควรหยุดการทำหัตถการ และนัดใหม่อีก 1 สัปดาห์
- การดูดเก็บน้ำคร่ำเพื่อส่งตรวจ แนะนำให้ผู้ช่วยถือหัวตรวจอัลตราซาวด์ให้เห็นภาพเข็มอยู่ในแอ่งน้ำคร่ำตลอดเวลา (continuous ultrasound guidance) และผู้ทำหัตถการใช้มือซ้ายจับ hub ของเข็มให้มั่นคง ใช้มือขวาต่อ syringe เข้ากับ hub และเป็นผู้ดูดเก็บน้ำคร่ำเอง (รูปที่ 6d) หรือผู้ทำหัตถการใช้มือซ้ายถือหัวตรวจอัลตราซาวด์ มือขวาจับ hub ให้มั่นคง และให้ผู้ช่วยต่อ syringe เข้ากับ hub และดูดน้ำคร่ำ การเห็นภาพเข็มอยู่ในแอ่งน้ำคร่ำตลอดเวลาที่ทำหัตถการช่วยป้องกันไม่ให้ทารกถูกเข็มตำโดยไม่ตั้งใจ และช่วยให้สังเกตเห็นมดลูกหดรัดตัวซึ่งอาจทำให้เข็มถูกดึงกลับเข้าไปในกล้ามเนื้อมดลูก ลดการเจาะได้ dry tab และ bloody tab ลงได้ร้อยละ 38[10]
- ปริมาณน้ำคร่ำที่เก็บเพื่อส่งตรวจประมาณ 1 ซีซีต่ออายุครรภ์เป็นสัปดาห์ สำหรับการเจาะน้ำคร่ำเพื่อตรวจโครโมโซมที่คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ใช้ syringe ขนาด 10 ซีซี ดูดเก็บน้ำคร่ำปริมาณ 8 ซีซี จำนวน 2 หลอด
- ใส่ stylet กลับคืนให้เข้าที่ และดึงเข็มออกจากหน้าท้อง (รูปที่ 6e) เช็ดทำความสะอาดหน้าท้อง และปิดรอยเข็มด้วยพลาสเตอร์
- ผู้ช่วยติดป้ายชื่อ นามสกุล เลขโรงพยาบาลของสตรีตั้งครรภ์บน syringe ทั้ง 2 หลอด และตรวจเช็คซ้ำก่อนนำส่งห้องปฏิบัติการ (รูปที่ 6f)
- สังเกตภาวะแทรกซ้อน (immediate complications) และบันทึกไว้หลังทำหัตถการ เช่น เลือดออกจากรก (bleeding from placenta), ปวดเกร็งมดลูก (uterine cramping)
- แจ้งให้สตรีตั้งครรภ์ทราบว่าทำหัตถการเสร็จสิ้น แนะนำให้นอนพักเพื่อสังเกตภาวะแทรกซ้อนประมาณ 30 นาที หากปกติดีอนุญาตให้กลับบ้าน แนะนำให้งดการทำงานหนักและงดเพศสัมพันธ์อย่างน้อย 24 – 48 ชั่วโมง นัดมาฟังผลการตรวจโดยหากมีอาการผิดปกติให้มาพบแพทย์ก่อนนัด
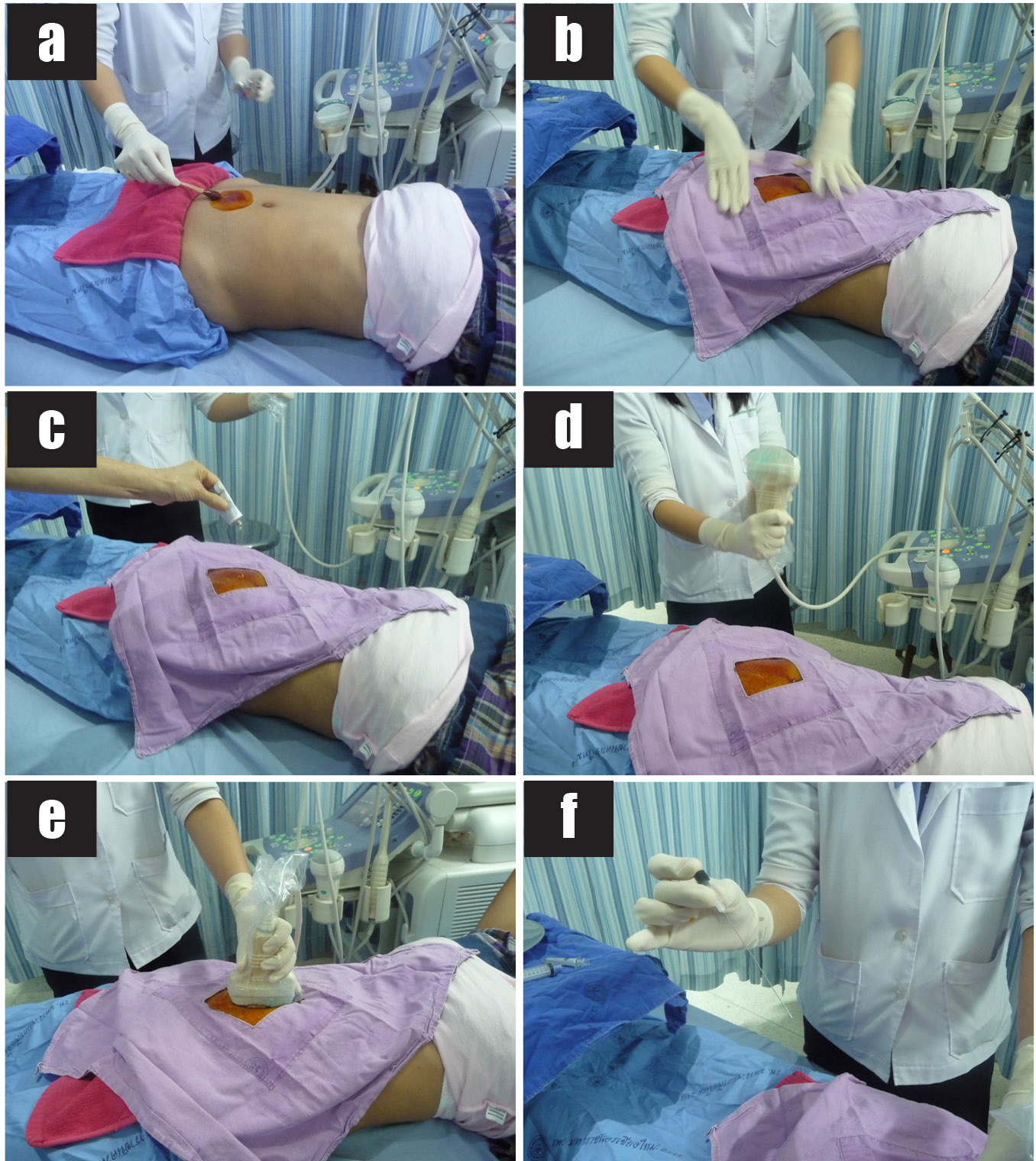
รูปที่ 5 แสดงขั้นตอนการเจาะน้ำคร่ำ
5a) ทำความสะอาดหน้าท้องบริเวณที่ต้องการเจาะด้วยน้ำยา 10% povidone iodine
5b) ปูผ้าช่อง
5c) หล่อลื่นด้วยอัลตราซาวด์เจลปราศจากเชื้อ
5d) หุ้มหัวตรวจอัลตราซาวด์ที่ใส่อัลตราซาวด์เจลแล้วด้วยถุงพลาสติกใสปราศจากเชื้อ
5e) ตรวจอัลตราซาวด์ซ้ำเพื่อยืนยันตำแหน่งของแอ่งน้ำคร่ำที่ต้องการเจาะ
5f) จับเข็ม spinal needle โดยใช้นิ้วหัวแม่มือและนิ้วกลางจับด้านข้างของ hub นิ้วชี้วางบน stylet ซึ่งล็อคเข้าที่ โดยหันด้าน bevel เข้าหาด้านข้างของหัวตรวจอัลตราซาวด์

รูปที่ 6 แสดงขั้นตอนการเจาะน้ำคร่ำ
6a) แทงเข็ม spinal needle ผ่านผนังหน้าท้องไปยังแอ่งน้ำคร่ำที่เลือกไว้
6b) ปรับภาพอัลตราซาวด์ให้เห็นแนวเข็มตลอดเวลาขณะลงเข็ม
6c) ใช้ syringe ขนาด 3 ซีซีดูดน้ำคร่ำ 1 – 2 ซีซีแรกทิ้ง
6d) ใช้ syringe ขนาด 10 ซีซีดูดเก็บน้ำคร่ำหลอดละ 8 ซีซี จำนวน 2 หลอด
6e) ใส่ stylet กลับคืนให้เข้าที่และดึงเข็มออกจากหน้าท้อง
6f) ติดป้ายชื่อนามสกุลและเลขโรงพยาบาลบน syringe ทั้ง 2 หลอด
ภาวะแทรกซ้อนจากการทำหัตถการ
- อาการปวดเกร็งมดลูก (uterine cramping): พบได้บ่อยหลังการเจาะน้ำคร่ำ มักมีอาการอยู่นานประมาณ 1 – 2 ชั่วโมง ส่วนอาการปวดถ่วงบริเวณท้องน้อย (lower abdominal discomfort) พบได้ใน 48 ชั่วโมงแรกแต่อาการจะไม่รุนแรง การดูแลรักษาอาจให้ยาแก้ปวดในบางราย
- น้ำคร่ำรั่ว (amniotic fluid leakage): ภาวะน้ำคร่ำรั่วมักเป็นชั่วคราว โดยน้ำคร่ำที่รั่วมีปริมาณเล็กน้อย สามารถหยุดเองได้ภายใน 1 สัปดาห์ และมีการสร้างน้ำคร่ำสะสมจนปริมาณกลับมาเป็นปกติเฉลี่ยภายใน 3 สัปดาห์ อัตราการเกิดภาวะน้ำคร่ำรั่วหลังการเจาะน้ำคร่ำพบร้อยละ 1.7 มากกว่าประชากรทั่วไปที่ไม่ได้ทำหัตถการที่พบเพียงร้อยละ 0.4[11, 12] หากน้ำคร่ำรั่วเป็นชั่วคราวมักไม่ส่งผลกระทบต่อการตั้งครรภ์[13]
- น้ำเดิน (premature rupture of membrane; PROM): ภาวะน้ำเดิน หรือ น้ำคร่ำรั่วเรื้อรัง พบน้อยกว่าภาวะน้ำคร่ำรั่วชั่วคราว แม้ว่าจะส่งผลกระทบต่อการตั้งครรภ์ แต่ผลลัพธ์การตั้งครรภ์ในกรณีน้ำเดินหลังการทำหัตถการจะดีกว่ากรณีน้ำเดินเอง (spontaneous PROM) หากเปรียบเทียบการเกิดเหตุการณ์ที่อายุครรภ์เท่ากัน โดยพบว่าจะคลอดที่อายุครรภ์เฉลี่ย 34.2 สัปดาห์, อัตราการรอดชีวิตของทารกร้อยละ 91[11] การดูแลรักษาอาจพิจารณารักษาแบบประคับประคองด้วยการเฝ้าติดตามปริมาณน้ำคร่ำ การเจริญเติบโตของทารก และการติดเชื้อ อย่างไรก็ตามพบว่าเพิ่มโอกาสเสี่ยงต่อภาวะ pulmonary hypoplasia, skeletal deformity และ preterm birth ได้มากขึ้น โดยเฉพาะอย่างยิ่งกรณีน้ำเดินจนเกิดภาวะ anhydramnios
- การบาดเจ็บโดยตรงต่อทารกในครรภ์ (direct fetal injury): รายงานการศึกษาจากการเจาะน้ำคร่ำในระยะเริ่มแรกพบอัตราการบาดเจ็บโดยตรงต่อทารกในครรภ์ร้อยละ 0.1 – 3.0 เช่น fetal exsanguination, intestinal atresia, skin dimples, ocular injury, porencephaly เป็นต้น ในปัจจุบันพบอุบัติการณ์น้อยมากหรือไม่พบเลยหากเจาะน้ำคร่ำโดยการใช้อัลตราซาวด์ช่วยดูทิศทางเข็มตลอดเวลาที่ทำหัตถการ[14]
- การบาดเจ็บโดยอ้อมต่อทารกในครรภ์ (indirect fetal injury): พบอัตราการเกิดภาวะ orthopedic malformations เช่น talipes equinovarus เพิ่มขึ้น 1.32 เท่า อัตราการเกิดภาวะ abnormal lung growth หรือ respiratory distress เพิ่มขึ้น 1.12 เท่า ในการเจาะน้ำคร่ำก่อนอายุครรภ์ 14 – 15 สัปดาห์[15] คาดว่าเกิดจากภาวะ fetal compression ซึ่งเป็นผลที่ตามมาจากน้ำคร่ำที่ลดปริมาณลง สามารถป้องกันได้โดยหลีกเลี่ยงการดูดน้ำคร่ำในปริมาณมากกว่าที่กำหนดในแต่ละอายุครรภ์ และหลีกเลี่ยงการเจาะน้ำคร่ำก่อนอายุครรภ์ 15 สัปดาห์ (early amniocentesis)
- การติดเชื้อ (infection): พบร้อยละ 0.1 ส่วนใหญ่เป็นการติดเชื้อของถุงน้ำคร่ำ (amnionitis) ซึ่งอาจปนเปื้อนเชื้อจากผิวหนัง หรือเชื้อจากลำไส้ (inoculation by bowel flora) ผ่านการเจาะทะลุลำไส้มารดาโดยไม่ได้ตั้งใจ (inadvertent puncture of the maternal bowel) ซึ่งนำไปสู่การสูญเสียทารกในครรภ์ได้ (creasy, 250)
- เลือดทารกเข้าสู่กระแสเลือดมารดา (fetomaternal hemorrhage): พบได้ร้อยละ 1[16] วินิจฉัยได้จากการตรวจเลือดมารดาด้วย Kleihauer-Betke test ภาวะนี้ส่งผลทำให้มารดาที่มีหมู่เลือด Rh negative สร้าง antibody มากขึ้นและเกิดภาวะ rhesus isoimmunization ตามมาได้ ควรป้องกันด้วยการให้ Rh immunoglobulin (RhIG) 300 microgram หลังทำหัตถการทันที[17]
การสูญเสียทารกจากการทำหัตถการ
รายงานการศึกษาส่วนใหญ่พบอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์อยู่ระหว่างร้อยละ 0.8 – 2.2 และจากการรวบรวม 14 รายงานการศึกษาที่มีจำนวนการเจาะน้ำคร่ำโดยการใช้ ultrasound guidance ตั้งแต่ 1000 รายขึ้นไปในแต่ละการศึกษามาวิเคราะห์พบว่า อัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์จากการเจาะน้ำคร่ำในช่วง mid-trimester ทั้งหมด 34114 รายเท่ากับร้อยละ 1.4 โดยเพิ่มขึ้นร้อยละ 0.33 จากอัตราการสูญเสียทารกร้อยละ 1.08 ในสตรีตั้งครรภ์ทั่วไปที่ไม่ได้รับการเจาะน้ำคร่ำ[14] โดยการสูญเสียทารกส่วนใหญ่เกิดภายใน 2 – 4 สัปดาห์หลังการเจาะน้ำคร่ำ
รายงานการศึกษาจากหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ เปรียบเทียบอัตราการสูญเสียทารกในครรภ์ระหว่างกลุ่มที่ได้รับการเจาะน้ำคร่ำกับกลุ่มควบคุมจำนวน 2045 คู่ (matched control) พบว่ากลุ่มที่ได้รับการเจาะน้ำคร่ำเพื่อวินิจฉัยก่อนคลอดระหว่างอายุครรภ์ 15 – 24 สัปดาห์ มีอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์ร้อยละ 1.8 (เทียบกับร้อยละ 1.4 ในกลุ่มควบคุม) และอัตราการสูญเสียทารกตลอดการตั้งครรภ์ร้อยละ 3.2 (เทียบกับร้อยละ 2.8 ในกลุ่มควบคุม) อย่างไรก็ตามอัตราการสูญเสียทารกที่เพิ่มขึ้นไม่มีนัยสำคัญทางสถิติ[18]
ปัจจัยที่มีผลต่ออัตราการสูญเสียทารกที่เพิ่มขึ้น ได้แก่
- ปัจจัยจากความผิดปกติของทารกในครรภ์ เช่น อายุมารดาที่เพิ่มขึ้น, ผลการตรวจคัดกรองด้วย serum marker ผิดปกติ, ระดับ maternal serum alpha-fetoprotein (MSAFP) ที่เพิ่มขึ้น โดยพบอัตราการสูญเสียทารกเพิ่มขึ้น 8.3 เท่าหากการเจาะน้ำคร่ำด้วยข้อบ่งชี้จากระดับ MSAFP มากกว่า 2.0 multiples of median (MoM)[13]
- ประวัติการแท้งในครรภ์ก่อน (history of abortion): ประวัติการแท้งในไตรมาสแรกมากกว่าหรือเท่ากับ 3 ครั้งขึ้นไป หรือประวัติการแท้งในไตรมาสสองมากกว่าหนึ่งครั้งขึ้นไปเพิ่มอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์ร้อยละ 3.4 เมื่อเปรียบเทียบกับกลุ่มควบคุมที่ไม่มีประวัติการแท้งมาก่อน[19]
- ประวัติการมีเลือดออกจากช่องคลอดในครรภ์ปัจจุบัน (vaginal bleeding during the current pregnancy): เพิ่มอัตราการสูญเสียทารกก่อนอายุครรภ์ 28 สัปดาห์ร้อยละ 2.1 เมื่อเปรียบเทียบกับกลุ่มควบคุมที่ไม่มีประวัติเลือดออกจากช่องคลอดมาก่อน[19]
- จำนวนการแทงเข็ม: เพิ่มอัตราการสูญเสียทารกร้อยละ 3.8 หากแทงเข็มมากกว่า 3 ครั้งขึ้นไป เมื่อเปรียบเทียบกับอัตราการสูญเสียทารกร้อยละ 1.2 หากแทงเข็มเพียงหนึ่งครั้ง[20] โดยอัตราการสูญเสียทารกไม่เพิ่มขึ้นหากนัดเจาะน้ำคร่ำใหม่ในระยะเวลาที่ห่างจากครั้งแรกพอสมควร การเห็นภาพเข็มอยู่ในแอ่งน้ำคร่ำตลอดเวลาที่ทำหัตถการ (continuous ultrasound guidance) จะช่วยลดโอกาสในการแทงเข็มหลายครั้งลงได้ร้อยละ 42[10]
- ขนาดของเข็ม spinal needle: เพิ่มอัตราการสูญเสียทารกหากใช้เข็มขนาดใหญ่กว่าหรือเท่ากับ 19G ขึ้นไป (Operative OB)
- การเจาะได้น้ำคร่ำปนเลือด (bloody amniotic fluid): พบได้ร้อยละ 1 ของการเจาะน้ำคร่ำทั้งหมด เลือดที่ตรวจพบส่วนมากเป็นเลือดมารดา และไม่มีผลต่อการเพาะเลี้ยงเซลล์ มี 2 รายงานการศึกษาพบว่าอัตราการสูญเสียทารกเพิ่มขึ้น 2.2 เท่าและ 6.5 เท่าหากพบภาวะนี้จากการเจาะน้ำคร่ำ[21, 22]
- การเจาะได้น้ำคร่ำสีเขียวหรือสีน้ำตาล (green or brown amniotic fluid discoloration): พบได้ร้อยละ 2 ของการเจาะน้ำคร่ำทั้งหมด บ่งบอกถึงการมีภาวะเลือดออกในถุงน้ำคร่ำ (intraamniotic hemorrhage) มาก่อน หากพบภาวะนี้จากการเจาะน้ำคร่ำอัตราการสูญเสียทารกจะเพิ่มขึ้น 10 เท่า เมื่อเปรียบเทียบกับกลุ่มควบคุมที่สีน้ำคร่ำปกติ[13] และเพิ่มอัตราการเพาะเลี้ยงเซลล์ไม่สำเร็จ (culture failure)[23]
- น้ำหนักของมารดา (maternal body mass index; BMI): มารดาที่มี BMI มากกว่าหรือเท่ากับ 40 kg/m2 เพิ่มอัตราการสูญเสียทารก 2.2 เท่า เมื่อเปรียบเทียบกับมารดาที่มี BMI น้อยกว่าหรือเท่ากับ 25 kg/m2[24]
ปัจจัยที่ไม่มีผลต่ออัตราการสูญเสียทารกที่เพิ่มขึ้น ได้แก่
- การเจาะผ่านรก (transplacental amniocentesis): มีอัตราการสูญเสียทารกร้อยละ 1.4 ซึ่งใกล้เคียงกับอัตราการสูญเสียทารกในประชากรทั่วไปที่ได้รับการเจาะน้ำคร่ำ อย่างไรก็ตามการเจาะน้ำคร่ำทุกครั้งควรหลีกเลี่ยงการลงเข็มผ่านรก หากหลีกเลี่ยงไม่ได้ควรเลือกลงเข็มผ่านรกส่วนที่บางที่สุด โดยลงเข็มห่างจากขอบรกและตำแหน่งที่สายสะดือเกาะ และอาจใช้ color Doppler ช่วยดูตำแหน่งเส้นเลือดขนาดใหญ่บนรก การปฏิบัติเช่นนี้เป็นกิจวัตรจะช่วยไม่ให้อัตราการสูญเสียทารกเพิ่มขึ้น[25]
- ประสบการณ์ของผู้ทำหัตถการ: ไม่สัมพันธ์กับอัตราการสูญเสียทารก แต่อาจส่งผลต่อคุณภาพของตัวอย่างน้ำคร่ำที่ส่งตรวจ[13, 26, 27]
อัตราความสำเร็จของการเจาะน้ำคร่ำ
การเจาะน้ำคร่ำส่วนใหญ่ประสบความสำเร็จในครั้งแรก รายงานการศึกษาจากสถาบันที่มีประสบการณ์พบอัตราการนัดเจาะน้ำคร่ำใหม่ (revisit) ร้อยละ 1[4] อัตราการเพาะเลี้ยงเซลล์ไม่ขึ้น (cell culture failure) พบร้อยละ 0.1 ของตัวอย่างน้ำคร่ำทั้งหมด[17]
ในรายที่เจาะน้ำคร่ำได้ยากอาจเกิดจากปัจจัยต่างๆ ได้แก่ มีเนื้องอกกล้ามเนื้อมดลูก (leiomyomas), กล้ามเนื้อมดลูกหดรัดตัว (uterine contraction), มีแผลผ่าตัดบริเวณหน้าท้อง (previous surgical scar), ผนังหน้าท้องหนา (thick abdominal wall) หรืออ้วนมาก (obesity)
ภาวะ chromosomal mosaicism
ภาวะ chromosomal mosaicism พบได้ร้อยละ 0.1 – 0.3[28] ของการเจาะน้ำคร่ำทั้งหมด ส่วนใหญ่เป็นภาวะ pseudomosaicism (พบ cell line ผิดปกติในขวดเพาะเลี้ยงเซลล์บางขวด) อาจพบได้มากถึงร้อยละ 8[29] ซึ่งไม่ได้มี cell line ที่แตกต่างกันอยู่ภายในตัวทารกในครรภ์จริงๆ ส่วนภาวะ true mosaicism พบได้ร้อยละ 0.25 ซึ่งอาจส่งผลต่อ phenotype ของทารกได้ หากตรวจพบภาวะ chromosomal mosaicism จากการเจาะน้ำคร่ำ แนะนำให้ยืนยันผลการตรวจด้วยการเจาะเลือดทารกในครรภ์ (fetal blood sampling) ซึ่งจะยังคงพบ cell line ที่ผิดปกติหากเป็น true mosaicism อย่างไรก็ตามภาวะ mosaicism ของโครโมโซมบางชนิด เช่น โครโมโซมคู่ที่ 22 อาจให้ผลการตรวจโครโมโซมปกติจากการเจาะเลือดทารกในครรภ์ แต่ทารกมี cell line ที่ผิดปกติเฉพาะในเนื้อเยื่อบางชนิด เช่น ผิวหนัง[30] ซึ่งยากที่จะตรวจวินิจฉัยก่อนคลอด จึงจำเป็นต้องปรึกษานักพันธุศาสตร์ และตรวจอัลตราซาวด์เพื่อหาความผิดปกติของทารกในครรภ์อย่างละเอียดทุกครั้ง
References
1. Old JM. Hemoglobinopathies. In: Rodeck CH, Whittle MJ, editors. Fetal Medicine: Basic Science and Clinical Practice. 2nd ed. London: Churchill Livingstone Elsevier; 2009. p. 331-343.
2. Marie HB, Michael GR. Amniotic Fluid Dynamics. In: Creasy RK, Resnik R, Iams JD, Lockwood CJ, Moore TR, editors. Creasy and Resnik’s Maternal-Fetal Medicine: Principles and Practice. 6th ed. Philadelphia: Saunders Elsevier; 2009. p. 47-54.
3. Randomised trial to assess safety and fetal outcome of early and midtrimester amniocentesis. The Canadian Early and Mid-trimester Amniocentesis Trial (CEMAT) Group. Lancet 1998;351:242-247.
4. Johnson JM, Wilson RD, Singer J, Winsor E, Harman C, Armson BA, et al. Technical factors in early amniocentesis predict adverse outcome. Results of the Canadian Early (EA) versus Mid-trimester (MA) Amniocentesis Trial. Prenat Diagn 1999;19:732-738.
5. Nicolaides K, Brizot Mde L, Patel F, Snijders R. Comparison of chorionic villus sampling and amniocentesis for fetal karyotyping at 10-13 weeks’ gestation. Lancet 1994;344:435-439.
6. ACOG practice bulletin. Prevention of Rh D alloimmunization. Number 4, May 1999 (replaces educational bulletin Number 147, October 1990). Clinical management guidelines for obstetrician-gynecologists. American College of Obstetrics and Gynecology. Int J Gynaecol Obstet 1999;66:63-70.
7. Giorlandino C, Cignini P, Cini M, Brizzi C, Carcioppolo O, Milite V, et al. Antibiotic prophylaxis before second-trimester genetic amniocentesis (APGA): a single-centre open randomised controlled trial. Prenat Diagn 2009;29:606-612.
8. Gramellini D, Fieni S, Casilla G, Raboni S, Nardelli GB. Mid-trimester amniocentesis and antibiotic prophylaxis. Prenat Diagn 2007;27:956-959.
9. Sonek J, Nicolaides K, Sadowsky G, Foley M, O’Shaughnessy R. Articulated needle guide: report on the first 30 cases. Obstet Gynecol 1989;74:821-823.
10. Romero R, Jeanty P, Reece EA, Grannum P, Bracken M, Berkowitz R, et al. Sonographically monitored amniocentesis to decrease intraoperative complications. Obstet Gynecol 1985;65:426-430.
11. Borgida AF, Mills AA, Feldman DM, Rodis JF, Egan JF. Outcome of pregnancies complicated by ruptured membranes after genetic amniocentesis. Am J Obstet Gynecol 2000;183:937-939.
12. Gold RB, Goyert GL, Schwartz DB, Evans MI, Seabolt LA. Conservative management of second-trimester post-amniocentesis fluid leakage. Obstet Gynecol 1989;74:745-747.
13. Tabor A, Philip J, Madsen M, Bang J, Obel EB, Norgaard-Pedersen B. Randomised controlled trial of genetic amniocentesis in 4606 low-risk women. Lancet 1986;1:1287-1293.
14. Seeds JW. Diagnostic mid trimester amniocentesis: how safe? Am J Obstet Gynecol 2004;191:607-615.
15. Cederholm M, Haglund B, Axelsson O. Infant morbidity following amniocentesis and chorionic villus sampling for prenatal karyotyping. BJOG 2005;112:394-402.
16. Hill LM, Platt LD, Kellogg B. Rh sensitization after genetic amniocentesis. Obstet Gynecol 1980;56:459-461.
17. ACOG Practice Bulletin No. 88, December 2007. Invasive prenatal testing for aneuploidy. Obstet Gynecol 2007;110:1459-1467.
18. Tongsong T, Wanapirak C, Sirivatanapa P, Piyamongkol W, Sirichotiyakul S, Yampochai A. Amniocentesis-related fetal loss: a cohort study. Obstet Gynecol 1998;92:64-67.
19. Antsaklis A, Papantoniou N, Xygakis A, Mesogitis S, Tzortzis E, Michalas S. Genetic amniocentesis in women 20-34 years old: associated risks. Prenat Diagn 2000;20:247-250.
20. Marthin T, Liedgren S, Hammar M. Transplacental needle passage and other risk-factors associated with second trimester amniocentesis. Acta Obstet Gynecol Scand 1997;76:728-732.
21. Kappel B, Nielsen J, Brogaard Hansen K, Mikkelsen M, Therkelsen AJ. Spontaneous abortion following mid-trimester amniocentesis. Clinical significance of placental perforation and blood-stained amniotic fluid. Br J Obstet Gynaecol 1987;94:50-54.
22. Kong CW, Leung TN, Leung TY, Chan LW, Sahota DS, Fung TY, et al. Risk factors for procedure-related fetal losses after mid-trimester genetic amniocentesis. Prenat Diagn 2006;26:925-930.
23. Golbus MS, Loughman WD, Epstein CJ, Halbasch G, Stephens JD, Hall BD. Prenatal genetic diagnosis in 3000 amniocenteses. N Engl J Med 1979;300:157-163.
24. Harper LM, Cahill AG, Smith K, Macones GA, Odibo AO. Effect of maternal obesity on the risk of fetal loss after amniocentesis and chorionic villus sampling. Obstet Gynecol;119:745-751.
25. Bombard AT, Powers JF, Carter S, Schwartz A, Nitowsky HM. Procedure-related fetal losses in transplacental versus nontransplacental genetic amniocentesis. Am J Obstet Gynecol 1995;172:868-872.
26. Hockstein S, Chen PX, Thangavelu M, Pergament E. Factors associated with maternal cell contamination in amniocentesis samples as evaluated by fluorescent in situ hybridization. Obstet Gynecol 1998;92:551-556.
27. Welch RA, Salem-Elgharib S, Wiktor AE, Van Dyke DL, Blessed WB. Operator experience and sample quality in genetic amniocentesis. Am J Obstet Gynecol 2006;194:189-191.
28. Hsu LY, Perlis TE. United States survey on chromosome mosaicism and pseudomosaicism in prenatal diagnosis. Prenat Diagn 1984;4 Spec No:97-130.
29. Hsu LY, Kaffe S, Jenkins EC, Alonso L, Benn PA, David K, et al. Proposed guidelines for diagnosis of chromosome mosaicism in amniocytes based on data derived from chromosome mosaicism and pseudomosaicism studies. Prenat Diagn 1992;12:555-573.
30. Berghella V, Wapner RJ, Yang-Feng T, Mahoney MJ. Prenatal confirmation of true fetal trisomy 22 mosaicism by fetal skin biopsy following normal fetal blood sampling. Prenat Diagn 1998;18:384-389.

