การเจาะชิ้นเนื้อรก : Chorionic villus sampling (CVS)
การเจาะชิ้นเนื้อรก หมายถึง การดูดเก็บชิ้นเนื้อรกโดยใช้เข็มเจาะผ่านทางหน้าท้องมารดา (transabdominal CVS) และ การดูดเก็บหรือคีบตัดชิ้นเนื้อรกโดยใช้อุปกรณ์สอดผ่านทางปากมดลูก (transcervical CVS) โดยชิ้นเนื้อรก (placental villi) ที่ได้สามารถนำมาตรวจวินิจฉัยโรคของทารกในครรภ์ได้ เนื่องจากมีส่วนประกอบของเซลล์ทารก
ส่วนประกอบของชิ้นเนื้อรก[1]
ชิ้นเนื้อรกแบ่งออกเป็น 2 ส่วน ได้แก่
- Superficial layer of trophoblast: ประกอบด้วยเซลล์ cytotrophoblasts และเซลล์ syncytotrophoblasts
- Villous core: ประกอบด้วย stroma และเส้นเลือดที่มาจากทารก (fetally derived blood vessels)
เซลล์จากชิ้นเนื้อรกเป็นเซลล์ที่มาจากการแบ่งตัวเพื่อสร้างทารก ส่วนของรกและถุงน้ำคร่ำในระยะแรกๆ ของกระบวนการ embryogenesis ทำให้เซลล์จากชิ้นเนื้อรกอาจมีโครโมโซมที่แตกต่างจากตัวทารกได้ (confined placental mosaicism; CPM) โดยเซลล์ที่อยู่ในชั้น mesenchymal core หรือ villous core จะมี cell line ที่เป็นต้นกำเนิดในการพัฒนาไปเป็นทารกมากกว่าเซลล์ที่อยู่ในชั้น superficial cytotrophoblast layer
ข้อบ่งชี้ในการทำหัตถการ
การเจาะชิ้นเนื้อรกทำเพื่อวินิจฉัยโรคทารกในครรภ์โดยมีข้อบ่งชี้หลัก 2 ข้อ ได้แก่
- Fetal karyotyping: การตรวจโครโมโซมจากชิ้นเนื้อรกด้วยวิธีการเพาะเลี้ยงเซลล์ (cell culture) มี 2 เทคนิค ได้แก่ การเพาะเลี้ยงเซลล์แบบ short-term culture หรือ direct preparation จะวิเคราะห์เซลล์ cytotrophoblasts ซึ่งเป็นเซลล์ที่มี mitosis จึงแบ่งตัวเร็ว และการเพาะเลี้ยงเซลล์แบบ long-term culture จะวิเคราะห์เซลล์ villous stroma ซึ่งจะมีการแบ่งตัวช้ากว่า แต่เป็นเซลล์ที่มาจากทารกมากกว่า
- DNA analysis for single gene defects: ชิ้นเนื้อรกสามารถนำมาสกัดให้ได้ fetal DNA เพื่อวิเคราะห์ความผิดปกติของทารกในครรภ์ เช่น α-Thalassemia, β-Thalassemia, Hemophilia A, Duchenne muscular dystrophy, congenital adrenal hyperplasia (CAH), cystic fibrosis, Fragile X syndrome เป็นต้น โดยจะได้ fetal DNA เฉลี่ยประมาณ 35 ไมโครกรัมจากการเจาะชิ้นเนื้อรกในไตรมาสแรก[2] มากกว่าปริมาณ fetal DNA ที่ได้จากการเจาะน้ำคร่ำ แต่การเจาะชิ้นเนื้อรกมีโอกาสปนเปื้อนเซลล์มารดา (maternal cell contamination) ได้มากกว่าการเจาะน้ำคร่ำ ดังนั้นการนำชิ้นเนื้อรกมาตรวจจึงต้องระมัดระวังในการแยก maternal decidua ออกไปให้หมดก่อนการนำไปใช้ตรวจวินิจฉัย
จากสถิติการตรวจวินิจฉัยก่อนคลอดในปีพ.ศ. 2555 ของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบการเจาะชิ้นเนื้อรกจำนวน 96 ราย โดยมีข้อบ่งชี้เพื่อการวินิจฉัยโรคธาลัสซีเมียชนิดรุนแรง (ร้อยละ 75), เพื่อการวินิจฉัยภาวะโครโมโซมผิดปกติของทารกในครรภ์ (ร้อยละ 10.4) และมีข้อบ่งชี้ทั้งสองข้อร่วมกัน (ร้อยละ 14.6) โดยร้อยละ 92.5 เป็นการทำหัตถการ transabdominal CVS และร้อยละ 7.5 เป็นการทำหัตถการ transcervical CVS
อายุครรภ์ที่เหมาะสมในการทำหัตถการ
การเจาะชิ้นเนื้อรกเพื่อการวินิจฉัยก่อนคลอดมักทำตั้งแต่อายุครรภ์ 10 สัปดาห์ เป็นต้นไป โดยการทำหัตถการ transabdominal CVS สามารถทำได้ตลอดการตั้งครรภ์ และเป็นทางเลือกที่ดีในการเก็บตัวอย่างเซลล์ทารกในครรภ์หากหัตถการอื่นทำได้ยาก เช่น ภาวะน้ำคร่ำน้อย (oligohydramnios) ทำให้ไม่สามารถเจาะน้ำคร่ำหรือเจาะเลือดสายสะดือทารกในครรภ์ได้อย่างปลอดภัย แต่การทำหัตถการ transcervical CVS อายุครรภ์ที่เหมาะสมอยู่ระหว่าง 10 – 14 สัปดาห์ แม้ว่าจะมีรายงานการเจาะชิ้นเนื้อรกก่อนอายุครรภ์ 10 สัปดาห์ แต่พบว่าเพิ่มความเสี่ยงต่อการเกิดภาวะ limb reduction defects และภาวะ oromandibular hypogenesis ในทารก สาเหตุเกิดจากการบาดเจ็บต่อรกในระยะ embryonic stage ซึ่งส่งผลกระทบต่อการเจริญเติบโตของเส้นเลือดแดงส่วนปลาย (terminal arteries)[3]
ภาวะ limb reduction defects พบ 5 – 6 รายใน 10000 รายของการคลอดมีชีพ[4, 5] การเจาะชิ้นเนื้อรกในทารกอายุครรภ์ 56 – 66 วัน[6] พบรายงานอุบัติการณ์การเกิดภาวะนี้เพิ่มมากขึ้น โดยอุบัติการณ์และความรุนแรงสัมพันธ์กับอายุครรภ์ที่เจาะชิ้นเนื้อรก โดยจากรายงานการเจาะชิ้นเนื้อรกที่อายุครรภ์ 8, 9, 10, 11 และมากกว่า 12 สัปดาห์ขึ้นไปจะพบการเกิดภาวะ limb reduction defects จำนวน 11.7, 4.9, 3.8, 3.4 และ 2.3 รายต่อ 10000 รายตามลำดับ[4] รายงานการศึกษาใหญ่แบบ case control พบว่าการเจาะชิ้นเนื้อรกที่อายุครรภ์น้อยกว่า 10 สัปดาห์มีอัตราการเกิดภาวะ limb reduction defects ร้อยละ 0.2 หรือ 6 เท่ามากกว่าประชากรทั่วไป แต่การเจาะชิ้นเนื้อรกที่อายุครรภ์มากกว่าหรือเท่ากับ 10 สัปดาห์มีอัตราการเกิดภาวะนี้เพียงร้อยละ 0.07 และความผิดปกติส่วนมากไม่รุนแรง[7] ดังนั้นการเจาะชิ้นเนื้อรกตั้งแต่อายุครรภ์ 10 สัปดาห์เป็นต้นไปจึงเป็นที่ยอมรับได้ในทางปฏิบัติ
ภาวะ oromandibular hypoplasia พบ 1 รายใน 175000 รายของการคลอดมีชีพ การเจาะชิ้นเนื้อรกก่อนอายุครรภ์ 10 สัปดาห์ที่ทำให้เกิดภาวะ limb reduction defects อาจพบภาวะ oromandibular hypoplasia ร่วมด้วย เรียกว่า oromandibular-limb hypogenesis syndrome[8]
การเตรียมสตรีตั้งครรภ์ก่อนการทำหัตถการ
- ตรวจสอบข้อบ่งชี้ในการทำหัตถการ: สตรีตั้งครรภ์บางรายอาจมีข้อบ่งชี้มากกว่าหนึ่งอย่าง เช่น สตรีตั้งครรภ์อายุมากเสี่ยงต่อภาวะโครโมโซมผิดปกติของทารกในครรภ์และเป็นคู่เสี่ยงต่อการตั้งครรภ์ทารกเป็นโรคธาลัสซีเมียชนิดรุนแรง
- เลือกช่องทางการทำหัตถการ: การเจาะชิ้นเนื้อรกทำได้สองช่องทาง ได้แก่ การดูดเก็บชิ้นเนื้อรกโดยใช้เข็มเจาะผ่านทางหน้าท้องมารดา (transabdominal CVS; TA-CVS) หรือการดูดเก็บหรือคีบตัดชิ้นเนื้อรกโดยใช้อุปกรณ์สอดผ่านทางปากมดลูก (transcervical CVS; TC-CVS) แม้ว่าในการเจาะชิ้นเนื้อรกส่วนใหญ่สามารถทำหัตถการผ่านช่องทางใดก็ได้ โดยการเลือกช่องทางการทำหัตถการขึ้นอยู่กับสตรีตั้งครรภ์และผู้ทำหัตถการ (ความถนัดและประสบการณ์) อย่างไรก็ตามร้อยละ 3 – 5 ของการเจาะชิ้นเนื้อรกจำเป็นต้องทำหัตถการผ่านทางช่องทางใดช่องทางหนึ่งเท่านั้น[9] ดังนั้นผู้ทำหัตถการจึงต้องมีความสามารถในการทำหัตถการได้ทั้งสองช่องทาง ข้อเปรียบเทียบของการทำหัตถการ transabdominal CVS และ transcervical CVS แสดงดังตารางที่ 1
| ตารางที่ 1 ความแตกต่างระหว่างการทำหัตถการ transabdominal CVS (TA-CVS) และการทำหัตถการ transcervical CVS (TC-CVS) | ||
| ข้อเปรียบเทียบ | TA-CVS | TC-CVS |
ตำแหน่งรก
|
ทำได้ยาก
ทำได้ง่าย |
ทำได้ง่าย
ทำได้ยาก |
| ปริมาณชิ้นเนื้อรกที่ได้[10] | ได้ปริมาณน้อยกว่า | ได้ปริมาณมากกว่า |
| การปนเปื้อนเซลล์มารดา[11] | ปนเปื้อนมากกว่า | ปนเปื้อนน้อยกว่า |
ภาวะแทรกซ้อน
|
น้อยกว่า
มากกว่า น้อยกว่า |
มากกว่า
น้อยกว่า มากกว่า |
| อัตราการสูญเสียทารกในครรภ์[15] | น้อยกว่า | มากกว่า |
- ตรวจสอบข้อห้ามในการทำหัตถการ: เช่น การติดเชื้อเอชไอวี (human immunocompromised virus; HIV infection), ภาวะแท้งคุกคาม (threatened abortion), ภาวะเลือดออกผิดปกติทางช่องคลอดที่ยังไม่ทราบสาเหตุ, มีห่วงคุมกำเนิดค้างในมดลูก (presence of an intrauterine device), ภาวะเกล็ดเลือดต่ำ หรือการแข็งตัวของเลือดผิดปกติ, มีภาวะ Rh-negative ที่ถูกกระตุ้นแล้ว (preexisting Rh sensitization) เป็นต้น นอกจากนี้ยังมีข้อห้ามจำเพาะที่แตกต่างกันระหว่างการทำหัตถการ transabdominal CVS และการทำหัตถการ transcervical CVS ดังนี้
- ข้อห้ามในการทำหัตถการ transabdominal CVS
- มดลูกคว่ำหลังมาก (severe retroflexion of the uterus) ทำให้ลำไส้ของมารดาเคลื่อนตัวมาอยู่ระหว่างผนังหน้าท้องและมดลูก
- ตำแหน่งรกอยู่ด้านหลังมาก (posterior placenta) โดยเฉพาะอย่างยิ่งอยู่ค่อนไปทางด้านล่างของมดลูก ทำให้เข้าถึงรกได้ยาก
- ข้อห้ามในการทำหัตถการ transcervical CVS
- ภาวะช่องคลอดเกร็งตัวมากผิดปกติ (vaginismus)
- ภาวะปากมดลูกตีบ (cervical stenosis)
- ก้อนเนื้องอกที่ปากมดลูก (cervical myoma) หรือก้อนเนื้องอกที่ตัวมดลูกด้านล่าง (lower uterine segment myoma) ที่ทำให้เข้าถึงรกได้ยาก
- ปากมดลูกอักเสบติดเชื้อ (cervical infection) หรือ ช่องคลอดอักเสบติดเชื้อ (vaginal infection) หรือมีแผลบริเวณปากช่องคลอด (genital ulcer) โดยเฉพาะอย่างยิ่ง herpes infection
- มดลูกคว่ำหน้าหรือคว่ำหลังมาก (severe anteflexion or retroflexion of the uterus) ทำให้เข้าถึงรกได้ยาก
- การให้ข้อมูลแก่สตรีตั้งครรภ์ คู่สมรส และญาติ: อธิบายถึงความจำเป็นในการทำหัตถการ ภาวะแทรกซ้อน ความเสี่ยงต่อการสูญเสียทารกในครรภ์ ขั้นตอนในการทำหัตถการ การปฏิบัติตัวหลังการทำหัตถการ วิธีการและระยะเวลาในการแจ้งผลการตรวจ เปิดโอกาสให้สตรีตั้งครรภ์ซักถาม ให้เวลาตัดสินใจในการเลือกทำหรือไม่ทำหัตถการโดยไม่บังคับ และให้เซ็นต์ใบยินยอมการทำหัตถการ (informed consent form)
- การให้ anti-D immunoglobulin: สตรีตั้งครรภ์ที่มีผลตรวจหมู่เลือด Rh (D) เป็นลบ (Rh negative) ที่ยังไม่ถูกกระตุ้น และสามีมีผลตรวจหมู่เลือด Rh เป็นบวก (Rh positive) หรือไม่ทราบผลตรวจหมู่เลือดของสามี ควรได้รับ anti-D immunoglobulin เช่น RhoGAM 50 – 300 microgram หลังการทำหัตถการเพื่อป้องกันการเกิดภาวะ rhesus isoimmunization[16]
- การให้ยาปฏิชีวนะ (antibiotic): ไม่จำเป็นต้องให้ยาปฏิชีวนะก่อนการทำหัตถการ เนื่องจากอัตราการเกิดถุงน้ำคร่ำอักเสบติดเชื้อ (chorioamnionitis) หลังการทำหัตถการค่อนข้างน้อย (น้อยกว่าร้อยละ 0.5) แม้ในรายที่ทำหัตถการผ่านทางปากมดลูก[14]
- การให้ยาชาและยาระงับปวด (anesthesia and analgesic drugs): ในการเจาะชิ้นเนื้อรกผ่านทางหน้าท้อง จำเป็นต้องใช้ยาชาเฉพาะที่เช่น 1% lidocaine hydrochloride ฉีดบริเวณผิวหนังหน้าท้องตำแหน่งที่ต้องการเจาะ แต่หากเจาะชิ้นเนื้อรกผ่านทางปากมดลูกไม่จำเป็นต้องให้ยานอนหลับ ยากล่อมประสาท หรือยาระงับปวดก่อนหรือหลังการทำหัตถการในสตรีตั้งครรภ์ทุกราย เนื่องจากสตรีตั้งครรภ์ส่วนใหญ่มักทนอาการปวดได้หากหัตถการใช้เวลาไม่นาน แต่อาจพิจารณาให้ยาระงับปวดหลังการทำหัตถการที่ใช้เวลานาน หรือมีอาการปวดมดลูก
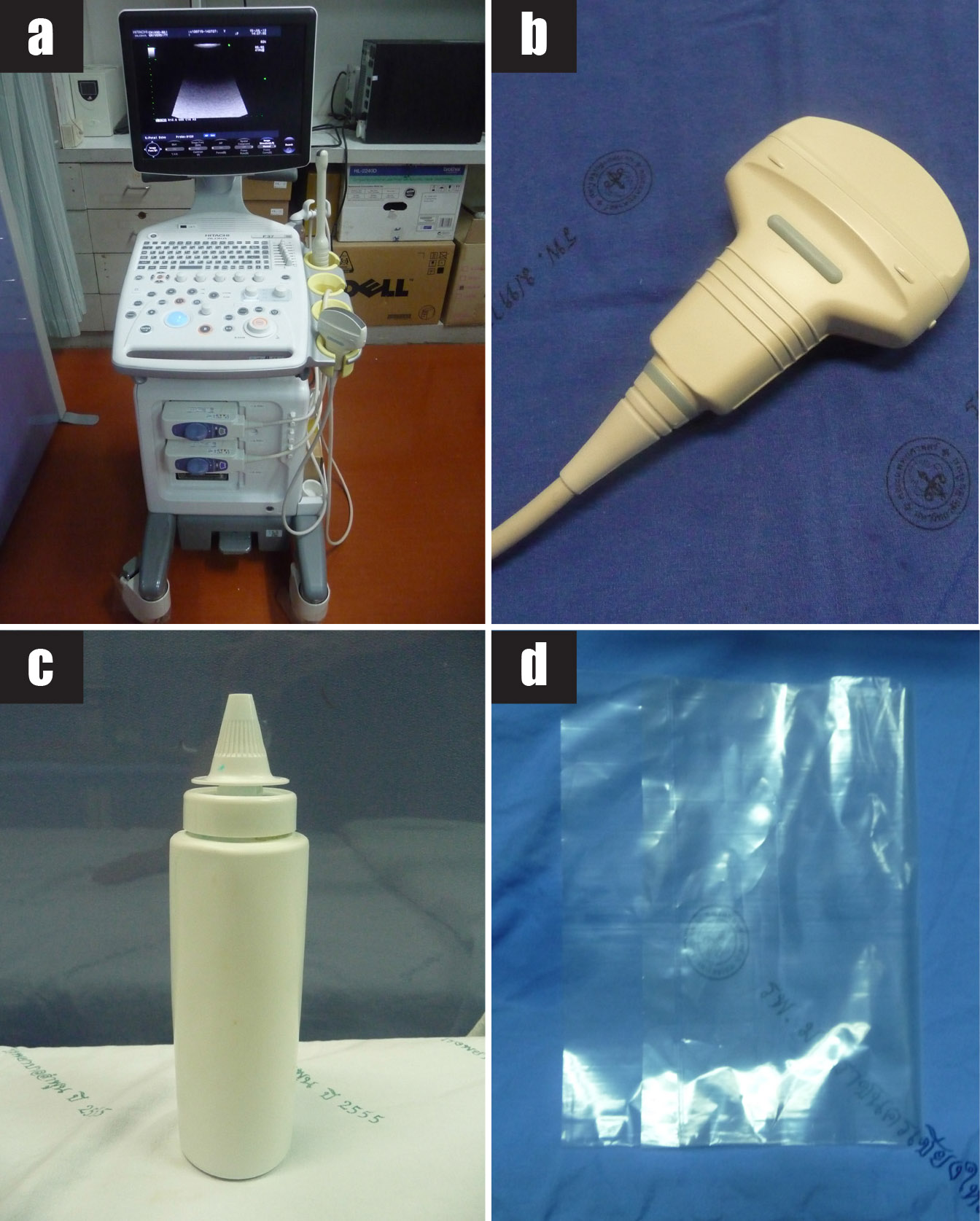
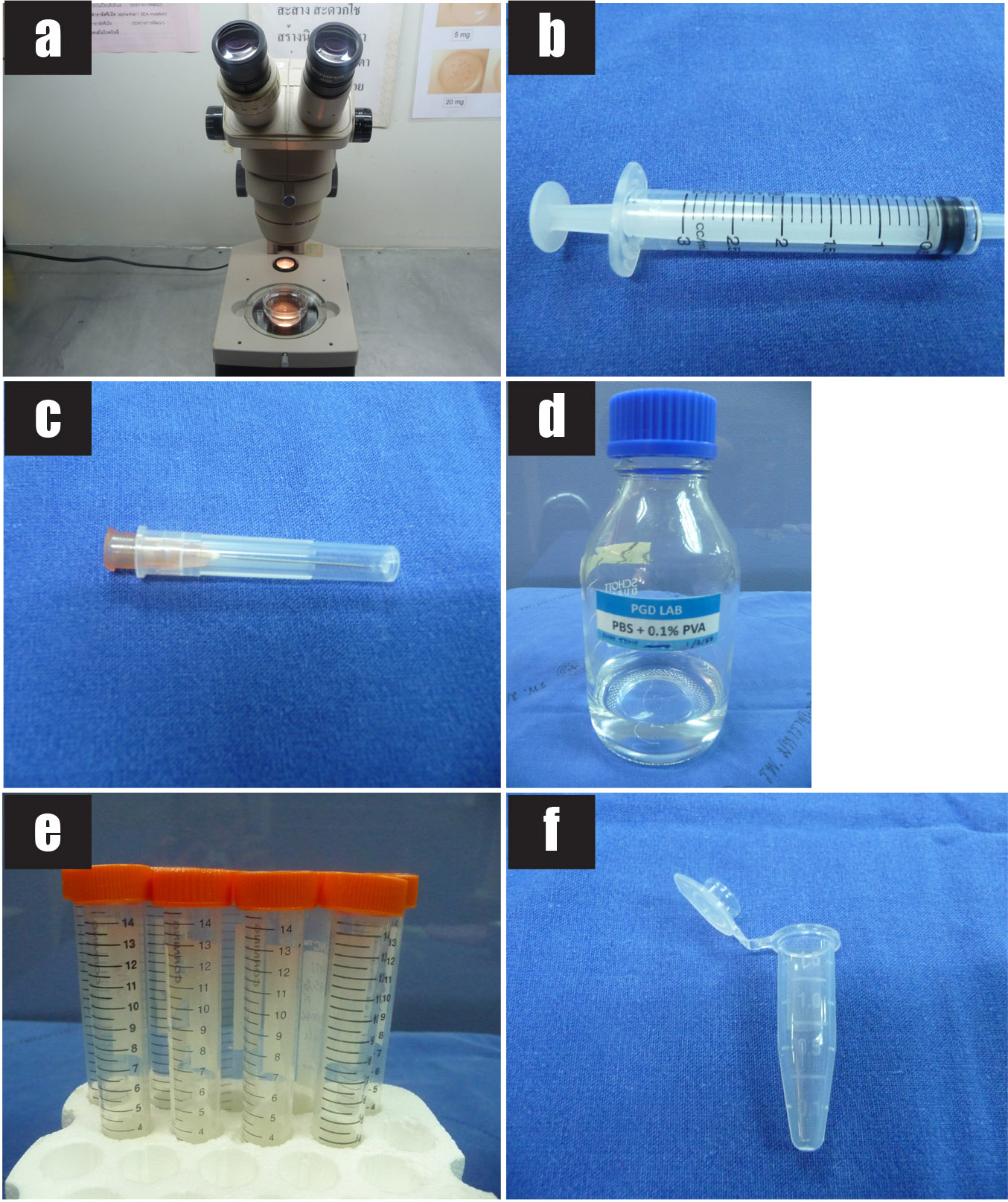
รูปที่ 1 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transabdominal CVS
1a) เครื่องตรวจอัลตราซาวด์
1b) หัวตรวจอัลตราซาวด์ชนิด convex ความถี่ 3.5 MHz
1c) อัลตราซาวด์เจล
1d) ถุงพลาสติกใสปราศจากเชื้อ
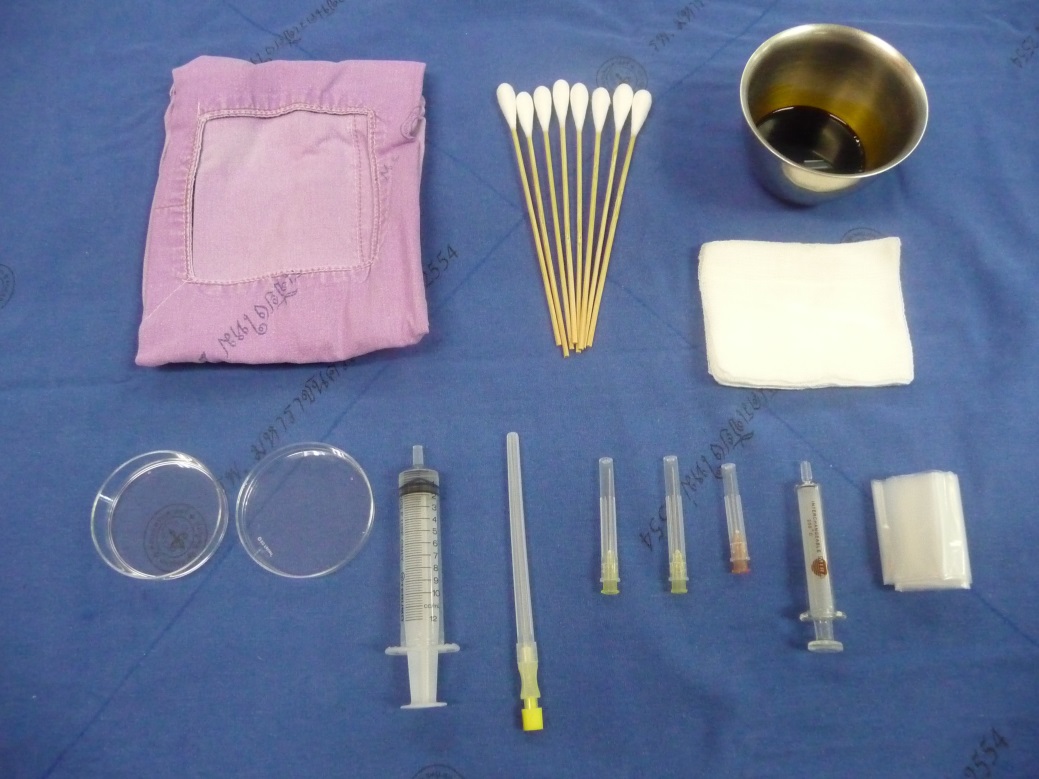
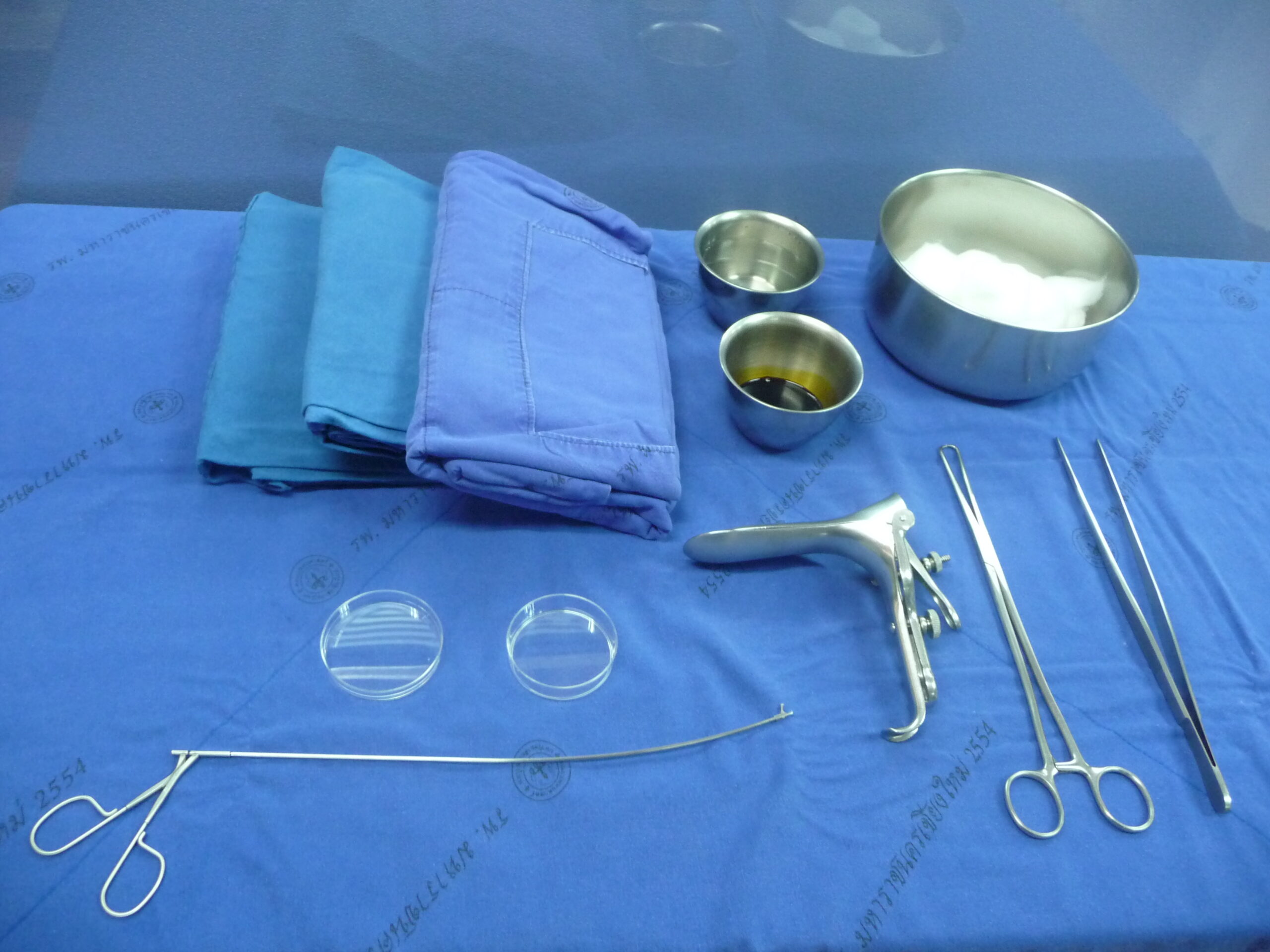
รูปที่ 2 แสดงชุดอุปกรณ์เจาะที่ใช้ในการทำหัตถการ transabdominal CVS
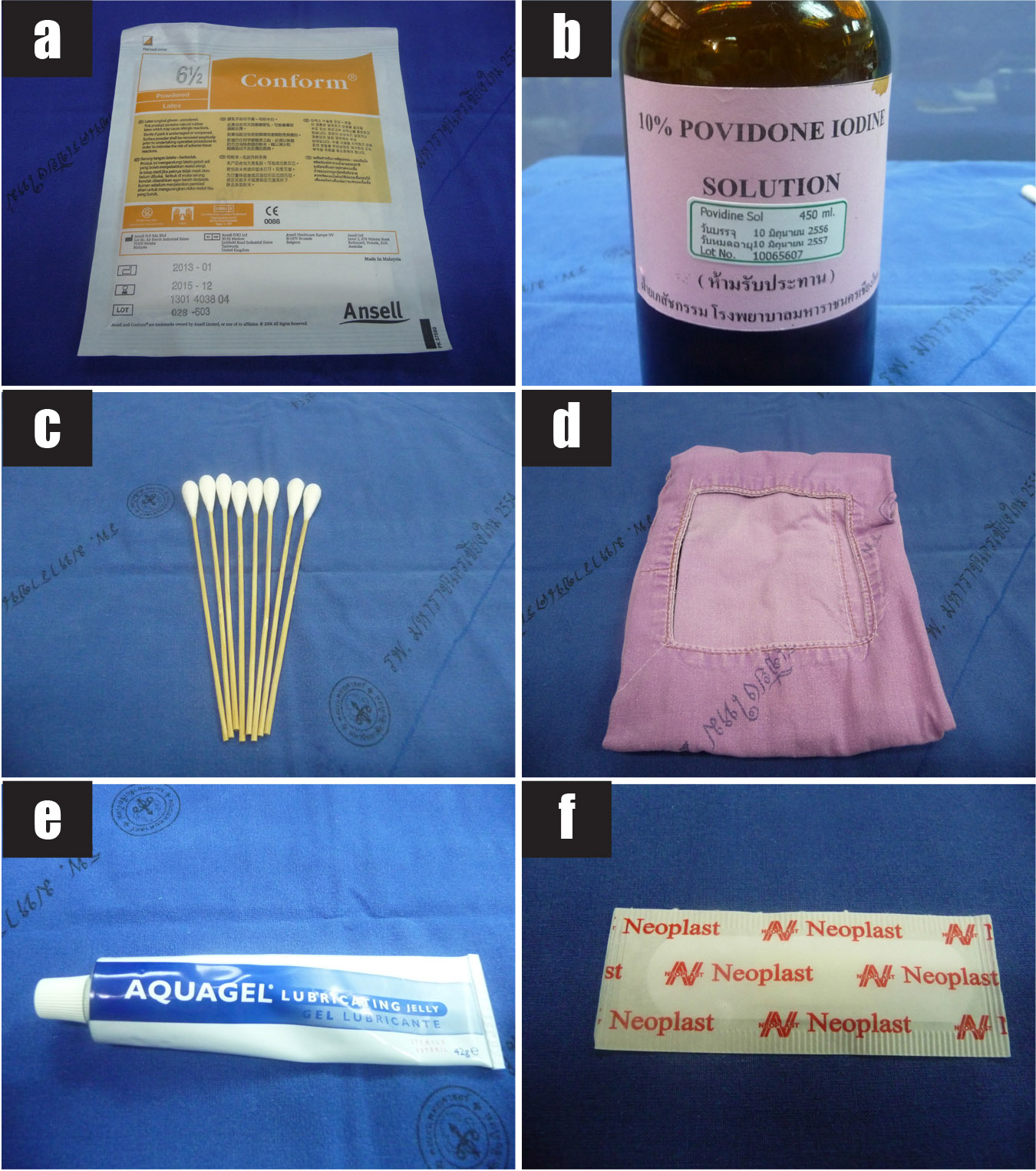
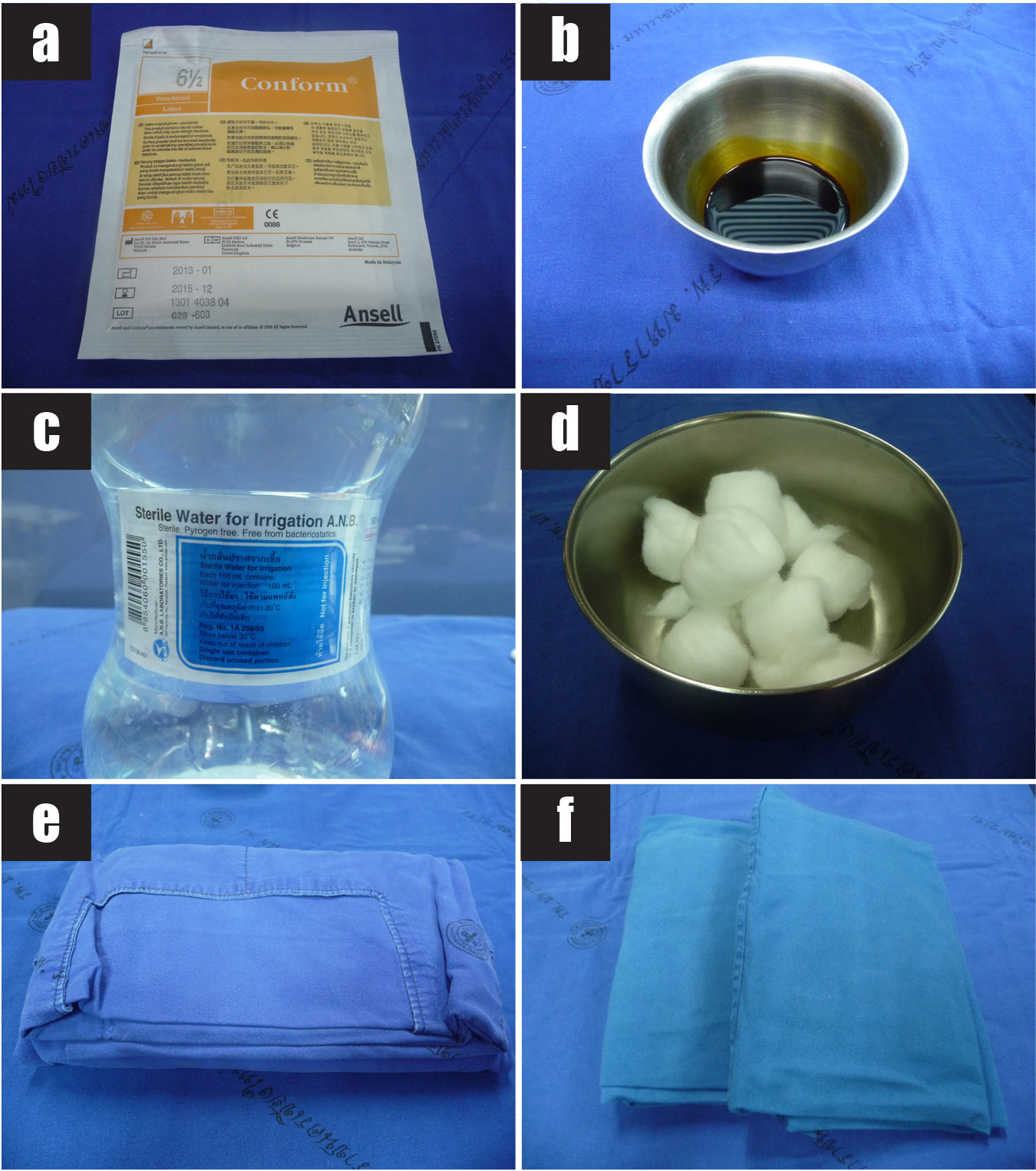
รูปที่ 3 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transabdominal CVS
3a) ถุงมือปราศจากเชื้อ
3b) 10% povidone iodine solution
3c) ไม้พันสำลีสำหรับทำความสะอาดหน้าท้อง
3d) ผ้าช่อง
3e) อัลตราซาวด์เจลปราศจากเชื้อ
3f) พลาสเตอร์ปิดแผล
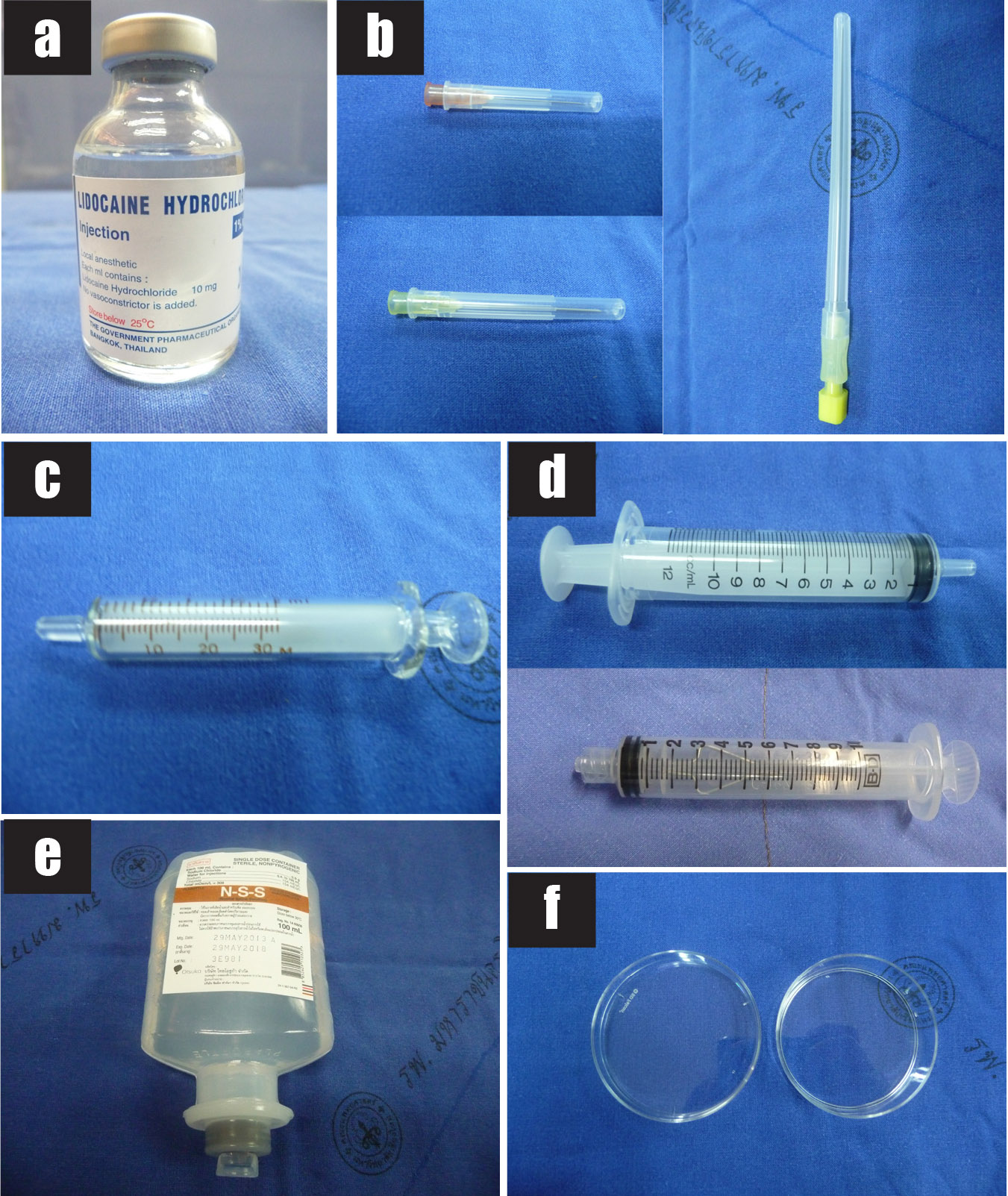
รูปที่ 4 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transabdominal CVS
4a) 1% lidocaine hydrochloride
4b) เข็มฉีดยาขนาด 25G เข็มฉีดยาขนาด 20G และ เข็ม spinal needle ขนาด 20G
4c) Syringe ขนาด 3 ซีซี (สำหรับฉีดยาชา)
4d) Syringe ขนาด 10 ซีซี และ syringe with lock ขนาด 10 ซีซี
4e) Normal saline solution
4f) จาน petri dish ปราศจากเชื้อ
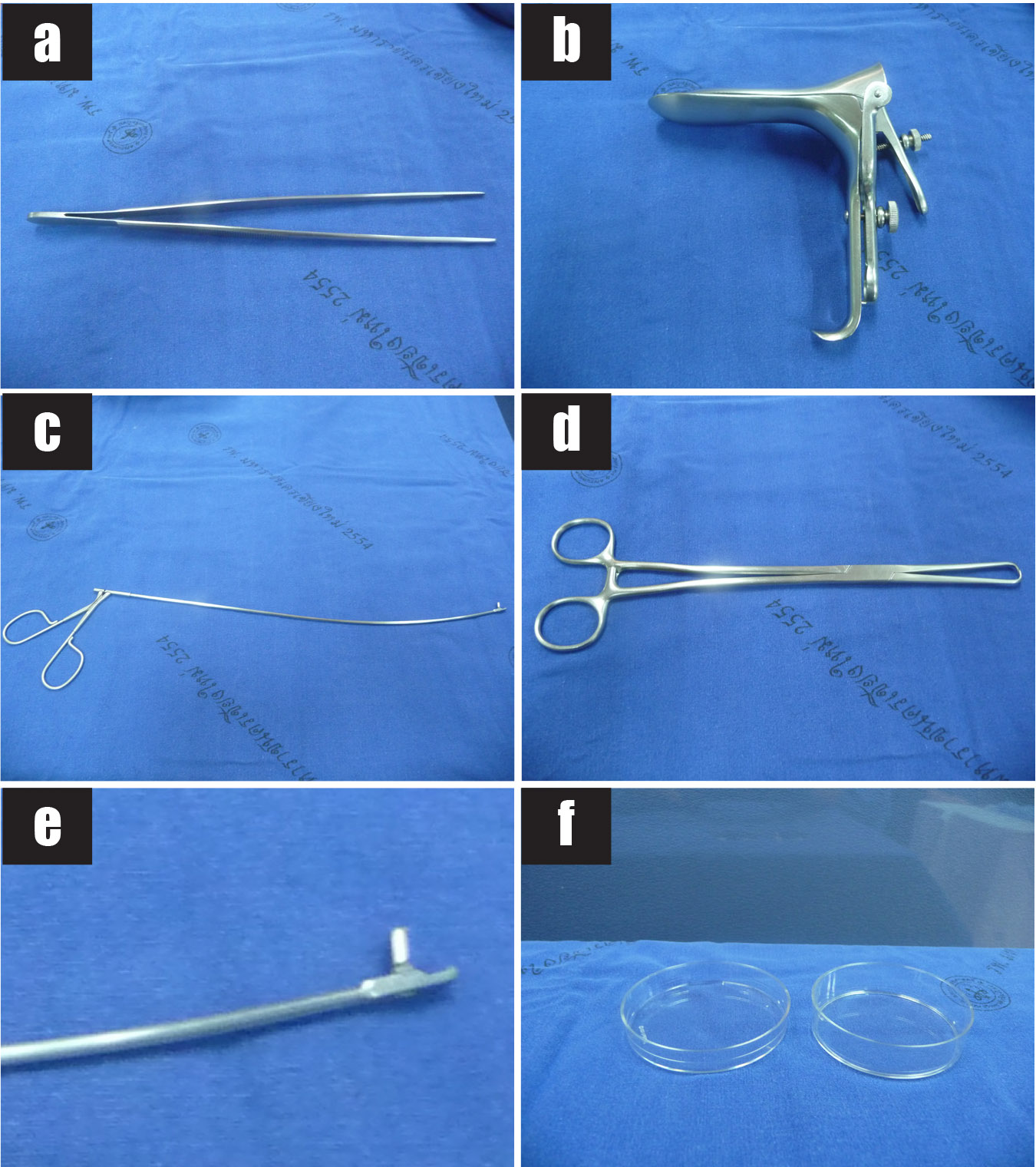
รูปที่ 5 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transabdominal CVS
5a) กล้องจุลทรรศน์
5b) Syringe ขนาด 3 ซีซี
5c) เข็มฉีดยาขนาด 25G
5d) Tissue culture medium
5e) Centrifuge tube
5f) Microcentrifuge tube
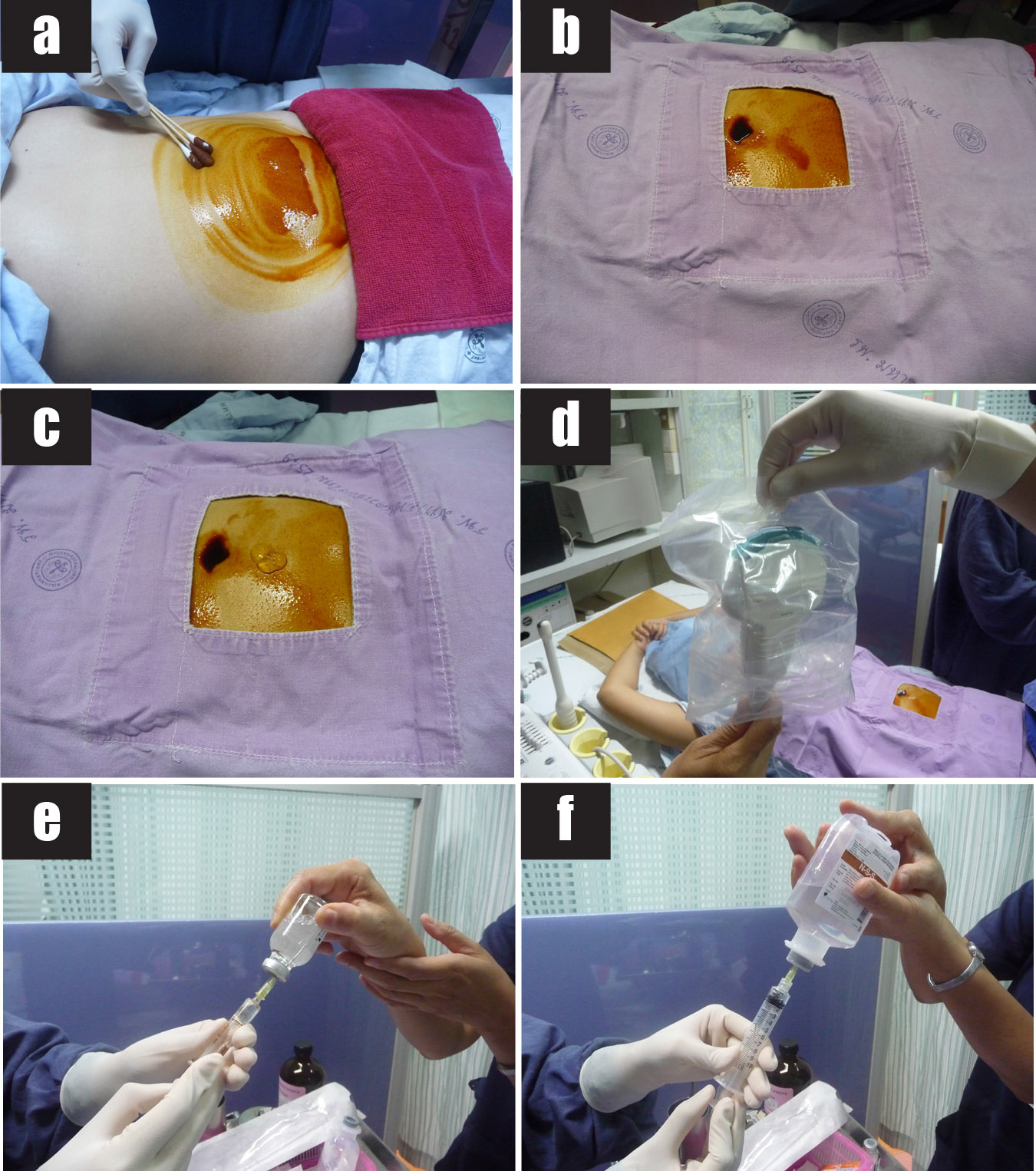
รูปที่ 6 แสดงขั้นตอนการทำหัตถการ transabdominal CVS
6a) ทำความสะอาดหน้าท้องบริเวณที่ต้องการเจาะด้วยน้ำยา 10% povidone iodine
6b) ปูผ้าช่อง
6c) หล่อลื่นด้วยอัลตราซาวด์เจลปราศจากเชื้อ
6d) หุ้มหัวตรวจอัลตราซาวด์ที่ใส่อัลตราซาวด์เจลแล้วด้วยถุงพลาสติกใสปราศจากเชื้อ
6e) เตรียมยาชา 1% lodocaine hydrochloride ปริมาณ 2 – 3 ซีซี
6f) เตรียม syringe ขนาด 10 ซีซีที่มีน้ำยาเพาะเลี้ยงเซลล์ (ในรูปใช้ syringe with lock ขนาด 10 ซีซีที่มีน้ำเกลือ) ปริมาณ 1 – 2 ซีซี
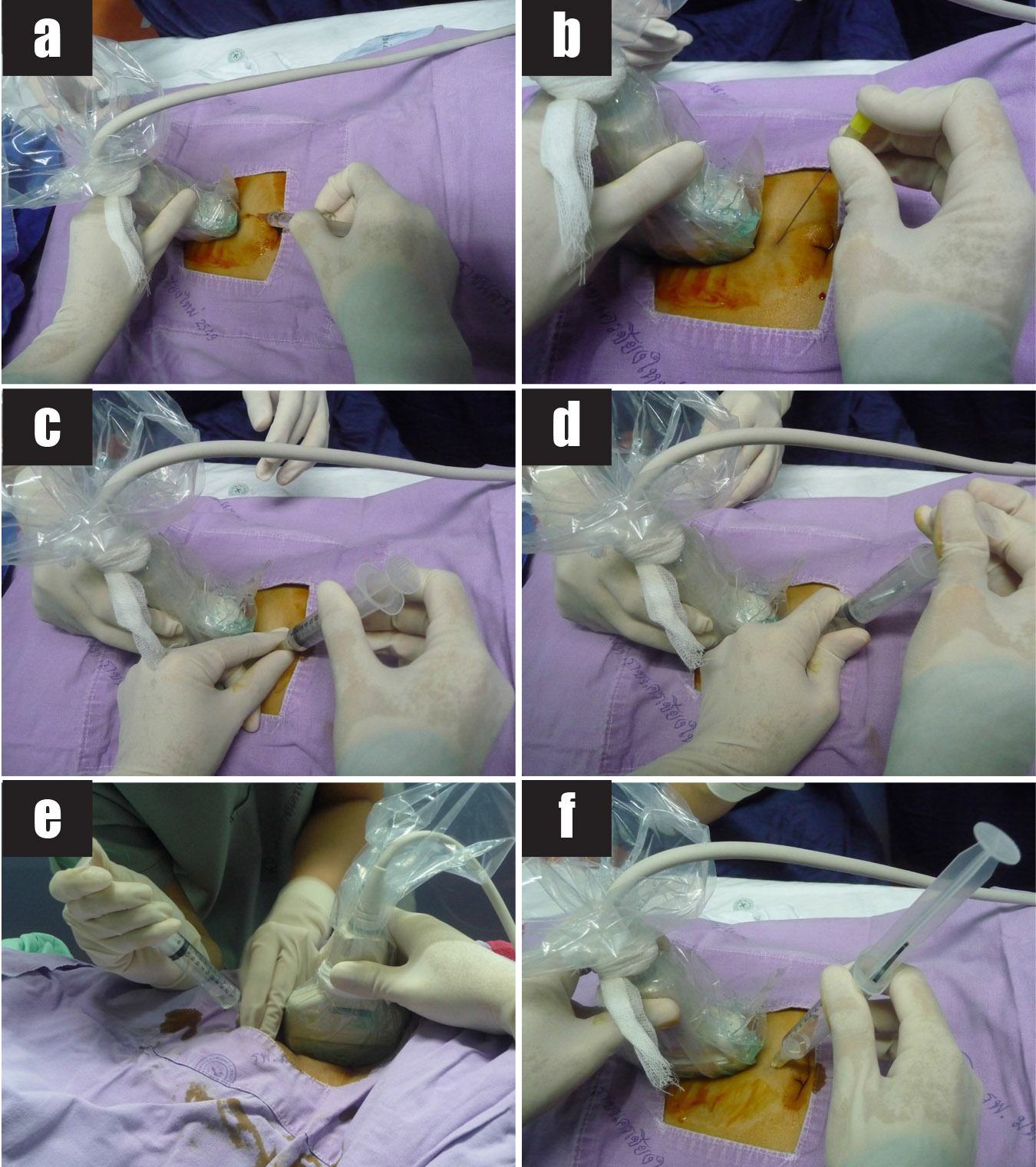
รูปที่ 7 แสดงขั้นตอนการทำหัตถการ transabdominal CVS
7a) ฉีดยาชาบนผิวหนังหน้าท้องตำแหน่งที่ต้องการเจาะ
7b) แทงเข็ม spinal needle ผ่านผนังหน้าท้องไปยังตำแหน่งรกที่เลือกไว้
7c) ถอด stylet ออก ใช้ syringe with lock ต่อกับ hub ให้แน่น
7d) ออกแรงดูด และ
7e) lock ไว้ (ในรูปใช้ syringe with lock) ขยับเข็มเข้าออกตามแนวยาวของรก 4 – 5 ครั้งแล้วดึงเข็มออก หรือ
7f) ออกแรงดูดค้างไว้ที่ซีซีที่ 10 (ในรูปใช้ syringe without lock) ขยับเข็มเข้าออกตามแนวยาวของรก 4 – 5 ครั้งแล้วดึงเข็มออก
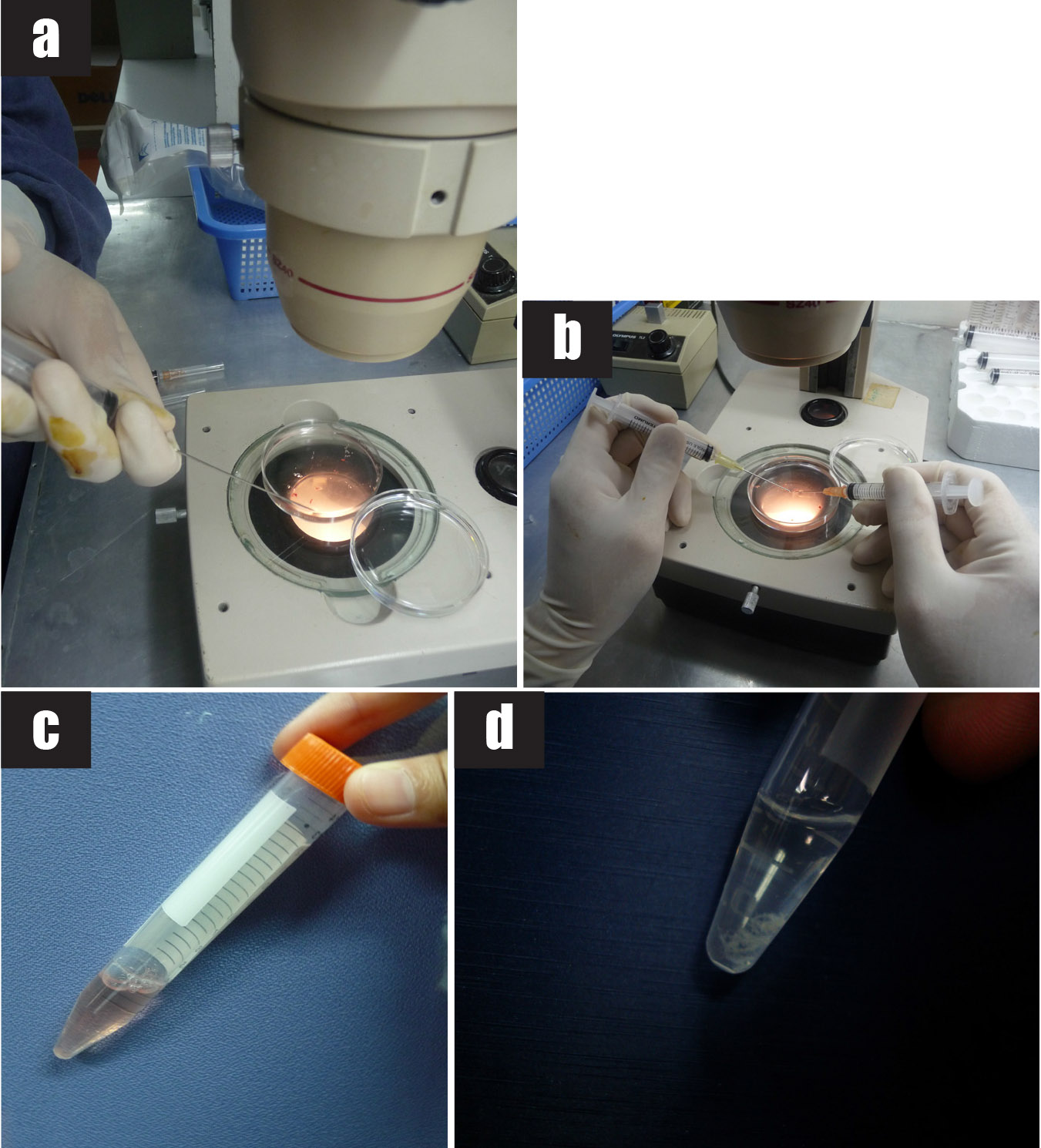
รูปที่ 8 แสดงขั้นตอนการทำหัตถการ transabdominal CVS
8a) นำชิ้นเนื้อรกที่ได้ใน syringe เทลงในจาน petri dish
8b) ล้างและแยก maternal decidua ออกจาก chorionic villi โดยดูผ่านกล้องจุลทรรศน์
8c-8d) เก็บ chrionic villi ที่ได้ใส่หลอดทดลองที่มีน้ำยาเพาะเลี้ยงเซลล์
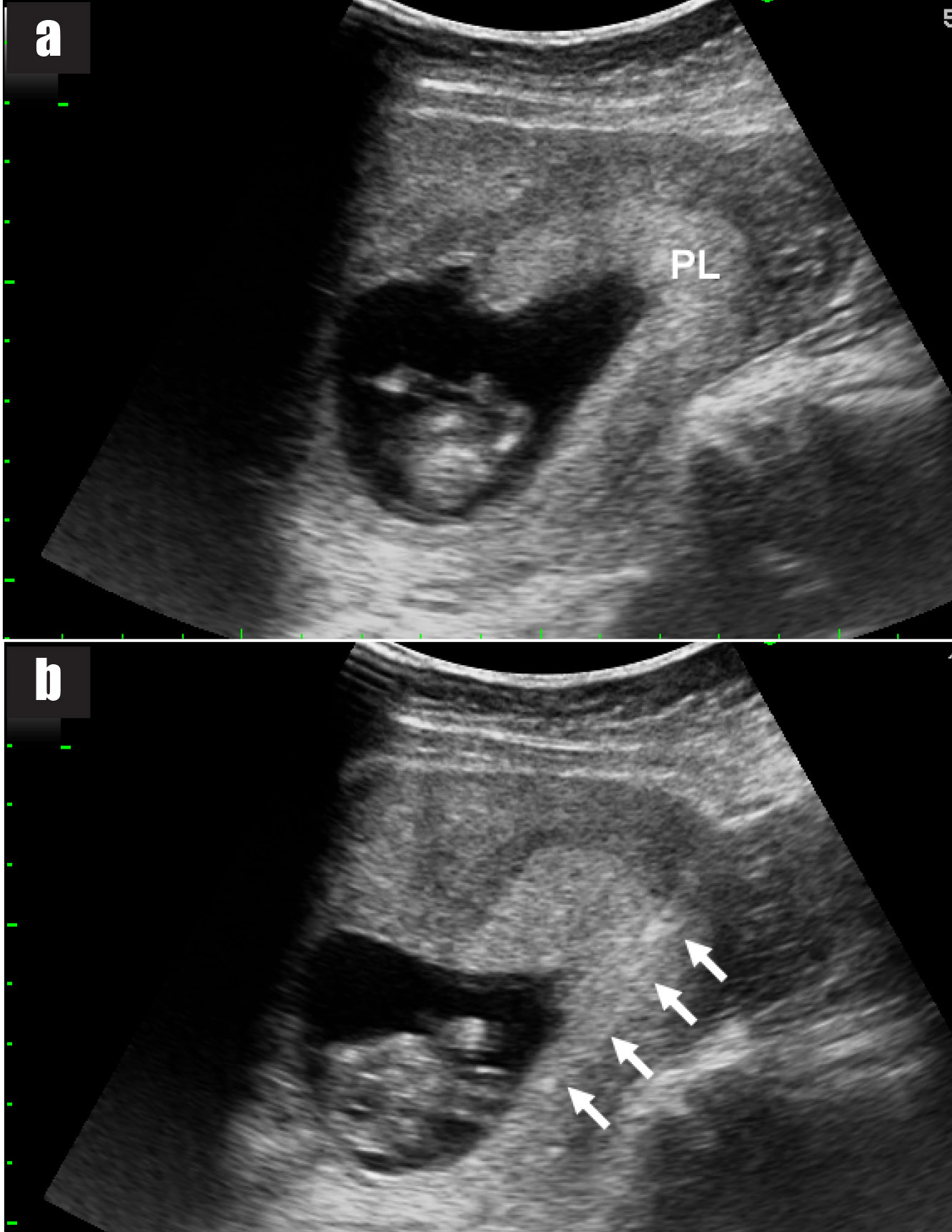
รูปที่ 9 แสดงภาพอัลตราซาวด์ cross-sectional view ของมดลูก
9a) ภาพอัลตราซาวด์เห็นตำแหน่งรก (PL) ที่ต้องการเจาะตามแนวยาว
9b) ภาพอัลตราซาวด์เห็นเข็ม spinal needle แทงผ่านรก (ลูกศร)

รูปที่ 10 แสดงปริมาณของ chorionic villi
10a) ปริมาณ 5 กรัม 10b) ปริมาณ 10 กรัม
10c) ปริมาณ 15 กรัม 10d) ปริมาณ 20 กรัม
10e) ปริมาณ 25 กรัม 10f) ปริมาณ 30 กรัม
รูปที่ 11 แสดงชุดอุปกรณ์เจาะที่ใช้ในการทำหัตถการ transcervical CVS
รูปที่ 12 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transcervical CVS
12a) ถุงมือปราศจากเชื้อ
12b) 10% povidone iodine solution
12c) น้ำกลั่นปราศจากเชื้อ (sterile water)
12d) สำลีก้อน
12e) ผ้าช่องใหญ่
12f) ถุงคลุมขาสองข้าง
รูปที่ 13 แสดงวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transcervical CVS
13a) Long forceps
13b) Speculum
13c) Tenaculum
13d-e) Curved biopsy forceps
13f) จาน petri dish ปราศจากเชื้อ
การเตรียมวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transcervical CVS
การทำหัตถการ transcervical CVS อาจทำโดยใช้ polyethylene catheter หรือ cannula สอดผ่านปากมดลูกและใช้ negative pressure เพื่อดูดเก็บชิ้นเนื้อรก (aspiration) หรือใช้ forceps สอดผ่านปากมดลูกเพื่อคีบตัดชิ้นเนื้อรก (biopsy) การเลือกใช้อุปกรณ์ขึ้นอยู่กับความถนัดและประสบการณ์ของผู้ทำหัตถการ อย่างไรก็ตามการใช้ aspiration cannula มีโอกาสเก็บชิ้นเนื้อรกได้ในปริมาณไม่เพียงพอ (น้อยกว่า 5 มิลลิกรัม) บ่อยกว่าการใช้ forceps 3.8 เท่า และเจ็บกว่าการใช้ forceps 1.93 เท่า แต่จำนวนครั้งของการสอดเครื่องมือ (reinsertion of instruments)ไม่แตกต่างกันอย่างมีนัยสำคัญทางสถิติแม้ว่าการใช้ cannula จะมีแนวโน้มเพิ่มจำนวนครั้งในการสอดเครื่องมือบ่อยกว่า forceps 2.44 เท่า ส่วนอัตราการสูญเสียทารกในครรภ์ไม่แตกต่างกัน สรุปว่าแม้จะมีหลักฐานทางการแพทย์บ่งชี้ว่าการใช้ forceps ดีกว่าการใช้ cannula แต่ยังไม่หนักแน่นพอที่จะแนะนำให้เปลี่ยนแนวทางการปฏิบัติของผู้ทำหัตถการที่คุ้นเคยกับการใช้ cannula อยู่ก่อนหน้านี้[18] การเลือกใช้อุปกรณ์จึงขึ้นอยู่กับความถนัดและประสบการณ์ของผู้ทำหัตถการเป็นหลัก ในที่นี้จะนำเสนอการทำหัตถการ transcervical CVS โดยใช้ forceps ซึ่งเป็นอุปกรณ์ที่ใช้ในหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
| ตารางที่ 3 แสดงการเตรียมวัสดุอุปกรณ์ที่ใช้ในการทำหัตถการ transcervical CVS และตัวอย่างรูป | |
| วัสดุอุปกรณ์ | รูปที่ |
|
|
|
1a
1b 1c |
|
11 |
|
12a
12b 12c 12d 12e,12f 13a 13b 13c 13d,13e 13f |
|
|
|
5a
5b 5c 5d 5e, 5f |
ขั้นตอนการทำหัตถการ transcervical CVS
- ให้สตรีตั้งครรภ์นอนหงายราบบนเตียง ตรวจอัลตราซาวด์เพื่อประเมินจำนวนทารก วัดขนาดของทารกเพื่อประเมินอายุครรภ์ ตรวจหาความผิดปกติของทารก ปริมาณน้ำคร่ำ ตำแหน่งรก ตำแหน่งปากมดลูก
- กำหนดทิศทาง (mapping) การสอด biopsy forceps จากปากมดลูกไปยังตำแหน่งรกที่เลือก โดยตำแหน่งรกที่เหมาะสมคือ รกที่เกาะด้านล่างของมดลูก และไม่มีแอ่งเลือดคั่งที่ชายรกด้านล่าง (รูปที่ 14a)
- ให้สตรีตั้งครรภ์ปัสสาวะทิ้งให้หมดก่อนการทำหัตถการ (ในกรณีมดลูกคว่ำหน้ามากๆ อาจต้องให้มีปัสสาวะค้างในกระเพาะปัสสาวะในปริมาณที่พอเหมาะ) และให้สตรีตั้งครรภ์นอนบนเตียงขาหยั่งในท่า lithotomy
- เตรียมอุปกรณ์ด้วยเทคนิคปราศจากเชื้อ และแจ้งให้สตรีตั้งครรภ์ทราบว่ากำลังจะเริ่มทำหัตถการ
- เตรียมผู้ทำหัตถการ และผู้ช่วย 1 คน โดยล้างมือให้สะอาด สวมถุงมือปราศจากเชื้อ ผู้ทำหัตถการนั่งตรงกลางระหว่างขาของสตรีตั้งครรภ์ทั้งสองข้าง ผู้ช่วยยืนหรือนั่งในท่าที่ถนัดด้านข้างของเตียงใกล้กับเครื่องอัลตราซาวด์ และควรมีผู้ช่วยที่ทำหน้าที่เป็น circulating nurse จัดหาอุปกรณ์ที่ต้องการได้ทันทีอีก 1 คน (ไม่จำเป็นต้องสวมถุงมือปราศจากเชื้อ)
- ทำความสะอาดปากช่องคลอดของสตรีตั้งครรภ์ด้วยน้ำยาฆ่าเชื้อ เช่น 10% povidone iodine solution และปูผ้าช่อง (รูปที่ 15a)
- ใส่ speculum ให้เห็นปากมดลูกทั้งหมด ทำความสะอาดช่องคลอด และปากมดลูกด้วยน้ำยาฆ่าเชื้อ 10% povidone iodine solution (รูปที่ 15b)
- ผู้ช่วยตรวจอัลตราซาวด์ซ้ำเพื่อยืนยันตำแหน่งรก หากพบว่าตำแหน่งรกเปลี่ยนไปจากกระเพาะปัสสาวะที่โป่งขึ้นหรือมดลูกหดรัดตัว ควรให้ปัสสาวะทิ้งก่อนทำหัตถการหรือรอให้มดลูกคลายตัว แต่หากพบว่ามดลูกคว่ำหน้ามากๆ ควรรอให้มีปัสสาวะค้างในกระเพาะปัสสาวะจนเบียดมดลูกมาทางด้านหลังเพื่อให้ทำหัตถการได้ง่าย
- ผู้ทำหัตถการใช้ biopsy forceps สอดผ่านปากมดลูกมุ่งตรงไปยังตำแหน่งรกที่เลือกไว้ (รูปที่ 15c) อาจใช้ tenaculum ช่วยจับปากมดลูกไว้หรือไม่ก็ได้ โดยปรับทิศทางของ biopsy forceps เข้าหาตำแหน่งรกที่เห็นจากภาพอัลตราซาวด์ และต้องระมัดระวังไม่ให้ปลาย biopsy forceps เลื่อนทะลุเข้าสู่โพรงน้ำคร่ำ
- เมื่อปลาย biopsy forceps อยู่ในตำแหน่งรกที่เหมาะสม (รูปที่ 14b) คีบตัดชิ้นเนื้อรกและค่อยๆ ดึงออกจากปากมดลูกและปากช่องคลอด (รูปที่ 15d)
- นำชิ้นเนื้อรกที่ได้ใส่ในจาน petri dish (รูปที่ 15e-15f) ใช้เข็มฉีดยาต่อกับ syringe ขนาด 5 ซีซีจำนวน 2 ชุด ช่วยแยก maternal decidua ออกจาก chorionic villi โดยการดูผ่านกล้องจุลทรรศน์กำลังขยายต่ำ แบ่ง chorionic villi ที่ได้ใส่หลอดทดลองที่มีน้ำยาเพาะเลี้ยงเซลล์
- ผู้ช่วยติดป้ายชื่อ นามสกุล เลขโรงพยาบาลของสตรีตั้งครรภ์ บนหลอดทดลองที่จะส่งตรวจ และตรวจเช็คซ้ำก่อนนำส่งห้องปฏิบัติการ
- หาก chorionic villi ที่ได้มีปริมาณไม่เพียงพอในการส่งตรวจ อาจจำเป็นต้องตัดเก็บชิ้นเนื้อรกซ้ำ แต่ไม่ควรมากกว่า 2 ครั้งในการตัดชิ้นเนื้อรกแต่ละครั้ง หากทำไม่ได้ควรหยุดการทำหัตถการ และนัดใหม่อีก 1 สัปดาห์
- เช็ดทำความสะอาดปากมดลูก (ถ้าใช้ tenacultum ให้ถอดออกและกดหยุดเลือดด้วยสำลี) และถอด speculum ออก
- สังเกตภาวะแทรกซ้อน (immediate complications) และบันทึกไว้หลังทำหัตถการ เช่น เลือดออกจากช่องคลอด (vaginal bleeding), ก้อนเลือดคั่งในรก (placental hematoma), ปวดเกร็งมดลูก (uterine cramping)
- แจ้งให้สตรีตั้งครรภ์ทราบว่าทำหัตถการเสร็จสิ้น แนะนำให้นอนพักเพื่อสังเกตภาวะแทรกซ้อนประมาณ 30 นาที หากปกติดีอนุญาตให้กลับบ้าน แนะนำให้งดการทำงานหนักและงดเพศสัมพันธ์อย่างน้อย 24 – 48 ชั่วโมง นัดมาฟังผลการตรวจโดยหากมีอาการผิดปกติให้มาพบแพทย์ก่อนนัด
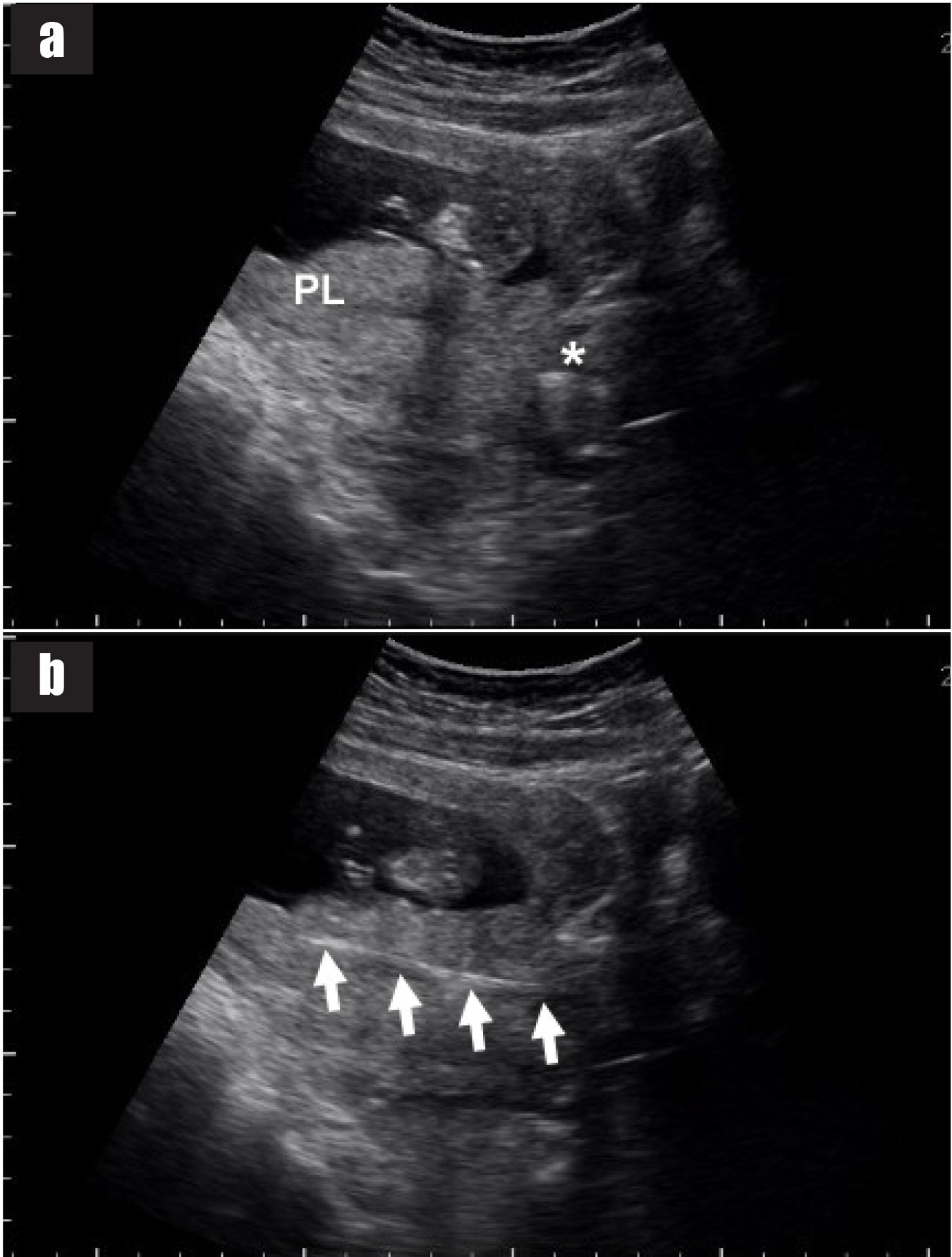
รูปที่ 14 แสดงภาพอัลตราซาวด์ sagittal view ของมดลูก
14a) ภาพอัลตราซาวด์เห็นตำแหน่งรกที่ต้องการเจาะ (PL) เกาะด้านหลังของมดลูก ใกล้ปากมดลูก (*)
14b) ภาพอัลตราซาวด์เห็น biopsy forceps อยู่ในรก (ลูกศร)
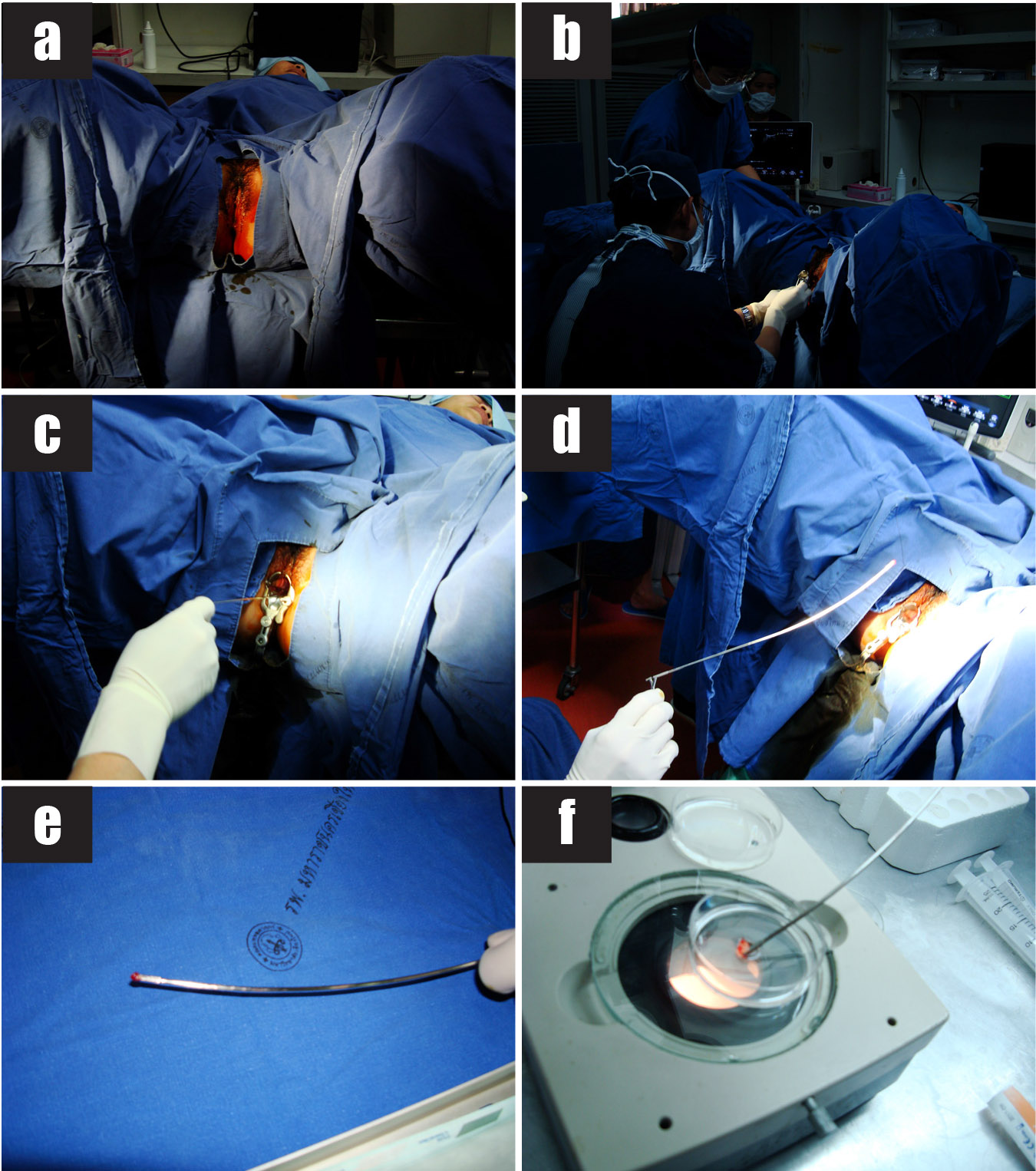
รูปที่ 15 แสดงขั้นตอนการทำหัตถการ transcervical CVS
15a) ทำความสะอาดปากช่องคลอดด้วยน้ำยาฆ่าเชื้อ และปูผ้าช่อง
15b) ใส่ speculum ให้เห็นปากมดลูกทั้งหมด
15c) สอด biopsy forceps ผ่านปากมดลูกไปยังรก โดยสังเกตภาพจากอัลตราซาวด์
15d) คีบตัดชิ้นเนื้อรกและค่อยๆ ดึง biopsy forceps ออกจากปากมดลูก
15e-f) นำชิ้นเนื้อรกที่ได้ (ลูกศร) ใส่ในจาน petri dish
ภาวะแทรกซ้อนจากการทำหัตถการ
- ภาวะเลือดออกทางช่องคลอด (vaginal bleeding): เป็นภาวะแทรกซ้อนที่พบบ่อยที่สุด โดยพบหลังการทำหัตถการ transcervical CVS ได้บ่อยกว่า transabdominal CVS โดยการทำหัตถการ transcervical CVS พบภาวะเลือดออกกะปริบกะปรอยทางช่องคลอด (vaginal spotting) ได้ประมาณร้อยละ 20 – 30 และภาวะเลือดออกทางช่องคลอด (vaginal bleeding) ได้ร้อยละ 7 – 10 ซึ่งสัมพันธ์กับการใช้ tenaculum ส่วนการทำ transabdominal CVS พบภาวะเลือดออกทางช่องคลอดน้อยกว่าร้อยละ 1[19]
จากรายงานการศึกษาของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบภาวะเลือดออกทางช่องคลอดหลังการทำหัตถการ transcervical CVS ร้อยละ 10.9 และพบหลังการทำหัตถการ transabdominal CVS ร้อยละ 0.5 โดยส่วนใหญ่มีปริมาณเลือดที่ออกไม่มาก[12]
- ภาวะเลือดออกในรก (subchorionic hematoma): พบได้ร้อยละ 4 หลังการทำหัตถการ transcervical CVS[20, 21] ส่วนใหญ่หายได้เองภายในเวลาหลายสัปดาห์ เกิดจากการใส่ biopsy forceps หรือ catheter ลึกเกินไปยังชั้น decidua basalis ที่มีเส้นเลือดอยู่มาก หรือการตัดชิ้นเนื้อรกบริเวณที่เป็น placental lakes[22]
- เลือดทารกเข้าสู่กระแสเลือดมารดา (fetomaternal hemorrhage): วินิจฉัยได้จากการเพิ่มขึ้นของ alpha-fetoprotein (AFP) ในกระแสเลือดมารดาหลังการทำหัตถการ โดยร้อยละ 50 ของการเจาะชิ้นเนื้อรกวินิจฉัยว่าน่าจะมีเลือดทารกจะเข้าสู่กระแสเลือดมารดา[23] การทำหัตถการ transabdominal CVS พบภาวะ fetomaternal hemorrhage ได้มากกว่า transcervical CVS โดยพบปริมาณเลือดทารกที่เข้าสู่กระแสเลือดมารดาอย่างน้อย 0.1 ซีซีหลังการทำหัตถการ transabdominal CVS ร้อยละ 18 และหลังการทำหัตถการ transcervical CVS ร้อยละ 5[24] แม้ว่าเลือดทารกที่เข้าสู่กระแสเลือดมารดาจะมีปริมาณน้อย แต่ส่งผลทำให้มารดาที่มีหมู่เลือด Rh negative ที่ไม่เคยถูกกระตุ้น สร้าง anti-D antibody ขึ้นได้ และกระตุ้นทำให้เกิดภาวะ Rh immunization รุนแรงมากขึ้นในการตั้งครรภ์ที่มารดาเคยถูกกระตุ้นแล้ว (preexisting Rh sensitization)[13] และหากเลือดทารกเข้าสู่กระแสเลือดมารดาปริมาณมาก อาจส่งผลให้ทารกซีดจนเสียชีวิตได้
- การติดเชื้อ (infection): พบน้อยกว่าร้อยละ 0.5 ได้แก่ chorioamnionitis, septic shock, peritonitis จากเข็มเจาะทะลุผ่านลำไส้มารดา (maternal intestinal perforation) เป็นต้น โดยพบอัตราการติดเชื้อหลังการทำหัตถการ transcervical CVS มากกว่า transabdominal CVS[14]
- น้ำคร่ำรั่ว (amniotic fluid leakage): พบน้อยมากและส่วนมากเป็นชั่วคราว แต่อาจทำให้เกิดภาวะน้ำคร่ำน้อยในไตรมาสสองได้[19, 25]
จากรายงานการศึกษาของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบภาวะน้ำคร่ำรั่วร้อยละ 0.3 โดยส่วนใหญ่หยุดได้เอง และไม่มีผลต่อผลลัพธ์การตั้งครรภ์[12]
การสูญเสียทารกจากการทำหัตถการ
อัตราการสูญเสียทารกจากการทำหัตถการ transabdominal CVS พบร้อยละ 0.7 ภายใน 14 วันหลังการทำหัตถการ ร้อยละ 1.3 ภายใน 30 วันหลังการทำหัตถการ และร้อยละ 2 ตลอดการตั้งครรภ์[26] โดยอัตราการสูญเสียทารกหลังการทำหัตถการ transabdominal CVS ไม่แตกต่างจากอัตราการสูญเสียทารกหลังการทำหัตถการ amniocentesis[15] แต่อัตราการสูญเสียทารกหลังการทำหัตถการ transcervical CVS พบมากกว่าอัตราการสูญเสียทารกหลังการทำหัตถการ amniocentesis อย่างมีนัยสำคัญ (เพิ่มขึ้นร้อยละ 3.5 หรือ 1.5 – 1.7 เท่า)[14, 15, 27]
ปัจจัยสำคัญ (นอกเหนือไปจาก sampling route) ที่มีผลทำให้อัตราการสูญเสียทารกเพิ่มมากขึ้น ได้แก่
- จำนวนครั้งของการแทงเข็ม: โดยมีรายงานการศึกษาพบอัตราการสูญเสียทารกเพิ่มขึ้นหากแทงเข็มหรือสอด catheter ผ่านปากมดลูกมากกว่าหรือเท่ากับ 3 ครั้งขึ้นไป[19, 28]
- ประสบการณ์ของผู้ทำหัตถการ: ภาวะแทรกซ้อนหลังการทำหัตถการมักพบบ่อยขึ้นสัมพันธ์กับทักษะและประสบการณ์ของผู้ทำหัตถการ โดยเฉพาะอย่างยิ่งการทำหัตถการ transcervical CVS ที่มีความยากกว่า transabdominal CVS[29] จากรายงานการศึกษาตั้งแต่ปีค.ศ. 1983 พบว่าการทำหัตถการในยุคเริ่มแรกพบอัตราการสูญเสียทารกในครรภ์ร้อยละ 4.4 และค่อยๆ ลดลงเหลือร้อยละ 1.9 ภายในระยะเวลา 20 ปีหลังจากนั้น[30] แสดงให้เห็นถึงประสบการณ์ที่มากขึ้นส่งผลต่ออัตราการสูญเสียทารกในครรภ์ ดังนั้นการฝึกปฏิบัติเพื่อเพิ่มทักษะและความชำนาญในการทำหัตถการจึงมีความจำเป็นอย่างยิ่ง (รายละเอียดเพิ่มเติมในบทที่ 7 การฝึกปฏิบัติการทำหัตถการวินิจฉัยก่อนคลอด)
จากรายงานการศึกษาของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบอัตราการสูญเสียทารกในครรภ์ร้อยละ 0.8 โดยพบหลังการทำหัตถการ transabdominal CVS ร้อยละ 0.4 และพบหลังการทำหัตถการ transcervical CVS ร้อยละ 2.2[12]
อัตราความสำเร็จของการเจาะชิ้นเนื้อรก
การเจาะชิ้นเนื้อรกเพื่อตรวจวินิจฉัยโครโมโซมของทารกในครรภ์ให้ผลร้อยละ 97 – 99 มีเพียงประมาณร้อยละ 1 ที่จำเป็นต้องตรวจซ้ำด้วยการเจาะน้ำคร่ำหรือการเจาะเลือดสายสะดือทารกในครรภ์[10, 11, 19] โดยมีสาเหตุจากผลการตรวจโครโมโซมเป็น mosaic หรือผลก้ำกึ่ง (ร้อยละ 76) จากการเพาะเลี้ยงเซลล์ไม่ขึ้น (ร้อยละ 21) และภาวะ maternal cell contamination (ร้อยละ 3)[11] หัตถการส่วนใหญ่ทั้ง transabdominal CVS และ transcervical CVS (ร้อยละ 97 – 100) เจาะได้สำเร็จในครั้งแรก และจากการแทงเข็มหรือสอด biopsy forceps เพียงครั้งเดียว[10, 20, 28, 31]
จากรายงานการศึกษาการเจาะชิ้นเนื้อรกจำนวน 636 รายของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบว่าร้อยละ 3.4 ของการเจาะชิ้นเนื้อรกทั้งหมดไม่สามารถให้ผลการตรวจได้และจำเป็นต้องตรวจวินิจฉัยก่อนคลอดซ้ำในไตรมาสสอง โดยพบว่าเกิดจากผลการตรวจทางห้องปฏิบัติการให้ผลก้ำกึ่งหรือเพาะเลี้ยงเซลล์ไม่ขึ้นร้อยละ 2.8 จากการศึกษานี้พบว่าการเจาะชิ้นเนื้อรกทุกรายประสบความสำเร็จในการนัดเจาะครั้งนั้นโดยร้อยละ 89.6 เจาะได้สำเร็จจากการแทงเข็มหรือสอด biopsy forceps เพียงครั้งเดียว และมีเพียงร้อยละ 0.6 ที่จำเป็นต้องแทงเข็มหรือสอด biopsy forceps มากถึง 3 ครั้ง[12]
ภาวะ confined placental mosaicism
คือความผิดปกติของโครโมโซมที่พบเฉพาะในรก แต่ทารกมีโครโมโซมปกติ เป็นสาเหตุหนึ่งที่พบได้บ่อยของการวินิจฉัยโครโมโซมทารกในครรภ์ผิดพลาดจากการเจาะชิ้นเนื้อรก สามารถอธิบายได้จาก 2 กระบวนการดังนี้ [9]
- meiotic error: โดยภาวะ trisomy เกิดจากการแบ่งตัวผิดปกติในระยะ meiotic ต่อมาหากเซลล์ aneuploid บางเซลล์เกิดการสูญเสีย trisomic chromosome ไป 1 ตัว (anaphase lag) ระหว่างการแบ่งตัวในระยะ mitotic จะทำให้เกิด mosaic morula ซึ่งประกอบด้วยเซลล์ปกติที่เป็น disomy และเซลล์ผิดปกติที่เป็น trisomy (สัดส่วนของเซลล์ trisomy จะพบจำนวนมากขึ้นสัมพันธ์กับการแบ่งตัวที่เกิดขึ้นช้าจากการแบ่งตัวครั้งที่สองหรือครั้งต่อๆ มา) โดยในระยะ 32 – 64 เซลล์ของตัวอ่อนนั้น มีเพียง 3 – 4 เซลล์จะเป็นต้นกำเนิดของ embryo ส่วนเซลล์ที่เหลือจะเป็นต้นกำเนิดของ extraembryonic tissue ทำให้เซลล์ trisomy ส่วนใหญ่พัฒนาไปเป็นรก (trophoblast cell line) ส่วนเซลล์ disomy พัฒนาไปเป็นทารก (fetal cell line) เกิดภาวะ confined placental mosaicism ขึ้น
- mitotic error: โดยภาวะ trisomy เกิดจากการแบ่งตัวผิดปกติในระยะ mitotic postzygotic ทำให้เกิดภาวะ mosaicism ขึ้นใน morula หรือ blastocyst ซึ่งประกอบด้วยเซลล์ผิดปกติที่เป็น trisomy และเซลล์ปกติที่เป็น disomy (สัดส่วนของเซลล์ trisomy จะขึ้นอยู่กับเวลาที่เกิดภาวะ nondisjunction) หากการแบ่งตัวผิดปกติเกิดขึ้นในระยะที่เซลล์ตัวอ่อนมี differentiation เพื่อพัฒนาไปเป็น inner cell mass หรือ outer cell mass แล้วจะทำให้เกิดความผิดปกติของโครโมโซมใน cell line เดียวเท่านั้น
ภาวะ confined placental mosaicism มีความสำคัญต่อการตั้งครรภ์ดังนี้
- การวินิจฉัยภาวะ uniparental disomy: ภาวะ meiotic rescue ทำให้เกิดภาวะ uniparental disomy ได้ เนื่องจากเซลล์ที่เป็น trisomy มีโครโมโซมสองตัวที่มาจากบิดาหรือมารดาคนใดคนหนึ่ง และโครโมโซมอีกตัวมาจากอีกคนหนึ่ง โดยมีโอกาสหนึ่งในสามที่ทำให้โครโมโซมคู่นั้นมาจากบิดาหรือมารดาคนเดียวกันหรือเรียกว่า uniparental disomy ตัวอย่างเช่น Prader-Willi syndrome ซึ่งเกิดจากภาวะ uniparental paternal disomy ของโครโมโซมคู่ที่ 15 หรือ Angelman syndrome ซึ่งเกิดจากภาวะ uniparental maternal disomy การเจาะชิ้นเนื้อรกพบภาวะ confined placental mosaicism ของโครโมโซมคู่ที่ 15 อาจทำให้สงสัยว่ามีภาวะ uniparental disomy ในตัวทารกและนำไปสู่การวินิจฉัยต่อไป[32] ดังนั้นหากตรวจพบ trisomy 15 จากการเจาะชิ้นเนื้อรก จึงควรเจาะน้ำคร่ำหรือเจาะเลือดสายสะดือทารกในครรภ์เพื่อวินิจฉัยว่าทารกมีภาวะ uniparental disomy หรือไม่ นอกจากโครโมโซมคู่ที่ 15 แล้วยังมีโครโมโซมคู่อื่นที่อาจส่งผลต่อทารกได้หากเกิดภาวะ uniparental disomy ได้แก่ โครโมโซมคู่ที่ 7, 11, 14 และ 22[9]
- ทารกเจริญเติบโตช้าในครรภ์ (fetal growth restriction): ภาวะ confined placental mosaicism สามารถเปลี่ยนแปลงการทำงานของรก และนำไปสู่การเกิดภาวะทารกเจริญเติบโตช้าในครรภ์ได้โดยไม่ทราบกลไกการเกิดที่แน่ชัด[33, 34] โดยผลกระทบต่อการทำงานของรกจะเกิดขึ้นจำกัดเฉพาะโครโมโซมบางคู่ ตัวอย่างเช่น ภาวะ confined placental mosaicism ของโครโมโซมคู่ที่ 16 จะทำให้เกิด severe fetal growth restriction, prematurity และ perinatal death ได้[35]
ภาวะ mosaicism พบประมาณร้อยละ 1 – 2 จากการตรวจชิ้นเนื้อรก แต่ยืนยันผลในทารกเพียงร้อยละ 10 – 40 ของการตรวจพบทั้งหมด[10, 11, 34] โดยทั่วไปหากภาวะ mosaicism จำกัดอยู่เฉพาะในรก (confined placental mosaicism) พัฒนาการของทารกในครรภ์จะปกติ แต่หากภาวะ mosaicism พบในตัวทารกด้วยอาจส่งผลต่อ phenotype ของทารกได้ โดยหากตรวจพบภาวะ mosaicism จากการตรวจชิ้นเนื้อรกด้วยวิธี long-term culture ซึ่งวิเคราะห์โครโมโซมจากเซลล์ใน villous core ของชิ้นเนื้อรกจะสะท้อนถึงภาวะ true fetal mosaicism มากกว่าการตรวจพบภาวะ mosaicism จากการตรวจชิ้นเนื้อรกด้วยวิธี direct preparation ซึ่งวิเคราะห์โครโมโซมจากเซลล์ cytotrophoblasts
จากรายงานการศึกษาของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบภาวะ mosaicism ร้อยละ 1 จากการตรวจโครโมโซมจากชิ้นเนื้อรกจำนวน 304 ราย โดยพบภาวะ mosaicism ของ sex chromosome หนึ่งราย และภาวะ mosaisism ของโครโมโซมคู่ที่ 13 หนึ่งรายซึ่งไม่พบความผิดปกติจากการตรวจอัลตราซาวด์และได้ตรวจยืนยันผลโครโมโซมในไตรมาสสองพบว่าปกติ ส่วนอีกหนึ่งรายพบภาวะ mosaicism ของโครโมโซมคู่ที่ 7 และตรวจอัลตราซาวด์พบภาวะ cystic hygroma จึงยุติการตั้งครรภ์โดยไม่ได้ตรวจยืนยันผลโครโมโซม[12]
ดังนั้นหากพบภาวะ mosaicism จากการเจาะชิ้นเนื้อรก แนะนำให้ทางเลือกแก่สตรีตั้งครรภ์ในการเจาะน้ำคร่ำ การตัดสินใจยุติการตั้งครรภ์ไม่ควรยึดตามผลการตรวจจากการเจาะชิ้นเนื้อรกเพียงอย่างเดียว ในกรณีที่ผลการตรวจชิ้นเนื้อรกเป็น mosaicism ของ sex chromosome, polyploidy, marker chromosome, structural rearrangement หรือ trisomy โดยที่ผลการตรวจยืนยันจากการเจาะน้ำคร่ำเป็น euploid และการตรวจอัลตราซาวด์ไม่พบความผิดปกติของทารกในครรภ์ ควรให้ความมั่นใจแก่สตรีตั้งครรภ์ว่าทารกปกติ แม้ว่าจะไม่สามารถรับประกันได้ว่าทารกจะปกติทุกราย เนื่องจากผลการตรวจโครโมโซมที่ปกติจากการเจาะน้ำคร่ำอาจเกิดจากภาวะ uniparental disomy ดังกล่าวข้างต้น หรือเป็นผลจาก false negative result ได้ ดังนั้นอาจพิจารณาตรวจติดตามด้วยการตรวจอัลตราซาวด์เป็นระยะ หรือตรวจโครโมโซมจากเลือดสายสะดือทารกในครรภ์เพื่อยืนยันผลในสตรีตั้งครรภ์บางราย
ภาวะปนเปื้อนเซลล์มารดา (maternal cell contamination)
ตัวอย่างชิ้นเนื้อรกที่เก็บได้ส่วนมากจะประกอบด้วย placental villi และ maternal decidua แม้ว่าจะล้างและคัดแยกเฉพาะ villi ภายใต้กล้องจุลทรรศน์ เซลล์ของมารดายังมีโอกาสปนเปื้อนและเจริญเติบโตได้ดีระหว่างการเพาะเลี้ยง ส่งผลให้ผลการตรวจโครโมโซมจากชิ้นเนื้อรกพบ 2 cell lines หรือพบ 1 cell line ที่เป็นโครโมโซมของมารดาเนื่องจากเป็น false negative result จากการที่เซลล์ของมารดาเจริญเติบโตดีกว่าเซลล์ของทารกโดยสมบูรณ์ อัตราการพบภาวะ maternal cell contamination ประมาณร้อยละ 1 – 3 ของการเจาะชิ้นเนื้อรกทั้งหมด[11] จากรายงานการศึกษาของหน่วยเวชศาสตร์มารดาและทารก ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ พบภาวะนี้ร้อยละ 0.3 จากจำนวนการเจาะชิ้นเนื้อรกทั้งหมด 636 ราย[12] โดยปัจจัยที่ส่งผลต่อการพบภาวะ maternal cell contamination ได้แก่
- เทคนิคการตรวจโครโมโซม: การตรวจโครโมโซมจากชิ้นเนื้อรกด้วยวิธี direct preparation เชื่อว่าสามารถป้องกันการแปลผลผิดพลาดจากภาวะ maternal cell contamination ได้ ขณะที่การตรวจด้วยวิธี long-term culture พบอัตราการเกิดภาวะ maternal cell contamination ได้ร้อยละ 1.8 – 4[11] ดังนั้นอาจจำเป็นต้องตรวจโครโมโซมทั้งสองวิธีในตัวอย่างชิ้นเนื้อรกแต่ละตัวอย่าง
- ช่องทางการเจาะชิ้นเนื้อรก: การทำหัตถการ transabdominal CVS จะพบอัตราการเกิดภาวะ maternal cell contamination มากกว่า transcervical CVS[11]
- ปริมาณชิ้นเนื้อรกที่เจาะได้: การเจาะชิ้นเนื้อรกที่ได้ปริมาณน้อย ทำให้คัดแยกเฉพาะ villi ยาก ได้ปริมาณ villi น้อย ส่งผลให้เซลล์ของมารดาที่มีสัดส่วนมากกว่ามีโอกาสเจริญเติบโตได้ดีกว่าระหว่างการเพาะเลี้ยงเซลล์ ดังนั้นหากการเจาะชิ้นเนื้อรกได้ villi ปริมาณน้อยในการเจาะครั้งแรก ควรเจาะครั้งที่สองเพื่อเก็บชิ้นเนื้อรกเพิ่ม
- การคัดแยก chorionic villi: การคัดแยกเฉพาะ villi ภายใต้กล้องจุลทรรศน์ ควรคัดเลือกเฉพาะ villus ที่ชัดเจนจริงๆ เช่น villus ที่ครบสมบูรณ์ทั้งส่วน โดยทิ้งส่วนที่ไม่แน่ใจว่าเป็น villus เช่น เศษชิ้นเนื้อเล็กๆ หรือ villus ที่มี decidua ติดอยู่ ซึ่งมีโอกาสเกิดภาวะ maternal cell contamination ได้มากกว่า
References
1. Dunk C, Huppertz B, Kingdom J. Development of the placenta and its circulation. In: Rodeck CH, Whittle MJ, editors. Fetal Medicine: Basic Science and Clinical Practice. 2nd ed. London: Churchill Livingstone Elsevier; 2009. p. 69-96.
2. Old JM. Hemoglobinopathies. In: Rodeck CH, Whittle MJ, editors. Fetal Medicine: Basic Science and Clinical Practice. 2nd ed. London: Churchill Livingstone Elsevier; 2009. p. 331-343.
3. van der Zee DC, Bax KM, Vermeij-Keers C. Maternoembryonic transfusion and congenital malformations. Prenat Diagn 1997;17:59-69.
4. Evaluation of chorionic villus sampling safety: WHO/PAHO consultation on CVS. Prenat Diagn 1999;19:97-99.
5. Froster-Iskenius UG, Baird PA. Limb reduction defects in over one million consecutive livebirths. Teratology 1989;39:127-135.
6. Firth HV, Boyd PA, Chamberlain P, MacKenzie IZ, Lindenbaum RH, Huson SM. Severe limb abnormalities after chorion villus sampling at 56-66 days’ gestation. Lancet 1991;337:762-763.
7. Olney RS, Khoury MJ, Alo CJ, Costa P, Edmonds LD, Flood TJ, et al. Increased risk for transverse digital deficiency after chorionic villus sampling: results of the United States Multistate Case-Control Study, 1988-1992. Teratology 1995;51:20-29.
8. Firth HV, Boyd PA, Chamberlain PF, MacKenzie IZ, Morriss-Kay GM, Huson SM. Analysis of limb reduction defects in babies exposed to chorionic villus sampling. Lancet 1994;343:1069-1071.
9. Wapner RJ, Jenkins TM, Khalek N. Prenatal diagnosis of congenital disorders. In: Creasy RK, Resnik R, Iams JD, Lockwood CJ, Moore TR, editors. Creasy and Resnik’s Maternal-Fetal Medicine: Principles and Practice. 6th ed. Philadelphia: Saunders Elsevier; 2009. p. 221-274.
10. Brambati B, Tului L, Cislaghi C, Alberti E. First 10,000 chorionic villus samplings performed on singleton pregnancies by a single operator. Prenat Diagn 1998;18:255-266.
11. Ledbetter DH, Zachary JM, Simpson JL, Golbus MS, Pergament E, Jackson L, et al. Cytogenetic results from the U.S. Collaborative Study on CVS. Prenat Diagn 1992;12:317-345.
12. Laksanavilai U, Piyamongkol W, Sirichotiyakul S, Tongprasert F, Luewan S, Srisupundit K. Chorionic Villous Sampling: Experience of 636 Cases. J Med Assoc Thai 2013;96:383-388.
13. Moise KJ, Jr., Carpenter RJ, Jr. Increased severity of fetal hemolytic disease with known rhesus alloimmunization after first-trimester transcervical chorionic villus biopsy. Fetal Diagn Ther 1990;5:76-78.
14. Lippman A, Tomkins DJ, Shime J, Hamerton JL. Canadian multicentre randomized clinical trial of chorion villus sampling and amniocentesis. Final report. Prenat Diagn 1992;12:385-408.
15. Smidt-Jensen S, Permin M, Philip J, Lundsteen C, Zachary JM, Fowler SE, et al. Randomised comparison of amniocentesis and transabdominal and transcervical chorionic villus sampling. Lancet 1992;340:1237-1244.
16. ACOG practice bulletin. Prevention of Rh D alloimmunization. Number 4, May 1999 (replaces educational bulletin Number 147, October 1990). Clinical management guidelines for obstetrician-gynecologists. American College of Obstetrics and Gynecology. Int J Gynaecol Obstet 1999;66:63-70.
17. Sonek J, Nicolaides K, Sadowsky G, Foley M, O’Shaughnessy R. Articulated needle guide: report on the first 30 cases. Obstet Gynecol 1989;74:821-823.
18. Young C, von Dadelszen P, Alfirevic Z. Instruments for chorionic villus sampling for prenatal diagnosis. Cochrane Database Syst Rev;1:CD000114.
19. Rhoads GG, Jackson LG, Schlesselman SE, de la Cruz FF, Desnick RJ, Golbus MS, et al. The safety and efficacy of chorionic villus sampling for early prenatal diagnosis of cytogenetic abnormalities. N Engl J Med 1989;320:609-617.
20. Jahoda MG, Pijpers L, Reuss A, Los FJ, Wladimiroff JW, Sachs ES. Evaluation of transcervical chorionic villus sampling with a completed follow-up of 1550 consecutive pregnancies. Prenat Diagn 1989;9:621-628.
21. Brambati B, Oldrini A, Ferrazzi E, Lanzani A. Chorionic villus sampling: an analysis of the obstetric experience of 1,000 cases. Prenat Diagn 1987;7:157-169.
22. Liu DT, Agbaje R, Preston C, Savage J. Intraplacental sonolucent spaces: incidences and relevance to chorionic villus sampling. Prenat Diagn 1991;11:805-808.
23. Blakemore KJ, Baumgarten A, Schoenfeld-Dimaio M, Hobbins JC, Mason EA, Mahoney MJ. Rise in maternal serum alpha-fetoprotein concentration after chorionic villus sampling and the possibility of isoimmunization. Am J Obstet Gynecol 1986;155:988-993.
24. Smidt-Jensen S, Philip J, Zachary JM, Fowler SE, Norgaard-Pedersen B. Implications of maternal serum alpha-fetoprotein elevation caused by transabdominal and transcervical CVS. Prenat Diagn 1994;14:35-45.
25. Cheng EY, Luthy DA, Hickok DE, Hollenbach KA, Resta RG, Mahony BS, et al. Transcervical chorionic villus sampling and midtrimester oligohydramnios. Am J Obstet Gynecol 1991;165:1063-1068.
26. Mujezinovic F, Alfirevic Z. Procedure-related complications of amniocentesis and chorionic villous sampling: a systematic review. Obstet Gynecol 2007;110:687-694.
27. Medical Research Council European trial of chorion villus sampling. MRC working party on the evaluation pf chorion villus sampling. Lancet 1991;337:1491-1499.
28. Williams J, 3rd, Wang BB, Rubin CH, Aiken-Hunting D. Chorionic villus sampling: experience with 3016 cases performed by a single operator. Obstet Gynecol 1992;80:1023-1029.
29. Silver RK, MacGregor SN, Sholl JS, Hobart ED, Waldee JK. An evaluation of the chorionic villus sampling learning curve. Am J Obstet Gynecol 1990;163:917-922.
30. Caughey AB, Hopkins LM, Norton ME. Chorionic villus sampling compared with amniocentesis and the difference in the rate of pregnancy loss. Obstet Gynecol 2006;108:612-616.
31. Nicolaides K, Brizot Mde L, Patel F, Snijders R. Comparison of chorionic villus sampling and amniocentesis for fetal karyotyping at 10-13 weeks’ gestation. Lancet 1994;344:435-439.
32. Purvis-Smith SG, Saville T, Manass S, Yip MY, Lam-Po-Tang PR, Duffy B, et al. Uniparental disomy 15 resulting from “correction” of an initial trisomy 15. Am J Hum Genet 1992;50:1348-1350.
33. Kalousek DK, Howard-Peebles PN, Olson SB, Barrett IJ, Dorfmann A, Black SH, et al. Confirmation of CVS mosaicism in term placentae and high frequency of intrauterine growth retardation association with confined placental mosaicism. Prenat Diagn 1991;11:743-750.
34. Johnson A, Wapner RJ, Davis GH, Jackson LG. Mosaicism in chorionic villus sampling: an association with poor perinatal outcome. Obstet Gynecol 1990;75:573-577.
35. Yong PJ, Barrett IJ, Kalousek DK, Robinson WP. Clinical aspects, prenatal diagnosis, and pathogenesis of trisomy 16 mosaicism. J Med Genet 2003;40:175-182.

