Pain control in pregnancy การระงับปวดในระหว่างตั้งครรภ์
Pain control in pregnancy
การระงับปวดในระหว่างตั้งครรภ์
พญ.ลลิตา ประดิษฐ์
อาจารย์ที่ปรึกษา อ.พญ.สุพัตรา ศิริโชติยะกุล
สตรีตั้งครรภ์หลายท่านมีความจำเป็นต้องใช้ยาระงับปวดจากหลายสาเหตุ ทั้งที่เป็นการเจ็บปวดแบบเฉียบพลันและเรื้อรัง โดยหากมีการระงับปวดที่ไม่เพียงพอ อาจนำไปสู่ผลกระทบต่อทั้งสุขภาพกายและสุขภาพใจในระยะยาวได้ แต่อย่างไรก็ตาม ต้องมีการเลือกใช้ยาอย่างเหมาะสม ไม่ส่งผลกระทบต่อการตั้งครรภ์และในระยะการให้นมบุตร
กลไกการทำงานของยาแก้ปวดแต่ละชนิด (Mechanisms of action)
ยาระงับปวดกลุ่มที่ไม่ใช่โอปิออยด์ (Non-opioids)
1. พาราเซตามอล (Paracetamol)
ยังไม่ทราบกลไกที่แน่ชัด แต่พบว่ามีฤทธิ์ในการยับยั้งการสร้างพรอสตาแกลนดินแบบอ่อนๆ ( Weak inhibitor of prostaglandin synthesis) และเป็น selective cox-2 inhibitor(1) มีทั้งรูปแบบรับประทานและรูปแบบฉีด เป็นยาที่ใช้ได้อย่างปลอดภัย และอันตรกิริยาระหว่างยาต่ำ (Drug interaction)
2. ยาบรรเทาอาการอักเสบที่ไม่ใช่สเตียรอยด์ (Non-steroidal anti-inflammatory drugs: NSAIDS)
โดยปกติเมื่อมีการบาดเจ็บของเนื้อเยื่อ(2) ฟอสโฟลิปิดที่เยื่อหุ้มเซลล์จะถูกเอนไซม์ phospholipase A2 สลายออกมาเป็น Arachidonic acid จากนั้นจะมีเอนไซม์ cyclooxygenase ( COX-1 and COX-2) ที่ร่างกายสร้างขึ้น เข้ามาเปลี่ยนเป็น prostaglandins และ Thromboxanes
COX-1 เป็น housekeeper ทำให้เกิด cytoprotective prostaglandins ทำหน้าที่ปกป้อง gastric mucosal lining, เพิ่ม GFR จากการทำให้เกิด afferent arteriolar vasodilatation เพิ่ม platelet aggregation เป็นต้น
COX-2 เป็นเอนไซม์ที่ทำให้เกิดการอักเสบ กระตุ้นให้มีไข้ ทำให้เกิดอาการปวด และลด platelet aggregation
NSAIDS ทำหน้าที่ยับยั้งการทำงานของเอนไซม์ COX จึงช่วยลดการสร้าง prostaglandins ลดการอักเสบและการเกิดไข้ได้
ยาระงับปวดกลุ่มโอปิออยด์ (opioids)
- Codeine เป็นยาโอปิออยด์ที่ได้จากธรรมชาติ ความสามารถในการจับกับ opioid receptor ต่ำ ทำให้ฤทธิ์ในการระงับปวดต่ำ(3) แต่เมื่อเข้าสู่ร่างกาย จะถูกเปลี่ยนไปเป็นมอร์ฟีน(Morphine) โดยที่แต่ละบุคคล ร่างกายจะมีความสามารถในการเปลี่ยน codeine ไปเป็นมอร์ฟีนได้ต่างกัน ขึ้นกับปัจจัยทางด้านพันธุกรรม ความหลากหลายของ cytochrome P450 isoenzyme CYP2D6(4) เป็นตัวกลางหลักที่ใช้ในการ metabolize codeine โดยปกติจะแบ่งเป็น poor, intermediate, extension และ ultra-rapid metabolizer โดยในคนผิวขาวพบว่าเป็นกลุ่ม ultra-rapid metabolizer (duplications of the CYP2D6 gene) ได้ถึงร้อยละ 7 ถึง 10 ประเทศเอธิโอเปียพบได้ร้อยละ 29 ประเทศจีนร้อยละ 0.5 และประเทศไทยพบได้ร้อยละ 1 (5)
- Dihydrocodeine (DHC) ทำงานคล้ายกับ codeine แต่เปลี่ยนไปเป็น active metabolize น้อยมาก ในกลุ่ม extensive metabolize เปลี่ยน DHC เป็นมอร์ฟีนน้อยกว่าร้อยละ 10
- Tramadol เป็นโอปิออยด์สังเคราะห์ที่ใช้กับอาการปวดระดับปานกลางจนถึงรุนแรง ถูกเปลี่ยนแปลงโดยเอนไซม์หลายชนิดที่สำคัญคือ CYP2D6 และ CYP3A4 และทำให้เกิด active metabolize หลายชนิด แต่ชนิดที่สำคัญและจับกับ μ-opioid receptor ได้ดีกว่า tramadol อีกทั้งมีฤทธิ์ระงับปวดแรงกว่า tramadol หลายเท่า คือ O-demethylated metabolite (หรือ O-desmethyltramadol) แม้ว่า tramadol จะปลอดภัยกว่ายาหลายชนิดในกลุ่มโอปิออยด์ แต่เป็นยาที่ออกฤทธิ์แรงรวมถึงมีฤทธิ์กดการหายใจ ทำให้เสี่ยงต่อการกดระบบหายใจที่รุนแรง เช่น หายใจหอบ หายใจลำบาก แน่นหน้าอก เป็นต้น
- Morphine ใช้รักษาอาการปวดระดับปานกลางจนถึงรุนแรง โดยจับกับ μ-opioid receptor โดยตรงที่ระบบสมองส่วนกลาง(6)
การใช้ยาระงับปวดในระยะก่อนคลอด (Antepartum analgesia)
– พาราเซตามอล เป็นยาตัวแรกที่มักเลือกใช้ในการระงับปวดระดับน้อยถึงปานกลาง ไม่พบว่าก่อให้เกิดอันตรายต่อทารกในครรภ์และไม่เพิ่มอัตราการแท้ง(7)
– แอสไพริน(Aspirin) เป็นยาที่ใช้ในการระงับปวด ลดไข้ และใช้กันแพร่หลายในการป้องกันภาวะแทรกซ้อนต่าง ๆ ในระหว่างตั้งครรภ์(8) เช่น ป้องกันการเกิดครรภ์เป็นพิษ เป็นต้น จากการศึกษา meta-analysis พบว่าไม่ทำให้เกิดการพิการโดยกำเนิดของทารกในครรภ์ แต่มีบางการศึกษาพบว่าการใช้แอสไพรินในช่วงไตรมาสแรกอาจจะเพิ่มความเสี่ยงของการเกิด gastroschisis ของทารกในครรภ์(9)
– NSAIDS
ก่อนอายุครรภ์ 30 สัปดาห์
มีการศึกษาแบบ case control และ population-base observation(10) ในกลุ่มสแกนดิเนเวีย หากใช้ยากลุ่มนี้ในช่วงไตรมาสแรกของการตั้งครรภ์พบว่าเพิ่มความเสี่ยงในการแท้งเมื่อเทียบกับกลุ่มที่ไม่ได้ใช้ยากลุ่มนี้ แต่ไม่มีการศึกษาที่พบว่าส่งผลกระทบโดยตรงกับทารกในครรภ์ (Teratogenic effect) แต่อย่างไรก็ตาม การศึกษาดังกล่าวเป็นเพียงการศึกษาแบบ retrospective ไม่มีการควบคุมกลุ่มตัวอย่างและไม่มีการแจกแจงถึงข้อบ่งชี้การใช้ยาและโรคประจำตัวของกลุ่มประชากร เป็นต้น องค์การอาหารและยาแห่งสหรัฐอเมริกา (U.S. Food and Drug Administration:FDA) จึงแนะนำให้หลีกเลี่ยงการใช้ยากลุ่มนี้ระหว่างตั้งครรภ์ในช่วงแรก แต่หากมีความจำเป็นต้องใช้ ควรใช้ในระยะเวลาสั้น
หลังอายุครรภ์ 30 สัปดาห์
เนื่องจากยาเป็น COX-inhibitor ในทารก cyclooxygenase เป็นสารที่ช่วยให้เส้นเลือด ductus arteriosus และหลอดเลือด pulmonary ขยายตัว (Potent dilator) เพราะฉะนั้นยาอาจทำให้เกิด ductus arteriosus ปิดตัว เกิด pulmonary hypertension และลดปริมาณเลือดที่ไต ทำให้ทารกสร้างปัสสาวะลดลง ส่งผลให้น้ำคร่ำลดลงได้(11)
– Opioids สามารถใช้ได้ โดยไม่ก่อให้เกิดการพิการแต่กำเนิดหรือการแท้งเพิ่มขึ้น แต่การใช้ในระยะยาว อาจก่อให้เกิดการติดยา และต้องการยาในปริมาณสูงขึ้นเรื่อย ๆ และหากใช้อย่างต่อเนื่องในระยะใกล้คลอด ทารกที่เกิดมาอาจมีอาการของ neonatal withdrawal syndrome ได้
– อื่น ๆ เช่น gabapentin ที่มักใช้ใน neuropathic pain และกลุ่ม anti-depressant ที่อาจช่วยลดการใช้โอปิออยด์ลงได้ พบว่าไม่ก่อให้เกิดการพิการแต่กำเนิดของทารกหรือผลต่อการตั้งครรภ์ในด้านอื่น ๆ
การใช้ยาระงับปวดในระยะคลอด (Intrapartum anesthesia and analgesia)
สรีรวิทยาของการเจ็บครรภ์คลอด
ในระยะแรกของการเจ็บครรภ์คลอด (First stage of labor) การเจ็บครรภ์คลอดเกิดจากการหดรัดตัวของมดลูกและการยืดขยายของปากมดลูก โดยจะรับความรู้สึกผ่านเส้นประสาท sympathetic และส่งเข้าสู่เส้นประสาทไขสันหลังระดับ T10-L1 ส่วนการเจ็บครรภ์ในระยะที่สอง (Second stage of labor) เกิดจากการที่ศีรษะทารกเคลื่อนต่ำลง ทำให้เกิดการยืดขยายของอวัยวะสืบพันธุ์ช่วงล่าง โดยนำกระแสประสาทผ่านทางเส้นประสาท pudendal และเส้นประสาท sacral ระดับ S2-4 ซึ่งเส้นประสาทนี้จะทอดตัวอยู่ใต้ sacrospinous ligament ที่ติดกับ ischial spine(12)
หลักการในการให้ยาระงับปวด
การเลือกช่องทางการให้ยาและชนิดของยาขึ้นกับหลายปัจจัย เช่น ความต้องการของผู้ป่วย ข้อจำกัดทางด้าน สุขภาพ ข้อบ่งห้ามการใช้ยา เป็นต้น
1. การให้ยาระงับปวดแบบฉีดเข้าหลอดเลือด (Parenteral/systemic analgesia)
ข้อดี – ราคาถูก บริหารยาง่าย ไม่ต้องใช้ผู้เชี่ยวชาญพิเศษ
ข้อเสีย – ผลข้างเคียงจากยาค่อนข้างมาก เช่น คลื่นไส้อาเจียน ง่วงซึม ยาผ่านรกส่งผลเสียต่อทารกในครรภ์ได้ เช่น กดการหายใจ และผลข้างเคียงที่เกิดกับทารกจะอยู่ได้นานกว่า เนื่องจากเด็กขับยาออกได้ช้ากว่าผู้ใหญ่
ยาที่ใช้ทางช่องทางนี้มีหลายตัว มักเป็นยากลุ่ม narcotics และกลุ่มยากล่อมประสาท (sedatives) โดยยาที่เป็นที่นิยมใช้กันมีดังนี้
- Meperidine (Pethidine)
เป็นยากลุ่ม narcotics ที่มักใช้ในทางสูติกรรม แต่ปัจจุบันความนิยมลดลง เนื่องจากยาสามารถผ่านรกได้อย่างรวดเร็วเข้าสู่ทารก และปริมาณยาในทารกสูงกว่ามารดา รวมทั้งระยะครึ่งชีวิตของยาในทารกค่อนข้างยาวนาน ทำให้ฤทธิ์ในการกดการหายใจในทารกยาวนานอีกด้วย - Morphine เป็นยาต้นแบบของยากลุ่มโอปิออยด์ มีฤทธิ์ในการกดการหายใจของทารกได้มาก นอกจากนี้หากใช้ยาในขนาดสูงนอกจากจะกดการหายใจแล้วยังกดการทำงานของกล้ามเนื้อหัวใจได้โดยตรง รวมทั้งส่งผลต่อการหดรัดตัวของมดลูก จึงไม่เป็นที่นิยมใช้
- Fentanyl ออกฤทธิ์เร็ว สามารถผ่านรกได้ แต่มีผลต่อการกดการหายใจของทารกและการหดรัดตัวของมดลูกน้อยมาก แต่ไม่เป็นที่นิยมใช้เนื่องจากระยะเวลาในการออกฤทธิ์ค่อนข้างสั้น อาจต้องให้ยาทุก 1 ชั่วโมง
- Nalbuphine/Butorphanol ออกฤทธิ์เป็น mixed opioid receptor agonist-antagonist มีผลกดการหายใจน้อยกว่ายาตัวอื่น แต่ประสิทธิภาพการระงับปวดก็ต่ำลงด้วย
- Remifentanil มีคุณสมบัติเป็น ultrashort-acting opioid without active metabolite ทำให้การปรับระดับยาง่าย กดการหายของทารกน้อย มักเป็นที่นิยมใช้ใน patient-controlled intravenous infusion แต่อย่างไรก็ดี มีรายงานว่าพบการเกิด apnea ได้ถึงร้อยละ 26 ดังนั้นหากต้องการใช้ยาตัวนี้ควรจะมีการติดตามการหายใจอย่างใกล้ชิด แนะนำให้มีพยาบาล 1 คนต่อผู้ป่วย 1 คน รวมทั้งเตรียมพร้อมสำหรับการให้ oxygen support(13)
ตารางที่1 แสดงการบริหารยาทางหลอดเลือดดำที่ใช้บ่อยในระยะเจ็บครรภ์คลอด
|
Drug |
Dosage and Route |
Onset |
Duration |
Elimination (Maternal) |
|
Fentanyl |
50-100 mcg IV q 1 hr. PCA: load 50 mcg then 10-25 mcg q 10-12 min. |
2-4 min. |
30-60 min. |
3 hr. |
|
Meperidine |
25-5o mg IV q 1-2 hr. 50-100 mg IM q 2-4 hr. |
5 min. (IV)
30-45 min. (IM) |
2-4 hr. |
3-8 hr. |
|
Morphine |
2-5 mg IV 5-10 mg IM |
10 min. (IV) 30 min. (IM) |
1-3 hr. |
2 hr. |
|
Butorphanol |
1-2 mg IV, IM |
5-10 min. (IV) 30-60 min. (IM) |
4-6 hr. |
2-5 hr. |
|
Remifentanil |
0.15-0.5 mcg/kg q 2 min. as PCA |
20-90 sec |
3-4 min. |
9-10 min. |
2. การให้ยาระงับปวดเฉพาะส่วน (Regional/Neuraxial analgesia)
ข้อดี ประสิทธิภาพในการระงับปวดสูง ไม่ส่งผลต่อการหดรัดตัวของมดลูก สามารถให้ได้ทั้งการคลอดทางช่องคลอดและการผ่าตัดคลอด
ข้อเสีย ต้องใช้แพทย์เชี่ยวชาญเฉพาะด้าน หากใช้ไม่เหมาะสมอาจส่งผลเสียต่อทั้งมารดาและทารกได้
ข้อบ่งห้ามเด็ดขาดในการทำ neuraxial anesthesia (Absolute contraindication)
- ผู้ป่วยปฏิเสธการทำหัตถการ
ข้อบ่งห้ามที่ควรพิจารณาในการทำ neuraxial anesthesia (Relative contraindications) - ความผิดปกติของการแข็งตัวของเลือด หรือเกล็ดเลือดต่ำ น้อยกว่า 70,000/มล.
- ความดันโลหิตต่ำ
- มีการใช้ low-molecular weight heparin ในช่วง 12 ชั่วโมงที่ผ่านมา
- ผิวหนังติดเชื้อบริเวณที่จะแทงเข็ม
- ติดเชื้อในกระแสเลือดที่ยังไม่ได้รับการรักษา
- มีรอยโรคในสมองที่ทำให้เกิดความดันในกะโหลกศีรษะสูง
2.1 Spinal-injection anesthesia
เป็นการฉีดยากลุ่มยาชา (local anesthetic) และยากลุ่มโอปิออยด์เข้าสู่ subarachnoid space เพื่อลดการใช้ปริมาณยาทั้งสองลง
ข้อดี – ทำได้ง่าย ประสิทธิภาพในการระงับปวดดี ออกฤทธิ์เร็ว และระยะเวลาออกฤทธิ์นาน
ข้อเสีย – เป็นการให้ยาแบบ single-shot ทำให้ไม่สามารถปรับระดับยาและระดับการยับยั้งการเจ็บปวดได้
- เกิดภาวะความดันโลหิตต่ำ จากการยับยั้งระบบประสาท sympathetic ป้องกันได้ด้วยจัดท่าให้ผู้ป่วยนอนตะแคงซ้ายและการให้สารน้ำทางหลอดเลือดดำก่อนทำหัตถการ
- การเกิด postdural puncture headache ลดความเสี่ยงได้โดยการใช้เข็มเบอร์เล็กปลายกลม ไม่แทงเข็มหลายครั้ง ซึ่งบางรายอาจมีอาการอยู่ได้หลายวัน ในรายที่เป็นรุนแรงอาจต้องให้การรักษาโดยใช้ epidural blood patching
- บล็อกระดับสูง (high blockade) ทำให้หยุดหายใจและหัวใจหยุดเต้นได้
- อื่น ๆ เช่น อาการคัน, bladder dysfunction, คลื่นไส้อาเจียน เป็นต้น
2.2 Continuous spinal anesthesia
มักไม่ใช้ใน labor pain เนื่องจากมีความเสี่ยงในการเกิด postdural puncture headache มาก มักใช้ใน cesarean section มากกว่า
2.3 Epidural analgesia
เป็นการวางสาย catheter เพื่อฉีดยาชาเข้าสู่ epidural space ตัวยามักผสมกันระหว่างยาชา (local anesthetic) และยากลุ่มโอปิออยด์ โดยใช้ยาชาในระดับความเข้มข้นต่ำ ทำให้ยับยั้งระบบประสาทมอเตอร์น้อย ยาที่มักใช้ของกลุ่มยาชา คือ Bupivacaine หรือ Ropivacaine ร่วมกับกลุ่มโอปิออยด์ เช่น Fentanyl หรือ Sufentanil เป็นต้น นอกจากนี้บางสถาบันยังผสม epinephrine (very dilute dose 1:200,000) เพื่อเพิ่มระยะการออกฤทธิ์ของยาชา สามารถให้ยาได้ทั้งแบบ bolus และ continuous infusion โดยมีการศึกษาแบบ systematic review พบว่าการให้ยาแบบ continuous infusion (with or without PCA) ไม่เพิ่มอัตราการผ่าคลอดเมื่อเทียบกับกลุ่ม bolus เป็นที่นิยมใช้กันมากขึ้นโดยเฉพาะประเทศที่พัฒนาแล้วโดยเรียกว่า painless labor(14) มีข้อดีกว่า spinal block ที่สามารถควบคุมระยะเวลาและระดับยาได้ดีกว่า ใช้ระดับยาน้อยกว่า ทำให้เกิดความดันโลหิตต่ำได้น้อย ยับยั้งระบบประสาทมอเตอร์ต่ำ ไม่มีอาการปวดศีรษะหลังทำหัตถการ
2.4 Combined spinal-epidural analgesia
ข้อดี ใช้ปริมาณยาชาน้อยกว่า epidural anesthesia, ออกฤทธิ์เร็วกว่าจากการมี spinal component จาก Cochrane review(15) พบว่า ไม่มีความแตกต่างกันของเรื่อง patient morbidity, labor augmentation, urinary retention รวมถึงอัตราการผ่าคลอดหรือการใช้หัตถการช่วยคลอด เมื่อเทียบกับ epidural anesthesia
ข้อเสีย ผลข้างเคียงเรื่องการคันมากกว่า พบ fetal bradycardia(16) มากขึ้นจากการที่มดลูกหดรัดตัวแรงขึ้น
3. การให้ยาระงับปวดเฉพาะที่ (Local anesthesia)(12)
เป็นการใช้ยาชาเฉพาะที่ โดยทั่วไปทำงานโดยการไปยับยั้ง Na channel อาจให้ร่วมกับ epinephrine เพื่อเพิ่มระยะเวลาการออกฤทธิ์ของยา แต่ทั้งนี้ต้องระวังการฉีดยาเข้าสู่หลอดเลือดซึ่งทำให้เกิดผลข้างเคียงตามมาได้ เช่น หัวใจเต้นเร็ว หัวใจเต้นผิดจังหวะ กดการทำงานของกล้ามเนื้อหัวใจ ความดันโลหิตสูงขึ้น ชัก เป็นต้น โดยหากเกิดผลข้างเคียงเหล่านี้ต้องรักษาโดยการให้ lipid emulsion โดยการดูแลอย่างใกล้ชิดของวิสัญญีแพทย์
ข้อบ่งห้ามของการใช้ยาชาเฉพาะที่
- ผู้ป่วยที่มีปัญหาการทำงานของหัวใจ หลีกเลี่ยงในมารดาที่มีอัตราการเต้นของหัวใจที่เร็ว
- มีประวัติแพ้ยาชา
Pudendal nerve block
เป็นการฉีดยาชาเพื่อไปบล็อก pudendal nerve(S2-4) ที่ไปเลี้ยงยัง perineum, anus, vulva และ clitoris หลังจากนั้นจะวกผ่าน sacrospinous ligament ที่ยึดอยู่กับ ischial spine มักใช้ในการคลอดทางช่องคลอด เมื่อศีรษะเด็กเคลื่อนต่ำลงมาแล้วกระตุ้นการทำงานของเส้นประสาท pudendal
วิธีทำ pudendal nerve block(12)
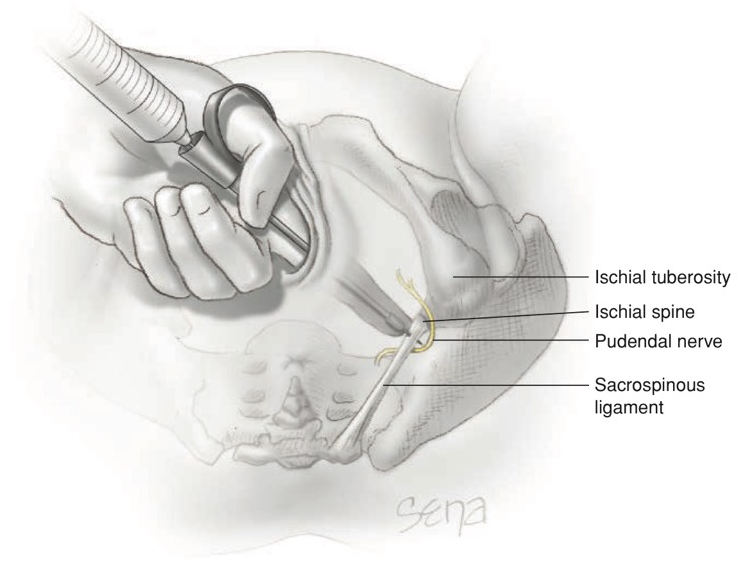
ภาพแสดงการทำ pudendal nerve block (12)
- ใช้เข็มเบอร์ 22 ยาว 15 ซม. ใส่ Iowa trumpet สอดเข้าช่องคลอด ให้ปลาย Iowa trumpet อยู่บริเวณ ischial spine
- สอดเข็มให้อยู่ในชั้นเยื่อบุช่องคลอดดูดดูว่าปลายเข็มไม่ได้อยู่ในหลอดเลือด หลังจากนั้นฉีดยาชาลงไป 1 มล.
- ดันปลายเข็มให้อยู่ในชั้น sacrospinous ligament แล้วฉีดยาชาไป 3 มล.
- ดันปลายเข็มเข้าสู่ loose areolar tissue ฉีดยาอีก 3 มล.
- ถอนเข็มออกมาให้อยู่บริเวณเหนือ ischial spine แล้วฉีดยาชาเข้าบริเวณเยื่อบุช่องคลอดอีก 3 มล.
- ทำเช่นเดียวกันทั้ง 2 ข้าง รอยาชาออกฤทธิ์ 3-4 นาที แล้วทดสอบการชาบริเวณปากช่องคลอด
Paracervical block
เป็นการบล็อกเส้นประสาทบริเวณปากมดลูก มักใช้ในระยะแรกของการเจ็บครรภ์คลอด โดยมักใช้เป็น 1%lidocaine หรือ 3%chloroprocaine โดยฉีดที่ตำแหน่ง 3 และ 9 นาฬิกา โดยฉีดยาชาข้างละ 5-10 มล. ผลข้างเคียงที่พบได้คือ เกิด fetal bradycardia ได้ร้อยละ 15 เกิดจากการที่ยาไปทำให้หลอดเลือดหดเกร็งและมดลูกหดตัวแรงขึ้น
ตารางที่ 2 แสดงยาที่ใช้บ่อยทางสูติกรรม(12)
|
Anesthetic agent |
Usual conc.(%) |
Usual volume (ml) |
Onset |
Duration (min) |
Max dose (mg) |
Clinical use |
|
Aminoesters |
||||||
|
2-chloroprocaine |
2 3 |
10-20 10-20 |
Rapid |
30-60 30-60 |
800 |
Local Epidural only c/s |
|
Aminoamides |
||||||
|
Bupivacaine |
0.0625-0.125 0.75 |
10-15 1.5-2 |
Slow |
60-90 60-120 |
175 |
Epidural for labor Spinal for c/s |
|
Lidocaine |
1-1.5 1.5-2 5 |
10-20 5-20 1.5-2 |
Rapid |
30-60 60-90 45-60 |
300 |
Local Epidural for labor, c/s Spinal for D&C |
|
Ropivacaine |
0.08-0.2 0.5-1 |
5-10 10-30 |
Slow |
60-90 90-150 |
200 250 |
Epidural for labor Epidural for c/s |
4.Inhaled agent
แก๊สที่ใช้คือ Nitrous oxide ผสมแก๊ส oxygen ในอัตราส่วน 50 ต่อ 50 ประสิทธิภาพการระงับปวดต่ำว่ากลุ่ม regional analgesia แต่มีข้อดีคือ ไม่มีผลกับมารดา ออกฤทธิ์เร็ว หมดฤทธิ์เร็ว ผ่านรกได้แต่กำจัดออกเร็วมาก และผู้ป่วยสามารถควบคุมการใช้งานเองได้ แต่ข้อเสียคือ ต้องมีการสูดดมอย่างถูกวิธี ยาจึงจะได้ประสิทธิภาพ ผลข้างเคียง เช่น คลื่นไส้อาเจียน วิงเวียนศีรษะ ง่วงซึม เป็นต้น(17)
5.General anesthesia
ไม่เป็นที่นิยมในทางสูติกรรม ต้องมีความระมัดระวังหลายอย่างในการใช้งาน เนื่องจากคนท้องมีความเสี่ยงของการสำลักมากขึ้น การจัดการทางเดินหายใจยากขึ้นจากการที่มีการบวมของเนื้อเยื่อต่าง ๆ ทำให้โอกาสการใส่ท่อช่วยหายใจยากขึ้น มีการศึกษาพบอัตราการเกิดความไม่ประสบความสำเร็จในคนท้องเมื่อเทียบกับคนทั่วไปเป็น 1:224 และ 1:390 ตามลำดับ (18, 19) ตัวยามีผลต่อการหดรัดตัวของมดลูก รวมทั้งยาดมสลบทุกตัวกดระบบประสาทมารดาและผ่านรกได้อาจมีภาวะแทรกซ้อนที่รุนแรงต่อทั้งมารดาและทารก จึงไม่เป็นที่นิยมใช้
Special situation
ภาวะครรภ์เป็นพิษ (Pre-eclampsia)
แนะนำให้ทำเป็น neuraxial analgesia เนื่องจากช่วยลดการหลั่งของ catecholamine ในช่วงเจ็บครรภ์คลอด(20) ทำให้ควบคุมความดันได้ง่ายขึ้น แต่อย่างไรก็ดีต้องระวังความดันโลหิตที่ต่ำเร็วเกิน และการให้สารน้ำระหว่างที่ทำหัตถการเนื่องจากมีโอกาสเกิด pulmonary edema ได้ รวมทั้งในผู้ป่วยกลุ่ม HELLP syndrome ต้องระวังเรื่อง coagulopathy รวมถึงค่าเกล็ดเลือดที่ต่ำกว่า 70,000/มล.หากมีความจำเป็นต้องทำ general anesthesia ต้องระวังในการใส่ท่อช่วยหายใจเนื่องจากเนื้อเยื่อบริเวณคอจะบวมมาก รวมทั้งการใส่ท่อช่วยหายใจและการ maintain airway อาจจะกระตุ้นให้เกิดความดันโลหิตสูงขึ้นได้ อาจต้องมีการให้ opioids หรือยากลุ่ม B-blocker นำไปก่อน(21)
การจัดการความปวดของมารดาในระยะคลอดโดยไม่ใช้ยา
(Non-pharmacological methods for relief of labor pain)
นอกจากการใช้ยาระงับปวดแล้ว ยังมีวิธีการจัดการความปวดอีกมากมายเพื่อช่วยลดปริมาณการใช้ยา โดยทั้งการจัดสิ่งแวดล้อม และลดปัจจัยกระตุ้นการเจ็บปวดต่าง ๆ ทั้งนี้ขอยกตัวอย่างวิธีการจัดการความเจ็บปวดที่พบได้ในปัจจุบัน ดังนี้
- การสะกดจิต (Hypnosis) เป็นเทคนิคที่ต้องได้รับการฝึกจากผู้เชี่ยวชาญอย่างใกล้ชิด เพื่อลดความเครียดและความวิตกกังวล และเพิ่มความผ่อนคลาย โดยมักเข้าเรียนเป็นโปรแกรมระยะยาว มักเริ่มตั้งแต่อายุครรภ์ 30 สัปดาห์ เข้าฝึกสัปดาห์ละ 1 วัน วันละ 2 ชั่วโมง โดยเป็นการฝึกจิตตัวเอง (Self-hypnosis) ในการจัดการและรับรู้ความเจ็บปวด อาจใช้เป็นการนึกถึงสถานที่สงบเพื่อลดการรับรู้เรื่องความเจ็บปวดที่เกิดขึ้น มีการศึกษาว่าไม่ส่งผลกระทบต่อมารดาและทารกในครรภ์ แต่พบว่าระยะคลอดยาวนานขึ้นในกลุ่มนี้ รวมทั้งเป็นเทคนิคที่ทำได้ยาก ความล้มเหลวสูงหากไม่ได้รับการฝึกมาเป็นอย่างดี(22)
- การฝังเข็ม (Acupuncture) เป็นศาสตร์ทางประเทศจีนที่ใช้กันมาอย่างยาวนาน โดยสามารถใช้ได้ในหลายแง่มุม รวมทั้งการเจ็บครรภ์คลอดด้วย โดยเชื่อว่าการฝังเข็มไปตามจุดต่าง ๆ จะไปยับยั้งการนำกระแสประสาทที่จะนำความเจ็บปวดขึ้นไปยังสมองส่วนกลาง รวมทั้งเพิ่มการหลั่งสาร endorphins ด้วย โดยทั่วไปมักเริ่มทำตั้งแต่อายุครรภ์ใกล้คลอดหลายสัปดาห์ แต่ก็มีข้อจำกัดหลายอย่าง ที่ทำให้ไม่เป็นที่นิยม เนื่องจากจำกัดท่าทางของมารดาระหว่างรอคลอด และมีหลายการศึกษาพบว่าระดับการหลั่งสาร endorphins ไม่ต่างกันเมื่อเทียบกับกลุ่มที่ไม่ได้ฝังเข็ม(23)
- การใช้กระแสไฟฟ้ากระตุ้น (Transcutaneous Electrical Nerve Stimulation: TENS) เป็นการติด electrodes ไว้ที่ผิวหนังบริเวณกล้ามเนื้อหลังคนไข้บริเวณ T10-L1 ทั้งสองข้าง และอาจย้ายลงไปที่ตำแหน่งก้นกบในระยะที่สองของการคลอด แล้วปล่อยกระแสไฟฟ้ากระตุ้น กลไกการทำงานไม่ทราบแน่ชัด แต่คาดว่ากระแสไฟฟ้าที่ปล่อยไปจะไปจัดการกับตัวนำกระแสประสาทที่รับรู้เรื่องการเจ็บปวดที่สมองส่วน substantia gelatinosa และกระตุ้นการหลั่ง endogenous opioids พบว่าไม่ส่งผลต่อทารกในครรภ์แต่ยังไม่เป็นที่นิยมใช้กัน(24)
- การสัมผัสและการนวด (Touch and massage) หลักการทำงานคล้ายกับการกระตุ้นด้วยกระแสไฟฟ้า แต่เป็นการใช้การกดนวดแทน โดนอาจจะเป็นตัวมารดาเองหรือสามีก็ได้ อาจจะใช้นิ้วมือ ฝ่ามือ หรือแขนก็ได้
- การใช้สุคนธบำบัด (Aromatherapy) เป็นการใช้น้ำมันหอมระเหยที่สกัดจากธรรมชาติ เช่น lavender, neroli เป็นต้น กลไกการลดการเจ็บปวดไม่สามารถอธิบายได้ แต่เชื่อว่าเป็นการจัดสิ่งแวดล้อมให้ผ่อนคลายขึ้น แต่ทั้งนี้อาจต้องระวังกลุ่มผู้แพ้ง่าย หรือกลิ่นอาจกระตุ้นให้เกิดอาการวิงเวียน คลื่นไส้อาเจียนได้
- การบำบัดด้วยน้ำ (Hydrotherapy) เป็นการให้มารดาแช่ในน้ำอุ่นหรือน้ำธรรมดาเพื่อช่วยผ่อนคลาย ลดความตึงเครียดในระยะคลอด สามารถลดความเจ็บปวดได้โดยเชื่อว่าไปกระตุ้นการหลั่ง endorphins ทำให้มีการไหลเวียนเลือดดีขึ้น น้ำที่ใช้ไม่ควรมีอุณหภูมิสูงเกิน 37 องศา อ่างควรกว้างและยาว 4×8 ฟุต และลึก 20 นิ้ว โดยควรเริ่มแช่ในระยะปากมดลูกเปิดเร็ว (Active phase) เนื่องจากมีการศึกษาพบว่าการเริ่มแช่ตั้งแต่ระยะปากมดลูกเปิดช้า (Latent phase) จะทำให้การดำเนินการคลอดล่าช้าขึ้น แต่ควรระวังในมารดาที่ถุงน้ำคร่ำแตกแล้ว เนื่องจากอาจชักนำให้เกิดการติดเชื้อได้(25)
การระงับปวดหลังคลอด (Postpartum analgesia)
ข้อระวังในการใช้ยาแก้ปวดในช่วงนี้คือยาอาจผ่านน้ำนมไปมีผลกับทารกได้ ดังนั้นควรให้การรักษาด้วยวิธี multimodal คือใช้ยาหลายตัวที่ออกฤทธิ์แตกต่างกันไป โดยใช้ stepwise approach ของ World Health Organization (WHO) เพื่อลดปัญหาการใช้ยากลุ่มโอปิออยด์เกินขนาดและช่วยลดระยะเวลาการนอนโรงพยาบาล รวมถึงกระตุ้นให้เกิด enhance recovery after surgery (ERAS) อีกด้วย
Step1: ใช้กับอาการปวดระดับน้อย โดยใช้เป็นยากลุ่ม paracetamol หรือ NSAIDS
Step2: ใช้กับอาการปวดระดับปานกลาง โดยเพิ่มยากลุ่ม weak opioids เข้าไป เช่น codeine, tramadol, hydrocodone, oxycodone เป็นต้น
Step3: ใช้กับอาการปวดระดับรุนแรง เป็นการเพิ่มยากลุ่ม strong opioids เช่น parenteral morphine, fentanyl เป็นต้น
Vaginal delivery
สาเหตุของอาการปวดหลักๆหลังคลอดทางช่องคลอด คือ การคัดตึงเต้านม การปวดจากการหดรัดตัวของมดลูก และการปวดบริเวณฝีเย็บ
- คัดตึงเต้านม (Breast engorgement), เจ็บหัวนม (nipple pain)
รักษาโดยไม่ใช้ยา เช่น การประคบร้อน, การใส่ breast shield
รักษาโดยใช้ยา หากอาการไม่ดีขึ้นอาจให้ยาจำพวก NSAIDS ได้
- มดลูกหดรัดตัว (Uterine cramping/afterpains)
รักษาโดยไม่ใช้ยา เช่น การประคบร้อนบริเวณท้อง
รักษาโดยใช้ยา ยากลุ่ม NSAIDS มีประสิทธิภาพสูงกว่าพาราเซตามอล ส่วนยากลุ่มโอปิออยด์ ยังไม่มีการศึกษาที่มีข้อสรุปว่าใช้ได้ดีในเรื่องนี้
- เจ็บฝีเย็บ (Perineal pain)
รักษาโดยไม่ใช้ยา เช่น การประคบเย็นในช่วงวันแรก ช่วยลดอาการบวมได้
รักษาโดยใช้ยา tropical anesthesia มีการศึกษาเปรียบเทียบพบว่าประสิทธิภาพไม่ต่างไปจาก placebo
การผ่าตัดคลอด (Caesarian section)
ใช้หลักการ stepwise approach ได้ โดยการให้ dexamethasone 1 dose ในช่วงผ่าตัด ช่วยลดอาการปวดและลดผลข้างเคียงเรื่องคลื่นไส้อาเจียนได้
Gabapentin ไม่แนะนำให้ใช้ เนื่องจากไม่มีข้อมูลที่ชัดเจนในเด็กทารก แต่อย่างไรก็ตามสามารถใช้ได้ในกรณีที่มารดามีประวัติ chronic pain ที่ไม่ตอบสนองต่อการรักษาด้วยยาทั่วไป
Discharge medication
ในการพิจารณาว่ายาตัวใดขับออกผ่านน้ำนมได้มากน้อยเพียงใดมีหลายปัจจัย เช่น คุณสมบัติ lipophilic ทำให้ผ่านน้ำนมได้ดี ความสามารถในการกระจายตัวของยา(Bioavailability) ค่าความเป็นกรดด่าง โดยทั่วไปน้ำมีความเป็นกรดเมื่อเทียบกับพลาสมา ดังนั้นยาที่มีคุณสมบัติเป็นด่างจะแตกตัวได้ดีในน้ำนม ขนาดของโมเลกุลยา เป็นต้น
- พาราเซตามอล สามารถใช้ได้อย่างปลอดภัย
- NSAIDS ประสิทธิภาพของยาแต่ละตัวในกลุ่มนี้แตกต่างกันออกไป โดยตัวที่เป็นที่ยอมรับและใช้กันอย่างแพร่หลายคือ Ibuprofen ที่มีค่าครึ่งชีวิตต่ำ relative infant dose ต่ำ น้อยกว่าร้อยละ1
- Opioids มีคุณสมบัติ lipophilic, low molecular weight และเป็น weak base จึงสามารถผ่านน้ำนมได้ ควรระมัดระวังในการใช้ codeine และ tramadol เนื่องจากอาจเปลี่ยนไปเป็น active metabolite ได้มากในผู้ป่วยกลุ่ม ultra-rapid metabolizer
เอกสารอ้างอิง
- Graham GG, Davies MJ, Day RO, Mohamudally A, Scott KF. The modern pharmacology of paracetamol: therapeutic actions, mechanism of action, metabolism, toxicity and recent pharmacological findings. Inflammopharmacology. 2013;21(3):201-32.
- Vane JR, Botting RM. Mechanism of action of nonsteroidal anti-inflammatory drugs. Am J Med. 1998;104(3a):2S-8S; discussion 21S-2S.
- Trescot AM, Datta S, Lee M, Hansen H. Opioid pharmacology. Pain Physician. 2008;11(2 Suppl):S133-53.
- Pattinson KT. Opioids and the control of respiration. Br J Anaesth. 2008;100(6):747-58.
- Bernard S, Neville KA, Nguyen AT, Flockhart DA. Interethnic differences in genetic polymorphisms of CYP2D6 in the U.S. population: clinical implications. Oncologist. 2006;11(2):126-35.
- Glare PA, Walsh TD. Clinical pharmacokinetics of morphine. Ther Drug Monit. 1991;13(1):1-23.
- FDA Drug Safety Communication: FDA has reviewed possible risks of pain medicine use during pregnancy [Internet]. US Food and Drug Administration. 2015 [cited Jan20, 2021]. Available from: [https://www.fda.gov/Drugs/DrugSafety/ucm429117.htm].
- Erkan D, Patel S, Nuzzo M, Gerosa M, Meroni PL, Tincani A, et al. Management of the controversial aspects of the antiphospholipid syndrome pregnancies: a guide for clinicians and researchers. Rheumatology (Oxford). 2008;47 Suppl 3:iii23-7.
- Kozer E, Nikfar S, Costei A, Boskovic R, Nulman I, Koren G. Aspirin consumption during the first trimester of pregnancy and congenital anomalies: a meta-analysis. Am J Obstet Gynecol. 2002;187(6):1623-30.
- Nielsen GL, Sørensen HT, Larsen H, Pedersen L. Risk of adverse birth outcome and miscarriage in pregnant users of non-steroidal anti-inflammatory drugs: population based observational study and case-control study. Bmj. 2001;322(7281):266-70.
- Gloor JM, Muchant DG, Norling LL. Prenatal maternal indomethacin use resulting in prolonged neonatal renal insufficiency. J Perinatol. 1993;13(6):425-7.
- cunningham FG, Leveno KJ, L.Bloom S, S.Dashe J, Hoffman BL, M.Casey B, et al. Williams Obstetrics. 25 ed. 25, editor. New york: McGraw-Hill Education; 2018. 485-502 p.
- Stocki D, Matot I, Einav S, Eventov-Friedman S, Ginosar Y, Weiniger CF. A randomized controlled trial of the efficacy and respiratory effects of patient-controlled intravenous remifentanil analgesia and patient-controlled epidural analgesia in laboring women. Anesth Analg. 2014;118(3):589-97.
- George RB, Allen TK, Habib AS. Intermittent epidural bolus compared with continuous epidural infusions for labor analgesia: a systematic review and meta-analysis. Anesth Analg. 2013;116(1):133-44.
- Simmons SW, Taghizadeh N, Dennis AT, Hughes D, Cyna AM. Combined spinal-epidural versus epidural analgesia in labour. Cochrane Database Syst Rev. 2012;10(10):Cd003401.
- Van de Velde M, Teunkens A, Hanssens M, Vandermeersch E, Verhaeghe J. Intrathecal sufentanil and fetal heart rate abnormalities: a double-blind, double placebo-controlled trial comparing two forms of combined spinal epidural analgesia with epidural analgesia in labor. Anesth Analg. 2004;98(4):1153-9, table of contents.
- Pinyan T, Curlee K, Keever M, Baldwin KM. A Nurse-Directed Model for Nitrous Oxide Use During Labor. MCN Am J Matern Child Nurs. 2017;42(3):160-5.
- Quinn AC, Milne D, Columb M, Gorton H, Knight M. Failed tracheal intubation in obstetric anaesthesia: 2 yr national case-control study in the UK. Br J Anaesth. 2013;110(1):74-80.
- Kinsella SM, Winton AL, Mushambi MC, Ramaswamy K, Swales H, Quinn AC, et al. Failed tracheal intubation during obstetric general anaesthesia: a literature review. Int J Obstet Anesth. 2015;24(4):356-74.
- Leffert LR. What’s new in obstetric anesthesia? Focus on preeclampsia. Int J Obstet Anesth. 2015;24(3):264-71.
- Yoo KY, Kang DH, Jeong H, Jeong CW, Choi YY, Lee J. A dose-response study of remifentanil for attenuation of the hypertensive response to laryngoscopy and tracheal intubation in severely preeclamptic women undergoing caesarean delivery under general anaesthesia. Int J Obstet Anesth. 2013;22(1):10-8.
- Eappen S, Robbins D. Nonpharmacological means of pain relief for labor and delivery. Int Anesthesiol Clin. 2002;40(4):103-14.
- Hantoushzadeh S, Alhusseini N, Lebaschi AH. The effects of acupuncture during labour on nulliparous women: a randomised controlled trial. Aust N Z J Obstet Gynaecol. 2007;47(1):26-30.
- Tsen LC, Thomas J, Segal S, Datta S, Bader AM. Transcutaneous electrical nerve stimulation does not augment epidural labor analgesia. J Clin Anesth. 2001;13(8):571-5.
- Gentz BA. Alternative therapies for the management of pain in labor and delivery. Clin Obstet Gynecol. 2001;44(4):704-32.
Fetal growth restriction ภาวะทารกโตช้าในครรภ์
Fetal growth restriction
ภาวะทารกโตช้าในครรภ์
แพทย์หญิงปิ่นนภา เตอะอ้าย
อาจารย์ที่ปรึกษา อาจารย์แพทย์หญิงศิรินาถ ศิริเลิศ
ทารกโตช้าในครรภ์ หรือ fetal growth restriction (FGR) เป็นภาวะแทรกซ้อนหนึ่งของการตั้งครรภ์ พบได้ประมาณร้อยละ 10 ของการตั้งครรภ์ (1) โดยภาวะดังกล่าวส่งผลเสียต่อการเจริญเติบโต การทำงานของระบบต่าง ๆ โดยเฉพาะระบบประสาท และเพิ่มอัตราการตายปริกำเนิดขึ้นเป็น 2 เท่าหรือเสียชีวิตร้อยละ 1.5 หากทารกมีน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 10 และเพิ่มขึ้นเป็นร้อยละ 2.5 หากทารกน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 5 ของอายุครรภ์นั้น ๆ (2) นอกจากนี้ในระยะยาวจะเพิ่มโอกาสการเกิดโรคทางเมตาบอลิก เช่น โรคเบาหวาน โรคอ้วน โรคหลอดเลือดหัวใจโคโรนารี และโรคหลอดเลือดสมอง (1)
การเจริญเติบโตของทารกในครรภ์ประเมินได้จากขนาดของทารกเทียบกับอายุครรภ์ โดยจะใช้คลื่นเสียงความถี่สูง (ultrasound) มาช่วยในการประเมินว่าขนาดและน้ำหนักของทารก (estimated fetal weight) เป็นไปตามเกณฑ์ปกติของอายุครรภ์หรือไม่ โดยใช้การวัดพารามิเตอร์ของทารก (biometric parameters) ได้แก่ ความกว้างของศีรษะ (BPD; biparietal diameter) เส้นรอบวงของศีรษะ (HC; head circumference) เส้นรอบวงของท้อง (AC; abdominal circumference) และความยาวของกระดูกต้นขา (FL; femur length) โดยสมาคมเวชศาสตร์มารดาและทารก (SMFM: The Society for Maternal-Fetal Medicine) แนะนำการใช้ข้อมูลอ้างอิงขนาดและน้ำหนักของทารกในครรภ์ตามกลุ่มประชากร (population-based fetal growth references ) ในการประเมินเปรียบเทียบ (3)
การวินิจฉัยภาวะทารกโตช้าในครรภ์ เบื้องต้นจะวินิจฉัยจากน้ำหนักของทารก ซึ่งคำนวณจากการวัดพารามิเตอร์ด้วยคลื่นเสียงความถี่สูง ได้ค่าน้อยกว่าเปอร์เซ็นไทล์ที่ 10 ของอายุครรภ์นั้น ๆ เมื่อตรวจพบน้ำหนักของทารกน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สิ่งแรกที่ต้องจำแนก คือน้ำหนักตัวหรือขนาดที่น้อยของทารกเป็นภาวะโตช้าในครรภ์จริง หรือเป็นเพียงทารกตัวเล็ก (small for gestational age; SGA) เนื่องจากหากเป็นเพียงทารกตัวเล็กจะไม่มีผลกระทบต่ออัตราการเจริญเติบโตและไม่เพิ่มอัตราการเสียชีวิตในครรภ์ รวมถึงไม่ส่งผลกระทบระยะยาวต่อการพัฒนาของทารกหลังคลอด โดยเกณฑ์การวินิจฉัยมีดังนี้
เกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก The American College of Obstetricians and Gynecologists (ACOG) (2)
- ทารกตัวเล็ก (SGA) คือ ทารกที่มีน้ำหนักแรกคลอด (birth weight) น้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ
- ทารกโตช้าในครรภ์ (FGR) คือ ทารกที่มีน้ำหนัก หรือเส้นรอบวงของท้องน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ
เกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก The International Society of Ultrasound in Obstetrics and Gynecology (ISUOG) (1)
- ทารกตัวเล็ก (SGA) คือ ทารกที่มีน้ำหนัก หรือเส้นรอบวงของท้องน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ โดยไม่เพิ่มอัตราการตายปริกำเนิด
- ทารกโตช้าในครรภ์ (FGR) คือทารกที่มีน้ำหนักน้อยและเพิ่มอัตราการตายปริกำเนิด ดังนั้นการวินิจฉัยสำหรับภาวะนี้ทาง ISUOG กล่าวว่าไม่สามารถใช้น้ำหนักของทารกเพียงอย่างเดียวมาใช้ในการวินิจฉัย โดยแนะนำการวัดค่าดอปเพลอร์ (Doppler velocimetry) ที่ใช้สำหรับประเมินการไหลเวียนของเลือดจากรกมายังทารก (uteroplacental or fetoplacental circulation) มาช่วยในการวินิจฉัยเพื่อจำแนกภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์ ดังแสดงในตารางที่ 1
ตารางที่ 1 แสดงเกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก ISUOG (1)
|
SGA |
Early FGR อายุครรภ์ < 32 สัปดาห์ และไม่มีความผิดปกติแต่กำเนิดของทารก (congenital anomalies) |
Late FGR อายุครรภ์ ≥ 32 สัปดาห์ และไม่มีความผิดปกติแต่กำเนิดของทารก |
|
AC หรือ EFW < 10th centile
|
AC หรือ EFW < 3rd centile หรือ UA-AEDF หรือ 1. AC หรือ EFW < 10th centile ร่วมกับ 2. UtA-PI > 95th centile และ/หรือ 3. UA-PI > 95th centile |
AC หรือ EFW < 3rd centile หรือ อย่างน้อย 2 ใน 3 ของข้อต่อไปนี้ 1. AC หรือ EFW < 10th centile 2. AC หรือ EFW crossing centiles > 2 quartiles on growth centiles 3. CPR < 5th centile หรือ UA-PI > 95th centile |
AEDF: (absent end-diastolic flow); CPR: (cerebroplacental ratio); EFW: (estimated fetal weight); PI: (pulsatility index); UA: (umbilical artery); UtA: (uterine artery)
สาเหตุของการเกิดภาวะทารกโตช้าในครรภ์ แบ่งได้เป็น 3 กลุ่ม คือ สาเหตุจากมารดา สาเหตุจากทารก และสาเหตุจากรกและสายสะดือ โดยส่วนใหญ่ไม่ว่าจะเกิดทารกโตช้าในครรภ์จากสาเหตุใดจะส่งผลให้เข้าสู่กลไกร่วมคือทำให้การไหลเวียนเลือดจากแม่ไปสู่ลูกไม่เพียงพอ ส่งผลให้ทารกในครรภ์ได้รับเลือดและสารอาหารไม่เพียงพอต่อการเจริญเติบโต (2) โดยสาเหตุหลักมีดังนี้
• สาเหตุจากมารดา (maternal disorder) (2)
- โรคประจำตัวของมารดา เช่น โรคเบาหวาน โรคไตวาย โรคแพ้ภูมิตัวเอง (systemic lupus erythematosus) โรคหัวใจชนิดเขียว เป็นต้น โดยส่วนใหญ่จะเป็นโรคเรื้อรังที่ส่งผลต่อความผิดปกติของเส้นเลือด
- โรคความดันโลหิตสูงขณะตั้งครรภ์ (pregnancy induced hypertension)
- กลุ่มอาการต้านฟอสโฟลิพิด (antiphospholipid syndrome) และการแข็งตัวของเลือดมากผิดปกติ เช่น acquired immune meditated thrombophilia แต่กลุ่ม hereditary thrombophilia ไม่พบความสัมพันธ์ที่ชัดเจนกับภาวะทารกโตช้าในครรภ์
- ภาวะขาดสารอาหารในมารดา (malnutrition) โดยเฉพาะหากได้รับแคลอรี <600-900 kcal/day
- การใช้สารเสพติด เช่น บุหรี่ แอลกอฮอล์ โคเคน หรือยากลุ่มระงับปวด โดยมีรายงานว่าการสูบบุหรี่ในสตรีตั้งครรภ์เพิ่มการเกิดภาวะทารกโตช้าในครรภ์ได้ถึง 3.5 เท่าเมื่อเทียบกับมารดาที่ไม่สูบบุหรี่
• สาเหตุจากทารก (fetal disorder) (2)
o ครรภ์แฝด (multiple pregnancy) โดยครรภ์แฝดสอง (twin) จะมีโอกาสเกิดภาวะทารกโตช้าในครรภ์ประมาณร้อยละ 25 สำหรับครรภ์แฝดสาม (triplet) และครรภ์แฝดสี่ (quadruplet) จะมีโอกาสเกิดภาวะทารกโตช้าในครรภ์สูงถึงร้อยละ 60
- การได้รับสารก่อวิรูป (teratogen) เช่น cyclophosphamide, valproic acid, warfarin เป็นต้น ทั้งนี้ความสัมพันธ์ของสารดังกล่าวกับการเกิดภาวะทารกโตช้าในครรภ์ขึ้นอยู่กับความสามารถในการก่อวิรูป (teratogenicity) ของสารแต่ละชนิด ระยะเวลาที่สตรีตั้งครรภ์สัมผัสสาร รวมถึงอัตราการเผาผลาญสารต่าง ๆ ของแต่ละบุคคล
- โรคติดเชื้อ เช่น malaria, cytomegalovirus, rubella, toxoplasmosis หรือ syphilis
- ความผิดปกติทางพันธุกรรม เช่น trisomy 13, trisomy 18, confined placental mosaicism
- ความผิดปกติทางโครงสร้าง เช่น congenital heart disease หรือ gastroschisis
• สาเหตุจากรกและสายสะดือ (placental disorders and umbilical cord abnormalities) (2)
- ระบบการไหลเวียนของเลือดของรกผิดปกติ (placental insufficiency) ถือเป็นสาเหตุที่พบมากที่สุด
- ความผิดปกติของรก เช่น abruption, infarction, circumvallate shape, hemangioma, และ chorioangioma
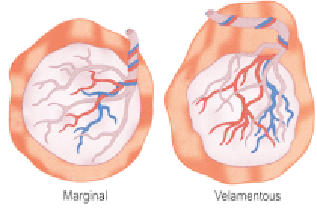
- ความผิดปกติของสายสะดือ เช่น velamentous หรือ marginal cord insertion
ภาพที่ 1 แสดง circumvallate placenta (4)
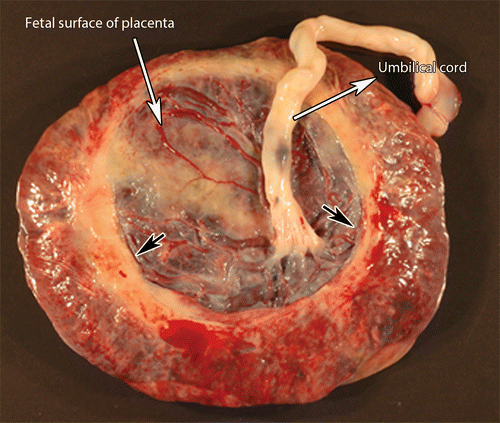
ภาพที่ 2 แสดง marginal and velamentous cord insertion (5)
การประเมินภาวะทารกโตช้าในครรภ์
• ซักประวัติตรวจร่างกาย
สำหรับการซักประวัติมารดาที่พบภาวะทารกโตช้าในครรภ์ สิ่งแรกที่ต้องคำนึงถึงคือ อายุครรภ์ว่าถูกต้องหรือไม่ ลักษณะตัวเล็กของทารกเป็นภาวะปกติตามพันธุกรรมหรือเชื้อชาติหรือไม่ มีปัจจัยที่เกี่ยวข้องกับการเติบโตช้าของทารกอะไรบ้าง เช่น พฤติกรรมการสูบบุรี่ ดื่มแอลกอฮอล์ การใช้สารเสพติด หรือการได้รับสารพวกก่อวิรูป รวมถึงประวัติการติดเชื้อในช่วงการตั้งครรภ์ของมารดา เพื่อนำมาช่วยในการวินิจฉัยและวิเคราะห์หาสาเหตุที่เป็นไปได้
สำหรับการตรวจร่างกาย ACOG 2021 (2) แนะนำใช้การวัดความสูงของยอดมดลูก (fundal height) เป็นตัวคัดกรองภาวะโตช้าในครรภ์ของทารก ซึ่งหากความสูงของยอดมดลูกกับอายุครรภ์ต่างกันมากกว่า 3 เซนติเมตร ควรสงสัยภาวะโตช้าในครรภ์และตรวจเพิ่มเติมด้วยการตรวจคลื่นเสียงความถี่สูง โดยจากรายงานพบว่าการวัดความสูงของยอดมดลูกในช่วงอายุครรภ์ 24-38 สัปดาห์ มีความไว (sensitivity) ร้อยละ 65-85 และความจำเพาะ (specificity) ร้อยละ 96 สำหรับการคัดกรองดังกล่าว แต่ในมารดาที่มีภาวะอ้วน ครรภ์แฝด หรือมีเนื้องอกมดลูก (leiomyoma) จะลดความน่าเชื่อถือและความแม่นยำของการวัดความสูงของยอดมดลูกนั้น แนะนำใช้การตรวจด้วยคลื่นความถี่สูงมาช่วยในการประเมินและคัดกรองเพื่อความแม่นยำที่มากขึ้น
• การประเมินด้วยคลื่นเสียงความถี่สูง (ultrasound)
o การวัด biometric parameters ของทารก
- ความกว้างของศีรษะ (BPD; biparietal diameter)
- เส้นรอบวงของศีรษะ (HC; head circumference)
- เส้นรอบวงของท้อง (AC; abdominal circumference)
- ความยาวของกระดูกต้นขา (FL; femur length)
เพื่อประเมินขนาดและน้ำหนักของทารกว่าอยู่ในเกณฑ์ปกติตามอายุครรภ์หรือไม่ รวมถึงใช้ติดตามอัตราการเจริญเติบโตของทารก
สิ่งที่แนะนำให้ประเมินร่วมด้วย มีดังนี้
- การประเมินน้ำคร่ำ (amniotic fluid assessment)
- การประเมินความผิดปกติทางกายภาพของทารก (fetal structural abnormality)
- การประเมินสุขภาพทารก (BPP; biophysical profile)
- การประเมิน Doppler velocity
Umbilical artery
เป็นเครื่องมือที่ใช้ในการประเมินและติดตามสุขภาพของทารก (fetal surveillance) ที่มีภาวะโตช้าในครรภ์ โดยการประเมิน umbilical artery Doppler velocity ถือว่าเป็นการตรวจเดียวที่มีรายงานจากการศึกษาของ PORTO (9) ว่าสามารถช่วยลดผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ในทารก (adverse perinatal outcome) จากภาวะโตช้าในครรภ์ได้ ไม่ว่าจะเป็น ภาวะเลือดออกในสมอง (intraventricular hemorrhage) ภาวะสมองขาดออกซิเจน (hypoxic ischemic encephalopathy) ภาวะลำไส้เน่าตาย (necrotizing enterocolitis) โรคปอดเรื้อรัง (bronchopulmonary dysplasia) ภาวะติดเชื้อในกระแสเลือด (sepsis) และการเสียชีวิตของทารก เป็นต้น
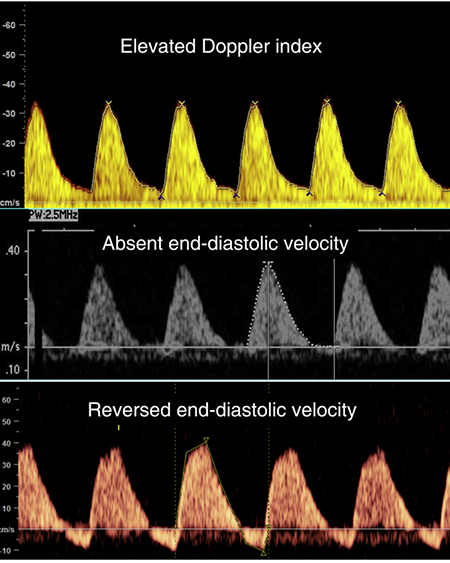
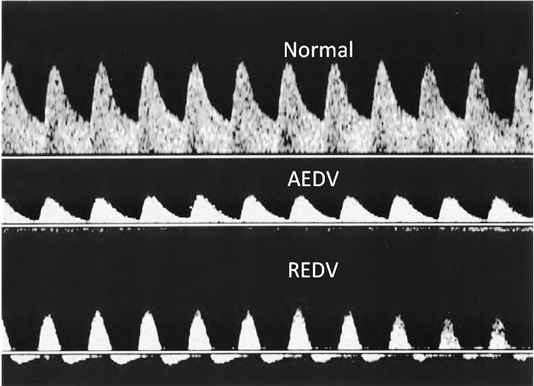
ความผิดปกติของ umbilical artery Doppler velocity ที่ตรวจพบได้แก่ pulsatility index (PI) >95th centile, absent end-diastolic flow (AEDV) และ reversed end-diastolic flow (REDV) ซึ่งแสดงถึงการมีแรงต้านในรก (placental resistance) หรือมีแรงต้านในเส้นเลือด umbilical artery (umbilical artery resistance) จากภาวะ placental insufficiency ที่เป็นสาเหตุของทารกโตช้าในครรภ์
ภาพที่ 3 แสดงความผิดปกติของ umbilical artery doppler velocity ในภาวะ placental insufficiency (10)
Ductus venosus
Ductus venosus เป็นตัวบอกสภาวะการไหลเวียนเลือดของทารก (hemodynamic status) ในภาวะปกติระบบไหลเวียนเลือดดำของทารก จะไหลไปข้างหน้าเพียงอย่างเดียว โดย ductus venosus จะนำเลือดที่มีออกซิเจนและสารอาหารมายังหัวใจทารก แต่เมื่อมีภาวะทารกโตช้าในครรภ์ร่วมกับมี umbilical artery pressure ที่สูงมากกว่าปกติ ส่งผลให้การไหลเวียนเลือดผ่านหัวใจทารกแย่ลง central venous pressure จึงเพิ่มขึ้น ทำให้ ductus venosus มีความดันภายในที่เพิ่มขึ้นเช่นกัน แสดงให้เห็นในรูปแบบ absent หรือ reversed ductus venous a-wave ซึ่งความผิดปกติที่พบมักจะพบในช่วงท้ายก่อนทารกจะเสียชีวิต นอกจากนั้นยังมีรายงานว่าการพบลักษณะดังกล่าวสัมพันธ์กับภาวะขาดออกซิเจน และเลือดเป็นกรดของทารก รวมถึงเพิ่มอัตราการเสียชีวิตของทารก (stillbirth) ร้อยละ 46 (3) ตามคำแนะนำของ ISUOG ใช้การวัดค่าดอปเพลอร์ของ ductus venosus ตรวจติดตามในรายที่มีภาวะทารกโตช้าในครรภ์ที่ได้รับการวินิจฉัยก่อนอายุครรภ์ 32 สัปดาห์ (early FGR) และใช้เป็นเกณฑ์ในการพิจารณาการคลอด พบว่าสามารถลดความผิดปกติของการพัฒนาทางระบบประสาทของทารกที่อายุ 2 ปีได้ เมื่อเทียบกับการติดตามทารกด้วยเครื่องติดตามการเต้นของหัวใจทารก (CTG) เพียงอย่างเดียว
ภาพที่ 4 แสดง ductus venosus Doppler (10)
Middle cerebral artery
การประเมิน middle cerebral artery Doppler สามารถบอกถึงสภาวะการไหลเวียนเลือดของทารกได้ กล่าวคือในภาวะปกติการไหลเวียนเลือดใน middle cerebral arteryของทารกจะมีแรงต้านในหลอดเลือดที่สูงกว่า umbilical artery แต่เมื่อมีภาวะโตช้าในครรภ์และภาวะขาดออกซิเจน จะเกิดการขยายตัวของหลอดเลือดสมอง (cerebral vasodilation) เพื่อเพิ่มการไหลเวียนของเลือดมายังสมองมากขึ้นชดเชยภาวะขาดออกซิเจน เรียกปรากฏการณ์นี้ว่า “brain sparing effect” (3) ซึ่งจะทำให้แรงต้านใน middle cerebral artery ต่ำกว่า umbilical artery
การประเมินจะดูจาก peak systolic to end diastolic blood flow velocity ratio (S/D), resistance index และ pulsatility index แต่ยังไม่มีรายงานว่าสามารถใช้ middle cerebral artery Doppler ในการตัดสินใจเรื่องกำหนดเวลาการคลอดของทารกโตช้าในครรภ์ เพียงนำมาช่วยประกอบการประเมินภาวะขาดออกซิเจนและผลลัพธ์ที่ไม่พึงประสงค์ของทารกร่วมกับการประเมิน umbilical artery Doppler เท่านั้น
ภาพที่ 5 แสดง middle cerebral artery Doppler ในทารกปกติ และในภาวะ placental insufficiency (10)
Cerebroplacental ratio (CPR)
คำนวณมาจากสัดส่วนของ pulsatility index ของ middle cerebral artery เทียบกับ umbilical artery (MCA-PI / UA-PI) เป็นค่าที่บ่งบอกว่ามีภาวะ fetal blood flow redistribution หรือเกิด brain sparing effect โดยจากการศึกษาของ PORTO (9) พบว่า CPR < 1 สัมพันธ์กับผลลัพธ์ที่ไม่พึงประสงค์ของทารก และพบว่ามีการพัฒนาของระบบประสาทและพัฒนาการที่แย่กว่าเมื่อเทียบกับกลุ่มที่มีค่า CPR สูง
Uterine artery (3)
ใช้ประเมินการไหลเวียนเลือดเข้าสู่มดลูก เป็นสิ่งที่ใช่ประเมินการ remodelling ของ spiral artery ซึ่งในภาวะปกติการไหลเวียนเลือดในเส้นเลือดนี้จะมีอัตราเร็วที่สูง และไหลอย่างต่อเนื่องไปด้านหน้า (continuous forward flow) หากมีความผิดปกติจะพบความต้านทานที่สูงขึ้น ค่า pulsatility index (PI) >95th percentile หรือพบลักษณะ diastolic notch ซึ่งสัมพันธ์กับผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ต่าง ๆ
• การส่งตรวจเพิ่มเติม
o Genetic counselling and prenatal diagnostic test
ให้แนะนำเกี่ยวกับโรคทางพันธุกรรม และความคุ้มค่าของการตรวจสารพันธุกรรมของทารก โดย karyotyping และ chromosomal microarray analysis ซึ่งควรพิจารณาตรวจในกรณีดังต่อไปนี้
- วินิจฉัยภาวะทารกโตช้าในครรภ์ก่อนอายุครรภ์ 32 สัปดาห์ (early FGR)
- วินิจฉัยภาวะทารกโตช้าในครรภ์ร่วมกับตรวจพบภาวะน้ำคร่ำเยอะผิดปกติ (polyhydramnios)
- วินิจฉัยภาวะทารกโตช้าในครรภ์ร่วมกับตรวจพบความผิดปกติทางโครงสร้างของทารก
o Screening of infection
- แนะนำตรวจ PCR สำหรับหาการติดเชื้อ CMV ในกรณีที่ไม่สามารถอธิบายการเกิดทารกโตช้าในครรภ์ได้ โดยจะแนะนำตรวจจาก amniocentesis เนื่องจากการตรวจทาง serology สำหรับ CMV ยังมีการใช้ที่จำกัด
- ไม่แนะนำตรวจคัดกรองการติดเชื้อ toxoplasmosis, rubella, หรือ herpes ในมารดาที่ไม่มีประวัติปัจจัยเสี่ยงของการติดเชื้อและไม่พบความผิดปกติทางกายภาพของทารกจากการตรวจด้วยคลื่นความถี่สูง
การดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในช่วงก่อนคลอด (Antepartum care)
• การป้องกันการเกิดภาวะโตช้าในครรภ์
จากข้อมูลในปัจจุบัน ยังไม่มีการดูแลที่มีหลักฐานยืนยันว่าสามารถป้องกันการเกิดทารกโตช้าในครรภ์ ไม่ว่าจะเป็นการนอนพัก (bed rest) จำกัดการทำกิจกรรมต่างๆ หรือการเพิ่มสารอาหาร (nutritional and dietary supplement) สำหรับการใช้ยากลุ่ม low dose aspirin, low molecular weight heparin (LMWH) และ sildenafil ก็ยังไม่พบหลักฐานว่าสามารถช่วยเพิ่มการไหลเวียนเลือดของรก ดังนั้น SMFM 2020 จึงไม่แนะนำการใช้ยาเหล่านี้ในมารดาที่มีภาวะทารกโตช้าในครรภ์(3)
• การตรวจด้วยคลื่นเสียงความถี่สูง
การตรวจคัดกรองภาวะทารกโตช้าในครรภ์สามารถทำได้โดยการวัดความสูงของยอดมดลูก หากพบว่าความสูงของยอดมดลูกน้อยกว่าอายุครรภ์มากกว่า 3 เซนติเมตร ควรได้รับการตรวจด้วยคลื่นเสียงความถี่สูงเพิ่มเติม เพื่อหาสาเหตุของขนาดมดลูกที่เล็กกว่าอายุครรภ์ เช่น น้ำคร่ำน้อย ทารกโตช้าในครรภ์ หากพบมีภาวะทารกโตช้าในครรภ์ ควรตรวจดูปริมาณน้ำคร่ำแล Doppler เพื่อนำมาช่วยในการดูแลและวางแผนการคลอดของทารก นอกจากนั้นหากวินิจฉัยก่อนอายุครรภ์ 32 สัปดาห์ ควรตรวจดูความผิดปกติทางกายภาพของทารกโดยละเอียด เนื่องจากพบว่าภาวะนี้สัมพันธ์กับความผิดปกติทางกายภาพของทารกและสารพันธุกรรม
• การตรวจติดตามการเจริญเติบโตของทารก (follow up growth)
แนะนำตรวจติดตามการเจริญเติบโตของทารกด้วยคลื่นเสียงความถี่สูงอย่างน้อยทุก 3-4 สัปดาห์ แต่หากพบว่ามีภาวะทารกโตช้าในครรภ์ที่รุนแรงมากหรือพบว่ามีความผิดปกติของ umbilical artery Doppler สามารถเพิ่มความถี่ในการตรวจได้ทุก 2 สัปดาห์
• การตรวจประเมินสุขภาพทารก (fetal monitor and surveillance)
ในปัจจุบันพบว่าการประเมินสุขภาพทารกด้วยการตรวจ cardiotocography (CTG) และการตรวจ umbilical artery Doppler สามารถช่วยลดผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์และลดความผิดปกติของการพัฒนาระบบประสาทและการเจริญเติบโตของทารกหลังคลอดที่อายุ 2 ปี (6) ดังนั้น SMFM 2020 จึงแนะนำดังนี้
- กรณีพบการลดลงของ end-diastolic velocity ใน umbilical artery Doppler ที่มากกว่าเปอร์เซนไทล์ที่ 95 หรือพบทารกโตช้าที่รุนแรง (น้ำหนักน้อยกว่าเปอร์เซนไทล์ที่ 3) ควร ตรวจ CTG 1-2 ครั้งต่อสัปดาห์ และประเมิน umbilical artery Doppler ทุกสัปดาห์
- กรณีพบ AEDV ใน umbilical artery Doppler ควรตรวจ CTG 2 ครั้งต่อสัปดาห์ และประเมิน umbilical artery Doppler 2-3 ครั้งต่อสัปดาห์
- กรณีพบ REDV ใน umbilical artery Doppler แนะนำนอนโรงพยาบาล ควรตรวจ CTG 1-2 ครั้งต่อวัน และพิจารณาการคลอดของทารก
การประเมินสุขภาพทารกด้วย biophysical profile (BPP) หากพบความผิดปกติ มักจะเป็นอาการที่แสดงออกมาในช่วงท้ายของโรค โดยจะพบความผิดปกตินี้ประมาณ 48-72 ชั่วโมงหลังพบความผิดปกติของ ductus venosus Doppler และจากรายงานของ Cochrane review ยังไม่มีหลักฐานที่สนับสนุนการนำ BPP มาใช้ในการตรวจติดตามสุขภาพทารกแบบ routine เนื่องจากพบ false positive และ false negative ค่อนข้างมาก แต่มักใช้ร่วมประเมินทารกเมื่อพบความผิดปกติของ CTG หรือ umbilical artery Doppler หรือใช้ในกรณีที่บางสถานพยาบาลไม่มีเครื่อง CTG
อายุครรภ์ที่แนะนำให้คลอดสำหรับสตรีตั้งครรภ์ภาวะทารกโตช้าในครรภ์ (timing of delivery)
การดูแลทารกโตช้าในครรภ์ควรได้รับการดูแลในโรงพยาบาลที่มีความพร้อมในระดับตติยภูมิ (tertiary care) ต้องมีความพร้อมของสูติแพทย์ กุมารแพทย์ มีห้องอภิบาลทารกแรกเกิด (NICU; neonatal intensive care unit) สำหรับการพิจารณาเวลาที่เหมาะสมในการคลอดของทารกโตช้าในครรภ์ SMFM และ ACOG มีคำแนะนำดังนี้ (2,3)
- อายุครรภ์ 26 สัปดาห์ หรือน้ำหนักทารก 500 กรัม สำหรับ severe early-onset FGR แต่ทั้งนี้ทั้งนั้นต้องพิจารณาความพร้อมของทีมรักษา และต้องผ่านการพูดคุยถึงผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ที่อาจเกิดขึ้นกับมารดา เพื่อพูดคุยถึงแนวทางการดูแล
- อายุครรภ์ 38-39 สัปดาห์ สำหรับทารกที่มีน้ำหนักอยู่ในช่วงเปอร์เซ็นไทล์ที่ 3-10 โดยที่ไม่พบความผิดปกติของ umbilical artery Doppler
- อายุครรภ์ 37 สัปดาห์ สำหรับทารกที่มีน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 3 หรือ ทารกโตช้าที่ตรวจพบความผิดปกติ umbilical artery S/D ratio มากกว่าเปอร์เซ็นไทล์ที่ 95
- อายุครรภ์ 33-34 สัปดาห์ สำหรับทารกที่ตรวจพบ AEDV ใน umbilical artery Doppler
- อายุครรภ์ 30-32 สัปดาห์ สำหรับทารกที่ตรวจพบ REDV ใน umbilical artery Doppler
- อายุครรภ์ 34-37 6/7 สัปดาห์ สำหรับทารกที่ตรวจพบภาวะน้ำคร่ำน้อย (oligohydramnios) หรือโรคร่วมของมารดา เช่น ครรภ์เป็นพิษ ความดันโลหิตสูงเป็นต้น
คำแนะนำจากองค์กรต่างๆ ในการดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในครรภ์ยังมีความแตกต่างกัน โดยเฉพาะส่วนของการตรวจติดตามสุขภาพทารกในครรภ์และอายุครรภ์ที่แนะนำให้คลอด ดังแสดงในตารางที่ 2 ดังนั้นการนำไปใช้จึงควรปรับให้เข้ากับบริบทอย่างเหมาะสม
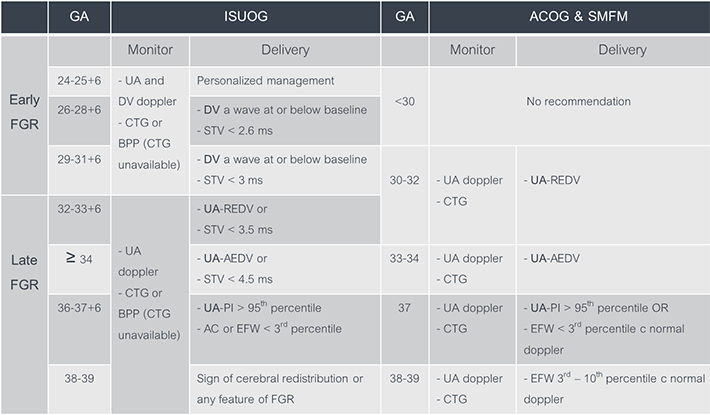
ตารางที่ 2 แสดงการเปรียบเทียบการตรวจติดตามและการพิจารณาคลอดของภาวะทารกโตช้าในครรภ์ตามคำแนะนำของ ISUOG และ ACOG & SMFM (1,2,3)
การดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในช่วงระยะคลอด (Intrapartum care)
- ควรได้รับการดูแลจากสหสาขาวิชาชีพได้แก่ สูติแพทย์ สูติแพทย์เฉพาะทางเวชศาสตร์มารดาและทารก กุมารแพทย์เฉพาะทางสาขาทารกแรกเกิด
- ควรได้รับการติดตามดูลักษณะการเต้นของหัวใจทารกอย่างต่อเนื่อง (continuous fetal monitor) เพื่อเฝ้าระวังภาวะเครียดของทารก (fetal distress)
- การให้ antenatal corticosteroid (2)
มีประโยชน์และควรให้ในกรณีที่จะคลอดก่อนอายุครรภ์ 33 6/7 สัปดาห์ สำหรับในช่วงอายุครรภ์ 34 0/7 สัปดาห์ถึง 36 6/7 สัปดาห์ กรณีที่มีความเสี่ยงจะคลอดใน 7 วัน และไม่เคยได้รับ corticosteroid มาก่อน พิจารณาให้ได้หากประโยชน์มากกว่าความเสี่ยงที่จะเกิดขึ้นจากการได้รับยา - การให้ magnesium sulfate (2)
พิจารณาให้ในกรณีที่จะคลอดก่อนอายุครรภ์ 32 สัปดาห์ เพื่อหวังผลการป้องกันภาวะแทรกซ้อนทางระบบประสาท (neuroprotection) ในทารก - ช่องทางการคลอด (route of delivery)
ปัจจุบันข้อมูลยังมีจำกัดสำหรับการแนะนำช่องทางการคลอดที่เหมาะสมที่สุดสำหรับทารกโตช้าในครรภ์ การพิจารณาอาศัยสุขภาพทารกระหว่างเข้าสู่กระบวนการคลอดร่วมด้วย ซึ่งอาจพบการเต้นของหัวใจทารกผิดปกติที่แสดงถึงการขาดออกซิเจนในช่วงระยะคลอด และตามมาด้วยการผ่าตัดคลอด โดยเฉพาะในรายที่ตรวจพบความผิดปกติแบบ AEDV หรือ REDV ใน umbilical artery Doppler โดยทาง SMFM 2020 (3) ได้แนะนำให้การผ่าตัดคลอดในกรณีทารกโตช้าในครรภ์ที่พบความผิดปกติของ umbilical artery Doppler โดยพิจารณาร่วมกับบริบทอื่น ๆ ณ ขณะนั้น
ภาวะทารกโตช้าในครรภ์สามารถคลอดทางช่องคลอดได้และไม่เป็นข้อบ่งห้ามในการชักนำการคลอด จากการศึกษาของ DIGITAT (7) ที่ศึกษาการชักนำการคลอดของทารกที่โตช้าในครรภ์อายุครรภ์ 36 -41สัปดาห์ พบว่าไม่มีความสัมพันธ์กับการเพิ่มโอกาสการผ่าตัดคลอดเมื่อเทียบกับกลุ่มที่ไม่ชักนำคลอด (expectant group) และสามารถคลอดทางช่องคลอดได้สำเร็จถึงร้อยละ 85 ทั้งกลุ่มที่ได้รับการชักนำคลอดและไม่ได้รับการชักนำคลอด ดังนั้นในการกำหนดช่องทางการคลอดที่เหมาะสมควรได้รับการพิจารณาเป็นราย ๆ ตามบริบทของมารดาและทารกในครรภ์
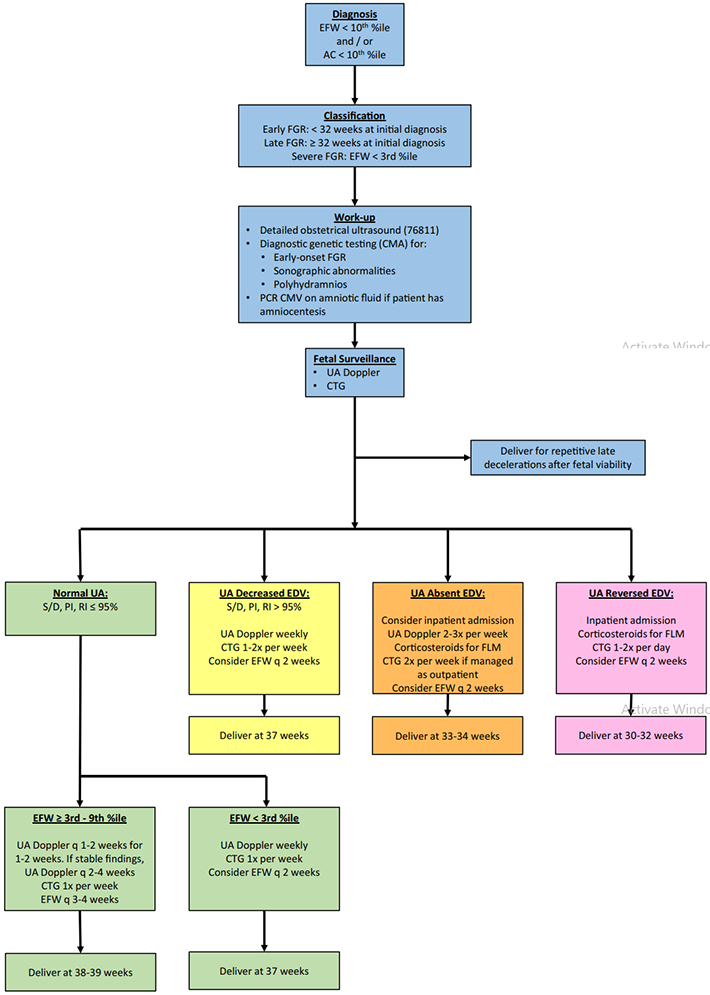
ภาพที่ 6 แสดงแผนผังแนวทางการวินิจฉัยและการดูแลทารกโตช้าในครรภ์ (3)
ภาวะทารกโตช้าในครรภ์ส่งผลเสียต่อการตั้งครรภ์ที่ เพิ่มโอกาสเสียชีวิตและพัฒนาการที่ผิดปกติในช่วงหลังคลอด เพิ่มโอกาสเกิดโรคเรื้องรังในวัยผู้ใหญ่ การดูแลรักษาภาวะนี้ จึงมุ่งเน้นการวินิจฉัยให้ได้อย่างรวดเร็ว (early diagnosis) การติดตามสุขภาพทารกที่มีประสิทธิภาพ และการกำหนดเวลาการคลอดที่เหมาะสม เพื่อผลลัพธ์ที่ดี
เอกสารอ้างอิง
- ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol 2020; 56: 298–312
- Fetal Growth Restriction. ACOG Practice Bulletin Number 227. the American College of Obstetricians and Gynecologists. vol. 137, no. 2, February 2021
- Juliana Gevaerd Martins, MD. Society for Maternal-Fetal Medicine Consult Series #52: Diagnosis and management of fetal growth restriction. Society for Maternal-Fetal Medicine (SMFM), October 2020
- Shaimaa Fadl, MD. Placental Imaging: Normal Appearance with Review of Pathologic Findings. radiographics.rsna.org. May-June, 2017
- Fox H, Sebire NJ. Pathology of the placenta. 3rd ed. Philadelphia, PA: W.B. Saunders; 2007
- G. H. A. VISSER. Fetal monitoring indications for delivery and 2-year outcome in 310 infants with fetal growth restriction delivered before 32 weeks’ gestation in the TRUFFLE study. Ultrasound Obstet Gynecol 2017; 50: 347–352
- Kim E Boers. Disproportionate Intrauterine Growth Intervention Trial At Term: DIGITAT. BMC Pregnancy and Childbirth 2007, 7:12
- Dawn-Marie Walker. The Growth Restriction Intervention Trial: long-term outcomes in a randomized trial of timing of delivery in fetal growth restriction. American Journal of Obstetrics & Gynecology; JANUARY 2011, 34e1-9
- Julia Unterscheider. Optimizing the definition of intrauterine growth restriction: the multicenter prospective PORTO Study. Am J Obstet Gynecol 2013;208:290.e1-6.
- Ahmet A. Baschat. Examination of the fetal cardiovascular system. Seminars in Fetal & Neonatal Medicine 16;2011, 2e12
การวินิจฉัยและการดูแลภาวะวัยสาวก่อนกำหนดชนิด gonadotropin dependent
Diagnosis and management of gonadotropin dependent precocious puberty
การวินิจฉัยและการดูแลภาวะวัยสาวก่อนกำหนดชนิด gonadotropin dependent
พญ. ปิ่นนภา เตอะอ้าย
อาจารย์ที่ปรึกษา ผศ.พญ. อุบล แสงอนันต์
วัยแรกรุ่นหรือวัยสาว (Puberty) คือช่วงเวลาในการเข้าสู่วัยสาว ซึ่งแสดงออกโดยมีการพัฒนาของลักษณะทางเพศขั้นที่สอง (secondary sex characteristic) และมีความสามารถในการเจริญพันธุ์ (sexual reproduction) ซึ่งเป็นผลทั้งทางตรงและทางอ้อมจากการพัฒนาที่สมบูรณ์ของต่อมใต้สมอง ส่งผลให้ hypothalamus-pituitary-gonadal axis (HPA) ทำงานได้อย่างมีประสิทธิภาพ เกิดการสร้าง gonadotropin releasing hormone (GnRH) มากระตุ้นต่อม pituitary ให้สร้าง gonadotropin เพื่อกระตุ้นต่อมเพศให้สร้างฮอร์โมนเพศ (sex steroid) ต่อไป (1) โดยอายุเฉลี่ยปกติในการเข้าสู่วัยสาวของเด็กผู้หญิงคือ 10 ปี (2)
วัยสาวก่อนกำหนด หรือที่เรียกว่า precocious puberty คือ ภาวะเข้าสู่วัยสาวก่อนกำหนด โดยมีการพัฒนาของวัยสาวเกิดขึ้นเร็วกว่าอายุเฉลี่ยของประชากรทั่วไปมากกว่า 2.5 SD กล่าวคือพบการพัฒนาของลักษณะทางเพศขั้นที่สองก่อนอายุ 8 ปีในเด็กผู้หญิง และก่อนอายุ 9 ปีในเด็กผู้ชาย (2) โดยมีปัจจัยต่าง ๆ เป็นสิ่งส่งเสริม ไม่ว่าจะเป็นปัจจัยทางด้านพันธุกรรม ภาวะโภชนาการ สภาวะสุขภาพกายและสุขภาพจิต ภูมิประเทศที่อยู่อาศัย เป็นต้น (1)
ประเภทของภาวะเข้าสู่วัยสาวก่อนกำหนด
สามารถจำแนกภาวะเข้าสู่วัยสาวก่อนกำหนดได้ 3 กลุ่ม ดังแสดงในภาพที่ 1 ได้แก่ (2)
1. Gonadotropin dependent precocious puberty (GDPP) or central precocious puberty or true precocious puberty:
เป็นความผิดปกติที่เกิดจาก HPA axis พัฒนาและเริ่มทำงานเร็วกว่าปกติ (maturation and activation) ทำให้เกิดการพัฒนาการของเต้านม และขนบริเวณหัวเหน่าก่อนอายุเฉลี่ยของประชากรทั่วไป โดยลักษณะทางเพศขั้นที่สองจะแสดงออกแบบเดียวกับเพศของเด็ก เรียกว่า isosexual precocious puberty
2. Gonadotropin independent precocious puberty (GIPP) or peripheral precocious puberty or pseudo precocious puberty:
เป็นความผิดปกติที่เกิดจากการได้รับฮอร์โมนเพศจากตัวต่อมเพศ (gonad) เอง ต่อมหมวกไต (adrenal) หรือ สิ่งแวดล้อมภายนอก โดยการแสดงออกของลักษณะทางเพศขั้นที่สองพบได้ทั้งแบบตรงเพศของเด็ก (isosexual) และตรงข้ามกับเพศของเด็ก (contrasexual) ขึ้นกับว่ามีการสร้างฮอร์โมนเพศชนิดใดเป็นหลัก
3. Incomplete precocious puberty or benign or nonprogressive pubertal variants
เป็นความแปรปรวนของการพัฒนาสู่วัยสาวปกติที่อาจพบได้ เช่น การเจริญของเต้านมก่อนวัย (isolated premature thelarche) การเจริญของขนบริเวณหัวเหน่าก่อนวัย (isolated premature adrenarche) การมีประจำเดือนก่อนวัย (isolated premature menarche) ซึ่งภาวะเหล่านี้สามารถกลายเป็น complete precocious puberty ได้ในอนาคต ดังนั้นจึงควรติดตามอาการอย่างใกล้ชิด
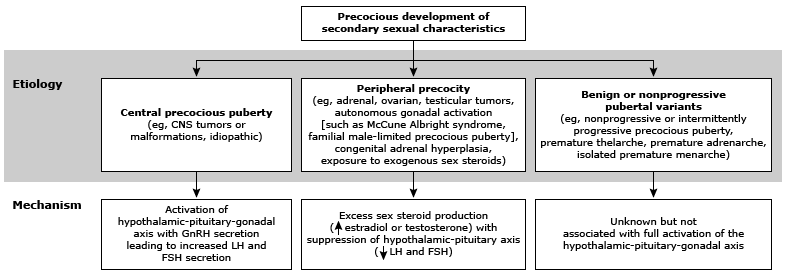
ภาพที่ 1 แสดงการแบ่งจำแนกประเภทของ precocious puberty
อ้างอิง: Harrington J, Palmert MR, Hamilton J. an example from the diagnostic evaluation of precocious puberty. Arch Dis Child 2014; 99:15.
สาเหตุของการเข้าสู่วัยสาวก่อนกำหนด
สาเหตุของการเกิดภาวะเข้าสู่วัยสาวก่อนกำหนดสามารถจำแนกได้ตามประเภทของภาวะวัยสาวก่อนกำหนดดังตารางที่ 1
ตารางที่ 1 ตารางแสดงสาเหตุของการเกิดภาวะเข้าสู่วัยสาวก่อนกำหนด
|
GDPP or Central precocious puberty |
GIPP or Peripheral precocious puberty |
|
|
อ้างอิง: S.Berek J. Berek & Novak’s Gynecology 16 ed: Wolters Kluwer 2020.
การประเมินและวินิจฉัยภาวะวัยสาวก่อนกำหนด
หลักการของการประเมินและการวินิจฉัยภาวะวัยสาวก่อนกำหนด จะเริ่มด้วยการซักประวัติ ตรวจร่างกาย เป็นหลักในเด็กที่สงสัยภาวะวัยสาวก่อนกำหนด หากพบว่าประวัติและการตรวจร่างกายเข้าได้กับภาวะวัยสาวก่อนกำหนดจะมีการส่งตรวจทางห้องปฏิบัติการเพื่อดูระดับฮอร์โมน รวมไปถึงการตรวจทางรังสีเพื่อประเมินอายุกระดูกว่ามีการเจริญเติบโตอย่างไร โดยจะนำข้อมูลเหล่านี้มาประกอบการวินิจฉัย ซึ่งมีรายละเอียดดังนี้
• การซักประวัติ (2,3)
- เน้นให้ทราบถึงช่วงเวลาและลำดับเหตุการณ์ที่เกิดการพัฒนาและเปลี่ยนแปลงของร่างกายรวมถึงลักษณะทางเพศขั้นที่สองที่ชัดเจน ว่าสิ่งใดเกิดก่อนหลัง ยกตัวอย่างเช่น หากการพัฒนาและการเปลี่ยนแปลงของลักษณะทางเพศขั้นที่สองเป็นไปตามลำดับการพัฒนาเข้าสู่วัยสาวปกติ กล่าวคือพบการพัฒนาของเต้านมเป็นสิ่งแรก ตามด้วยการพัฒนาของขนบริเวณหัวเหน่า และการมีประจำเดือน เพียงแต่การพัฒนาเหล่านี้เกิดก่อนอายุที่สมควร จะบ่งบอกได้ว่าเด็กหญิงรายนั้นอาจมีภาวะ GDPP แต่หากลำดับการพัฒนาและการเปลี่ยนแปลงไม่ได้เรียงตามลำดับการพัฒนาปกติ และเกิดก่อนวัยที่สมควร อาจบ่งบอกได้ว่าเด็กหญิงรายนั้นมีภาวะ GIPP ที่เกิดจากการได้รับฮอร์โมนเพศจากแหล่งอื่นมากกว่าเกิดจากภาวะ GDPP หรือหากพบการพัฒนาของเต้านม ขนบริเวณหัวเน่า การมีประจำเดือนเพียงอย่างใดอย่างหนึ่งโดยไม่มีการพัฒนาของลักษณะทางเพศขั้นที่สองอื่นๆ อาจเป็นเพียง benign pubertal variants ก็เป็นได้
- ช่วงเวลาการเข้าสู่วัยหนุ่มสาวของพ่อแม่และพี่น้องในครอบครัว
- หาหลักฐานของความสูงที่เพิ่มขึ้นอย่างรวดเร็ว (growth acceleration) เช่น สมุดบันทึกการเจริญเติบโต โดยนำมาคำนวณอัตราการเจริญเติบโต โดยเฉพาะอัตราการเพิ่มขึ้นของความสูง (height velocity) มีหน่วยเป็นเซนติเมตรต่อปี โดยในเด็กหญิงที่มีภาวะวัยสาวก่อนกำหนดชนิด GDPP มักจะพบลักษณะของความสูงที่เพิ่มขึ้นอย่างรวดเร็ว กล่าวคือพบความสูงเพิ่มขึ้นมากกว่า 6 เซนติเมตรต่อปี
- ซักถามประวัติอาการผิดปกติทางระบบประสาท เช่น ปวดศีรษะ ชัก พฤติกรรมเปลี่ยนแปลงไป ประวัติการบาดเจ็บต่อระบบประสาทส่วนกลางและการได้รับการฉายรังสีบริเวณศีรษะ ซึ่งจะสัมพันธ์กับการเกิดภาวะวัยสาวก่อนกำหนดที่มาจาก GDPP ได้
- ซักถามประวัติการสัมผัส sex steroid จากยา หรือ ผลิตภัณฑ์เครื่องสำอาง โดยเฉพาะที่มีส่วนผสมของฮอร์โมนเพศ ซึ่งจะสัมพันธ์กับการเกิดภาวะวัยสาวก่อนกำหนดที่มาจาก GIPP
- ซักถามประวัติร่วมอื่นๆ เช่น ปวดท้องน้อย คลำได้ก้อนบริเวณท้องน้อย มีรอยโรคผิวหนัง เป็นต้น
• การตรวจร่างกาย (2,3)
o ตรวจร่างกายทุกระบบอย่างละเอียด โดยเฉพาะระบบประสาท
- น้ำหนัก ส่วนสูง และมวลกาย (BMI)
- ตรวจลักษณะทางเพศขั้นที่สอง (tanner stage) ประเมินลักษณะทางเพศขั้นที่สองว่าเจริญเติบโตตามปกติของช่วงอายุหรือไม่ ดังแสดงในภาพที่ 2 และ 3
การพัฒนาของเต้านม
ภาพที่ 2 แสดงการพัฒนาการของเต้านม (tanner stage of breast)
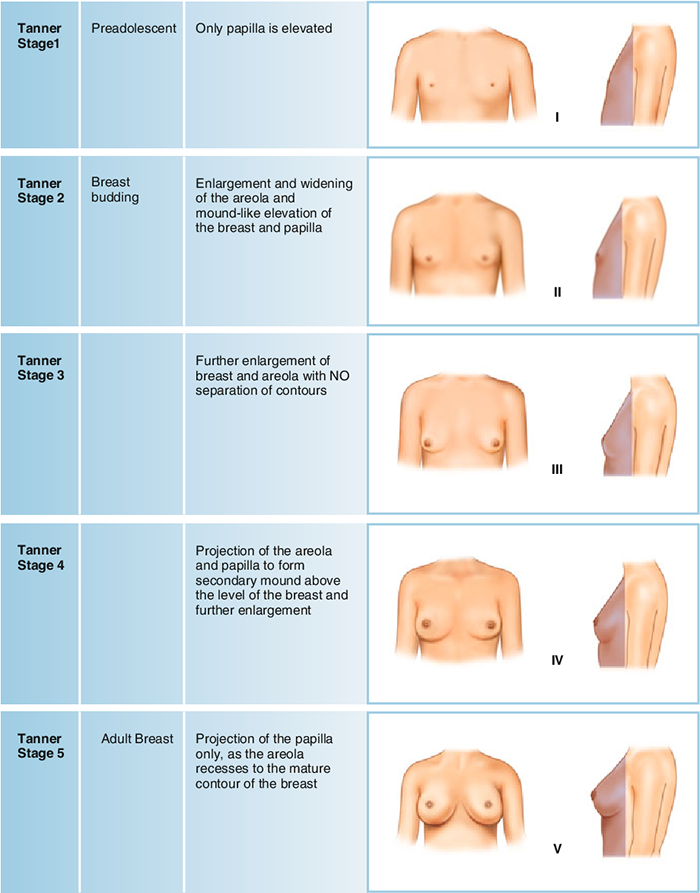
อ้างอิง: Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls (5)
การพัฒนาของขนบริเวณหัวเหน่า
ภาพที่ 3 แสดงการพัฒนาของขนบริเวณหัวเหน่า ( tanner stage of pubic hair)
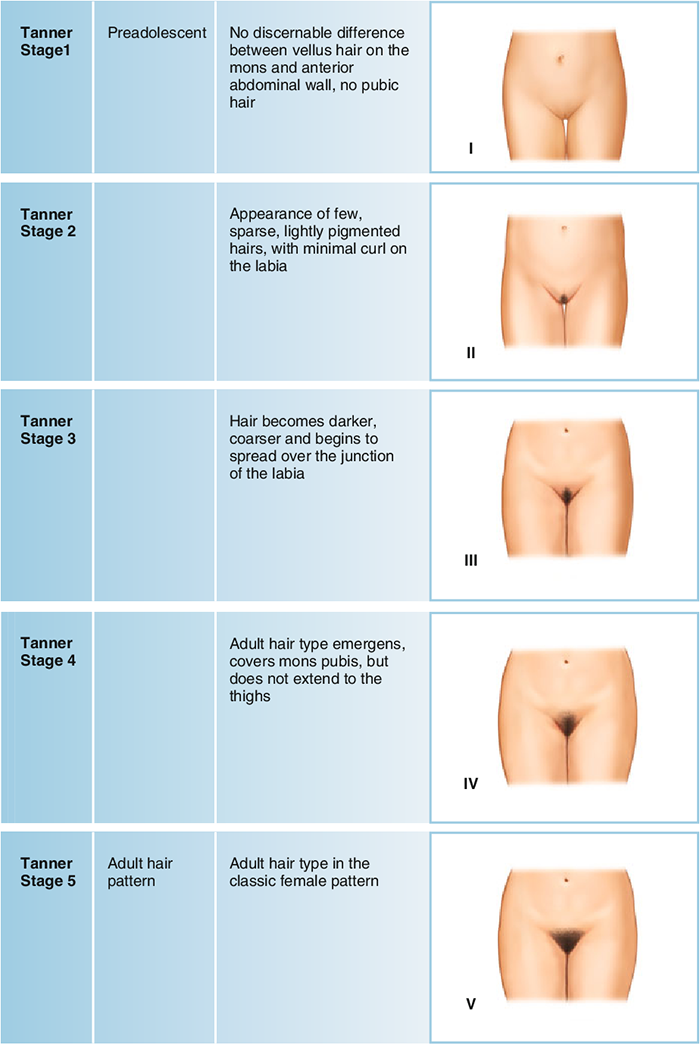
อ้างอิง: Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls (5)
- การตรวจลานสายตา (Visual fields) กรณีสงสัย sellar mass lesion
- ตรวจดูจอตา (Fundoscopic examination) เพื่อดู papilledema กรณีมีภาวะ increase intracranial pressure
- Café-au-lait spots ซึ่งจะพบในกลุ่มที่เป็น neurofibromatosis หรือ McCune-Albright syndrome
• การตรวจทางห้องปฏิบัติการ
o อายุกระดูก (bone age)
การตรวจด้วยการ X-ray บริเวณมือหรือข้อมือ (hand or wrist) เพื่อประเมินอายุกระดูกตามแนวทางของ Greulich and Pyle หรือ Tanner and Whitehouse โดยในเด็กหญิงที่มีภาวะวัยสาวก่อนกำหนด มักพบลักษณะ “advanced bone age” กล่าวคือ อายุกระดูกมากกว่า 2SD ของอายุจริงของเด็ก (chronological age) ซึ่งจะพบในภาวะวัยสาวก่อนกำหนดชนิด GDPP หรือ GIPP มากกว่า benign pubertal variants (6) แต่อย่างไรก็ตามมีรายงานว่าร้อยละ 30 ของ เด็กที่มีภาวะ premature adrenarche พบอายุกระดูกมากกว่าอายุจริงของเด็กประมาณ 2 ปี (7)
o การตรวจระดับฮอร์โมน (hormonal profile) มีแนวทางการตรวจดังแสดงในภาพที่ 4 โดยมีรายละเอียดดังนี้
- Basal serum luteinizing hormone (LH)
เป็นตรวจคัดกรองขั้นต้นที่ดี ในการบ่งบอกว่า HPA axis เริ่มมีการทำงาน โดยในภาวะก่อนเข้าสู่วัยสาว ระดับของ LH ควรมีค่าน้อยกว่า 0.2 IU/L แต่หากพบว่าระดับของ LH มีค่า ตั้งแต่ 0.2-0.3 IU/L ขึ้นไป แสดงว่ามีภาวะ progressive GDPP (8) ส่วน GIPP หรือ benign pubertal variants จะพบระดับของ LH มีค่าใกล้เคียงกับภาวะก่อนเข้าสู่วัยสาว - Basal serum follicle-stimulating hormone (FSH)
FSH ยังมีข้อจำกัดในการนำมาใช้ในการวินิจฉัย เนื่องจากระดับฮอร์โมนอาจสูงได้ในเด็กที่มีภาวะ GDPP แต่อาจมีระดับต่ำได้ในเด็กที่มีภาวะ GIPP นอกจากนั้นในเด็กปกติที่กำลังจะเข้าสู่วัยสาวอาจมีระดับ FSH, LH, E2 ในระดับต่ำ ๆ ได้เช่นเดียวกับเด็กที่ยังไม่เข้าสู่วัยสาว (3) จึงควรระมัดระวังในการแปลผล - GnRH stimulation test
เป็นการทดสอบที่จะนำมาช่วยในการวินิจฉัยเมื่อลักษณะทางคลินิกไม่สัมพันธ์กับระดับฮอร์โมน LH เช่น มีการพัฒนาของลักษณะทางเพศขั้นที่สองชัดเจน แต่ระดับฮอร์โมน LH น้อยกว่า 0.3 IU/L จึงนำการทดสอบนี้มาช่วยแยกภาวะ GDPP และ benign pubertal variants โดยใช้ GnRH agonist 100 ไมโครกรัม ฉีดเข้าหลอดเลือดดำ หรือ Leuprolide acetate 20 ไมโครกรัมต่อกิโลกรัม ฉีดเข้าชั้นใต้ผิวหนัง จากนั้นตรวจวัดระดับ LH และ FSH หลังให้ยา โดยจะวินิจฉัยภาวะ GDPP เมื่อระดับ LH > 4-5 IU/L ที่ 30-60 นาทีหลังให้ยา หรือ ระดับ LH > 5 IU/L ที่นาทีที่ 40 และ 45 ทั้งสองครั้ง ซึ่งความไวของการทดสอบอยู่ที่ร้อยละ 98 และความจำเพาะของการทดสอบอยู่ที่ร้อยละ 100 นอกจากนั้นยังสามารถใช้ LH/FSH ratio ช่วยวินิจฉัยได้ โดยจะวินิจฉัยภาวะ GDPP เมื่อค่า LH/FSH ratio มากกว่า 0.66 (10) - Serum estradiol (E2)
E2 อาจตรวจพบว่ามีระดับสูงได้ใน GIPP ที่มีสาเหตุจากเนื้องอกรังไข่ แต่การตรวจวัดระดับ E2 ใน เด็กช่วงก่อนเข้าสู่วัยสาวหรือช่วงเริ่มต้นวัยสาวนั้นมีความไวต่ำ จึงยังมีข้อจำกัดในการนำมาใช้ในการวินิจฉัย (3) - Serum testosterone
ระดับฮอร์โมน testosterone ในเด็กผู้ชาย มีความไวสูงในการวินิจฉัย precocious puberty หากมีค่าตั้งแต่ 50 ng/dL ขึ้นไปแสดงว่าเข้าสู่วัยหนุ่มแล้ว ระดับ testosterone ที่มีระดับสูงมาก ๆ อาจบ่งบอกว่ามีภาวะ GIPP ได้ นอกจากนั้นการตรวจวัดระดับ DHEAS ที่เป็น adrenal steroid อาจช่วยแยกว่าระดับ androgen ที่สูงนั้นสร้างมาจากต่อมหมวกไตหรืออัณฑะได้ (3)
ภาพที่ 4 แผนภาพแสดงแนวทางการประเมินและวินิจฉัยภาวะวัยสาวก่อนกำหนดในผู้หญิง
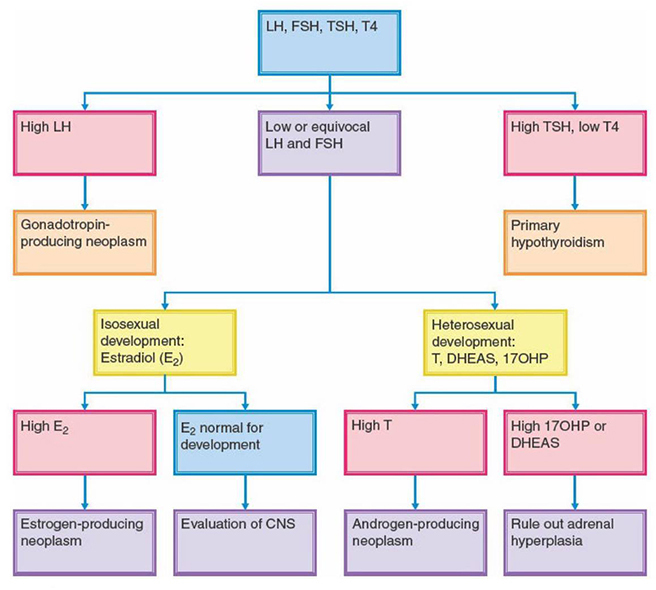
อ้างอิง: S.Berek J. Berek & Novak’s Gynecology 16 ed: Wolters Kluwer 2020.
• การตรวจอื่น ๆ
o การตรวจอวัยวะในอุ้งเชิงกรานด้วยคลื่นเสียงความถี่สูง (pelvic ultrasound)
สามารถช่วยในการวินิจฉัย GIPP ที่เกิดจากถุงน้ำหรือเนื้องอกรังไข่ เนื้องอกต่อมหมวกไต เป็นต้น นอกจากนั้นการตรวจอวัยวะในอุ้งเชิงกรานด้วยคลื่นเสียงความถี่สูงยังสามารถช่วยแยก GDPP กับ benign pubertal variants ได้ ในกรณีที่การวินิจฉัยไม่ชัดเจน โดยเด็กที่มีภาวะ GDPP จะตรวจพบปริมาตรของมดลูกและรังไข่ (uterine and ovary volume) ที่มากกว่าเด็กที่ยังไม่เข้าสู่วัยสาว จากการศึกษาในปี 2008 พบว่าในเด็กที่มีภาวะ GDPP มักมี ปริมาตรของมดลูกมากกว่า 2 มิลลิลิตร และความยาวมากกว่า 34 มิลลิเมตร และมีเยื่อบุโพรงมดลูกที่หนา (11) แต่จากการศึกษาที่พบในปี 2016 (12) พบว่ามีเพียงปริมาตรของมดลูกเท่านั้นที่ช่วยแยกภาวะ GDPP กับ benign pubertal variants ได้ กล่าวคือปริมาตรของมดลูกใน GDPP จะมากกว่าใน benign pubertal variants และจากการวิเคราะห์พบว่าความไวและความจำเพาะของการตรวจนี้ค่อนข้างต่ำ ไม่เหมาะกับการนำมาใช้เป็นข้อบ่งชี้ในการวินิจฉัย
o การตรวจสมองด้วยคลื่นแม่เหล็กไฟฟ้า (brain MRI)
การตรวจนี้แนะนำให้ทำในเด็กผู้ชายทุกคนที่วินิจฉัยว่ามีภาวะ GDPP และในเด็กผู้หญิงอายุน้อยกว่า 6 ปี ที่มีภาวะ GDPP เนื่องจากพบว่า สาเหตุของการเข้าสู่วัยสาวก่อนกำหนดมากจากความผิดปกติของระบบประสาทได้ค่อนข้างบ่อยในคนกลุ่มดังกล่าว รวมถึงเด็กทุกรายที่มีอาการผิดปกติทางระบบประสาทควรได้รับการตรวจสมองด้วยคลื่นแม่เหล็กไฟฟ้าเพื่อหารอยโรคในสมอง
การประเมินและวินิจฉัยภาวะวัยสาวก่อนกำหนด จะเห็นได้ว่ามีหลายขั้นตอนในการประเมินเพื่อให้ได้มาซึ่งการวินิจฉัยว่าแท้จริงแล้วเด็กมีภาวะวัยสาวก่อนกำหนดจริงหรือไม่ เกิดจากสาเหตุใด อยู่ในกลุ่มชนิด GDPP, GIPP หรือ benign pubertal variants ซึ่งการวินิจฉัยที่ถูกต้องแม่นยำ จะนำไปสู่การวางแผนการรักษาที่เหมาะสมต่อไป โดยขั้นตอนการประเมินโดยสรุปเป็นดังภาพที่ 5 ดังนี้
ภาพที่ 5 แสดงแนวทางการประเมินและวินิจฉัยภาวะวัยสาวก่อนกำหนด
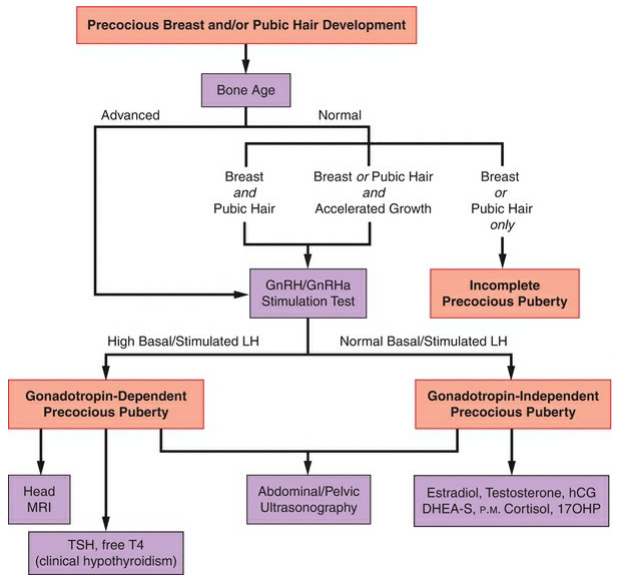
อ้างอิง: Hugh S. Taylor. Speroff’s clinical gynecologic endocrinology and infertility 9 ed: Wolters Kluwer 2020
จากขั้นตอนการประเมินที่กล่าวมาข้างต้น การวินิจฉัยแยกโรคของภาวะวัยสาวก่อนกำหนดว่าเกิดจากสาเหตุใด ต้องอาศัยการรวบรวมข้อมูลจากการซักประวัติ ตรวจร่างกาย การส่งตรวจทางห้องปฏิบัติการ รวมถึงการตรวจทางรังสี ซึ่งสามารถจำแนกภาวะ GDPP, GIPP และ benign pubertal variants ได้ดังตารางที่ 2
ตารางที่ 2 ตารางแสดงการวินิจฉัยแยกโรคสำหรับภาวะ precocious puberty
|
Nonprogressive pubertal variants |
GDPP or Central precocious puberty |
GIPP or Peripheral precocious puberty |
|
| การตรวจร่างกายและลักษณะทางเพศขั้นที่ 2 (Tanner stage) | ไม่มีการเปลี่ยนแปลงของระดับขั้นลักษณะทางเพศขั้นที่สองภายใน 3-6 เดือนจากการสังเกต | มีการเปลี่ยนแปลงของระดับขั้นลักษณะทางเพศขั้นที่สองใน 3-6 เดือน | มีการเปลี่ยนแปลง |
| อัตราเร็วในการเจริญเติบโต (ความสูง) | อัตราเร็วปกติ | อัตราเร็วสูง (มากกว่า 6 เซนติเมตรต่อปี) | อัตราเร็วสูง |
| อายุกระดูก (Bone age) | ปกติหรือมากกว่าอายุจริงเล็กน้อย | มากกว่าอายุจริง (มากกว่า 2SD) | มากกว่าอายุจริง |
| ระดับฮอร์โมนเอสโตรเจน (estrogen) ในเด็กผู้หญิง | เทียบเท่าระดับก่อนเข้าสู่วัยสาว | เทียบเท่าระดับก่อนเข้าสู่วัยสาวและระดับในวัยสาว | เพิ่มขึ้นในกรณีมีสาเหตุจากรังไข่ที่ผิดปกติ (GIPP) หรือได้รับฮอร์โมนเอสโตรเจนจากภายนอกมากเกินไป |
| ระดับฮอร์โมนเทสโทสเทอโรน (testosterone) ในเด็กผู้ชาย หรือเด็กผู้หญิงที่มีภาวะ virilization | เทียบเท่าระดับก่อนเข้าสู่วัยสาว | เทียบเท่าระดับก่อนเข้าสู่วัยสาวและระดับในวัยสาว | เทียบเท่าระดับในวัยสาว หรือเพิ่มขึ้นจากปกติ |
| ระดับฮอร์โมน LH ที่ไม่ได้รับการกระตุ้น (Basal serum LH) | เทียบเท่าระดับก่อนเข้าสู่วัยสาว (<0.2 IU/L) | เทียบเท่าระดับวัยสาว (0.2-0.3 IU/L) | ระดับต่ำกว่าปกติ หรือเทียบเท่าระดับก่อนเข้าสู่วัยสาว |
| GnRH stimulation test |
ระดับ LH เทียบเท่าระดับก่อนเข้าสู่วัยสาว LH:FSH ratio ต่ำ |
ระดับ LH เทียบเท่าระดับวัยสาว LH:FSH ratio สูง (>0.66) |
ไม่มีการเปลี่ยนแปลง หรือระดับ LH เทียบเท่าระดับก่อนเข้าสู่วัยสาว |
อ้างอิง: Oerter KE, Uriarte MM, Rose SR, et al. Gonadotropin secretory dynamics during puberty in normal girls and boys. J Clin Endocrinol Metab 1990; 71:1251
การรักษาภาวะวัยสาวก่อนกำหนดชนิด gonadotropin dependent
การรักษาภาวะเข้าสู่วัยสาวก่อนกำหนดชนิด GDPP ขึ้นอยู่กับสาเหตุ หากเกิดพยาธิสภาพในระบบประสาทส่วนกลาง ไม่ว่าจะเป็นเนื้องอก การติดเชื้อ การได้รับบาดเจ็บ การกำจัดพยาธิสภาพนั้นถือเป็นการรักษาที่เหมาะสม ในส่วนของ hypothalamic hamartomas ที่เป็นเนื้องอกชนิดหนึ่งในระบบประสาทส่วนกลาง และพบเป็นสาเหตุของการเกิดวัยสาวก่อนกำหนดได้บ่อยเป็นอันดับสอง การรักษาจะมุ่งเน้นการติดตามและเฝ้าระวังอาการทางระบบประสาท หากพบมีอาการชัก จะรักษาด้วยยาควบคุมการชัก และหากพบภาวะวัยสาวก่อนกำหนดจากเนื้องอกชนิดนี้สามารถรักษาด้วยยา GnRH agonist เพื่อยับยั้งการเข้าสู่วัยสาวก่อนกำหนดได้ ทั้งนี้การผ่าตัดไม่ใช่ทางเลือกแรกของเนื้องอกชนิดนี้ เนื่องจากเป็นเนื้องอกที่อยู่ในตำแหน่งที่ผ่าตัดยาก มีความเสี่ยงในการผ่าตัดสูง อีกทั้งหลังการผ่าตัดมีรายงานว่า ไม่สามารถรักษาอาการชักที่เกิดจากเนื้องอกให้หายขาดได้
สำหรับการรักษาที่จะขอกล่าวในบทความนี้จะเน้นในส่วนของการรักษา GDPP แบบ idiopathic เป็นหลัก เนื่องจากเป็นสาเหตุที่พบได้บ่อยที่สุด และสามารถรักษาด้วยการใช้ยาได้ โดยในกระบวนการรักษานั้น สิ่งที่ต้องคำนึงถึงและตอบคำถามให้ได้ คือ ใครบ้างควรได้รับการรักษา เป้าหมายการรักษาเป็นอย่างไร แนวทางการรักษา และสามารถตรวจติดตามการรักษาได้เช่นไร ซึ่งจะได้กล่าวในลำดับถัดไป
• กลุ่มเป้าหมายที่ควรได้รับการรักษา
เด็กที่มีภาวะเข้าสู่วัยสาวก่อนกำหนด ไม่จำเป็นต้องได้รับการรักษาด้วยยาในทุกราย บางรายสามารถเจริญเข้าสู่วัยสาวโดยที่ไม่พบความผิดปกติ และระดับความสูงอยู่ในเกณฑ์ที่เหมาะสม ซึ่งกลุ่มที่ควรได้รับการรักษาด้วยยานั้นมีข้อพิจารณา ดังนี้
o อายุ
- ในเด็กผู้หญิงที่มีภาวะ precocious puberty ก่อนอายุ 6 ปี หากได้รับการรักษาด้วย GnRH agonist มีรายงานว่าสามารถเพิ่มความสูงในวัยผู้ใหญ่ (adult height) ได้ 9-10 เซนติเมตร หรือช่วงอายุ 6-8 ปี เพิ่มความสูงได้ 4-7 เซนติเมตร (2)
- หากเกิดภาวะ precocious puberty เมื่ออายุใกล้เคียงกับช่วงอายุปกติที่จะเข้าสู่ภาวะวัยสาว การรักษาอาจไม่จำเป็น
o อัตราการพัฒนาของการเข้าสู่วัยสาว (pubertal progression)
- การพัฒนาแบบรวดเร็ว (rapid progression) ควรได้รับการรักษา
- การพัฒนาแบบช้า (slow progression) ไม่แนะนำรักษาด้วย GnRH agonist จากการศึกษาพบว่าไม่ได้ส่งผลต่อความสูงในวัยผู้ใหญ่มากนัก โดยเฉพาะเด็กที่มีภาวะ precocious puberty หลังอายุ 6 ปี มักจะเป็นพัฒนาการแบบช้า
o การคำนวณความสูงในวัยผู้ใหญ่ (predicted adult height)
- คำนวณความสูงจากความสูงของพ่อแม่ (midparental height or MPH) โดยมีสูตรการคำนวณดังนี้
- เด็กหญิง MPH = (ความสูงพ่อ (ซม.) + ความสูงแม่ (ซม.) – 13) / 2
- เด็กชาย MPH = (ความสูงพ่อ (ซม.) + ความสูงแม่ (ซม.) + 13) / 2
- ความสูงในวัยผู้ใหญ่ที่คาดคะเน คือ MPH ± 8.5 (ซม.)
- การคำนวณความสูงในวัยผู้ใหญ่ หากได้มากกว่า 150 เซนติเมตร ในเด็กผู้หญิง หรือ มากกว่า 160 เซนติเมตร ในเด็กผู้ชาย ไม่แนะนำรักษาด้วย GnRH agonist (2)
จากที่ได้กล่าวมาข้างต้น สรุปได้ว่ากลุ่มที่ควรได้รับการรักษาด้วย GnRH agonist คือ “เด็กผู้หญิงอายุน้อยกว่า 6 ปี ที่มีภาวะ Progressive GDPP พบการพัฒนาของเต้านมและขนบริเวณอวัยวะเพศ, advanced bone age (อายุกระดูกมากกว่าหรือเท่ากับ 1 ปี เมื่อเทียบกับอายุจริง) และอัตราการเพิ่มขึ้นของความสูงอย่างรวดเร็วเร็ว ที่เรียกว่า accelerated height velocity (มากว่า 6 เซนติเมตรต่อปี) ”
“เด็กผู้หญิงที่เกิด late onset GDPP ที่มีการพัฒนาเข้าสู่วัยสาวแบบช้า ไม่พบอัตราการเพิ่มขึ้นของความสูงอย่างรวดเร็ว แนะนำให้ติดตามอาการ 3-6 เดือน จากนั้นประเมินและตัดสินใจการรักษาอีกครั้ง”
• เป้าหมายของการรักษา
o ต้องการหยุดหรือชะลอการพัฒนาเข้าสู่วัยสาวจนกว่าอายุใกล้เคียงกับช่วงเข้าสู่วัยสาวปกติ
o ต้องการให้ความสูงใกล้เคียงความสูงปกติในวัยผู้ใหญ่
o ต้องการบรรเทาความเครียด วิตกกังวลของเด็กและผู้ปกครอง
• การรักษาด้วย GnRH agonist
เป้าหมายการใช้ยาในกลุ่ม GnRH agonist มุ่งหวังเพื่อกดการทำงานของ HPA axis ขนาดยาที่ใช้ในการรักษามีความหลากหลาย โดยมียาที่ใช้ในปัจจุบัน ดังนี้ (2)
o Buserelin 6.3 mg every 2 months
o Goserelin 3.6 mg every months or 9.8 mg every 3 months
o Histrelin 50 mg implant every year
o Leuprolide 3.75-7.5 mg monthly or 11.25 mg every 3 months
o Triptorelin 3.0-3.75 mg monthly or 11.25 mg every 3 months
การติดตามการรักษาหลังจากให้ยากลุ่ม GnRH agonist ว่าการรักษาได้ผลหรือไม่ ควรติดตามทุก 3-6 เดือนเป็นระยะ สิ่งที่ต้องประเมิน มีดังนี้
o พัฒนาการการเข้าสู่วัยสาว: หากการรักษาได้ผล การพัฒนาลักษณะทางเพศขั้นที่สอง (เต้านม, ขนบริเวณอวัยวะเพศ) ควรหยุดการพัฒนา หากมีประจำเดือนก็ควรหายไปหลังการรักษา
o อัตราการเพิ่มขึ้นของความสูง: อัตราการเพิ่มขึ้นของความสูงควรช้าลง
o อายุกระดูก (ควรตรวจทุก 6-12 เดือน): อายุกระดูกควรลดลง รวมถึง ความหนาแน่นของมวลกระดูก (bone density) ควรลดลงด้วยเช่นกัน แต่หลังหยุดการรักษา ค่ามวลกระดูกสูงสุด (peak bone mass) ควรกลับมาเป็นปกติ
o การวัดระดับความเข้มข้นของฮอร์โมน LH ในเลือด: โดยจะเจาะดูระดับ LH ในเลือด ประมาณ 30-60 นาที หลังได้รับการฉีด GnRH agonist ซ้ำในแต่ละครั้ง โดยระดับ LH ควรน้อยกว่า 3.0 IU/L
ระยะเวลาในการรักษาด้วย GnRH agonist ส่วนมากจะหยุดให้ยา เมื่ออายุจริงประมาณ 11 ปี อายุกระดูก 12 ปี และความสูงในวัยผู้ใหญ่ที่คาดคะเนไว้ใกล้เคียงกับความสูงตามพันธุกรรม(1) โดยส่วนใหญ่ GnRH agonist มักไม่พบผลเสียในระยะยาวจากการใช้ยา และไม่มีผลต่อ HPA axis หลังหยุดใช้ยา จากการศึกษาพบว่า HPA axis จะกลับมาทำงานได้ปกติหลังหยุดยาประมาณ 12-18 เดือน
ภาวะเข้าสู่วัยสาวก่อนกำหนดเกิดได้จากหลายสาเหตุ การค้นหาสาเหตุเป็นสิ่งสำคัญ โดยเน้นจากการซักประวัติ ตรวจร่างกาย ประเมินลักษณะทางเพศขั้นที่สอง รวมถึงการตรวจระดับฮอร์โมน เพื่อให้ได้การวินิจฉัยที่ถูกต้อง นำไปสู่การดูแลรักษาที่เหมาะสม เนื่องจากเด็กที่เข้าสู่ภาวะวัยสาวก่อนกำหนดไม่จำเป็นต้องได้รับการรักษาด้วย GnRH agonist ทุกราย ทั้งนี้ขึ้นอยู่กับอายุ อัตราการเพิ่มขึ้นของความสูง อายุกระดูก ที่จะนำมาพิจารณาในการตัดสินใจรักษา เพื่อมุ่งหวังให้เด็กมีความสูงที่ใกล้เคียงกับความสูงตามพันธุกรรม และลดความเครียดวิตกกังวลของทั้งเด็กและผู้ปกครอง ให้เด็กสามารถใช้ชีวิตได้อย่างปกติสุข
เอกสารอ้างอิง
- S.Berek J. Berek & Novak’s Gynecology 16 ed: Wolters Kluwer 2020.
- Hugh S. Taylor. Speroff’s clinical gynecologic endocrinology and infertility 9 ed: Wolters Kluwer 2020.
- Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty. Lancet Diabetes Endocrinol 2016;4:265-74.
- Kota AS, Ejaz S. Precocious Puberty. StatPearls Publishing; 2020 Jan-: https://www.ncbi.nlm.nih.gov/books/NBK544313/
- Chronological ageMarshall WA, Tanner JM. Variations in pattern of pubertal changes in girls. Arch Dis Child 1969 Jun;44(235): 291–303
- Stephen H Bradley , Neil Lawrence, Caroline Steele, Zainaba Mohamed. Precocious puberty. BMJ 2020;368:l6597
- DeSalvo DJ, Mehra R, Vaidyanathan P, Kaplowitz PB. In children with premature adrenarche, bone age advancement by 2 or more years is common and generally benign. J Pediatr Endocrinol Metab 2013; 26:215.
- Bangalore Krishna K, Fuqua JS, Rogol AD, et al. Use of Gonadotropin-Releasing Hormone Analogs in Children: Update by an International Consortium. Horm Res Paediatr 2019; 91:357.
- Wacharasindhu S, Srivuthana S, Aroonparkmongkol S, et al. Final adult height in “early normal pubertal girls” treated with gonadotropin releasing hormone agonists. J Med Assoc Thai 2003;86(Suppl 2):S170-3
- Siti Nadirah Ab Rahim, MBBS1,2, Julia Omar, MBBS, MPaTH3,4, Tuan Salwani Tuan Ismail, MBBS, MPaTH. Gonadotropin-releasing hormone stimulation test and diagnostic cutoff in precocious puberty: a mini review. Annals of Pediatric Endocrinology & Metabolism2020;25:152-155
- Carel JC, Leger J. Precocious puberty (clinical practice). N Engl J Med. 2008; 358:2366-2377
- Sang Heon Lee. The Diagnostic Value of Pelvic Ultrasound in Girls with Central Precocious Puberty. Chonnam Med J 2016;52:70-74
การดูแลต่อการบาดเจ็บอวัยวะระบบทางเดินอาหาร และระบบทางเดินปัสสาวะ
การดูแลต่อการบาดเจ็บอวัยวะระบบทางเดินอาหาร และระบบทางเดินปัสสาวะ ระหว่างผ่าตัดสำหรับสูตินรีแพทย์
(Basic management for gastrointestinal and urinary tract injury during gynecologic surgery)
นพ. พุทธิภณ ใจพรหม
อาจารย์ที่ปรึกษา อ.พญ. ชลัยธร นันทสุภา
การผ่าตัดทางนรีเวช ไม่ว่าจะเป็นการผ่าตัดมดลูก หรือรังไข่ ทั้งการผ่าตัดทางหน้าท้อง ผ่าตัดผ่านช่องคลอด หรือการผ่าตัดผ่านกล้อง อาจเกิดการบาดเจ็บต่อระบบทางเดินอาหาร หรือระบบทางเดินปัสสาวะได้ โดยการบาดเจ็บที่เกิดขึ้น ส่วนใหญ่เป็นการบาดเจ็บเพียงเล็กน้อย (minor injury) ซึ่งหากแพทย์ที่ทำการผ่าตัด มีความรู้เกี่ยวกับแนวทางการวินิจฉัยการบาดเจ็บต่ออวัยวะต่างๆ ระหว่างผ่าตัด รวมถึงมีความรู้เรื่องการซ่อมแซมการบาดเจ็บเบื้องต้น สามารถช่วยให้ผู้ป่วยได้รับการรักษาอย่างทันท่วงทีในการผ่าตัดครั้งเดียว สามารถตัดสินใจปรึกษาแผนกศัลยกรรมอย่างเหมาะสม หรือ กรณีที่สถานการณ์ที่ไม่เอื้อต่อการปรึกษาศัลยแพทย์ และการบาดเจ็บนั้นไม่รุนแรง แพทย์ผู้ผ่าตัดจะสามารถดูแลการบาดเจ็บต่ออวัยวะต่างๆที่เกิดขึ้นเบื้องต้นด้วยตนเองอย่างมั่นใจมากขึ้น
การดูแลการบาดเจ็บอวัยวะระบบทางเดินอาหารระหว่างการผ่าตัดทางนรีเวช
อุบัติการณ์การบาดเจ็บต่อระบบทางเดินอาหาร จากการผ่าตัดทางนรีเวชพบได้ไม่บ่อย เมื่อเกิดขึ้น มีความจำเป็นที่แพทย์ผู้ผ่าตัด ต้องวินิจฉัยให้ได้ในระหว่างการผ่าตัด เพราะการวินิจฉัยได้ในระหว่างผ่าตัด และการแก้ไขอย่างทันท่วงที สามารถลดความรุนแรงของภาวะแทรกซ้อนที่เกิดตามมา จากรายงานประมาณครึ่งหนึ่งจะได้รับการวินิจฉัยในขณะผ่าตัด และอีกครึ่งหนึ่งที่วินิจฉัยได้หลังจากการผ่าตัด ซึ่งในกรณีหลัง จะสัมพันธ์กับอัตราการเสียชีวิตที่เพิ่มขึ้น1-3 การบาดเจ็บของอวัยวะในระบบทางเดินอาหาร ที่พบบ่อย ได้แก่ การบาดเจ็บของลำไส้เล็ก สำไส้ใหญ่ ซึ่งส่วนใหญ่จะเป็นการบาดเจ็บเพียงเล็กน้อย เช่น จากมีดผ่าตัด จากอุปกรณ์จี้ไฟฟ้า (electric coagulation) หรือจากการดึงรั้งเนื้อเยื่อข้างเคียง การบาดเจ็บส่วนใหญ่สามารถรักษาโดยการเย็บซ่อมแซมได้1-4 ยกเว้นการบาดเจ็บที่รุนแรง จำเป็นต้องปรึกษาศัลยแพทย์เพื่อให้การรักษาด้วยการตัดต่อลำไส้ หรือการรักษาที่เหมาะสมต่อไป
โครงสร้างของผนังทางเดินอาหาร ประกอบด้วยผนัง 4 ชั้น เรียงจากด้านนอกไปด้านใน ดังนี้5 (รูปที่ 1)
- Serosa เป็นชั้นเนื้อเยื่อเกี่ยวพัน
- Muscularis propria เป็นชั้นกล้ามเนื้อเรียบ มีการเรียงตัวของกล้ามเนื้อเป็นวงกลม และตามยาวของลำไส้
- Submucosa เป็นชั้นที่มีความแข็งแรงมากที่สุด เนื่องจากชั้นนี้มีองค์ประกอบเป็นเนื้อเยื่อเกี่ยวพันต่างๆ นอกจากนี้ยังประกอบด้วยหลอดเลือด หลอดน้ำเหลือง และเส้นประสาทอยู่ในชั้นนี้
- Mucosa ซึ่งยังแบ่งต่อเป็นชั้น muscularis mucosae, lamina propria และ epithelium ตามลำดับ
รูปที่ 1 แสดงผนังของทางเดินอาหาร
ที่มา Brunicardi FC, et al. Schwartz’s Principles of surgery. 2019
การวินิจฉัยการบาดเจ็บของลำไส้เล็ก ลำไส้ใหญ่ ในขณะผ่าตัด ต้องอาศัยความละเอียดรอบคอบของแพทย์ ตั้งแต่การประเมินความเสี่ยงก่อนการผ่าตัด ว่ามีความเสี่ยงต่อการผ่าตัดที่ยากลำบาก เช่น มีประวัติเคยผ่าตัดในอุ้งเชิงกราน มีภาวะเยื่อบุมดลูกเจริญผิดที่ (endometriosis) เป็นต้น เพื่อจะได้วางแผนป้องกันการบาดเจ็บต่ออวัยวะข้างเคียง และในขณะผ่าตัดก็ต้องอาศัยความระมัดระวังต่อการบาดเจ็บที่อาจเกิดขึ้น หากเห็นการบาดเจ็บต่อลำไส้เล็ก หรือลำไส้ใหญ่ที่ชัดเจน สามารถให้การวินิจฉัยได้ทันที แล้วจึงแบ่งระดับความรุนแรงของการบาดเจ็บนั้นๆ เพื่อให้การรักษาที่เหมาะสมต่อไป ในบางกรณี อาจไม่เห็นการบาดเจ็บที่ชัดเจน แต่สงสัยว่าจะมีการบาดเจ็บต่อลำไส้เล็ก หรือสำไส้ใหญ่ จำเป็นต้องใช้การทดสอบเพิ่มเติม เพื่อช่วยยืนยันว่ามีการบาดเจ็บต่อลำไส้เกิดขึ้น การทดสอบทางเดินอาหารรั่วในระหว่างการผ่าตัดพิจารณาตามตำแหน่งที่สงสัยการบาดเจ็บ ได้แก่
- สงสัยการบาดเจ็บในส่วนของ sigmoid colon หรือ rectum การใส่ลมเข้าไปในทางเดินอาหาร (air leak test) สามารถทดสอบโดยการเทน้ำเกลืออุ่น (0.9% NaCl) ลงไปในอุ้งเชิงกรานให้ท่วมถึงบริเวณลำไส้ที่สงสัยว่ามีการบาดเจ็บ แล้วใช้มือ หรือยางรัดส่วนของ proximal colon ไว้ เพื่อป้องกันไม่ให้ลมไหลไปส่วนอื่น แล้วใส่ลมเข้าไปทางทวารหนัก โดยใช้ bulb syringe หรือ proctoscope แล้วดันลมเข้าไปทาง rectum แล้วสังเกตฟองอากาศที่เกิดขึ้นในน้ำ ซึ่งจะบ่งบอกตำแหน่งของการบาดเจ็บได้ บางครั้งเรียกการทดสอบนี้ว่า ” flat tire test “6, 7
- สงสัยการบาดเจ็บในส่วนของ small bowel สามารถทดสอบด้วย air leak test ได้โดยการเทน้ำเกลืออุ่น ให้ท่วมบริเวณลำไส้เล็กส่วนที่สงสัย ใช้มือ หรือยางรัดส่วนของ distal small bowel ไว้ แล้วขอให้วิสัญญีแพทย์ช่วยใส่ลมเข้าไปทาง nasogastric tube สังเกตฟองอากาศที่เกิดขึ้นในน้ำ ซึ่งสามารถบอกตำแหน่งของการบาดเจ็บได้
อย่างไรก็ตามหากสงสัยว่ามีการบาดเจ็บต่อทางเดินอาหาร แต่ไม่สามารถทดสอบด้วยวิธีดังกล่าวได้ จำเป็นต้องปรึกษาศัลยแพทย์เพื่อช่วยประเมินระหว่างการผ่าตัด
หลังจากที่วินิจฉัยได้แล้วว่ามีการบาดเจ็บต่ออวัยวะระบบทางเดินอาหาร มีความจำเป็นที่จะต้องประเมินระดับความรุนแรงที่เกิดขึ้น เพื่อพิจารณาว่าสามารถจัดการเย็บซ่อมบาดแผลนั้นได้เอง หรือควรปรึกษาศัลยแพทย์ โดยในบทความนี้จะแบ่งระดับการบาดเจ็บตาม Glaser and Milad6 ดังนี้
- Superficial sharp, small thermal injuries การบาดเจ็บเพียงบริเวณชั้นผิวของลำไส้บริเวณ serosa หรือการบาดเจ็บขนาดเล็กจากเครื่องจี้ไฟฟ้า
- Partial thickness seromuscular การบาดเจ็บที่ชั้นของ serosa ลงไปถึงชั้นกล้ามเนื้อเรียบ
- Full thickness, less than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังลำไส้ที่ขนาดเล็กกว่า 1 ซม.
- Full thickness, more than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังลำไส้ที่ขนาดใหญ่กว่า 1 ซม.
- Large, delayed, necrotic, grossly infected, complicated บาดแผลขนาดใหญ่ เรื้อรัง มีเนื้อเยื่อลำไส้ส่วนที่ติดเชื้อ หรือมีเนื้อตายบริเวณบาดแผล
การบาดเจ็บระดับที่ 4 หรือ 5 ควรปรึกษาศัลยแพทย์ เพื่อทำการเย็บซ่อม หรือตัดต่อลำไส้ ในขณะที่ระดับ 1 ถึง 3 สูติ-นรีแพทย์อาจพิจารณาทำการเย็บซ่อมได้เอง (เฉพาะแพทย์ที่ได้รับการฝึกฝนมา หรือมีประสบการณ์ในการผ่าตัดเย็บซ่อมลำไส้) อย่างไรก็ตาม หากแพทย์ผู้ผ่าตัดไม่มั่นใจหรือไม่มีประสบการณ์ควรปรึกษาศัลยแพทย์ทันที การดูแลรักษาการบาดเจ็บของลำไส้ แบ่งตามระดับความรุนแรง ได้สรุปไว้ ในตารางที่ 1 สำหรับการให้ยาปฏิชีวนะหลังการผ่าตัด กรณีที่ผู้ป่วยได้รับยาปฏิชีวนะป้องกันการติดเชื้อแล้วก่อนผ่าตัด (prophylactic antibiotics) และระหว่างผ่าตัดไม่มีการ contamination ของ content ภายในลำไส้ ไม่มีความจำเป็นต้องได้รับยาปฏิชีวนะหลังการผ่าตัด แต่กรณีที่ผู้ป่วยไม่ได้รับยาฆ่าเชื้อที่เหมาะสมก่อนการผ่าตัด หรือระหว่างผ่าตัดมีการ contamination ควรเลือกยาฆ่าเชื้อชนิด broad spectrum โดยให้ต่อไปหลังผ่าตัดอย่างน้อย 24 ชั่วโมง6
ตารางที่ 1 แนวทางการดูแลการบาดเจ็บของลำไส้ แบ่งตามความรุนแรงของบาดแผล
|
Injury type |
Management |
Postoperative diet |
|
1.Superficial sharp, small thermal injuries |
Primary oversewing, 3-0 delayed absorbable |
Routine |
|
2.Partial thickness seromuscular |
Primary interrupted, 2-0 or 3-0 delayed absorbable |
Routine |
|
3.Full thickness, less than 1 cm |
Two-layer closure, with or without closed-suction drain placement |
Routine |
|
4.Full thickness, more than 1 cm |
Primary repair or resection and re-anastomosis, with or without closed suction drain placement |
Clear liquid diet until return of bowel function |
|
5.Large, delayed, necrotic, grossly infected, complicated |
Resection and re-anastomosis plus or minus diverting proximal ostomy, plus closed suction drain placement |
Clear liquid diet until return of bowel function |
ดัดแปลงจาก Glaser LM, et al. Bowel and Bladder Injury Repair and Follow-up After Gynecologic Surgery. Obstet Gynecol, 2019
หลักการเย็บซ่อมแซมบาดแผลบริเวณลำไส้
ในการเย็บซ่อมแซม หรือตัดต่อลำไส้ มีหลากหลายวิธี การพิจารณาขึ้นอยู่กับหลายปัจจัย เช่น ตำแหน่งได้รับบาดเจ็บ ลักษณะหรือสุขภาพของเนื้อเยื่อที่ได้รับความเสียหาย ความชำนาญของแพทย์ เป็นต้น โดยยึดหลักสำคัญ คือลักษณะของเนื้อเยื่อที่นำมาต่อกันต้องเป็นส่วนที่มีสุขภาพดี มีเลือดมาเลี้ยงเพียงพอ การเย็บหรือเชื่อมต่อลำไส้ด้วยความนุ่มนวลและสะอาด8 ชนิดของไหมที่ใช้ในการเย็บแผลที่ลำไส้ ใช้เป็น absorbable suture หรือ delayed absorbable suture ขนาด 3-0, 2-0 เช่น Vicryl และในกรณีที่เย็บ two layer techniques ชั้นนอกอาจใช้ได้ทั้ง delayed absorbable suture 3-0 หรือ silk 3-0 ก็ได้9
บทความนี้จะเสนอตัวอย่างวิธีการเย็บซ่อมลำไส้ โดยวิธี Lembert suture pattern และ Czerny – Lembert suture pattern
- Lembert suture pattern ใช้การเย็บด้วยวิธี interrupted suture เริ่มจากลำไส้ฝั่งหนึ่งที่บริเวณ serosa ห่างจากขอบแผล ปลายเข็มผ่านชั้นกล้ามเนื้อเรียบ(Muscularis propria) แต่ไม่ทะลุผ่านชั้น mucosa แล้วออกมาที่ชั้น serosa อีกครั้งหนึ่ง ในบริเวณที่ใกล้ขอบแผล จากนั้นเย็บลำไส้อีกฝั่งจากชั้น serosa บริเวณใกล้ขอบแผล ปลายเข็มผ่านชั้นกล้ามเนื้อ แต่ไม่ทะลุผ่านชั้น mucosa แล้วออกมาที่ชั้น serosa อีกครั้งหนึ่ง ในบริเวณที่ไกลขอบแผล ดังรูปที่ 2 เป็นการเย็บที่ทำให้ serosa ของลำไส้ทั้งสองฝั่งมาชนกันและติดกันได้ และสามารถ inverted ผนังลำไส้ได้ ข้อดีในการเย็บวิธีนี้ ทำได้รวดเร็ว นำไปใช้กับทางเดินอาหารได้ทุกส่วน สามารถปิดช่องว่างของลำไส้ ทำให้ลมหรืออุจจาระไม่สามารถผ่านออกมานอกรอยเย็บได้
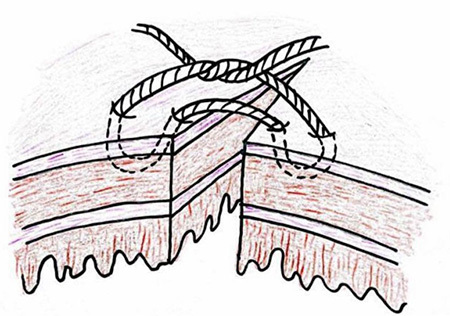
รูปที่ 2 แสดงการเย็บวิธี Lembert suture pattern
ที่มา https://mir.ismu.baikal.ru/src/downloads/3cb17a69_intestinal_suture.pdf, Kantor J. Atlas of suturing techniques2016
- Czerny – Lembert suture pattern เป็นการเย็บ interrupted suture 2 ชั้น โดยชั้นในเย็บ interrupted suture ผ่าน mucosa หรือ Submucosa และชั้นที่สองเย็บด้วย Lembert suture pattern ซึ่งอาจเรียกการเย็บวิธีนี้ว่า two-layer suture ดังรูปที่ 3 โดยแผลที่ขนานกับแนวของลำไส้ ควรเย็บแผลให้ตั้งฉากกับแนวแผล เพื่อป้องการการตีบแคบของรูลำไส้8, 10 ดังรูปที่ 4
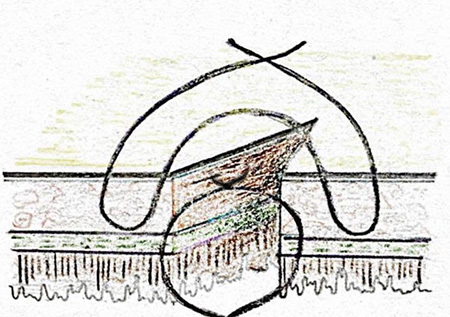
รูปที่ 3 แสดงการเย็บวิธี Czerny – Lembert suture pattern
ที่มา https://mir.ismu.baikal.ru/src/downloads/3cb17a69_intestinal_suture.pdf
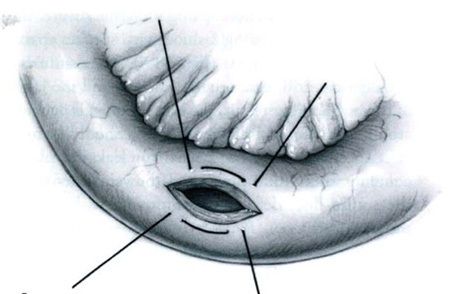
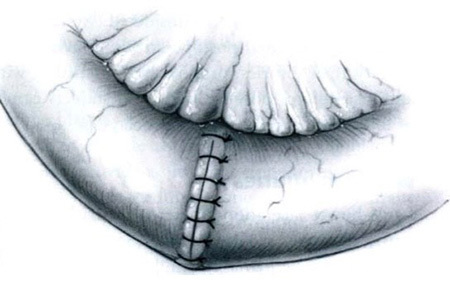
รูปที่ 4 แสดงการเย็บแบบตั้งฉากกับแนวแผล6
ที่มา Glaser LM, Milad MP. Bowel and Bladder Injury Repair and Follow-up After Gynecologic Surgery, 2019
การดูแลการบาดเจ็บอวัยวะระบบทางเดินปัสสาวะระหว่างการผ่าตัดทางนรีเวช
อุบัติการณ์ของการบาดเจ็บต่อระบบทางเดินปัสสาวะ จากการผ่าตัดทางนรีเวชพบได้น้อย ประมาณร้อยละ 1-29, 11 การบาดเจ็บของอวัยวะที่พบได้บ่อย ได้แก่ ท่อไต และกระเพาะปัสสาวะ โดยมีปัจจัยเสี่ยงที่คล้ายกัน ด้วยธรรมชาติทางกายวิภาคที่เป็นพื้นที่จำกัดภายในอุ้งเชิงกราน ทำให้ภาวะต่างๆ เช่น การเคยผ่าตัดบริเวณอุ้งเชิงกราน การเคยฉายแสง การมีเนื้องอกบริเวณอุ้งเชิงกราน หรือภาวะใดๆที่ทำให้ลักษณะทางกายวิภาคในอุ้งเชิงกรานผิดปกติไปจากเดิม ส่งผลทำให้การระบุตำแหน่งของท่อไตลำบากมากขึ้น และเพิ่มโอกาสการบาดเจ็บต่ออวัยวะระบบทางเดินปัสสาวะ
กายวิภาคของกระเพาะปัสสาวะมีลักษณะคล้ายถุงทรงกลม อยู่ในอุ้งเชิงกราน วางตัวอยู่หลังต่อ pubic symphysis เรียกบริเวณของกระเพาะปัสสาวะนี้ว่า apex และอยู่หน้าต่อ uterus, cervix และ vagina เรียกส่วนนี้ว่า base หรือ fundus ดังรูปที่ 5 บริเวณส่วน base จะมี trigone ซึ่งเป็นตำแหน่งที่มีลักษณะเป็นรูปสามเหลี่ยมที่มีท่อไตมาเปิดเข้า อยู่ด้านข้างของสามเหลี่ยม 2 มุม (ureteric orifices) ส่วนมุมด้านล่างของสามเหลี่ยมนี้จะเป็นท่อเปิดปัสสาวะ ดังรูปที่ 6 และบริเวณที่อยู่ระหว่าง apex และ base จะเรียกว่า body of bladder โดยผนังด้านบน (superior) จะเรียกว่า dome of bladder
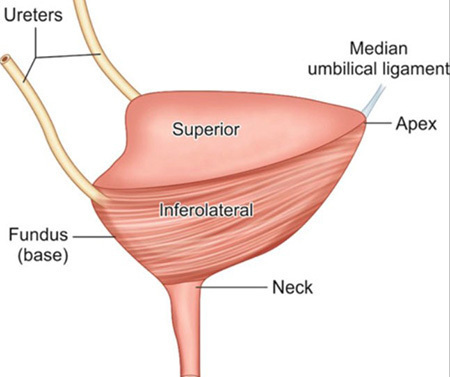
รูปที่ 5 แสดงกายวิภาคของกระเพาะปัสสาวะ
ที่มา Moses K P., Banks J C, Nava P B., Petersen D K. Atlas of clinical gross anatomy, 2013
รูปที่ 6 แสดงผนังของกระเพาะปัสสาวะ
ที่มา https://teachmeanatomy.info/pelvis/viscera/bladder/
กระเพาะปัสสาวะ ในสภาวะปกติ ผนังของกระเพาะปัสสาวะหนาประมาณ 3-5 มม. ซึ่งประกอบด้วยชั้นต่างๆ เรียงจากด้านในไปสู่ด้านนอก ทั้งหมด 4 ชั้น ดังนี้
- Mucosa เยื่อบุผิวกระเพาะปัสสาวะ เป็นเยื่อบุผิวชนิด urothelium หรือ transitional epithelium ซึ่งเป็นชนิดเดียวกับเยื่อบุบริเวณท่อไต และท่อปัสสาวะ
- Submucosa ชั้นที่มีองค์ประกอบเป็นเนื้อเยื่อเกี่ยวพัน เช่น คอลลาเจน และหลอดเลือด หลอดน้ำเหลือง
- Muscular layer เป็นชั้นกล้ามเนื้อเรียบที่หนา และ มีการเรียงตัวเป็น 3 ชั้นในแนวต่างกัน ชั้นด้านใน และชั้นนอก เรียงตัวในแนวยาว ส่วนชั้นกลางเรียงตัวเป็นรอบวง เรียกกล้ามเนื้อเหล่านี้ว่า detrusor muscle
- Adventitia เป็นชั้นเนื้อเยื่อเกี่ยวพันที่เรียงตัวหลวมๆ และบริเวณด้านบน และด้านข้างของกระเพาะปัสสาวะจะถูกหุ้มด้วยชั้น serosa ของเยื่อบุช่องท้อง ดังรูปที่ 6
การบาดเจ็บของกระเพาะปัสสาวะจากการผ่าตัดทางนรีเวช ส่วนใหญ่จะเป็นแผลฉีกขาด และตำแหน่งที่บาดเจ็บ มักเป็นส่วน dome ของกระเพาะปัสสาวะ ซึ่งสังเกตเห็นบาดแผลได้ง่าย หรืออาจเห็น foley catheter ที่อยู่ในกระเพาะปัสสาวะ หรือเห็นน้ำปัสสาวะไหลออกมาในอุ้งเชิงกราน กรณีต่างๆข้างต้น ทำให้สามารถให้การวินิจฉัยได้ทันที มีบางครั้งอาจไม่เห็นรอยแผลบาดเจ็บชัดเจน แต่สงสัยว่าจะมีการบาดเจ็บต่อกระเพาะปัสสาวะเกิดขึ้น เช่น การเห็นน้ำปัสสาวะในถุงเก็บมีเลือดปน หรือโดนเข็มเย็บเกี่ยวส่วนที่สงสัยว่าเป็นกระเพาะปัสสาวะ จำเป็นต้องทดสอบเพื่อยืนยันว่ามีการบาดเจ็บต่อกระเพาะปัสสาวะหรือไม่ ซึ่งการช่วยวินิจฉัย มีหลายวิธี เช่นการฉีด sodium fluorescein ทางเส้นเลือดดำจะทำให้ปัสสาวะเป็นสีเขียว สังเกตการรั้วของสีปัสสาวะที่ออกมาในอุ้งเชิงกราน หรือฉีด indigo carmine ซึ่งจะทำให้สีปัสสาวะเป็นสีน้ำเงิน หรือการใส่น้ำเกลือที่ผสม methylene blue เข้าไปในกระเพาะปัสสาวะ ปริมาณ 200-300 มิลลิลิตร แล้วสังเกตการรั่วของสี methylene blue 6, 11, 12 ความสำคัญของการระบุบาดแผลที่กระเพาะปัสสาวะคือ ตำแหน่ง trigone เนื่องจากเป็นตำแหน่งที่ไม่สามารถเย็บซ่อมแซมเอง ได้ การบาดเจ็บต่อกระเพาะปัสสาวะ สามารถจัดแบ่งระดับความรุนแรงตาม Glaser and Milad6 ได้เป็น
- Pinpoint full thickness, serosal injury only การบาดเจ็บที่มีลักษณะเป็นรูเล็ก ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ หรือการบาดเจ็บเฉพาะที่ชั้นของ serosa
- Nontrigonal, less than 1cm การบาดเจ็บที่ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ ขนาดเล็กกว่า 1 ซม. ที่ไม่ใช่ตำแหน่ง trigone
- Nontrigonal, more than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ ขนาดใหญ่กว่า 1 ซม. ที่ไม่ใช่ตำแหน่ง trigone
- Trigonal, complicated, necrotic, infected injury การบาดเจ็บตำแหน่ง trigone หรือ การบาดเจ็บที่แผลซับซ้อน มีเนื้อตาย หรือมีเนื้อเยื่อกระเพาะปัสสาวะส่วนที่ติดเชื้อ
ในกรณีที่ไม่สามารถระบุตำแหน่งบาดแผลได้ หรือการบาดเจ็บเป็นระดับที่ 4 ควรปรึกษาศัลยแพทย์ทางเดินปัสสาวะทันที ส่วนแนวทางการดูแลบาดแผลบริเวณกระเพาะปัสสาวะ โดยจำแนกตามระดับความรุนแรง ได้สรุปไว้ในตารางที่ 2
ตารางที่ 2 แนวทางการดูแลแผลบาดเจ็บของกระเพาะปัสสาวะ จำแนกตามระดับความรุนแรง
|
Injury type |
Management |
Postoperative care |
|
1.Pinpoint full thickness, serosal injury only |
Expectant management |
Routine |
|
2.Nontrigonal, less than 1cm |
Primary repair or expectant management |
Urinary catheter decompression x 1wk |
|
3.Nontrigonal, more than 1 cm |
Primary repair, 1-2 layers, plus or minus closed suction drain |
Urinary catheter decompression x 1-2 wk with or without cystogram |
|
4.Trigonal, complicated, necrotic, infected injury |
Specialist consultation, repair, possible stenting or reimplantation, closed suction drain |
Urinary catheter decompression, possible stenting, CT urogram |
ดัดแปลงจาก Glaser LM, et al. Bowel and Bladder Injury Repair and Follow-up After Gynecologic Surgery. Obstet Gynecol, 2019
หลักในการเย็บซ่อมบาดแผลที่กระเพาะปัสสาวะ และท่อไต
การเย็บซ่อมบาดแผลกระเพาะปัสสาวะที่ไม่ใช่ส่วน trigone สามารถเย็บซ่อมแบบ 1 หรือ 2 ชั้นก็ได้ โดยใช้ไหมละลาย absorbable suture ขนาด 2-0, 3-0 เช่น Vicryl หรือ Monocryl ในกรณีที่เย็บเป็น 1 ชั้น ให้เย็บทุกชั้นของผนังกระเพาะปัสสาวะ อาจเย็บเป็น interrupted หรือ running ก็ได้ แต่ในกรณีที่เย็บซ่อมแบบ 2 ชั้นนั้น ชั้นด้านใน ให้เย็บชั้น mucosa, submucosa และ muscular layer เข้าด้วยกัน ส่วนชั้นนอกให้เย็บบริเวณ seromuscular อาจเย็บเป็น interrupted หรือ running ก็ได้ ในกรณีที่แผลมีขนาดใหญ่ อาจเย็บเพิ่มอีกชั้น และลดโอกาสแผลรั่วด้วยการนำ omental flap มาปิด หลังจากเย็บซ่อมแล้วควรมีการทดสอบรอยรั่วบริเวณบาดแผลที่เย็บซ่อม โดยใส่น้ำเข้าไปในกระเพาะปัสสาวะ ปริมาณ 300 มิลลิลิตร ผ่าน foley catheter แล้วสังเกตการรั่วของน้ำที่รอยเย็บ อาจผสม methylene blue เพื่อช่วยให้เห็นชัดเจนยิ่งขึ้น พิจารณาวาง drain ตามระดับการการบาดเจ็บของแผล6, 9, 11 หลังผ่าตัดควรให้ยาปฏิชีวนะครอบคลุมแบคทีเรียชนิดกรัมลบ เพื่อป้องกันการติดเชื้อ7
สำหรับการบาดเจ็บของท่อไต ทุกรายควรปรึกษาศัลยแพทย์ทางเดินปัสสาวะ การบาดเจ็บท่อไตจากการผ่าตัดทางนรีเวช โดยเฉพาะการผ่าตัดมดลูก มีตำแหน่งของท่อไตที่ได้รับการบาดเจ็บบ่อย13 ได้แก่
- ตำแหน่งที่ท่อไตเข้าสู่ pelvis บริเวณ pelvic brim
- ตำแหน่งที่ base of broad ligament ซึ่งท่อไตจะลอดใต้ต่อ uterine artery
- ตำแหน่งที่ท่อไตจะผ่านเข้าไปใน cardinal ligament ที่ระดับ internal cervical os
- ตำแหน่งที่อยู่ด้านหน้าและด้านข้าง fornix of vagina แล้วเข้าสู่กระเพาะปัสสาวะ
- ตำแหน่งด้านข้าง pelvic sidewall เหนือต่อ uterosacral ligament
การเฝ้าระวังและคอยสังเกตว่ามีการบาดเจ็บต่อท่อไต ที่เกิดขึ้นในระหว่างการผ่าตัดมีความสำคัญ เนื่องจากการรักษาที่ทันท่วงที จะช่วยลดความรุนแรงที่จะเกิดตามมาได้อย่างชัดเจน เช่น การมีปัสสาวะรั่วในช่องท้อง การติดเชื้อในกระแสเลือด การบาดเจ็บต่อท่อไตสามารถวินิจฉัยได้ทันที ถ้าเห็นน้ำปัสสาวะไหลออกจากปลายท่อไตที่ถูกตัด หรือเห็นบาดแผลชัดเจน แต่ในกรณีที่เห็นไม่ชัดเจน แต่สงสัยการบาดเจ็บต่อท่อไต อาจทำการทดสอบ dye test โดยการฉีด phenazopyridine hydrochloride หรือ indigo carmine หรือ methylene blue ทางหลอดเลือดดำ แล้วสังเกตปัสสาวะที่รั่วออกมาจากปลายท่อไตที่บาดเจ็บ เพื่อให้การวินิจฉัยในขณะผ่าตัด แล้วพิจารณาปรึกษาศัลยแพทย์ทางเดินปัสสาวะ ในการซ่อมแซมต่อไป
ในการผ่าตัดทั้งทางสูติศาสตร์และนรีเวช แพทย์ผู้ผ่าตัดต้องสามารถประเมินความเสี่ยงตั้งแต่ก่อนผ่าตัด ในรายที่มีความเสี่ยงของการผ่าตัดยาก และมีโอกาสบาดเจ็บต่ออวัยวะข้างเคียงสูง ควรมีการปรึกษาศัลยกรรมมาร่วมประเมินและผ่าตัดร่วมกันตั้งแต่แรก นอกจากนี้ การประเมินสถานการณ์ และการวินิจฉัยให้ได้เมื่อสงสัยการบาดเจ็บของอวัยวะข้างเคียงที่เกิดขึ้นนั้น ก็สำคัญอย่างมาก เนื่องจากจะช่วยให้ผู้ป่วยได้รับการซ่อมแซมและแก้ไขได้ทันท่วงที ช่วยลดอัตราความเจ็บป่วย (morbidity) และอัตราการเสียชีวิตได้ ในการบาดเจ็บที่ไม่รุนแรง แพทย์ผู้ผ่าตัดสามารถเย็บซ่อมแซมเองได้ แต่ต้องมีประสบการณ์ อย่างไรก็ตามหากไม่สามารถวินิจฉัยได้ชัดเจน แต่ยังสงสัยการบาดเจ็บอยู่ หรือไม่มั่นใจในความรุนแรงของแผล หรือไม่มีประสบการณ์การเย็บซ่อมแซมมาก่อน ควรปรึกษาศัลยแพทย์มาช่วยประเมินและดูแลรักษาร่วมกัน
เอกสารอ้างอิง
- Mesdaghinia E, Abedzadeh-Kalahroudi M, Hedayati M, Moussavi-Bioki N. Iatrogenic gastrointestinal injuries during obstetrical and gynecological operation. Arch Trauma Res. 2013;2(2):81-4.
- Krebs HB. Intestinal injury in gynecologic surgery: a ten-year experience. Am J Obstet Gynecol. 1986;155(3):509-14.
- Llarena NC, Shah AB, Milad MP. Bowel injury in gynecologic laparoscopy: a systematic review. Obstet Gynecol. 2015;125(6):1407-17.
- Eisner IS, Wadhwa RK, Downing KT, Singhal PK. Prevention and management of bowel injury during gynecologic laparoscopy: an update. Curr Opin Obstet Gynecol. 2019;31(4):245-50.
- Brunicardi FC, Andersen DK, Billiar TR, Dunn DL, Hunter JG, Kao LS, et al. Schwartz’s Principles of surgery. 11th ed. New York: McGraw-Hill; 2019.
- Glaser LM, Milad MP. Bowel and Bladder Injury Repair and Follow-up After Gynecologic Surgery. Obstet Gynecol. 2019;133(2):313-22.
- โชติรสนิรมิต น. Surical complication. 1st ed. เชียงใหม่: หน่วยงานวารสารวิชาการ งานบริการการศึกษา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่; 2548.
- จันท์แสนโรจน์ ป, สังข์ทอง น, จิตตวัฒนรัตน์ ก, โตวิกภัย ช, สิริกุลพิลูลย์ ส, เอื้อพานิชเจริญ เ. ศัลยศาสตร์วิวัฒน์ เล่มที่ 58. 1st ed. กรุงเทพฯ: ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย; 2562.
- Handa VL, Van Le L, editors. Te Linde’s Operative Gynecology. 12th ed. Philadelphia: Lippincott Williams and Wilkins; 2020.
- Kantor J. Atlas of suturing techniques : approaches to surgical wound, laceration, and cosmetic repair. New York: McGraw-Hill; 2016.
- McDougal WS, Wein AJ, Kavoussi LR, Partin AW, Peters CA. Campbell-Walsh Urology 12th Edition Review E-Book. 12th ed: Elsevier Health Sciences; 2021.
- Sharp HT, Adelman MR. Prevention, Recognition, and Management of Urologic Injuries During Gynecologic Surgery. Obstet Gynecol. 2016;127(6):1085-96.
- Sorinola O, Begum R. Prevention and management of ureteric injuries. Hosp Med. 2005;66(6):329-34.
การดูแลต่อการบาดเจ็บอวัยวะระบบทางเดินอาหาร และระบบทางเดินปัสสาวะ ระหว่างผ่าตัดสำหรับสูตินรีแพทย์ (Basic management for gastrointestinal and urinary tract injury during gynecologic surgery)
การผ่าตัดทางนรีเวช ไม่ว่าจะเป็นการผ่าตัดมดลูก หรือรังไข่ ทั้งการผ่าตัดทางหน้าท้อง ผ่าตัดผ่านช่องคลอด หรือการผ่าตัดผ่านกล้อง อาจเกิดการบาดเจ็บต่อระบบทางเดินอาหาร หรือระบบทางเดินปัสสาวะได้ โดยการบาดเจ็บที่เกิดขึ้น ส่วนใหญ่เป็นการบาดเจ็บเพียงเล็กน้อย (minor injury) ซึ่งหากแพทย์ที่ทำการผ่าตัด มีความรู้เกี่ยวกับแนวทางการวินิจฉัยการบาดเจ็บต่ออวัยวะต่างๆ ระหว่างผ่าตัด รวมถึงมีความรู้เรื่องการซ่อมแซมการบาดเจ็บเบื้องต้น สามารถช่วยให้ผู้ป่วยได้รับการรักษาอย่างทันท่วงทีในการผ่าตัดครั้งเดียว สามารถตัดสินใจปรึกษาแผนกศัลยกรรมอย่างเหมาะสม หรือ กรณีที่สถานการณ์ที่ไม่เอื้อต่อการปรึกษาศัลยแพทย์ และการบาดเจ็บนั้นไม่รุนแรง แพทย์ผู้ผ่าตัดจะสามารถดูแลการบาดเจ็บต่ออวัยวะต่างๆที่เกิดขึ้นเบื้องต้นด้วยตนเองอย่างมั่นใจมากขึ้น
การดูแลการบาดเจ็บอวัยวะระบบทางเดินอาหารระหว่างการผ่าตัดทางนรีเวช
อุบัติการณ์การบาดเจ็บต่อระบบทางเดินอาหาร จากการผ่าตัดทางนรีเวชพบได้ไม่บ่อย เมื่อเกิดขึ้น มีความจำเป็นที่แพทย์ผู้ผ่าตัด ต้องวินิจฉัยให้ได้ในระหว่างการผ่าตัด เพราะการวินิจฉัยได้ในระหว่างผ่าตัด และการแก้ไขอย่างทันท่วงที สามารถลดความรุนแรงของภาวะแทรกซ้อนที่เกิดตามมา จากรายงานประมาณครึ่งหนึ่งจะได้รับการวินิจฉัยในขณะผ่าตัด และอีกครึ่งหนึ่งที่วินิจฉัยได้หลังจากการผ่าตัด ซึ่งในกรณีหลัง จะสัมพันธ์กับอัตราการเสียชีวิตที่เพิ่มขึ้น1–3 การบาดเจ็บของอวัยวะในระบบทางเดินอาหาร ที่พบบ่อย ได้แก่ การบาดเจ็บของลำไส้เล็ก สำไส้ใหญ่ ซึ่งส่วนใหญ่จะเป็นการบาดเจ็บเพียงเล็กน้อย เช่น จากมีดผ่าตัด จากอุปกรณ์จี้ไฟฟ้า (electric coagulation) หรือจากการดึงรั้งเนื้อเยื่อข้างเคียง การบาดเจ็บส่วนใหญ่สามารถรักษาโดยการเย็บซ่อมแซมได้1-4 ยกเว้นการบาดเจ็บที่รุนแรง จำเป็นต้องปรึกษาศัลยแพทย์เพื่อให้การรักษาด้วยการตัดต่อลำไส้ หรือการรักษาที่เหมาะสมต่อไป
โครงสร้างของผนังทางเดินอาหาร ประกอบด้วยผนัง 4 ชั้น เรียงจากด้านนอกไปด้านใน ดังนี้5 (รูปที่ 1)
1) Serosa เป็นชั้นเนื้อเยื่อเกี่ยวพัน
2) Muscularis propria เป็นชั้นกล้ามเนื้อเรียบ มีการเรียงตัวของกล้ามเนื้อเป็นวงกลม และตามยาวของลำไส้
3) Submucosa เป็นชั้นที่มีความแข็งแรงมากที่สุด เนื่องจากชั้นนี้มีองค์ประกอบเป็นเนื้อเยื่อ
เกี่ยวพันต่างๆ นอกจากนี้ยังประกอบด้วยหลอดเลือด หลอดน้ำเหลือง และเส้นประสาทอยู่ในชั้นนี้
4) Mucosa ซึ่งยังแบ่งต่อเป็นชั้น muscularis mucosae, lamina propria และ epithelium ตามลำดับ
รูปที่ 1 แสดงผนังของทางเดินอาหาร
ที่มา Brunicardi FC, et al. Schwartz’s Principles of surgery. 2019
การวินิจฉัยการบาดเจ็บของลำไส้เล็ก ลำไส้ใหญ่ ในขณะผ่าตัด ต้องอาศัยความละเอียดรอบคอบของแพทย์ ตั้งแต่การประเมินความเสี่ยงก่อนการผ่าตัด ว่ามีความเสี่ยงต่อการผ่าตัดที่ยากลำบาก เช่น มีประวัติเคยผ่าตัดในอุ้งเชิงกราน มีภาวะเยื่อบุมดลูกเจริญผิดที่ (endometriosis) เป็นต้น เพื่อจะได้วางแผนป้องกันการบาดเจ็บต่ออวัยวะข้างเคียง และในขณะผ่าตัดก็ต้องอาศัยความระมัดระวังต่อการบาดเจ็บที่อาจเกิดขึ้น หากเห็นการบาดเจ็บต่อลำไส้เล็ก หรือลำไส้ใหญ่ที่ชัดเจน สามารถให้การวินิจฉัยได้ทันที แล้วจึงแบ่งระดับความรุนแรงของการบาดเจ็บนั้นๆ เพื่อให้การรักษาที่เหมาะสมต่อไป ในบางกรณี อาจไม่เห็นการบาดเจ็บที่ชัดเจน แต่สงสัยว่าจะมีการบาดเจ็บต่อลำไส้เล็ก หรือสำไส้ใหญ่ จำเป็นต้องใช้การทดสอบเพิ่มเติม เพื่อช่วยยืนยันว่ามีการบาดเจ็บต่อลำไส้เกิดขึ้น การทดสอบทางเดินอาหารรั่วในระหว่างการผ่าตัดพิจารณาตามตำแหน่งที่สงสัยการบาดเจ็บ ได้แก่
– สงสัยการบาดเจ็บในส่วนของ sigmoid colon หรือ rectum การใส่ลมเข้าไปในทางเดินอาหาร (air leak test) สามารถทดสอบโดยการเทน้ำเกลืออุ่น (0.9% NaCl) ลงไปในอุ้งเชิงกรานให้ท่วมถึงบริเวณลำไส้ที่สงสัยว่ามีการบาดเจ็บ แล้วใช้มือ หรือยางรัดส่วนของ proximal colon ไว้ เพื่อป้องกันไม่ให้ลมไหลไปส่วนอื่น แล้วใส่ลมเข้าไปทางทวารหนัก โดยใช้ bulb syringe หรือ proctoscope แล้วดันลมเข้าไปทาง rectum แล้วสังเกตฟองอากาศที่เกิดขึ้นในน้ำ ซึ่งจะบ่งบอกตำแหน่งของการบาดเจ็บได้ บางครั้งเรียกการทดสอบนี้ว่า “ flat tire test ”6, 7
– สงสัยการบาดเจ็บในส่วนของ small bowel สามารถทดสอบด้วย air leak test ได้โดยการเทน้ำเกลืออุ่น ให้ท่วมบริเวณลำไส้เล็กส่วนที่สงสัย ใช้มือ หรือยางรัดส่วนของ distal small bowel ไว้ แล้วขอให้วิสัญญีแพทย์ช่วยใส่ลมเข้าไปทาง nasogastric tube สังเกตฟองอากาศที่เกิดขึ้นในน้ำ ซึ่งสามารถบอกตำแหน่งของการบาดเจ็บได้
อย่างไรก็ตามหากสงสัยว่ามีการบาดเจ็บต่อทางเดินอาหาร แต่ไม่สามารถทดสอบด้วยวิธีดังกล่าวได้ จำเป็นต้องปรึกษาศัลยแพทย์เพื่อช่วยประเมินระหว่างการผ่าตัด
หลังจากที่วินิจฉัยได้แล้วว่ามีการบาดเจ็บต่ออวัยวะระบบทางเดินอาหาร มีความจำเป็นที่จะต้องประเมินระดับความรุนแรงที่เกิดขึ้น เพื่อพิจารณาว่าสามารถจัดการเย็บซ่อมบาดแผลนั้นได้เอง หรือควรปรึกษาศัลยแพทย์ โดยในบทความนี้จะแบ่งระดับการบาดเจ็บตาม Glaser and Milad6 ดังนี้
1) Superficial sharp, small thermal injuries การบาดเจ็บเพียงบริเวณชั้นผิวของลำไส้บริเวณ serosa หรือการบาดเจ็บขนาดเล็กจากเครื่องจี้ไฟฟ้า
2) Partial thickness seromuscular การบาดเจ็บที่ชั้นของ serosa ลงไปถึงชั้นกล้ามเนื้อเรียบ
3) Full thickness, less than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังลำไส้ที่ขนาดเล็กกว่า 1 ซม.
4) Full thickness, more than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังลำไส้ที่ขนาดใหญ่กว่า 1 ซม.
5) Large, delayed, necrotic, grossly infected, complicated บาดแผลขนาดใหญ่ เรื้อรัง มีเนื้อเยื่อลำไส้ส่วนที่ติดเชื้อ หรือมีเนื้อตายบริเวณบาดแผล
การบาดเจ็บระดับที่ 4 หรือ 5 ควรปรึกษาศัลยแพทย์ เพื่อทำการเย็บซ่อม หรือตัดต่อลำไส้ ในขณะที่ระดับ 1 ถึง 3 สูติ-นรีแพทย์อาจพิจารณาทำการเย็บซ่อมได้เอง (เฉพาะแพทย์ที่ได้รับการฝึกฝนมา หรือมีประสบการณ์ในการผ่าตัดเย็บซ่อมลำไส้) อย่างไรก็ตาม หากแพทย์ผู้ผ่าตัดไม่มั่นใจหรือไม่มีประสบการณ์ควรปรึกษาศัลยแพทย์ทันที การดูแลรักษาการบาดเจ็บของลำไส้ แบ่งตามระดับความรุนแรง ได้สรุปไว้ ในตารางที่ 1 สำหรับการให้ยาปฏิชีวนะหลังการผ่าตัด กรณีที่ผู้ป่วยได้รับยาปฏิชีวนะป้องกันการติดเชื้อแล้วก่อนผ่าตัด (prophylactic antibiotics) และระหว่างผ่าตัดไม่มีการ contamination ของ content ภายในลำไส้ ไม่มีความจำเป็นต้องได้รับยาปฏิชีวนะหลังการผ่าตัด แต่กรณีที่ผู้ป่วยไม่ได้รับยาฆ่าเชื้อที่เหมาะสมก่อนการผ่าตัด หรือระหว่างผ่าตัดมีการ contamination ควรเลือกยาฆ่าเชื้อชนิด broad spectrum โดยให้ต่อไปหลังผ่าตัดอย่างน้อย 24 ชั่วโมง6
ตารางที่ 1 แนวทางการดูแลการบาดเจ็บของลำไส้ แบ่งตามความรุนแรงของบาดแผล
|
Injury type |
Management |
Postoperative diet |
|
1.Superficial sharp, small thermal injuries |
Primary oversewing, 3–0 delayed absorbable |
Routine |
|
2.Partial thickness seromuscular |
Primary interrupted, 2–0 or 3–0 delayed absorbable |
Routine |
|
3.Full thickness, less than 1 cm |
Two–layer closure, with or without closed–suction drain placement |
Routine |
|
4.Full thickness, more than 1 cm |
Primary repair or resection and re–anastomosis, with or without closed suction drain placement |
Clear liquid diet until return of bowel function |
|
5.Large, delayed, necrotic, grossly infected, complicated |
Resection and re–anastomosis plus or minus diverting proximal ostomy, plus closed suction drain placement |
Clear liquid diet until return of bowel function |
ดัดแปลงจาก Glaser LM, et al. Bowel and Bladder Injury Repair and Follow–up After Gynecologic Surgery. Obstet Gynecol, 2019
หลักการเย็บซ่อมแซมบาดแผลบริเวณลำไส้
ในการเย็บซ่อมแซม หรือตัดต่อลำไส้ มีหลากหลายวิธี การพิจารณาขึ้นอยู่กับหลายปัจจัย เช่น ตำแหน่งได้รับบาดเจ็บ ลักษณะหรือสุขภาพของเนื้อเยื่อที่ได้รับความเสียหาย ความชำนาญของแพทย์ เป็นต้น โดยยึดหลักสำคัญ คือลักษณะของเนื้อเยื่อที่นำมาต่อกันต้องเป็นส่วนที่มีสุขภาพดี มีเลือดมาเลี้ยงเพียงพอ การเย็บหรือเชื่อมต่อลำไส้ด้วยความนุ่มนวลและสะอาด8 ชนิดของไหมที่ใช้ในการเย็บแผลที่ลำไส้ ใช้เป็น absorbable suture หรือ delayed absorbable suture ขนาด 3–0, 2–0 เช่น Vicryl และในกรณีที่เย็บ two layer techniques ชั้นนอกอาจใช้ได้ทั้ง delayed absorbable suture 3–0 หรือ silk 3–0 ก็ได้9
บทความนี้จะเสนอตัวอย่างวิธีการเย็บซ่อมลำไส้ โดยวิธี Lembert suture pattern และ Czerny – Lembert suture pattern
– Lembert suture pattern ใช้การเย็บด้วยวิธี interrupted suture เริ่มจากลำไส้ฝั่งหนึ่งที่บริเวณ serosa ห่างจากขอบแผล ปลายเข็มผ่านชั้นกล้ามเนื้อเรียบ(Muscularis propria) แต่ไม่ทะลุผ่านชั้น mucosa แล้วออกมาที่ชั้น serosa อีกครั้งหนึ่ง ในบริเวณที่ใกล้ขอบแผล จากนั้นเย็บลำไส้อีกฝั่งจากชั้น serosa บริเวณใกล้ขอบแผล ปลายเข็มผ่านชั้นกล้ามเนื้อ แต่ไม่ทะลุผ่านชั้น mucosa แล้วออกมาที่ชั้น serosa อีกครั้งหนึ่ง ในบริเวณที่ไกลขอบแผล ดังรูปที่ 2 เป็นการเย็บที่ทำให้ serosa ของลำไส้ทั้งสองฝั่งมาชนกันและติดกันได้ และสามารถ inverted ผนังลำไส้ได้ ข้อดีในการเย็บวิธีนี้ ทำได้รวดเร็ว นำไปใช้กับทางเดินอาหารได้ทุกส่วน สามารถปิดช่องว่างของลำไส้ ทำให้ลมหรืออุจจาระไม่สามารถผ่านออกมานอกรอยเย็บได้
|
|
|
|
รูปที่ 2 แสดงการเย็บวิธี Lembert suture pattern
ที่มา https://mir.ismu.baikal.ru/src/downloads/3cb17a69_intestinal_suture.pdf, Kantor J. Atlas of suturing techniques2016
– Czerny – Lembert suture pattern เป็นการเย็บ interrupted suture 2 ชั้น โดยชั้นในเย็บ interrupted suture ผ่าน mucosa หรือ Submucosa และชั้นที่สองเย็บด้วย Lembert suture pattern ซึ่งอาจเรียกการเย็บวิธีนี้ว่า two–layer suture ดังรูปที่ 3 โดยแผลที่ขนานกับแนวของลำไส้ ควรเย็บแผลให้ตั้งฉากกับแนวแผล เพื่อป้องการการตีบแคบของรูลำไส้8, 10 ดังรูปที่ 4
|
|
|
|
รูปที่ 3 แสดงการเย็บวิธี Czerny – Lembert suture pattern
ที่มา https://mir.ismu.baikal.ru/src/downloads/3cb17a69_intestinal_suture.pdf
|
|
|
|
รูปที่ 4 แสดงการเย็บแบบตั้งฉากกับแนวแผล6
ที่มา Glaser LM, Milad MP. Bowel and Bladder Injury Repair and Follow-up After Gynecologic Surgery, 2019
การดูแลการบาดเจ็บอวัยวะระบบทางเดินปัสสาวะระหว่างการผ่าตัดทางนรีเวช
อุบัติการณ์ของการบาดเจ็บต่อระบบทางเดินปัสสาวะ จากการผ่าตัดทางนรีเวชพบได้น้อย ประมาณร้อยละ 1-29, 11 การบาดเจ็บของอวัยวะที่พบได้บ่อย ได้แก่ ท่อไต และกระเพาะปัสสาวะ โดยมีปัจจัยเสี่ยงที่คล้ายกัน ด้วยธรรมชาติทางกายวิภาคที่เป็นพื้นที่จำกัดภายในอุ้งเชิงกราน ทำให้ภาวะต่างๆ เช่น การเคยผ่าตัดบริเวณอุ้งเชิงกราน การเคยฉายแสง การมีเนื้องอกบริเวณอุ้งเชิงกราน หรือภาวะใดๆที่ทำให้ลักษณะทางกายวิภาคในอุ้งเชิงกรานผิดปกติไปจากเดิม ส่งผลทำให้การระบุตำแหน่งของท่อไตลำบากมากขึ้น และเพิ่มโอกาสการบาดเจ็บต่ออวัยวะระบบทางเดินปัสสาวะ
กายวิภาคของกระเพาะปัสสาวะมีลักษณะคล้ายถุงทรงกลม อยู่ในอุ้งเชิงกราน วางตัวอยู่หลังต่อ pubic symphysis เรียกบริเวณของกระเพาะปัสสาวะนี้ว่า apex และอยู่หน้าต่อ uterus, cervix และ vagina เรียกส่วนนี้ว่า base หรือ fundus ดังรูปที่ 5 บริเวณส่วน base จะมี trigone ซึ่งเป็นตำแหน่งที่มีลักษณะเป็นรูปสามเหลี่ยมที่มีท่อไตมาเปิดเข้า อยู่ด้านข้างของสามเหลี่ยม 2 มุม (ureteric orifices) ส่วนมุมด้านล่างของสามเหลี่ยมนี้จะเป็นท่อเปิดปัสสาวะ ดังรูปที่ 6 และบริเวณที่อยู่ระหว่าง apex และ base จะเรียกว่า body of bladder โดยผนังด้านบน (superior) จะเรียกว่า dome of bladder
|
|
|
|
รูปที่ 5 แสดงกายวิภาคของกระเพาะปัสสาวะ
|
|
|
Ureters |
|
adventitia |
ที่มา Moses K P., Banks J C, Nava P B., Petersen D K. Atlas of clinical gross anatomy, 2013
รูปที่ 6 แสดงผนังของกระเพาะปัสสาวะ
ที่มา https://teachmeanatomy.info/pelvis/viscera/bladder/
กระเพาะปัสสาวะ ในสภาวะปกติ ผนังของกระเพาะปัสสาวะหนาประมาณ 3–5 มม. ซึ่งประกอบด้วยชั้นต่างๆ เรียงจากด้านในไปสู่ด้านนอก ทั้งหมด 4 ชั้น ดังนี้
1) Mucosa เยื่อบุผิวกระเพาะปัสสาวะ เป็นเยื่อบุผิวชนิด urothelium หรือ transitional epithelium ซึ่งเป็นชนิดเดียวกับเยื่อบุบริเวณท่อไต และท่อปัสสาวะ
2) Submucosa ชั้นที่มีองค์ประกอบเป็นเนื้อเยื่อเกี่ยวพัน เช่น คอลลาเจน และหลอดเลือด หลอดน้ำเหลือง
3) Muscular layer เป็นชั้นกล้ามเนื้อเรียบที่หนา และ มีการเรียงตัวเป็น 3 ชั้นในแนวต่างกัน ชั้นด้านใน และชั้นนอก เรียงตัวในแนวยาว ส่วนชั้นกลางเรียงตัวเป็นรอบวง เรียกกล้ามเนื้อเหล่านี้ว่า detrusor muscle
4) Adventitia เป็นชั้นเนื้อเยื่อเกี่ยวพันที่เรียงตัวหลวมๆ และบริเวณด้านบน และด้านข้างของกระเพาะปัสสาวะจะถูกหุ้มด้วยชั้น serosa ของเยื่อบุช่องท้อง ดังรูปที่ 6
การบาดเจ็บของกระเพาะปัสสาวะจากการผ่าตัดทางนรีเวช ส่วนใหญ่จะเป็นแผลฉีกขาด และตำแหน่งที่บาดเจ็บ มักเป็นส่วน dome ของกระเพาะปัสสาวะ ซึ่งสังเกตเห็นบาดแผลได้ง่าย หรืออาจเห็น foley catheter ที่อยู่ในกระเพาะปัสสาวะ หรือเห็นน้ำปัสสาวะไหลออกมาในอุ้งเชิงกราน กรณีต่างๆข้างต้น ทำให้สามารถให้การวินิจฉัยได้ทันที มีบางครั้งอาจไม่เห็นรอยแผลบาดเจ็บชัดเจน แต่สงสัยว่าจะมีการบาดเจ็บต่อกระเพาะปัสสาวะเกิดขึ้น เช่น การเห็นน้ำปัสสาวะในถุงเก็บมีเลือดปน หรือโดนเข็มเย็บเกี่ยวส่วนที่สงสัยว่าเป็นกระเพาะปัสสาวะ จำเป็นต้องทดสอบเพื่อยืนยันว่ามีการบาดเจ็บต่อกระเพาะปัสสาวะหรือไม่ ซึ่งการช่วยวินิจฉัย มีหลายวิธี เช่นการฉีด sodium fluorescein ทางเส้นเลือดดำจะทำให้ปัสสาวะเป็นสีเขียว สังเกตการรั้วของสีปัสสาวะที่ออกมาในอุ้งเชิงกราน หรือฉีด indigo carmine ซึ่งจะทำให้สีปัสสาวะเป็นสีน้ำเงิน หรือการใส่น้ำเกลือที่ผสม methylene blue เข้าไปในกระเพาะปัสสาวะ ปริมาณ 200-300 มิลลิลิตร แล้วสังเกตการรั่วของสี methylene blue 6, 11, 12 ความสำคัญของการระบุบาดแผลที่กระเพาะปัสสาวะคือ ตำแหน่ง trigone เนื่องจากเป็นตำแหน่งที่ไม่สามารถเย็บซ่อมแซมเอง ได้ การบาดเจ็บต่อกระเพาะปัสสาวะ สามารถจัดแบ่งระดับความรุนแรงตาม Glaser and Milad6 ได้เป็น
1) Pinpoint full thickness, serosal injury only การบาดเจ็บที่มีลักษณะเป็นรูเล็ก ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ หรือการบาดเจ็บเฉพาะที่ชั้นของ serosa
2) Nontrigonal, less than 1cm การบาดเจ็บที่ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ ขนาดเล็กกว่า 1 ซม. ที่ไม่ใช่ตำแหน่ง trigone
3) Nontrigonal, more than 1 cm การบาดเจ็บที่ลึกตลอดชั้นของผนังกระเพาะปัสสาวะ ขนาดใหญ่กว่า 1 ซม. ที่ไม่ใช่ตำแหน่ง trigone
4) Trigonal, complicated, necrotic, infected injury การบาดเจ็บตำแหน่ง trigone หรือ การบาดเจ็บที่แผลซับซ้อน มีเนื้อตาย หรือมีเนื้อเยื่อกระเพาะปัสสาวะส่วนที่ติดเชื้อ
ในกรณีที่ไม่สามารถระบุตำแหน่งบาดแผลได้ หรือการบาดเจ็บเป็นระดับที่ 4 ควรปรึกษาศัลยแพทย์ทางเดินปัสสาวะทันที ส่วนแนวทางการดูแลบาดแผลบริเวณกระเพาะปัสสาวะ โดยจำแนกตามระดับความรุนแรง ได้สรุปไว้ในตารางที่ 2
ตารางที่ 2 แนวทางการดูแลแผลบาดเจ็บของกระเพาะปัสสาวะ จำแนกตามระดับความรุนแรง
|
Injury type |
Management |
Postoperative care |
|
1.Pinpoint full thickness, serosal injury only |
Expectant management |
Routine |
|
2.Nontrigonal, less than 1cm |
Primary repair or expectant management |
Urinary catheter decompression x 1wk |
|
3.Nontrigonal, more than 1 cm |
Primary repair, 1–2 layers, plus or minus closed suction drain |
Urinary catheter decompression x 1–2 wk with or without cystogram |
|
4.Trigonal, complicated, necrotic, infected injury |
Specialist consultation, repair, possible stenting or reimplantation, closed suction drain |
Urinary catheter decompression, possible stenting, CT urogram |
ดัดแปลงจาก Glaser LM, et al. Bowel and Bladder Injury Repair and Follow–up After Gynecologic Surgery. Obstet Gynecol, 2019
หลักในการเย็บซ่อมบาดแผลที่กระเพาะปัสสาวะ และท่อไต
การเย็บซ่อมบาดแผลกระเพาะปัสสาวะที่ไม่ใช่ส่วน trigone สามารถเย็บซ่อมแบบ 1 หรือ 2 ชั้นก็ได้ โดยใช้ไหมละลาย absorbable suture ขนาด 2–0, 3–0 เช่น Vicryl หรือ Monocryl ในกรณีที่เย็บเป็น 1 ชั้น ให้เย็บทุกชั้นของผนังกระเพาะปัสสาวะ อาจเย็บเป็น interrupted หรือ running ก็ได้ แต่ในกรณีที่เย็บซ่อมแบบ 2 ชั้นนั้น ชั้นด้านใน ให้เย็บชั้น mucosa, submucosa และ muscular layer เข้าด้วยกัน ส่วนชั้นนอกให้เย็บบริเวณ seromuscular อาจเย็บเป็น interrupted หรือ running ก็ได้ ในกรณีที่แผลมีขนาดใหญ่ อาจเย็บเพิ่มอีกชั้น และลดโอกาสแผลรั่วด้วยการนำ omental flap มาปิด หลังจากเย็บซ่อมแล้วควรมีการทดสอบรอยรั่วบริเวณบาดแผลที่เย็บซ่อม โดยใส่น้ำเข้าไปในกระเพาะปัสสาวะ ปริมาณ 300 มิลลิลิตร ผ่าน foley catheter แล้วสังเกตการรั่วของน้ำที่รอยเย็บ อาจผสม methylene blue เพื่อช่วยให้เห็นชัดเจนยิ่งขึ้น พิจารณาวาง drain ตามระดับการการบาดเจ็บของแผล6, 9, 11 หลังผ่าตัดควรให้ยาปฏิชีวนะครอบคลุมแบคทีเรียชนิดกรัมลบ เพื่อป้องกันการติดเชื้อ7
สำหรับการบาดเจ็บของท่อไต ทุกรายควรปรึกษาศัลยแพทย์ทางเดินปัสสาวะ การบาดเจ็บท่อไตจากการผ่าตัดทางนรีเวช โดยเฉพาะการผ่าตัดมดลูก มีตำแหน่งของท่อไตที่ได้รับการบาดเจ็บบ่อย13 ได้แก่
1) ตำแหน่งที่ท่อไตเข้าสู่ pelvis บริเวณ pelvic brim
2) ตำแหน่งที่ base of broad ligament ซึ่งท่อไตจะลอดใต้ต่อ uterine artery
3) ตำแหน่งที่ท่อไตจะผ่านเข้าไปใน cardinal ligament ที่ระดับ internal cervical os
4) ตำแหน่งที่อยู่ด้านหน้าและด้านข้าง fornix of vagina แล้วเข้าสู่กระเพาะปัสสาวะ
5) ตำแหน่งด้านข้าง pelvic sidewall เหนือต่อ uterosacral ligament
การเฝ้าระวังและคอยสังเกตว่ามีการบาดเจ็บต่อท่อไต ที่เกิดขึ้นในระหว่างการผ่าตัดมีความสำคัญ เนื่องจากการรักษาที่ทันท่วงที จะช่วยลดความรุนแรงที่จะเกิดตามมาได้อย่างชัดเจน เช่น การมีปัสสาวะรั่วในช่องท้อง การติดเชื้อในกระแสเลือด การบาดเจ็บต่อท่อไตสามารถวินิจฉัยได้ทันที ถ้าเห็นน้ำปัสสาวะไหลออกจากปลายท่อไตที่ถูกตัด หรือเห็นบาดแผลชัดเจน แต่ในกรณีที่เห็นไม่ชัดเจน แต่สงสัยการบาดเจ็บต่อท่อไต อาจทำการทดสอบ dye test โดยการฉีด phenazopyridine hydrochloride หรือ indigo carmine หรือ methylene blue ทางหลอดเลือดดำ แล้วสังเกตปัสสาวะที่รั่วออกมาจากปลายท่อไตที่บาดเจ็บ เพื่อให้การวินิจฉัยในขณะผ่าตัด แล้วพิจารณาปรึกษาศัลยแพทย์ทางเดินปัสสาวะ ในการซ่อมแซมต่อไป
ในการผ่าตัดทั้งทางสูติศาสตร์และนรีเวช แพทย์ผู้ผ่าตัดต้องสามารถประเมินความเสี่ยงตั้งแต่ก่อนผ่าตัด ในรายที่มีความเสี่ยงของการผ่าตัดยาก และมีโอกาสบาดเจ็บต่ออวัยวะข้างเคียงสูง ควรมีการปรึกษาศัลยกรรมมาร่วมประเมินและผ่าตัดร่วมกันตั้งแต่แรก นอกจากนี้ การประเมินสถานการณ์ และการวินิจฉัยให้ได้เมื่อสงสัยการบาดเจ็บของอวัยวะข้างเคียงที่เกิดขึ้นนั้น ก็สำคัญอย่างมาก เนื่องจากจะช่วยให้ผู้ป่วยได้รับการซ่อมแซมและแก้ไขได้ทันท่วงที ช่วยลดอัตราความเจ็บป่วย (morbidity) และอัตราการเสียชีวิตได้ ในการบาดเจ็บที่ไม่รุนแรง แพทย์ผู้ผ่าตัดสามารถเย็บซ่อมแซมเองได้ แต่ต้องมีประสบการณ์ อย่างไรก็ตามหากไม่สามารถวินิจฉัยได้ชัดเจน แต่ยังสงสัยการบาดเจ็บอยู่ หรือไม่มั่นใจในความรุนแรงของแผล หรือไม่มีประสบการณ์การเย็บซ่อมแซมมาก่อน ควรปรึกษาศัลยแพทย์มาช่วยประเมินและดูแลรักษาร่วมกัน
ที่มา
1. Mesdaghinia E, Abedzadeh–Kalahroudi M, Hedayati M, Moussavi–Bioki N. Iatrogenic gastrointestinal injuries during obstetrical and gynecological operation. Arch Trauma Res. 2013;2(2):81–4.
2. Krebs HB. Intestinal injury in gynecologic surgery: a ten–year experience. Am J Obstet Gynecol. 1986;155(3):509–14.
3. Llarena NC, Shah AB, Milad MP. Bowel injury in gynecologic laparoscopy: a systematic review. Obstet Gynecol. 2015;125(6):1407–17.
4. Eisner IS, Wadhwa RK, Downing KT, Singhal PK. Prevention and management of bowel injury during gynecologic laparoscopy: an update. Curr Opin Obstet Gynecol. 2019;31(4):245–50.
5. Brunicardi FC, Andersen DK, Billiar TR, Dunn DL, Hunter JG, Kao LS, et al. Schwartz’s Principles of surgery. 11th ed. New York: McGraw–Hill; 2019.
6. Glaser LM, Milad MP. Bowel and Bladder Injury Repair and Follow–up After Gynecologic Surgery. Obstet Gynecol. 2019;133(2):313–22.
7. โชติรสนิรมิต น. Surical complication. 1st ed. เชียงใหม่: หน่วยงานวารสารวิชาการ งานบริการการศึกษา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่; 2548.
8. จันท์แสนโรจน์ ป, สังข์ทอง น, จิตตวัฒนรัตน์ ก, โตวิกภัย ช, สิริกุลพิลูลย์ ส, เอื้อพานิชเจริญ เ. ศัลยศาสตร์วิวัฒน์ เล่มที่ 58. 1st ed. กรุงเทพฯ: ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย; 2562.
9. Handa VL, Van Le L, editors. Te Linde’s Operative Gynecology. 12th ed. Philadelphia: Lippincott Williams and Wilkins; 2020.
10. Kantor J. Atlas of suturing techniques : approaches to surgical wound, laceration, and cosmetic repair. New York: McGraw–Hill; 2016.
11. McDougal WS, Wein AJ, Kavoussi LR, Partin AW, Peters CA. Campbell–Walsh Urology 12th Edition Review E–Book. 12th ed: Elsevier Health Sciences; 2021.
12. Sharp HT, Adelman MR. Prevention, Recognition, and Management of Urologic Injuries During Gynecologic Surgery. Obstet Gynecol. 2016;127(6):1085–96.
13. Sorinola O, Begum R. Prevention and management of ureteric injuries. Hosp Med. 2005;66(6):329–34.
ภาวะเยื่อบุโพรงมดลูกหนาตัว (Endometrial hyperplasia)
ภาวะเยื่อบุโพรงมดลูกหนาตัว (Endometrial hyperplasia)
พญ. กานต์ทอง ศิริวัฒน์
ผศ. นพ..มนัสวี มะโนปัญญา
ภาวะเยื่อบุโพรงมดลูกหนาตัว (endometrial hyperplasia) เป็นการเจริญผิดปกติของทั้งต่อม (gland) และสโตรมา (stroma) ที่ประกอบกันขึ้นเป็นเยื่อบุโพรงมดลูก โดยลักษณะทางจุลพยาธิวิทยาจะพบว่ามีการเพิ่มขึ้นของต่อมในเยื่อบุโพรงมดลูกจนมีอัตราส่วนของต่อมต่อสโตรมาสูงกว่าปกติ และอาจจะมีเซลล์เยื่อบุที่มีลักษณะผิดปกติ (atypia) ร่วมด้วย ทั้งนี้ปัจจัยเสี่ยงที่ทำให้เกิดภาวะเยื่อบุโพรงมดลูกหนาตัวจำแนกได้ดังนี้(1)
- ปัจจัยที่ปรับเปลี่ยนไม่ได้ ได้แก่ อายุมากกว่า 35 ปี, เชื้อชาติคอเคเซียน, มีประวัติภาวะเยื่อบุโพรงมดลูกหนาตัวในครอบครัว
- ลักษณะประจำเดือน ได้แก่ อยู่ในวัยหมดระดู, เริ่มมีประจำเดือนเร็วหรือหมดประจำเดือนช้า, มีระยะก่อนหมดประจำเดือน (perimenopause) ยาวนาน, ไม่เคยตั้งครรภ์มาก่อน
- โรคแทรกซ้อนอื่น ๆ ได้แก่ ภาวะอ้วน, โรคเบาหวาน, ภาวะถุงน้ำรังไข่หลายใบ (polycystic ovary syndrome; PCOS), กลุ่มโรค hereditary non-polyposis colon cancer (Lynch syndrome) และมะเร็งที่สร้างฮอร์โมน เช่น มะเร็งรังไข่ชนิด granulosa cell
- สาเหตุจากการให้ยาหรือฮอร์โมน เช่น การได้รับยาในกลุ่ม selective estrogen receptor modulators (SERMs) เช่น Tamoxifen หรือ Raloxifen เป็นเวลานาน, การได้รับฮอร์โมนทดแทนกลุ่มเอสโตรเจนเพียงอย่างเดียว, การได้รับฮอร์โมนเอสโตรเจนจากแหล่งภายนอกร่างกาย
- ปัจจัยอื่น ๆ ได้แก่ การสูบบุหรี่ และการกลายพันธุ์ของยีน เป็นต้น
จะเห็นได้ว่าปัจจัยต่าง ๆ ที่กล่าวมาข้างต้นโดยส่วนใหญ่เกี่ยวข้องกับการที่เยื่อบุโพรงมดลูกได้รับการกระตุ้นด้วยฮอร์โมนเอสโตรเจนในร่างกายที่มีระดับสูงอยู่เป็นเวลานาน โดยไม่มีฮอร์โมนโปรเจสเตอโรนหรือมีอยู่ในระดับที่ไม่เพียงพอต่อการเปลี่ยน prolferative endometrium เป็น secretory endometrium ตามรอบประจำเดือนหรือที่เรียกภาวะนี้ว่า “unopposed estrogen stimulation” ซึ่งจะทำให้เกิดภาวะเยื่อบุโพรงมดลูกหนาตัวและเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกตามมาได้
ทั้งนี้มะเร็งเยื่อบุโพรงมดลูกจำแนกออกเป็น 2 ชนิดใหญ่ ๆ ตามพยาธิกำเนิด ได้แก่ ชนิดที่เกี่ยวข้องกับฮอร์โมนเอสโตรเจน (type I หรือ estrogen dependent) และชนิดที่ไม่เกี่ยวข้องกับฮอร์โมนเอสโตรเจน (type II หรือ non-estrogen dependent) โดยชนิดแรกจะมีลักษณะทางพยาธิวิทยาเป็นแบบ endometrioid adenocarcinoma และสัมพันธ์กับภาวะเยื่อบุโพรงมดลูกหนาตัว มักพบในสตรีวัยหมดระดูหรือมีภาวะอ้วน ในขณะที่ชนิดที่ 2 จะสัมพันธ์กับภาวะเยื่อบุโพรงมดลูกฝ่อและมีพยากรณ์โรคไม่ดีเมื่อเทียบกับชนิดที่ 1 โดยปัจจัยเสี่ยงในการเกิดมะเร็งเยื่อบุโพรงมดลูกแสดงในตารางที่ 1
ตารางที่ 1 ปัจจัยเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก
|
ปัจจัยเสี่ยง |
ความเสี่ยงสัมพัทธ์ (เท่า) |
|
ไม่เคยตั้งครรภ์มาก่อน |
2-3 |
|
หมดประจำเดือนช้า |
2-4 |
|
น้ำหนัก 21-50 ปอนด์ |
3 |
|
น้ำหนักมากกว่า 50 ปอนด์ |
10 |
|
โรคเบาหวาน |
2-8 |
|
การได้รับฮอร์โมนเอสโตรเจนเพียงชนิดเดียว |
4-8 |
|
มีประวัติได้รับการรักษาด้วยยา Tamoxifen |
2-3 |
|
ภาวะเยื่อบุโพรงมดลูกหนาชนิด atypical endometrial hyperplasia |
8-29 |
|
กลุ่มโรค hereditary non-polyposis colon cancer (Lynch syndrome) |
20 |
ที่มา : ดัดแปลงจาก Berek and Novak’s Gynecology, 16th edition, Lippincott Williams and Wilkins, 2019, Chapter 37 page no: 1003
แต่เดิมการแบ่งชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวอ้างอิงตามระบบของระบบขององค์การอนามัยโลกหรือที่เรียกว่า World Health Organization (WHO) system ที่จัดทำขึ้นในปี ค.ศ.1994 ซึ่งแบ่งภาวะเยื่อบุโพรงมดลูกหนาตัวออกเป็น 4 ชนิดตามลักษณะทางพยาธิวิทยา ได้แก่ simple hyperplasia, complex hyperplasia (adenomatous), simple atypical hyperplasia และ complex atypical hyperplasia (adenomatous with atypia) ต่อมาองค์กร American College of Obstetrics and Gynecology และ Society of Gynecologic Oncology ได้เสนอให้ใช้ระบบ endometrial intraepithelial neoplasia (EIN) system ซึ่งสามารถทำนายการเกิดมะเร็งเยื่อบุโพรงมดลูกได้ดีและเป็นประโยชน์ต่อการวางแผนการดูแลรักษาผู้ป่วยมากกว่า แต่ไม่ค่อยได้รับความนิยมในกลุ่มพยาธิแพทย์ และในปี ค.ศ. 2014 องค์การอนามัยโลกได้ปรับปรุงเกณฑ์การจำแนกใหม่ (WHO 2014 classification) ซึ่งได้ปรับจากเกณฑ์เดิมและผนวกระบบ EIN เข้ามาเพื่อลดการสับสนและง่ายต่อการสื่อสารในวงกว้าง ทำให้ระบบนี้เป็นที่ยอมรับและนิยมใช้มากกว่า โดยระบบนี้ได้จำแนกภาวะเยื่อบุโพรงมดลูกหนาตัวออกเป็น 2 ชนิด ดังนี้ (2, 3)
ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ
เยื่อบุโพรงมดลูกที่มี nonatypical endometrial hyperplasia ลักษณะตรวจพบด้วยตาเปล่าจะมีการหนาตัวของเยื่อบุโพรงมดลูกโดยทั่วๆ หรืออาจมีลักษณะเป็น polypoid apparance หน้าตัดสีขาวหรือสีน้ำตาลอ่อน ลักษณะจุลพยาธิวิทยาของภาวะเยื่อบุโพรงมดลูกหนาชนิดนี้จะมีจำนวนของต่อมในเยื่อบุโพรงมดลูก (endometrial gland) เพิ่มมากขึ้นและอยู่กันอย่างหนาแน่น (croweded) โดยกินพื้นที่มากกว่าร้อยละ 50 ของเยื่อบุโพรงมดลูก ทำให้อัตราส่วนของต่อมต่อสโตรมา (gland-to-stoma ratio) มากกว่า 1 ขนาดของต่อมจะมีความหลากหลายร่วมกับมี cystic dilatation หรือ irregular luminal contour ลักษณะของต่อมมีแบบแผนการเรียงตัวเป็น round และ tubular pattern หรืออาจเรียงตัวกันอย่างไม่เป็นระเบียบแบบแผน อย่างไรก็ตามจะไม่มีลักษณะ atypia ของต่อม เซลล์เยื่อบุผิวจะมีการเรียงตัวซ้อนกันเป็นแบบ pseudostratification, มี mitotically active หรือมีการยืดออกของเซลล์คอลัมนาร์คล้ายกับที่พบในช่วง mid หรือ late proliferative phase ของรอบเดือนปกติ ขนาดของเซลล์อาจจะโตขึ้นเล็กน้อยและนิวเคลียสจะมีลักษณะที่ยืดออก chromatin กระจายสม่ำเสมอและจะเห็น nucleolus ไม่ชัด ที่สำคัญคือลักษณะของเซลล์ที่อยู่ในบริเวณที่มีต่อมอยู่กันอย่างหนาแน่นจะไม่แตกต่างจากบริเวณที่ต่อมมีจำนวนปกติ โดยผู้ป่วยส่วนใหญ่จะอยู่ในวัยใกล้หมดระดู (perimenopause) และไม่ค่อยมีอาการหรืออาจจะมาด้วยเลือดออกผิดปกติจากโพรงมดลูก ทั้งนี้ภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้จะไม่สัมพันธ์กับการกลายพันธุ์ของยีนและมีโอกาสพัฒนาเป็นมะเร็งเยื่อบุโพรงมดลูกน้อยกว่าร้อยละ 5 (ค่าความเสี่ยงสัมพัทธ์ 1.01-1.03)(3)
ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติ
ภาวะ atypical endometrial hyperplasia (AEH) หรือ endometrial intraepithelial neoplasia (EIN) ลักษณะตรวจพบด้วยตาเปล่าจะมีลักษณะหนาตัวกว่าปกติ โดยอาจจะพบติ่งเนื้อ (polypoid apparance) ร่วมอยู่ด้วยได้ประมาณร้อยละ 40 หน้าตัดมีสีน้ำตาลอ่อน ลักษณะทางจุลพยาธิวิทยาจะมีความผิดปกติของต่อมเยื่อบุโพรงมดลูกเช่นเดียวกับกลุ่ม nonatypical endometrial hyperplasia แต่จะพบ nuclear atypia ร่วมด้วย โดยนิวเคลียสจะมีขนาดใหญ่ขึ้น (neclear enlargement) และรูปร่างหลากหลาย (pleomorphism) เช่น กลมขึ้น (rounding) แนวการเรียงตัวของเซลล์หรือนิวเคลียสไม่เป็นไปในทิศทางเดียวกัน (loss of polarity) มี chromatin จับตัวกันเป็นเม็ด และเห็นนิวคลีโอไล (nucleoli) เมื่อตรวจเพิ่มเติมด้วยการย้อมอิมมูโน (immunohistochemistry) ส่วนใหญ่จะพบว่าย้อมติด ER และ PR แต่ส่วนหนึ่งจะย้อมไม่ติด PTEN และ PAX2 โดยคิดเป็นร้อยละ 44 และ 71 ตามลำดับ ซึ่งสามารถใช้ในการแยก AH/EIN ออกจาก nonatypical endometrial hyperplasia ผู้ป่วยส่วนใหญ่จะอยู่ในวัยหมดระดู และสัมพันธ์กับกับการกลายพันธุ์ของยีน เช่น PAX2, PTEN, KRAS และ CTNNB1(3) ทั้งนี้ภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้มีโอกาสพัฒนาเป็นมะเร็งเยื่อบุโพรงมดลูกสูงถึงร้อยละ 60 (ค่าความเสี่ยงสัมพัทธ์ 14-45)(3)
อาการและอาการแสดง
- เลือดออกผิดปกติจากช่องคลอด โดยพบว่าร้อยละ 75-90 ของผู้ป่วยจะมีเลือดออกจากโพรงมดลูก (4, 5) ผู้ป่วยจะมาด้วยเลือดออกในวัยหมดระดู (postmenopausal bleeding) หรือมีลักษณะที่ผิดปกติของรอบเดือน คือ ระยะเวลาระหว่างรอบสั้นเกินไปหรือระยะเวลาในแต่ละรอบมากเกินไป แต่จะไม่สัมพันธ์กับปริมาณประจำเดือนที่ผิดปกติ
- ไม่มีอาการแต่ตรวจพบเซลล์ผิดปกติจากการตรวจคัดกรองมะเร็งปากมดลูก โดยความไวของการตรวจแบบ conventional Pap smear และ liquid-based cytology อยู่ที่ร้อยละ 40-50 และ 50-60 ตามลำดับ(6)
ข้อบ่งชี้ในการตรวจหาภาวะเยื่อบุโพรงมดลูกหนาตัว
- สตรีวัยหมดระดูที่มีเลือดออกผิดปกติจากช่องคลอด (postmenopausal bleeding)
- สตรีอายุ 45 ปีขึ้นไปที่ยังไม่หมดประจำเดือน แต่มีเลือดออกผิดปกติทางช่องคลอด(7)
- สตรีอายุน้อยกว่า 45 ปีที่ยังไม่หมดประจำเดือนและมีเลือดออกผิดปกติทางช่องคลอด แต่มีปัจจัยเสี่ยงร่วมด้วย เช่น ดัชนีมวลกาย (body mass index) มากกว่า 30 กิโลกรัม/ตารางเมตร(8) , มีภาวะไข่ไม่ตกเรื้อรัง, ได้รับฮอร์โมนเอสโตรเจนเป็นเวลานาน, เคยรักษาอาการเลือดออกผิดปกติด้วยยาแล้วอาการไม่ดีขึ้น และมีกลุ่มโรคที่มีความเสี่ยงสูงในการเป็นมะเร็งเยื่อบุโพรงมดลูก เช่น กลุ่มโรค Lynch syndrome หรือ Cowden syndrome
- สตรีที่มีผลการตรวจคัดกรองมะเร็งปากมดลูกผิดปกติผลเป็น Atypical glandular cells (AGC)
- สตรีกลุ่มเสี่ยงสูงที่จะเป็นมะเร็งเยื่อบุโพรงมดลูก เช่น กลุ่มโรค Lynch syndrome
วิธีการตรวจเพื่อวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัว
การวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัวควรเริ่มด้วยการตรวจร่างกายและตรวจภายใน เพื่อแยกสาเหตุของเลือดออกผิดปกติจากโพรงมดลูกด้วยสาเหตุอื่นออกไปก่อน แล้วจึงทำการตรวจเพื่อวินิจฉัยเพิ่มเติม โดยมีแนวทางดังนี้
1) การเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ (endometrial sampling) เป็นวิธีการหลักในการวินิจฉัยภาวะเยื่อบุโพรงมดลูกหนาตัว โดยการเก็บตัวอย่างเยื่อบุโพรงมดลูกจะใช้อุปกรณ์ขนาดเล็ก (รูปที่ 1) ใส่เข้าไปในโพรงมดลูกเพื่อดูดเอาเยื่อบุโพรงมดลูกส่งตรวจ วิธีการนี้มีข้อดี คือ ค่าใช้จ่ายไม่สูง, สามารถทำได้ง่ายและมีความไว (sensitivity) ในการวินิจฉัยโรคสูง โดยความไวในการวินิจฉัยภาวะเยื่อบุมดลูกหนาตัวสูงถึงร้อยละ 81 และความไวในการวินิจฉัยมะเร็งเยื่อบุโพรงมดลูกในสตรีวัยเจริญพันธุ์และในหญิงวัยหมดประจำเดือนสูงถึงร้อยละ 91 และ 99.6 ตามลำดับ อย่างไรก็เก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจนั้นมักจะสุ่มได้ชิ้นเนื้อเพียงร้อยละ 50 ของโพรงมดลูกเท่านั้น หากในรายที่ยังไม่ได้รับการวินิจฉัยหรือได้ชิ้นเนื้อไม่เพียงพอและยังสงสัยว่าจะมีพยาธิสภาพที่เยื่อบุโพรงมดลูกให้พิจารณาเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจซ้ำหรือทำการขูดมดลูก (dilatation and curettage) เพิ่มเติม หรืออาจจะทำการตรวจด้วยการส่องกล้องตรวจโพรงมดลูกเพื่อวินิจฉัย (diagnostic hysteroscopy) และตัดชิ้นเนื้อโดยตรงร่วมกับการขูดมดลูกเพื่อนำชิ้นเนื้อส่งตรวจเพิ่มเติม (3)

รูปที่ 1 แสดงตัวอย่างอุปกรณ์ที่ใช้ในการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ
ที่มา Hong Kong College of Obstetricians and Gynaecologists guideline on investigations of premenopausal women with abnormal uterine bleeding. Hong Kong medical journal. 2020;26(6):520-5
2) การตรวจด้วยคลื่นความถี่สูงทางช่องคลอด (transvaginal ultrasonography) เพื่อแยกพยาธิสภาพที่ทำให้มีเลือดออกผิดปกติจากโพรงมดลูกจากสาเหตุอื่นออกไปก่อน หากไม่พบว่ามีพยาธิสภาพใด ๆ การวัดความหนาของเยื่อบุโพรงมดลูกก็สามารถใช้ตรวจประเมินเป็นลำดับแรกในสตรีวัยหมดระดูที่มีเลือดออกผิดปกติจากโพรงมดลูกได้ อย่างไรก็ตามการตรวจนี้มีเกณฑ์สำหรับมะเร็งเยื่อบุโพรงมดลูกแต่ไม่มีเกณฑ์จำเพาะสำหรับภาวะเยื่อบุโพรงมดลูกหนาตัว โดยถ้าตรวจพบว่าเยื่อบุโพรงมดลูกมีความหนาน้อยกว่าหรือเท่ากับ 4 มิลลิเมตรจะมีค่าทำนายผลลบถูกต้อง (negative predictive value) สำหรับมะเร็งเยื่อบุโพรงมดลูกสูงมากกว่าร้อยละ 99 อย่างไรก็ตามในผู้ป่วยที่มีความเสี่ยงร่วมอื่น ๆ หรือยังคงมีเลือดออกอย่างต่อเนื่อง หรือเป็นซ้ำควรได้รับการตรวจเพิ่มเติมด้วยการเก็บชิ้นเนื้อจากโพรงมดลูกส่งตรวจ(9) นอกจากนี้ในกรณีที่ทำการดูดชิ้นเนื้อโพรงมดลูกส่งตรวจเป็นลำดับแรกและได้ชิ้นเนื้อไม่เพียงพอ การตรวจด้วยคลื่นความถี่สูงทางช่องคลอดยังคงมีประโยชน์ในการใช้ร่วมประเมินความเสี่ยงเพิ่มเติม(triage) ถ้าหากได้ทำการตรวจด้วยคลื่นความถี่สูงทางช่องคลอดแล้วพบว่าเยื่อบุโพรงมดลูกบางโอกาสที่ผู้ป่วยจะเป็นมะเร็งเยื่อบุโพรงมดลูกไม่มากนัก(10) ดังนั้นสามารถหลีกเลี่ยงการตรวจวินิจฉัยด้วยวิธีอื่น ๆ เพิ่มเติมในผู้ป่วยกลุ่มนี้
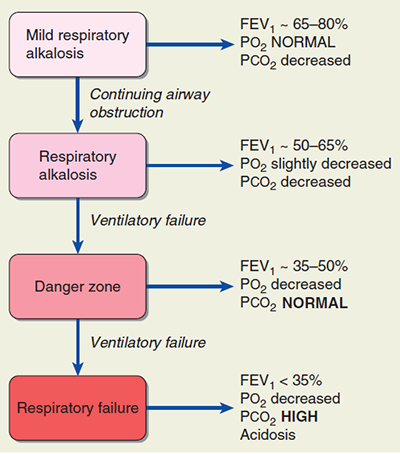
รูปที่ 2 แสดงการวัดความหนาของเยื่อบุโพรงมดลูกจากการตรวจด้วยคลื่นความถี่สูงทางช่องคลอด โดยการวัดความหนาของเยื่อโพรงมดลูกในแนว anterior-posterior ในส่วนที่หนาที่สุดจากภาพถ่าย long-axis transvaginal view ของมดลูก
ที่มา: ACOG Committee Opinion No. 734: The Role of Transvaginal Ultrasonography in Evaluating the Endometrium of Women With Postmenopausal Bleeding. Obstetrics and gynecology. 2018;131:e124-e9.
3) การขูดมดลูก (dilatation and curettage) วิธีนี้มีประสิทธิภาพในการวินิจฉัยภาวะเทียบเท่ากับการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ สามารถใช้เป็นทางเลือกในการวินิจฉัยและวิธีนี้ยังมีประสิทธิภาพดีกว่าในการวินิจฉัยมะเร็งเยื่อบุโพรงมดลูก ซึ่งมักจะพบร่วมด้วยได้สูงถึงร้อยละ 37 ในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิด complex atypical hyperplasia(11) ซึ่งเหมาะที่จะใช้ในการตรวจเพิ่มเติมก่อนที่จะให้การรักษาในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิด atypical endometrial hyperplasia ที่ยังต้องการมีบุตรหรือไม่ต้องการตัดมดลูกออก นอกจากนี้การขูดมดลูกยังมีข้อบ่งชี้ในผู้ป่วยที่ไม่สามารถทนต่อการทำ office endometrial sampling ได้เพราะความเจ็บปวดหรือวิตกกังวล หรือในกรณีที่ผู้ป่วยมีภาวะปากมดลูกตีบและจำเป็นต้องถ่างขยายปากมดลูก หรือในรายที่เนื้อเยื่อไม่เพียงพอต่อการตรวจทางพยาธิวิทยาดังที่ได้กล่าวไปข้างต้น
4) การส่องกล้องโพรงมดลูกเพื่อวินิจฉัย (diagnostic hysteroscopy) ร่วมกับการตัดชิ้นเนื้อส่งตรวจ ถือเป็นวิธีทางเลือกนอกเหนือจากการขูดมดลูกด้วยข้อบ่งชี้ดังที่ได้กล่าวไปข้างต้น ข้อดีของวิธีนี้คือสามารถมองเห็นและสามารถเลือกตัดชิ้นเนื้อในโพรงมดลูกจากบริเวณที่สงสัยว่าจะมีพยาธิสภาพได้โดยตรง และยังช่วยในการวินิจฉัยพยาธิสภาพอื่น ๆ ที่เป็นสาเหตุของเลือดออกผิดปกติจากโพรงมดลูกที่ไม่ได้รับการวินิจฉัยด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจตั้งแต่แรก เช่น ติ่งเนื้อของเยื่อบุโพรงมดลูก (endometrial polyp) เป็นต้น(3)
การรักษาภาวะเยื่อบุโพรงมดลูกหนาตัว
ข้อพิจารณาในการเลือกวิธีการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวนั้นขึ้นอยู่กับปัจจัยหลัก 2 ประการ คือ ชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวและความต้องการในการธำรงภาวะการเจริญพันธุ์ของผู้ป่วย โดยแนวทางในการดูแลรักษาสตรีที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวได้แสดงไว้ในแผนภูมิของรูปที่ 3 ทั้งนี้รายละเอียดของการดูแลรักษาในแต่ละวิธีมีดังนี้
1) การสังเกตอาการ (expectant management)
การสังเกตอาการโดยที่ไม่ต้องให้การรักษาเพิ่มเติมสามารถทำได้ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) ที่อยู่ในวัยเจริญพันธุ์ที่มีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำและต้องมีรอบเดือนมาสม่ำเสมอ ในผู้ป่วยกลุ่มนี้หากไม่มีอาการเลือดออกผิดปกติจากโพรงมดลูกก็ไม่จำเป็นต้องตรวจติดตามด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ(12) และเมื่อตรวจติดตามในผู้ป่วยกลุ่มนี้พบว่าภาวะเยื่อบุโพรงมดลูกหนาตัวสามารถหายได้เองร้อยละ 75-100(3)
2) การให้ยาฮอร์โมนกลุ่มโปรเจสติน (progestin therapy)
การให้ยาฮอร์โมนกลุ่มโปรเจสตินเป็นวิธีการรักษาที่มีประสิทธิภาพในการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ โดยรูปแบบของยาฮอร์โมน, ช่องทางการให้ยาและวิธีการบริหารยามีความหลากหลายดังแสดงรายละเอียดในตารางที่ 2 ทั้งนี้การให้ยาฮอร์โมนกลุ่มโปรเจสติน มีข้อห้ามในกลุ่มผู้ป่วยที่เป็นโรคหลอดเลือดผิดปกติหรือโรคหลอดเลือดสมอง, โรคตับ, เป็นมะเร็งเต้านมชนิดที่ตรวจพบ progesterone receptor, มีเลือดออกจากช่องคลอดผิดปกติไม่ทราบสาเหตุ, ต้องการมีบุตร หรือแพ้ยาฮอร์โมนกลุ่มโปรเจสติน สำหรับยาฮอร์โมนกลุ่มโปรเจสตินสามารถใช้เพื่อวัตถุประสงค์หลัก 2 ประการ คือ
- ให้เพื่อการรักษา (treatment) โดยการให้ยาฮอร์โมนกลุ่มโปรเจสตินเป็นระยะเวลา 3-6 เดือน และติดตามผลการตอบสนองต่อการรักษาด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจ
- ให้เพื่อป้องกันการกลับเป็นซ้ำ (maintenance) หลังจากให้การรักษาจนครบแล้วติดตามการรักษาด้วยการเก็บตัวอย่างเยื่อบุโพรงมดลูกส่งตรวจและพบว่าผลปกติแล้ว จึงพิจารณาให้ยาฮอร์โมนกลุ่มโปรเจสตินต่อในกลุ่มผู้ป่วยที่มีความเสี่ยงสูงและยังมีรอบเดือนที่ผิดปกติ โดยมีระยะเวลาให้ยาต่อเนื่องอีก 1-2 ปี
ตารางที่ 2 การให้ยาฮอร์โมนกลุ่มโปรเจสติน (progestin therapy) เพื่อรักษาภาวะเยื่อบุโพรงมดลูกหนาตัว
|
ชนิดยาฮอร์โมน |
ขนาดยาและการบริหารยา |
ผลลัพธ์การรักษา อัตราการหาย (ร้อยละ) |
|
Levonorgestrel-Intrauterine device (LNG-IUD) |
52 มิลลิกรัมใน steroid resurvoir ใส่ในโพรงมดลูกนาน 1-5 ปี |
90-100(13, 14) |
|
Medroxyprogesterone acetate |
รับประทานทุกวัน วันละ 10-20 มิลลิกรัม หรือให้เป็นรอบ รอบละ 12-14 วันต่อเดือน |
80-90 |
|
Megestrol acetate |
รับประทานทุกวัน 40-200 มิลลิกรัมต่อวัน |
90.0(15) |
|
Depot medroxyprogesterone |
150 มิลลิกรัม ฉีดเข้ากล้าม ทุก 3 เดือน |
91 |
|
Micronized vaginal progesterone |
ชนิดครีมใส่ในช่องคลอดทุกวัน 45-90 มิลลิกรัม ชนิดเม็ดสอดช่องคลอดทุกวันปริมาณ 100-200 มิลลิกรัม หรือให้เป็นรอบ รอบละ 12-14 วันต่อเดือน |
90.5(16) |
ที่มา : ดัดแปลงจาก Trimble CL, Method M, Leitao M, Lu K, Ioffe O, Hampton M, et al. Management of endometrial precancers. Society of Gynecologic Oncology Clinical Practice Committee. Obstet Gynecol 2012;120:1160–75.
โดยรายละเอียดของยาฮอร์โมนกลุ่มโปรเจสตินแต่ละชนิด มีดังนี้
- Levonorgestrel–Intrauterine devices ( IUD) เช่น Mirena® เป็นห่วงคุมกำเนิดที่ออกฤทธิ์ต่อเยื่อบุโพรงมดลูกโดยตรง โดยจะมีการปล่อยฮอร์โมนออกมา 20 ไมโครกรัมต่อวันและมีระยะเวลาการใช้งานได้ยาวนานถึง 5 ปีนับตั้งแต่เริ่มใส่ จากการศึกษาพบว่ามีประสิทธิภาพสูงกว่ายาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทาน (17) ทำให้ปัจจุบันการรักษาด้วยห่วงคุมกำเนิดชนิดนี้ได้รับการแนะนำเป็นทางเลือกแรกในการรักษาภาวะเยื่อมุมดลูกหนาตัว แต่หากผู้ป่วยปฎิเสธการใส่ห่วงคุมกำเนิด หรือใส่ห่วงคุมกำเนิดไม่ได้จากการที่มีโพรงมดลูกผิดรูปหรือปากมดลูกตีบตัน อาจพิจารณาให้เป็นยาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทานแทน
- Medroxyprogesterone acetate (MPA) การบริหารยาสามารถทำได้ 2 รูปแบบ คือ แบบต่อเนื่อง (continuous) โดยให้รับประทานทุกวัน วันละ 10-20 มิลลิกรัม หรือให้เป็นรอบ (cyclical) รอบละ 12-14 วันต่อเดือน ขนาดยาที่สามารถให้ได้มากที่สุด คือ 100-200 มิลลิกรัมต่อวัน(3) ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) ที่ต้องการรักษาด้วยยากลุ่มฮอร์โมนชนิดรับประทาน แนะนำให้ใช้ยาชนิดนี้เป็นทางเลือกแรก โดยให้รับประทานเป็นระยะเวลานาน 3-6 เดือน ทั้งนี้จากการวิจัยเชิงรักษาแบบสุ่มพบว่าการให้ยา MPA แบบต่อเนื่องจะมีประสิทธิภาพสูงกว่าการให้แบบเป็นรอบ โดยมีอัตราการหาย (regression rate) ร้อยละ 96 ในกลุ่มที่ให้แบบต่อเนื่องและร้อยละ 69 ในกลุ่มที่ให้เป็นรอบ(18)
- Megestrol acetate การบริหารยาให้รับประทานแบบต่อเนื่อง 40-200 มิลลิกรัมต่อวัน ในกลุ่มผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาแบบมีเซลล์ผิดปกติ (atypical endometrial hyperplasia) ที่ต้องการรักษาด้วยยากลุ่มฮอร์โมนชนิดรับประทาน แนะนำให้ใช้ยาชนิดนี้เป็นทางเลือกแรก โดยแนะนำให้รับประทานเป็นระยะเวลานาน 3-6 เดือน และมีอัตราการหายสูงถึงร้อยละ 90 และไม่พบการกลับเป็นซ้ำ(15)
- Micronized progesterone โดยทั่วไปจะมียาในรูปแบบครีมและเป็นเม็ดสำหรับสอดช่องคลอดการบริหารยาทั้ง 2 รูปแบบให้ใส่หรือสอดช่องคลอดทุกวัน (continuous) โดยชนิดครีมที่มีความเข้มข้นร้อยละ 4 หรือ 8 ให้ใส่ในช่องคลอด 45-90 มิลลิกรัมต่อวัน และชนิดเม็ดให้สอดช่องคลอดปริมาณ 100-200 มิลลิกรัมต่อวัน หรือให้เป็นรอบ (cyclical) รอบละ 12-14 วันต่อเดือน โดยมีการศึกษาพบว่ามีอัตราการหายสูงถึงร้อยละ 80-95 (16, 19) แต่ยังไม่สูงเท่ากับการใช้ห่วงอนามัยชนิดปล่อยฮอร์โมน (Levonorgestrel–Intrauterine devices)(20) อย่างไรก็ตามจำนวนผู้ป่วยในการศึกษายังไม่มากนัก ดังนั้นอาจจะพิจารณาให้การรักษาด้วยความระมัดระวังและติดตามการตอบสนองต่อการรักษาอย่างใกล้ชิด
- Depot medroxyprogesterone (DMPA) เป็นยาฮอร์โมนกลุ่มโปรเจสตินที่ออกฤทธิ์นาน ในบางการศึกษาพบว่าสามารถใช้เป็นทางเลือกรองจากการใช้แบบห่วงคุมกำเนิดได้ และมีการวิจัยเชิงรักษาแบบสุ่มในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ (nonatypical endometrial hyperplasia) พบว่าการรักษาด้วย DMPA 150 มิลลิกรัมเป็นเวลา 3 เดือน มีประสิทธิภาพสูงกว่าการรักษาด้วย Norethindrone acetate โดยสามารถทำให้เยื่อบุโพรงมดลูกกลับมาเป็นปกติได้สูงถึงร้อยละ 91 เทียบกับร้อยละ 66 (21)
นอกจากนี้เริ่มการศึกษาการรักษาภาวะเยื่อบุโพรงมดลูกหนาตัวด้วยยากลุ่มฮอร์โมนโปรเจสตินกลุ่มใหม่ เช่น dienogest พบว่ามีอัตาราการหายสูงถึงร้อยละ 96.9(22) ซึ่งในอนาคตหากมีการศึกษาวิจัยรองรับมากขึ้นอาจใช้เป็นทางเลือกในการรักษาได้
3) การตัดมดลูก (hysterectomy)
การผ่าตัดเอามดลูกออกเป็นการรักษาแบบถาวร โดยแนะนำให้ตัดมดลูกออกทั้งหมด (total hysterectomy) ทั้งนี้การผ่าตัดสามารถทำได้ทั้งแบบเปิดหน้าท้อง, ผ่าตัดผ่านกล้องหรือผ่าตัดทางช่องคลอด โดยวิธีการนี้แนะนำให้เป็นทางเลือกแรกสำหรับผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติหรือผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติแต่เข้าสู่วัยหมดระดูแล้ว และเป็นทางเลือกรองในสตรีวัยเจริญพันธุ์ที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติแต่ไม่ต้องการธำรงค์ภาวะการเจริญพันธุ์ ข้อบ่งชี้อื่น ๆ ในการให้การรักษาด้วยการตัดมดลูก ได้แก่ การรักษาด้วยกลุ่มยาฮอร์โมนไม่สัมฤทธิ์ผลภายในระยะเวลา 12 เดือน, ยังมีอาการเลือดออกผิดปกติอยู่, มีการกลับเป็นซ้ำ, พยาธิสภาพรุนแรงขึ้นภายหลังการรักษา หรือผู้ป่วยปฎิเสธการติดตามอาการ
ทั้งนี้ไม่แนะนำให้ตัดรังไข่ในกลุ่มผู้ป่วยที่อยู่วัยเจริญพันธุ์ หรือทำการเลาะต่อมน้ำเหลือง (lymphadenectomy) รวมถึงการผ่าตัดเพื่อกำหนดระยะโรคเพิ่มเติม เพราะจะเพิ่มความเสี่ยงในการเกิดภาวะแทรกซ้อนจากการผ่าตัดโดยไม่จำเป็น โดยมะเร็งเยื่อบุโพรงมดลูกที่พบร่วมด้วยมักจะมีลักษณะทางพยาธิวิทยาเป็นชนิดไม่รุนแรง (low-grade) อยู่ในระยะเริ่มต้นและมีโอกาสแพร่กระจายไปยังต่อมน้ำเหลืองน้อย แต่หากผลการตรวจทางพยาธิวิทยาเป็นชนิดรุนแรง (high-grade) หรือลุกลามเข้าไปในกล้ามเนื้อมดลูกลึก (deep mypmetrial invasion) สามารถทำการผ่าตัดเพิ่มเติมเพื่อตัดรังไข่และกำหนดระยะของโรคได้ในภายหลัง
นอกจากการให้การดูแลรักษาตามแนวทางในแต่ละวิธีแล้วสิ่งสำคัญที่ต้องทำควบคู่กันไปด้วย คือ การกำจัดปัจจัยเสี่ยงหรือปัจจัยสนับสนุนที่ทำให้เกิดภาวะ “unopposed estrogen” เช่น การช่วยทำให้ไข่ตกในกลุ่มโรคถุงน้ำรังไข่หลายใบ, การลดน้ำหนัก เป็นต้น
แนวทางการรักษาโดยจำแนกตามชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัว
1) ภาวะเยื่อบุโพรงมดลูกหนาตัวแบบไม่มีเซลล์ผิดปกติ
สตรีวัยเจริญพันธุ์
ในกลุ่มผู้ป่วยที่มีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำ และมีรอบเดือนมาสม่ำเสมออาจพิจารณาสังเกตอาการและติดตามการรักษาได้ แต่หากมีความเสี่ยงร่วมอื่น ๆ ในการเกิดมะเร็งเยื่อบุโพรงมดลูกสูงให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินดังรายละเอียดที่ได้กล่าวไปข้างต้น มีการศึกษาพบว่าค่ามัธยฐานของระยะเวลาที่เยื่อบุโพรงมดลูกจะกลับมาเป็นปกติอยู่ที่ 6 เดือน(23) อย่างไรก็ตามแม้จะยังไม่มีข้อสรุปที่ชัดเจนเกี่ยวกับระยะเวลาที่ต้องให้การรักษาแต่แนะนำให้รักษาต่อเนื่องนานอย่างน้อย 6 เดือน ทั้งนี้ควรเลือกยากลุ่มที่มีประสิทธิภาพในการคุมกำเนิดร่วมด้วย และในสตรีที่ต้องการตั้งครรภ์เมื่อเยื่อบุโพรงมดลูกกลับมาเป็นปกติแต่ยังมีภาวะไข่ไม่ตก (anovulation) ให้พิจารณากระตุ้นให้มีการตกไข่ (ovulation induction) การประเมินการตอบสนองต่อการรักษาแนะนำให้ทำทุก 3-6 เดือนภายหลังการรักษาด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจ โดยองค์กร Royal College of Obstetricians and Gynaecologists (RCOG) ร่วมกับ British Society for Gynaecological Endoscopy (BSGE) แนะนำให้ตรวจติดตามต่อจนครบ 1 ปี แต่ในผู้ป่วยที่มีความเสี่ยงในการกลับเป็นซ้ำสูง เช่น ดัชนีมวลกายมากกว่า 35 กิโลกรัม/ตารางเมตร ให้พิจารณาติดตามด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจปีละครั้ง และให้ยาฮอร์โมนกลุ่มโปรเจสตินชนิดรับประทานต่อเนื่อง 1-2 ปี ทั้งนี้ในกลุ่มสตรีวัยเจริญพันธุ์ที่ไม่ต้องการธำรงภาวะการเจริญพันธุ์สามารถแนะนำให้รับการรักษาด้วยการตัดมดลูกในกรณีดังต่อไปนี้
- มีการพัฒนาเป็นเยื่อบุโพรงมดลูกหนาชนิดที่มีเซลล์ผิดปกติในระหว่างการรักษา
- เยื่อบุโพรงมดลูกยังไม่กลับมาปกติภายหลังให้การรักษาเป็นระยะเวลานาน 12 เดือน
- มีการกลับเป็นซ้ำของภาวะเยื่อบุโพรงมดลูกหนาตัวหลังรักษาด้วยฮอร์โมนกลุ่มโปรเจสติน
- มีอาการเลือดออกผิดปกติจากโพรงมดลูกอย่างต่อเนื่อง
- ปฏิเสธการตรวจติดตามด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจหรือการรักษาด้วยยาฮอร์โมนกลุ่มโปรเจสติน
ในกรณีที่ได้รับการรักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินเป็นระยะเวลานาน 6 เดือนและยังพบว่ามีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดที่ไม่มีเซลล์ผิดปกติอยู่ สามารถเพิ่มขนาดยาโปรเจสตินและติดตามซ้ำได้ แต่ถ้าหากเพิ่มขนาดยาแล้วเยื่อบุโพรงมดลูกยังไม่กลับมาเป็นปกติหรือมีความผิดปกติรุนแรงขึ้นอาจพิจารณาตัดมดลูก
สตรีวัยหมดระดู
ให้พิจารณาตัดมดลูกและรังไข่ทั้งสองข้างเป็นทางเลือกแรก แต่หากมีข้อห้ามในการผ่าตัดหรือไม่ต้องการผ่าตัดให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินและติดตามการรักษาเช่นเดียวกับสตรีวัยเจริญพันธุ์(3)
2) ภาวะเยื่อบุโพรงมดลูกหนาตัว แบบมีเซลล์ผิดปกติ
แนวทางในการดูแลรักษาสตรีที่มีภาวะเยื่อบุโพรงมดลูกหนาตัวชนิดนี้มีวัตถุประสงค์สำคัญ คือ การวินิจฉัยให้ได้ว่ามีรอยโรคที่พัฒนาไปเป็นมะเร็งเยื่อบุโพรงมดลูกร่วมด้วยหรือไม่ และให้การรักษาเพื่อป้องกันไม่ให้พัฒนาไปเป็นมะเร็งเยื่อบุโพรงมดลูกในอนาคต ผู้เชี่ยวชาญบางท่านหรือบางองค์กรแนะนำให้มีการขูดมดลูกหรือส่องกล้องโพรงมดลูกเพิ่มเติม(10) อย่างไรก็ตามยังมีโอกาสที่หลังจากที่ได้ทำการผ่าตัดเรียบร้อยแล้วจะได้รับการวินิจฉัยว่าเป็นมะเร็งเยื่อบุโพรงมดลูกจากผลการตรวจทางพยาธิวิทยาในภายหลัง ทั้งนี้แนวทางการผ่าตัดในผู้ป่วยแต่ละกลุ่มมีข้อแนะนำดังนี้(3)
สตรีวัยหมดระดู
แนะนำให้ตัดมดลูกและรังไข่ออกทั้งสองข้าง
สตรีวัยหมดระดูที่มีข้อห้ามในการผ่าตัด หรือ สตรีวัยเจริญพันธุ์ที่ต้องการธำรงภาวะการเจริญพันธุ์
ให้พิจารณารักษาด้วยยาฮอร์โมนกลุ่มโปรเจสตินเป็นทางเลือกแรก ภายหลังจากที่ให้ข้อมูลและคำปรึกษาแก่ผู้ป่วย ทั้งนี้ผู้ป่วยต้องทราบถึงโอกาสที่จะประสบความสำเร็จจากการรักษาและยอมรับความเสี่ยงต่าง ๆ ที่อาจจะเกิดขึ้น อาทิ เช่น เป็นมะเร็งเยื่อบุโพรงมดลูกในระยะที่สูงกว่าระยะที่ 1 ร้อยละ 2, พบมะเร็งรังไข่ร่วมด้วยร้อยละ 4, โอกาสเสียชีวิตร้อยละ 0.5 เป็นต้น
หลังจากนั้นให้ติดตามผลการรักษาด้วยการเก็บเยื่อบุโพรงมดลูกส่งตรวจในอีก 3 เดือน ถ้ายังพบว่ามีภาวะเยื่อบุโพรงมดลูกหนาตัวแบบมีเซลล์ผิดปกติอยู่ ให้พิจารณาเพิ่มขนาดยาและตรวจติดตามซ้ำในอีก 3 เดือนถัดไป หากยังไม่ตอบสนองต่อการรักษาให้พิจารณาตัดมดลูก แต่ถ้าผลการตรวจพบว่าเยื่อบุโพรงมดลูกกลับมาเป็นปกติให้ตรวจติดตามต่อทุก 3 เดือน และถ้าผลการตรวจปกติ 2 ครั้งติดต่อกันให้เลื่อนระยะเวลาการตรวจติดตามเป็นทุก 6 เดือนจนครบ 2 ปี หลังจากนั้นควรตรวจติดตามทุกปี และถ้าหากยังไม่มีแผนจะมีบุตรในระยะเวลาอันใกล้ให้ใช้ยาฮอร์โมนกลุ่มโปรเจสตินต่ออย่างต่อเนื่องเป็นระยะเวลาอย่างน้อย 1-2 ปี แต่ในกรณีที่ต้องการมีบุตรทันทีภายหลังจากสิ้นสุดการรักษาก็สามารถที่จะหยุดยาได้ และเมื่อมีบุตรเพียงพอแล้วให้พิจารณาตัดมดลูกและรังไข่ทั้งสองข้างในภายหลัง
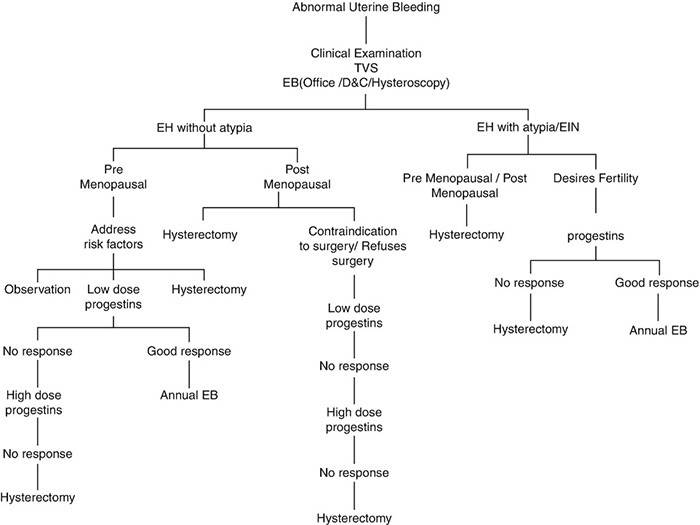
รูปที่ 3 แผนภูมิแสดงแนวทางการรักษาภาวะเยื่อบุมดลูกหนาตัวผิดปกติ
ที่มา ปรับปรุงจากTherapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016
สรุป
ภาวะเยื่อบุโพรงมดลูกหนาตัวถูกจำแนกเป็นชนิดที่มีเซลล์ผิดปกติและชนิดที่ไม่มีเซลล์ผิดปกติ โดยข้อพิจารณาในการเลือกวิธีการรักษานั้นขึ้นอยู่กับปัจจัยหลัก 2 ประการ คือ ชนิดของภาวะเยื่อบุโพรงมดลูกหนาตัวและความต้องการในการธำรงภาวะการเจริญพันธุ์ของผู้ป่วย ทั้งนี้การดูแลรักษามีเป้าหมายเพื่อแก้ไขภาวะเลือดออกผิดปกติจากโพรงมดลูกและป้องกันการพัฒนากลายเป็นมะเร็งเยื่อบุโพรงมดลูกในอนาคต โดยแพทย์ผู้ดูแลควรทราบพยาธิกำเนิด พยากรณ์โรค และแนวทางการรักษา เพื่อที่จะให้การดูแลผู้ป่วยได้อย่างถูกต้องและเหมาะสม
เอกสารอ้างอิง
- Sanderson PA, Critchley HO, Williams AR, Arends MJ, Saunders PT. New concepts for an old problem: the diagnosis of endometrial hyperplasia. Hum Reprod Update. 2017;23:232-54.
- Sobczuk K, Sobczuk A. New classification system of endometrial hyperplasia WHO 2014 and its clinical implications. Prz Menopauzalny. 2017;16:107-11.
- Auclair M-H, Yong PJ, Salvador S, Thurston J, Colgan TJ, Sebastianelli A. Guideline No. 390-Classification and Management of Endometrial Hyperplasia. Journal of Obstetrics and Gynaecology Canada. 2019;41:1789-800.
- ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstetrics and gynecology. 2005;106:413-25.
- Amant F, Mirza MR, Koskas M, Creutzberg CL. Cancer of the corpus uteri. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. 2018;143 Suppl 2:37-50.
- Schorge JO, Hossein Saboorian M, Hynan L, Ashfaq R. ThinPrep detection of cervical and endometrial adenocarcinoma: a retrospective cohort study. Cancer. 2002;96:338-43.
- Practice bulletin no. 128: diagnosis of abnormal uterine bleeding in reproductive-aged women. Obstetrics and gynecology. 2012;120:197-206.
- Wise MR, Gill P, Lensen S, Thompson JM, Farquhar CM. Body mass index trumps age in decision for endometrial biopsy: cohort study of symptomatic premenopausal women. American journal of obstetrics and gynecology. 2016;215:598.e1-.e8.
- ACOG Committee Opinion No. 734: The Role of Transvaginal Ultrasonography in Evaluating the Endometrium of Women With Postmenopausal Bleeding. Obstetrics and gynecology. 2018;131:e124-e9.
- Bakour SH, Khan KS, Gupta JK. Controlled analysis of factors associated with insufficient sample on outpatient endometrial biopsy. Bjog. 2000;107:1312-4.
- Rakha E, Wong SC, Soomro I, et al. Clinical outcome of atypical endometrial hyperplasia diagnosed on an endometrial biopsy: institutional experience and review of literature. Am J Surg Pathol. 2012;36:1683-90.
- Reed SD, Voigt LF, Newton KM, et al. Progestin therapy of complex endometrial hyperplasia with and without atypia. Obstetrics and gynecology. 2009;113:655-62.
- Gallos ID, Shehmar M, Thangaratinam S, Papapostolou TK, Coomarasamy A, Gupta JK. Oral progestogens vs levonorgestrel-releasing intrauterine system for endometrial hyperplasia: a systematic review and metaanalysis. Am J Obstet Gynecol. 2010;203:547.e1-10.
- Luo L, Luo B, Zheng Y, Zhang H, Li J, Sidell N. Oral and intrauterine progestogens for atypical endometrial hyperplasia. Cochrane Database Syst Rev. 2018;12:Cd009458.
- Gal D, Edman CD, Vellios F, Forney JP. Long-term effect of megestrol acetate in the treatment of endometrial hyperplasia. Am J Obstet Gynecol. 1983;146:316-22.
- Affinito P, Di Carlo C, Di Mauro P, Napolitano V, Nappi C. Endometrial hyperplasia: efficacy of a new treatment with a vaginal cream containing natural micronized progesterone. Maturitas. 1994;20:191-8.
- Perino A, Quartararo P, Catinella E, Genova G, Cittadini E. Treatment of endometrial hyperplasia with levonorgestrel releasing intrauterine devices. Acta Europaea fertilitatis. 1987;18:137-40.
- Orbo A, Vereide A, Arnes M, Pettersen I, Straume B. Levonorgestrel-impregnated intrauterine device as treatment for endometrial hyperplasia: a national multicentre randomised trial. Bjog. 2014;121:477-86.
- Marra C, Penati C, Ferrari L, Cantù MG, Bargossi L, Fruscio R. Treatment of simple and complex endometrial non-atypical hyperplasia with natural progesterone: response rate to different doses. Gynecol Endocrinol. 2014;30:899-901.
- Tasci Y, Polat OG, Ozdogan S, Karcaaltincaba D, Seckin L, Erkaya S. Comparison of the efficacy of micronized progesterone and lynestrenol in treatment of simple endometrial hyperplasia without atypia. Arch Gynecol Obstet. 2014;290:83-6.
- Nooh AM, Abdeldayem HM, Girbash EF, Arafa EM, Atwa K, Abdel-Raouf SM. Depo-Provera Versus Norethisterone Acetate in Management of Endometrial Hyperplasia Without Atypia. Reproductive sciences (Thousand Oaks, Calif). 2016;23:448-54.
- Uysal G, Acmaz G, Madendag Y, et al. The Efficacy of Dienogest in the Treatment of Simple Endometrial Hyperplasia without Atypia. Gynecol Obstet Invest. 2018;83:151-5.
- Gunderson CC, Fader AN, Carson KA, Bristow RE. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: a systematic review. Gynecol Oncol. 2012;125:477-82.
- Lee JHS, Cheng EOL, Choi KM, Ngu SF, Cheung RYK. 2020 Hong Kong College of Obstetricians and Gynaecologists guideline on investigations of premenopausal women with abnormal uterine bleeding. Hong Kong medical journal = Xianggang yi xue za zhi. 2020;26(6):520-5.
- Chandra V, Kim JJ, Benbrook DM, Dwivedi A, Rai R. Therapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016;27(1).
Critical Care in Postoperative Gynecologic Patients
Critical Care in Postoperative Gynecologic Patients
พญ. ณัฐกานต์ เสงี่ยมพร
รศ. พญ. จารุวรรณ แซ่เต็ง
ศ. ดร. นพ. กวีศักดิ์ จิตตวัฒนรัตน์
การผ่าตัดโดยทั่วไปรวมไปถึงการผ่าตัดทางนรีเวชวิทยา การจะได้ผลลัพธ์ในการผ่าตัดที่ดีนั้น ขึ้นอยู่กับการประเมินผู้ป่วยตั้งแต่ก่อนผ่าตัด ในระหว่างการผ่าตัด และหลังการผ่าตัด ซึ่งพบว่าแม้จะได้มีการเตรียมพร้อมผู้ป่วยก่อนการผ่าตัดและการผ่าตัดเรียบร้อยดีแล้ว ช่วงเวลาหลังการผ่าตัดของผู้ป่วยนั้น ยังคงมีความเสี่ยงที่อาจจะเกิดภาวะแทรกซ้อน เกิดภาวะทุพลภาพ หรือเสียชีวิตได้ ดังนั้น การให้ความสำคัญกับการดูแลผู้ป่วยหลังการผ่าตัดยังคงมีความจำเป็นที่จะต้องดูแลอย่างต่อเนื่องและใกล้ชิด ในการดูแลผู้ป่วยหลังผ่าตัดที่ดีนั้น จำเป็นต้องมีการประเมินและให้การรักษาครอบคลุมระบบต่างๆ ซึ่งภายหลังการผ่าตัดนั้นเราควรจะต้องประเมินได้ว่าผู้ป่วยรายใดที่สามารถดูแลรักษาที่วอร์ดทั่วไป หรือผู้ป่วยรายใดที่จำเป็นต้องเข้ารับการดูแลในห้องผู้ป่วยวิกฤต (Intensive care unit : ICU) ซึ่งผู้ป่วยที่ควรต้องเข้ารับการดูแลใน ICU ได้แก่ ผู้ป่วยที่ต้องได้รับการติดตามดูแลอย่างใกล้ชิด หรือยังต้องอาศัยเครื่องช่วยหายใจ, ผู้ป่วยที่สัญญาณชีพไม่คงที่, หรือผู้ป่วยที่มีโอกาสที่จะแย่ลงหลังการผ่าตัด แต่ในกรณีที่สถานพยาบาลที่เราดูแลนั้น มีผู้ป่วยจำนวนมาก และจำนวนของเตียงในห้องผู้ป่วยวิกฤตมีจำกัด เราจึงจำเป็นต้องมีเครื่องมือที่ช่วยในการจัดสรรผู้ป่วยหลังการผ่าตัดให้เหมาะสม
Surgical Apgar Score (SAS) เป็นเครื่องมือที่ช่วยในการประเมินความเสี่ยงของผู้ป่วยในการเกิดภาวะแทรกซ้อนภายหลังการผ่าตัด (1) โดยจะประเมินจากปริมาณเลือดที่เสียไประหว่างผ่าตัด, ค่าเฉลี่ยของความดันโลหิตที่ต่ำที่สุด, และอัตราการเต้นของหัวใจที่ช้าที่สุด ซึ่งจะคำนวนออกมาเป็นคะแนน ดังแสดงในรูปที่ 1 โดยหากคะแนน ≥ 7 สามารถดูแลแบบผู้ป่วยทั่วไปได้, ≤ 6 ดูแลอย่างใกล้ชิด, ≤ 4 ควรต้องได้รับการดูแลในห้องผู้ป่วยวิกฤต

รูปที่ 1 Surgical Apgar Score (SAS)
ในที่นี้จะขอกล่าวถึงการดูแลผู้ป่วยหลังการผ่าตัดในห้องผู้ป่วยวิกฤต โดยจะดูแลอย่างเป็นระบบ ดังนี้
ระบบการไหลเวียนโลหิต (Hemodynamic)
ภาวะช็อก (Shock) หมายถึง ภาวะที่มีการขาดออกซิเจนของเนื้อเยื่อส่วนปลายซึ่งนำไปสู่ความผิดปกติของการทำงานของอวัยวะต่างๆ(2) การที่เราเข้าใจกระบวนการและปัจจัยของการนำส่งออกซิเจนปกติในร่างกาย (รูปที่ 2) จะช่วยทำให้เราสามารถให้การรักษาแก่ผู้ป่วยที่มีภาวะช็อคได้อย่างถูกต้องและเหมาะสม

รูปที่ 2 ปัจจัยที่เกี่ยวข้องกับการนำส่งออกซิเจนตามปกติของร่างกาย
(DO2 = Oxygen delivery, CaO2 = Oxygen content, CO = Cardiac output, SaO2 = Oxygen saturation, PaO2 = Partial arterial oxygen pressure, MAP = Mean arterial pressure, SVR = Systemic vascular resistance, SV = Stroke volume, HR = Heart rate, EDV = End-diastolic volume, EF = Ejection fraction)
การทำงานของอวัยวะในร่างกายนั้น จำเป็นต้องมีความสมดุลระหว่างความต้องการออกซิเจนและปริมาณออกซิเจนที่นำส่ง (Demand & Supply) ซึ่งในการนำส่งออกซิเจนไปยังอวัยวะส่วนปลายให้มีประสิทธิภาพ ต้องอาศัย 2 องค์ประกอบที่สำคัญ ได้แก่ ปริมาณของออกซิเจนในเลือดที่ส่งออกไป (Oxygen content: CaO2) และปริมาตรเลือดส่งออกจากหัวใจต่อนาที (Cardiac output: CO) ดังสมการในรูปที่ 2
ในส่วนของปริมาณของออกซิเจนในเลือดที่ส่งออกนั้น โดยปกติออกซิเจนจะถูกขนส่งโดยผ่านฮีโมโกลบิน (Hemoglobin: Hb) ที่อยู่ในเม็ดเลือดแดง ซึ่งการที่ออกซิเจนจะเข้าไปอยู่ได้นั้น ต้องมีการละลายในพลาสมาก่อน(Partial arterial oxygen pressure: PaO2) แล้วจึงค่อยเข้าไปจับได้ และเมื่อออกซิเจนจับกับฮีโมโกลบินจนครบทุกหน่วยจะบ่งชี้เป็นความอิ่มตัวของออกซิเจนในเลือด (Oxygen saturation: SaO2) ดังรูปที่ 3 กล่าวคือ หากมี ปริมาณฮีโมโกลบินในเลือดไม่พอ เช่น ภาวะซีด หรือภาวะที่ขาดออกซิเจน หรือภาวะที่มีก๊าซบางอย่างละลายในพลาสมาและเข้ามาแย่งออกซิเจนจับกับฮีโมโลบิน เช่น ปริมาณคาร์บอนไดออกไซด์เกินจากสาเหตุใดๆ ก็ตาม (รูปที่ 4) ผลลัพธ์คือความอิ่มตัวของออกซิเจนในเลือดลดลง ปริมาณออกซิเจนในเลือดที่ส่งออกลดลง จนนำไปสู่การลดลงของออกซิเจนที่นำส่งไปยังอวัยวะต่างๆ นั่นเอง
ในส่วนของปริมาตรเลือดส่งออกจากหัวใจต่อนาที ขึ้นอยู่กับการทำงานของหัวใจ ซึ่งได้แก่ ความสามารถในการบีบตัวของหัวใจ (Ejection fraction: EF) ความดันโลหิต (Mean arterial pressure: MAP) อัตราการเต้นของหัวใจ (Heart rate: HR) กล่าวคือ หากหัวใจบีบตัวได้ไม่ดี หรือมีภาวะความดันโลหิตต่ำ หรือหัวใจเต้นช้าผิดปกติ จะส่งผลให้เลือดไปเลี้ยงยังอวัยวะต่างๆ ลดลง นอกจากนี้ ยังมีปัจจัยที่มีผลต่อการบีบตัวของหัวใจ ได้แก่ ปริมาณเลือดในหัวใจช่วงคลายตัว (EDV: End-diastolic volume) บ่งบอกถึง Preload และความต้านทานของหลอดเลือดส่วนปลาย (Systemic vascular resistance: SVR) หรือก็คือ Afterload ซึ่งหากปริมาณเลือดที่เข้าสู่หัวใจลดลง หรือมีความต้านทานของหลอดเลือดที่หัวใจจะบีบออกไปเพิ่มขึ้น จะส่งผลให้หัวใจบีบเลือดออกไปได้ลดลง
โดยสรุป จะเห็นได้ว่ากระบวนการนำส่งออกซิเจนจะขึ้นอยู่กับ 8 ปัจจัยสำคัญ ได้แก่ ความเข้มข้นของเลือด (Hb), ความอิ่มตัวของออกซิเจน (SaO2), ปริมาณของออกซิเจนที่ละลายในพลาสมา (PaO2), ความดันโลหิต (MAP), ความต้านทานของหลอดเลือดส่วนปลาย (SVR), ความสามารถในการบีบตัวของหัวใจ (EF), ปริมาณเลือดในหัวใจช่วงคลายตัว (EDV), และอัตราการเต้นของหัวใจ (HR) ซึ่งหากเกิดความไม่สมดุลระหว่างความต้องการออกซิเจนและปริมาณออกซิเจนที่นำส่ง ก็จะนำไปสู่การเกิดภาวะช็อคได้ และเมื่อร่างกายมีปริมาณออกซิเจนไม่เพียงพอ ร่างกายจะใช้กระบวนการเผาผลาญโดยไม่ใช้ออกซิเจน เกิดผลลัพธ์ออกมาเป็นแลคเตด (Lactate) ทำให้เลือดเกิดสภาวะความเป็นกรดตามมา ส่งผลให้เซลล์ต่างๆ ในร่างกายไม่สามารถทำงานได้ และล้มเหลวไปในที่สุด
รูปที่ 3 ภาวะที่ออกซิเจนไปจับรวมกับฮีโมโกลบินในเม็ดเลือดแดงจนครบทุกหน่วย มีการอิ่มตัวของออกซิเจน 100%
ก.
ข
ค
รูปที่ 4 แสดงสภาวะที่ส่งผลให้ปริมาณปริมาณของออกซิเจนในเลือดที่ส่งออกลดลง
กรณี ก : ภาวะ Hypercapnia มีฮีโมโกลบินเพียงพอ แต่มีก๊าซที่เข้ามาแย่งออกซิเจนในการจับฮีโมโกลบิน; กรณี ข : ภาวะ Hypoxia มีฮีโมโกลบินเพียงพอ แต่ปริมาณออกซิเจนไม่เพียงพอ;
กรณี ค : ภาวะ Anemia มีออกซิเจนที่เพียงพอ แต่ขาดฮีโมโกลบินที่นำส่งออกซิเจน
ภาวะช็อคนั้นเกิดได้จากหลายสาเหตุ ได้แก่ Hypovolemic/Hemorrhagic shock, Obstructive shock, Vasodilatory/Vasogenic shock, Cardiogenic shock, และ Neurogenic shock ซึ่งสาเหตุที่พบบ่อยจากการผ่าตัดทางนรีเวชวิทยานั้น มักจะเป็น 3 กรณีแรกซึ่งจะขอไม่ลงรายละเอียดในทีนี้
เมื่อผู้ป่วยเกิดภาวะช็อคขึ้น การที่ประเมินได้อย่างรวดเร็วและรีบรักษาให้ทันในช่วงที่ร่างกายยังสามารถตอบสนองได้นั้น (Reversible shock) เป็นสิ่งที่จำเป็น เพราะหากปล่อยร่างกายเกิดภาวะช็อคเป็นระยะเวลานาน อาจจะส่งผลให้อวัยวะต่างๆ เริ่มเสียหาย และสามารถกลับมาแก้ไขได้อีก (Irreversible shock)
ดังนั้น เราต้องทราบถึงวิธีการประเมินสภาวะช็อค ซึ่งสามารถแบ่งออกได้อยู่ 3 ส่วน ได้แก่ Clinical assessment, Hemodynamic assessment และ Perfusion assessment (2)
- Clinical assessment ได้แก่ การประเมินความรู้สึกตัวของผู้ป่วย, สัญญาณชีพ (ความดันโลหิต, ชีพจร, ช่วงความกว้างของความดันโลหิต), อุณหภูมิร่างกาย โดยเฉพาะบริเวณปลายมือปลายเท้า, และปริมาณปัสสาวะ
- Hemodynamic assessment หมายถึง การประเมินปริมาณสารน้ำที่อยู่ในร่างกายว่ามีเพียงพอแล้วหรือไม่
โดยตามกฏของ Frank-Starling law (รูปที่ 5) การให้สารน้ำในกรณีที่ผู้ป่วยขาดน้ำถือเป็นการเพิ่ม Preload ซึ่งจะทำให้เพิ่มปริมาตรเลือดที่ถูกสูบฉีดออกจากหัวใจในแต่ละครั้ง (Stoke volume) แต่ถ้าหากผู้ป่วยได้น้ำในปริมาณที่มากเกินจุดๆ หนึ่งไป อาจจะส่งผลเสียทำให้ผู้ป่วยเกิดภาวะปอดบวมน้ำ หรือหัวใจล้มเหลวตามมาได้ เรียกจุดนั้นว่า จุดอันตราย ซึ่งก่อนที่จะไปถึงจุดอันตรายนั้น จะมีจุดหนึ่งที่เริ่มบ่งบอกได้ว่าการให้สารน้ำเพิ่มเติมจากนี้ไม่ได้มีผลต่อการเพิ่มปริมาตรสารน้ำที่บีบออกจากหัวใจ เรียกจุดนั้นว่า จุดวิกฤต ซึ่งเรามีหลายวิธีในการบอกถึงจุดวิกฤต เช่น Fluid challenge test (ตารางที่ 1), Fluid responsiveness/Preload responsiveness guide fluid management, หรือ Ultrasound guide fluid management ซึ่งได้แก่ IVC diameter (รูปที่ 6) หรือ Lung ultrasound (รูปที่ 7) (3)
รูปที่ 5 กราฟแสดงความสัมพันธ์ระหว่าง Ventricular EDV และ Stroke volume ตามกฏของ Frank-Starling law
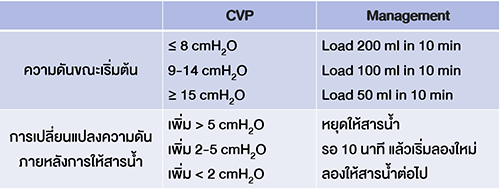
ตารางที่ 1 แสดงแนวทางประเมินสารน้ำโดยวิธี Fluid challenge test และแนวทางการรักษา
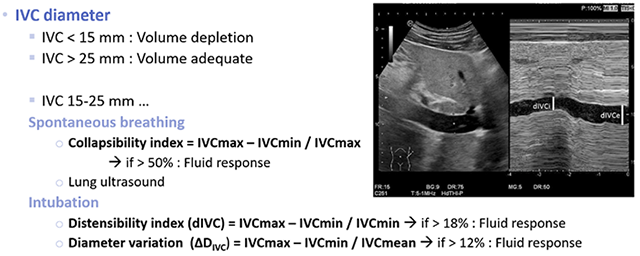
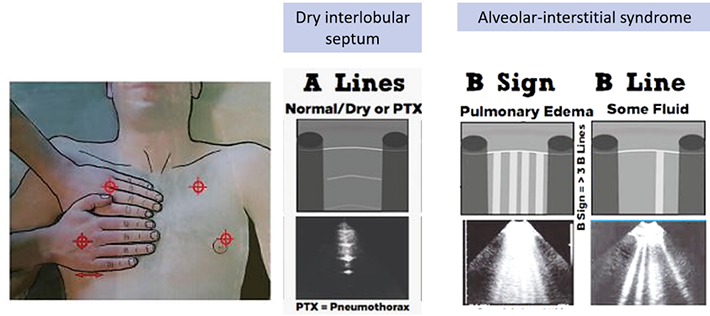
รูปที่ 6 ตำแหน่งการวัด IVC (รูปซ้าย) และวิธีประเมินสารน้ำ (รูปขวา) โดยการอัลตราซาวน์ประมิน IVC diameter
รูปที่ 6 วิธีประเมินสารน้ำ โดยการอัลตราซาวน์ปอด
- Perfusion assessment สามารถประเมินได้จาก Systemic oxygen transport เช่น SvO2, ScvO2 หรือ Peripheral tissue end product ได้แก่ Blood lactate, Base deficit (ดังที่ได้กล่าวไปข้างต้น)
ระบบการหายใจ และการช่วยหายใจ (Respiratory and Ventilation)
ภาวะแทรกซ้อนที่พบได้บ่อยภายหลังผ่าตัด ได้แก่ ภาวะถุงลมแฟบ (Atelectasis) แท้จริงแล้ว ภาวะดังกล่าวเกิดขึ้นตั้งแต่ก่อนที่จะเริ่มการผ่าตัดจากการที่ผู้ป่วยได้รับยาหย่อนกล้ามเนื้อ (Neuromuscular blocking drug: NMBD) เพื่อช่วยในการใช้เครื่องช่วยหายใจ และคลายกล้ามเนื้อระหว่างการผ่าตัด การได้รับยาดังกล่าวนั้นมีผลให้กล้ามเนื้อทั้งร่างกายคลายตัว รวมไปถึงกล้ามเนื้อในการหายใจด้วยเช่นกัน ซึ่งจะส่งผลให้เกิดภาวะอุดกลั้นทางเดินหายใจ และปริมาตรของอากาศคงเหลืออยู่ในปอดหลังจากหายใจออก (Functional residual capacity: FRC) ลดลง ซึ่งภาวะดังกล่าวนั้นจะส่งผลให้นำไปสู่การเกิดถุงลมแฟบ (Atelectasis) ซึ่งหากการผ่าตัดใช้ระยะเวลาไม่นาน หลังการผ่าตัด ร่างกายก็จะสามารถกลับเข้าสู่ภาวะปกติได้หลังผู้ป่วยเริ่มหายใจได้เอง แต่ถ้าหากระยะเวลาในการผ่าตัดนานหรือผู้ป่วยมีภาวะอ้วน จะเพิ่มความเสี่ยงในการเกิดภาวะถุงลมแฟบภายหลังการผ่าตัดได้เช่นกัน (4)
นอกจากนี้ ภาวะแทรกซ้อนของทางเดินหายใจอื่นๆ ที่พบได้บ่อยหลังการผ่าตัด ได้แก่ ภาวะปอดบวม (Pulmonary edema), ปอดอักเสบจากการสำลัก (Aspiration pneumonitis), ปอดติดเชื้อ (pneumonia), ภาวะทางเดินหายใจล้มเหลวเฉียบพลัน (Acute respiratory distress syndrome), หรือภาวะลิ่มเลือดอุดกั้นในปอด (Pulmonary embolism) เป็นต้น
จากการศึกษาพบว่า 3 ใน 4 ของผู้ป่วยที่เข้าทำการผ่าตัดเกิดภาวะถุงลมแฟบในระหว่างการผ่าตัด(4) ซึ่งภายหลังการผ่าตัดนั้น หากผู้ป่วยไม่ได้รับการดูแลที่เหมาะสมอาจส่งผลให้ภาวะถุงลมแฟบยังคงดำเนินต่อไปจนทำให้เกิดภาวะแทรกซ้อนอื่นๆ ตามมาได้ ดังนั้น เราจึงควรมีแนวทางดูแลผู้ป่วย เพื่อป้องกันการเกิดภาวะดังกล่าวนั้น
I COUGH คือหนึ่งในกระบวนการดูแลผู้ป่วย ที่ช่วยป้องกันภาวะแทรกซ้อนของระบบทางเดินหายใจหลังการผ่าตัด ได้มีการศึกษาที่ได้นำ I COUGH มาเป็นส่วนหนึ่งในการดูแลหลังการผ่าตัด พบว่าช่วยลดอุบัติการณ์การเกิดปอดติดเชื้อหลังผ่าตัดได้ (5) I COUGH สามารถทำได้ตั้งแต่หลังผ่าตัดวันแรก หากผู้ป่วยตื่นดี ซึ่งมีขั้นตอนดังนี้
- I Incentive spirometry – สูดเครื่องบริหารปอด รอบละ 10 ครั้งต่อชั่วโมง ทำ 3-5 รอบต่อวัน
- C Coughing and deep breathing – ไอและหายใจลึกๆ ทุกๆ 2 ชั่วโมง
- O Oral care – ให้แปรงฟันและบ้วนปากทุกวัน
- U Understanding – ให้ความรู้ ความเข้าใจเกี่ยวกับการปฏบัติตัวหลังการผ่าตัดกับผู้ป่วยและครอบครัว
- G Getting out of bed – ลุกออกจากเตียง อย่างน้อย 3 ครั้งต่อวัน
- H Head-of-bed elevation – ยกหัวเตียงขึ้นสูง > 30O
ในผู้ป่วยบางรายที่มีความเสี่ยงสูงนั้น หลังการผ่าตัดบางครั้งอาจจะยังจำเป็นต้องอาศัยเครื่องช่วยหายใจในช่วงแรก และรอให้ร่างกายเริ่มฟื้นตัวดีก่อน จึงจะพิจารณาหย่าเครื่องช่วยหายใจ (Weaning)
เครื่องช่วยหายใจ (Ventilator) เป็นอุปกรณ์หนึ่งในห้องผู้ป่วยวิกฤตที่เรามีโอกาสที่จะได้ใช้งาน ในที่นี้จะขอไม่ลงรายละเอียดถึงการใช้งาน แต่จะขอกล่าวถึงโหมดการทำงานที่ควรจะต้องรู้จักและเข้าใจ โดยทั่วไปเครื่อง ช่วยหายใจจะมีโหมดทำงานอยู่ 3 โหมด ได้แก่
▫ Assisted – controlled mode (A/C) เป็นโหมดที่จะพิจารณาใช้ในกรณีที่ผู้ป่วยยังไม่มีสติ ยังหายใจเองได้ไม่ดี หรือไม่สามารถหายใจได้ด้วยตัวเอง โดยหากผู้ป่วยไม่สามารถดึงเครื่องช่วยหายใจได้เองเครื่องจะเป็นตัวควบคุมหลักในการหายใจเข้าออกของผู้ป่วยทั้งหมด (Totally controlled) แต่หากผู้ป่วยยังพอสามารถดึงเครื่องช่วยหายใจได้เอง เครื่องจะจ่ายอากาศตามที่ได้กำหนดไว้ให้หลังจากนั้น (Assisted) ซึ่งมีอยู่ 2 ชนิด คือ Volume control กับ Pressure control
- Volume control ต้องมีการกำหนดปริมาณลมที่ผู้ป่วยจะหายใจเข้า (Tidal volume) และอัตราการไหลของลม (Flow rate)
- Pressure control จะกำหนดความดันลมและระยะเวลาในของการหายใจเข้า (Inspiratory pressure and inspiratory time)
▫ Spontaneous mode หรือ Pressure support ventilator (PSV) เป็นโหมดที่ผู้ป่วยต้องรู้สึกตัวดีและเริ่มหายใจได้เอง จะพิจารณาใช้กรณีที่ต้องการลดการช่วยหายใจหรือต้องการหย่าเครื่องช่วยหายใจ โหมดนี้ผู้ป่วยจะเป็นผู้กำหนดการเริ่มการหายใจเอง และเครื่องจะทำหน้าที่เพียงสร้างแรงดันบวก (Support)
▫ Synchronous intermittent mandatory ventilator (SIMV) เป็นโหมดที่ปัจจุบันได้รับความนิยมลดลง เนื่องจากทำให้ใช้ระยะเวลาในการหย่าเครื่องช่วยหายใจนานขึ้น จึงจะขอไม่พูดถึงในที่นี้
การจะพิจารณาหย่าเครื่องช่วยหายใจนั้น ผู้ป่วยต้องมีความพร้อมของร่างกายทั้ง 3 ระบบ ได้แก่ ระบบการหายใจ, ระบบหัวใจและหลอดเลือด, และระบบประสาท โดยเราจะพิจารณาหย่าเครื่องช่วยหายใจในกรณีที่ผู้ป่วยตื่นดี, โรคหรือสาเหตุที่ทำให้เกิดอาการเหนื่อยได้ถูกแก้ไขแล้ว, สามารถไอได้แรงดีพอสมควร, สัญญาณชีพคงที่, ไม่ได้ใช้ยากระตุ้นหัวใจ หรือใช้ในปริมาณที่น้อยมาก, PEEP ≤ 5 cmH2O, และ PaO2/FiO2 > 200
โดยวิธีการหย่าเครื่องช่วยหายใจ เช่น T-piece, Low PSV mode, หรือ SIMV mode (ใช้กรณีที่ผู้ป่วยจำเป็นต้องใช้ระยะเวลาในการค่อยๆ หย่าเครื่องช่วยหายใจ เช่น Heart failure or Ischemic heart disease,
Chronic hypercapnia, Neuromuscular disorder เป็นต้น)
สาเหตุของการหย่าเครื่องช่วยหายใจไม่สำเร็จ(2) แบ่งออกเป็น 3 กลุ่ม
- การทำงานของศูนย์การหายใจถูกกด เช่น ได้รับยากดประสาท หรือภาวะเลือดเป็นด่างรุนแรง
- การทำงานของกล้ามเนื้อการหายใจลดลง เช่น ความผิดปกติของเกลือแร่ (แคลเซียมหรือโพแทสเซียมต่ำ ภาวะเลือดเป็นกรด), ภาวะทุพโภชนาการ, ไทรอยด์ต่ำ
- การทำงานของกล้ามเนื้อการหายใจเพิ่มขึ้น เช่น หัวใจล้มเหลว, ปอดแฟบ, ความดันในช่องท้องสูง, เสมหะอุดตัน, ติดเชื้อในกระแสเลือด, ลิ่มเลือดอุดตันในปอด
ระบบทางเดินอาหาร และโภชนาบำบัด (Gastrointestinal and Nutrition)
ภาวะแทรกซ้อนของระบบทางเดินอาหารที่พบได้บ่อย ได้แก่ ภาวะลำไส้เคลื่อนไหวน้อยลง (Bowel ileus), ภาวะลำไส้เล็กอุดตัน (Small bowel obstruction), ภาวะลำไส้ใหญ่อุดตัน (Colonic obstruction)
ภาวะลำไส้เคลื่อนไหวน้อยลง (Bowel ileus) เป็นภาวะแทรกซ้อนของทางเดินอาหารหลังการผ่าตัดที่พบได้บ่อยที่สุด ซึ่งพบประมาณร้อยละ 3 ของผู้ป่วยที่เข้ารับการผ่าตัดมดลูก (Hysterectomy) (6) โดยการผ่าตัดที่มีการรบกวน หรือบาดเจ็บต่อลำไส้ การผ่าตัดที่ใช้ระยะเวลานาน การติดเชื้อ การอักเสบของช่องท้อง การใช้ยาในกลุ่ม opioid และภาวะไม่สมดุลของเกลือแร่ ส่งผลให้เพิ่มความเสี่ยงต่อการเกิดภาวะลำไส้เคลื่อนไหวน้อยลง ผู้ป่วยมักจะมีอาการอืดท้อง ทานไม่ได้ คลื่นไส้อาเจียน เสียงการทำงานของลำไส้ลดลง ซึ่งการรักษาทำได้โดยการให้งดน้ำงดอาหารทางปาก และให้สารน้ำทางเส้นเลือด ใส่สายทางจมูกเพื่อลดความดันในช่องท้อง แก้ไขสมดุลเกลือแร่ และกระตุ้นให้ขยับตัว หากอาการดังกล่าวไม่ดีขึ้นภายใน 48-72 ชั่วโมง ควรพิจารณาหาสาเหตุอื่น
ภาวะลำไส้เล็กอุดตัน (Small bowel obstruction) เป็นภาวะที่พบได้ประมาณร้อยละ 1-2 ของผู้ป่วยที่เข้าผ่าตัดเปิดหน้าท้องทางนรีเวช (6) ซึ่งส่วนมากมักเป็นการอุดตันแค่บางส่วน (Partial bowel obstruction) โดยสาเหตุส่วนใหญ่มักเกิดจากการมีพังผืดจากการผ่าตัดและส่วนน้อยเกิดจากการที่ลำไส้เข้าไปอุดอยู่ในบริเวณที่มีการหย่อนของผนังหน้าท้องจากการผ่าตัด (Incisional hernia) อาการจะคล้ายกับภาวะลำไส้เคลื่อนไหวน้อยลง แต่ต่างกันตรงที่ภาวะนี้มีเสียงการทำงานของลำไส้ที่เพิ่มมากขึ้น ซึ่งการดูแลรักษาจะเน้นแบบอนุรักษ์ (Conservative treatment) เช่นเดียวกับภาวะลำไส้เคลื่อนไหวน้อยลง
ภาวะลำไส้ใหญ่อุดตัน (Colonic obstruction) เป็นภาวะแรกซ้อนที่พบได้น้อย มักจะเกิดในผู้ป่วยที่เป็นมะเร็งทางนรีเวช โดยพบว่ามะเร็งรังไข่ระยะลุกลาม (Advanced ovarian carcinoma) เป็นสาเหตุที่พบบ่อยที่สุดที่ทำให้เกิดภาวะนี้ ผู้ป่วยจะมีอาการท้องอืด และตรวจภาพทางรังสีพบกระเปาะลำไส้ใหญ่มีการขยายตัว (Dilated cecum) มากกว่า 10-12 เซนติเมตร ซึ่งภาวะนี้ถือเป็นภาวะอันตรายต้องรักษาโดยการผ่าตัด ไม่สามารถรักษาแบบอนุรักษ์ได้ เพราะมีความเสี่ยงสูงต่อการแตกของลำไส้
ในส่วนของโภชนาการ ได้มีการแนะนำปริมาณแคลอรี่ที่เหมาะสมในแต่ละวันโดยคำนวนตามน้ำหนักตัว ในกรณีผู้ป่วยทั่วไปในห้องผู้ป่วยวิกฤตควรได้รับแคลอรี่ประมาณ 25-30 kcal/kg/day (7) แต่ในกรณีที่ผู้ป่วยน้ำหนักเยอะปริมาณแคลอรี่ควรได้จะให้เพียงร้อยละ 65-70 ของพลังงานเป้าหมาย โดยหากผู้ป่วยมีดัชนีมวลกายอยู่ในช่วง 30-50 kg/m2 คำนวนแคลอรี่ได้ 11-14 kcal/kg(น้ำหนักจริง)/day และถ้าดัชนีมวลกายมากกว่า 50 kg/m จะคำนวนแคลอรี่ได้ 22-25 kcal/kg(IBW)/day (7) นอกจากนี้ ผู้ป่วยที่สัญญาณชีพไม่คงที่ ผู้ป่วยมะเร็งระยะสุดท้าย ผู้ป่วยที่มีข้อห้ามในการรับประทานอาหารทางปาก หรือรับประทานได้น้อยกว่าปกติ มากกว่าร้อยละ 50 เป็นเวลามากกว่า 5 วัน ผู้ป่วยเหล่านี้มีความเสี่ยงที่จะได้รับสารอาหารที่ไม่เพียงพอ จำเป็นต้องได้รับสารอาหารเพิ่มเติมจากทางอื่นๆ เช่น ทางสายจมูก หรือเส้นเลือด เป็นต้น จากนั้นต้องมีการติดตามผล (8) โดยประเมินอยู่ 3 ประเด็น ได้แก่
- ประสิทธิผลของการให้อาหาร (Efficacy) เช่น การเพิ่มหรือลดของน้ำหนักตัว การหายของแผล ปริมาณอาหารที่เหลือ การขับถ่าย
- การเผาผลาญของพลังงานและการนำไปใช้ (Metabolic state) เช่น ระดับกลูโคส สมดุลของไนโตรเจน
- ภาวะแทรกซ้อน (Complications) แบ่งออกเป็น
- Feeding เช่น ภาวะ over/underfeeding, refeeding syndrome, osmotic diarrhea
- Metabolism เช่น ภาวะน้ำตาลในเลือดสูง, การไม่สมดุลของเกลือแร่
- Infection เช่น phlebitis, catheter-related sepsis
สมดุลสารน้ำ (Renal and Fluid balance)
ในระหว่างการผ่าตัดร่างกายจะเกิดภาวะเครียดขึ้น ส่งผลให้เกิดการสร้าง Antidiuretic hormone (ADH) เพิ่มมากขึ้น นอกจากนี้ การผ่าตัดอาจจะมีช่วงที่ความดันโลหิตลดต่ำลง จะส่งผลไปยังร่างกายให้มีการหลั่งฮอร์โมน Aldosterone เพิ่มขึ้น ซึ่งการเพิ่มขึ้นฮอร์โมนทั้งสองตัวนี้ (ADH และ Aldosterone) จะทำให้ร่างกายเกิดภาวะคั่งของโซเดียมและน้ำ (Salt and water retention) และภาวะโพแทสเซียมต่ำตามมาได้ ดังนั้น อาจจะส่งผลให้ภาย หลังการผ่าตัดเกิดภาวะน้ำเกิน หรือภาวะลำไส้เคลื่อนไหวน้อยลงจากโพแทสเซียมต่ำได้ (6) นอกจากนี้ภาวะไม่สมดุลในเกลือแร่ที่พบได้บ่อยภายหลังการผ่าตัด ได้แก่ โซเดียมต่ำหรือสูง โพแทสเซียมต่ำหรือสูง ภาวะเลือดเป็นกรดและภาวะเลือดเป็นด่าง ดังนั้น ในผู้ป่วยหลังผ่าตัดที่คาดว่าจะมีความเสี่ยงต่อการเกิดภาวะไม่สมดุลของเกลือแร่ เช่น ควรที่จะต้องมีการเจาะติดตามดูระดับเกลือแร่หลังการผ่าตัด
ภาวะปัสสาวะออกน้อย หรือปัสสาวะไม่ออก (Oliguria or Anuria) เป็นภาวะที่พบได้บ่อยหลังการผ่าตัด ซึ่งอาจจะเกิดจากการเสียเลือดระหว่างผ่าตัด (Hypovolemia) หรืออาจจะเป็นอาการแสดงเริ่มต้นของการนำไปสู่ภาวะไตวายเฉียบพลัน (Acute kidney injury) ได้ โดยผู้ป่วยที่มีความเสี่ยงต่อการเกิดภาวะไตวายเฉียบพลัน เช่น มีโรคไตวายเรื้อรังเดิม, อายุมาก, หัวใจล้มเหลว, โรคความดันโลหิตสูง, โรคเบาหวาน, โรคเส้นเลือดแดงส่วนปลายอุดตัน, มีความดันโลหิตต่ำในระหว่างการผ่าตัด, การผ่าตัดฉุกเฉิน เป็นต้น แต่ในบางกรณีภาวะไตวายเฉียบพลัน อาจจะปัสสาวะออกปกติ แต่มีค่าไตที่สูงขึ้น เช่น ภาวะ Contrast-induced nephropathy เป็นต้น ซึ่งหากเกิดภาวะไตวายเฉียบพลันขึ้น เราควรจะต้องค้นหาสาเหตุ โดยสาเหตุสามารถแบ่งได้ ดังนี้ (ตารางที่ 2)

ตารางที่ 2 แสดงสาเหตุของการเกิดภาวะไตวายเฉียบพลัน
การติดเชื้อ (Infectious)
ไข้หลังผ่าตัดเป็นภาวะที่พบได้ ซึ่งหากพบว่ามีไข้ในช่วง 24 ชั่วโมงแรก หรือหลังผ่าตัดวันแรกมักจะเป็นไข้ที่เกิดจากกระบวนการอักเสบที่เกิดได้จากการผ่าตัด แต่หากไข้ดังกล่าวยังคงอยู่เกิน 48 ชั่วโมงหลังการผ่าตัด เราควรจะต้องค้นหาสาเหตุ เพื่อจะพิจารณาให้การรักษาได้อย่างเหมาะสม โดยสาเหตุแสดงดังตารางที่ 3 ซึ่งผู้ป่วยที่มีความเสี่ยงที่จะเกิดการติดเชื้อหลังการผ่าตัดได้ เช่น ผู้ป่วยที่ไม่ได้รับยาฆ่าเชื้อป้องกันก่อนการผ่าตัด, มีการปนเปื้อนของเนื้อเยื่อที่มีการอักเสบ หรือปนเปื้อนของอุจจาระภายในช่องท้อง, ผู้ป่วยที่มีภูมิคุ้มกันต่ำ, มีภาวะทุพโภชนาการ, หรือมีการติดเชื้อใดๆ ก็ตามก่อนการผ่าตัด เป็นต้น

ตารางที่ 3 แสดงสาเหตุของไข้หลังการผ่าตัดตามช่วงเวลา
ระบบเลือด (Hematology)
ในระหว่างการผ่าตัด ผู้ป่วยบางรายเสียเลือดไปในระหว่างการผ่าตัด แต่เกณฑ์ความเข้มข้นของเลือดสำหรับผู้ป่วยโดยทั่วไปอยู่ในช่วง 7-9 g/ml แต่ในกรณีผู้ป่วยติดเชื้อในกระแสเลือดรุนแรง ภาวะหัวใจขาดเลือดเฉียบพลัน หรือบาดเจ็บทางระบบประสาท เกณฑ์ความเข้มข้นของเลือดจะอยู่ในช่วง 8-10 g/ml (9)
ในกรณีของเกร็ดเลือด จะพิจารณาเติมก็ต่อเมื่อต่ำกว่า 50,000/mm3 และจะพิจารณาเติม FFP ในกรณีที่ aPTT มากกว่า 1.5 เท่าของค่าปกติ ภาวะแทรกซ้อนที่พบได้ในระหว่างการเติมเลือด เช่น Massive transfusion, Transfusion-associated circulatory overload (TACO), Transfusion-related acute lung injury (TRALI), Hemolytic transfusion reaction, Non-hemolytic febrile reaction, Transfusion related infection, Allergic reaction
ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำส่วนลึก (Deep vein thrombosis: DVT) และภาวะลิ่มเลือดอุดกั้นในปอด (Pulmonary embolism: PE) เป็นภาวะแทรกซ้อนที่สำคัญและสามารถพบได้ภายหลังจากการผ่าตัด ซึ่งเป็นภาวะที่สามารถป้องกันได้ โดยพบว่าร้อยละ 40 ของผู้ป่วยที่ผ่าตัดทางนรีเวชเสียชีวิตจากภาวะลิ่มเลือดอุดกั้นในปอด และสาเหตุที่พบบ่อยที่สุดของภาวะดังกล่าว ได้แก่ มะเร็งมดลูก และมะเร็งปากมดลูก ดังนั้น การที่เราสามารถรู้ความเสี่ยงหรือโอกาสที่ผู้ป่วยจะเกิดภาวะดังกล่าว จะช่วยทำให้เราวางแผนและเตรียมพร้อมสำหรับการป้องกัน รวมไปถึงให้การรักษาได้อย่างทันท่วงทีหากเกิดเหตุการณ์ขึ้น ซึ่งอดีตในปี ค.ศ.1858 ได้มีการประเมินผู้ป่วยแบบคร่าวๆ โดยอาศัย Virchow triad ซึ่งประกอบด้วย hypercoagulable state, venous stasis, และการมี vessel endothelial injury ต่อมาในปี ค.ศ.2005 ได้มีการพัฒนาเครื่องมือที่เข้ามาช่วยในการประเมินความเสี่ยงของผู้ป่วยต่อการเกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำส่วนลึก และภาวะลิ่มเลือดอุดกั้นในปอด ได้แก่ Caprini Risk score ซึ่งจะคำนวนจากปัจจัยเสี่ยงต่างๆ ของผู้ป่วย ประเมินออกมาเป็นคะแนน โดยคะแนนรวมดังกล่าวนั้น จะช่วยให้สามารถแบ่งระดับความเสี่ยงของผู้ป่วย รวมไปถึงแนวทางการจัดการที่เหมาะสมให้ (รูปที่ 7)

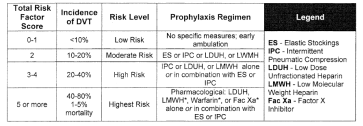
รูปที่ 7 แสดง Caprini Risk score สำหรับประเมินความเสี่ยงในการเกิดลิ่มเลือด (รูปซ้าย) และแนวทางการจัดการตามความเสี่ยงที่ประเมินได้ (รูปขวา)
การดูแลแผลหลังผ่าตัด (Wound care)
แผลผ่าตัดทางนรีเวชเป็นลักษณะ Clean-contaminated ซึ่งกระบวนการหายของแผลตามปกตินั้นขึ้นอยู่กับปริมาณออกซิเจนที่มายังบาดแผล, การปนเปื้อนของแบคทีเรีย, โภชนาการของผู้ป่วย และความตึงของขอบแผล โดยปัจจัยที่มีผลรบกวนการหายของแผล เช่น การติดเชื้อแบคทีเรีย, การมีสิ่งแปลกปลอมหรือเนื้อตาย, เลือดมายังบาดแผลไม่เพียงพอ, โรคเบาหวาน, โรคมะเร็ง, การสูบบุหรี่, ภาวะทุพโภชนาการ, และอุณหภูมิร่างกายต่ำ เป็นต้น ซึ่งภาวะแทรกซ้อนของแผลผ่าตัดที่พบได้บ่อย มีดังนี้
Wound infection / Surgical site infections (SSI) เป็นภาวะที่เกิดจากการปนเปื้อนของแผลจากเชื้อแบคทีเรีย โดยสามารถเป็นได้ตั้งแต่ชั้นผิวหนังลึกไปจนถึงอวัยวะภายใน (Cellulitis, Superficial/Deep abscess) หรืออาจจะกลายเป็น Necrotizing fasciitis ซึ่งมักจะพัฒนาอย่างรวดเร็วภายในไม่กี่ชั่วโมง
Wound dehiscence คือ การแยกของบาดแผลจากการสูญเสียหน้าที่ของชั้นผิวหนัง
Incisional hernia เป็นภาวะไส้เลื่อนที่พบบ่อยที่สุดของไส้เลื่อนที่เกิดกับผนังหน้าท้อง โดยเกิดจากการชั้นเนื้อเยื่อเกี่ยวพันบริเวณแผลผ่าตัดเชื่อมกันไม่สนิท ส่งผลให้ผนังหน้าท้องบริเวณนั้นไม่แข็งแรง ทำให้มีการยื่นของลำไส้ออกมาทางผนังหน้าท้องนั้น โดยเพิ่มความดันในช่องท้อง (เช่น การไอเรื้อรัง การมีน้ำในช่องท้อง การตั้งครรภ์ เป็นต้น) ก็เป็นหนึ่งในปัจจัยที่เพิ่มความเสี่ยงในการเกิดภาวะนี้
การดูแลอาการปวด (Pain management)
การระงับปวดภายหลังการผ่าตัดมีหลากหลายวิธี เช่น Spinal and epidural block, Opioid, NSAIDs, Paracetamol เป็นต้น ซึ่งแต่ละวิธีมีทั้งข้อดีข้อเสีย ดังนี้
- Spinal (Intrathecal) analgesia เป็นการให้ยาทางไขสันหลัง โดยจะสามารถควบคุมอาการปวดได้เป็นระยะเวลานาน โดยภาวะแทรกซ้อนที่พบได้ เช่น การติดเชื้อทางระบบประสาท, ปวดศีรษะ, กดการหายใจ, หรือทำให้เกิดภาวะความดันโลหิตต่ำ เป็นต้น ซึ่งวิธีนี้จะจำกัดให้ได้เพียง single shot เท่านั้น
- Epidural analgesia เป็นการให้ยาผ่านทางชั้นที่เหนือต่อดูรา โดยภาวะแทรกซ้อนที่พบจะคล้ายกันกับการทำ Spinal analgesia แต่สามารถให้ได้ในหลายรูปแบบ (Single, Intermittent, Continuous)
- Opioid เป็นยาแก้ปวดที่สามารถช่วยรักษาได้ทั้งอาการปวดเฉียบพลันและเรื้อรัง โดยยากลุ่มนี้จะมีทั้งแบบ Strong opioid เช่น Morphine, Pethidine, Fentanyl และ Weak opioid เช่น Tramadol, Codeine, Pentazocine โดยภาวะแทรกซ้อนที่พบได้บ่อยจากการใช้ยาในกลุ่มนี้ เช่น อาการคลื่นไส้อาเจียน, ท้องอืดหรือง่วงซึม แต่หากใช้ในปริมาณมากอาจเกิดภาวะ Opioid overdose โดยผู้ป่วยจะมาด้วยอาการซึม ไม่รู้สึกตัว หายใจช้า และตรวจร่างกายพบลักษณะของ Pin point pupils ซึ่งเราต้องให้การรักษาโดยเร่งด่วนโดยการให้ยา Anti-dote ซึ่งก็คือ Naloxone โดยให้ 1 amp (0.4 mg) ผสมกับ NSS 10 ml ฉีดให้ผู้ป่วย
- NSAIDs เป็นยาที่มีฤทธิ์ลดการอักเสบและอาการปวด โดยจะมีข้อดีที่ไม่กดการหายใจ ไม่ง่วงซึม ไม่มีคลื่นไส้อาเจียน ซึ่งทำให้ผู้ป่วยสามารถฟื้นตัวได้รวดเร็วมากขึ้น แต่ก้มีผลข้างเคียงที่ต้องเฝ้าระวัง เช่น มีผลต่อการทำงานของไต และเพิ่มความเสี่ยงในการเกิดเลือดออกในทางเดินอาหารรวมถึงบริเวณแผลผ่าตัด
โดยสรุปแล้ว การดูแลผู้ป่วยหลังการผ่าตัดใดๆ ก็ตาม รวมไปถึงการผ่าตัดทางนรีเวช ควรจะต้องมีการดูแลผู้ป่วยให้ครอบคลุมในทุกๆ ระบบ เพื่อป้องกันภาวะแทรกซ้อนหรืออันตรายที่อาจจะเกิดขึ้นตามมาได้
เอกสารอ้างอิง
- Nair A, Bharuka A, Rayani BK. The Reliability of Surgical Apgar Score in Predicting Immediate and Late Postoperative Morbidity and Mortality: A Narrative Review. Rambam Maimonides Med J. 2018;9(1): e0004. Published 2018 Jan 29. doi:10.5041/RMMJ.10316
- รศ.ดร.นพ.กวีศักดิ์ จิตตวัฒนรัตน์. เวชบำบัดวิกฤตศัลยศาสตร์ ในเวชปฏิบัติ. เชียงใหม่. ภาควิชาศัลยศาสตร์ คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่.2560
- Lichtenstein DA, Mezière GA, Lagoueyte JF, Biderman P, Goldstein I, Gepner A. A-lines and B-lines: lung ultrasound as a bedside tool for predicting pulmonary artery occlusion pressure in the critically ill. Chest. 2009 Oct;136(4):1014-1020. doi: 10.1378/chest.09-0001. PMID: 19809049.
- A. Miskovic, A. B. Lumb, Postoperative pulmonary complications, BJA: British Journal of Anaesthesia, Volume 118, Issue 3, March 2017, Pages 317–334, https://doi.org/10.1093/bja/aex002
- Cassidy MR, Rosenkranz P, McCabe K, Rosen JE, McAneny D. I COUGH: reducing postoperative pulmonary complications with a multidisciplinary patient care program. JAMA Surg. 2013 Aug;148(8):740-5. doi: 10.1001/jamasurg.2013.358. PMID: 23740240.
- Daniel L. Clarke-Pearson, et al. Chapter 25 Preoperative evaluation and postoperative management. In: Jonanthan S, Berek, editor. Berek & Novak’s Gynecology. Fifteenth edition. United States of America; 2012. p. 557-574.
- McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) JPEN J Parenter Enteral Nutr. 2016;40:159–211
- กวีศักดิ์ จิตตวัฒนรัตน์. Carbohydrate, lipid, protein need and used in critical care and surgical nutrition. ใน: พรพรหม เมืองแมน, ประยุทธ ศิริวงษ์, เพชร เกษตรสุวรรณ, ณัฐพล สันตระกูล, ธวัชชัย อัครวิพุธ, วรุตม์ โล่ห์สิริวัฒน์, บรรณาธิการ. ศัลยศาสตร์ทั่วไป 13 National surgical week current surgical practice in Thailand. กรุงเทพมหานคร: โฆษิตการพิมพ์ โดย สมาคมศัลยแพทย์ทั่วไปแห่งประเทศไทย; 2555: 367-401
- Retter A, Wyncoll D, Pearse R, Carson D, McKechnie S, Stanworth S, Allard S, Thomas D, Walsh T; British Committee for Standards in Haematology. Guidelines on the management of anaemia and red cell transfusion in adult critically ill patients. Br J Haematol. 2013 Feb;160(4):445-64. doi: 10.1111/bjh.12143. Epub 2012 Dec 27. PMID: 23278459.
Premenstrual syndrome and Premenstrual dysphoric disorder
Premenstrual syndrome and Premenstrual dysphoric disorder (กลุ่มอาการก่อนมีประจำเดือน)
พญ. ปาณิศา ฮันตระกูล
อาจารย์ แพทย์หญิง วรชร ลัทธิวงศกร
Premenstrual disorders หรือกลุ่มอาการก่อนมีประจำเดือน ส่งผลต่อผู้หญิงถึงประมาณ 12%1 ทำให้ต้องอาศัยแพทย์เฉพาะทางด้านนรีเวชกรรมและด้านจิตวิทยา สำหรับการวินิจฉัยแยกโรคต่างๆเหล่านี้ ไม่ว่าจะเป็น premenstrual syndrome (PMS) หรือ premenstrual dysphoric disorder (PMDD) โดยโรคในกลุ่มนี้ จะมีอาการทั้งทางด้านร่างกายและจิตใจ ทำให้ส่งผลต่อการใช้ชีวิตประจำวันและการทำงานต่างๆ ซึ่งอาการที่เกิดขึ้นนั้นจะอยู่ในช่วง luteal phase ของ menstrual cycle แต่จะหายไปได้อย่างรวดเร็วหลังจากที่ประจำเดือนมา การที่ผู้ป่วยสังเกตตัวเองและจดบันทึกอาการที่เกิดขึ้น จะเป็นส่วนช่วยสำคัญสำหรับการวินิจฉัยแยกโรคเหล่านี้ออกจาก psychiatric และ physical disorders ได้ แพทย์ควรพิจารณาให้การรักษาแบบเฉพาะบุคคล เพื่อที่จะได้สามารถช่วยพัฒนาปรับปรุงการใช้ชีวิตของผู้ป่วยให้ดีขึ้น
คำจำกัดความ (Definition)
Premenstrual syndrome (PMS) เป็นคำที่ใช้เรียกกลุ่มอาการที่ส่งผลต่อร่างกาย พฤติกรรม และอารมณ์จิตใจ โดยที่ไม่ได้มีปัญหาด้าน organic หรือมีโรคประจำตัวทางด้าน psychiatric disease มาก่อน โดยที่อาการเหล่านี้จะเกิดเฉพาะช่วง luteal phase ของแต่ละ menstrual cycle แล้วจะหายไปในช่วงที่มี menstruation ซึ่งตัวอย่างของอาการ PMS มีได้ทั้งทาง behavioral, psychologic และ physical symptoms ได้แก่
- Behavioral symptoms: เหนื่อยง่าย, นอนไม่หลับ, ความสนใจทางเพศเปลี่ยนไป, ความอยากอาหารเปลี่ยน
- Psychologic symptoms: กระสับกระส่าย, โกรธง่าย, ซึมเศร้า, ร้องไห้ง่าย, วิตกกังวล, เครียด, อารมณ์แปรปรวนง่าย, ไม่มีสมาธิ, สับสน, ลืมง่าย, ร้อนรน, รู้สึกโดดเดี่ยว, ความมั่นใจในตัวเองลดลง
- Physical symptoms: ปวดศีรษะ, เจ็บบริเวณเต้านม, ปวดหลัง, ท้องอืด, ปวดท้องมากขึ้น, น้ำหนักขึ้น, แขนขาบวม, บวมน้ำมากขึ้น, คลื่นไส้, ปวดตามกล้ามเนื้อและข้อต่างๆ
สาเหตุและความชุกของโรค (Etiology and Prevalence)
ในปัจจุบัน ความเข้าใจเกี่ยวกับสาเหตุของการเกิดโรคกลุ่มนี้ยังไม่ชัดเจน แต่จากการศึกษาหลายฉบับที่ผ่านมากล่าวไว้ว่า การที่ระดับของ estrogen และ progesterone เปลี่ยนแปลงไปในแต่ละช่วงของรอบเดือน จะไปกระตุ้นทำให้เกิดอาการต่างๆ2-4 ในกลุ่มผู้หญิงที่อยู่ในวัยหมดประจำเดือน แต่เคยถูกวินิจฉัยว่าเป็น PMS มาก่อน เมื่อได้รับการรักษาด้วย cyclical progestogen แล้วจะมีอาการทางร่างกายและจิตใจกำเริบขึ้นมาได้2 นอกจากนั้นการยับยั้ง estrogen ด้วยการใช้ gonadotropin-releasing hormone analogues (GnRH analogues) ทำให้อาการของ PMS ลดลงได้อย่างมีนัยสำคัญ3 สำหรับการเปลี่ยนแปลงทางด้านอารมณ์นั้น อาจเกิดจากการที่ estrogen และ progesterone ไปมีผลต่อระดับของ serotonin, γ-aminobutyric acid (GABA) และ dopamine รวมทั้งยังไปมีผลต่อ renin-angiotensin-aldosterone system ที่ทำให้สามารถอธิบายอาการท้องอืดและบวมได้ในระหว่าง luteal phase4 แต่อย่างไรก็ตาม ระดับของฮอร์โมนเพศอย่างเดียว ก็ไม่สามารถอธิบายถึงสาเหตุของการเกิด premenstrual disorders ได้ทั้งหมด เพราะจากบางการศึกษา ผู้หญิงที่ถูกวินิจฉัยอยู่ในกลุ่มโรคนี้ ก็ไม่ได้มีระดับ estrogen หรือ progesterone สูงกว่าประชากรกลุ่มปกติ
สำหรับความชุกของโรคกลุ่มนี้ ผู้หญิง 4 ใน 10 คน (40%) เคยมีอาการของ PMS และ 5-8% มีอาการจนทั้งขั้นรุนแรง โดยความชุกของโรคจะลดลงในผู้หญิงที่ทานยาคุมกำเนิด น้ำหนักตัวปกติ และออกกำลังกายอย่างสม่ำเสมอ
การวินิจฉัย (Diagnosis)
สำหรับการวินิจฉัยภาวะ premenstrual syndrome จะต้องอาศัยความร่วมมือจากตัวผู้ป่วยในการจดบันทึกอาการต่างๆที่เกิดขึ้น ในปัจจุบัน นิยมใช้เป็น Daily Record of Severity of Problems (DRSP)5 ดังรูปภาพที่ 1 ซึ่งมี positive predictive value 63.4% และมี negative predictive value 90%6 โดยการบันทึกจะเป็นแบบ prospective เนื่องจากถ้าบันทึกอาการแบบ retrospective recall จะทำให้ความน่าเชื่อถือของข้อมูลน้อยลง ซึ่งการบันทึกอาการต่างๆลงในแบบบันทึกข้อมูลนั้นควรทำอย่างน้อย 2 cycles ติดต่อกัน แต่อย่างไรก็ตาม การใช้ diary บันทึกอาการนั้นอาจทำให้สับสนและไม่สามารถสรุปผลได้ จึงมีการแนะนำสำหรับการใช้ GnRH analogues ยับยั้ง cyclic ovarian function เพื่อที่จะสามารถแยกว่าอาการที่เกิดขึ้นนั้นเป็น PMS จริงหรือไม่ โดยแนะนำให้ใช้เป็นระยะเวลา 3 เดือนเพื่อที่จะได้วินิจฉัยกลุ่มอาการ PMS ได้อย่างชัดเจน
รูปภาพที่ 1: Daily Record of Severity of Problems (DRSP)5
RCOG ได้มีการแบ่ง PMS ออกเป็นหลายประเภท7 ตามช่วงที่มีอาการ ช่วงที่ไม่มีอาการ และการส่งผลต่อการใช้ชีวิตประจำวัน ดังแผนภูมิที่ 1
แผนภูมิที่ 1: Classification of PMS7
นอกจากนั้น ถ้ามีอาการทาง PMS แบบรุนแรงมาก อาจวินิจฉัยได้เป็น premenstrual dysphoric disorder (PMDD) ซึ่งมีเกณฑ์สำหรับการวินิจฉัย โดยอ้างอิงตาม Diagnostic and Statistical Mental disorder fifth edition (DSM-V) ของ American Psychiatric Association8 ดังต่อไปนี้
A. In the majority of menstrual cycles, at least five symptoms must be present in the final week before the onset of menses, start to improve within a few days after the onset of menses, and become minimal or absent in the week postmenses.
B. One (or more) of the following symptoms must be present:
- Marked affective lability (e.g., mood swings; feeling suddenly sad or tearful, or increased sensitivity to rejection).
- Marked irritability or anger or increased interpersonal conflicts.
- Marked depressed mood, feelings of hopelessness, or self-deprecating thoughts.
- Marked anxiety, tension, and/or feelings of being keyed up or on edge.
C. One (or more) of the following symptoms must additionally be present, to reach a total of five symptoms when combined with symptoms from Criterion B above.
- Decreased interest in usual activities (e.g., work, school, friends, hobbies).
- Subjective difficulty in concentration.
- Lethargy, easy fatigability, or marked lack of energy.
- Marked change in appetite; overeating; or specific food cravings.
- Hypersomnia or insomnia.
- A sense of being overwhelmed or out of control.
- Physical symptoms such as breast tenderness or swelling, joint or muscle pain, a sensation of “bloating,” or weight gain.
NOTE: The symptoms in Criteria A–C must have been met for most menstrual cycles that occurred in the preceding year.
D. The symptoms are associated with clinically significant distress or interference with work, school, usual social activities, or relationships with others (e.g., avoidance of social activities; decreased productivity and efficiency at work, school, or home).
E. The disturbance is not merely an exacerbation of the symptoms of another disorder, such as major depressive disorder, panic disorder, persistent depressive disorder (dysthymia), or a personality disorder (although it may co-occur with any of these disorders).
F. Criterion A should be confirmed by prospective daily ratings during at least two symptomatic cycles. (NOTE: The diagnosis may be made provisionally before this confirmation.)
G. The symptoms are not attributable to the physiologic effects of a substance (e.g., a drug of abuse, a medication, other treatment) or another medical condition (e.g., hyperthyroidism).
PMS versus PMDD
ผู้ป่วยสามารถมีอาการและอาการแสดงได้ในหลากหลายรูปแบบ โดยก่อนที่จะวินิจฉัยว่าผู้ป่วยจัดอยู่ในกลุ่ม premenstrual disorders แพทย์จำเป็นจะต้องมองหาโรคทางกายอย่างอื่นเพิ่มเติมด้วย ไม่ว่าจะเป็น thyroid disorders, anemia, perimenopausal symptoms และกลุ่มโรคทางจิตเวชต่างๆ เช่น major psychiatric disorder, major depressive disorder, minor depressive disorder หรือ dysthymic disorder เป็นต้น
ปัจจัยที่สำคัญต่อการวินิจฉัย PMS ก็คือ การที่มีอาการทางกายและทางอารมณ์ เกิดขึ้นทั้งสองอย่างพร้อมกัน โดยต้องไม่มีโรคทางจิตเวชอื่นร่วมด้วย แต่สำหรับการวินิจฉัย PMDD นั้น อาจไม่พบอาการทางกายก็ได้ ร่วมกับอาจทำให้โรคจิตเวชที่เป็นอยู่เดิมนั้นมีอาการเพิ่มมากขึ้นได้ โดยมีแนวทางการวินิจฉัยแยกโรคดังแผนภูมิที่ 2
แผนภูมิที่ 2: แนวทางการวินิจฉัยแยกภาวะ premenstrual symptoms, PMS และ PMDD9
การรักษา (Management)
การรักษา PMS และ PMDD นั้นจะมุ่งเน้นเพื่อลดอาการทางร่างกายและอารมณ์ที่มีการเปลี่ยนแปลงไป สำหรับการใช้ยาเพื่อรักษา จุดมุ่งหมายเพื่อปรับฮอร์โมนในร่างกาย โดยยับยั้งการตกไข่ แล้วยังมีกลุ่มยารักษาที่มีผลต่อระดับของสารสื่อประสาท (neurotransmitters) ในร่างกาย เช่น serotonin, norepinephrine หรือ dopamine เป็นต้น นอกจากนั้นยังมีการรักษาแบบแพทย์ทางเลือก (Complementary therapies) อีกหลากหลายวิธี ดังนั้นแพทย์ผู้ทำการรักษาจะต้องเลือกวิธีรักษาสำหรับผู้ป่วยแต่ละบุคคลไป เพื่อให้ได้ผลการรักษาที่เหมาะกับผู้ป่วยและมีประสิทธิภาพมากที่สุด
Complementary therapies
ถึงแม้ว่าการศึกษาเกี่ยวกับแพทย์ทางเลือกในการรักษากลุ่มอาการ PMS ยังมีอยู่อย่างจำกัด แต่ผู้หญิงที่มีอาการ PMS ที่ได้รับการ holistic approach นั้นมีประโยชน์อยู่บ้าง มักจะใช้วิธีการรักษานี้ในกลุ่มผู้หญิงที่มีข้อห้ามสำหรับการใช้ hormonal therapy แต่อย่างไรก็ตาม ควรมีความระมัดระวังในการใช้วิธีนี้ด้วย ตัวอย่างของวิธีการรักษาแบบแพทย์ทางเลือก ประโยชน์ รวมทั้งลักษณะการศึกษาที่ผ่านมา ปรากฎดังตารางที่ 1
Vitamin B610
Vitamin B6 มักถูกใช้รักษาอาการ PMS โดยที่ยังไม่ได้หลักฐานแน่ชัดเกี่ยวกับประโยชน์ของยา จากคำแนะนำของ Department of Health และ Medicine Control Agency ได้จำกัดปริมาณการให้ โดยสามารถให้ได้เพียง 10 mg/day
Magnesium10
มีการศึกษาเพียงไม่กี่ฉบับเท่านั้นที่พูดถึงการใช้ magnesium ใน PMS โดยบอกไว้ว่า การได้รับ magnesium อย่างเป็นประจำ อาจมีประโยชน์ต่อการรักษา PMS ได้ แต่อย่างไรก็ตาม ต้องมีการศึกษาเพิ่มเติมต่อไป
Calcium/vitamin D10
จากบางการศึกษาที่ผ่านมา บอกไว้ว่า ระดับของ calcium และ vitamin D จะต่ำลงในกลุ่มผู้หญิงที่มีอาการ PMS ดังนั้นการได้รับ calcium อาจช่วยลดอาการได้บ้าง นอกจากนั้นการที่ได้รับ total vitamin D สูง (median; 706 IU/d) จะมี relative risk 0.59 (95%CI; 0.40-0.86) เมื่อเทียบกับได้รับในปริมาณที่น้อยกว่า (median; 112 IU/d) [p-value = 0.01] นอกจากนั้นการได้รับ skimmed/low-fat milk ก็สัมพันธ์กับความเสี่ยงในการเกิด PMS ที่ลดลงด้วย (p-value <0.001) ดังนั้นการได้รับทั้ง calcium/vitamin D อาจมีผลช่วยลดการเกิด PMS และลดความเสี่ยงในการเกิด osteoporosis และมะเร็งบางชนิดในอนาคตอีกด้วย แต่ก็ยังต้องมีการศึกษาถึงประโยชน์ที่ชัดเจนต่อไป
Isoflavones10
มีการศึกษาผลของการใช้ isoflavones คือ ผู้หญิงที่มีอาการ menstrual migraine เมื่อได้รับ Soy isoflavones, Dong Quai และ Black Cohosh extracts จะมีอาการที่ดีขึ้นเมื่อเทียบกับกลุ่มที่ได้รับ placebo นอกจากนั้นการได้รับ Red Clover isoflavones ช่วยให้ผู้หญิงที่มีอาการ severe PMS ดีขึ้น แต่อย่างไรก็ตาม เมื่อเทียบกับกลุ่มที่ได้ placebo แล้ว ไม่ได้มีความแตกต่างของผลอย่างมีนัยสำคัญ อาจจำเป็นต้องมีการศึกษาในกลุ่มประชากรขนาดใหญ่กว่าเดิม
Agnus castus10
Vitex agnus castus L. หรือที่รู้จักกันคือ chasteberry ซึ่งประกอบไปด้วยสาร iridoids และ flavonoids โดยไปมีผลต่อการควบคุม stress-induced prolactin secretion ผ่านทาง dopamine โดยที่ไม่ได้ไปมีผลโดยตรงต่อ LH หรือ FSH ซึ่ง agnus castus นี้จัดเป็นวิธีการรักษาแบบแพทย์ทางเลือกที่มีงานวิจัยรองรับว่าดีที่สุดสำหรับ PMS แต่ก็ยังขาด standardized quality controlled preparation โดยจะต้องมีการศึกษาเพิ่มเติมต่อไป
St John’s Wort 7, 10
St John’s Wort หรือ Hypericum perforatum เป็นสมุนไพรชนิดหนึ่ง มีผลช่วยลดอาการซึมเศร้าได้ แต่อย่างไรก็ตาม ยังไม่มีการศึกษาทาง clinical ที่ชัดเจนสำหรับผลของการรักษาอาการ PMS แต่คาดว่าจะช่วยลดอาการ physical และ behavioral symptoms ได้ โดยไม่ได้ช่วยลดอาการด้านอารมณ์หรือความเจ็บปวดใดๆ11 นอกจากนั้นที่สำคัญ St John’s Wort ยังไปมีผลกระทบต่อยาตัวอื่นๆ เช่น ไม่ควรใช้ร่วมกับยาในกลุ่ม SSRIs (Selective serotonin reuptake inhibitors) และสมุนไพรชนิดนี้ยังส่งผลไปลดประสิทธิภาพของยาคุมกำเนิดด้วย
Evening primrose oil 7, 10
Evening primrose oil ประกอบไปด้วย γ-linoleic acid ปริมาณมาก ซึ่งถูกใช้เพื่อรักษาอาการ severe PMS มีการศึกษาแบบ meta-analysis บ่งชี้ว่าการใช้ evening primrose oil ไม่มีประสิทธิภาพเพียงพอในการรักษา severe PMS แต่ช่วยเพียงลดอาการเจ็บเต้านมได้เท่านั้น
|
Complementary therapy |
Benefit |
Type of studies |
Numbers in the study |
Note |
|
Exercise |
Some benefit |
Nonrandomised and randomized |
72 (4 published studies) |
High quality studies recommended. |
|
Reflexology |
Some benefit |
Randomised |
35 |
|
|
Vitamin B6 |
Mixed results |
Double-blind Randomised Cross-over |
1067 (13 published studies) |
Peripheral neuropathy with high doses (most studies performed using higher doses). Department of Health restricts the daily dose to 10 mg. |
|
Magnesium |
Mixed results |
Double-blind Randomised Cross-over |
153 (3 published studies) |
Used in premenstrual phase. |
|
Multivitamins |
Unknown |
– |
400 (several published studies) |
Unclear which are the active ingredients. |
|
Calcium/vitamin D |
Yes |
Double-blind Randomised Cross-over |
499 (2 published studies) |
|
|
Isoflavones |
Mixed results |
Double-blind Randomised Cross-over |
72 (2 published studies) |
May benefit menstrual migraine. |
|
Vitex agnus castus L. |
Yes |
Double-blind Randomised |
923 (7 published studies) |
There is no standardized preparation. |
|
St John’s Wort |
Mixed results |
Double-blind Placebo-controlled |
401 (4 published studies) |
May benefit physical and behavioral symptoms. Many withdrew from one study due to adverse effects. Significant interactions with conventional medicines. The British National Formulary advises avoid concomitant use with SSRIs. |
|
Ginkgo biloba |
Some benefit |
Double-blind Placebo-controlled |
233 (2 published studies) |
|
|
Saffron |
Yes |
Double-blind Placebo-controlled |
47 |
Further data before recommendation. |
|
Evening primrose oil |
Some benefit |
Double-blind Placebo-controlled Cross-over |
215 (4 published studies) |
May benefit women with cyclical breast symptoms. |
|
Acupuncture |
Some benefit |
Case-control |
235 (10 published studies) |
High risk of bias. Further data before recommendation. |
|
Lemon balm |
Some benefit |
Double-blind Placebo-controlled |
100 (1 published study) |
PMS severity quantified by PSST. Further data before recommendation. |
|
Curcumin |
Some benefit |
Double-blind Placebo-controlled |
70 (1 published study) |
PMS severity quantified by an unvalidated symptom score. Further data before recommendation. |
|
Wheat germ |
Some benefit |
Triple-blind Placebo-controlled |
84 (1 published study) |
PMS severity quantified by an unvalidated symptom score. Further data before recommendation. |
ตารางที่ 1: Complementary therapies7 (ดัดแปลงจาก Management of Premenstrual Syndrome. BJOG: An International Journal of Obstetrics & Gynaecology. 2017;124(3):e73-e105.)
นอกจากนี้ Cognitive behavioral therapy (CBT)7, 10 เป็นการทำจิตบำบัดประเภทหนึ่ง มีการศึกษาถึงผลของการใช้ fluoxetine (20 mg daily) และการทำ CBT และ combined therapy (fluoxetine ร่วมกับ CBT) ในผู้ป่วย PMDD ปรากฎว่า อาการต่างๆของผู้ป่วยดีขึ้นทั้ง 3 กลุ่มหลังจากได้รับการรักษามา 6 เดือน โดยกลุ่มที่ใช้ fluoxetine อย่างเดียว สัมพันธ์กับการลดของอาการต่างๆได้รวดเร็วกว่า แต่เมื่อติดตามการรักษาไป การทำ CBT สัมพันธ์กับอาการที่ดีขึ้นอย่างคงที่มากกว่าการใช้ fluoxetine12 ดังนั้นแพทย์จึงควรพิจารณาการทำ CBT ในผู้ป่วย severe PMS ทุกราย
Medical treatment
กลุ่มยาสองประเภทที่มีหลักฐานชัดเจนว่ามีประสิทธิภาพในการรักษากลุ่มผู้หญิงที่มีอาการ moderate-to-severe PMS ได้แก่ กลุ่มยาที่ไปยับยั้งการตกไข่ และกลุ่มยา SSRIs (Selective serotonin reuptake inhibitors)
Combined oral contraceptive pill (COC)7, 10
จาก randomized prospective trials ในช่วงแรก combined pill ไม่ได้มีประโยชน์ในการรักษา PMS โดยอาจเกิดจากมีส่วนประกอบของ pill-free week และมี daily progestogen (second-generation pills; levonorgestrel) ที่ทำให้เกิด PMS-type symptoms ได้ แต่ในปัจจุบัน มีการคิดค้น new combined contraceptive pill นั่นก็คือ Yasmin ที่ประกอบไปด้วย anti-mineralocorticoid, anti-androgenic progestogen และ drospirenone ทำให้สามารถรักษากลุ่มอาการ severe PMS ได้ เพราะว่ามีการลดลงของผลข้างเคียงจาก progestogen และมีฤทธิ์ mild diuretic และ anti-androgenic effect นอกจากนี้ยังมีการพัฒนาจาก Yasmin (30 mg ethinylestradiol/3 mg dropirenone โดยเป็นแบบ 21/7 regimen) มาเป็น Yaz® (20 mg ethinylestradiol/3 mg dropirenone โดยเป็นแบบ 24/4 regimen) การที่ลด hormone free interval มาเป็น 4 วันจะช่วยลดความเสี่ยงในการเกิด cycle-related symptoms ได้ แล้วมีการศึกษาอีกว่า การใช้ Yaz® นั้นมีประสิทธิภาพมากกว่า placebo เมื่อใช้รักษากลุ่ม PMDD ด้วย13, 14 ซึ่งการใช้ยาแบบต่อเนื่องได้ผลมากกว่าการใช้ยาเป็นรอบ cycle โดยได้ผลทั้งการจัดการกับอารมณ์ อาการปวดศีรษะ และปวดบริเวณเชิงกราน
Transdermal estradiol7, 10
มีงานศึกษา Placebo-controlled trials กล่าวไว้ว่าการใช้ implanted และ transdermal patch (17ß-estradiol) ร่วมกับ cyclical progestogen มีประสิทธิภาพสำหรับการรักษาอาการ physical และ psychological ในผู้ป่วยกลุ่ม severe PMS แล้วยังมีการศึกษาว่าการใช้ 100 mcg patch มีผลเหนือกว่า placebo15 ซึ่งการใช้เป็นแบบ 100 mcg estradiol patches 2 ครั้งต่อสัปดาห์ ได้ผลในการลดอาการต่างๆได้ดี รวมไปถึงผลข้างเคียงที่น้อยกว่าการใช้เป็นแบบ 200 mcg patch 2 ครั้งต่อสัปดาห์ แต่อย่างไรก็ตาม ข้อมูลสำหรับการใช้ในระยะยาวยังจำกัด รวมทั้งผลต่อ endometrium และ breast ด้วย
Progestogen intolerance7, 10
สำหรับการใช้ continuous estradiol นั้นจำเป็นต้องเพิ่ม cyclical progestogen (10-12 วัน/cycle) เข้าไปด้วย เพื่อป้องกันการเกิด endometrial hyperplasia ในผู้หญิงที่ยังมีมดลูกอยู่ โดยการใช้ progestogen-releasing system (LNG-IUS 52 mg; Mirena) จะมีประสิทธิภาพสูงในการลดอาการ PMS-like adverse effects นอกจากนี้ยังมีการใช้ micronized oral progesterone (100 หรือ 200 mg) มีผลทางด้าน androgenic น้อย แล้วยังมีผลข้างเคียงที่ไม่ต้องการ น้อยกว่ากลุ่ม progestogens พวก norethisterone และ levonorgestrel โดยที่ progesterone สามารถเป็น diuretic แลพ CNS anxiolytic จึงอาจไปช่วยลดอาการของ PMS ได้ด้วย
การใช้ cyclical progestogen ในปริมาณที่ต่ำ และระยะเวลาที่สั้น จะช่วยลดผลข้างเคียงต่างๆที่ไม่ต้องการได้ (micronized progesterone 100 mg หรือ norethisterone 2.5 mg) ควรใช้ในวันที่ 17-28 ของแต่ละรอบเดือน
Danazol7, 10
Danazol เป็น androgenic steroid มีผลในการยับยั้งการตกไข่ ซึ่งการใช้ danazol 200 mg วันละ 2 ครั้ง มีผลเหนือกว่าการใช้ placebo ในเรื่องของการลดอาการ severe PMS ได้16 แต่อย่างไรก็ตาม ผลข้างเคียงของยาชนิดนี้ก็มีหลายอย่างด้วยกัน เช่น สิว น้ำหนักเพิ่มขึ้น ขนดก เสียงแหบ (masculinizing side-effects) เป็นต้น นอกจากนั้นยังมีการศึกษาหนึ่งบอกไว้ว่า การรักษาด้วย danazol ในช่วง luteal phase นั้นจะช่วยลดอาการทางเต้านมเท่านั้น โดยไม่ได้มีผลไปลดอาการด้านอื่นๆ17
นอกจากนี้ การใช้ danazol ในช่วงตั้งครรภ์ ทำให้เกิด cliteromegaly, labial fusion และ urogenital sinus abnormalities ในทารกเพศหญิง ทำให้ผู้หญิงที่รักษาด้วยยาชนิดนี้ จะต้องมีการคุมกำเนิดที่ดีด้วย
Gonadotropin-releasing hormone (GnRH) analogues7, 10
GnRH analogues มีผลในการยับยั้งการสร้าง ovarian steroid โดยทั่วไปแล้ว ไม่นิยมใช้ยากลุ่มนี้ในการรักษา PMS เนื่องจากผลข้างเคียงและราคาที่สูงของยา ซึ่งอาจพิจารณาใช้ในรายที่มีอาการแบบ most severe symptoms เท่านั้น ยาชนิดนี้จะไปมีผลลดอาการทางร่างกายมากกว่าพฤติกรรมหรืออารมณ์ที่เปลี่ยนแปลงไป ผลข้างเคียงของยาชนิดนี้ อาจรักษาโดยการใช้ hormone replacement therapy ร่วมด้วย เพื่อลด hypoestrogenic state และคงระดับของ bone mineral density (BMD) เอาไว้ ซึ่งแนะนำเป็น continuous combined therapy หรือใช้เป็น Tibolone แต่อย่างไรก็ตาม การรักษาผู้ป่วย PMS ด้วยการใช้ GnRH analogues ควรใช้ระยะเวลาเพียง 6 เดือนเท่านั้น (ถ้าใช้เพียงตัวเดียว) ในผู้ป่วยที่ต้องใช้แบบ long-term ควรตรวจ BMD ประจำปีด้วย (ตรวจโดย dual energy X-ray absorptiometry; DEXA) โดยถ้า BMD ลดลง ก็เป็นข้อบ่งชี้สำหรับหยุดการรักษาด้วย GnRH analogues
Progesterone and Progestogens7, 10
Meta-analysis สำหรับการศึกษาผลของ progestogen และ progesterone ที่มีต่อการรักษาอาการ PMS พบว่า ยากลุ่มนี้ไม่มีประสิทธิภาพพอที่จะใช้รักษา PMS ได้18 แล้วก็ไม่มีหลักฐานสนับสนุนว่าการใช้ LNG-IUS 52 mg เพียงอย่างเดียว จะช่วยลดอาการของ PMS ซึ่งการใช้ตัวนี้ อาจไปเพิ่มระยะเวลาในการเป็น PMS ในแต่ละรอบเดือนด้วย
Selective serotonin reuptake inhibitors (SSRIs)7, 10
เนื่องจากมีหลักฐานมากขึ้นว่า serotonin นั้นเกี่ยวข้องกับการเกิดอาการ PMS โดยในผู้หญิงที่มีอาการของ PMS จะมีระดับของ serotonin ต่ำกว่ากลุ่มประชากรทั่วไป19 แต่ว่ากลไกของยาที่มีต่อการลดอาการนั้น ยังเป็นที่ถกเถียงกันอยู่ แต่อย่างไรก็ตาม ทั้ง estrogen และ progesterone มีความสามารถในการควบคุมปริมาณของ serotonin receptors
Cochrane review ศึกษาแล้วว่าการใช้ SSRIs ไม่ว่าจะเป็น fluoxetine, paroxetine, sertraline, escitalopram และ citalopram ในปริมาณ moderate dose ช่วยทำให้อาการของ PMS ดีขึ้นเมื่อเทียบกับ placebo (SMD -0.65, 95%CI -0.46 to -0.84)20 โดยเมื่อเปรียบเทียบระหว่างการใช้เป็นแบบต่อเนื่อง และการใช้เฉพาะช่วง luteal phase พบว่าไม่มีความแตกต่างกันอย่างมีนัยสำคัญ20 ยากลุ่มนี้สามารถลดได้ทั้งอาการทาง physical และ psychological symptoms นอกจากนี้ยังมีหลักฐานที่สนับสนุนการใช้ serotonin-noradrenaline reuptake inhibitors (SNRIs) ในการรักษาผู้ป่วยกลุ่ม PMDD ด้วย21
เมื่ออาการของผู้ป่วยดีขึ้นแล้ว ต้องการหยุดการใช้ SSRIs จะต้องค่อยๆลดปริมาณของยาลง เพื่อหลีกเลี่ยงอาการ withdrawal symptoms ไม่ว่าจะเป็น gastrointestinal disturbances, ปวดศีรษะ, วิตกกังวล, มีนงงสับสน, sleep disturbances, เหนื่อยง่าย, influenza-like symptoms และเหงื่อแตก
ยาในกลุ่ม SSRIs ที่ออกมาใหม่ เช่น citalopram พบว่าช่วยลดอาการ PMS ได้ดีกว่า SSRIs ตัวอื่นๆ โดยแนะนำเป็น citalopram หรือ escitalopram 20 mg/day เริ่มในวันที่ 15-28 ของแต่ละรอบเดือน10
มีการศึกษาเกี่ยวกับยากลุ่มนี้ (SSRIs, SNRIs) ต่อความเสี่ยงในการเกิด birth defects ต่างๆ มีรายงานว่าพบความผิดปกติในหลายรูปแบบ ได้แก่ cardiovascular birth defects และ major congenital defects ต่างๆ (เช่น anal atresia, cystic kidneys, clubfoot, gastroschisis, hypospadias, limb reduction และ omphalocele) ทำให้ผู้หญิงที่รักษาด้วยยาชนิดนี้ จะต้องมีการคุมกำเนิดที่ดีด้วย ถ้าประจำเดือนเริ่มขาดไป ก็ควรหยุดยาในกลุ่มนี้
Spironolactone7
เนื่องจาก spironolactone จัดเป็นกลุ่มยา potassium-sparing diuretic โดยมีสูตรโครงสร้างโมเลกุลคล้ายคลึงกับ steroid hormone มีการศึกษาแล้วว่า ช่วยทำให้อาการทาง physical และ mood ดีขึ้นในผู้ป่วย PMS22, 23
Surgical treatment
Hysterectomy7, 10
การตัดมดลูกและรังไข่ทั้งสองข้าง (Hysterectomy and bilateral oophorectomy) เป็นรูปแบบการรักษาเพื่อยับยั้งการตกไข่อย่างถาวร โดยการตัดทั้งหมดออกไป ทำให้ยุติ ovarian cycle นอกจากนั้นหากตัดมดลูกออกไปด้วย ทำให้สามารถใช้ estrogen replacement ได้โดยไม่ต้องใช้ progestogen ร่วมด้วย สำหรับวิธีรักษาแบบนี้ ควรพิจารณาเฉพาะผู้ป่วยที่เป็น severe PMS ที่ล้มเหลวจากการรักษาด้วยยา แล้วต้องรักษาด้วย long-term GnRH analogues
ก่อนที่จะรักษาผู้ป่วย PMS ด้วยการผ่าตัด ผู้ป่วยควรได้รับ preoperative GnRH analogues เพื่อทำนายแนวโน้มผลของการทำ oophorectomy ในอนาคต โดยเฉพาะอย่างยิ่งในผู้ป่วยที่จะได้รับการผ่าตัดนั้น อายุน้อยกว่า 45 ปีแล้วไม่ได้มีข้อบ่งชี้อื่นๆในการตัดมดลูกหรือรังไข่ทั้งสองข้างออก24
ในผู้ป่วยที่อายุน้อยกว่า 45 ปีที่ได้รับ surgical treatment ควรได้รับ hormone replacement therapy โดยถ้าตัดเฉพาะรังไข่ทั้งสองข้างออก (ไม่ได้ตัดมดลูก) จำเป็นต้องได้รับทั้ง HRT และ progestogen ร่วมด้วย แต่ก็จะมีความเสี่ยงในการเกิด PMS-like symptoms ได้เนื่องจาก progestogen จะไปกระตุ้นทำให้เกิดอาการต่างๆได้
สรุป Premenstrual syndrome and Premenstrual dysphoric disorder หรือกลุ่มอาการก่อนมีประจำเดือน เป็นกลุ่มอาการที่แสดงออกทั้งทางด้านร่างกายและจิตใจ ส่งผลต่อการใช้ชีวิตประจำวันและการทำงาน อาการที่เกิดขึ้นจะอยู่ในช่วง luteal phase และหายไปได้อย่างรวดเร็วหลังจากที่ประจำเดือนมา โดยการรักษาก็มีทั้งการใช้แพทย์ทางเลือก การใช้ยาในกลุ่มต่างๆ ไม่ว่าจะเป็น hormonal therapy หรือการใช้ยาในกลุ่ม SSRIs/SNRIs แล้วก็มีการรักษาในรูปแบบการผ่าตัด ซึ่งแนวทางในการรักษาเป็นไปดังแผนภูมิที่ 3 ตามคำแนะนำของ The National Association for Premenstrual Syndrome (NAPS) การดูแลรักษาผู้ป่วยในกลุ่มนี้อาจต้องอาศัยความร่วมมือจากทั้งตัวผู้ป่วยเอง แพทย์เฉพาะทางด้านนรีเวชกรรมและด้านจิตวิทยา เพื่อให้การรักษาเหมาะกับตัวผู้ป่วยและมีประสิทธิภาพมากที่สุด
แผนภูมิที่ 3: แนวทางการรักษา PMS10
เอกสารอ้างอิง
- Hofmeister S, Bodden S. Premenstrual Syndrome and Premenstrual Dysphoric Disorder. Am Fam Physician. 2016;94(3):236-40.
- Hammarbäck S, Bäckström T, Holst J, von Schoultz B, Lyrenäs S. Cyclical mood changes as in the premenstrual tension syndrome during sequential estrogen-progestagen postmenopausal replacement therapy. Acta Obstet Gynecol Scand. 1985;64(5):393-7.
- Kumar P, Sharma A. Gonadotropin-releasing hormone analogs: Understanding advantages and limitations. J Hum Reprod Sci. 2014;7(3):170-4.
- Halbreich U. The etiology, biology, and evolving pathology of premenstrual syndromes. Psychoneuroendocrinology. 2003;28 Suppl 3:55-99.
- Endicott J, Nee J, Harrison W. Daily Record of Severity of Problems (DRSP): reliability and validity. Arch Womens Ment Health. 2006;9(1):41-9.
- Borenstein JE, Dean BB, Yonkers KA, Endicott J. Using the daily record of severity of problems as a screening instrument for premenstrual syndrome. Obstet Gynecol. 2007;109(5):1068-75.
- Management of Premenstrual Syndrome. BJOG: An International Journal of Obstetrics & Gynaecology. 2017;124(3):e73-e105.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. Washington, DC: American Psychiatric Association; 2013.
- Dickerson LM, Mazyck PJ, Hunter MH. Premenstrual syndrome. Am Fam Physician. 2003;67(8):1743-52.
- (NAPS) TNAfPS. NAPS Guidelines on Premenstrual Syndrome 2018 [cited 2020 SEP 26]. Available from: https://www.pms.org.uk/app/uploads/2018/06/guidelinesfinal60210.pdf.
- Canning S, Waterman M, Orsi N, Ayres J, Simpson N, Dye L. The efficacy of Hypericum perforatum (St John’s wort) for the treatment of premenstrual syndrome: a randomized, double-blind, placebo-controlled trial. CNS Drugs. 2010;24(3):207-25.
- Hunter MS, Ussher JM, Browne SJ, Cariss M, Jelley R, Katz M. A randomized comparison of psychological (cognitive behavior therapy), medical (fluoxetine) and combined treatment for women with premenstrual dysphoric disorder. J Psychosom Obstet Gynaecol. 2002;23(3):193-9.
- Coffee AL, Kuehl TJ, Willis S, Sulak PJ. Oral contraceptives and premenstrual symptoms: Comparison of a 21/7 and extended regimen. American Journal of Obstetrics & Gynecology. 2006;195(5):1311-9.
- Coffee AL, Sulak PJ, Kuehl TJ. Long-term assessment of symptomatology and satisfaction of an extended oral contraceptive regimen. Contraception. 2007;75(6):444-9.
- Magos AL, Brincat M, Studd JW. Treatment of the premenstrual syndrome by subcutaneous estradiol implants and cyclical oral norethisterone: placebo controlled study. Br Med J (Clin Res Ed). 1986;292(6536):1629-33.
- Hahn PM, Van Vugt DA, Reid RL. A randomized, placebo-controlled, crossover trial of danazol for the treatment of premenstrual syndrome. Psychoneuroendocrinology. 1995;20(2):193-209.
- O’Brien PM, Abukhalil IE. Randomized controlled trial of the management of premenstrual syndrome and premenstrual mastalgia using luteal phase-only danazol. Am J Obstet Gynecol. 1999;180(1 Pt 1):18-23.
- Wyatt K, Dimmock P, Jones P, Obhrai M, O’Brien S. Efficacy of progesterone and progestogens in management of premenstrual syndrome: systematic review. Bmj. 2001;323(7316):776-80.
- Ashby CR, Jr., Carr LA, Cook CL, Steptoe MM, Franks DD. Alteration of platelet serotonergic mechanisms and monoamine oxidase activity in premenstrual syndrome. Biol Psychiatry. 1988;24(2):225-33.
- Marjoribanks J, Brown J, O’Brien PM, Wyatt K. Selective serotonin reuptake inhibitors for premenstrual syndrome. Cochrane Database Syst Rev. 2013;2013(6):Cd001396.
- Cohen LS, Soares CN, Lyster A, Cassano P, Brandes M, Leblanc GA. Efficacy and tolerability of premenstrual use of venlafaxine (flexible dose) in the treatment of premenstrual dysphoric disorder. J Clin Psychopharmacol. 2004;24(5):540-3.
- Wang M, Hammarbäck S, Lindhe BA, Bäckström T. Treatment of premenstrual syndrome by spironolactone: a double-blind, placebo-controlled study. Acta Obstet Gynecol Scand. 1995;74(10):803-8.
- O’Brien PM, Craven D, Selby C, Symonds EM. Treatment of premenstrual syndrome by spironolactone. Br J Obstet Gynaecol. 1979;86(2):142-7.
- Wyatt KM, Dimmock PW, Ismail KM, Jones PW, O’Brien PM. The effectiveness of GnRHa with and without ‘add-back’ therapy in treating premenstrual syndrome: a meta analysis. Bjog. 2004;111(6):585-93.
อ.ปุย ได้รับรางวัลนักวิจัยดีเด่นรุ่นใหม่ (ช้างทองคำ)

อ.ปุยได้รับรางวัลนักวิจัยดีเด่นรุ่นใหม่ (ช้างทองคำ: ที่สุดของมช.) ประจำปี 2563 : ภาควิชาขอแสดงความยินดีกับกับ ผู้ช่วยศาสตราจารย์แพทย์หญิง กุณฑรี ไตรศรีศิลป์ ภาควิชาสูติฯ มช. ที่ได้รับรางวัลนักวิจัยรุ่นใหม่ดีเด่น “ช้างทองคำ” ในวันที่ 24 มกราคม 2564 มหาวิทยาลัยเชียงใหม่ ในวันคล้ายวันสถาปนามหาวิทยาลัยเชียงใหม่ ณ. ศาลาธรรม