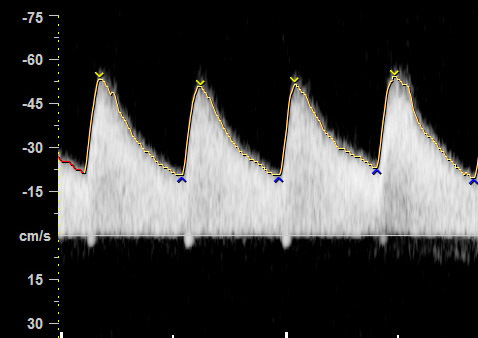
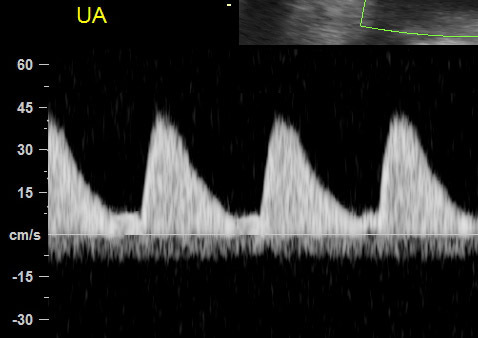
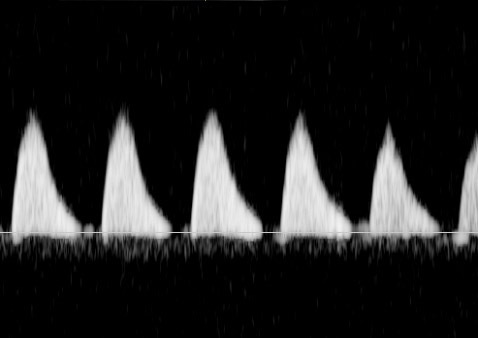
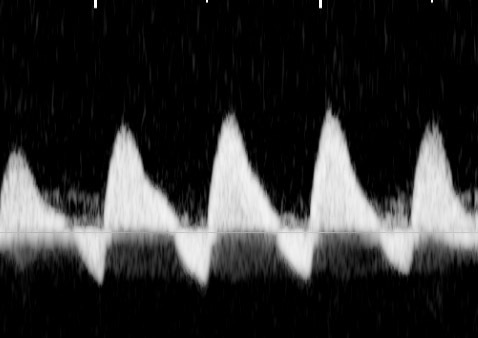
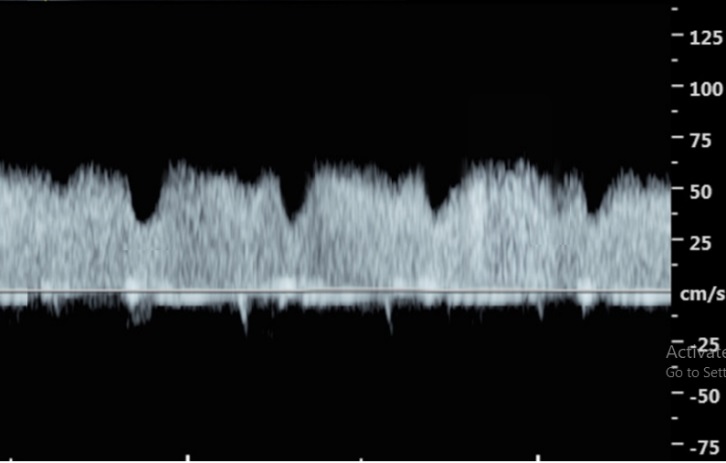
ในทารก FGR ที่มีปัญหา uteroplacental insufficiency (UPI) การไหลเวียนเลือดที่รกแย่ลง umbilical artery pulsatility index (UA-PI) จะมีค่าสูงขึ้น (แสดงถึงความต้านทานที่รกมากขึ้น) และการมี brain sparing effect ซึ่งมีทำให้ค่า MCA-PI มีค่าสูงขึ้น ค่าอัตราส่วน MCA-PI /UA-PI หรือ cerebroplacental ratio (CPR) การวัดค่านี้จะช่วยให้ความมั่นใจในการวินิจฉัย FGR มากขึ้น ในทารกปกติค่า UA-PI ต่ำกว่า MCA-PI หรือค่า CPR มากกว่า 1.0 ในกรณีที่ความต้านทานในหลอดเลือดสมองลดลงต่ำกว่าความต้านทานในหลอดเลือดรก CPR มีค่าต่ำกว่า 1.0 เป็นปรากฏการณ์ขโมยเลือดไปเลี้ยงสมอง ซึ่งสะท้อนถึงระบบการปรับตัวในการเพิ่มการไหลเวียนเลือดที่สมองในภาวะที่รกเสื่อมลง (cephalization)(12) ค่าดังกล่าวสะท้อนว่าทารกมีความเสี่ยงมากขึ้นแล้วและทำนายผลลัพธ์ที่ไม่ดี ต้องได้รับการติดตามอย่างใกล้ชิดต่อไป ในการศึกษา PORTO trial(13) พบว่าอัตราผลเสียร้ายแรงต่อทารกแรกคลอด (เช่น hypoxic ischaemic encephalopathy; HIE, Necrotizing enterocolitis; NEC การเสียชีวิต) ในรายที่ CPR ต่ำกว่า 1 พบสูงร้อยละ 18 เมื่อเทียบกับร้อยละ 2 ในกลุ่มที่ค่า CPR สูงกว่า 1 ในกรณีที่ UA-PI มีค่ามากกว่าเปอร์เซ็นไทล์ที่ 95 การใช้ CPR จะมีประโยชน์มากในการทำนายผลลัพธ์ที่รุนแรง และยังทำนายผลลัพธ์ที่ไม่ดีได้พอ ๆ กับ UA-AEDV/REDV ด้วย รายงานอื่น ๆ ก็สนับสนุนว่า CPR ที่ผิดปกติสัมพันธ์กับผลลัพธ์ที่ไม่ดีเช่นเดียวกัน(14-18) อย่างไรก็ตามการใช้ CPR เป็นกิจวัตรยังไม่ได้เพิ่มคุณค่าการทำนายเหนือไปกว่าการตรวจ UA-PI อย่างเดียว(19)
การวัด Doppler indices ในทารก FGR ได้มีการศึกษากันอย่างกว้างขวาง และขยายออกไปถึงหลอดเลือดอื่น ๆ นอกจากหลอดเลือดแดงสายสะดือ เช่น การไหลเวียนเลือดผิดปกติใน ductus venosus (DV) และ umbilical vein (UV) บ่งชี้ถึงภาวะเครียดของทารก ยังบ่งชี้ถึงปัญหาระบบหัวใจและหลอดเลือดของทารกเองด้วย reverse flow ที่ DV สัมพันธ์กับผลการตั้งครรภ์ที่ไม่ดี โดยเฉพาะอย่างยิ่งในรายโตช้าตั้งแต่อายุครรภ์ยังน้อย(20, 21) DV Doppler อาจมีการเปลี่ยนแปลงก่อนที่ทารกจะเกิดภาวะเลือดมีออกซิเจนน้อย (hypoxia) จริง ๆ (โดยที่ fetal heart rate tracing ปกติอยู่ได้) การศึกษา TRUFFLE ก็สนับสนุนปรากฏการณ์ดังกล่าว (22, 23) แต่ช่วงเวลาดังกล่าวมีผลเสียต่อพัฒนาการของสมอง สมองตายหรือไม่ ยังยากที่จะตอบได้ในปัจจุบัน
เมื่อรกเสื่อมลงเป็นลำดับ ความผิดปกติของ Doppler ก็มักแสดงความรุนแรงเป็นลำดับดังนี้ (24-26)
- ปริมาณเลือดในหลอดเลือดดำสายสะดือ (UV) ลดลง ซึ่งเกิดเร็วและเกิดนำมาก่อนเห็นการโตที่ช้าลงในทางคลินิก
- เลือดใน UV มีการกระจายของเลือดใหม่ (redistribution) โดยลดปริมาณจากตับไปเพิ่มเข้าหัวใจ ขนาดตับลดลง เส้นรอบท้องลดลง ซึ่งเป็นการตรวจวัดที่พบได้เป็นครั้งแรก
- DI ในหลอดเลือดแดงสายสะดือ (UA) จะเพิ่มขึ้น เนื่องจากการไหลเวียนขณะ end diastolic flow น้อยลง ซึ่งเป็นผลจากความต้านทานในรกมากขึ้น
- DI ใน MCA ลดลง (เพิ่ม end diastolic flow) เนื่องจากการกระจายเลือดไปสมองมากขึ้นจาก brain sparing effect
- วิลไลฝ่อและเพิ่มความต้านทานในรกที่เป็นมากขึ้นจะก่อให้เกิด AEDV/REDV ใน UA
- การทำงานของกล้ามเนื้อหัวใจผิดปกติเนื่องจากขาดออกซิเจนและอาหารอย่างเรื้อรัง เพิ่มความดันในหลอดเลือดแดงของรกและทารก ส่งผลให้เพิ่มค่า DI ใน DV ขณะที่สมรรถนะของหัวใจ (cardiac performance) แย่ลง ทำให้เกิด AEDV / REDV ใน DV และมี pulsatile UV ซึ่งอาจถือได้ว่าเป็นเหตุการณ์ระยะใกล้เสียชีวิต
- ในระยะนี้จะมีคะแนน BPP ต่ำ NST ให้ผล non-reactive และมี late deceleration
ข้อพิจารณาในเชิงคลินิก
การตรวจวัดความสูงมดลูกเป็นเพียงการคัดกรองเบื้องต้น แต่ยังไม่มีหลักฐานว่ามีประสิทธิภาพสูงในการทำนาย FGR เป็นการตรวจคัดกรองคร่าว ๆ ที่มีอัตราการตรวจพบความผิดปกติในการเจริญเติบโตค่อนข้างต่ำ แต่ก็ยังมีประโยชน์ และแม้ในรายที่มารดาอ้วนก็ยังใช้ได้ จึงเป็นที่ยอมรับกันโดยทั่วไปว่าถ้าตรวจครรภ์พบว่ามดลูกขนาดเล็กกว่าที่ควรจะเป็นให้ตรวจประเมินด้วยอัลตราซาวด์
เนื่องจากทารกบางรายมีโอกาสน้ำหนักน้อยตามธรรมชาติ ทั้งที่มีสุขภาพดี การใช้แผนภูมิบันทึกการเติบโต (growth chart) สำหรับทารกทั่วไปอาจไม่เหมาะสม จึงมีบางท่านแนะนำให้ใช้ customized growth chart ซึ่งนำเอาปัจจัยเสี่ยงอื่น ๆ ต่อน้ำหนักทารกมาช่วยคะเนน้ำหนักที่ควรจะเป็นด้วย ได้แก่ น้ำหนัก/ส่วนสูงของมารดา เชื้อชาติ จำนวนครั้งของครรภ์ เป็นต้น(27) เช่นมารดาชาวไทย ที่น้ำหนักน้อย จะถูกคาดว่าทารกมีน้ำหนักน้อยกว่าชาวตะวันตกเป็นปกติ จะมีการปรับค่าน้ำหนักปกติที่ต่ำกว่าเป็นต้น การใช้ customized growth chart จะทำให้อัตราการวินิจฉัย FGR ลดลง และการใช้ค่า cut-off ที่เปอร์เซ็นไทล์ที่ 5 น่าจะดีกว่าที่ 10(28, 29) การใช้ customize growth chart ตรวจวัดอย่างต่อเนื่องช่วยให้วินิจฉัยทารกตัวเล็กได้ดีขึ้น(30) อย่างไรก็ตามยังไม่มีหลักฐานชัดเจนถึงประโยชน์ของการ customized growth chart และการศึกษาเบื้องต้นพบว่าทำนายผลลัพธ์การปริกำเนิดที่แย่ได้ไม่ดีนัก(28) อนึ่ง เนื่องจากประเทศต่าง ๆ มิได้มีการสร้าง growth chart ที่เหมาะสมสำหรับประชากรตนเอง จึงมักจะอาศัย growth chart ที่แพร่หลายของประเทศทางตะวันตก ซึ่งอาจนำไปสู่การประเมินการเติบโตของทารกในครรภ์ได้ไม่แม่นยำนักเมื่อใช้กับกลุ่มประชากรที่มีน้ำหนักมารดาและเชื้อชาติที่แตกต่างกัน องค์การอนามัยโลกจึงได้พัฒนา fetal growth chart ในการทำนายน้ำหนักทารกโดยอัลตราซาวด์มาร์คเกอร์ที่ใช้อยู่เป็นประจำ(31) เชื่อว่าจะทำให้การวินิจฉัยการเจริญเติบโตของทารกมีความถูกต้องแม่นยำมากขึ้น
เนื่องจากการวินิจฉัย FGR ส่วนใหญ่ถือกันตามขนาดทารก แทนที่จะประเมินสภาวะการขาดอาหาร (malnutrition) หรือไม่ ทารกตัวเล็ก (SGA) มิได้หมายความว่าทารกเหล่านั้นจะมีการโตที่ผิดปกติในแง่ของการขาดอาหาร ซึ่งเล็กโดยธรรมชาติไม่ถือว่ามีความเสี่ยงในแง่สุขภาพ แต่เป็นเพียงความแปรปรวนในขนาดทารกที่ย่อมแตกต่างกันได้ เช่นเดียวกับมนุษย์ทั่วไป
การศึกษาในแง่นี้ควรจะย้ำลงไปว่าการเจริญเติบโตผิดปกติ อาจไม่ใช่ SGA ก็ได้ เช่นทารกตัวโตโดยธรรมชาติ แต่พอถึงระยะท้ายของการตั้งครรภ์มีภาวะขาดอาหารเกิดขึ้นจากรกเสื่อมสภาพ มีความเสี่ยงต่อการขาดออกซิเจน แต่การตรวจวัดทางคลื่นเสียงความถี่สูงอาจพบว่าอยู่ที่เปอร์เซ็นไทล์ที่ 50 ทำนายว่าไม่เล็ก ไม่เป็น SGA แต่แท้จริงแล้วเป็น FGR ได้
การตรวจวัดทางคลื่นเสียงความถี่สูง มักจะเป็นการวัด SGA มากกว่า FGR แม้ว่าส่วนใหญ่จะใช้เป็นคำคำเดียวกันก็ตาม เพียงแต่ว่าส่วนใหญ่ของ FGR ตกอยู่ต่ำกว่าเปอร์เซ็นไทล์ที่ 10 ดังนั้นเมื่อวินิจฉัย SGA ก็น่าจะเป็น FGR ไปด้วย ควรได้รับการดูแลเป็นพิเศษในฐานะที่มีความเสี่ยงสูง การแยกระหว่าง SGA และ FGR จึงอาจจะยาก แต่ก็ควรได้รับการตรวจระวังเหมือนกัน ทั้งในแง่ของการได้รับออกซิเจน และการเติบโตต่อไป
ประมาณร้อยละ 80 ของรายที่สงสัย SGA พบว่ามีน้ำหนักแรกคลอดต่ำกว่าเปอร์เซ็นไทล์ที่ 10 และความแม่นยำจะยิ่งถูกต้องมากขึ้นในกลุ่มที่น้ำหนักต่ำกว่าเปอร์เซ็นไทล์ที่ 5 และกลุ่มนี้มีโอกาสสูงที่จะต้องรับไว้ใน NICU และมีภาวะแทรกซ้อนสูงกว่ากลุ่มที่มีน้ำหนักอยู่ระหว่างเปอร์เซ็นไทล์ที่ 5-9(32)
การวัดทางคลื่นเสียงความถี่สูง (fetal biometry) เป็นเพียงความพยายามที่จะบอกขนาดเด็ก แต่มิได้บอกสุขภาพเด็ก ในทางตรงกันข้าม Doppler หรือ non stress test (NST), biophysical profile (BPP), oxytocin challenge test (OCT) และปริมาณน้ำคร่ำบอกถึงสุขภาพเด็ก แต่ไม่บอกขนาดเด็ก ทารกที่มีความเสี่ยงควรได้รับการตรวจทั้งขนาดและสุขภาพด้วย
เมื่อตรวจพบ หรือทำนายว่าทารกเป็น SGA และได้รับการตรวจสุขภาพแล้วพบว่าปกติ ก็มิได้หมายความว่าไม่ขาดอาหาร อาจเป็นรายที่ขาดอาหารแต่ยังไม่ถึงกับรุนแรงจนถึงขั้นขาดออกซิเจนขั้นวิกฤต การติดตามการเจริญเติบโต และสุขภาพจึงเป็นสิ่งที่จำเป็น ตราบใดก็ตามที่กราฟการเติบโตยังคงขนาน (ไปด้วยกันกับ normal curve) ไม่ว่าจะตกอยู่ที่เปอร์เซนไทล์เท่าใด ควรถือว่าเป็นการเติบโตที่เหมาะสม(33)
แม้ว่าการตรวจวัดทางคลื่นเสียงความถี่สูง จะบอกขนาดทารกว่าเป็น SGA หรือไม่ แต่ก็อาจให้ข้อมูลที่บ่งขี้ว่าน่าจะเป็น FGR หรือเล็กโดยธรรมชาติอย่างเดียว เช่น HC/AC ผิดปกติน่าจะบ่งชี้ว่าทารกผอมจากการขาดอาหารมากกว่าเล็กโดยธรรมชาติ เพราะผิดสัดส่วนคือ หัวโตท้องเล็ก เป็นต้น
SGA ที่บ่งชี้ว่าน่าจะเป็น FGR ได้แก่
- น้ำคร่ำน้อย
- สัดส่วนผิดปกติ เช่น อัตราส่วน HC/AC, FL/AC, TCD/AC ผิดปกติ ท้องเล็กแบบไม่ได้สัดส่วน
- อัตราการเติบโตของทารกช้า ซึ่งประเมินได้ด้วยการตรวจติดตามซ้ำใน 2-4 สัปดาห์ต่อมา
- Doppler studies ผิดปกติ
- มีความผิดปกติในการตรวจสุขภาพทารกในครรภ์อื่น ๆ
- ทารก FGR มีพฤติกรรมต่างไปจากทารกที่เติบโตปกติ (ทั้งกระตุ้นและไม่กระตุ้น) เช่น การดิ้นการตอบสนองต่อการกระตุ้นด้วยเสียง เป็นต้น ซึ่งอาจวิเคราะห์รูปแบบพฤติกรรมด้วยคอมพิวเตอร์ หรือการเฝ้าสังเกตธรรมดาก็ได้(34)
SGA ที่น้ำคร่ำปกติ ไดัสัดส่วน สุขภาพปกติ อาจจะเป็นเพียงเล็กโดยธรรมชาติ ซึ่งควรติดตามสุขภาพต่อไป แต่อาจไม่จำเป็นต้องรีบให้ยุติการตั้งครรภ์
ควรทำความเข้าใจว่าการวัดคลื่นเสียงความถี่สูงด้วยตัววัดต่าง ๆ มุ่งจะทำนายน้ำหนักว่าต่ำกว่าเปอร์เซ็นไทล์ที่ 10 หรือไม่ มิได้บอกสุขภาพทารกโดยตรงว่าสมบูรณ์หรืออ่อนแอ อย่างไรก็ตามโดยรวมแล้ว SGA ย่อมมีความเสี่ยงต่อภาวะอ่อนแอมากกว่าทารกน้ำหนักปกติ ประมาณร้อยละ 80 ของรายที่สงสัย SGA จะมีน้ำหนักคลอดต่ำกว่าเปอร์เซ็นไทล์ที่ 10 จริง และความถูกต้องยิ่งสูงขึ้นในกลุ่มต่ำกว่าเปอร์เซ็นไทล์ที่ 5 ซึ่งเป็นกลุ่มที่มีปัญหาในทารกแรกคลอดสูง (32)
คลอดเมื่อไหร่ดี: เป็นที่ยอมรับกันโดยทั่วไปว่า เมื่อมีหลักฐานว่าทารกอยู่ในครรภ์ด้วยความยากลำบาก ท่ามกลางสภาพแวดล้อมที่อันตราย และปอดสมบูรณ์พอที่จะอยู่ในโลกภายนอกได้อย่างไม่ลำบาก ก็สมควรให้คลอด อย่างไรก็ตามในรายที่ปอดสมบูรณ์แล้ว (มากกว่า 37 สัปดาห์) ทารกที่สงสัยโตช้า แต่ยังไม่มีท่าทีทุกข์ร้อน การไหลเวียนเลือดยังไม่บกพร่อง (reassuring fetal well-being) สามารถเลือกที่ให้คลอด หรือติดตามอย่างใกล้ชิดด้วยความระมัดระวัง ก็สามารถให้ผลลัพธ์การตั้งครรภ์ที่พอ ๆ กัน ทั้งในระยะคลอด หลังคลอดใหม่ ๆ(35) หรือในระยะยาว(36) National Institute of Child Health and Human Development, the Society for Maternal-Fetal Medicine, and the American College of Obstetricians and Gynecologists(37) แนะนำว่าในกรณีที่เป็น FGR เดี่ยว ๆ ที่ไม่มีปัญหาอื่น ๆ และสุขภาพทารกดี ให้คลอดที่อายุครรภ์ 38 0/7–39 6/7 สัปดาห์ และกรณีที่มีปัจจัยเสี่ยงเพิ่มเติมต่อผลลัพธ์ที่ไม่ดี เช่น น้ำคร่ำน้อย Doppler ของหลอดเลือดแดงสายสะดือผิดปกติ มีความเสี่ยงอื่นในมารดา 2) ให้คลอดที่ 34 0/7–37 6/7 สัปดาห์ ส่วนกรณีที่คาดว่าจะคลอดก่อน 34 สัปดาห์ (เช่น Doppler ผิดปกติ และการทดสอบ BPP บ่งชี้ไม่ดี เป็นต้น) ควรวางแผนให้คลอดในศูนย์ที่มีความพร้อมของทารกแรกคลอด และถ้าเป็นไปได้ให้ปรึกษาแพทย์ผู้เชี่ยวชาญสาขาเวชศาสตร์มารดาและทารกในครรภ์ (MFM specialist) การตัดสินใจยากคือรายที่อายุครรภ์น้อย โดยเฉพาะก่อน 32 สัปดาห์ (ซึ่งศักยภาพในการเลี้ยงทารกดังกล่าวก็แตกต่างกันไประหว่างสถาบัน) แต่โดยทั่วไปแล้วมีอัตราการตายสูง ระหว่าง 26 – 29 สัปดาห์ มีอัตราการรอดเพิ่มขึ้นสัปดาห์ละ 1-2%(20) ปัจจัยที่บอกว่าถ้าเป็นไปได้ควรให้คลอดเลย ได้แก่ ductus venosus Doppler ผิดปกติ หรือการมี UA-AEDV และ UA-REDV ในกรณีที่อายุครรภ์มากกว่า 34 หรือ 32 สัปดาห์ตามลำดับ ควรให้คลอด ในรายที่ยอมรับการตรวจติดตามหลัง 36 สัปดาห์ ควรให้คลอดช่วง 37-38 สัปดาห์ หลัง 40 สัปดาห์ไปแล้วอัตราการเสียชีวิตจะสูงขึ้นชัดเจน สำหรับกรณีปากมดลูกไม่พร้อม ไม่ควรเป็นเหตุผลในการไม่ชักนำคลอด สามารถทำปากมดลูกให้สุกได้ด้วยพรอสตาแกลนดิน หรือวิธีบอลลูนเป็นต้น
แนวทางการดูแลรักษา (1, 2, 7, 37, 38)
- การป้องกัน แนะนำให้หลีกเลี่ยงหรือรักษาปัจจัยเสี่ยง เช่น ควบคุมความดันโลหิตสูง เป็นต้น สำหรับการใช้ยาป้องกัน เช่น sildelnafil (เพิ่มการไหลเวียนที่รก) มีส่วนช่วยเพิ่มน้ำหนักทารกในรายที่รกเสื่อม (39) แต่ยังต้องการการศึกษาเพิ่มเติม
- แนะนำให้ตรวจอัลตราซาวด์ขั้นละเอียดสูง โดยเฉพาะในราย early-onset
- แนะนำให้ตรวจโครโมโซม รวมถึง CMA (chromosomal microarray) ในรายที่ทารกพิการ น้ำคร่ำมาก โดยไม่คำนึงอายุครรภ์ หรือ early-onset (แม้ไม่พบความผิดปกติอื่น) ในกรณีที่ตรวจโครโมโซมปกติ การตรวจ CMA ทำให้ทราบสาเหตุเพิ่มขึ้นอีกร้อยละ 6
- การติดเชื้อ TORCHไม่แนะนำให้ตรวจเป็นกิจวัตร แต่อาจทำในรายเสี่ยงสูง เช่น มีมาร์คเกอร์ทางอัลตราซาวด์ เป็นต้น ในรายที่ตรวจหา แนะนำให้ตรวจ PCR สำหรับ CMV จากการเจาะน้ำคร่ำ
- UA-Doppler ทุกสัปดาห์ถ้ามี EDV ลดลง (PI > 95 เปอร์เซ็นไทล์) หรือเป็นรุนแรง (EFW <เปอร์เซ็นไทล์ที่ 3)
- UA-Doppler 2-3 ครั้ง/สัปดาห์ ในราย AEDV
- ในราย REDV ให้รับไว้ในโรงพยาบาล ตรวจ CTG วันละอย่างน้อย 1-2 ครั้ง
- FGR ที่ไม่มี AEDV/REDV ให้ตรวจ CTG สัปดาห์ละครั้ง (ระยะที่เลี้ยงรอดแล้ว)
- ให้สเตียรอยด์เร่งปอดในรายที่คาดว่าจะคลอดก่อน 33+6สัปดาห์ หรือรายที่อายุครรภ์ 34-36+6 ที่คาดว่าจะคลอดใน 7 วัน โดยไม่มีข้อบ่งห้าม และไม่ได้รับสเตียรอยด์มาก่อน
- รายที่คลอดก่อน 32 สัปดาห์ พิจารณาให้ magnesium sulfate ในระยะคลอดสำหรับ neuroprotection
- อายุครรภ์ที่พิจารณาให้คลอดในกรณีที่ CTG (cardiotocography)ปกติ
- UA-Doppler ปกติ : 38-39 สัปดาห์
- UA-Doppler ปกติแต่ FGR รุนแรง (<เปอร์เซ็นไทล์ที่ 3) : 37 สัปดาห์
- UA-Doppler มีค่า (PI >เปอเซ็นไทล์ที่ 95) : 37 สัปดาห์
- UA-AEDV : 33-34 สัปดาห์
- UA-REDV : 30-32 สัปดาห์
- FGR ที่วินิจฉัยก่อน 24-25 สัปดาห์ให้พิจารณาเป็นราย ๆ ไป (เช่น ให้ทางเลือกยุติการตั้งครรภ์)
บางองค์กรแนะนำเพิ่มรายละเอียดปลีกย่อยเช่น ISUOG(7, 21) แนะนำให้ตรวจ DV-Doppler / computerized CTG (short term variations: STV) ในรายที่มี AEDV/REDV (แตกต่างกันในวิธี surveillance) และให้คลอดถ้ามีหลักฐานว่าทารกอยู่ในขีดอันตราย เช่น late deceleration หรือ absent / reversed DV a-wave หรือ BPP คะแนนต่ำกว่า 6 เป็นต้น
- ในรายที่มารดามีปัญหามาก อาจมีความจำเป็นต้องให้ยุติการตั้งครรภ์ด้วยข้อบ่งชี้ทางมารดาเช่นโรคครรภ์เป็นพิษชนิดรุนแรง (severe preeclampsia)เป็นต้น
- ระยะคลอด : ติดตามสุขภาพทารกระยะคลอดแบบต่อเนื่อง แจ้ง/ปรึกษากุมารแพทย์ทารกแรกคลอด
- วิธีการคลอดโดยทั่วไปแล้วให้คลอดตามปกติ ผ่าตัดเมื่อมีข้อบ่งชี้เช่น fetal distressถ้ามีเพียงปัญหา FGR ไม่ควรถือเป็นข้อบ่งชี้ในการผ่าตัดคลอด
ระยะหลังคลอด
มีความเตรียมพร้อมสำหรับช่วยแก้ไขและป้องกันภาวะแทรกซ้อนมาตั้งแต่ก่อนคลอด ทันทีที่คลอดในรายที่น้ำคร่ำมีขี้เทาปนต้องดูดออกจากช่องจมูกและ oropharynx ให้มากที่สุดก่อนคลอดลำตัว ร่วมกับการทำ tracheal suction ทาง endotracheal tube หรือป้องกันและลดความรุนแรงของภาวะ meconium aspiration syndrome (MAS) และ birth asphyxia นอกจากนั้นต้องระมัดระวังภาวะน้ำตาลในเลือดต่ำ อุณหภูมิต่ำ ความเข้มข้นเลือดสูง และติดตามการเจริญเติบโตระยะยาวต่อไป
การพยากรณ์โรค
นอกเหนือจากการเพิ่มปัญหา acidosis ภาวะทุพพลภาพและการตายปริกำเนิดแล้ว FGR อาจพบมี neurological และ intellectual deficit มากกว่าทารกปกติ โดยเฉพาะในรายที่เป็นรุนแรง ในระยะยาวเพิ่มความเสี่ยงต่อโรคหัวใจและหลอดเลือด หรือโรคทางเมตาบอลิซึมมากขึ้น กลุ่ม early-onset FGR จะยังคงมีการเจริญเติบโตช้ากว่าปกติ เนื่องจากสาเหตุส่วนใหญ่เป็นปัจจัยภายใน (intrinsic factors) ส่วนกลุ่ม late-onset FGR มักมีพยากรณ์ที่ดีกว่า ถ้าได้รับการดูแลเหมาะสมจะมีการเจริญเติบโตปกติหลังคลอดซึ่งการเจริญเติบโตและพัฒนาการทางสมองไม่แตกต่างจากทารกปกติ มีหลักฐานการศึกษาว่าการเพิ่มความระมัดระวังของการตรวจ SGA ให้ได้มีส่วนสำคัญในการช่วยลดอัตราการตายคลอดหรือการตายปริกำเนิดได้อย่างมีนัยสำคัญ (40)
การเป็นซ้ำและการป้องกัน
มีโอกาสให้กำเนิดทารกเป็น FGR ในครรภ์ต่อไปเป็น 2 เท่า ถ้าเคยมีบุตรเป็น FGR มา 2 คนแล้วมีโอกาสเพิ่มขึ้นเป็น 4 เท่ายังไม่มีวิธีการป้องกันที่มีประสิทธิภาพสูงสำหรับทุกราย แต่สำหรับรายที่มีปัจจัยเสี่ยง แนะนำให้หลีกเลี่ยงปัจจัยเสี่ยงเช่น บุหรี่ แอลกอฮอล์ เป็นต้น ในรายที่เป็น FGR ที่สัมพันธ์กับ preeclampsia การกินแอสไพรินขนาดต่ำจะมีประโยชน์ในการป้องกัน preeclampsia ในครรภ์ต่อไป และช่วยลดความเสี่ยง FGR ลงด้วยเช่นกัน (relative risk 0.56, 95% CI 0.44-0.70)(41)
เอกสารอ้างอิง
1. Resnik R. Intrauterine Growth Restriction. In: Resnik R, Lockwood CJ, Moore TR, Greene MF, Copel JA, Silver RM, editors. Creasy & Resnik’s Maternal-Fetal Medicine: Principles and Practice. 8 ed. Philadelphia: Elsevier, Inc.; 2019. p. 798-809.
2. Cunningham FG, Leveno KJ, Bloom SL, Dashe JS, Hoffman BL, Casey BM, et al. Williams Obstetrics. 25 ed. New York: McGraw-Hill Education; 2018.
3. Barker DJ. Early growth and cardiovascular disease. Arch Dis Child. 1999;80(4):305-7.
4. Carmody JB, Charlton JR. Short-term gestation, long-term risk: prematurity and chronic kidney disease. Pediatrics. 2013;131(6):1168-79.
5. Lugthart MA, Horenblas J, Kleinrouweler EC, Engels M, Knegt AC, Huijsdens K, et al. Prenatal sonographic features can accurately determine parental origin in triploid pregnancies. Prenat Diagn. 2020;40(6):705-14.
6. Mateus J, Newman RB, Zhang C, Pugh SJ, Grewal J, Kim S, et al. Fetal growth patterns in pregnancy-associated hypertensive disorders: NICHD Fetal Growth Studies. Am J Obstet Gynecol. 2019;221(6):635.e1-.e16.
7. Lees CC, Stampalija T, Baschat A, da Silva Costa F, Ferrazzi E, Figueras F, et al. ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol. 2020;56(2):298-312.
8. Turan OM, Turan S, Gungor S, Berg C, Moyano D, Gembruch U, et al. Progression of Doppler abnormalities in intrauterine growth restriction. Ultrasound Obstet Gynecol. 2008;32(2):160-7.
9. Bates JA, Evans JA, Mason G. Differentiation of growth retarded from normally grown fetuses and prediction of intrauterine growth retardation using Doppler ultrasound. Br J Obstet Gynaecol. 1996;103(7):670-5.
10. Todros T, Sciarrone A, Piccoli E, Guiot C, Kaufmann P, Kingdom J. Umbilical Doppler waveforms and placental villous angiogenesis in pregnancies complicated by fetal growth restriction. Obstet Gynecol. 1999;93(4):499-503.
11. Harrington K, Carpenter RG, Goldfrad C, Campbell S. Transvaginal Doppler ultrasound of the uteroplacental circulation in the early prediction of pre-eclampsia and intrauterine growth retardation. Br J Obstet Gynaecol. 1997;104(6):674-81.
12. Morales-Rosello J, Khalil A. Fetal cerebral redistribution: a marker of compromise regardless of fetal size. Ultrasound Obstet Gynecol. 2015;46(4):385-8.
13. Flood K, Unterscheider J, Daly S, Geary MP, Kennelly MM, McAuliffe FM, et al. The role of brain sparing in the prediction of adverse outcomes in intrauterine growth restriction: results of the multicenter PORTO Study. Am J Obstet Gynecol. 2014;211(3):288 e1-5.
14. Khalil AA, Morales-Rosello J, Morlando M, Hannan H, Bhide A, Papageorghiou A, et al. Is fetal cerebroplacental ratio an independent predictor of intrapartum fetal compromise and neonatal unit admission? Am J Obstet Gynecol. 2015;213(1):54 e1-10.
15. Khalil AA, Morales-Rosello J, Elsaddig M, Khan N, Papageorghiou A, Bhide A, et al. The association between fetal Doppler and admission to neonatal unit at term. Am J Obstet Gynecol. 2015;213(1):57 e1-7.
16. Regan J, Masters H, Warshak CR. Estimation of the growth rate in fetuses with an abnormal cerebroplacental ratio compared to those with suspected growth restriction without evidence of centralization of blood flow. J Ultrasound Med. 2015;34(5):837-42.
17. Conde-Agudelo A, Villar J, Kennedy SH, Papageorghiou AT. Predictive accuracy of cerebroplacental ratio for adverse perinatal and neurodevelopmental outcomes in suspected fetal growth restriction: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2018;52(4):430-41.
18. Vollgraff Heidweiller-Schreurs CA, De Boer MA, Heymans MW, Schoonmade LJ, Bossuyt PMM, Mol BWJ, et al. Prognostic accuracy of cerebroplacental ratio and middle cerebral artery Doppler for adverse perinatal outcome: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2018;51(3):313-22.
19. Vollgraff Heidweiller-Schreurs CA, van Osch IR, Heymans MW, Ganzevoort W, Schoonmade LJ, Bax CJ, et al. Cerebroplacental ratio in predicting adverse perinatal outcome: a meta-analysis of individual participant data. Bjog. 2021;128(2):226-35.
20. Baschat AA, Cosmi E, Bilardo CM, Wolf H, Berg C, Rigano S, et al. Predictors of neonatal outcome in early-onset placental dysfunction. Obstet Gynecol. 2007;109(2 Pt 1):253-61.
21. Ganzevoort W, Thornton JG, Marlow N, Thilaganathan B, Arabin B, Prefumo F, et al. Comparative analysis of 2-year outcomes in GRIT and TRUFFLE trials. Ultrasound Obstet Gynecol. 2020;55(1):68-74.
22. Lees CC, Marlow N, van Wassenaer-Leemhuis A, Arabin B, Bilardo CM, Brezinka C, et al. 2 year neurodevelopmental and intermediate perinatal outcomes in infants with very preterm fetal growth restriction (TRUFFLE): a randomised trial. Lancet. 2015;385(9983):2162-72.
23. Vora NL, Chescheir N. Delivery of the growth restricted preterm fetus. Lancet. 2015;385(9983):2126-8.
24. Ferrazzi E, Bozzo M, Rigano S, Bellotti M, Morabito A, Pardi G, et al. Temporal sequence of abnormal Doppler changes in the peripheral and central circulatory systems of the severely growth-restricted fetus. Ultrasound Obstet Gynecol. 2002;19(2):140-6.
25. Cosmi E, Ambrosini G, D’Antona D, Saccardi C, Mari G. Doppler, cardiotocography, and biophysical profile changes in growth-restricted fetuses. Obstet Gynecol. 2005;106(6):1240-5.
26. Baschat AA. Venous Doppler evaluation of the growth-restricted fetus. Clin Perinatol. 2011;38(1):103-12, vi.
27. De Jong CL, Francis A, Van Geijn HP, Gardosi J. Customized fetal weight limits for antenatal detection of fetal growth restriction. Ultrasound Obstet Gynecol. 2000;15(1):36-40.
28. Zhang J, Mikolajczyk R, Grewal J, Neta G, Klebanoff M. Prenatal application of the individualized fetal growth reference. Am J Epidemiol. 2011;173(5):539-43.
29. Zhang J, Merialdi M, Platt LD, Kramer MS. Defining normal and abnormal fetal growth: promises and challenges. Am J Obstet Gynecol. 2010;202(6):522-8.
30. Roex A, Nikpoor P, van EE, Hodyl N, Dekker G. Serial plotting on customised fundal height charts results in doubling of the antenatal detection of small for gestational age fetuses in nulliparous women. Aust N Z J Obstet Gynaecol. 2012;52(1):78-82.
31. Kiserud T, Piaggio G, Carroli G, Widmer M, Carvalho J, Neerup JL, et al. The World Health Organization Fetal Growth Charts: A Multinational Longitudinal Study of Ultrasound Biometric Measurements and Estimated Fetal Weight. PLoS Med. 2017;14(1):e1002220.
32. Mlynarczyk M, Chauhan SP, Baydoun HA, Wilkes CM, Earhart KR, Zhao Y, et al. The clinical significance of an estimated fetal weight below the 10th percentile: a comparison of outcomes of <5th vs 5th-9th percentile. Am J Obstet Gynecol. 2017;217(2):198.e1-.e11.
33. Dubinsky TJ, Sonneborn R. Trouble With the Curve: Pearls and Pitfalls in the Evaluation of Fetal Growth. J Ultrasound Med. 2020;39(9):1839-46.
34. Vindla S, James D, Sahota D. Computerised analysis of unstimulated and stimulated behaviour in fetuses with intrauterine growth restriction. Eur J Obstet Gynecol Reprod Biol. 1999;83(1):37-45.
35. Boers KE, Vijgen SM, Bijlenga D, van der Post JA, Bekedam DJ, Kwee A, et al. Induction versus expectant monitoring for intrauterine growth restriction at term: randomised equivalence trial (DIGITAT). BMJ. 2010;341:c7087.
36. Walker DM, Marlow N, Upstone L, Gross H, Hornbuckle J, Vail A, et al. The Growth Restriction Intervention Trial: long-term outcomes in a randomized trial of timing of delivery in fetal growth restriction. Am J Obstet Gynecol. 2011;204(1):34-9.
37. Fetal Growth Restriction: ACOG Practice Bulletin, Number 227. Obstet Gynecol. 2021;137(2):e16-e28.
38. Martins JG, Biggio JR, Abuhamad A. Society for Maternal-Fetal Medicine (SMFM) Consult Series #52: Diagnosis and Management of Fetal Growth Restriction. Am J Obstet Gynecol. 2020.
39. Ferreira R, Negrini R, Bernardo WM, Simões R, Piato S. The effects of sildenafil in maternal and fetal outcomes in pregnancy: A systematic review and meta-analysis. PLoS One. 2019;14(7):e0219732.
40. Hugh O, Williams M, Turner S, Gardosi J. Reduction of stillbirths in England from 2008 to 2017 according to uptake of the Growth Assessment Protocol: 10-year population-based cohort study. Ultrasound Obstet Gynecol. 2021;57(3):401-8.
41. Roberge S, Nicolaides K, Demers S, Hyett J, Chaillet N, Bujold E. The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta-analysis. Am J Obstet Gynecol. 2017;216(2):110-20 e6.