Asthma in Pregnancy
Asthma in Pregnancy
พญ.พรปวีณ์ นิรันดร์รุ่งเรือง
อาจารย์ที่ปรึกษา ศ.พญ.สุพัตรา ศิริโชติยะกุล
โรคปอดเป็นสิ่งที่พบได้บ่อยขณะตั้งครรภ์ มีการศึกษาพบว่าโรคหอบหืดและโรคปอดอักเสบเป็นสาเหตุของการรักษาตัวในโรงพยาบาลระหว่างตั้งครรภ์ที่ไม่ได้เกิดจากภาวะทางสูติศาสตร์ถึงร้อยละ 10 และการตั้งครรภ์ส่งผลให้โรคปอดรุนแรงมากขึ้นได้เนื่องจากมีการเปลี่ยนแปลงทางสรีรวิทยาของระบบทางเดินหายใจ โดยเฉพาะช่วงไตรมาสสุดท้ายของการตั้งครรภ์ (1)
การเปลี่ยนแปลงทางสรีรวิทยาของระบบทางเดินหายใจขณะตั้งครรภ์
- การเปลี่ยนแปลงทางกายวิภาคศาสตร์ (Anatomical change)
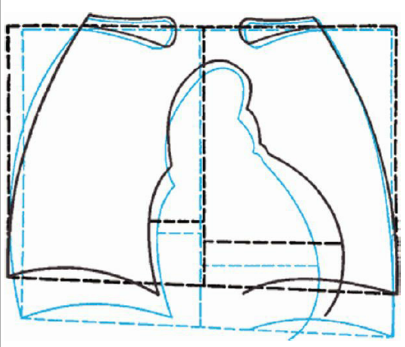
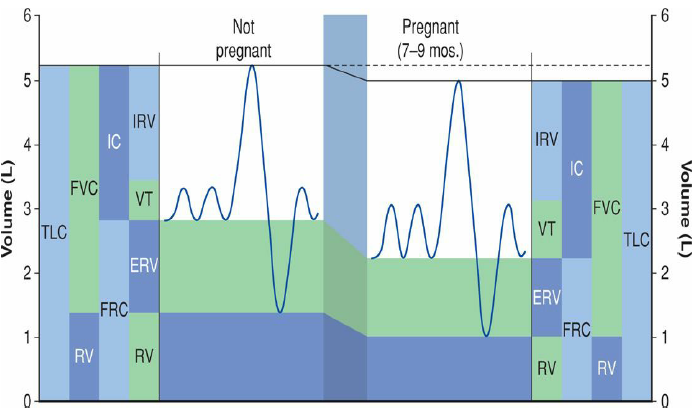
ขณะตั้งครรภ์ กระบังลม (diaphragm) จะยกสูงขึ้นประมาณ 4 ซม. Subcostal angle กว้างมากขึ้น เส้นรอบวงทรวงอก (thoracic circumference) มากขึ้นประมาณ 6 ซม. AP diameter ของทรวงอกเพิ่มขึ้นประมาณ 2 ซม. แต่ไม่สามารถป้องกันการลดของ residual lung volumes ที่เกิดจากการยกขึ้นของกระบังลมได้ ทำให้เกิดอาการเหนื่อยขณะตั้งครรภ์ได้ (1)
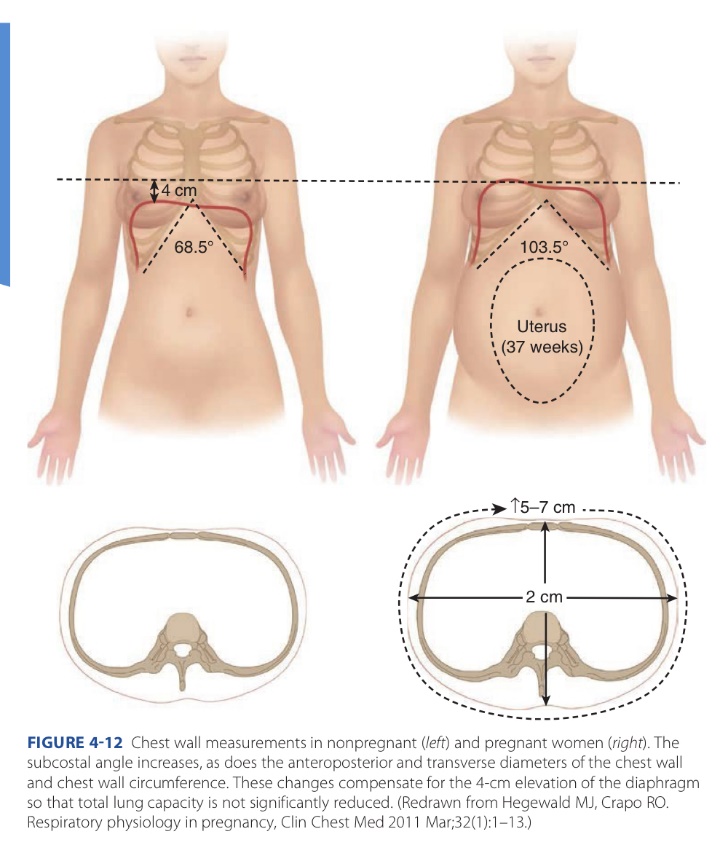
รูปที่ 1 ขนาดผนังทรวงอกในสตรีที่ไม่ได้ตั้งครรภ์ (ซ้าย) ในสตรีตั้งครรภ์ (ขวา) จาก Williams Obstetrics, 26th ed, 2022 (1)
- การทำงานของปอด (Pulmonary function)
- Vital capacity และ inspiratory capacity เพิ่มประมาณร้อยละ 20 ช่วงท้ายของการตั้งครรภ์
- Expiratory reserve volume ลดลงจาก 1300 มล. เป็น 1100 มล.
- Tidal volume เพิ่มขึ้นร้อยละ 40
- Minute ventilation เพิ่มร้อยละ 30-40 เนื่องจาก Tidal volume ที่เพิ่มขึ้น ทำให้ PaO2 เพิ่มขึ้นจาก 100 เป็น 105 มิลลิเมตรปรอท
- การสร้างคาร์บอนไดออกไซด์เพิ่มขึ้นร้อยละ 30 เนื่องจาก metabolic demand ที่มากขึ้น แต่ PaCO2 ลดลง จาก 40 เป็น 32 มิลลิเมตรปรอท เป็นผลมาจาก diffuse capacity ที่มากขึ้น และ hyperventilation
- Residual volume ลดลงร้อยละ 20 จาก 1500 มล. เป็น 1200 มล.
- Chest wall compliance ลดลง 1/3 ส่วน เนื่องจากมดลูกขยายขนาดมากขึ้นและความดันในช่องทองเพิ่มสูงขึ้น ทำให้ Functional residual capacity ลดลงร้อยละ 10-20
การเปลี่ยนแปลงที่เกิดขึ้นระหว่างตั้งครรภ์ทำให้เกิด hyperventilation เนื่องจากต้องหายใจลึกขึ้นแต่ไม่ได้เพิ่มอัตราการหายใจ ซึ่งเกิดจากมี oxygen consumption ที่เพิ่มมากขึ้นระหว่างตั้งครรภ์จาก 20 เป็น 40 mL/min ในช่วงไตรมาสที่ 2 ของการตั้งครรภ์ (1)
พยาธิสรีรวิทยาของโรคหอบหืด (Pathophysiology of Asthma)
โรคหอบหืดเป็นโรคที่เกิดจากการอักเสบเรื้อรังของท่อหายใจ (Chronic airway inflammation) ทำให้มีอาการและอาการแสดงทางระบบทางเดินหายใจ เช่น หายใจเสียงวี๊ด หายใจเหนื่อย แน่นหน้าอก และไอ ซึ่งอาการจะแตกต่างกันออกไปตามระยะเวลาและความรุนแรง ร่วมกับมี expiratory airflow limitation ที่แตกต่างกัน (2)
โรคหอบหืดเป็นโรคที่มีสาเหตุมาจากหลายปัจจัย (Heterogeneous disease) ร่วมกับมีปัจจัยกระตุ้นจากสิ่งแวดล้อม เช่น ไข้หวัดใหญ่ (Influenza) และควันบุหรี่ ซึ่งสิ่งกระตุ้นจะทำให้มี eosinophil, mast cell, T-lymphocyte เพิ่มมากขึ้น เพิ่มการหลั่ง inflammatory mediators ต่างๆ ได้แก่ histamine, leukotrienes, prostaglandins, cytokines, immunoglobulin E (IgE) และอื่นๆ ทำให้เกิดการหดรัดตัวของกล้ามเนื้อเรียบที่หลอดลม มีการคั่งของหลอดเลือด มีการหลั่งมูกมากขึ้น และเยื่อบุหลอดลมบวมซึ่งทำให้เกิดการอุดกันของหลอดลมแบบไม่ถาวร (reversible airway obstruction) (1)
ลักษณะทางคลินิก (Clinical course)
โรคหอบหืดมีอาการแสดงที่รุนแรงแตกต่างกันไปตั้งแต่หายใจเสียงวี๊ดเล็กน้อยไปจนถึงมีหลอดลมตีบอย่างรุนแรง ทำให้เกิดการอุดกั้นของหลอดลมและอากาศผ่านหลอดลมได้ลดลง ต้องใช้แรงในการหายใจที่มาก เกิดอาการเหนื่อย หายใจเสียงวี๊ด แน่นหน้าอกและหายใจไม่ออก
การแบ่งความรุนแรงของโรคหอบหืดในที่นี่จะกล่าวถึงการแบ่งความรุนแรงตาม National Asthma Education and Prevention Program (NAEPP) 2020 และ Global Initiative for Asthma (GINA) 2022
- NAEPP 2022 แบ่งความรุนแรงโดยใช้ความถี่ในการเกิดอาการ ความถี่ในการใช้ reliever และ lung function ตามตารางที่ 1
- GINA 2022 แบ่งความรุนแรงโดยใช้ความยากในการรักษาเป็นหลัก ตามตารางที่ 2 (2)
| Component | Severity | |||
| Intermittent | Persistent | |||
| Mild | Moderate | Severe | ||
| Symptoms | ≤ 2 d/wk | >2 d/wk, not daily | Daily | Throughout day |
| Nocturnal awakenings | ≤2x/mo | 3-4x/mo | >1x/wk, not nightly | Often 7x/wk |
| Short-acting β-agonist for symptoms | ≤2d/wk | ≥2d/wk, but not >1x/d | Daily | Several times daily |
| Interference with normal activity | None | Minor limitation | Some limitation | Extremely limited |
| Lung function | Normal between exacerbations | |||
| FEV1 | >80% predicted | ≥80% predicted | 60-80% predicted | <60% predicted |
| FEV1/FVC | Normal | Normal | Reduced 5% | Reduced >5% |
ตารางที่ 1 การแบ่งระดับความรุนแรงของโรคหอบหืด จาก Williams Obstetrics, 26th ed, 2022 (1)
| Severity | Definition |
| Mild | Well controlled with
|
| Moderate | Well controlled with step 3 or step 4 treatment |
| Severe |
|
ตารางที่ 2 การแบ่งระดับความรุนแรงของโรคหอบหืด ตาม GINA 2022 (2)
ในรายที่มีการอุดกั้นหลอดลมถาวรหรือรุนแรงจะมีอาการที่มากขึ้นเป็นลำดับ (ภาพที่ 2) เริ่มจากมี respiratory alkalosis จากภาวะ hypoxia ทำให้เกิด hyperventilation เพื่อทำให้ระดับ PaO2 อยู่ในระดับปกติ แต่ทำให้ PaCO2 ต่ำลง เมื่อหลอดลมตีบมากขึ้น ventilation-perfusion defect มากขึ้น ก็จะเกิด hypoxemia มากขึ้น เมื่อเกิดหลอดลมอุดกั้นอย่างรุนแรง จะทำให้เกิดการคั่งของ CO2 และ ventilation ที่แย่ลง เกิดภาวะการหายใจล้มเหลวตามมา (1)
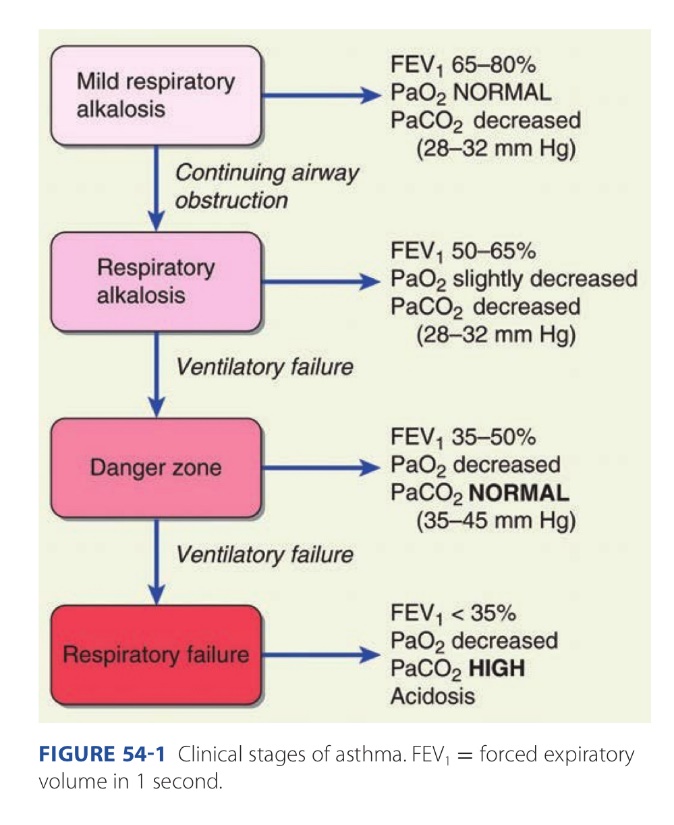
รูปที่ 2 การเปลี่ยนแปลงอาการเมื่อเกิดการอุดกั้นหลอดลมอย่างถาวรหรือรุนแรง จาก Williams Obstetrics, 26th ed, 2022 (1)
การเปลี่ยนแปลงเหล่านี้เป็นแค่ชั่วคราวสามารถกลับคืนภาวะปกติได้ ซึ่งมักไม่รุนแรงในสตรีที่ไม่ได้ตั้งครรภ์และมีสุขภาพแข็งแรง แต่ในสตรีตั้งครรภ์จะมี residual capacity ที่ลดลงจากมดลูกที่ขยายขนาดขึ้นทำให้เกิดภาวะ hypoxemia ได้ง่ายกว่า ดังนั้นในสตรีตั้งครรภ์แม้จะมีอาการของโรคหอบหืดในระยะต้น ก็สามารถทำให้เกิดอัตรายต่อมารดาและทารกในครรภ์ได้ (1)
ผลกระทบจากการตั้งครรภ์ต่อโรคหอบหืด (Effects of Pregnancy on Asthma)
การดำเนินโรคระหว่างการตั้งครรภ์มักไม่อาจทำนายได้ ประมาณ 1/3 อาการดีขึ้น 1/3 อาการไม่เปลี่ยนแปลง และ1/3 อาการแย่ลง การกำเริบเกิดได้บ่อยระหว่างการตั้งครรภ์ และมีแนวโน้มบ่อยขึ้นในไตรมาสที่ 2 ของการตั้งครรภ์ ในรายที่เป็นโรคหอบหืดรุนแรงจะมีโอกาสเกิดการกำเริบได้มากกว่าและมีอัตราการนอนโรงพยาบาลมากกว่า รายที่มีอาการเล็กน้อยมักไม่มีปัญหาในระหว่างการตั้งครรภ์ อัตราการกำเริบอาจเกิดได้ร้อยละ 10-20 ในระยะคลอด และอาจเพิ่มมากขึ้นหลังผ่าตัดคลอด ซึ่งมากกว่าการคลอดทางช่องคลอด (1,2,3)
ผลของโรคหอบหืดต่อการตั้งครรภ์ (Effects of Asthma on Pregnancy)
โรคหอบหืดยังคงเป็นปัจจัยเสี่ยงที่ทำให้ผลการตั้งครรภ์แย่ลง แต่โรคหอบหืดไม่ถือเป็นข้อห้ามของการตั้งครรภ์ ซึ่งการรักษาและควบคุมอาการของโรคได้ดีสามารภลดภาวะแทรกซ้อนที่อาจเกิดขึ้นได้ ในกรณีที่โรคไม่รุนแรง ผลลัพธ์การตั้งครรภ์ไม่แตกต่างกับครรภ์ทั่วไป ผลต่อการตั้งครรภ์ที่พบ ได้แก่ เพิ่มอุบัติการณ์ small-for-gestational-age, perinatal mortality, ปอดอักเสบ, preeclampsia และเพิ่มอัตราการผ่าตัดคลอด ซึ่งโรคหอบหืดที่รุนแรงหรือควบคุมตัวโรคได้ไม่ดี สัมพันธ์กับ maternal and perinatal mortality rate ที่สูงมากขึ้น ซึ่งเพิ่มขึ้นชัดเจนในกรณีเกิด status asthmaticus หรือ life-threatening complications อื่นๆ เช่น ภาวะหายใจล้มเหลว ลมรั่วในปอด เป็นต้น (1,4)
สาเหตุที่เป็นไปได้ที่ทำให้ผลลัพธ์การตั้งครรภ์แย่ลง ได้แก่ ภาวะ hypoxia ของมารดาขณะที่โรคกำเริบ เกิดภาวะ respiratory alkalosis ซึ่งทำให้ fetal oxygenation และ uteroplacental blood flow ลดลง เกิด fetal hypoxia ตามมา ซึ่งโรคหอบหืดที่รุนแรงมากจะมีอัตราการเกิด fetal growth restriction ที่มากขึ้น (1)
อีกสาเหตุที่เป็นไปได้ คือ ยาโรคหอบหืดขณะตั้งครรภ์ที่มีโอกาสเป็น teratogen หรือส่งผลต่อทารกในครรภ์ได้ มีบางการศึกษาพบว่า inhaled β2-agonist อาจเพิ่มความเสี่ยงในการเกิด cleft lip and palate และ autism spectrum ได้เล็กน้อย แต่เนื่องจากโรคหอบหืดที่ควบคุมไม่ได้ส่งผลต่อทั้งมารดาและทารกในทางที่แย่ลง ดังนั้นควรพิจารณาถึงโทษและประโยชน์จากการใช้ยารักษาโรคหอบหืดอย่างระมัดระวัง (1,5,6)
การดูแลระยะก่อนคลอด (Antepartum Management) (7)
- ให้ความรู้แก่สตรีตั้งครรภ์เรื่องผลกระทบของโรคหอบหืดต่อการตั้งครรภ์ และผลของการตั้งครรภ์ต่อโรคหอบหืด เสริมความมั่นใจในการใช้ยารักษาโรคหอบหืดอย่างต่อเนื่องในขณะตั้งครรภ์ เนื่องจากการรักษาและควบคุมโรคได้มีประโยชน์มากกว่าการหยุดการรักษา
- ประเมินอาการและฟังปอดทุกครั้งที่มาฝากครรภ์
- Ultrasound เพื่อคาดคะเนอายุครรภ์ตั้งแต่ไตรมสาแรกของการตั้งครรภ์ เนื่องจากมีโอกาสเกิด fetal growth restriction หรือ preterm birth ได้
- พิจารณา serial ultrasound เพื่อดูการเจริญเติบโตของทารก โดยเริ่มตั้งแต่อายุครรภ์ 32 สัปดาห์เป็นต้นไป ในรายที่ควบคุมโรคหอบหืดได้ไม่ดี หรือ โรคหอบหืดที่รุนแรงปานกลางถึงรุนแรงมาก และในรายที่ฟื้นตัวจากโรคหอบหืดกำเริบรุนแรง
- พิจารณา antenatal fetal testing ในรายที่โรคหอบหืดรุนแรงปานกลางถึงรุนแรงมากขณะตั้งครรภ์
- Fetal movement count ในสตรีตั้งครรภ์ทุกราย
- Low-dose aspirin prophylaxis for preeclampsia เป็นข้อห้ามในรายที่มีประวัติ aspirin-induced acute bronchospasm เนื่องจากทำให้เกิด life-threatening bronchoconstriction (8)
แนวทางการรักษาโรคหอบหืดเรื้อรัง (Management of Chronic Asthma)
- ให้ความรู้แก่สตรีตั้งครรภ์เกี่ยวกับแนวทางการรักษาทั่วไปของโรคหอบหืด ผลกระทบของโรคต่อการตั้งครรภ์ ความปลอดภัยของยาต่อการตั้งครรภ์ และสังเกตอาการที่บ่งบอกการกำเริบของโรค
- หลีกเลี่ยงปัจจัยกระตุ้นทางสิ่งแวดล้อมที่ทำให้โรคกำเริบ เช่น ฝุ่น ควัน มลภาวะ ไข้หวัดใหญ่ ดังนั้นควรแนะนำให้รับวัคซีนไข้หวัดใหญ่ pneumococcal และ COVID-19
- เลิกสูบบุหรี่ เนื่องจากการสูบบุหรี่ทำให้โรคกำเริบได้มากขึ้นและต้องใช้ยาที่มากกว่าปกติในการคุมอาการ
- ตรวจวัดการทำงานของปอด ด้วย PEFR หรือ FEV1 ในรายที่มีอาการปานกลางและรุนแรงควรวัด FEV1 หรือ PEFR วันละ 2 ครั้ง ค่าที่น่าพอใจ คือ FEV1 > 80% หรือ PEFR 380-550 L/min
- ให้การรักษาด้วยยาเพื่อควบคุมตัวโรคและรักษาการกำเริบของโรค
- รักษาความผิดปกติที่เกี่ยวข้องอื่นๆ เช่น ภาวะซึมเศร้า เยื่อบุโพรงจมูกอักเสบ และกรดไหลย้อน เป็นต้น
การรักษาโรคหอบหืดเรื้อรังมีเป้าหมายเพื่อควบคุมอาการและป้องกันการกำเริบ ซึ่งแนวทางการรักษาด้วยยาแบ่งตามระดับความรุนแรงของอาการเหมือนในสตรีที่ไม่ตั้งครรภ์ แนวทางปฏิบัติที่เป็นมาตรฐานมีหลายแนวทาง ซึ่งในที่นี้จะกล่าวถึงแนวทางปฏิบัติของ National Asthma Education and Prevention Program (NAEPP) 2020 และ แนวทางปฏิบัติของ Global Initiative for Asthma (GINA) 2022
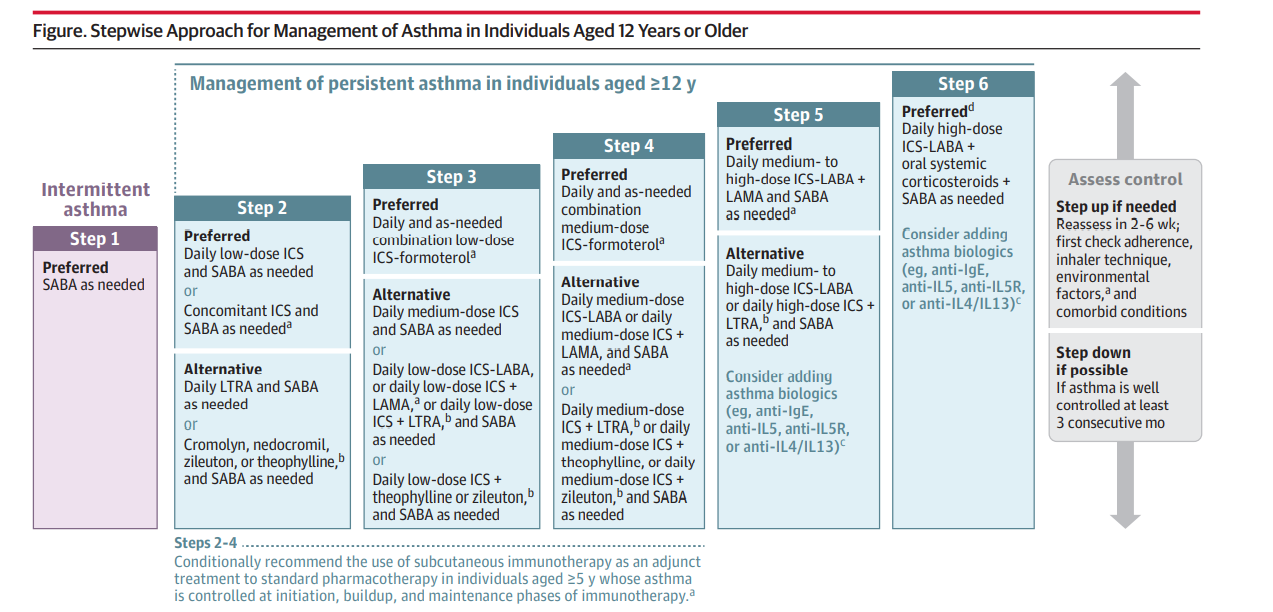
แนวทางการรักษาตาม NAEPP 2020 (9) เป็นแบบ stepwise approach คือ การรักษาจะเพิ่มทีละขั้นจนกว่าจะควบคุมอาการได้ และลดการรักษาที่ละขั้นหลังสามารถควบคุมอาการได้อย่างน้อย 3 consecutive month แบ่ง step การรักษาเป็น 6 step ได้แก่ (รูปที่ 3)
- STEP 1: ใช้ในการรักษา intermittent asthma การรักษาที่แนะนำ คือ การใช้ short-acting β2-agonist (SABA) เป็น rescue therapy
- STEP 2: ใช้ในการรักษา mild persistent asthma การรักษาที่แนะนำ คือ การใช้ daily low-dose inhaled corticosteroids (ICS) ร่วมกับ SABA เป็น rescue therapy หรือ การใช้ ICS ร่วมกับ SABA เป็น rescue therapy
- STEP 3: ใช้ในการรักษา moderate persistent asthma การรักษาที่แนะนำ คือ single maintenance and reliever therapy (SMART) โดยการใช้ low-dose ICS-formoterol เป็นทั้ง daily controller และ rescue therapy เป็นการรักษาหลัก
- STEP 4: ใช้ในการรักษา moderate-to-severe persistent asthma การรักษาที่แนะนำ คือ SMART therapy โดยใช้ medium-dose ICS-formoterol เป็นทั้ง daily controller และ rescue therapy เป็นการรักษาหลัก
- STEP 5: ใช้ในการรักษา severe persistent asthma การรักษาที่แนะนำ คือ daily medium-to high-dose ICS-LABA (long-acting β-agonist) ร่วมกับ LAMA (long-acting muscarinic antagonist) เป็น controller และใช้ SABA เป็น rescue therapy เป็นการรักษาหลัก
- STEP 6: ใช้ในการรักษา uncontrolled severe persistent asthma การรักษาที่แนะนำ คือ daily high-dose ICS-LABA ร่วมกับ oral systemic corticosteroids เป็น controller และใช้ SABA เป็น rescue therapy
รูปที่ 3 Stepwise approach for management of asthma ในคนอายุ 12 ปีขึ้นไป จาก Managing asthma in adolescents and adults 2020 Asthma guideline update from the national asthma education and prevention program, JAMA 2020 (9)
อีกแนวทางการรักษาหนึ่ง คือ แนวทางการรักษาตาม GINA 2022 (2) จะแบ่งการรักษาเป็น 2 track
- Track 1: ใช้ low dose ICS-formoterol เป็น reliever เนื่องจากลดความเสี่ยงในการเกิดการกำเริบได้ดีกว่าการใช้ SABA เป็น reliever และสามารถควบคุมอาการและการทำงานของปอดใกล้เคียงกับการใช้ SABA ดังนั้นควรเลือกใช้ track 1 ในการรักษาเป็นหลัก
- Track 2: ใช้ SABA เป็น reliever ให้ใช้แนวทางนี้เป็นแนวทางเลือกกรณีที่ไม่สามารถรักษาด้วย track 1 ได้ เนื่องจากให้ประสิทธิภาพต่ำกว่าในการลดการกำเริบของโรค ซึ่งถ้าจะใช้แนวทางนี้ต้องแน่ใจว่าผู้ป่วยใช้ controller อย่างสม่ำเสมอ และไม่มีการกำเริบของโรคในช่วง 12 เดือนที่ผ่านมา
การรักษาจะแบ่งการรักษาเป็น 5 step ซึ่งสามารถ step up การรักษาถ้าควบคุมโรคไม่ได้ และ step down การรักษาได้เมื่อควบคุมโรคได้ดี (รูปที่ 4)
- STEP 1-2: ใช้ low dose ICS-formoterol เป็น reliever
- STEP 3: ใช้ low dose ICS-formoterol เป็นทั้ง controller และ reliever
- STEP 4: ใช้ medium dose ICS-formoterol เป็น controller และใช้ low dose ICS-formoterol เป็น reliever
- STEP 5: เพิ่ม long-acting muscarinic antagonists (LAMA) เป็น controller และใช้ low dose ICS-formoterol เป็น reliever
แม้ว่ายาที่ใช้รักษาโรคหอบหืด ยังไม่ทราบ adverse effect ต่อการตั้งครรภ์ที่แน่ชัด แต่การรักษาโรคหอบหืดระหว่างตั้งครรภ์ถือว่ามีประโยชน์มากกว่าความเสี่ยงที่จะเกิดขึ้นถ้ามีอาการกำเริบระหว่างตั้งครรภ์ (2) ซึ่งชนิดของยาและขนาดยารักษาโรคหอบหืดเรื้อรัง เป็นดังรูปที่ 4 (1)
การตรวจติดตามโรคหอบหืดขณะตั้งครรภ์ แนะนำให้ติดตามทุกเดือน แม้ว่าในรายที่ควบคุมอาการได้ดีโดยไม่ต้องใช้ controller หรือไม่มีอาการกำเริบมาก่อนจะมีความเสี่ยงต่ำที่จะเกิดการกำเริบระหว่างตั้งครรภ์ แต่ก็ควรได้รับการตรวจติดตามอย่างใกล้ชิด (2)
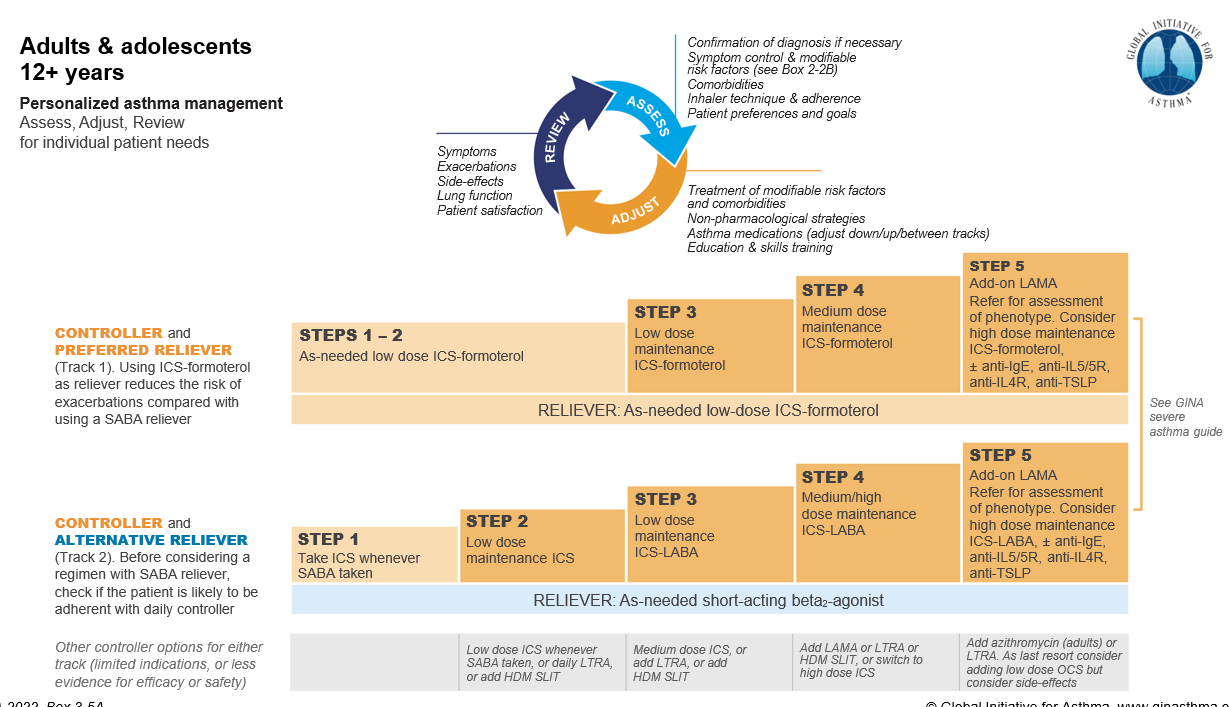
รูปที่ 3 Management of asthma ในคนอายุ 12 ปีขึ้นไป จาก GINA 2022 (2)
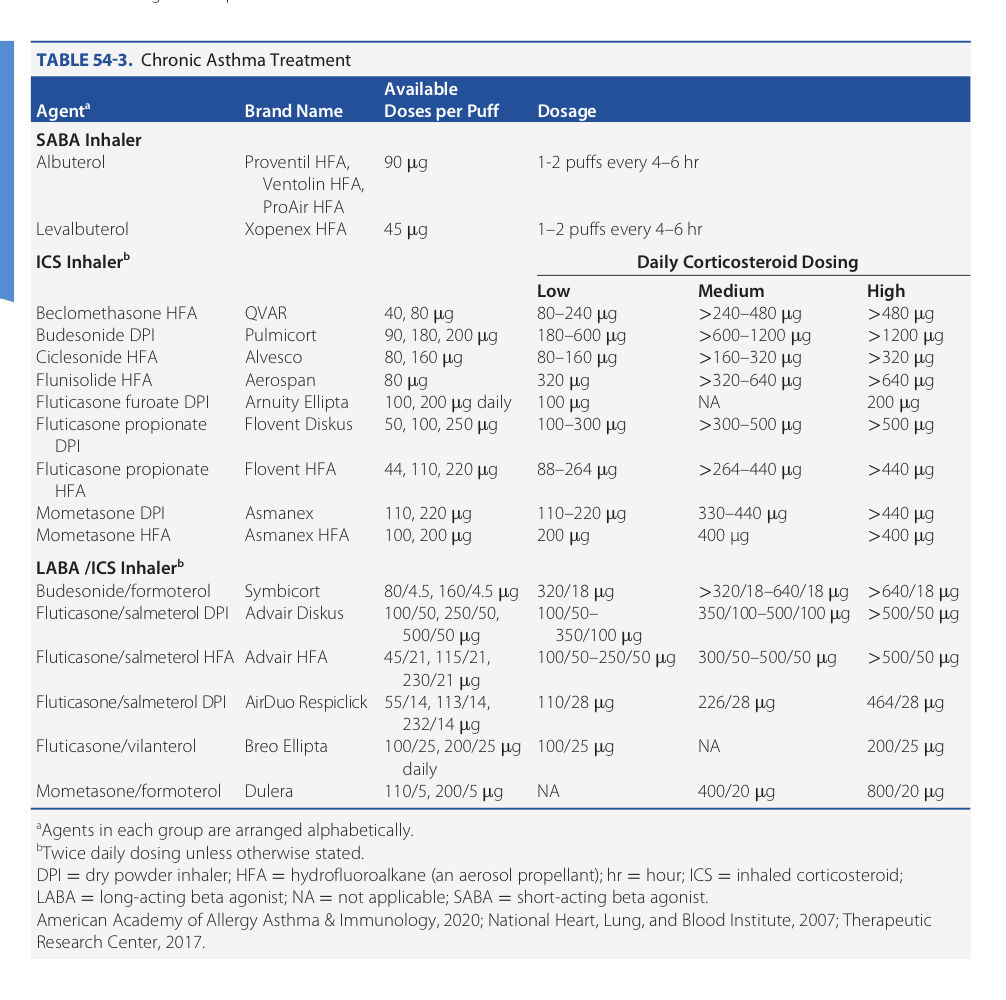
รูปที่ 4 ชนิดและขนาดยาที่ใช้ในการรักษาโรคหอบหืดเรื้อรัง จาก Williams Obstetrics, 26th ed, 2022 (1)
แนวทางการรักษาโรคหอบหืดกำเริบเฉียบพลัน (Management of Acute Exacerbation) (1,2,10)
การรักษาโรคหอบหืดกำเริบเฉียบพลันในสตรีตั้งครรภ์คล้ายกับสตรีไม่ตั้งครรภ์ แต่เกณฑ์การนอนโรงพยาบาลสำหรับสตรีตั้งครรภ์ควรต่ำกว่าสตรีไม่ตั้งครรภ์อย่างชัดเจน เมื่อคนไข้มาโรงพยาบาลด้วยอาการกำเริบควรประเมินสัญญาณชีพและตรวจร่างกายเพื่อประเมินความรุนแรงของการกำเริบ และให้การรักษาตามระดับความรุนแรงนั้นๆ (แผนผังที่ 1) (2)
- Supplement oxygen
ให้ low flow oxygen ผ่าน nasal canulae หรือ mask เพื่อให้ oxygen saturation อยู่ระหว่าง 93-95%
- Maternal position
ควรอยู่ท่านั่งหรือนอนตะแคง มากกว่านอนหงาย โดยเฉพาะไตรมาสที่ 3 ของการตั้งครรภ์ เพื่อหลีกเลี่ยง aortocaval compression จากมดลูกที่โตขึ้นขณะตั้งครรภ์
- Maternal monitoring
- วัด oxygen saturation อย่างต่อเนื่อง
- วัด baseline pulmonary function test (PFT) และวัด PFT หลังรักษา เพื่อดูการตอบสนองต่อการรักษา
- ตรวจ arterial blood gas เพื่อประเมินความรุนแรงของโรค ประเมิน maternal oxygenation, ventilation และ acid-base status แต่ไม่แนะนำทำในทุกราย พิจารณาตรวจ arterial blood gas ในรายที่ PEF or FEV1 < 50% predicted หรือรายที่ไม่ตอบสนองต่อการรักษาเบื้องต้น หรือรายที่มีอาการรุนแรง
- Chest radiograph ไม่แนะนำทำในทุกรายที่มีการกำเริบของโรค ให้ทำในรายที่สงสัย pneumonia, pneumothorax หรือ impending/actual respiratory failure
- Fetal monitoring
Continuous electronic fetal monitoring แต่ก็ขึ้นกับอายุครรภ์ด้วย
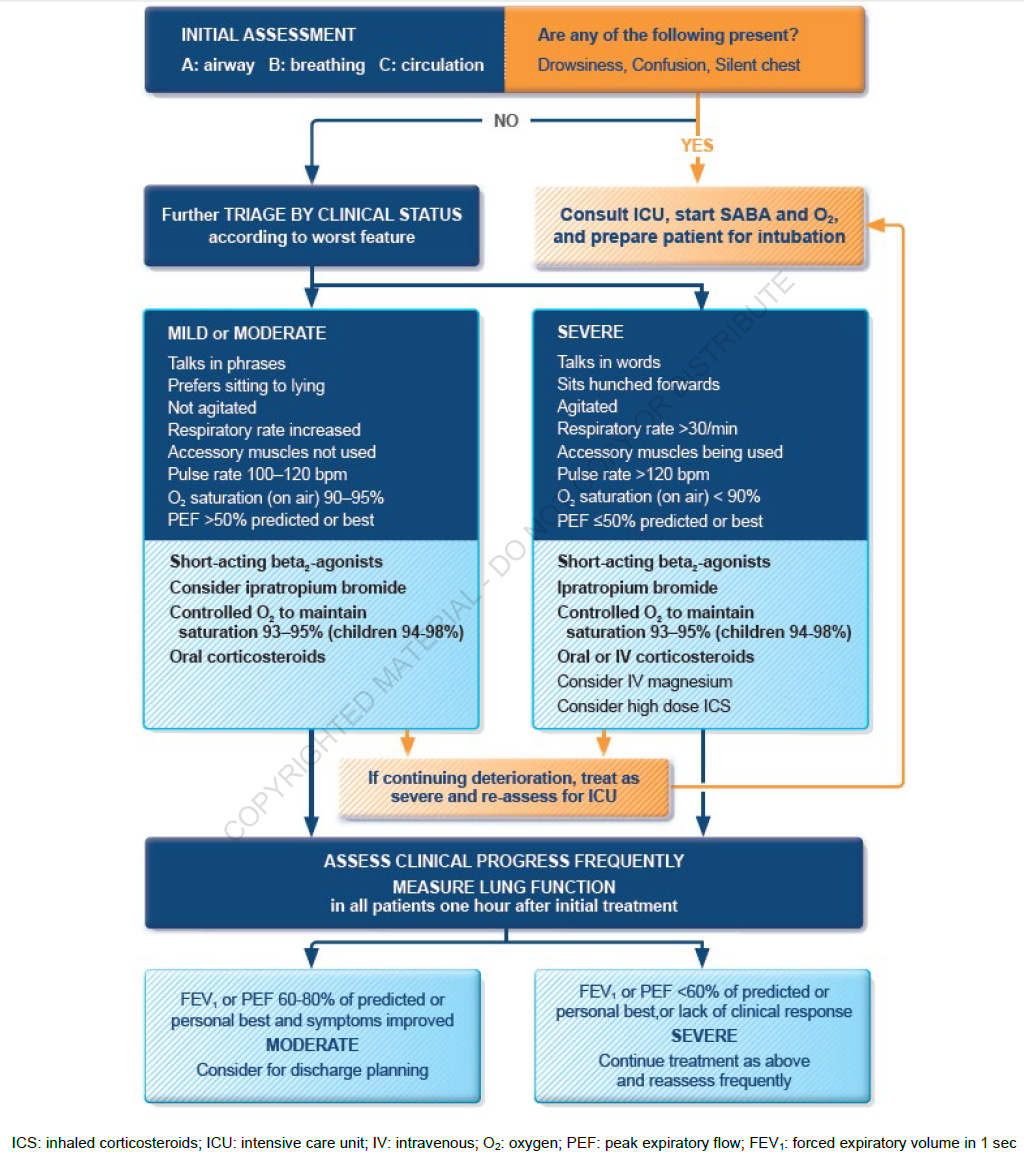
แผนผังที่ 1 แนวทางการรักษาโรคหอบหืดกำเริบเฉียบพลัน จาก GINA 2022 (2)
- Medications
- Inhaled short-acting β2-agonists (SABA) เช่น Albuterol เป็น bronchodilator ที่ใช้เป็น first-line therapy ในการรักษาโรคหอบหืดกำเริบเฉียบพลัน สามารถให้ได้ทั้งแบบ MDI และ nebulizer
- Ipratropium เป็น short-acting anticholinergic ซึ่งการให้ ipratropium ร่วมกับ SABA ในรายที่มี moderate to severe exacerbation สามารถลดอัตราการนอนโรงพยาบาลได้ และ PEF หรือ FEV1 ดีกว่าในรายที่ได้ SABA อย่างเดียว โดยสามารถให้ได้ทั้งแบบ MDI และ nebulizer
- Systemic corticosteroid ช่วยให้การกำเริบหายเร็วขึ้นและป้องกันการกลับเป็นซ้ำ ในสตรีตั้งครรภ์ควรให้ early corticosteroid ร่วมกับ SABA และ oxygen โดยสามารถให้ได้ oral route และ intravenous route ซึ่งแนะนำให้ oral route มากกว่า เนื่องจากไม่ต้องทำหัตการและราคาถูกกว่า จะให้ intravenous route กรณีที่คนไข้หายใจเหนื่อยมากจนไม่สามารถทานยาได้ อาเจียน หรือต้องใส่ท่อช่วยหายใจ
- Intravenous magnesium sulfate ไม่แนะนำให้ให้ทุกรายที่มีอาการกำเริบ แต่อย่างไรก็ตาม การให้ single dose magnesium sulfate 2 g ใน 20 นาที สามารถลดการนอนโรงพยาบาลได้ในผู้ป่วยบางราย รวมถึงมีประโยชน์ในรายที่ FEV1 < 25-30% predicted ตอนแรกรับ และในรายที่ได้รับการรักษาเบื้องต้นแล้วแต่ยังมี persistent hypoxemia อยู่ แต่การให้ในทุกรายไม่ได้เพิ่มประโยชน์เมื่อเทียบกับการรักษาทั่วไป
- Theophylline ไม่ควรใช้ในการรักษาโรคหอบหืดกำเริบแล้ว เนื่องจากมีประสิทธิภาพและความปลอดภัยต่ำ
- Antibiotics ให้เฉพาะรายที่มี lung infection
ขนาดยาและวิธีใช้ตามตารางที่ 2 (10)
ในสตรีตั้งครรภ์ การรักษาอาการกำเริบควรเป็นการรักษาแบบ aggressive ด้วย SABA, oxygen และ early corticosteroid เพื่อป้องกัน fetal hypoxemia หลังการรักษาเบื้องต้น ควรประเมินการตอบสนองต่อการรักษาเป็นระยะ และตรวจ pulmonary function test หลังการรักษา 1 ชั่วโมง เช่น หลังได้ bronchodilator 3 doses เป็นต้น ในรายที่มีอาการรุนแรงไม่ตอบสนองต่อการรักษาหลังได้ intensive bronchodilator และ corticosteroid หรือ status asthmaticus ควรประเมินผู้ป่วยซ้ำอีกครั้ง พิจารณารักษาใน intensive care ในสตรีตั้งครรภ์ควรพิจารณา early intubation กว่าคนทั่วไป (1)

ตารางที่ 2 ขนาดยาและวิธีใช้ จาก Management of asthma during pregnancy www.UpToDate.com (10)
การดูแลระยะคลอด (Intrapartum management) (1,7,10)
- ใช้ controller ต่อตลอดการคลอด และใช้ SABA เป็น reliever เมื่อมีอาการ ไม่จำเป็นต้องให้ stress-dose corticosteroid
- Acute exacerbation ในระยะคลอดพบไม่บ่อยนัก แต่ hyperventilation ขณะเจ็บครรภ์อาจกระตุ้นให้เกิด bronchoconstriction ถ้ามี exacerbation ให้รักษาด้วย SABA
- Oxytocin หรือ prostaglandin E1 หรือ E2 สามารถใช้ cervical ripening และ induction ได้
- Peripartum pain control ควรใช้ non-histamine-releasing narcotic เช่น fentanyl และหลีกเลี่ยง morphine และ meperidine เนื่องจากกระตุ้นให้เกิดการหลั่ง histamine ได้
- Epidural anesthesia เป็นวิธีในอุดมคติที่ใช้ลดอาการปวดระหว่างคลอด เนื่องจากลด oxygen consumption และ minute ventilation และเป็น anesthesia ที่เพียงพอถ้าต้องผ่าตัดคลอด
- ถ้าต้องให้ general anesthesia ควรให้ conduction anesthesia เนื่องจากการใส่ท่อช่วยหายใจกระตุ้นให้เกิด bronchospasm ได้
- Postpartum hemorrhage
- สามารถให้ Oxytocin, prostaglandin E1 หรือ E2 และ methylergonovine ได้
- Prostaglandin F2 alpha เป็นข้อบ่งห้ามในสตรีตั้งครรภ์ที่เป็นโรคหอบหืด เนื่องจากทำให้เกิด bronchospasm
- Sulprostone เป็นข้อบ่งห้ามในสตรีตั้งครรภ์ที่เป็นโรคหอบหืด
- Tranexamic acid สามารถให้ได้
- Tocolytic drugs
- สามารถให้ magnesium sulfate, nifedipine และ terbutaline ได้
- Indomethacin อาจทำให้มี bronchospasm ในผู้ป่วยที่ไวต่อ aspirin ได้
- Antihypertensive drugs
- สามารถให้ hydralazine, nicardipine และ nifedipine ได้
- Labetalol เป็นข้อห้ามในโรคหอบหืด
- Neonatal hypoglycemia อาจเกิดได้โดยเฉพาะ preterm baby ในรายที่มารดาได้ high-dose SABA ภายใน 48 ชั่วโมงก่อนคลอด ดังนั้นควรติดตามระดับน้ำตาลในทารกช่วง 24 ชั่วโมงแรกหลังคลอด
การให้นมบุตร (Breastfeeding)
ยาที่ใช้รักษาโรคหอบหืดผ่านทางน้ำนมเพียงเล็กน้อย การใช้ prednisolone, theophylline, antihistamines, inhaled corticosteroid และ β2-agonist ไม่ได้เป็นข้อห้ามของการให้นมบุตร (7)
เอกสารอ้างอิง
- Cunningham F.G., Lenovo K.J., Dashe J.S., Hoffman B.L., Spong C.Y. and Casey B.M. Williams obstetrics. 26 ed. New York: McGraw-Hill Education; 2022.
- GINA. Global strategy for asthma management and prevention: Global Initiative for Asthma; 2022.
- ธีระ ทองสง. โรคปอดในสตรีตั้งครรภ์. ใน: ธีระ ทองสง.บรรณาธิการ. สูติศาสตร์. ฉบับ 6. กรุงเทพมหานคร: ลักษมีรุ่ง จำกัด; 2021
- Steven E Weinberger MS. Asthma in pregnancy: Clinical course and physiologic changes 2021[updated Nov 30, 2021. Available from: https://www.uptodate.com/contents/asthma-in-pregnancy-clinicacal-course-and-physiologic-change?source=history_widget.
- Eltony S, Blais L. Asthma during pregnancy and congenital malformations: The challenging task of separating the medication effect from asthma itself. J Allergy Clin Immunol. 2016;137(5):1623-4
- Gidaya NB, Lee BK, Burstyn I, Michael Y, Newschaffer CJ, Mortensen EL. In utero Exposure to β-2-Adrenergic Receptor Agonist Drugs and Risk for Autism Spectrum Disorders. Pediatrics. 2016;137(2):e20151316.
- ACOG. Asthma in pregnancy. ACOG practice bulletin number 90. 2008:457-64
- ACOG. Low-dose aspirin use during pregnancy 2018 [updated July 2018. Available from: http://www..acog.org/clinical/clinical-guidance/committee-opinion/articles/2018/07/low-dose-aspirin-use-during-pregnancy.
- Cloutier MM, Dixon AE, Krishnan JA, Lemanske RF, Jr., Pace W, Schatz M. Managing Asthma in Adolescents and Adults: 2020 Asthma Guideline Update From the National Asthma Education and Prevention Program. Jama. 2020;324(22):2301-17.
- Michael Schatz SEW. Management of asthma during pregnancy: UpToDate; 2022 [updated 10 Mar, 2022. Available from: http://www.uptodate.com/contents/management-of-asthma-during-pregnancy?source=history_widget.