ภาวะ Female sexual dysfunction
ภาวะ Female sexual dysfunction
จัดทำโดย : พ.ญ.กานต์ทอง ศิริวัฒน์
อาจารย์ที่ปรึกษา : อ.พญ. ณัฐนิตา มัทวานนท์
ภาวะ Female Sexual Dysfunction คือสภาวะที่จิตใจมีความบกพร่องเรื่องความต้องการทางเพศ และไม่สามารถตอบสนองต่อการกระตุ้นทางเพศได้ตามปกติ ทำให้เกิดปัญหาในการร่วมเพศ หรือเกิดปัญหาในการถึงจุดสุดยอดทางเพศ (orgasm) เป็นผลให้เกิดความวิตกกังวล และความขัดแย้งในคู่สมรส โดยปัญหาทางเพศนี้พบได้มากถึงร้อยละ 40 ในประชากรหญิงทั้งหมดในโลก และพบว่าร้อยละ12 ของผู้ป่วยทั้งหมดเกิดสภาวะความเครียด(1) ความชุกของโรคนี้จะมากขึ้นในประชากรภูมิภาคเอเชียตะวันออกเฉียงใต้ เช่น ประเทศไทย, อินโดนีเซีย, มาเลเซีย, สิงค์โปร์ และฟิลิปปินส์ เป็นต้น (2) โดยในบทความนี้จะขอกล่าวเฉพาะความบกพร่องทางเพศที่พบในเพศหญิงเท่านั้น
กายวิภาคของอวัยวะที่เกี่ยวข้อง
จุดที่มีความไวต่อการสัมผัสในอวัยวะเพศของสตรีนั้นคือ คลิตอริส (Clitoris) โดยคลิตอริส เป็นอวัยวะที่มีความอ่อนไหว ถ้าถูกกระตุ้นสามารถทำให้เกิดความรู้สึกทางเพศและเกิดความสุขสุดยอดได้ คลิตอริสประกอบไปด้วยส่วนของ head, shaft และ rami ซึ่งทอดตัวอยู่ในส่วนของ pubic arch นอกจากนี้ยังมีส่วนอื่น ๆ ที่ไวต่อการกระตุ้นอีก เช่น Periurethral tissue หรือเนื้อเยื่อรอบท่อปัสสาวะที่ทอดตัวอยู่หน้าของช่องคลอด, bulbar tissue เนื้อเยื่อที่อยู่ใต้ต่อ superficial perineal muscle ซึ่งเรียงตัวอยู่ด้านหน้าของช่องคลอดส่วนปลาย ซึ่งบริเวณดังกล่าวนี้หากได้รับการกระตุ้นที่เหมาะสมจะทำให้เกิดการตื่นตัวทางเพศได้ สำหรับ ช่องคลอด (Vagina) พบว่ามีความสำคัญเช่นกันโดยแบ่งส่วนเป็นช่องคลอดส่วนล่าง (lower thirds vagina)และ ช่องคลอดส่วนบน (upper two-thirds) กลไกการถูกกระตุ้นเพื่อการตอบสนองทางเพศจะแตกต่างกัน เมื่อมีการกระตุ้นช่องคลอดส่วนล่าง (lower thirds vagina)โดยการสัมผัสจะทำให้เกิดการตอบสนองทางเพศได้ดี ตรงข้ามกับช่องคลอดส่วนบน (upper two-thirds) จะเกิดการตอบสนองทางเพศได้ดีกว่าเมื่อเป็นการสัมผัสที่มีแรงกด
นอกจากนี้ยังมีบริเวณที่เรียกว่า G-spot เป็นบริเวณที่อยู่ในช่องคลอดส่วนหน้าตำแหน่งกึ่งกลางระหว่าง pubic symphysis และปากมดลูก การกระตุ้นตำแหน่งนี้สามารถทำให้เกิดความสุขสุดยอดได้ โดยในบางรายอาจมีการหลั่งสารคัดหลั่งจาก Skene gland ขณะ orgasm ได้ นอกจากนี้สตรีบางรายอาจมีประวัติปัสสาวะเล็ดเมื่อ orgasm ได้ด้วย เนื่องจากของกล้ามเนื้อ detrusor มีการหดตัว ร่วมกับ กล้ามเนื้อหูรูดกระเพาะปัสสาวะมีการคลายตัว ดังนั้นการมีปัสสาวะเล็ดเมื่อถึงจุดสุดยอดจึงเป็นเรื่องปกติที่ไม่มีความจำเป็นต้องรักษา (3)
วงจรการตอบสนองทางเพศ (Sexual response cycle)
เป็นกลไกที่เกี่ยวกับลำดับการเปลี่ยนแปลงของร่างกายและอารมณ์ที่เกิดขึ้นเมื่อได้รับการกระตุ้นทางเพศ ในปี ค.ศ.1996 William Masters และ Virginia Johnson ได้คิดค้นรูปแบบของวงจรการตอบสนองทางเพศโดยมีชื่อเรียกว่า Master and Johnson’s model (4) โดยแบ่งวงจรของการตอบสนองทางเพศออกเป็น 4 ระยะ
- ระยะความต้องการทางเพศ (Desire or Excitement phase)
- ระยะนี้อาจจะใช้เวลาตั้งแต่เป็นนาทีหรือหลายชั่วโมง
- ระยะนี้จะเริ่มมีลักษณะที่จำเพาะหลายอย่าง เช่น กล้ามเนื้อมีการตึงตัวมากขึ้น, หัวใจเต้นเร็วขึ้น หายใจแรงและเร็วขึ้น, เกิด sex flush หรือการขยายตัวของหลอดเลือด (vasodilation) ที่ผิวหนังบริเวณเต้านมและใบหน้า ทำให้ผิวหนังดูแดงขึ้น, หัวนมแข็งและตั้งชันมากขึ้น, มีเลือดไปเลี้ยงบริเวณอวัยวะเพศมากขึ้นส่งผลให้เกิดการบวมบริเวณคลิตอริส/ช่องคลอด และมีน้ำหล่อลื่นบริเวณอวัยวะเพศ
- ระยะนี้อาจจะใช้เวลาตั้งแต่เป็นนาทีหรือหลายชั่วโมง
- ระยะตื่นตัวทางเพศ (Arousal or Plateau phase)
- ลักษณะทางกายภาพที่เปลี่ยนแปลงได้แก่
-
- ผิวหนังมีความไวต่อการกระตุ้นทางเพศและชุ่มชื้นมากขึ้น
- มีการเปลี่ยนแปลงของการเต้นหัวใจ ความดันโลหิต อุณหภูมิร่างกาย อัตราการหายใจ และ ความตึงตัวของกล้ามเนื้อ
- อวัยวะเพศบวมและบริเวณแคมมีสีแดงเข้มขึ้น
- คลิตอริสบวมและตั้งชัน
- มีน้ำหล่อลื่นจากช่องคลอดเพิ่มขึ้น
- ช่องคลอดส่วนล่างบวมและหนาขึ้นเกิดเป็น orgasmic platform
- เต้านมและหัวนมแข็งตั้งชัน
- Cervicomotor reflex เกิดขึ้นระหว่างมีเพศสัมพันธ์เมื่อองคชาติไปสัมผัสส่วนของปากมดลูกจะเกิดการหดตัวของกล้ามเนื้ออุ้งเชิงกรานทำให้เกิดการบีบรัดที่ส่วนล่างของช่องคลอดและช่องคลอดส่วนบนจะเกิดการโป่งลักษณะคล้ายบอลลูนเพื่อใช้ในการกักเก็บน้ำอสุจิ นอกจากนี้การหดตัวของกล้ามเนื้ออุ้งเชิงกรานจะช่วยให้คงการแข็งตัวของอวัยวะเพศชายได้ด้วย
- มดลูกมีขนาดใหญ่ขึ้นและลอยตัวสูงขึ้นมาจากบริเวณเชิงกราน (ballooning)
-
- ระยะสุดยอดทางเพศ (Orgasm phase)
- เป็นระยะที่สูงสุดของวงจรการตอบสนองทางเพศ (Sexual Response cycle) โดยใช้เวลาสั้นที่สุดคือเพียงประมาณไม่กี่วินาที
- ระยะนี้จะมีการส่งสัญญาณไปยังสมองกระตุ้นทำให้เกิดความพึงพอใจสูงสุด รวมถึงมีการเปลี่ยนแปลงที่เกิดขึ้นดังนี้
-
- การเปลี่ยนแปลงของกล้ามเนื้อเรียบและกล้ามเนื้อลายทำให้เกิดการหดตัวของมดลูกเป็นจังหวะและเกิดการหดตัวของกล้ามเนื้อบริเวณช่องคลอดและรูทวาร ในบางรายอาจมีการเกร็งของมือและเท้า
- เต้านมมีขนาดใหญ่ ลานนมขนาดกว้างขึ้น
- ในสตรีบางราย สามารถถึงจุดสุดยอดได้ง่ายเพียงแค่สัมผัสคลิตอริส หรือการกระตุ้นเต้านมเท่านั้น
-
- การกลับสู่ภาวะปกติ (Resolution phase)
- หลังจากถึงจุดสุดยอดร่างกายจะเริ่มกลับเข้าสู่ภาวะปกติ จะเริ่มรู้สึกผ่อนคลายและมีความสุข กล้ามเนื้ออุ้งเชิงกรานจะคลายตัวลง ร่างกายจะกลับสู่ภาวะปกติใน 5-10 นาที
- สตรีบางรายสามารถกลับเข้าสู่ระยะ Orgasm ได้อีกในระยะเวลาอันสั้น ถ้าได้รับการกระตุ้นทางเพศอย่างต่อเนื่อง และสามารถมี Orgasm ได้หลายๆ ครั้งติดกัน
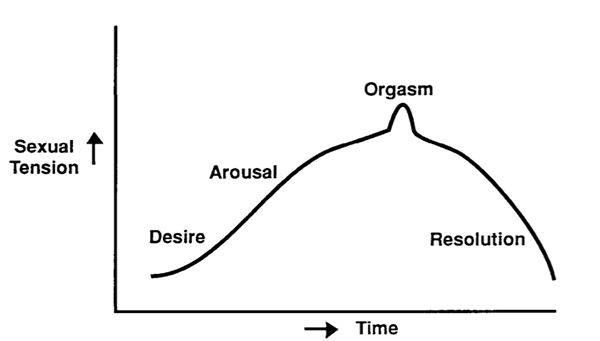
รูปที่1 แสดงวงจรของการมีเพศสัมพันธ์อ้างอิงจากทฤษฎีของ Master and johnson’s model (4)ในปี ค.ศ.1996
จะเห็นได้ว่ากลไกของ William Masters และ Virginia Johnsonเป็นกลไกที่มีลักษณะเป็นเส้นตรงและกล่าวถึงเฉพาะลักษณะทางกายภาพ จนกระทั้งในปี ค.ศ. 2002 Rosemary Basson (5)ได้ปรับวงจรการตอบสนองทางเพศให้ครอบคลุมมากขึ้น โดยเสนอว่า การเกิดวงจรตอบสนองทางเพศนั้นไม่ได้ขึ้นจากความต้องการ (desire) ส่งสัญญาณกระตุ้นไปยังอวัยวะเพศเท่านั้น แต่วงจรทั้งหมดเกี่ยวเนื่องกับการทำงานร่วมกันระหว่างร่างกายและจิตใจ เช่น สภาวะจิตใจ ความสัมพันธ์ระหว่างบุคคล วัฒนธรรม สภาพแวดล้อม ประสบการณ์เรื่องเพศ และลักษณะทางชีววิทยา (ฮอร์โมน, ระบบหลอดเลือด, กล้ามเนื้อ, ระบบสารสื่อประสาท)
ทฤษฎีของ Basson กล่าวว่า แรงจูงใจทางเพศนั้นเป็นสิ่งที่ซับซ้อน เพศสัมพันธ์ของสตรีส่วนใหญ่มักจะเกิดจากความใกล้ชิดและความสัมพันธ์อันดีระหว่างคู่รัก ก่อให้เกิดความเต็มใจที่จะมีเพศสัมพันธ์ นำไปสู่แรงกระตุ้นทางเพศ อย่างไรก็ตามความต้องการทางเพศที่เป็นสัญชาตญาณ สภาวะทางกายเช่นโรคประจำตัว และสภาวะทางจิตใจเช่น ความกลัว หรือประสบการณ์เลวร้ายจากการเคยมีเพศสัมพันธ์ครั้งก่อน ก็มีบทบาทสำคัญต่อความต้องการทางเพศในแต่ละบุคคลด้วย หรือในทางกลับกัน หากสตรีรายหนึ่งไม่มีความต้องการทางเพศ (Desire) ณ ช่วงเวลาหนึ่ง แต่ได้รับการเร้าอารมณ์ทางเพศอย่างเหมาะสม ก็อาจมีความต้องการขึ้นมาเพิ่มเติมในช่วงนี้ได้ สำหรับการถึงจุดสุดยอดนั้น Basson เสนอว่าแม้บางคนอาจมีความพึงพอใจจนถึงจุดสุดยอด แต่การถึงจุดสุดยอดก็ไม่ใช่เรื่องจำเป็นเสมอไปสำหรับผู้หญิงทุกคน หากแต่ประสบการณ์ที่ดีตลอดการมีเพศสัมพันธ์ต่างหากที่จะทำให้เกิดความพึงพอใจทางเพศ เช่น รู้สึกมีความใกล้ชิด มีความสุข และไม่เกิดความรู้สึกต่อต้านการมีเพศสัมพันธ์ จะนำไปสู่การตอบรับและเกิดแรงจูงใจในการมีเพศสัมพันธ์ในครั้งต่อไป ดังนั้นวงจรของ Bassen จึงเป็นวงกลมที่มีการตอบสนองกันไปเรื่อย ๆ ต่างจากของ Master and Johnson ที่เป็นแบบเส้นตรงทางเดียว
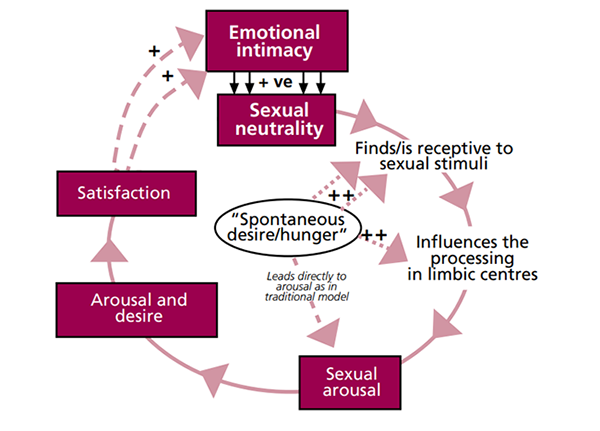
รูปที่1 แสดงวงจรของการมีเพศสัมพันธ์อ้างอิงจากทฤษฎีของ Basson model(5) ตีพิมพ์ในปี ค.ศ.2002
ฮอร์โมนที่เกี่ยวข้องกับการตอบสนองทางเพศ
- เอสโตรเจน (Estrogen)
เอสโตรเจน เป็นฮอร์โมนที่มีส่วนสำคัญต่อวงจรการตอบสนองทางเพศ การลดลงของระดับเอสโตรเจนในช่วงวัยใกล้หมดประจำเดือนและหมดประจำเดือน ทำให้เยื่อบุผิวมีความบางลงและเลือดมาเลี้ยงน้อยลงในบริเวณ vulvovaginal tissue ได้แก่ แคม ช่องคลอด ท่อปัสสาวะ และกระเพราะปัสสาวะ ทำให้เกิดความแห้งและระคายเคือง อาจรู้สึกแสบร้อนได้ นอกจากนี้การที่เลือดมาเลี้ยงน้อยลงทำให้ vasocongestion ในช่วงการเร้าอารมณ์ลดลง ทำให้สร้างสารคัดหลั่งได้น้อยลง จึงเกิดการแห้งและเจ็บเวลามีเพศสัมพันธ์ได้ นอกจากนี้ยังก่อให้เกิดความผิดปกติของการปัสสาวะได้ เช่นปัสสาวะบ่อย ติดเชื้อที่ระบบปัสสาวะส่วนล่างง่ายเป็นต้น โดยภาวะ genitourinary syndromes of menopause (GSM) นี้ก็เป็นสาเหตุหนึ่งของภาวะ female sexual dysfunction ที่พบได้บ่อย (6)
- แอนโดรเจน (Androgen)
แอนโดรเจนมีความสำคัญในเรื่องของเพศอย่างมาก โดยจะช่วยเรื่องความต้องการทางเพศ แต่ยังไม่ทราบกลไกที่แน่ชัด (7) ในสตรีนั้น ฮอร์โมนแอนโดรเจนจะถูกสร้างจากรังไข่และต่อมหมวกไต โดยปริมาณการสร้างจะลดลงตลอดช่วงอายุขัย โดยฮอร์โมนแอนโดรเจนหลักในร่างกายคือ testosterone
ร้อยละ 98 ของ Testosterone ในร่างกายจะอยู่ในรูปที่จับอยู่กับโปรตีน (Sex-hormone binding globulin or albumin) ซึ่งไม่สามารถออกฤทธิ์ได้ เหลือเพียงเล็กน้อยที่อยู่ในรูปอิสระซึ่งเป็นรูปแบบที่ออกฤทธิ์ได้ ดังนั้นบางภาวะเช่น การตั้งครรภ์ หรือการรับประทานยาคุมกำเนิด ซึ่งลดระดับ free testosterone ลง จึงอาจมีผลกับความรู้สึกทางเพศได้
การประเมินผู้ป่วยที่มีภาวะบกพร่องทางเพศ
สตรีจำนวนมากไม่กล้าปรึกษา หรือ พูดคุยเรื่องปัญหาทางเพศกับแพทย์ผู้ให้การรักษา และในทางกลับกันแพทย์บางท่านก็มีความลำบากใจในการพูดคุยถึงเรื่องเพศกับผู้ป่วย แต่ในความเป็นจริงปัญหาทางเพศเป็นปัญหาที่พบบ่อยแพทย์จึงควรสอบถามเรื่องปัญหาทางเพศกับผู้ป่วยเสมอ นอกจากปัญหาเรื่องเพศแล้วแพทย์จะได้ข้อมูลเกี่ยวกันความเสี่ยงของโรคติดต่อทางเพศสัมพันธ์ ได้แนะนำในเรื่องการคุมกำเนิด ได้ประเมินในเรื่องการมีเพศสัมพันธ์แบบปลอดภัย และได้ประเมินความคิดเกี่ยวกับการมีเพศสัมพันธ์ รวมทั้งค้นหาภาวะความบกพร่องทางเพศที่อาจเกิดขึ้น (3, 8)
หลักการในการซักประวัติผู้ป่วยนั้นจะต้องมีการสร้างความเป็นมิตรแก่ผู้ป่วยและใช้คำถามปลายเปิดเช่น “คุณมีความกังวลในเรื่องเพศ มีปัญหาเช่นการเจ็บปวดระหว่างมีเพศสัมพันธ์ หรือไม่มีความสุขขณะมีเพศสัมพันธ์หรือไม่” และจะต้องมีทักษะในการฟังที่ดี รวมทั้งการค้นหาตัวชี้นำจากท่าทางของผู้ป่วย โดยข้อมูลที่ต้องการทราบนั้นจะต้องประเมินแบบองค์รวมคือประเมินทั้งด้านชีววิทยา จิตวิทยา สังคมรวมถึงสิ่งแวดล้อมของผู้ป่วยและคู่นอน ให้ครอบคลุมสาเหตุของภาวะบกพร่องทางเพศดังแสดงใน ตารางที่ 1
ตารางที่ 1 ปัจจัยเสี่ยงที่ทำให้เกิดความบกพร่องทางเพศ (9)
| Psychological |
|
| Gynecologic issues |
|
| Medical conditions |
|
| Other |
|
หลักในการตรวจร่างกาย (3)
- ตรวจร่างกายครบทุกระบบ เช่น ลักษณะของโรคเรื้อรังเช่นโรคซีด โรคหัวใจเต้นช้า โรคไทรอยด์ต่ำ หรือโรคของเนื้อเยื่อเกี่ยวพัน เช่น Sclerodema ที่อาจทำให้เกิดภาวะช่องคลอดแห้งได้ เป็นต้น
- ตรวจหาลักษณะภายนอกของอวัยวะเพศ เช่น ความเบาบางของขนหัวเหน่าที่แสดงถึงภาวะฮอร์โมนเพศชายต่ำ การมองหาความผิดปกติบริเวณอวัยวะเพศภายนอกเช่น Lichen sclerosis ที่อาจทำให้เกิดการเจ็บช่วงมีเพศสัมพันธ์ การดูบาดแผลและความผิดปกติของรูปร่างของอวัยวะเพศเป็นต้น
- ตรวจลักษณะของปากช่องคลอด (introitus) คือการหาลักษณะความผิดปกติ ลักษณะของภาวะเอสโตรเจนต่ำ เช่น ผิวบริเวณอวัยวะเพศภายในมีสีซีด ขาดความยืดหยุ่น มีจุดจ้ำเลือด ดูความผิดปกติของเยื่อพรหมจรรย์ ดูว่ามีก้อนยื่นเช่น cystocele, rectocele หรือไม่ นอกจากนี้ควรดูสีของสารคัดหลั่งหรือตกขาวที่ออกมาจากช่องคลอดร่วมด้วย
- ตรวจภายใน ดูในเรื่องของความแข็งแรงของกล้ามเนื้ออุ้งเชิงกราน, คลำหาจุดกดเจ็บเมื่อกดลงไปที่กล้ามเนื้อ deep levator ani
- ตรวจ bimanual examination คลำหาก้อนหรือจุดกดเจ็บที่บริเวณ Cul de sac หรือ vagina fornix จนถึง uterosacral ligament เพื่อหาสาเหตุที่ทำให้เกิดการปวดขณะมีเพศสัมพันธ์
การตรวจทางห้องปฏิบัติการ
การตรวจทางห้องปฏิบัติการนั้นทำเฉพาะในกรณีที่มีข้อบ่งชี้จากการซักประวัติและตรวจร่างกาย ไม่จำเป็นต้องทำในทุกกรณี การตรวจหาค่า Androgen levels, Estradiol level หรือค่าฮอร์โมนอื่น ๆ เช่น follicle-stimulating hormone ไม่สามารถใช้ในการวินิจฉัยโรคนี้ได้ (10)
การวินิจฉัยโรคความบกพร่องทางเพศ
อ้างอิงจาก American psychiatric association’s diagnostic and statistical manual of mental disorder : DSM-5 ได้แบ่งโรคในกลุ่มนี้เป็น 3 กลุ่มใหญ่ๆได้แก่ (11)
- ความผิดปกติในระยะความต้องการและความตื่นตัวทางเพศ (Female Sexual Interest/ Arousal Disorder, FSIAD)
เกณฑ์วินิจฉัยต้องมีอาการเข้าได้อย่างน้อย 3 ข้อ จาก 6 ข้อ ดังนี้
-
- มีความสนใจในเรื่องการมีเพศสัมพันธ์ลดลงหรือไม่มีความสนใจในการมีเพศสัมพันธ์เลย
- มีความคิดหรือจินตนาการเรื่องเพศสัมพันธ์ลดลงหรือไม่มีเลย
- มีการเริ่มต้นหรือตอบรับการมีเพศสัมพันธ์ลดลงหรือไม่มีเลย
- ความตื่นเต้นหรือความพึงพอใจระหว่างการมีเพศสัมพันธ์ลดลงตลอดเวลา หรือลดลงประมาณร้อยละ 75 ระหว่างการมีเพศสัมพันธ์
- ความสนใจหรือความรู้สึกเร้าอารมณ์เมื่อมีการกระตุ้นทางเพศลดลง หรือขาดหายทั้งจากกการกระตุ้นภายในและภายนอก
- ความรู้สึกที่บริเวณอวัยวะเพศและบริเวณอื่น ๆ ลดลงระหว่างมีเพศสัมพันธ์ทั้งหมด หรือร้อยละ 75 ขณะมีเพศสัมพันธ์
โดยจะต้องมีอาการต่อเนื่องอย่างน้อย 6 เดือน และสร้างความเครียดให้แก่ผู้ป่วยและคู่นอนอย่างมีนัยยะสำคัญ รวมถึงอาการเหล่านี้จะต้องไม่เกี่ยวกับความผิดปกติทางจิตใจอื่น ๆ และไม่เกี่ยวข้องกับความเครียดระหว่างคู่นอน เช่น การใช้ความรุนแรง รวมถึงไม่เกี่ยวข้องกับการใช้ยาหรือสารเสพติด
- ภาวะความผิดปกติในระยะสุดยอดทางเพศ (Female orgasmic disorder, FOD)
เกณฑ์วินิจฉัยต้องมีอาการอย่างน้อย 1 ใน 2 โดยมีอาการทุกครั้งหรืออย่างน้อยร้อยละ75 ในช่วงที่มีเพศสัมพันธ์
-
- ไม่สามารถถึงจุดสุดยอดได้เลย หรือถึงช้า
- มีการลดลงของความแรง (intensity) ของการถึงจุดสุดยอด
โดยจะต้องมีอาการต่อเนื่องอย่างน้อย 6 เดือน และสร้างความเครียดให้แก่ผู้ป่วยและคู่นอนอย่างมีนัยยะสำคัญ
- ภาวะเจ็บปวดบริเวณอวัยวะเพศหรือช่องท้องส่วนล่างเมื่อพยายามสอดใส่ (Genito–pelvic pain/penetration disorder, GPPPD)
เกณฑ์วินิจฉัยจะต้องมีอาการอย่างน้อย 1 ใน 4 ข้อดังนี้
3.1 มีความยากลำบากเมื่อมีการสอดใส่ทางช่องคลอดขณะมีเพศสัมพันธ์
3.2 มีอาการเจ็บปวดบริเวณช่องคลอดและอุ้งเชิงกรานระหว่างมีการสอดใส่ หรือ มีเพศสัมพันธ์ หรือ มีอาการเจ็บปวดบริเวณอุ้งเชิงกราน
3.3 มีความกังวลและหวาดกลัวกับการเจ็บปวดบริเวณอวัยวะเพศอันเป็นผลจากการถูกสอดใส่ที่บริเวณช่องคลอด
3.4 มีการหดตัวหรือบีบรัดที่บริเวณกล้ามเนื้ออุ้งเชิงกรานเมื่อพยายามสอดใส่เข้าไปในช่องคลอด
โดยอาการดังกล่าวจะต้องคงอยู่อย่างน้อย 6 เดือนและสร้างความเครียดให้แก่ผู้ป่วยและคู่นอนอย่างมีนัยยะสำคัญ
การดูแลรักษาสตรีที่มีภาวะ Female Sexual Dysfunction
สตรีที่มีภาวะบกพร่องทางเพศนั้นควรได้รับการดูแลแบบองค์รวมทั้งด้านร่างกายและจิตใจ สำหรับหลักการในการดูแลสตรีกลุ่มนี้นั้นมีหลักการดังนี้
- ให้การประเมินและวินิจฉัยได้อย่างถูกต้อง
- ประเมินเป้าหมายของการรักษา เนื่องจากแต่ละรายอาจมีเป้าหมายต่างกัน
- แนะนำและให้ความรู้ที่เหมาะสม เพื่อสร้างความเข้าใจในตัวโรค
- ให้ความรู้และความเข้าใจแก่คู่นอน
- รักษาปัญหาที่เกี่ยวข้องทั้งหมด เช่น ปัญหาทางกาย และปัญหาทางจิตใจ
- ใช้ทีมสหวิชาชีพในการดูแลรักษาและดูแลผู้ป่วยแบบองค์รวม
ในสตรีเหล่านี้มีหลากหลายกรณีที่มีปัญหาเรื่องเพศสัมพันธ์เนื่องจากขาดความรู้ ขาดประสบการณ์ มีความเข้าใจผิดและขาดการสื่อสารระหว่างคู่นอนที่เหมาะสม ดังนั้นหากสูตินรีแพทย์พบเจอผู้ป่วยกลุ่มนี้ ควรให้ความรู้เกี่ยวกับวงจรของเพศสัมพันธ์เพื่อหาต้นตอของปัญหาและใช้กลไกของวงจรเพศสัมพันธ์เพื่อให้ผู้ป่วยและคู่ครองสามารถเข้าใจกันและกัน จนสามารถแก้ปัญหาให้ตรงสาเหตุได้
เพื่อให้การดูแลผู้ป่วยได้อย่างเหมาะสม สูตินรีแพทย์ควรใช้หลัก PLISSIT model ในการดูแลและเข้าถึงปัญหาของผู้ป่วยโดย PLISSIT model มีหลักการดังนี้
- Permission คือการขอความอนุญาตในการพูดคุยเกี่ยวกับปัญหาที่เป็นเรื่องส่วนตัวของผู้ป่วย หากผู้ป่วยเปิดใจและกล้าพูดคุยเกี่ยวกับปัญหาของตนเอง ก็จะทำให้การประเมินปัญหานั้นแม่นยำ และตรงประเด็นมากขึ้น โดยผู้รักษาควรให้ความมั่นใจแก่ผู้ป่วยว่าความคิด พฤติกรรม และสิ่งที่วิตกกังวลนั้นเป็นเรื่องปกติและเข้าใจได้
- Limited Information คือแพทย์ให้ข้อมูลความถูกต้องเกี่ยวกับสรีรวิทยาของเรื่องเพศและพฤติกรรมทางเพศ โดยความรู้นั้นจะต้องกระชับ และตรงจุด ไม่ยาวเกินไป เพื่อให้คนไข้และคู่นอนสามารถทำความเข้าใจได้เพื่อลดความเข้าใจผิด ปัญหาที่เกิดจากการขาดความรู้ จะถูกแก้ไขได้ในขั้นตอนนี้
- Specific Suggestion ขั้นตอนนี้คือการแก้ไขปัญหาที่เฉพาะเจาะจงของผู้ป่วย โดยการปรับทัศนะคติ การฝึกปฏิบัติ การแนะนำวิธีการกระตุ้นทางเพศที่เหมาะสม และตรวจหาความผิดปกติทางด้านจิตใจของผู้ป่วยรวมถึงปัญหาระหว่างคู่ครอง ขั้นตอนนี้อาจให้การรักษาด้วยยาหรือฮอร์โมน
- Referral for Intensive Therapy ขั้นตอนนี้จะจำเป็นในบางกรณี เช่น ผู้ที่มีความจำเป็นต้องส่งต่อไปยังผู้เชี่ยวชาญเฉพาะทาง เช่น ผู้ป่วยมีความผิดปกติทางจิตใจจากความรุนแรงในอดีตทำให้ไม่สามารถมีความสุขทางเพศได้ อาจต้องส่งพบนักจิตวิทยา หรือจิตแพทย์ หรือในบุรุษที่มีความบกพร่องทางเพศซึ่งเกิดจากปัญหาทางกายที่ต้องส่งต่อเพื่อรับการรักษากับแพทย์เฉพาะทางเป็นต้น
โดยการดูแลรักษาผู้ที่มีภาวะนี้จะต้องใช้เวลา และต้องมีการติดตามการรักษาต่อเนื่องยาวนานจึงจะได้ผลดี ดังนั้นการพูดคุยและให้กำลังใจในการรักษา และรักษาอย่างคอยเป็นค่อยไปจึงมีความสำคัญเป็นอย่างมาก
การดูแลรักษาผู้ป่วยที่มีภาวะความผิดปกติในระยะความต้องการและระยะตื่นตัวทางเพศ (Female Sexual Interest/ Arousal Disorder, FSIAD)
สูตินรีแพทย์ควรเริ่มต้นการรักษาเบื้องต้นด้วยการให้ความรู้เกี่ยวกับวงจรเพศสัมพันธ์ และความผิดปกติในระยะต่าง ๆ การให้ความรู้อาจจะช่วยสร้างความเข้าใจแก่ผู้ป่วยและคู่นอนได้ นอกจากนี้การรักษาที่พบว่ามีประโยชน์คือการรักษาด้วย cognitive behavioral therapy คือการรักษาด้วยจิตบำบัด โดยให้พูดคุยกับนักจิตบำบัดหรือจิตแพทย์เพื่อให้ผู้ป่วยเข้าใจเกี่ยวกับความคิดและความเชื่อ หรือการรับรู้ของตนเองที่อาจมีความผิดเพี้ยนไปจากความจริงเพื่อนำไปสู่การปรับเปลี่ยนพฤติกรรม โดยการรักษาแบบนี้ได้ถูกแนะนำโดย International consultantation on sexual medicineในปี ค.ศ.2015 ว่ามีความเหมาะสมในการรักษาผู้ป่วยกลุ่มนี้โดยให้คำแนะนำ Grade B
ส่วนการรักษาด้วยยาในภาวะมีความต้องการทางเพศน้อยเกินไปนั้นที่นิยมใช้มีดังนี้
- Estrogen therapy การใช้ยาประเภทนี้นิยมใช้ในรูปแบบฮอร์โมนต่ำเฉพาะที่ หรือ Low dose vaginal therapy ใช้ในการรักษาผู้ที่มีภาวะบกพร่องทางเพศในผู้ที่เข้าสู่วัยทองและมีภาวะ genitourinary syndrome of menopause (GSM) สำหรับการใช้ยารูปแบบรับประทานหรือ low dose systemic hormone therapy ทั้งกลุ่มของฮอร์โมนเอสโตรเจนอย่างเดี่ยว หรือ ฮอร์โมนรวม (เอสโตรเจนและโปรเจสติน) ก็สามารถใช้เป็นทางเลือกได้ในกลุ่มวัยหมดประจำเดือน ส่วนยาอีกประเภทคือ Selective estrogen receptor modulator (SERM) เช่นยา Ospemifene เป็นการรักษาทางเลือกอีกทางในการักษาสตรีวัยทองที่มีภาวะช่องคลอดแห้งหรือมีภาวะ GSM แต่ไม่นิยมให้ใช้ในการรักษาผู้ป่วยที่มีภาวะบกพร่องทางเพศ อย่างไรก็ตามการใช้ฮอร์โมนเอสโตรเจนในสตรีวัยเจริญพันธุ์นั้นไม่พบว่าช่วยให้อาการดีขึ้น
- Androgen therapy หลักฐานทางการศึกษาเกี่ยวกับการใช้ androgen ในกลุ่ม FSIAD ยังไม่สามารถสรุปได้แน่ชัดในปัจจุบัน ดังนั้นองค์การอาหารและยาของอเมริกายังไม่แนะนำให้ใช้ยากลุ่มนี้เพื่อรักษาภาวะ FSIAD อย่างไรก็ตาม ACOG และ Endocrine society แนะนำว่า androgen ชนิดทาหรือแผ่นแปะผิวหนัง (transdermal testosterone) มีประโยชน์และสามารถใช้ได้ในระยะเวลาสั้น ๆ เพื่อเพิ่มความต้องการทางเพศในสตรีวัยทอง (8) ส่วนรูปแบบรับประทานไม่แนะนำให้ใช้ในการรักษาผู้ป่วยเนื่องจากมีความเป็นพิษต่อตับ สำหรับผลข้างเคียงของการใช้ยากลุ่มนี้ค่อนข้างมาก คือ อาจเกิดภาวะขนดก สิวขึ้น มีความเป็นชายเพิ่มขึ้นเช่นเสียงใหญ่ขึ้น มีคลิตอริสขนาดใหญ่ ดังนั้นหากจะใช้ยากลุ่มนี้แนะนำให้ใช้ระยะสั้นคือ 3-6 เดือน และก่อนการเริ่มยาควรมีการตรวจระดับ Testosterone ในเลือดไว้เป็นพื้นฐาน และประเมินซ้ำหลังจากใช้ยาใน 3-6 อาทิตย์ และ 6 เดือนหลังการรักษา หากพบว่าใช้ยาแล้วไม่ได้ผล ควรหยุดยาใน 6 เดือน สำหรับรายที่ไม่ได้รับการรักษาด้วยยา ไม่แนะนำให้เจาะเลือดเพื่อตรวจวัดระดับ testosterone เนื่องจากไม่มีความจำเป็น (12)
- Flibanserin หรือยากลุ่ม serotonin receptor agonist/antagonist เป็นการรักษาทางเลือกในกลุ่มสตรีวัยเจริญพันธุ์ที่มีภาวะ hypoactive sexual desire disorder ยากลุ่มนี้จะเพิ่มการหลัง dopamine และ norepinephrine และลดการหลั่ง serotonin โดยต้องใช้ในรายที่ไม่มีภาวะซึมเศร้าร่วมด้วยเท่านั้น และการใช้ยากลุ่มนี้ต้องมีการแนะนำว่าห้ามใช้ร่วมกับการดื่มแอลกอฮอล์ ผลข้างเคียงของยาทำให้เกิดอาการเวียนศีรษะ ง่วงนอน คลื่นไส้ อ่อนแรง ความดันโลหิตต่ำได้
สำหรับการใช้ยานี้ในกลุ่มสตรีวัยหมดระดูที่มีภาวะ FSIAD พบว่าผลลัพธ์ไม่ดีนักและยังไม่ได้รับการรับรองจากองค์การอาหารและยาของอเมริกา (8) - Sildenafil หรือยากลุ่ม phosphodiesterase type 5 inhibitor เป็นยาที่มีการนำมาศึกษาในกลุ่มผู้ป่วย FSIAD อยู่บ้างเนื่องจากเชื่อว่า ยากลุ่มนี้อาจเพิ่มปริมาณเลือดที่ไปเลี้ยงบริเวณคลิตอริส และ ช่องคลอดได้ คล้ายกับหลักการในการรักษาการเสื่อมสมรรถภาพทางเพศชาย แต่ผลการศึกษายังไม่ชัดเจนจึงยังไม่มีการรับรองใช้ใช้ยานี้เพื่อรักษาภาวะ FSIAD จากองค์การอาหารและยาของอเมริกา ผลข้างเคียงของยาได้แก่ ปวดศีรษะ ผิวแดง คัดจมูก และอาจมีภาวะบกพร่องทางการมองเห็นชั่วคราว (8)
การดูแลรักษาผู้ป่วยที่มีภาวะความผิดปกติในระยะสุดยอดทางเพศ (orgasmic dysfunction)
ภาวะ orgasmic dysfunction ส่วนใหญ่มักเกิดขึ้นภายหลังร่วมกับโรคทางกายอื่น ๆ เช่น ความเจ็บป่วยทางกาย หรือภาวะทางจิตใจต่าง ๆ โดยมักพบร่วมกับภาวะ FSIAD หรือ GPPPD ในบางรายภาวะ orgasmic dysfunction นี้อาจจะเกิดเดี่ยว ๆ ได้ โดยมักเป็นความผิดปกติทางระบบประสาท เช่นการบาดเจ็บของเส้นประสาทที่เกิดจากการผ่าตัด หรือการฉายแสง หรือการใช้ยาบางชนิด
บางครั้งภาวะนี้เกิดจากมีความกังวลและหมกมุ่นในการสังเกตุตัวเองมากเกินไป รวมถึงมีการสังเกตตัวเองตลอดเวลาในช่วงระยะการเร้าอารมณ์ บางรายอาจมีความกังวล คิดลบเกี่ยวกับเรื่องเพศ หรือดูถูกตนเอง ซึ่งวิธีการรักษาที่พบว่ามีประโยชน์ในผู้ป่วยกลุ่มนี้คือการทำ sexual skill training คือ การให้คำแนะนำ ปรับทัศนคติเกี่ยวกันเรื่องเพศ เพื่อให้คนไข้จัดการกับความคิดด้านลบ เช่นความรู้สึกว่าการมีเพศสัมพันธ์เป็นเรื่องผิดบาป และการกระตุ้นตนเองในจุดที่เหมาะสม อาจจะเริ่มจากการจินตนาการที่กระตุ้นอารมณทางเพศได้ หรือการ Masturbation เป็นต้น นอกจากนี้การฝึกการสื่อสารระหว่างคู่นอน หรือการทำ sensate focus exercise ก็สามารถช่วยให้อาการดีขึ้นได้ นอกจากนี้ในปี 2000 FDA ได้รับรองอุปกรณ์ที่ใช้กระตุ้นบริเวณ Clitoris ซึ่งมีกลไกคือการดูดบริเวณ clitoris เพื่อเพิ่มเลือดมาเลี้ยงบริเวณดังกล่าว เพื่อใช้สำหรับ FOD ได้ด้วย (แต่ในประเทศไทยยังไม่สามารถนำเข้าและใช้อย่างถูกกฎหมายได้)
การดูแลรักษาผู้ป่วยที่มีภาวะเจ็บปวดบริเวณอวัยวะเพศหรือช่องท้องส่วนล่างเมื่อพยายามสอดใส่ (Genito-pelvic pain/penetration disorder, GPPPD)
Dyspareunia คือ ภาวะที่มีอาการเจ็บปวดที่อวัยวะเพศเกิดขึ้นระหว่างหรือหลังประกอบกิจทางเพศสำเร็จอาการอาจเป็นตลอดเวลาหรือหายแล้วกลับมาเป็นซ้ำอีก
Vaginismus หรือ Vaginistic คือ ภาวะที่มีความยากลำบากในการสอดใส่องคชาติหรือสิ่งต่างๆเช่นผ้าอนามัยเข้าไปในช่องคลอด ร่วมกับมีการหดเกร็งตัวแน่นอย่างไม่ตั้งใจของกล้ามเนื้อรอบปากช่องคลอดส่วนล่าง หรือ Levator Ani Muscle อาการนี้อาจเป็นตลอดเวลา หรือหายแล้วกลับมาเป็นซ้ำได้ ทำให้สตรีที่มีอาการไม่สามารถสอดใส่สิ่งใดเข้าไปในช่องคลอดได้เลยเช่น ผ้าอนามัยแบบสอด หรือ นิ้วมือ โดยภาวะนี้นี้อาจใช้ในความหมายของการรัดแน่นหลังจากมีความเจ็บปวดหลังมีเพศสัมพันธ์ก็ได้ และการจะวินิจฉัยว่ามีภาวะนี้จะต้องไม่มีความผิดปกติทางกายวิภาคอื่น ๆ (13)
สำหรับ Genito-pelvic pain/penetration disorder หรือ GPPPD เป็นการวินิจฉัยด้วยระบบใหม่ ที่เป็นกลุ่มโรคใหญ่และมีโรคอื่น ๆ แยกย่อยได้แก่ออกไป รวมไปถึงอาการ Dyspareunia และ Vaginismus ด้วย โดยแบ่งเป็น provoked vestibulodynia, genitourinary syndrome of menopause, pelvic muscle reflexive hypertonicity
เมื่อผู้ป่วยมาด้วยอาการ GPPPD มีหลักการดูแลดังนี้
- ประเมินผู้ป่วยด้วยหลักการ PLISSIT เพื่อหาสาเหตุและปัญหาที่ผู้ป่วยและคู่นอนมีอย่างรอบด้าน
- วางแผนการรักษาและกำหนดเป้าหมายกับผู้ป่วยและคู่นอน
- ตรวจร่างกายเพื่อแยกภาวะ provoked vestibulodynia ออก โดยใช้ไม่พันสำลีแตะเบา ๆ เริ่มจากบริเวณภายนอกไกลๆก่อน แล้วค่อยแตะบริเวณใกล้ introitus ในภายหลัง หากพบว่าเป็น provoked vestibulodynia ควรได้รับการรักษาเพิ่มเติม
- ส่งเสริมให้คู่รักมีส่วนร่วมในกิจกรรมทางเพศโดยไม่มีเพศสัมพันธ์ เพื่อเพิ่มความสัมพันธ์อันดีระหว่างคู่ เช่นการออกเดต การกอดจูบ การสัมผัสบริเวณอื่น ๆ เป็นต้น
- สอนผู้ป่วยให้เข้าใจอวัยวะเพศตนเอง เพื่อให้ผู้ป่วยรู้จักตนเองมากขึ้น ลดความกลัวเวลามีเพศสัมพันธ์
- อธิบายและให้ความรู้แก่ผู้ป่วยเกี่ยวกับการหดรัดของกล้ามเนื้ออุ้งเชิงกรานจะเกิดเมื่อสัมผัสบริเวณอวัยวะเพศซึ่งอาการนี้จะทำให้ผู้ป่วยเจ็บเมื่อมีการสอดใส่ไม่ว่าจะเป็นผ้าอนามัย หรืออวัยวะเพศก็ตาม
- แนะนำให้ผู้ป่วยดูอวัยวะเพศของตนเองในกระจก และทำการสำรวจตนเอง
- หากผู้ป่วยเริ่มคุ้นเคยแล้ว ให้เริ่มสัมผัสบริเวณอวัยวะเพศตนเอง โดยแนะนำให้ใช้เจลหล่อลื่นร่วมด้วยได้ เพื่อลดการระคายเคืองหรือความเจ็บปวด ให้สัมผัสบริเวณใกล้ทางเปิดของช่องคลอด ในครั้งแรกอาจมีความกังวลแต่ครั้งต่อ ๆ ไปความกังวลจะเริ่มลดลง
- เมื่อผู้ป่วยคุ้นเคยกับการสัมผัสบริเวณอวัยวะเพศภายนอกแล้ว แนะนำให้เริ่มสอดใส่นิ้วมือเข้าไปด้านในได้หากผู้ป่วยพร้อม โดยแนะนำให้ใช้เจลหล่อลื่นร่วมด้วยเสมอ
- ทำการนัดหมายผู้ป่วยมาเป็นระยะเพื่อติดตามความคืบหน้า
- เมื่อผู้ป่วยพร้อม แพทย์ค่อยทำการตรวจภายในเพื่อประเมินความผิดปกติทางกายภาพ
- เมื่อสามารถตรวจทางช่องคลอดได้ แพทย์ผู้ทำการรักษาควรสั่ง vaginal dilator เมื่อผู้ป่วยสอดใส่สำเร็จ
- ให้การรักษาต่อ ค่อยๆเพิ่มขนาดเส้นผ่าศูนย์กลางให้ใหญ่ขึ้น
- แนะนำให้คู่นอนมาร่วมรับรู้ขั้นตอนของการรักษาด้วยเป็นระยะ และอาจจะช่วยสอดใส่อุปกรณ์ในช่องคลอดได้ในระยะนี้ (หากผู้ป่วยยินยอม)
- ค่อยๆเพิ่มขนาดเส้นผ่าศูนย์กลางของ dilator จนกระทั่งผู้ป่วยสามารถใช้ vaginal dilator ขนาดใหญ่ใกล้เคียงกับอวัยวะเพศของคู่นอนได้ โดยแนะนำให้ใช้เจลหล่อลื่นร่วมด้วยเสมอ
- ทดลองสอดใส่องคชาติ โดยแนะนำให้ผู้ป่วยจับองคชาติของเพศชายและสอดใส่ในทิศทางเดียวกับที่เคยสอดใส่อุปกรณ์ด้วยตนเอง และใส่สารหล่อลื่นเสมอ
- ก่อนสอดใส่องคชาติ ให้ใช้ dilator ก่อนเสมอ เพื่อให้กล้ามเนื้อช่องคลอดผ่านคลาย และเพื่อยืนยันแก้ผู้ป่วยถึงความสามารถในการสอดใส่ได้ของผู้ป่วย
- สอดใส่องคชาติโดยให้ตัวผู้ป่วยเป็นคน control เอง
- สอดใส่องคชาติแล้วค้างไว้สักพักเพื่อให้คุ้นเคยและถอดออก
- หากไม่พร้อมมีเพศสัมพันธ์ต่อ ให้จบ session เพียงเท่านี้ ไม่ควรฝืนมีเพศสัมพันธ์โดยการสอดใส่ต่อ เนื่องจากอาจเกิดอาการเจ็บได้
- ควรมีเพศสัมพันธ์จริงเมื่อรู้สึกว่าพร้อมแล้วเท่านั้น และควรหยุดเมื่อรู้สึกว่าไม่อยากทำต่อเสมอ ดังนั้นฝ่ายชายต้องเข้าใจและพร้อมเข้ากระบวนการรักษาอย่างแท้จริง
- เมื่อสามารถมีเพศสัมพันธ์ได้ ให้ใช้ dilator ก่อนการสอดใส่จริงเสมอ
การดูแลผู้ป่วยที่มีภาวะ provoked vestibulodynia
ภาวะ provoked vestibulodynia คือภาวะที่มีอาการเจ็บเมื่อสัมผัสบริเวณ vestibule หรือ บริเวณที่อยู่ระหว่างแคมเล็กทั้งสองข้างตั้งแต่คลิตอริสจนถึง posterior fourchette ส่วนความผิดปกติที่อาจพบทางกายภาพนั้นมีได้หลากหลาย ตั้งแต่ไม่พบความผิดปกติ จนถึงมีลักษณะบวมแดงบวมแดง และมีอาการเจ็บปวด อาการปวดนี้มักเป็นอาการปวดเรื้อรังและปวดจากสิ่งสัมผัสที่ปกติที่ไม่สามารถทำให้ผู้ป่วยเจ็บปวด สำหรับสาเหตุของอาการนี้อาจเกิดได้จากหลากหลายสาเหตุ มีการศึกษาพบว่าความผิดปกตินี้เกิดจากความไวเกินของระบบประสาทส่วนกลางและส่วนปลาย ส่วนสาเหตุจากระบบประสาทที่ทำให้เกิดประสาทรับสัมผัสไวเกินนั้นไม่ทราบชัดเจน แต่สาเหตุอื่นๆที่อาจเป็นไปได้ ได้แก่ความเครียดเป็นต้น โดยส่วนมากแล้วหญิงที่มีอาการนี้มักมีโรคที่ทำให้เกิดอาการเจ็บปวดเรื้อรังอื่นๆร่วมด้วยเช่น irritable bowel syndrome, temporomandibular joint pain, interstitial cystitis, dysmenorrhea, fibromyalgia
สำหรับการดูแลรักษานั้นต้องมีการรักษาทางจิตใจร่วมด้วยเพื่อเปลี่ยนกลไกทางสมองเกี่ยวกับศักยภาพในการตอบรับความเจ็บปวดโดยใช้ Cognitive behavioral therapy (CBT) และ Mindfulness-Based Cognitive Therapy (MBCT) เพื่อปรับเปลี่ยนกลไกความคิด ส่วนยาที่ถูกใช้ในการรักษาเช่น tricyclic antidepressants, ยาชาทาเฉพาะที่ หรือยากันชักยาเหล่านี้พบว่าไม่มีประโยชน์ในการรักษากลุ่มอาการนี้ สำหรับยาทาเฉพาะที่กลุ่มสเตียรอยด์ไม่นิยมให้ใช้เพราะอาจเกิดผลเสียในกลุ่มที่มีการอักเสบของปลายประสาทได้ จะเห็นได้ว่าการรักษาทางด้านจิตใจเป็นการรักษาหลักในผู้ป่วยกลุ่มนี้ ซึ่งจะทำให้ความเจ็บปวดและความเครียดลดลง ทำให้ผู้ป่วยสามารถมีเพศสัมพันธ์ได้เมื่อได้รับการกระตุ้นอารมณ์
จะเห็นว่าการดูแลรักษาผู้ป่วยที่มีภาวะบกพร่องทางเพศนั้นแพทย์ที่ทำการดูแลต้องมีความเข้าใจ และเห็นอกเห็นใจผู้ป่วย มีความสามารถในการสื่อสารต่อผู้ป่วยและคู่นอนอย่างเหมาะสมและมีประสิทธิภาพเพื่อค้นหาสาเหตุทั้งสาเหตุทางด้านร่างกาย จิตใจ สังคม และสิ่งแวดล้อม และต้องให้การรักษาแบบองค์รวมด้วยทีมสหสาขาวิชาชีพที่มีความเข้าใจเรื่องเพศเพื่อประโยชน์สูงสุดของผู้ป่วย
เอกสารอ้างอิง
1.Shifren JL, Monz BU, Russo PA, Segreti A, Johannes CB. Sexual problems and distress in United States women: prevalence and correlates. Obstetrics and gynecology. 2008;112(5):970-8.
2.Zhang C, Tong J, Zhu L, Zhang L, Xu T, Lang J, et al. A Population-Based Epidemiologic Study of Female Sexual Dysfunction Risk in Mainland China: Prevalence and Predictors. J Sex Med. 2017;14(11):1348-56.
3.Berek JS. Berek & Novak’s Gynecology. 6 ed2019. 409-27 p.
4.Masters WHJVERBRF. Human sexual response. Boston: Little, Brown; 1966.
5.Basson R. Review: Female sexual dysfunctions — the new models. The British Journal of Diabetes & Vascular Disease. 2002;2(4):267-70.
6.Portman DJ, Gass ML. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. Menopause. 2014;21(10):1063-8.
7.Shifren JL, Davis SR. Androgens in postmenopausal women: a review. Menopause. 2017;24(8):970-9.
8.American College of O, Gynecologists’ Committee on Practice B-G. Female Sexual Dysfunction: ACOG Practice Bulletin Clinical Management Guidelines for Obstetrician-Gynecologists, Number 213. Obstet Gynecol. 2019;134(1):e1-e18.
9.Faubion SS, Rullo JE. Sexual Dysfunction in Women: A Practical Approach. Am Fam Physician. 2015;92(4):281-8.
10.Female Sexual Dysfunction: ACOG Practice Bulletin Clinical Management Guidelines for Obstetrician–Gynecologists, Number 213. Obstetrics & Gynecology. 2019;134(1).
11.Vahia VN. Diagnostic and statistical manual of mental disorders 5: A quick glance. Indian J Psychiatry. 2013;55(3):220-3.
12.Wierman ME, Arlt W, Basson R, Davis SR, Miller KK, Murad MH, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014;99(10):3489-510.
13.Clayton AH, Valladares Juarez EM. Female Sexual Dysfunction. Psychiatr Clin North Am. 2017;40(2):267-84.