งานต้อนรับปีใหม่
 สวัสดีปีใหม่ 2555
สวัสดีปีใหม่ 2555
ขอให้พี่ ๆ น้อง ๆ ประสบแต่สิ่งที่ดีๆ
เปิดดูรูปงานสังสรรค์ได้ในเมนู OB-GYN gallery หรือ คลิกที่นี่
วันพุธที่ 28 ธันวาคม 2554 ณ ห้องโถง ชั้น 2 อาคารเรียนรวม
 สวัสดีปีใหม่ 2555
สวัสดีปีใหม่ 2555ขอให้พี่ ๆ น้อง ๆ ประสบแต่สิ่งที่ดีๆ
เปิดดูรูปงานสังสรรค์ได้ในเมนู OB-GYN gallery หรือ คลิกที่นี่
วันพุธที่ 28 ธันวาคม 2554 ณ ห้องโถง ชั้น 2 อาคารเรียนรวม
มะเร็งปากมดลูก เป็นมะเร็งที่พบมากเป็นอับดับสองในสตรีไทย โดยมีแนวโน้มอัตราของผู้ป่วยรายใหม่ในแต่ละปีลดลงอย่างต่อเนื่อง1 อันเป็นผลจากการรณรงค์ของกระทรวงสาธารณสุขที่ให้สตรีไทยที่มีอายุมากกว่า 35 ปี ขึ้นไป รับการตรวจคัดกรองมะเร็งปากมดลูกทุกระยะ 5 ปี2
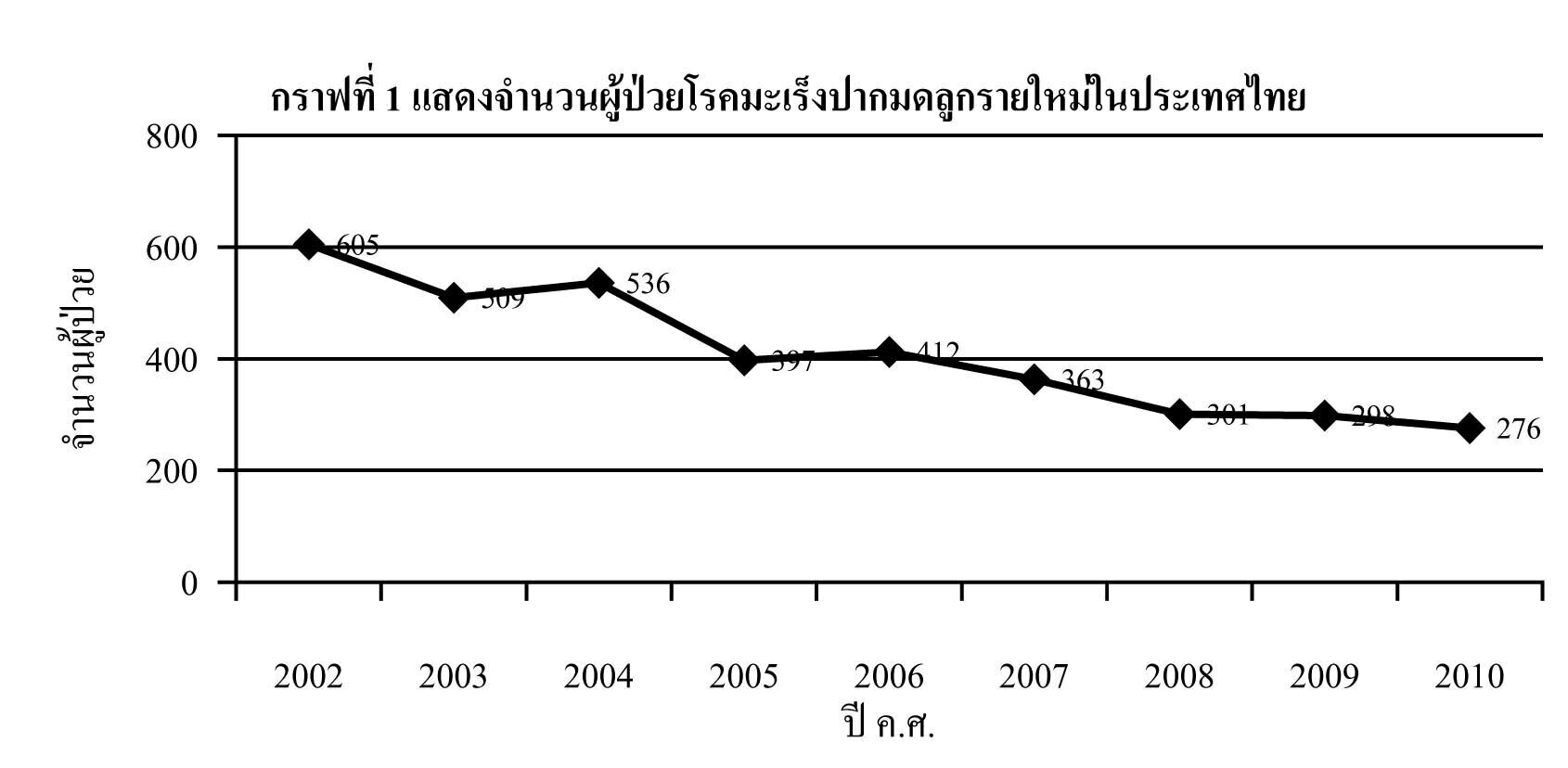
สิ่งสำคัญประการหนึ่งคือ การดูแลผู้ป่วยที่มีผลการคัดกรองผิดปกติอย่างถูกต้อง เพื่อค้นหาพยาธิสภาพระยะก่อนลุกลาม และให้การรักษาอย่างเหมาะสมต่อไป
ในการตรวจคัดกรองมะเร็งปากมดลูก จะรายงานผลตาม The 2001 Bethesda System ซึ่งได้ถูกพัฒนาขึ้นเพื่อให้มีแนวทางในการดูแลรักษาเยื่อบุปากมดลูกผิดปกติที่ชัดเจนต่อไป3 การรายงานผลจะประกอบด้วยส่วนหลักๆ ได้แก่ Specimen Adequacy ซึ่งจะรายงานเป็น satisfactory หรือ unsatisfactory for evaluation และ Interpretation แบ่งเป็น Negative for Intraepithelial Lesion of Malignancy กับ Epithelial Cell Abnormalities ในที่นี้จะขอกล่าวรายละเอียดเฉพาะลักษณะเซลล์เยื่อบุปากมดลูกที่ผิดปกติเท่านั้น ความผิดปกติแบ่งได้เป็น
1.1. Atypical squamous cells (ASC)
1.1.1. of undetermined significance (ASC-US)
1.1.2. cannot exclude HSIL (ASC-H)
1.2. Low-grade squamous intraepithelial lesion (LSIL) ได้แก่ human papillomavirus (HPV) infection และ mild dysplasia หรือ cervical intraepithelial neoplasia (CIN) 1
1.3. High-grade squamous intraepithelial lesion (HSIL) ได้แก่ moderate dysplasia, severe dysplasia และ carcinoma in situ หรือ CIN 2 และ CIN 3
1.4. Squamous cell carcinoma
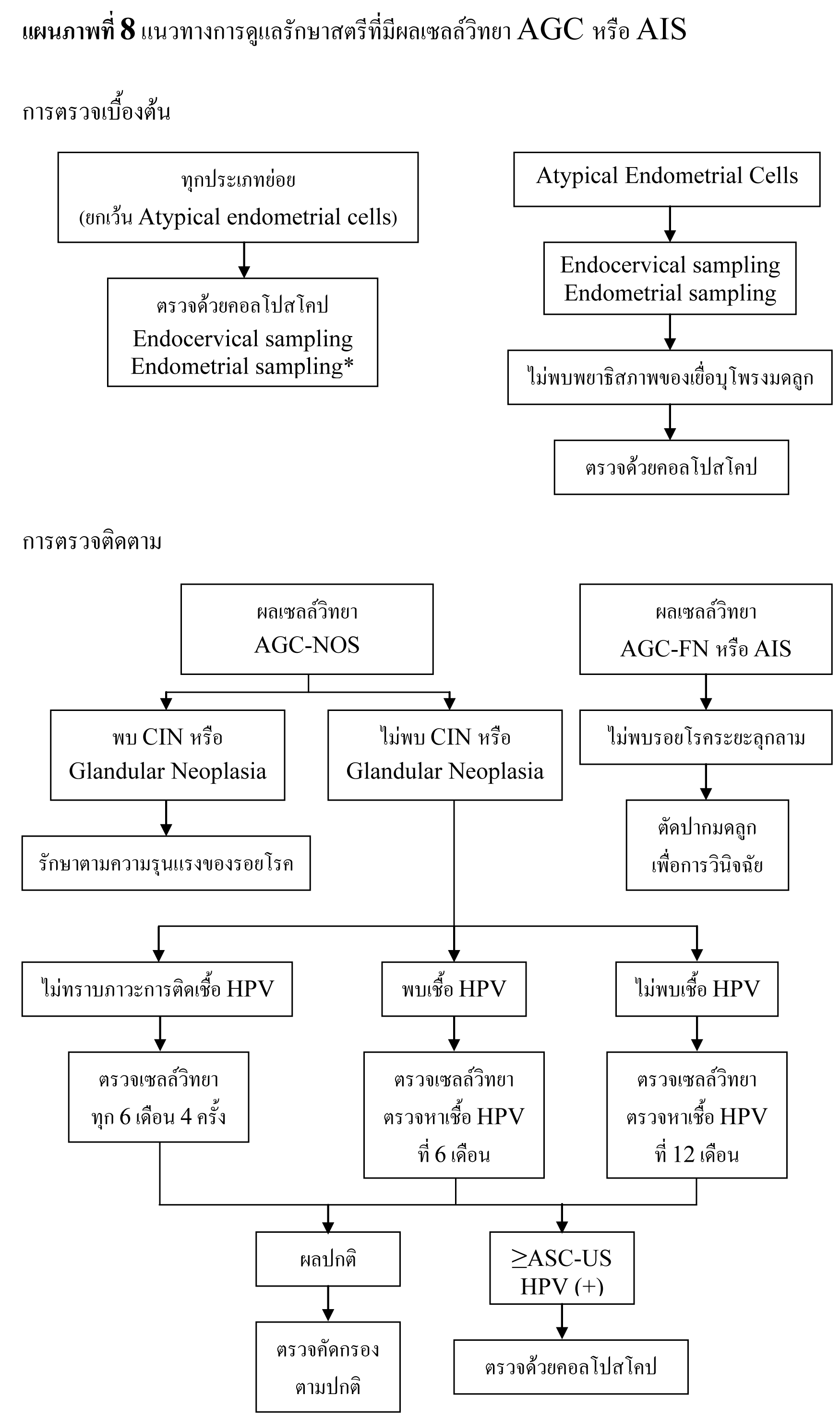
2.1. Atypical glandular cells (AGC) โดยให้ระบุว่าเป็น endocervical, endometrial หรือ not otherwise specified (AGC-NOS)
2.2. Atypical glandular cells, favor neoplastic (AGC-FN) ให้ระบุว่าเป็น endocervical หรือ not otherwise specified
2.3. Endocervical adenocarcinoma in situ (AIS)
2.4. Adenocarcinoma
ในปี 2006 สมาคมผู้เชี่ยวชาญ และองค์กรระดับนานาชาติต่างๆ ได้มีการประชุมเพื่อหาข้อตกลงร่วมกัน ในการปรับปรุงแนวทางการรักษาสตรีที่มีผลการคัดกรองมะเร็งปากมดลูกผิดปกติ4 โดยการนำของ the American Society for Colposcopy and Cervical Pathology (ASCCP) ซึ่งได้แก้ไขจากแนวทางเดิมในปี 20015 โดยอาศัยข้อมูลจากงานวิจัยที่ตีพิมพ์หลังปี 2000 รวมถึงการศึกษา ASCUS/LSIL Triage Study (ALTS)6,7 และจากการใช้ HPV DNA testing ร่วมในการคัดกรองที่เพิ่มมากขึ้น โดยแยกตามผลเซลล์วิทยาที่ผิดปกติได้ ดังนี้
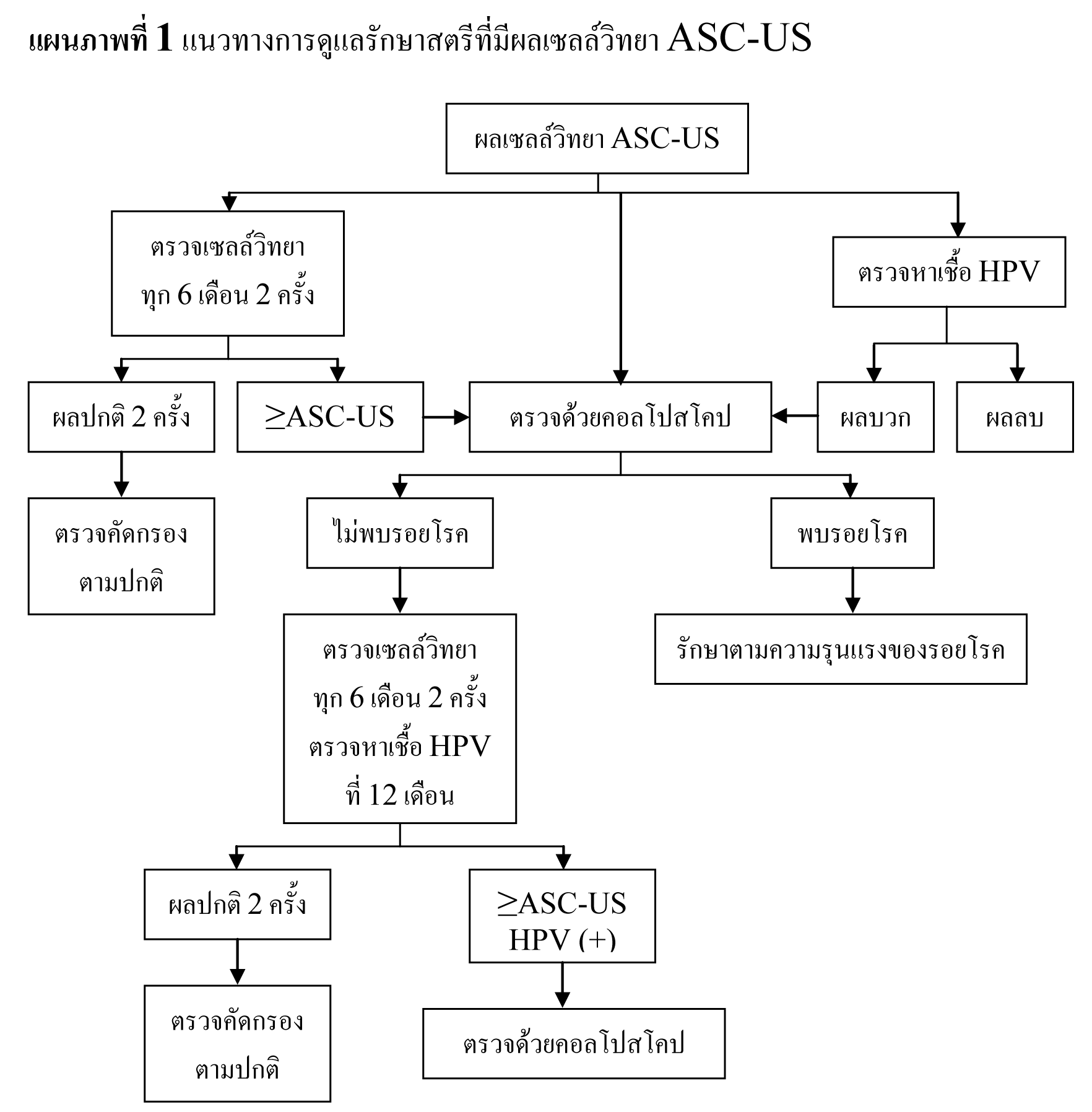
แบ่งออกได้เป็น atypical squamous cells of undetermined significance (ASC-US) และ atypical squamous cells, cannot exclude HSIL (ASC-H) โดยมีปัจจัยหลายๆ อย่างที่ต้องคำนึงถึง ในการดูแลสตรีที่มีผลเซลล์วิทยา ASC กล่าวคือ ASC เป็นความผิดปกติของเซลล์วิทยาที่มีความรุนแรงน้อยที่สุด8-10 โดยมีอุบัติการณ์ในการกลายเป็นมะเร็งระยะลุกลามเพียง 0.1-0.2%11,12 ซึ่งโอกาสที่จะพบรอยโรค CIN 2,3 มีประมาณ 5-17% โดยพบในสตรีที่มีผลเซลล์วิทยา ASC-H 24-94% ซึ่งมากกว่าสตรีที่มีผลเซลล์วิทยา ASC-US13-16 ด้วยเหตุนี้จึงควรให้ความสำคัญต่อผลเซลล์วิทยา ASC-H เทียบเท่ากับ HSIL
ข้อมูลจาก ALTS และการศึกษาอื่นๆ ได้แสดงให้เห็นว่า การตรวจด้วยคอลโปสโคป 1 ครั้ง ร่วมกับการตรวจหาเชื้อ HPV ที่ 12 เดือน และการตรวจทางเซลล์วิทยาทุก 6 เดือน 2 ครั้ง มีความปลอดภัยและมีประสิทธิภาพเพียงพอในการดูแลสตรีที่มีผลเซลล์วิทยา ASC-US17-19
การเก็บเซลล์ตัวอย่างในของเหลวเพื่อตรวจทางเซลล์วิทยา (liquid-based cytology) แล้วนำสิ่งส่งตรวจดังกล่าวมาตรวจหาเชื้อ HPV ภายหลังได้โดยไม่ต้องเรียกผู้ป่วยมาตรวจซ้ำอีก เรียกว่า “Reflex HPV DNA testing” วิธีการนี้ช่วยลดความจำเป็นของผู้ป่วยที่จะต้องเข้ารับการตรวจซ้ำ และลดจำนวนผู้ป่วยที่ต้องได้รับการตรวจด้วยคอลโปสโคปได้ 40-60%20,21
ในสตรีที่มีผลเซลล์วิทยาเป็น ASC-US พบว่า มีอุบัติการณ์การพบเชื้อ HPV แตกต่างกันตามอายุ โดยจะพบมากในหญิงอายุน้อย15,22,23 แต่เป็นกลุ่มที่มีความเสี่ยงต่ำที่จะกลายเป็นมะเร็ง จึงแนะนำให้ทำการตรวจหาเชื้อ HPV เฉพาะในกลุ่มสตรีที่มีอายุมากขึ้นเท่านั้น23,33 สำหรับในกลุ่มสตรีที่ติดเชื้อ HIV และมีผลเซลล์วิทยา ASC-US เคยมีการแนะนำให้ทำการตรวจด้วยคอลโปสโคปในผู้ป่วยกลุ่มนี้ทุกรายเนื่องจากพบอุบัติการณ์ของการติดเชื้อ HPV และรอยโรคขั้นสูงได้มากในผู้ป่วยกลุ่มนี้ แต่จากการศึกษาล่าสุดพบอุบัติการณ์ของรอยโรคขั้นสูงและการติดเชื้อ HPV ที่ลดลง จึงแนะนำให้ทำการรักษาสตรีที่มีภูมิคุ้มกันต่ำเช่นเดียวกับสตรีทั่วไป24,25 และสำหรับหญิงตั้งครรภ์ที่มีผลเซลล์วิทยา ASC-US พบว่ามีความเสี่ยงต่ำที่จะกลายเป็นมะเร็ง จึงไม่แนะนำให้ทำการตรวจด้วยคอลโปสโคปในช่วงก่อนคลอด26
สามารถทำได้ 3 แนวทาง คือ
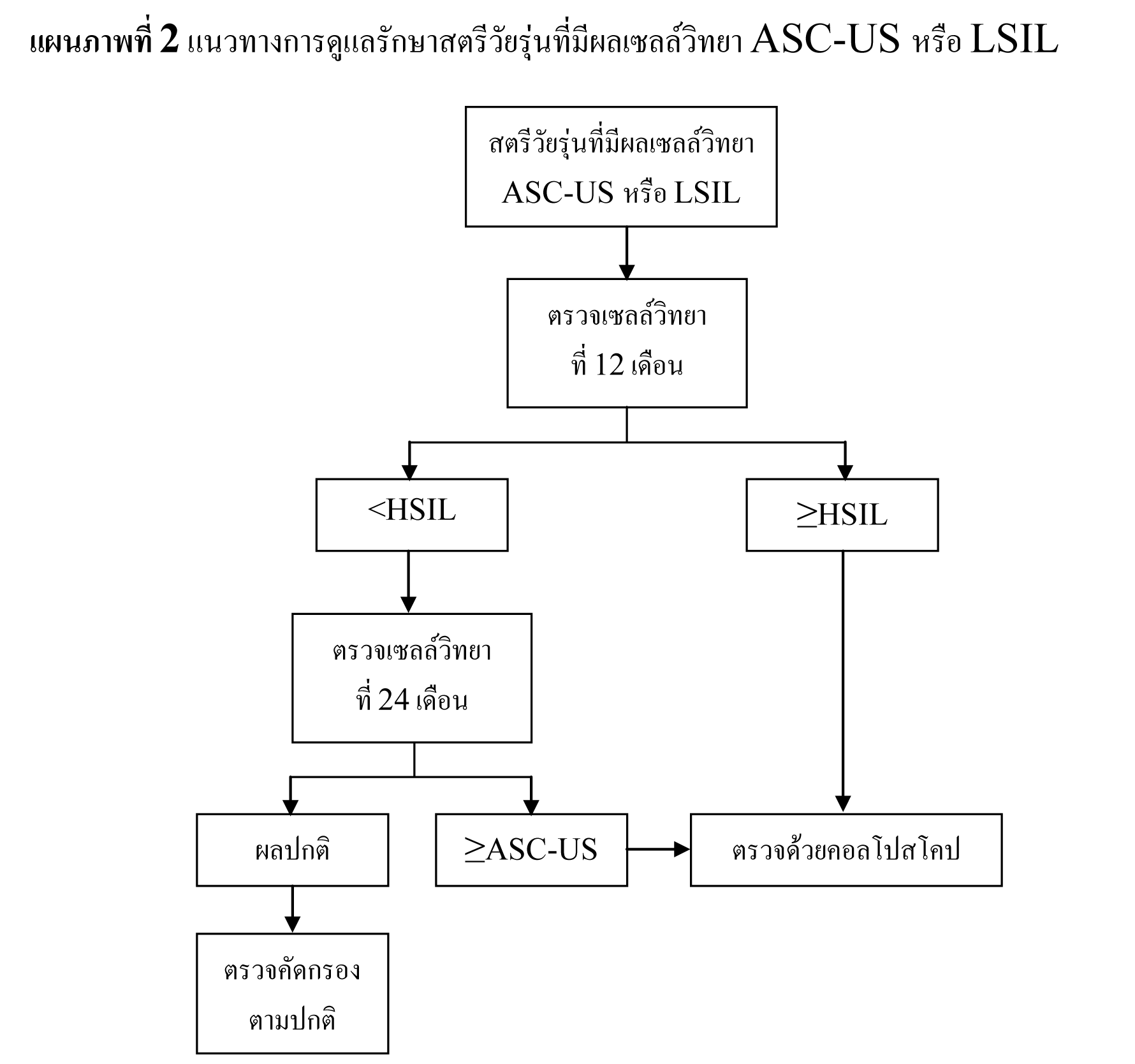
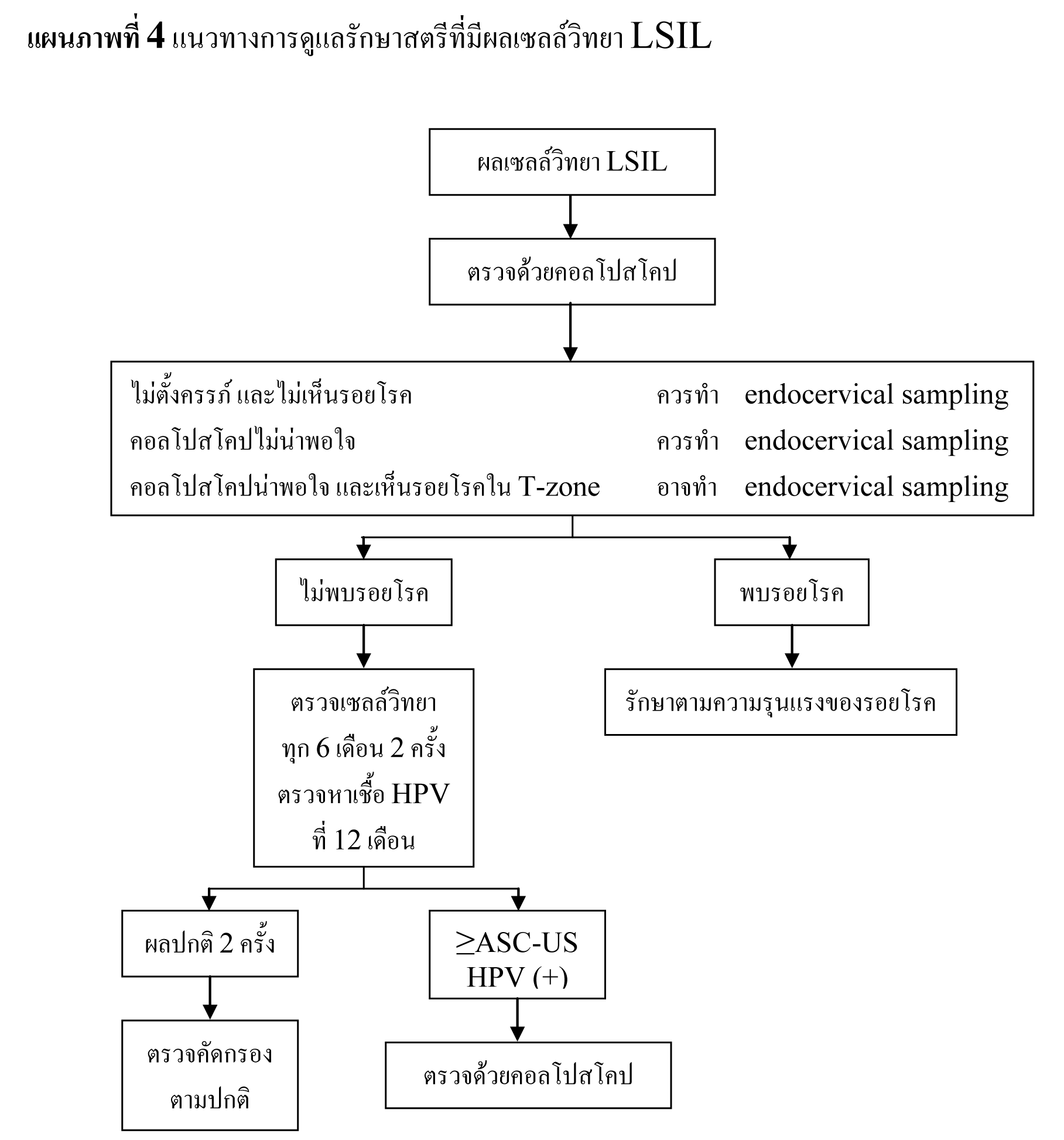
ในช่วงทศวรรษที่ผ่านมา พบอุบัติการณ์ของ LSIL เพิ่มสูงขึ้น โดยในปี 2003 มีการรายงานผล LSIL จากการเก็บเซลล์ตัวอย่างในของเหลวเฉลี่ย 2.9%27 พบการติดเชื้อ high-risk HPV ในสตรีที่มีผลเซลล์วิทยา LSIL 76.6%28 และพบรอยโรคขั้นสูงจากการตรวจด้วยคอลโปสโคป 12-16%7,29,30 จากข้อมูลของ ALTS ความเสี่ยงของการพบรอยโรค CIN 2,3 ในสตรีที่มีผลเซลล์วิทยา LSIL มีพอๆ กับสตรีที่มีผลเซลล์วิทยา ASC-US ที่พบการติดเชื้อ high-risk HPV31 ดังนั้นจึงสนับสนุนให้ทำการดูแลรักษาสตรีทั้งสองกลุ่มไปในแนวทางเดียวกัน จากการศึกษาไปข้างหน้าในสตรีวัยรุ่นที่มีผลเซลล์วิทยา LSIL พบอัตราการกลับมาเป็นปกติได้สูง32 และพบว่าอุบัติการณ์การติดเชื้อ HPV และการพบรอยโรคขั้นสูงในสตรีที่มีผลเซลล์วิทยา LSIL ลดลงตามอายุ33,34
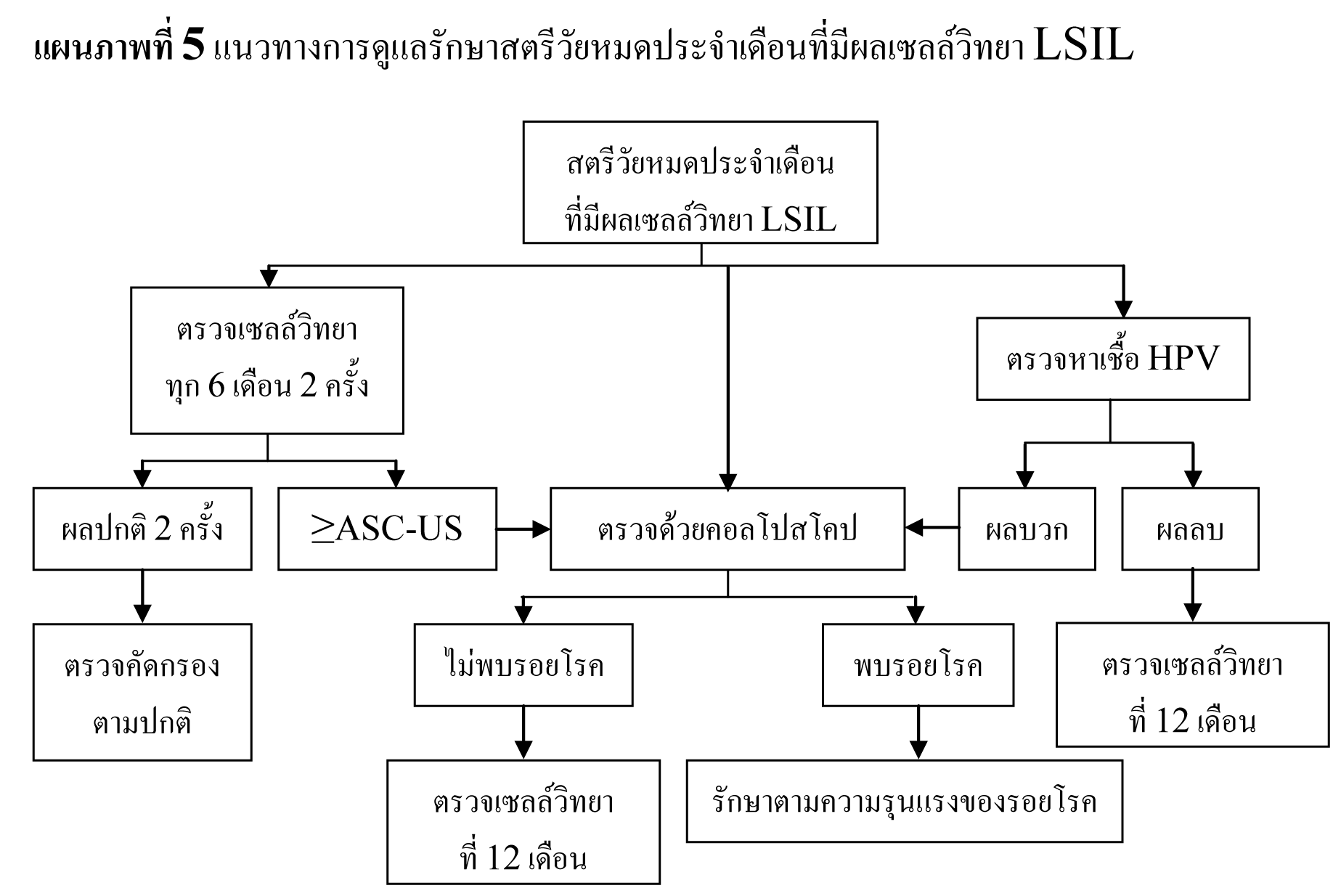
แนวทางการดูแลรักษาสตรีวัยหมดประจำเดือนที่มีผลเซลล์วิทยา LSIL
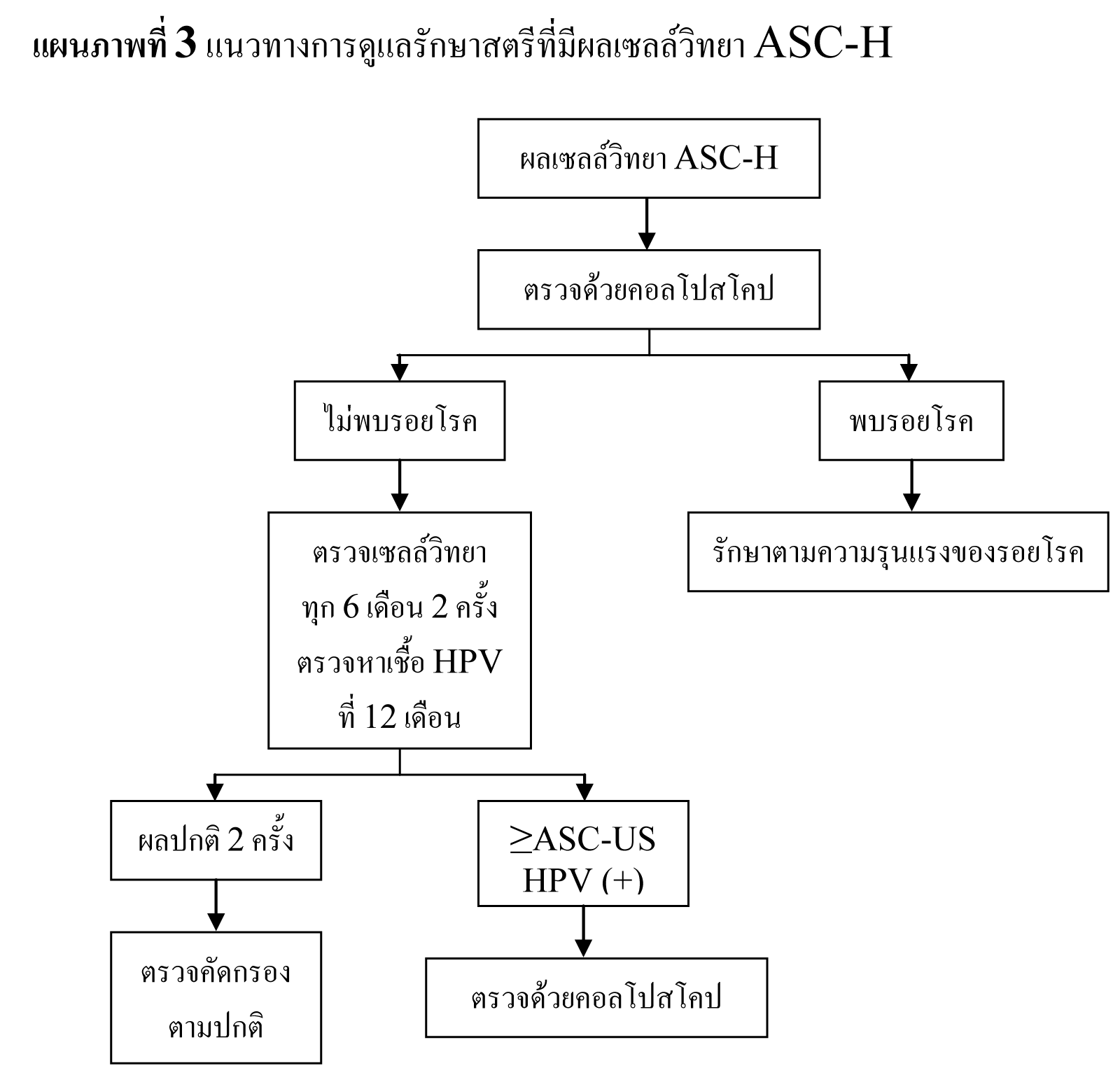
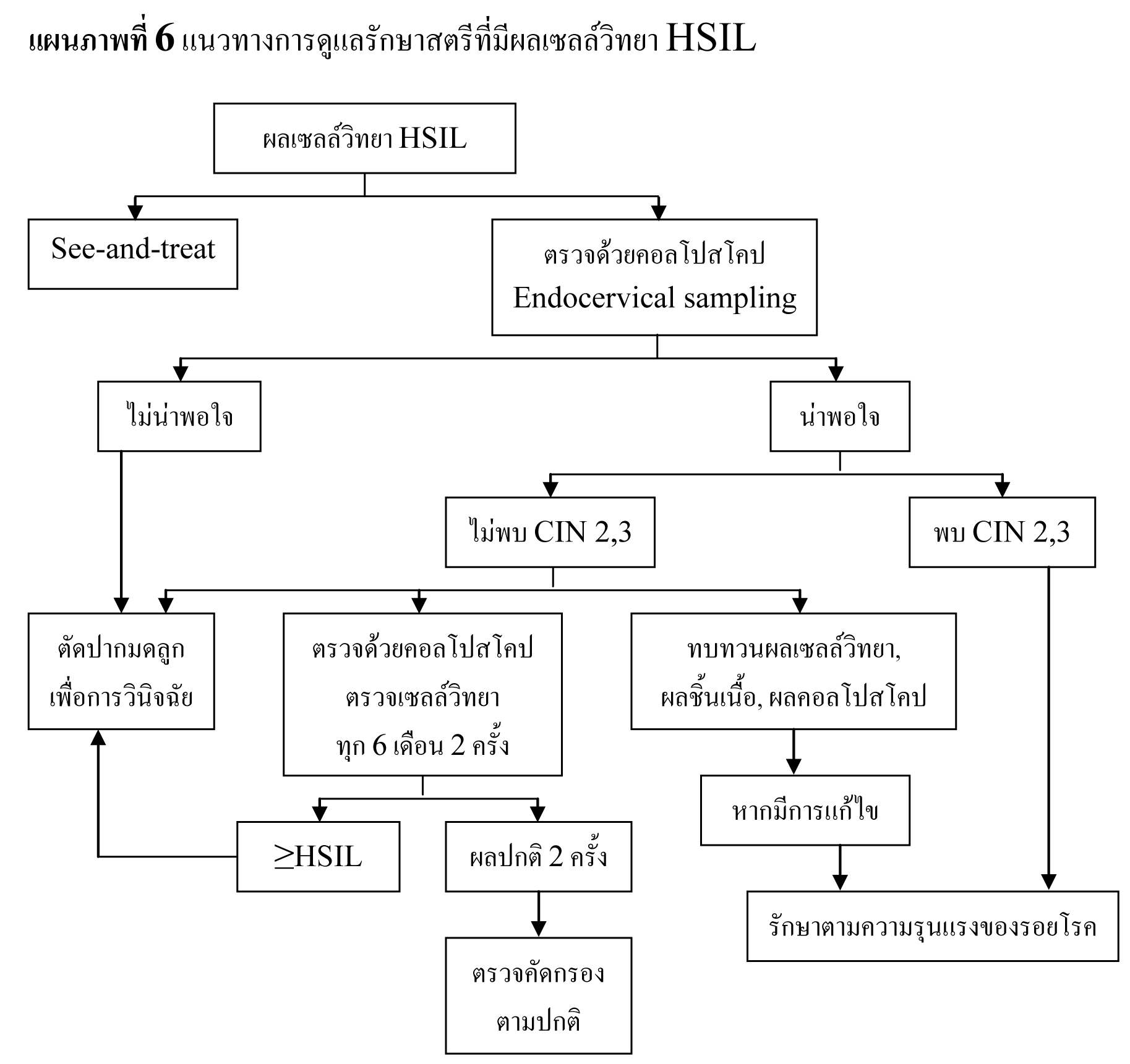
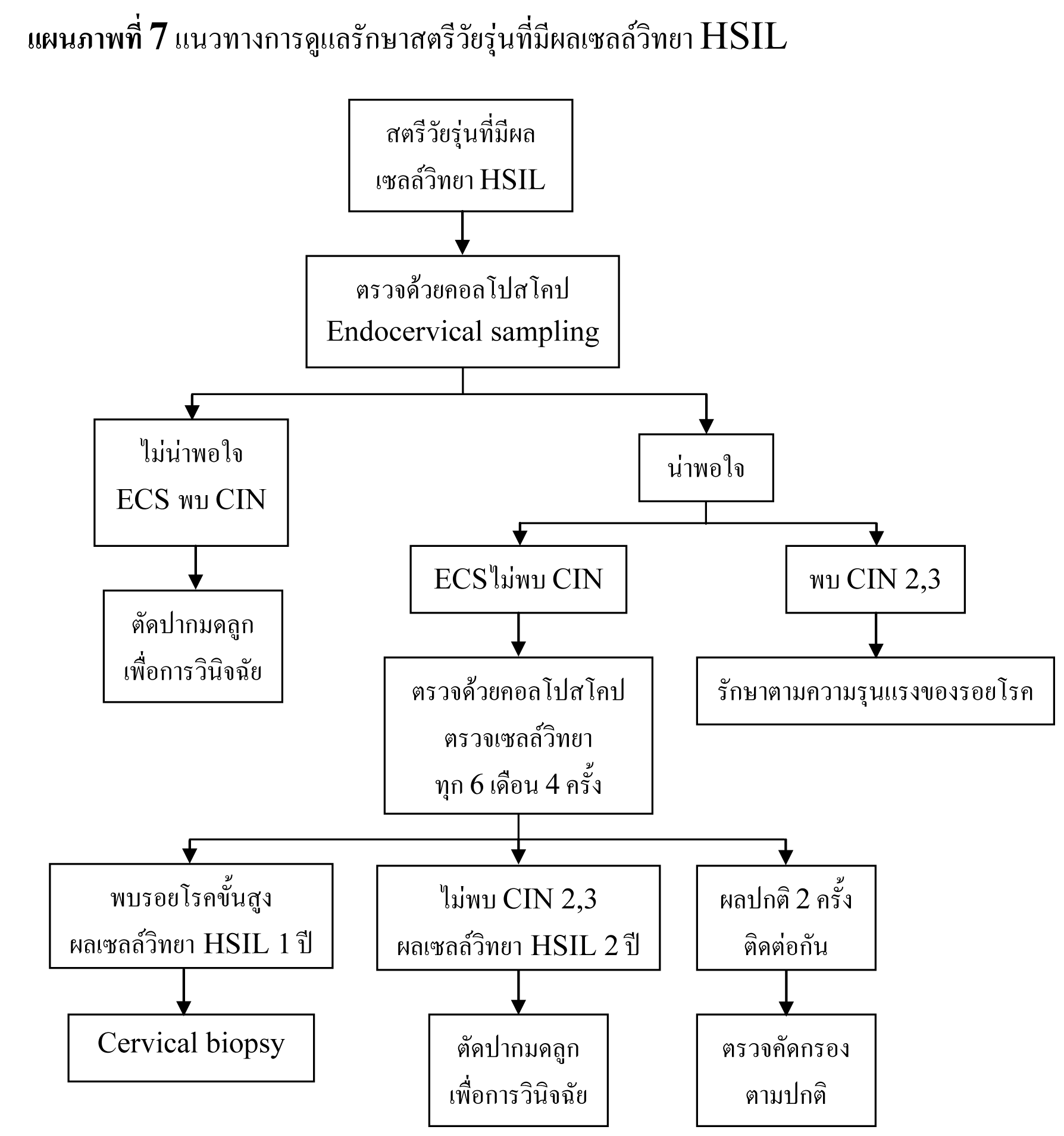
พบอัตราการรายงานผลเซลล์วิทยา HSIL เฉลี่ย 0.7%27 โดยมีอัตราลดลงตามอายุ สตรีที่มีผลเซลล์วิทยา HSIL มีความเสี่ยงสูงที่จะมีพยาธิสภาพของปากมดลูก จากการตรวจด้วยคอลโปสโคปพบรอยโรคขั้นสูง 53-66% และจากการตัดปากมดลูกด้วยห่วงไฟฟ้าพบรอยโรคขั้นสูง 84-97%29,35,36 โดยประมาณ 2% ของสตรีที่มีผลเซลล์วิทยา HSIL จะพบว่าเป็นมะเร็งระยะลุกลาม37 เนื่องจากการตรวจด้วยคอลโปสโคปอาจไม่พบรอยโรคขั้นสูง จึงแนะนำให้ทำการวินิจฉัยด้วยการตัดปากมดลูกในสตรีที่มีผลเซลล์วิทยา HSIL36,38,39 แต่ในกลุ่มสตรีอายุน้อย รอยโรค CIN 2,3 สามารถหายได้เอง40,41
อัตราการรายงานผล AGC พบได้น้อย เฉลี่ยเพียง 0.4%27 ถึงแม้ AGC จะมีสาเหตุจากพยาธิสภาพที่ไม่รุนแรง แต่จากการศึกษาล่าสุดพบว่า 9-38% ของสตรีที่มีผลเซลล์วิทยา AGC มีรอยโรคขั้นสูง และพบมะเร็งระยะลุกลามได้ 3-17%42-45 โดยมะเร็งนรีเวชมักจะพบได้น้อยในสตรีที่อายุน้อยกว่า 35 ปี42 และการตั้งครรภ์ไม่ได้เปลี่ยนแปลงความสัมพันธ์ระหว่าง AGC กับ พยาธิสภาพทางนรีเวช
เนื่องจากความหลากหลายของพยาธิสภาพที่เกี่ยวข้องกับ AGC การประเมินจึงต้องอาศัยการตรวจหลายๆ อย่างร่วมกัน ได้แก่ การตรวจด้วยคอลโปสโคป, การเก็บตัวอย่างเยื่อบุปากมดลูกด้านใน, การตรวจหาเชื้อ HPV และการตรวจเยื่อบุโพรงมดลูก45,47 หากการตรวจเบื้องต้นไม่พบความผิดปกติอาจจำเป็นต้องทำการตัดปากมดลูกเพื่อการวินิจฉัยร่วมด้วยสำหรับสตรีที่มีผลเซลล์วิทยา AGC-FN, AIS หรือ AGC เมื่อทำการตรวจเซลล์วิทยาซ้ำ5
ประมาณ 0.5-1.8% ของตัวอย่างเซลล์วิทยาปากมดลูกที่เก็บจากสตรีอายุ 40 ปี ขึ้นไปจะพบเซลล์เยื่อบุโพรงมดลูก ซึ่งในสตรีวัยก่อนหมดประจำเดือน เนื้อเยื่อเหล่านี้มักไม่สัมพันธ์กับพยาธิสภาพที่สำคัญ48 แต่ในสตรีวัยหมดประจำเดือน โดยเฉพาะในรายที่ได้รับฮอร์โมนทดแทน พบอุบัติการณ์ของพยาธิสภาพที่สำคัญมากขึ้น49
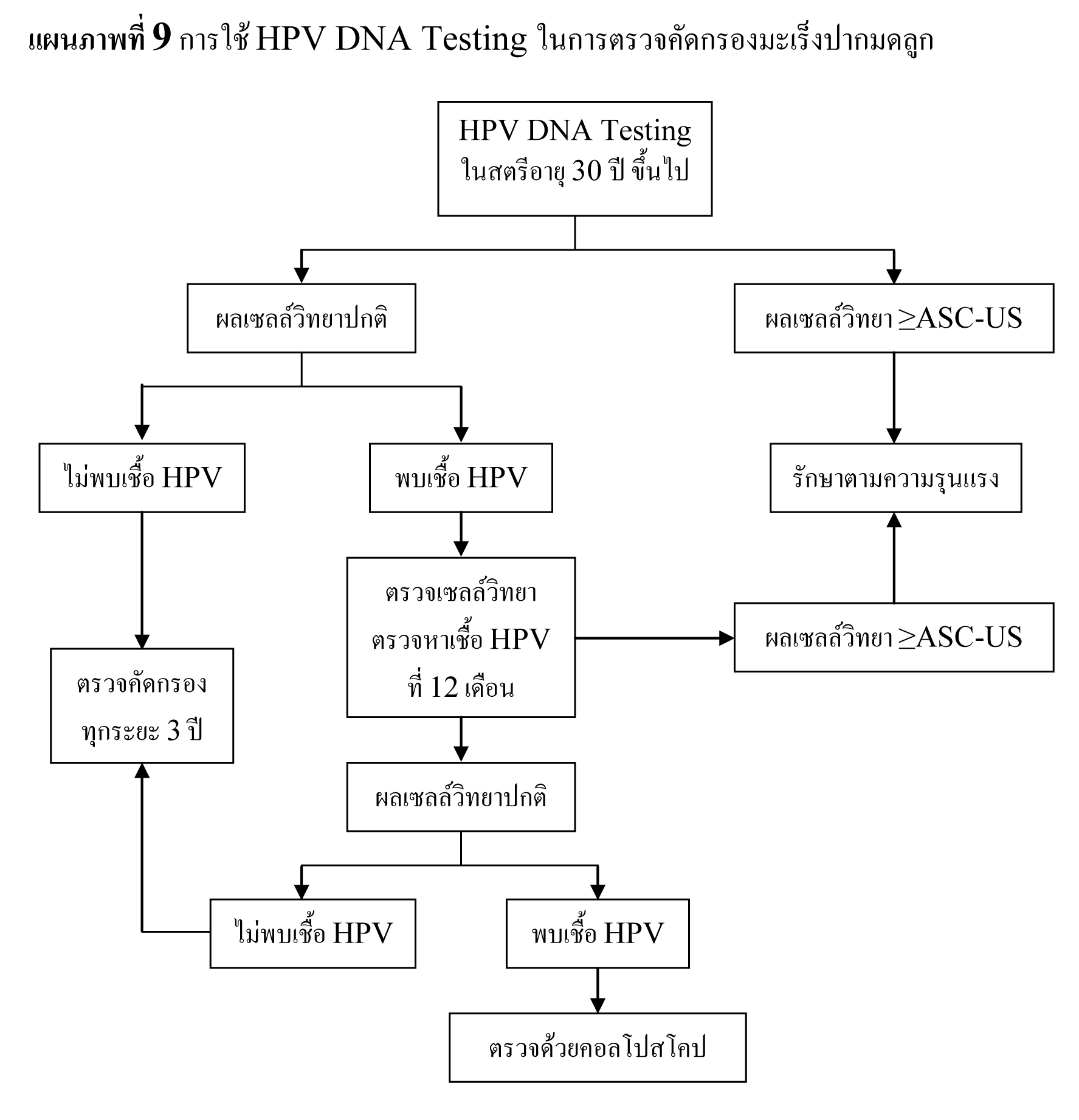
เนื่องจากการคัดกรองมะเร็งปากมดลูกด้วยการตรวจเซลล์วิทยายังมีข้อจำกัดอยู่มาก ทำให้มีความสนใจที่จะใช้การตรวจหาเชื้อ HPV ร่วมในการคัดกรอง50 พบอุบัติการณ์ของการติดเชื้อ HPV ได้มากในกลุ่มวัยรุ่น ซึ่งสามารถหายได้เอง ทำให้พบการติดเชื้อ HPV ลดลงตามอายุ51 ดังนั้นจึงควรใช้การตรวจหาเชื้อ HPV ในการคัดกรองมะเร็งปากมดลูกเฉพาะในสตรีอายุ 30 ปีขึ้นไป52
พบว่า การใช้การตรวจหาเชื้อ HPV เพื่อหารอยโรคขั้นสูงในสตรีอายุ 35 ปีขึ้นไป มีความไว 95% และความเฉพาะเจาะจง 93% ส่วนการใช้การตรวจเซลล์วิทยาในการตรวจคัดกรอง มีความไว 60% และความเฉพาะเจาะจง 97% และเมื่อนำทั้งสองวิธีการมาใช้ร่วมกัน จะทำให้ความไวในการตรวจคัดกรองเพิ่มขึ้นอย่างชัดเจน โดยมีค่า negative predictive value ที่ 99-100%53,54
สตรีที่มีผลตรวจเซลล์วิทยาปกติ และตรวจไม่พบการติดเชื้อ HPV มีความเสี่ยงที่จะพบรอยโรคขั้นสูงน้อยกว่า 1 ใน 1000 และเมื่อติดตามต่อไปเป็นเวลา 10 ปี พบอัตราการกลายเป็นรอยโรคขั้นสูงที่ค่อนข้างต่ำ55,56 มีการศึกษาที่แสดงให้เห็นว่า การตรวจคัดกรองด้วยการตรวจเซลล์วิทยาร่วมกับการตรวจหาการติดเชื้อ HPV ในสตรีอายุ 30 ปีขึ้นไป โดยการตรวจทุกระยะ 3 ปี มีประโยชน์เทียบเท่าหรือมากกว่าการตรวจเซลล์วิทยาแบบธรรมดาทุกปี57 ดังนั้นสตรีที่มีผลเซลล์วิทยาปกติ และตรวจไม่พบการติดเชื้อ HPV จึงไม่จำเป็นต้องรับการตรวจคัดกรองซ้ำในเวลา 3 ปี
พบว่า 58% ของสตรีที่มีการติดเชื้อ HPV มีผลการตรวจเซลล์วิทยาที่ปกติ ซึ่งความเสี่ยงที่จะไม่สามารถตรวจพบรอยโรคขั้นสูงที่อาจซ้อนเร้นในสตรีกลุ่มนี้ค่อนข้างต่ำ อยู่ที่ประมาณ 2.4-5.1%58-61 ร่วมกับการติดเชื้อ HPV นั้นสามารถหายได้เมื่อทำการตรวจติดตาม โดยหลังจากติดตามเป็นระยะเวลาเฉลี่ย 6 เดือน พบว่า 60% ของสตรีที่เคยตรวจพบการติดเชื้อ HPV ไม่พบการติดเชื้อเมื่อทำการตรวจซ้ำ61 จากข้อมูลเหล่านี้จึงให้สตรีที่มีผลตรวจเซลล์วิทยาปกติ แต่ตรวจพบการติดเชื้อ HPV รับการตรวจทั้งสองซ้ำที่ 12 เดือน หากยังคงพบการติดเชื้อ HPV ให้ทำการตรวจด้วยคอลโปสโคปต่อไป แต่ถ้าตรวจไม่พบการติดเชื้อ ให้ทำการตรวจคัดกรองซ้ำที่ระยะ 3 ปี
สาเหตุของภาวะมีบุตรยากนั้นเกิดขึ้นได้จากหลายประการ สาเหตุจาก ovulatory disorders, tubal obstruction และภาวะ semen abnormality นั้นเป็นภาวะที่สามารถวินิจฉัยได้โดยง่าย และเป็นสาเหตุสำคัญที่ทำให้เกิดภาวะมีบุตรยาก ได้ถึง 65% (1) สาเหตุที่ทำให้เกิดภาวะมีบุตรยากที่สำคัญอีกสาเหตุหนึ่งเกิดจากภาวะ endometriosis ซึ่งมีในการศึกษาหนึ่งพบภาวะ endometriosis ได้ถึง 25-35 % ในฝ่ายหญิงของคู่สมรสที่มาด้วยเรื่องภาวะมีบุตรยาก (2) ส่วนสาเหตุอื่น ๆ ที่นอกเหนือจากนี้ อาจจัดให้อยู่ในกลุ่มที่เรียกว่า unexplained infertility
ถึงแม้ว่าภาวะ endometriosis จะเป็นสาเหตุของการเกิดภาวะมีบุตรยากในฝ่ายหญิง แต่ก็ไม่ถึงกับทำให้ไม่สามารถตั้งครรภ์ได้ ปัจจุบันด้วยเทคโนโลยีของการผ่าตัด การกระตุ้นให้เกิดการตกไข่ (ovulation induction) ร่วมกับการทำ intrauterine insemination และการทำ in vitro fertilization สามารถช่วยให้สตรีที่มีภาวะ endometriosis สามารถตั้งครรภ์ได้เช่นกัน
Pathogenesis of infertility
กระบวนการที่ทำให้เกิดภาวะมีบุตรยากจาก endometriosis นั้น ยังเป็นที่โต้แย้งกันอยู่ และยังไม่สามารถหาข้อสรุปได้ชัดเจน อย่างไรก็ตามมีความเชื่อว่าจะมีความเกี่ยวข้องกับกับภาวะความรุนแรงของโรค ซึ่งสำหรับ endometriosis นั้น การจำแนกความรุนแรงของโรค จะใช้ the American society of reproductive medicine (ASRM) staging system ซึ่งเป็น surgical staging ระดับความรุนแรงของโรคมีตั้งแต่พบ ectopic tissue เล็กน้อย ไปจนถึง ทำให้เกิด severe anatomic distortion ดังรูป
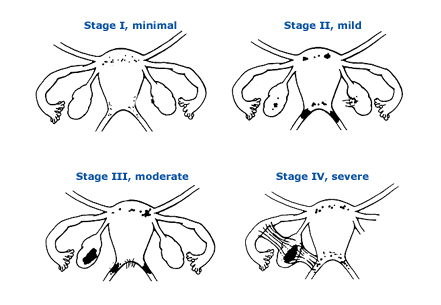
รูปที่ 1 Classification of endometriosis
ถึงแม้ว่า endometriosis stage I หรือ II อาจจะเป็น abnormal finding ที่พบได้จากการสืบค้นหาสาเหตุของภาวะมีบุตรยากในฝ่ายหญิง แต่ก็ยังไม่พบหลักฐานที่สนับสนุนอย่างแน่ชัดว่า early stage ของ endometriosis นั้นเป็นสาเหตุที่ทำให้เกิดภาวะมีบุตรยากที่แท้จริงในผู้ป่วยเหล่านี้ มีเพียงข้อสันนิษฐานที่อาจเป็นไปได้ว่าในผู้ป่วยที่เป็น minimal หรือ mild endometriosis อาจมีการสร้าง prostaglandin, metalloproteinases, cytokines และ chemokines (3) จาก endometriotic tissue มากเกินไป ทำให้มี inflammatory process เกิดขึ้น แล้วไปรบกวนการทำงานของ ovary, peritoneum, tube ตลอดจน endometrial function จึงทำให้เกิดความบกพร่องของกระบวนการ folliculogenesis, fertilization และ implantation ตามมา (4)
มีงานวิจัยที่ช่วยสนับสนุนข้อสันนิษฐานดังที่ได้กล่าวมาบางงานวิจัย พบว่า ในหญิงที่มีภาวะ endometriosis จะมีจำนวน macrophage และ cytokines เช่น IL-1, IL-6 เพิ่มมากขึ้นใน peritoneal fluid (4,5) ซึ่งจะทำให้ไปยับยั้ง sperm function (6) และ ciliary function ใน in vitro (7) อันจะทำให้เกิดปัญหาเรื่อง fertilization ตามมา หรืออาจมีปัญหาที่ endometrium เอง ทำให้แม้ว่าจะเป็น endometrium ที่อยู่ในตำแหน่งปกติ แต่มีการทำงานที่ผิดปกติไป จึงไม่สามารถเกิดการ implantation ได้ (4) นอกจากนี้ในผู้ป่วยที่เป็น endometriosis อาจมีภาวะดื้อต่อ progesterone เนื่องจากมีการสร้าง estradiol ขึ้นบน endometrium (5), มีการลดลงของ progesterone receptor หรือ progesterone coactivators เช่น Hic-5 ใน endometrium อีกด้วย (8)
รูปที่ 2 Effect of endometriosis on human reproduction
ในรายที่เป็น moderate หรือ severe endometriosis นั้นมีหลักฐานสนับสนุนมากกว่าว่า อาจจะเป็นสาเหตุที่ทำให้เกิดภาวะมีบุตรยากได้ เช่น มีการศึกษาหนึ่งในลิงโดยใช้วิธีการทำให้ลิงนั้นมีภาวะ endometriosis พบว่า ในกลุ่มที่เป็น control group มีอัตราการตั้งครรภ์มากถึง 40% ในขณะที่ ในลิงที่เป็น advanced endometriosis มีอัตราการตั้งครรภ์ 12% และ ไม่มีการตั้งครรภ์เกิดขึ้นเลยในลิงที่มี ovarian adhesion ร่วมด้วย (9) จะเห็นได้ว่า endometriosis ที่ไม่รุนแรงไม่ได้มีผลต่อการตั้งครรภ์มากเท่าใดนัก ส่วนผู้ป่วย endometriosis ที่มี major pelvic adhesion ร่วมด้วยอาจจะเกิดภาวะมีบุตรยากจาก impaired oocyte release หรือมีการขัดขวางไม่ให้ sperm เข้ามาสู่ peritoneal cavity หรือไปยับยั้งการทำงานของท่อรังไข่ในการพัดโบกเอา sperm เข้ามา
อัตราการตั้งครรภ์ที่ลดลงในผู้ป่วยที่มี advanced endometriosis เมื่อเทียบกับผู้ป่วยที่เป็น early stage หรือมี tubal factor infertility อาจเกิดจากการลดลงของจำนวน ovarian follicle ที่เร็วกว่าปกติ หรือมีความผิดปกติของ folliculogenesis (10) หรือ oozyte มีความสามารถในการ fertilization ลดลง ยิ่งถ้ามีประวัติของการผ่าตัดของรังไข่มาก่อนหน้านี้ยิ่งทำให้อัตราการตั้งครรภ์นั้นลดลงไปอีก (11)
Approach to treatment
การตัดสินใจว่าจะใช้วิธีใดในการรักษาภาวะมีบุตรยากที่เกิดจาก endometriosis นั้น เป็นเรื่องค่อนข้างยาก เนื่องจากงานวิจัยแบบ Randomized controlled Trials ที่จะเปรียบเทียบวิธีการและประสิทธิภาพในการรักษาแต่ละวิธีนั้นยังมีน้อย (13) แต่จากข้อมูลที่ผ่านมาพบกว่าการรักษาที่ได้ผล ได้แก่ conservative surgical therapy และ assisted reproductive technologies ส่วนการรักษาด้วยยานั้น มักจะไม่ค่อยได้ผล (12)
สิ่งที่นำมาพิจารณาในการรักษาผู้ป่วย endometriosis ที่เป็นคู่สมรสที่มีบุตรยาก ได้แก่ (13)
ในการรักษาภาวะมีบุตรยากนั้น จะต้องหาสาเหตุและรักษาโรคที่สามารถรักษาได้ก่อน ถ้าในบางสถาบัน สามารถทำ laparoscopy ได้ ก็จะสามารถช่วยวินิจฉัยแยกโรคได้ แต่สถาบันส่วนใหญ่อาจไม่ได้ใช่ laparoscopy ในการค้นหาสาเหตุของภาวะ infertility ทุกราย เนื่องจากจะต้องทำภายใต้การดมยาสลบ และอาจมีโอกาสต่อการเกิด complication ตามมาได้ ดังนั้น ในกรณีที่ไม่ได้ทำ laparoscopy เพื่อวินิจฉัย แต่ผู้ป่วยมีอาการที่ทำให้สงสัยว่ามีภาวะ endometriosis จะเริ่มให้การรักษาในแบบเดียวกันการรักษาผู้ป่วยที่มีภาวะ unexplained infertility ไปเลยก็ได้ คือ ได้รับ clomiphene citrate 3-4 cycle และการใช้วิธี intrauterine insemination (IUI) ร่วมกัน อย่างไรก็ตาม ปัจจุบันมีความเห็นว่าควรจะใช้ laparoscopy เพื่อเป็นการยืนยันการวินิจฉัยภาวะ endometriosis และวางแผนการรักษา (12)
ในกรณีที่เริ่มการรักษาเลย หากว่าการตั้งครรภ์ยังไม่เกิดขึ้นแม้ว่าจะได้ clomiphene และ ทำ IUI แล้ว สิ่งที่ควรทำต่อไปคือ
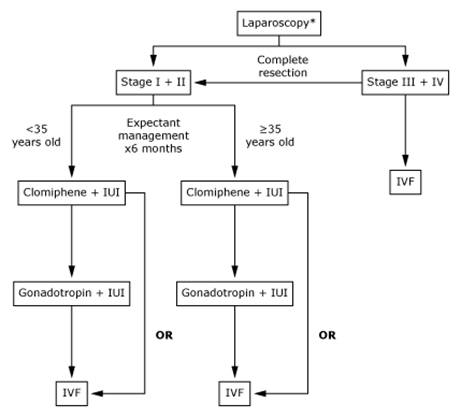
รูปที่ 3 Approach to treatment ในกรณีที่มี laparoscopy
ในผู้ป่วยที่อายุต่ำกว่า 35 ปี ควรทำ laparoscopy เพื่อการ diagnosis และการรักษาด้วยการทำ resection of endometriosis ก่อน ภายหลังจากทำการรักษาแล้ว อาจจะให้เวลาแก่คู่สมรสอีก 6 เดือนเพื่อที่จะให้โอกาสในการที่จะพยายามที่จะมีบุตรด้วยตัวเอง ถ้าไม่สำเร็จจะเปลี่ยนไปใช้วิธีการกระตุ้นให้มีการตกไข่ด้วยการใช้ clomiphene ตามด้วยการฉีด gonadotropin ร่วมกับการทำ IUI หรือในบางรายอาจจะให้ clomiphene ร่วมกับการทำ IUI ไปเลยก็ได้ ส่วนในรายที่อายุมากแล้ว อาจจะไม่จำเป็นต้องทำ laparoscope แต่ควรไปทำการกระตุ้นด้วยไข่ด้วย gonadotropin ร่วมกับทำ IUI หรือในบางรายที่สามารถทำ laparoscope ได้ และสามารถผ่าตัด endometriosis ได้ด้วย ก็ควรจะลดระยะเวลาเพื่อที่จะใช้การกระตุ้นไข่ร่วมกับทำ IUI ให้เร็วขึ้น ทั้งนี้เนื่องจากว่าในรายที่อายุมากแล้ว ยิ่งให้ intervention เร็วเท่าไหร่ยิ่งดีเพราะจำนวนของ ovarian folloicle เองก็จะลดลง ๆ ทุกที ในขณะที่ถ้าผู้ป่วยรายนี้สามารถทำ IVF ได้ การยืดระยะเวลาออกไป จะทำให้อัตราความสำเร็จจากการทำ IVF ก็จะลดลงไปด้วย โดยเฉพาะในรายที่รอยโรคเป็นไปมากแล้ว การทำ IVF เลยก็ถือว่าเป็นอีกทางเลือกที่ดีอีกทางเลือกหนึ่ง
ในกรณีที่คู่สมรสมีสาเหตุที่ทำให้มีภาวะมีบุตรยากหลายประการ เช่น มีปัญหาภาวะมีบุตรยากในฝ่ายชายด้วย มีปัญหาว่ามีจำนวนไข่ในฝ่ายหญิงลดลง อาจจะพิจารณาทำ IVF ไปเลยเนื่องจากการรักษาแบบ conservative therapy จะให้ผลเสียมากกว่า
Treatment of infertility in woman with endometriosis
เป็นที่ทราบกันดีอยู่แล้วว่า ยาที่ใช้ในการรักษา endometriosis ในปัจจุบันนั้น จะยับยั้งการทำงานของ ovarian function และเป็น contraceptive drugs มากกว่า ดังนั้น จึงไม่มีข้อบ่งชี้ที่จะใช้ในการรักษาภาวะมีบุตรยากที่เกิดจาก endometriosis ไม่ว่าจะเป็นการใช้เพื่อรักษาเดี่ยว ๆ หรือตามหลังการผ่าตัดก็ตาม (5) จากการศึกษาแบบ Randomized clinical trials พบว่าการรักษาด้วยการใช้ hormone อย่าง Danazol หรือ GnRH agonists เพื่อกดการโตของ endometriosis ไม่ช่วยในเรื่องของภาวะมีบุตรยาก หรือเพิ่มอัตราการตั้งครรภ์แต่อย่างใด (14-17) แต่พบว่าจะมีประสิทธิภาพในการช่วยลดอาการปวดจาก endometriosis มากกว่า
การรักษาด้วยการผ่าตัดในผู้ป่วย endometriosis ที่ได้ทำ laparoscope นั้น การวางแผนการรักษาในขั้นต่อไปจะขึ้นอยู่กับ operative findings ที่ได้จากการทำ laparoscope และผลจากการผ่าตัดผ่าน laparoscope ในครั้งนั้น ซึ่งแบ่งการรักษาตาม stage ของโรคได้ดังนี้
– Mild/minimal disease
สำหรับผู้ป่วยที่ เป็น mild/minimal endometriosis จากการศึกษาแบบ Randomized controlled trials พบว่า การทำ ablation หรือ excision ส่วนของ endometriosis ออก จะช่วยในเรื่องของภาวะมีบุตรยากได้ ถือว่า cost-effective (14,18) ภายหลังจากผ่าตัด ในผู้ป่วยที่อายุน้อยกว่า 35 ปี จะให้โอกาสในการมีบุตรเอง 6 เดือน ก่อนที่จะใช้วิธีกระตุ้นไข่ร่วมกับการทำ IUI ส่วนในผู้ป่วยที่อายุมากกว่า 35 ปี นั้น กระตุ้นไข่ร่วมกับทำ IUI อาจจะเริ่มได้เร็วกว่า 6 เดือนหลังจากที่ปล่อยให้คู่สมรสพยายามมีบุตรด้วยตัวเอง หรืออาจจะเริ่มทำทันทีหลังการผ่าตัดเลยก็ได้ ซึ่งที่ผ่านมาพบกว่าผู้ป่วยเองก็เลือกที่จะทำการกระตุ้นไข่ ร่วมกับทำ IUI เลยมากกว่าเนื่องจากความกังวลใจต่อการรักษา
– Moderate/ severe disease
รายที่โรค endometriosis เป็นแบบ moderate หรือ severe endometriosis การผ่าตัดจะผ่าตัดเอา ovarian endometrioma ตลอดจน superficial หรือ deep implants ของ endometriosis และ ส่วนที่เป็น pelvic adhesions ออกเพื่อให้กายวิภาคของอุ้งเชิงกรานและการทำงานกลับมาเป็นปกติ แม้ว่าประสิทธิภาพของการผ่าตัดเพื่อเลาะส่วนของ advanced endometriosis ออกเพื่อรักษาภาวะมีบุตรยากจะยังไม่มี Randomized trials พิสูจน์ว่าได้ผลจริง แต่ข้อมูลจาก nonrandomized study บางฉบับก็สรุปว่ามีความเป็นไปได้ที่โอกาสการตั้งครรภ์จะเพิ่มมากขึ้นหลังการทำ laparoscopy หรือ laparotomy ในการรักษาภาวะมีบุตรยากในผู้ป่วย severe endometriosis (19) นอกจากนี้ยังมี observational study อื่น ๆ ที่กล่าวว่า ในผู้ป่วย endometriosis Stage III/IV ที่ไม่มี infertility factor อื่น การทำ conservative surgery ด้วย laparoscopy หรือ laparotomy จะช่วยเพิ่มโอกาสในการมีบุตรได้มากขึ้น (12) และแม้ว่าท้ายที่สุดแล้วต้องทำ IVF อยู่ดี แต่การผ่าตัดเพื่อเลาะ deep infiltrating endometriosis โดยใช้ laparoscope จะก็ช่วยเพิ่มอัตราการตั้งครรภ์จากการทำ IVF ได้ (20)
ถ้าหากว่าการผ่าตัดในรายที่เป็น advanced stage endometriosis สำเร็จไปได้ด้วยดี การเริ่มการกระตุ้นไข่ร่วมกับการทำ IUI ก็จะสามารถทำได้ทันทีภายหลังจากผ่าตัดหรือจะให้โอกาสในการพยายามมีบุตรเอง 3-6 เดือนก่อนก็ได้เช่นเดียวกับในรายที่เป็น mild stage อย่างไรก็ตามหลังการผ่าตัด ถ้าหากว่าส่วนของ fallopian tube ยังไม่กลับสู่สภาพปกติ ยังมี adhesion มาก หรือว่ารอยโรคยังมีความรุนแรงอยู่ การทำ IVF อาจจะเป็นทางเลือกที่ดีกว่าการกระตุ้นไข่ภายหลังจากการทำการผ่าตัด โดยเฉพาะอย่างยิ่งในรายที่เป็นหญิงอายุค่อนข้างมาก หรือว่ามีปัจจัยเรื่องการมีบุตรยากจากทางด้านฝ่ายชายด้วย
– Repeated surgical resection
ในการผ่าตัดเพื่อรักษาภาวะมีบุตรยากในผู้ป่วย endometriosis ควรจะทำให้บรรลุผลการรักษาโดยเร็ว และเสร็จสิ้นตั้งแต่การผ่าตัดครั้งแรกเพราะว่าหลังจากนี้ อาจจะมี periovarion adhesions ที่รุนแรงเกิดตามมาได้และจะไปรบกวนการทำงานของท่อนำไข่ในการพัดโบกไข่เข้ามาในท่อ ซึ่งถ้าหากว่าการผ่าตัดครั้งแรกไม่สามารถทำให้มีการตั้งครรภ์เกิดขึ้นได้ การผ่าตัดซ้ำก็มิได้มีประสิทธิภาพในการเพิ่มอัตราการตั้งครรภ์ใหม่แต่อย่างใด จาก systemic review พบว่า ภายหลังจากการผ่าตัดซ้ำในผู้ป่วยที่มี recurrent endometriosis ความสำเร็จในการตั้งครรภ์มีเพียง 25% ซึ่งนับว่าเป็นเพียงครึ่งหนึ่งของความสำเร็จจากการผ่าตัดในครั้งแรก และน้อยกว่าอัตราการตั้งครรภ์จากการทำ IVF ดังนั้น แพทย์จึงควรพิจารณาถึงประโยชน์จากการทำการผ่าตัดครั้งที่สองหรือสามในการรักษาภาวะมีบุตรยาก กับความเสี่ยงในการผ่าตัดและโอกาสที่จะประสบความสำเร็จจากการเปลี่ยนไปทำ IVF แทน (21)
ในผู้ป่วยที่อายุน้อยกว่า 35 ปี พบว่าการรักษาภาวะมีบุตรยากด้วยการใช้ clomiphene citrate ร่วมกับการทำ IUI ถือว่าเป็นการรักษาที่เหมาะสม ส่วนในผู้ป่วยที่อายุมากกว่า 35 ปี ขณะนี้ยังไม่มีหลักฐานยืนยันชัดเจนว่าระหว่างการใช้ gonadotropin injection ร่วมกับ IUI จะให้ผลดีมากกว่าการใช้ clomiphene citrate ร่วมกับการทำ IUI แต่โดยส่วนใหญ่ แพทย์มักจะใช้ gonadotropin injection ในผู้ป่วยกลุ่มนี้มากกว่าเนื่องจากว่าต้องการการกระตุ้นการเจริญเติบโตของ follicle ด้วย
จุดมุ่งหมายของการใช้ combined therapy คือ จะสามารถกระตุ้นให้เกิด follicle development ได้ ทำให้มีการตกไข่ และมีระดับของ progesterone ที่เพิ่มสูงขึ้นในระยะ luteal phase ในขณะเดียวกัน ก็จะส่งอสุจิจำนวนมากเข้าไปใน reproductive tract เพื่อจะให้เกิดการ fertilization จากการศึกษาแบบ randomized trial ที่ผ่านมาพบว่า การกระตุ้นให้มีการตกไข่เมื่อใช้ร่วมกับการทำ IUI มักจะได้ผลดี และช่วยเพิ่มอัตราการตั้งครรภ์ในหญิงที่เป็น early stage endometriosis ได้ (22)
– Clomephene plus IUI
จากการศึกษาจะเห็นว่ามีการกล่าวถึงการใช้ clomephene ร่วมกับ IUI ในผู้หญิงที่เป็น early stage endometriosis เป็นส่วนใหญ่ แต่ก็มีบางท่านเชื่อว่าจะสามารถนำมาใช้กับผู้ป่วย endometriosis ระดับ advanced disease ที่ fallopian tubes ยังดี และได้มีการผ่าตัดเลาะ adhesion ได้เช่นกัน อย่างไรก็ตาม อัตราการตั้งครรภ์จากการใช้ clomiphene กับ IUI จะลดลง ๆ ตามจำนวนรอบ โดยเฉพาะเมื่อให้ไปรอบ 3-4 cycle (23) ดังนั้นถ้าให้ clomiphene ไปแล้ว 3-4 รอบยังไม่มีการตั้งครรภ์ อาจจะเปลี่ยนไปเป็นใช้วิธีการฉีด gonadotropin ร่วมกับ IUI แทน ส่วนในผู้ป่วยที่รอยโรครุนแรงมาก มีอาการปวด สงสัยกว่าอาจจะเป็น persistent หรือ recurrent disease ควรจะเปลี่ยนไปทำ IVF แทน
– Gonadotropin plus IUI
ผู้ป่วยที่ผ่านการกระตุ้นไข่ด้วย clomiphene แล้วแต่ไม่ประสบผลสำเร็จ อาจจะลองเปลี่ยนมาใช้ gonadotropin injections ร่วมกับทำ IUI แทน หลักการของการใช้วิธีนี้ คือ ช่วยกระตุ้นการเจริญเติบโตของ follicle กระตุ้น ovulation และ fertilization ซึ่งปัจจุบันมีการศึกษาแบบ randomized trials จำนวนมากที่สนับสนุนวิธีการนี้ ในการรักษาหญิงที่มีภาวะ mild endometriosis เมื่อเปรียบเทียบกับการไม่ให้การรักษาอะไรเลย หรือการให้การรักษาด้วยวิธีการอย่างใดอย่างหนึ่งเพียงอย่างเดียว (24 – 26)
นอกจากนี้ได้มีการศึกษาที่ได้รับการสนับสนุนโดย the National Instituted of Health ศึกษาในผู้หญิงที่เป็น early stage endometriosis หรือเป็น unexplained infertility ว่าการให้ gonadotropin injection ร่วมกับ IUI เป็นวิธีรักษาที่มีประสิทธิภาพ กว่าการทำ Intracervical insemination of sperm (ICI) หรือ Intrauterine insemination of sperm (IUI) เพียงอย่างเดียว (25) ข้อเสียหลัก ๆ ของการทำวิธีนี้ก็คือ อาจจะเพิ่มโอกาสการเกิดการตั้งครรภ์แฝดขึ้นได้ ดังนั้น แพทย์บางท่านจึงอาจจะข้ามวิธีการนี้ไป คือ หลังจากกระตุ้นด้วย clomiphene ไม่สำเร็จแล้ว ก็จะเปลี่ยนไปทำ IVF แทน เนื่องจากสามารถจะควบคุมจำนวน embryo ที่จะนำไปฝังยัง uterus ได้
เช่นเดียวกับการให้ clomiphene พบว่าอัตราการตั้งครรภ์ในผู้ป่วยที่ได้รับ 3-4 cycle ของการฉีด gonadotropin และทำ IUI จะมีอัตราการตั้งครรภ์ที่ลดลงเรื่อย ๆ ตาม cycle แพทย์ จึงอาจจะต้องให้คำแนะนำถึงการเปลี่ยนการรักษาไปเป็นการทำ IVF แทนด้วย ส่วนในกรณีที่เป็น mild endometriosis ก็สามารถที่จะเลือกทำ IVF ได้เลยเช่นเดียวกัน เพราะเคยมีการศึกษาในหญิงที่อายุน้อยกว่า 40 ปี ที่มี low stage endometriosis หรือ unexplained infertility ที่เคยได้ clomiphene กับ IUI มาก่อนนำมาสุ่มให้ได้รับการรักษาต่อด้วยการให้ FSH/IUI ต่อ 3 cycle ตามด้วย IVF อีก 6 cycle เปรียบเทียบกับกลุ่มที่ได้ IVF ไปเลย (27) พบว่า กลุ่มที่ได้ทำ IVF ต่อจะมีอัตราการตั้งครรภ์เพิ่มสูงขึ้นกว่า ระยะเวลาจากได้รับการรักษาจนถึงการตั้งครรภ์นั้นจะน้อยกว่า และเสียค่าใช้จ่ายน้อยกว่า
แม้ว่าการทำ IVF เป็นวิธีการที่ได้ผลดีที่สุดในการรักษาภาวะมีบุตรยาก และยังเป็นวิธีการที่มีอัตราการตั้งครรภ์สูงสุด แต่ยังไม่มีการศึกษาแบบ Randomized trial ในกลุ่มประชากรที่มากพอ ที่จะพิสูจน์ประสิทธิภาพของการทำ IVF ในผู้ป่วยที่มีภาวะมีบุตรยากจาก endometriosis (12) อย่างไรก็ตามได้มีการทำ meta – analysis ของการศึกษาแบบ observational study ถึงความสำเร็จของการตั้งครรภ์ด้วยวิธี IVF พบว่าในผู้ป่วยที่มีบุตรยากจาก endometriosis นั้นมีความสำเร็จของการตั้งครรภ์น้อยกว่าผู้ป่วยที่มีภาวะมีบุตรยากจากความผิดปกติของท่อนำไข่ และ เมื่อเปรียบเทียบอัตราการตั้งครรภ์ในกลุ่มผู้ป่วย endometriosis เองพบว่า กลุ่ม severe endometriosis จะมีอัตราการตั้งครรภ์น้อยกว่ากลุ่มที่เป็น mild/minimal endometriosis (28) อย่างไรก็ตามมีข้อมูลจากการศึกษาบางฉบับกล่าวว่าไม่พบว่าการทำ IVF จะประสบผลสำเร็จน้อยกว่าเมื่อเปรียบเทียบกับผู้หญิงคนอื่นที่ไม่ได้เป็น endometriosis (29)
ดังที่กล่าวมาแล้วว่าเมื่อเปรียบเทียบอัตราการตั้งครรภ์ในกลุ่มของ mild endometriosis กับกลุ่มที่เป็น severe endometriosis ที่ทำ IVF ในกลุ่ม mild endometriosis จะมีอัตราการตั้งครรภ์มากกว่า (28) ดังนั้น stage of disease มีความสำคัญโดยเฉพาะในกลุ่ม severe endometriosis ที่จำนวน oocyte ลดลง เก็บยาก มีทางเลือกในการรักษาน้อย อัตราความสำเร็จในการตั้งครรภ์ก็จะน้อยตามไปด้วย (30)
การรักษาผู้ป่วยที่มี endometrioma ที่มีภาวะมีบุตรยากโดยใช้วิธี IVF ใน เป็นเรื่องที่ตัดสินใจลำบาก เนื่องจากที่ผ่านมายังไม่มีการ แบบ randomized control trial ที่ยืนยันว่าการรักษา endometrioma ก่อน ซึ่งก็คือใช้การผ่าตัด จะสามารถเพิ่มโอกาสที่จะได้ทำ IVF สำเร็จ (31) สิ่งที่ต้องนึกถึงไว้เสมอนั้นก็คือ ตัวโรคเองก็ทำให้เกิดภาวะมีบุตรยากได้อยู่แล้ว ถ้าจะผ่าตัดเอา endometrioma ออกไปก็อาจจะส่งผลให้จำนวน oocyte ที่อยู่ใกล้ ๆ กับ cyst wall นั้นมีจำนวนน้อยลง ความถี่ของการเกิด ovulation ของรังไข่ด้านนั้น ๆ ก็จะลดลง (32 – 34)
อย่างไรก็ตามพบว่า มีการศึกษาแบบ randomized control trials ว่าด้วยการรักษาภาวะมีบุตรยากในผู้ป่วยที่มี endometioma ด้วยการผ่าตัด endometrioma ออกก่อน เปรียบเทียบกับกลุ่มที่ไม่ได้ให้การรักษาเรื่อง endometrioma ใด ๆ เลยก่อนทำ IVF ผลลัพธ์สุดท้ายพบว่าไม่มีความแตกต่างกันอย่างมีนัยยะสำคัญในเรื่องอัตราการตั้งครรภ์ (35) นอกจากนี้ยังมี การทำ Meta-analyses ของการศึกษาแบบ randomized controlled trial ระหว่างกลุ่มที่รักษา endometrioma ด้วยการผ่าตัดกับกลุ่มที่ไม่ได้รักษา ก็พบไปในทางเดียวกันว่า ไม่มีความแตกต่างกันทั้งในแง่ของการตอบสนองของรังไข่ต่อการกระตุ้น หรืออัตราการตั้งครรภ์ (36)
แม้ว่ายังไม่มีข้อสรุปที่แน่ชัดถึงแนวทางการรักษาในผู้ป่วยที่มี endometrioma ร่วมกับภาวะมีบุตรยาก แต่แพทย์ผู้เชี่ยวชาญมักจะไม่เลือกการผ่าตัดเอา endometrioma ออกก่อนทำ IVF เนื่องมาจากว่ายังไม่มีข้อดีที่ชัดเจน และการผ่าตัดรังไข่ อาจทำให้ ovarian function ลดลงได้ (35,36) ดังนั้น จะมีเพียงบางกรณีที่จะทำการผ่าตัดเอาก้อน endometrioma ออกก่อนได้แก่ gynecological indication เช่น มี pelvic pain หรือสงสัยภาวะ ovarian malignancy หรือว่าตำแหน่งหรือขนาดของ endometrioma นั้นอาจจะไปขัดขวางการทำ oocyte retrieval ระหว่างการทำ IVF
Cost- effectiveness
ในผู้ป่วยภาวะมีบุตรยากจาก advanced endometriosis เมื่อนำการรักษาหลาย ๆ วิธีการมาเปรียบเทียบกัน พบว่า การทำ IVF เลยจะเป็นวิธีการที่มี cost effective สูงสุด (37) ในขณะนี้ mild disease การทำตามขั้นตอน คือทำการกระตุ้นไข่ก่อนด้วย clomiphene ตามด้วย IUI ถ้าไม่สำเร็จก็เปลี่ยนไปทำ IVF เลย จะเสียค่าใช้จ่ายน้อยกว่าการเปลี่ยนไปทำการกระตุ้นด้วย gonadotropins ร่วมกับ IUI แล้วถ้าไม่สำเร็จค่อยมาทำเป็น IVF ซึ่งจะเสียค่าใช้จ่ายเพิ่มขึ้นไปอีกด้วย (38) ปัจจุบันการทำ IVF ก็มีอัตราการประสบความสำเร็จได้ดีขึ้น (39) และค่าใช้จ่ายต่อการเกิดมีชีพ 1 ครั้งก็ลดลงอีกด้วย
Summary and recommendations
– การ approach การรักษาภาวะมีบุตรยากที่เกิดจาก endometriosis นั้น ควรจะค้นหาสาเหตุที่ทำให้เกิดภาวะมีบุตรยากอื่น ๆ ที่สามารถรักษาได้ไปก่อน จากนั้นจึงมาคำนึงถึงปัจจัยสำคัญที่มีผลในการตัดสินใจเลือกวิธีการรักษา ได้แก่ อายุของฝ่ายหญิง มีภาวะมีบุตรยากจากสาเหตุอื่นร่วมด้วยขณะทำการรักษาหรือไม่ เช่น มีภาวะมีบุตรยากในฝ่ายชายด้วย ความรุนแรงของโรค endometriosis และ ปัจจัยทาง practical เช่น ความต้องการของผู้ป่วย และต้องคำนึงถึงความเสี่ยงและค่าใช้จ่ายของการรักษากับประสิทธิภาพของการรักษาด้วยวิธีนั้น ๆ ด้วย
– ในผู้ป่วยที่เป็น mild/ minimal endometriosis ที่ได้ทำ laparoscope เพื่อการวินิจฉัย แนะนำว่าให้ทำการรักษาไปด้วยเลย คือ ทำ ablation หรือ excision ส่วนที่เป็น endometriosis implants หลังการผ่าตัด ผู้หญิงที่อายุน้อยกว่า 35 ปี ควรจะพยายามมีบุตรด้วยตนเองให้ได้ก่อนภายใน 6 เดือน ถ้าไม่ประสบความสำเร็จ ควรทำ ovulation induction ร่วมกับทำ IUI ส่วนหญิงที่อายุมากกว่า 35 ปีแล้วนั้น การทำ ovulation induction ร่วมกับทำ IUI อาจทำได้เลยภายหลังการพยายามมีบุตรเองภายใน 3 – 6 เดือนหรือ ภายหลังการผ่าตัดเลยก็ได้ เนื่องจากอายุที่มากขึ้น ทำให้โอกาสที่จะตั้งครรภ์น้อยอยู่แล้ว
– ผู้ป่วยที่พบว่ามีภาวะ moderate หรือ severe endometriosis ระหว่างการทำ laparoscope แนะนำว่าให้ทำการ resection ส่วนของ endometriosis และ adhesion ไปเลยใน operative เดียวกัน ถ้าสามารถทำการผ่าตัดได้สำเร็จ ให้ทำ ovulation induction ร่วมกับทำ IUI ต่อซึ่งสามารถทำได้เลยหลังการผ่าตัด หรือ 3 -6 เดือนภายหลังที่ได้พยายามมีบุตรเองก่อนก็ได้
– ในรายที่เคยได้รับการผ่าตัดไปแล้ว แนะนำว่าไม่ควรจะทำการผ่าตัดเพื่อ resection รอยโรคจาก endometriosis อีก เนื่องจากว่าไม่ได้ช่วยให้ภาวะมีบุตรยากนั้นดีขึ้น
– การทำ ovulation induction ในผู้ป่วยที่อายุน้อยกว่า 35 ปี first line therapy ควรจะเป็น clomiphene citrate 3 – 4 cycles ก่อน และใช้วิธี gonadotropin injections เป็น second line therapy ส่วนรายที่อายุมากกว่า 35 ปี ควรใช้ gonadotropin injections เป็น first line therapy และการทำ ovulation induction ควรทำควบคู่ไปกับการทำ IUI
– สำหรับการทำ IVF นั้น ให้ทำในกรณีที่ไม่สามารถตั้งครรภ์ได้แม้ว่าจะใช้วิธีการต่าง ๆ ดังกล่าวข้างต้นมาแล้ว และควรใช้ในกรณีที่พบว่าการผ่าตัดไม่สามารถทำให้ fallopian tubes กลับมาเป็นปกติ หรือ ยังคงมี severe tubal adhesions หรือ รอยโรคนั้นมีความรุนแรงมากจริง ๆ ไม่สามารถรักษาให้หมดไปได้ด้วยการผ่าตัด
– ในผู้ป่วยที่มี endometrioma การรักษาด้วยการผ่าตัดก่อนการทำ IVF มีเพียงกรณีที่เกี่ยวข้องกับ gynecological indication เท่านั้น ได้แก่ มี pelvic pain หรือ สงสัยว่ามี ovarian malignancy หรือ ตัว endometrioma นั้นไปขัดขวาง oocyte retrieval ระหว่าง IVF cycle
Reference
จุดประสงค์หลักของการตรวจสุขภาพของทารกในครรภ์ คือ ค้นหาทารกในครรภ์ที่มี ที่มีความเสี่ยงต่อการเกิด การบาดเจ็บ ต่อระบบประสาทในครรภ์ (neurologic injury) และการเสียชีวิต ซึ่งถ้าเป็นภาวะที่สามารถป้องกันได้ จะได้เฝ้าระวังมิให้เกิดขึ้น ในการตั้งครรภ์ที่มีความเสี่ยงสูงทารกจะมีการปรับตัวเพื่อตอบสนองต่อภาวะขาด อ็อกซิเจนและภาวะเลือดเป็นกรด ซึ่งเป็น Physiologic change ที่สามารถตรวจพบได้
การปรับตัวของทารกที่ตอบสนองต่อภาวะขาดอ๊อกซิเจน
การประเมินสุขภาพของทารกในครรภ์ในระยะคลอด เป็นงานที่ท้าทาย สาเหตุที่จำเป็นจะต้องมีการติดเครื่องมอนิเตอร์การเต้นของหัวใจทารกในครรภ์ (FHR) คือ ลักษณะการเต้นของหัวใจ เป็นเครื่องมือหนึ่ง (indirect marker) ที่บอกถึง การทำงานของหัวใจและการทำงานของสมองส่วน medulla ที่ตอบสนองต่อการเปลี่ยนแปลง ปริมาณเลือดที่ไปเลี้ยงร่างกายของทารก ภาวะเลือดเป็นกรด และการขาดอ็อกซิเจน
มีการศึกษาที่เปรียบเทียบระหว่างการฟัง FHR เป็นระยะๆกับการติดเป็น monitor เลยพบว่า ทั้งสองวิธีสามารถ ลดอัตราการเสียชีวิตของทารกในครรภ์ได้ ไม่แตกต่างกัน แต่ยังไม่มีการศึกษาที่เปรียบเทียบระหว่างการ monitor กับ ไม่ monitor เลย แต่ทั้งสองวิธีช่วยลด mortality rate ได้แน่นอน
Primary Goal : เพื่อเฝ้าระวังภาวะขาดอ๊อกซิเจน และเลือดเป็นกรดในทารก จะได้สามารถ ให้การ ช่วยเหลือได้ทัน เพื่อป้องกันการเสียชีวิต
Secondary Goal : เพื่อหลีกเลี่ยงการเกิดบาดเจ็บต่อระบบประสาทของทารกในครรภ์
ในหญิงตั้งครรภ์ความเสี่ยงต่ำอาจจะไม่มีความจำเป็นต้องติดเครื่องมอนิเตอร์อัตราการเต้นของหัวใจ
แนะนำให้ฟังเป็นระยะ ซึ่งในการตั้งครรภ์ความเสี่ยงต่ำไม่ว่าจะใช้วิธีไหนก็ไม่แตกต่างกันทั้งในด้านการลด การเสียชีวิตของทารกใน ครรภ์ APGAR Score และ ผลกระทบต่อระบบประสาทของทารก ซึ่งการติด มอร์นิเตอร์สร้างความรำคาญให้ผู้ป่วย ได้มากกว่า
แต่ในหญิงตั้งครรภ์ความเสี่ยงสูง(High risk pregnancy)ควรจะได้รับการมอนิเตอร์อย่างต่อเนื่องในช่วงระยะคลอด
1. Intermittent auscultation ใช้เครื่องมือที่เรียกว่า Doppler Ultrasound หรือ fetal stethoscope
ในหญิงตั้งครรภ์ความเสี่ยงต่ำ แนะนำ
โดยการฟังครั้งละ 1-2 นาที ทั้งช่วงก่อนการบีบรัดตัวของมดลูก ระหว่างและหลัง การบีบรัดตัว จะทำให้ทราบ pattern ได้ ของการเปลี่ยนแปลง FHR ได้ ถ้ามีการลดลงของ FHR ตามหลังการหดรัดของมดลูก อาจนึกถึง Late deceleration จำเป็นต้องมอร์นิเตอร์แบบต่อเนื่องต่อ
2. Electronic FHR monitoring
External monitoring : มีความน่าเชื่อถือพอๆกับ Internal monitoring และเป็นทางเลือกแรกที่จะใช้ก่อน ยกเวันแต่เมื่อไม่สามารถแปลผลได้โดยพยายาม เปลี่ยนท่าทางแล้ว เฝ้าอย่างใกล้ชิดแล้ว จึงจะพิจารณาเปลี่ยนเป็น Internal monitoring
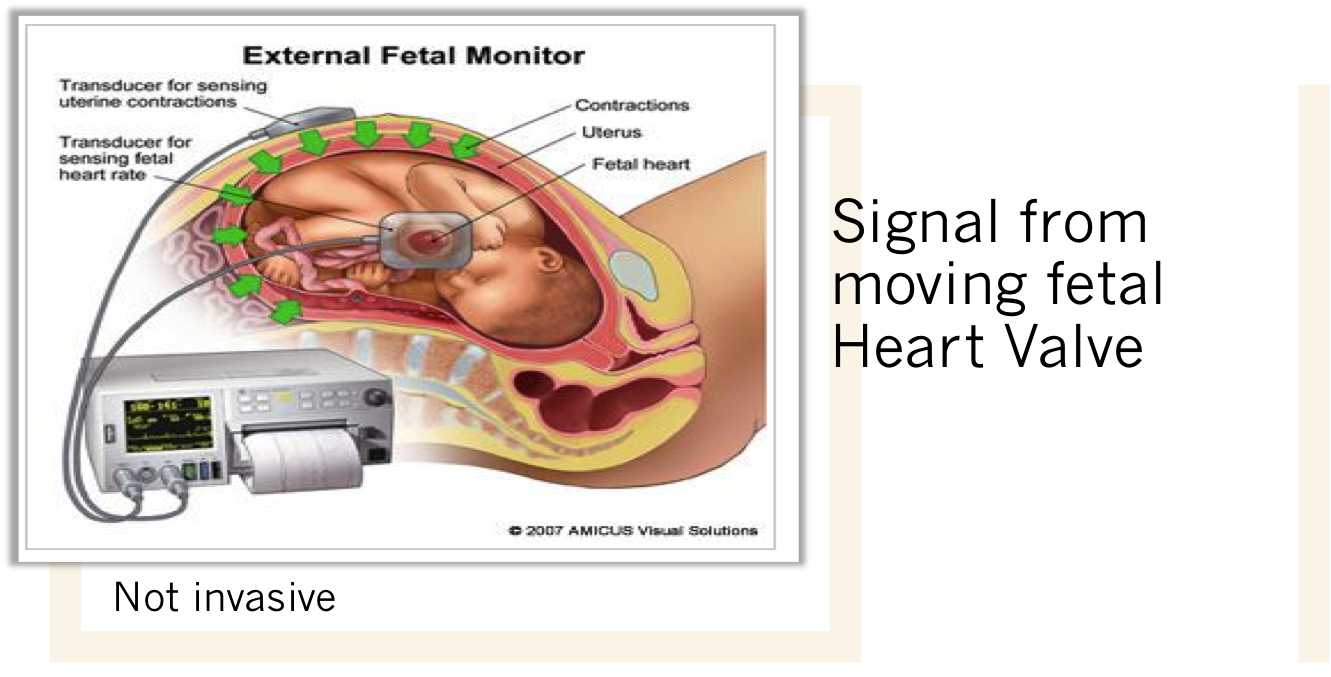
Internal monitoring : เป็นเครื่องมือที่ค่อนข้าง รบกวนต่อความสะดวกสบายของคนไข้ (invasive) จะใช้เฉพาะระยะคลอดเท่านั้น เนื่องจากต้องเจาะถุงน้ำคร่ำ (Amniotomy) เพื่อ ใส่ Bipolar spiral electrode ผ่านทางช่องคลอด ไปติดกับศรีษะเด็ก โดยเครื่องมือจะตรวจจับคลื่นไฟฟ้าหัวใจของทารกในครรภ์ (EKG) และ แปลผลด้วยใช้ความห่างระหว่าง R wave
ข้อดี ของวิธีนี้ คือแปลผลได้ชัดกว่า แต่ค่อนข้าง invasive จึงใช้เฉพาะในรายที่ไม่สามารถแปลผลโดยใช้ External monitoring ข้อบ่งห้าม ห้ามใช้ในสตรีที่มีความเสี่ยงต่อการติดเชื้อได้ง่าย มารดาติดเชื้อ HIV
มารดาติดเชื้อไวรัสตับอักเสบบี และซี
ซึ่งได้รับการรับรองโดย American College of OB and Gyn (ACOG)3-4
1.Variability คือ อัตราการเต้นของหัวใจทารกที่มีการเปลี่ยนแปลง (fluctuate) ที่ไม่สม่ำเสมอ ทั้ง amplitude และ ความถี่ (frequency)
Absent : ไม่เห็นการเปลี่ยนแปลงของ amplitude
Minimal :มีการเปลี่ยนแปลง 0 ถึง 5 beat / min
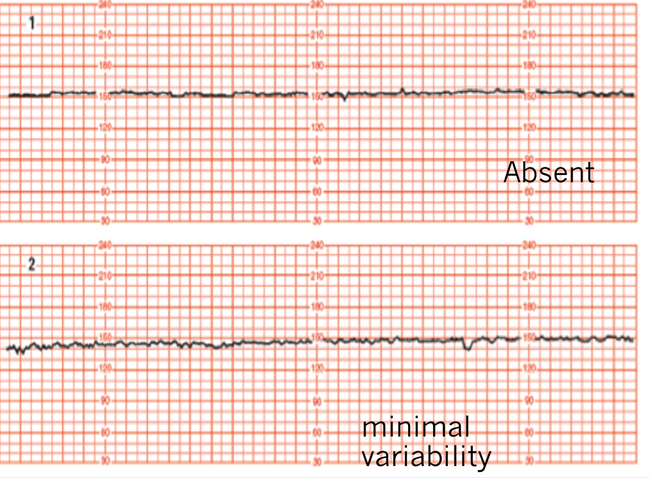
Moderate : มีการเปลี่ยนแปลง 6 ถึง 25 beat/min
Marked : มีการเปลี่ยนแปลงมากกว่า 25 beat/min

2. Baseline rate : ค่าเฉลี่ยของอัตราการเต้นของหัวใจทารก มีการเปลี่ยนแปลง 0 – 5 bpm ในระยะเวลา 10 นาที ไม่รวม การเปลี่ยนแปลงแบบชั่วคราว การเปลี่ยนแปลงที่มีลักษณะของ mark variability หรือช่วงระยะเวลาที่มีความแตกต่างกัน มากกว่า 25 bpm โดย baseline คงอยู่อย่างน้อย 10 นาที
3. Acceleration : การเพิ่มขึ้นของ FHR แบบทันที
ก่อนอายุครรภ์ 32 สัปดาห์ FHR สูงจาก baseline มากกว่า 10 bpm เป็นเวลามากกว่า 10 วินาที
หลังอายุครรภ์ 32 สัปดาห์ FHR สูงจาก baseline มากกว่า 15 bpm เป็นเวลามากกว่า 15 วินาที
Prolong acceleration สูงจาก baseline เดิมเป็นเวลามากกว่า 2 นาที แต่น้อยกว่า 10 นาที ถ้ามากกว่า 10 นาที อาจจะ เป็นการเปลี่ยน baseline
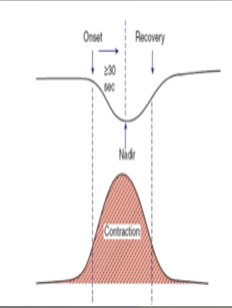
4.Late Deceleration : FHR ค่อยๆลดลงและกลับเข้าสู่ Baseline สัมพันธ์กับการหดรัดตัวของมดลูก โดยช่วงที่ต่ำที่สุด เกิดขึ้นตามหลังกับการหดรัดตัวของมดลูกที่สูงที่สุด Uteroplacental insufficiency , มารดามีความดันโลหิตที่ต่ำลง ทำให้ปริมาณเลือดที่ไปเลี้ยงมดลูกไม่พอ ทารกขาดออกซิเจนในเลือด , Uterine hyperactivity
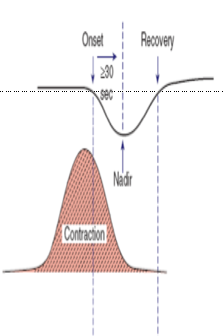
5. Early Deceleration : ค่อยๆลดลงและกลับเข้าสู่ Baseline สัมพันธ์กับการหดรัดตัวของมดลูกโดยช่วงที่ต่ำ ที่สุดเกิดขึ้นพร้อมกับการหดรัดตัวของมดลูกที่สูงที่สุดสาเหตุ ส่วนใหญ่เกิดจาก เป็นการเปลี่ยนแปลงแบบ Physiologic change ศรีษะของทารกถูกกด ส่วนใหญ่จะเกิดในช่วงที่มีการเปิดของปากมดลูก 4 ถึง 7 เซนติเมตร
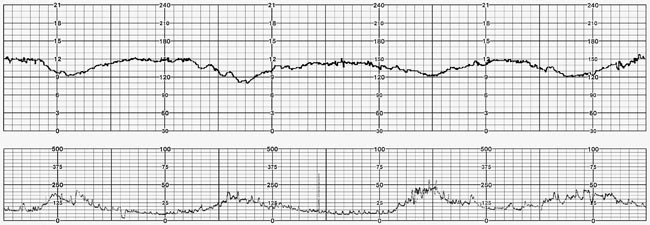
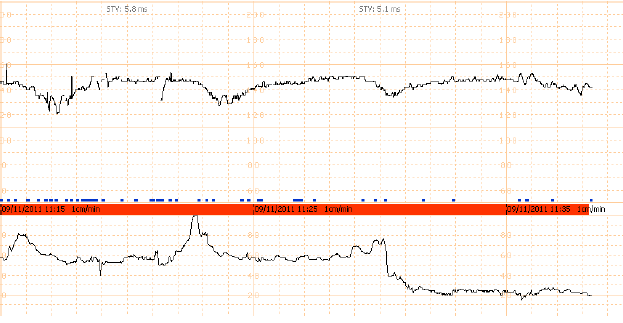
6. Variable deceleration : มีการลดลงของ FHR ต่ำกว่า baseline โดย ลดลงมากกว่า 15 bpm เป็นเวลามากกว่า 15 วินาทีแต่น้อยกว่า 2 นาที โดย onset , ความลึก และระยะเวลา ไม่สัมพันธ์กับการหดรัดตัวของมดลูก สัมพันธ์กับภาวะที่สายสะดือของทารกถูกกด
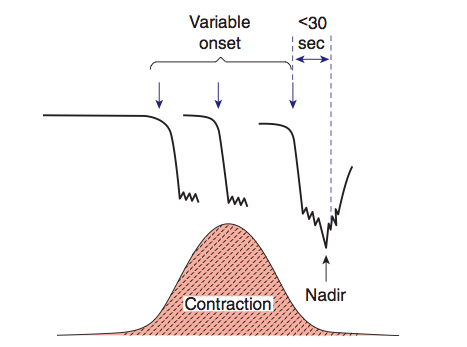
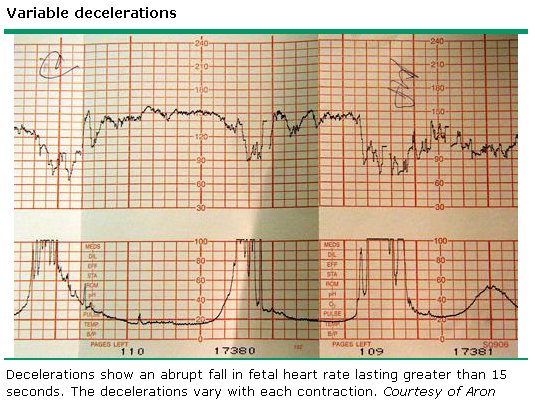
7. Prolong deceleration : มีการลดลงของ FHS ต่ำกว่า baseline อย่างน้อย 15 bpm และเป็นเวลาอย่างน้อย 2 นาที แต่ไม่ถึง 10 นาที นับตั้งแต่เริ่มต่ำลงจนถึง กลับเข้าสู่ rate ปกติ
1. Category I : บ่งบอกว่ามีโอกาสที่ทารกจะมีภาวะเลือดเป็นกรดน้อยมาก ในช่วงระยะเวลานั้น
(AT That point in Time )แต่ไม่สามารถบอกถึงอนาคตได้ จัดเป็น Category I ประกอบด้วย6
ซึ่ง FHR acceleration และ moderate variability เป็น important finding คู่กัน ที่บ่งบอกถึง การทำงานของหัวใจและหลอดเลือดยังอยู่ในภาวะที่ปกติอยุ่ ณ เวลานั้น
2. Category III: สัมพันธ์กับสภาวะเลือดเป็นกรดของทารกในครรภ์ในช่วงเวลานั้น ควรได้รับการประเมิน สาเหตุที่สามารถแก้ไขได้ และ เพิ่มปริมาณเลือด และอ็อกซิเจน ที่ไปเลี้ยงมดลูกและรก (uteroplacental perfusion) จัดเป็น Category III ประกอบด้วย
• Absent หรือ Minimal variability with deceleration หรือBradycardia : การที่ไม่มี
variability บ่งบอกถึง ทารกในครรภ์มีภาวะสมองขาดอ็อกซิเจน (cerebral hypoxia) และบ่ง
บอกถึงการที่ทารกไม่สามารถ compensate ภาวะ Hypoxia แล้วตามด้วย7
ความผิดปกติของ FHR Pattern ดังต่อไปนี้ บ่งบอกถึงความผิดปกติของ ภาวะ กรด และด่างในร่างกายทารก
Recurrent Late deceleration คือ ลักษณะของFHR tracing ที่มีลักษณะของ Late deceleration มากกว่า 50% ของ Contraction เกิดจาก reflex ของระบบประสาทส่วนกลางที่ตอบสนองต่อภาวะ Hypoxiaและ ภาวะเลือดเป็นกรด
Recurrent variable deceleration คือ เกิดขึ้นเมื่อสายสะดือของทารกถูกกด ในกรณีที่มีน้ำคร่ำ น้อย มีภาวะ nuchal cord , หรือ umbilical vein มีผนังบางทำให้ง่ายต่อการถูกกด ภาวะที่สายสะดือถูกกด
เป็นครั้งคราว ทารกสามารถทนต่อภาวะนี้ได้ แต่ถ้าถูกกดบ่อยขึ้นและนานขึ้นอาจกลายเป็น Metabolic acidosis ได้
Bradycardia : FHR น้อยกว่า 110 bpm และ ไม่มี variability อาจทำให้ tissue perfusion ไม่เพียงพอต่อ ทารก สาเหตุเกิดจาก ภาวะ Hypothermia , การได้รับยาบางอย่าง เช่น β adrenergic blocker
Sinusoidal heart rate pattern : รูปแบบการเต้นของหัวใจทารกมีลักษณะแบบมี variability ที่สม่ำเสมอ โดยมี period ประมาณ 3-5 รอบต่อนาที แบบ pattern ซ้ำๆ และมี amplitude 5 -40 bpm ไม่มีลักษณะของ deceleration และ acceleration ที่ตอบสนองต่อการดิ้นของทารก pattern แบบนี้สัมพันธ์กับ Fetal anemia ซึ่งทำให้เกิด fetal hypoxia FHR แบบนี้เชื่อกันว่าเป็น preterminal แต่ในระยะหลัง ถ้า pattern กลับสู่ปกติ เชื่อว่าอาจเกี่ยวข้องกับ physiologic change ของ peripheral arterial resistance ของทารก , fetal sucking movement , มารดาได้รับยาประเภท narcotic ถ้าพบ sinusoidal pattern ควรหาสาเหตุที่แก้ไขได้ก่อน ควรหาสาเหตุของ fetal anemia
การทำ Ultrasound ช่วยแยกสาเหตุดังกล่าวข้างต้นได้ หรือ droppler Ultrasound อาจช่วยบอกภาวะ severe anemia ได้ sinusoidal pattern สามารถกลับสู่ปกติได้ แต่ถ้าแย่ลง อาจจะต้องพิจารณาให้คลอดทันที
3. Category II : คือลักษณะที่ไม่เข้าเกณฑ์ ทั้ง CAT I และ CAT II
Category I เป็น normal tracing แสดงถึง ภาวะสมดุลของกรดและด่าง ในร่างกายของทารก ณ ขณะนั้น
Category II เป็น tracing ที่ยังไม่เข้าเกณฑ์ที่ผิดปกติชัดเจน ยังไม่สามารถบ่งบอกถีงภาวะผิดปกติของความเป็นกรดด่างได้ จำเป็นต้องได้รับการประเมินต่อไป
Category III เป็น tracing แสดงถึงความผิดปกติ ของสมดุลกรดและด่างในร่างกายทารก เมื่อเกิดภาวะนี้ขึ้น จำเป็นจะต้องประเมินหาสาเหตุ และ Intrauterine resuscitation เพื่อเพิ่มปริมาณ O2 ให้ทารกและ เพิ่มการไหลเวียนของเลือดที่รก (Uteroplacental insufficiency) โดย
แต่ถ้าไม่ดีขึ้นหลังจากนี้ ควรพิจารณาให้คลอดเลย
สรุป การตรวจสุขภาพของทารกในครรภ์ คือ ค้นหาทารกในครรภ์ที่มี ที่มีความเสี่ยงต่อการเกิด การบาดเจ็บต่อระบบ ประสาทในครรภ์ (neurologic injury) และการเสียชีวิต ซึ่งถ้าเป็นภาวะที่สามารถป้องกันได้ จะได้เฝ้าระวังมิให้เกิดขึ้น ดังนั้น แพทย์ผู้ตรวจจำเป็นต้องทาราบว่ามารดา คนใดมีความเสี่ยงสูง จะได้สามารถเฝ้าระวัง และให้การช่วยเหลือก่อนที่จะ มีความพิการเกิดขึ้น
 เรียนเชิญ อาจารย์แพทย์ แพทย์ประจำบ้าน และแพทย์ประจำบ้านหลักสูตรต่อยอด เข้าร่วมประชุมวิชาการ
เรียนเชิญ อาจารย์แพทย์ แพทย์ประจำบ้าน และแพทย์ประจำบ้านหลักสูตรต่อยอด เข้าร่วมประชุมวิชาการ
Menopasue acadamic Conference (MAC) 2011,
Theme : Sensible Perimenopause Medicine
วันที่ 9-11 ธันวาคม 2554 ณ โรงแรม ฮอลิเดย์อินน์ เชียงใหม่ (เวสทิน เดิม)
ทั้งนี้ทางคณะกรรมการได้ลงทะเบียนให้อาจารย์แพทย์ และแพทย์ทุกท่านไว้เรียบร้อยแล้ว และภาควิชาฯได้แจ้งการงดออกตรวจผู้ป่วยนอกห้องตรวจ 3, 4 และ 5 สำหรับวันศุกร์ที่ 9 ธันวาคม 2554 ไว้แล้ว)
(Brochure page1 page2)
 ประธาน อฝส. แจ้งเลื่อนสอบ Basic Science สำหรับแพทย์ประจำบ้าน จากวันที่ 1 ธันวาคม 2554
ประธาน อฝส. แจ้งเลื่อนสอบ Basic Science สำหรับแพทย์ประจำบ้าน จากวันที่ 1 ธันวาคม 2554
เป็น 4 กุมภาพันธ์ 2555
 วันจันทร์ที่ 7 และ 14 พฤศจิกายน 2554 มีการสอบแพทย์ประจำบ้านสูติศาสตร์ 13.00-16.00 วันจันทร์ที่ 7 สอบ MCQ โดย computer-based ที่ห้องคอมพิวเตอร์ชั้นสอง อาคารราชนครินทร์
วันจันทร์ที่ 7 และ 14 พฤศจิกายน 2554 มีการสอบแพทย์ประจำบ้านสูติศาสตร์ 13.00-16.00 วันจันทร์ที่ 7 สอบ MCQ โดย computer-based ที่ห้องคอมพิวเตอร์ชั้นสอง อาคารราชนครินทร์
วันจันทร์ที่ 14 สอบ MEQ ที่ห้องเรียน 2
แพทย์ประจำบ้าน และอาจารย์แต่ละจุดปฏิบัติงาน กรุณาวางแผนการบริหารจัดการล่วงหน้าตามจุดต่าง ๆ ด้วยนะครับ
 ขอแสดงความยินดีกับหนุ่ย (ทศพล) และสุคำ ที่ได้รับรางวัลเกียรติบัตรพนักงานมหาวิทยาลัย (ชั่วคราว) และลูกจ้างประจำดีเด่น ประจำปี 2554 นับเป็นอีกความภาคภูมิใจของเราชาวพี่ ๆ น้อง ๆ สูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
ขอแสดงความยินดีกับหนุ่ย (ทศพล) และสุคำ ที่ได้รับรางวัลเกียรติบัตรพนักงานมหาวิทยาลัย (ชั่วคราว) และลูกจ้างประจำดีเด่น ประจำปี 2554 นับเป็นอีกความภาคภูมิใจของเราชาวพี่ ๆ น้อง ๆ สูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
ซึ่งเป็นโรคที่ยังไม่มีทางรักษาให้หายขาดได้ในปัจจุบัน ในประเทศไทยได้มีการแพร่ระบาดของเชื้อเอชไอวี
มาแล้วมากกว่า 20 ปี โดยในปี พ.ศ. 2527 พบผู้ติดเชื้อรายแรกเป็นชายรักร่วมเพศ ต่อมามีการแพร่กระจายเข้าสู่สถาบันครอบครัวและมีการติดเชื้อเอชไอวีในสตรีวัยเจริญพันธ์ อุบัติการณ์ของการติดเชื้อเอชไอวีในสตรีตั้งครรภ์เพิ่มขึ้นจากร้อยละ 0 ในปีพ.ศ. 2532 จนสูงสุดถึงร้อยละ 2.29 1 ในปี พ.ศ.2538 หลังจากนั้นจึงลดลงมาตามลำดับ โดยในปี พ.ศ. 2550 ความชุกของการติดเชื้อในสตรตั้งครรภ์ที่มาฝากครรภ์เท่ากับร้อยละ 0.76 2
การดูแลหญิงตั้งครรภ์หรือการวางแผนจะตั้งครรภ์ที่ติดเชื้อเอชไอวีควรได้รับคำปรึกษาเกี่ยวกับทางเลือกในการมีบุตรอัตราความเสี่ยงของการถ่ายทอดเชื้อไปสู่ทารกภาวะแทรกซ้อนของการตั้งครรภ์และยาต้านไวรัสที่อาจได้รับขณะตั้งครรภ์เป้าหมายของการดูแลรักษาขณะตั้งครรภ์เพื่อรักษาให้มารดามีสุขภาพที่ดีได้รับยาต้านไวรัสที่เหมาะสมทำให้ภูมิต้านทานสามารถลดจำนวนเชื้อไวรัสและลดอัตราการถ่ายทอดเชื้อจากมารดาสู่ทารกโดยไม่กระทบต่อการให้ยาต้านไวรัสเอชไอวีในอนาคต พร้อมทั้งได้รับการส่งต่อเพื่อการดูแลรักษาอย่างต่อเนื่องหลังการคลอดบุตร
ในสตรีตั้งครรภ์ที่ติดเชื้อ เอชไอวี พบว่าร้อยละของเม็ดเลือดขาว CD4 และจำนวนเชื้อไวรัส (viral load) มีระดับลดลงในช่วงตั้งครรภ์และกลับเพิ่มขึ้นเท่าเดิมในระยะหลังคลอด และไม่พบว่าสตรีตั้งครรภ์ที่ติดเชื้อเอชไอวีมีความเสี่ยงต่อการเสียชีวิตหรือมีการดำเนินโรคไปเป็นโรคเอดส์มากกว่าสตรีที่ไม่ตั้งครรภ์ 3
การติดเชื้อเอชไอวีในมารดาไม่ได้เพิ่มความพิการแต่กำเนิดในทารกแม้ว่าทารกนั้นเกิดจากการติดเชื้อ เอชไอวีตั้งแต่อยู่ในครรภ์ แต่ยังมีความขัดแย้งของข้อมูลในเรื่องการเพิ่มขึ้นของอัตราการคลอดก่อนกำหนด
ทารกน้ำหนักตัวน้อย การเจริญเติบโตช้าในครรภ์และทารกตายคลอด เมื่อเปรียบเทียบกับในสตรีทั่วไป3
การให้ยาต้านไวรัสแก่หญิงตั้งครรภ์ ต้องคำนึงถึงปะโยชน์ทั้งสองด้านประโยชน์ต่อสุขภาพของตัวของหญิงตั้งครรภ์เองและประโยชน์ในการลดความเสี่ยงการติดเชื้อเอชไอวี จากมารดาสู่ทารก
การส่งตรวจทางห้องปฏิบัติการ
ก่อนเริ่มให้ยาต้านไวรัสจำเป็นต้องให้การปรึกษาแนะนำแก่หญิงตั้งครรภ์ถึงประโยชน์และความเสี่ยงหรือผลข้างเคียงของการรับประทานยา การปฏิบัติตัวระหว่างการรับประทานยาต้านไวรัส หลักการให้ยาต้านไวรัส เอชไอวี ในสตรีตั้งครรภ์จะเหมือนในผู้ป่วยที่ไม่ตั้งครรภ์ การเลือกสูตรยาควรพิจารณาจากสูตรที่มารดาสามารถทนต่ออาการข้างเคียงได้ดี มีผลต่อทารกน้อย และประวัติการใช้ยาต้านไวรัสที่มารดาได้รับมาก่อน หากมีความจำเป็นต้องใช้ยาต้านไวรัส เอชไอวี จะต้องพิจารณาความเสี่ยงที่จะก่อให้เกิดความพิการในทารก
สูตรยา HAART สำหรับหญิงตั้งครรภ์ที่แนะนำโดยองค์การอนามัยโลก ประกอบด้วย AZT (Zidovudine) และ 3TC (Lamivudine) ซึ่งเป็นยาในกลุ่ม NRTI (Nucleoside reverse transcriptase inhibitor ) ร่วมกับยาตัวที่สามเลือกระหว่างยาในกลุ่ม NNRTI (Non-nucleoside reverse transcriptase inhibitor ) ได้แก่ EFV ( Efavirenz) หรือยาในกลุ่ม PI (Protease inhibitor) ได้แก่ LVP/r (Lopinavir/ritonavir) หรือยาในกลุ่ม NRTI ได้แก่ ABC(Abacavir) ทั้งนี้หากเลือกใช้ยาในกลุ่ม NNRTI ในหญิงตั้งครรภ์ที่จะหยุดยาหลังคลอดจะต้องให้ AZT และ 3TC รับประทานต่อไปอีก 1 สัปดาห์ เพื่อลดความเสี่ยงของการดื้อยาดังนั้นยาสูตร AZT+3TC+LPV/r จึงถูกเลือกเป็นสูตรหลักในแนวทางการให้ยาต้านไวรัสแก่หญิงตั้งครรภ์ของกระทรวงสาธารณสุข โดยให้ AZT ขนาด 200-300 มิลลิกรัม ทุก 12 ชั่วโมง, 3TC ขนาด 150 มิลลิกรัม ทุก 12 ชั่วโมง และ LPV/r ขนาด 400/100 มิลลิกรัมทุก 12 ชั่วโมง
ยาต้านไวรัสที่ห้ามใช้ในหญิงตั้งครรภ์คือสูตรยาที่ประกอบด้วย d4T (Stavudine) และ ddI (Didanosine) ส่วนยาที่ควรหลีกเลี่ยงในไตรมาสแรกของการตั้งครรภ์คือ EFV เนื่องจากมีความเสี่ยงต่อความพิการของระบบประสาทแก่ทารกในครรภ์ นอกจากนี้ไม่แนะนำให้ใช้ NVP (Nevirapine) กรณีที่เริ่มยาในรายที่มีระดับเม็ดเลือดขาว CD4 มากกว่า 350 เซลล์ต่อลูกบาศก์มิลลิเมตร
กรณีที่หญิงตั้งครรภ์ใช้ยาต้านไวรัสมาก่อนตั้งครรภ์ แนะนำให้รับประทานต่อเนื่องไป ยกเว้นหากได้รับ EFV ให้พิจารณาเปลี่ยนเป็นยาตัวอื่นแทนในช่วงไตรมาสแรก
สำหรับการให้การดูแลและการให้ยาต้านไวรัสในกรณีอื่นๆ มีรายละเอียดดังตารางนี้
|
สถานการณ์ |
คำแนะนำเรื่องการดูแลและการใช้ยาต้านไวรัส |
| 1. สตรีตั้งครรภ์ติดเชื้อเอชไอวีที่ไม่เคยได้รับยาต้านไวรัสมาก่อน และ CD4 < 350 cells/mm3 | 1.1 ระยะก่อนคลอด
1.2 ระยะเจ็บครรภ์คลอด
1.3 ระยะหลังคลอด (มารดา)
1.4 ระยะหลังคลอด (ทารก)
|
|
สถานการณ์ |
คำแนะนำเรื่องการดูแลและการใช้ยาต้านไวรัส |
| 2. สตรีตั้งครรภ์ติดเชื้อเอชไอวีที่ไม่เคยได้รับยาต้านไวรัสมาก่อน และ CD4 > 350 cells/mm3 | 1.1 ระยะก่อนคลอด
1.2 ระยะเจ็บครรภ์คลอด
1.3 ระยะหลังคลอด (มารดา)
1.4 ระยะหลังคลอด (ทารก)
|
|
สถานการณ์ |
คำแนะนำเรื่องการดูแลและการใช้ยาต้านไวรัส |
| 3. สตรีตั้งครรภ์ติดเชื้อเอชไอวีที่ได้รับยาต้านไวรัสตั้งแต่ก่อนตั้งครรภ์ (หรือเคยได้รับยาต้านไวรัสตั้งแต่ก่อนตั้งครรภ์ แต่ปัจจุบันไม่ได้รับยาแล้ว) | 1.1 ระยะก่อนคลอด
1.2 ระยะเจ็บครรภ์คลอด
1.3 ระยะหลังคลอด (มารดา)
1.4 ระยะหลังคลอด (ทารก)
|
|
สถานการณ์ |
คำแนะนำเรื่องการดูแลและการใช้ยาต้านไวรัส |
| 4. สตรีตั้งครรภ์ที่ไม่เคยได้รับยาต้านไวรัสมาก่อน และอยู่ในระยะเจ็บครรภ์คลอด | 1.1 ระยะเจ็บครรภ์คลอด
1.2 ระยะหลังคลอด (มารดา)
1.3 ระยะหลังคลอด (ทารก)
|
ที่สำคัญต้องมีการเน้นให้ผู้ติดเชื้อรับประทานยาอย่างสม่ำเสมอไม่ขาดยา และรับประทานยาตรงเวลาไม่คลาดเคลื่อนจึงจะทำให้มีระดับยาสม่ำเสมอและสามารถกดการแบ่งตัวของไวรัสได้เพียงพอนำไปสู่ผลการรักษาที่ดี และป้องกันการเกิดเชื้อไวรัสดื้อยา
การให้ภูมิคุ้มกันถ้าเป็นไปได้ควรทำก่อนการตั้งครรภ์ การให้ในขณะตั้งครรภ์จะพิจารณาให้ในกรณีที่มีโอกาสสัมผัสกับเชื้อสูง มีความเสี่ยงที่มารดาหรือทารกจะติดเชื้อสูงและวัคซีนไม่เป็นอันตราย การให้วัคซีนจะกระตุ้นระบบภูมิคุ้มกันให้ตอบสนองต่อวัคซีนทำให้การตองสนองต่อไวรัสเอชไอวีลดลง จึงทำให้เชื้อไวรัสมีจำนวนมากขึ้นและทำให้โอกาสการถ่ายทอดเชื้อจากมารดาสู่ทารกในระยะปริกำเนิดมากตามไปด้วย ดังนั้นจึงแนะนำให้วัคซีนแก่ผู้ติดเชื้อเอชไอวี หลังจากได้ยาต้านไวรัส เอชไอวี ไประยะหนึ่งจนถึงระดับที่ยาได้ผลสูงสุดในการรักษาแล้ว (ประมาณ 4 สัปดาห์) ซึ่งการให้ภูมิคุ้มกันที่แนะนำสำหรับสตรีตั้งครรภ์ที่ติดเชื้อ เอชไอวี มีรายละเอียดดังตารางที่ 2
|
Immunization |
Comment |
| Hepatitis A virus (HAV)
Hepatitis B virus (HBV) Influenza Measles/Mumps/Rubella (MMR) Pneumococcus Tetanus-diptheria |
Recommended for susceptible patients at high risk of infection, those with chronic HBV or HCV, those traveling to endemic areas, injection drug users, or in the setting of a community outbreak
Generally recommended for susceptible patients Generally recommended; give before flu season Contraindicated Generally recommended, repeat every 5-7 years Recommended; give booster every 10 years |
| Immune globulins
(For exposure prophylaxis in susceptible individual) |
Comment |
| Measles
Hepatitis A |
Recommended after measles exposure, for symptomatic HIV-infected persons
Recommended after exposure to a close contact or sex partner, or in case travel to endemic areas |
|
Hyper immune globulins |
Comment |
| Varicella-Zoster virus immune globulin (VZIG)
Hepatitis B immune globulin (HBIG) |
Recommended after significant exposure to Varicella-Zoster virus
Recommended after needle stick or sexual exposure to a person with hepatitis B infection |
การตั้งครรภ์มีการเปลี่ยนแปลงการดำเนินโรคทำให้ต้องเปลี่ยนแปลงการรักษาโรคฉวยโอกาส ในขณะเดียวกันโรคฉวยโอกาสก็มีผลทำให้การตั้งครรภ์มีภาวะแทรกซ้อน ดังนั้นจำเป็นต้องเฝ้าระวังอาการต่างๆ ของการติดเชื้อเพื่อวินิจฉัยโรคติดเชื้อฉวยโอกาสและรีบรักษาให้หายโดยเร็วก่อนที่จะมีภาวะแทรกซ้อนตามมา มียาหลายตัวที่ใช้ป้องกันโรคติดเชื้อฉวยโอกาสและส่งผลให้เกิดความพิการของทารก การให้ยาป้องกันโรคติดเชื้อฉวยโอการในสตรีตั้งครรภ์จึงมีข้อพิจารณาต่างจากสตรีทั่วไป ดังมีรายละเอียดในตารางที่ 3 10, 11
6.1 ภาวะเสี่ยงทางโภชนาการและปัญหาเรื่องน้ำหนักตัวขึ้นน้อย มารดาที่ติดเชื้อเอชไอวีต้องได้รับการติดตามเรื่องภาวะโภชนาการและการขึ้นของน้ำหนักตัวตลอดการตั้งครรภ์ หากพบความผิดปกติต้องได้รับคำปรึกษาและแก้ไขปัญหาและสาเหตุของภาวะทุพโภชนาการ
6.2 อาการคลื่นไส้อาเจียน
ในระยะแรกของการตั้งครรภ์อาจจะมีการแพ้ท้องทำให้คลื่นไส้อาเจียนมาก ผู้ป่วยบางคนอาจมีภาวะขาดน้ำและมีภาวะกรดในเลือด โดยเฉพาะผู้ป่วยที่รับประทานยาต้านไวรัส ดังนั้นจึงควรเริ่มยาต้านไวรัสในระยะไตรมาสที่ 2 เพื่อหลีกเลี่ยงภาวะดังกล่าวและลดความเสี่ยงต่อความพิการของทารกจากยาต้านไวรัส
6.3 ภาวะน้ำตาลในเลือดสูงและไขมันในเลือดสูง
ในรายที่ได้รับยากลุ่มต้านเอนไซม์โปรตีเอส (Protease inhibitions, PIs) อาจชักนำให้เกิดภาะน้ำตาลในเลือดสูงและไขมันในเลือดสูง จึงควรได้รับการตรวจติดตามระดับน้ำตาลในเลือดและตรวจ Triglyceride, LDL cholesterol ในผู้ป่วยที่รับประทานยากลุ่มนี้ที่อายุครรภ์ 24 สัปดาห์และ 34 สัปดาห์ ทารกที่เกิดจากมารดาที่ระดับน้ำตาลสูงผิดปกติควรได้รับการตรวจคัดกรองภาวะน้ำตาลในเลือดต่ำหลังคลอดที่ 1 และ 4 ชั่วโมงตามลำดับ
6.4 ภาวะกรดแลดติกคั่ง
ภาวะนี้พบได้น้อยแต่เป็นอันตรายถึงชีวิต มักเกิดในสตรีตั้งครรภ์ที่รับประทานยาต้านไวรัสกลุ่ม Nucleotide reverse transcriptase inhibitors โดยเฉพาะ didanosine (ddi) และ stavudine (D4T) ดังนั้นจึงควรเลี่ยงการให้ยาทั้งสองชนิดในสตรีตั้งครรภ์ โดยภาวะนี้จะมีอาการเมื่อยตามตัว คลื่นไส้ อาเจียน ปวดและไม่สบายในท้อง หากสงสัยควรตรวจเลือดเพื่อหา lactate, Electrolytes และ Liver function test โดยเฉพาะในช่วงไตรมาสที่ 3
6.5 ภาวะเหลือง
ในสตรีตั้งครรภ์ที่รับประทานยา Nevilapine อาจมีอาการของตับอักเสบ หากมีระดับของเอนไซม์ตับสูงเกิน 5 เท่าของค่าปกติหรือมีตัวเหลือง ตาเหลือง ต้องรีบหยุดยาต้านไวรัส
|
Infectious agent |
Usual manifestation |
Drug for prophylaxis |
Approach in pregnancy |
| 1. Pneumocystis | Pneumonia | Trimethopim-sulfamethoxazone
(TMP-SMX) |
– Prophylaxis and therapy same as for nonpregnant person
– Notify neonatologist of maternal sulfa therapy |
| 2. toxoplasmosis | Encephalitis, brain abscess, pneumonitis, retinochoroiditis | TMP-SMX | – As noted previously |
| 3. Mycobacterium avium complex (MAC) | Fever, sweats, weight loss, fatique, diarrhea | Azithromycin weekly or clarithromycin daily | – Azithromycin is the first choice for primary prophylaxis in pregnancy
– Clarithromycin has teratogenic effect in animals -For maintenance therapy, use azithromycin plus ethambutol |
| 4. Mycobacterium tuberculosis | Asymptomatic or pulmonary disease | Isoniazid plus pyridoxine(B6) for 9 months | – If multiple-drug resistant TB in pregnancy, obtain expert consultation |
| 5. Candida species | Vaginal, oral, or esophageal infections | Oral fluconazole | -Prophylaxis not indicated in pregnancy
– Craniofacial and skeleton abnormalities report after prolonged exposure to fluconazole in utero
|
|
Infectious agent |
Usual manifestation |
Drug for prophylaxis |
Approach in pregnancy |
| 6.Crytococus neoformans | Meningoencephalitis | Oral fluconazole | – Anomalies as noted previously after prolonged fluconazole exposure
– Consider switching to amphoteracin B in first trimester for chronic suppression |
| 7. Histoplasma capsulatum | Disseminated disease with fever, fatigue, weight loss, pulmonary symptoms | Oral itraconazole | – Uncertain safety of chronic itraconazole in pregnancy
– Consider switching to amphoteracin B in first trimester for chronic suppression |
| 8. Coccidioides immitis | Focal or diffuse pneumonitis | Oral fluconazole | – Consider switching to amphoteracin B in first trimester for chronic suppression |
| 9. Cytomegalovirus | Retinitis, esophagitis, encephalitis or pneumonitis | Oral or parenteral ganciclovir, parenteral foscarnet or cidofovir, intraocular ganciclovir | – To manage chronic suppressive therapy in pregnancy, obtain in consultation with expert |
| 10. Herpes simplex virus | Genital or oral ulcer | Acyclovir, famciclovir | – Prophylaxis and therapeutic same as nonpregnant |
ในระยะเจ็บครรภ์คลอดและระยะคลอดเป็นระยะที่สำคัญในการแพร่เชื้อเอชไอวีจากมารดาสู่ทารก พบว่าการติดเชื้อของทารกร้อยละ 50 – 60 จะเกิดขึ้นในระยะนี้ 12 การแตกของถุงน้ำคร่ำก่อนการคลอดเป็นเวลานานกว่า 4 ชั่วโมง และการทำสูติศาสตร์หัตการทางช่องทางคลอดเป็นปัจจัยที่เพิ่มโอกาสในการแพร่เชื้อเอชไอวีจากมารดาสู่ทารก การผ่าตัดคลอดทางหน้าท้องก่อนการเจ็บครรภ์ช่วยป้องกันการถ่ายทอดระหว่างมารดาและทารกในระยะเจ็บครภ์คลอดและลดโอกาสของทารกที่จะสัมผัสกับสิ่งคัดหลั่งในช่องคลอดมารดา ทำให้สามารถลดอัตราการถ่ายทอดเชื้อ เอชไอวี จากมารดาสู่ทารกได้ดีกว่าการคลอดทางช่องคลอดอย่างมีนัยสำคัญ 13 แต่เนื่องจากประสิทธิภาพที่ดีของ HAART ในการลดปริมาณไวรัสในเลือดของสตรีตั้งครรภ์ ซึ่งสัมพันธ์กับความเสี่ยงต่อการติดเชื้อ เอชไอวี ในทารก โดยพบว่าถ้าปริมาณไวรัสในเลือดในช่วงใกล้คลอดมีค่าน้อยกว่า 1,000 ตัว/ มิลลิลิตรความเสี่ยงที่ทารกจะติดเชื้อมีโอกาสน้อยกว่าร้อยละ 2 14 ทำให้บทบาทของการผ่าตัดคลอดบุตรในกรณีนี้ไม่ชัดเจนมากนัก ดังนั้นจึงมีข้อแนะนำในการดูแลสตรีตั้งครรภ์ที่ติดเชื้อ เอชไอวี ในระยะเจ็บครรภ์คลอดและระยะคลอดดังต่อไปนี้
2.1 ไม่แนะนำให้เจาะถุงน้ำคร่ำในระยะแรกของการเจ็บครรภ์ควรรอให้ถุงน้ำแตกเองในช่วงใกล้คลอด เพื่อลดระยะเวลาที่ทารกจะสัมผัสกับสิ่งคัดหลั่งในช่องคลอด
2.2 หลีกเลี่ยงการทำสูติศาสตร์หัตถการทางช่องคลอดที่จะทำให้เกิดบาดแผลต่อทารก เช่น การช่วยคลอดด้วยคีมหรือเครื่องดูดสุญญากาศ
2.3 หากเป็นไปได้ไม่ควรตัดแผลฝีเย็บเพื่อลดปริมาณเลือดมารดาที่จะสัมผัสทารก
2.4 การป้องกันการตกเลือดหลังคลอดจากมดลูกหดรัดตัวไม่ดีมีความสำคัญเช่นเดียวกับสตรีตั้งครรภ์หลังคลอดทั่วไป แต่ในกรณีที่ผู้ป่วยได้รับยา Efavarenz หรือยาในกลุ่ม PI ควรหลีกเลี่ยงการใช้ Methergine เพื่อเพิ่มการหดรัดตัวของมดลูก เนื่องจากอาจเกิดการหดรัดตัวของหลอดเลือดอย่างรุนแรงจนอาจจะเป็นอันตรายต่อผู้ป่วยได้ 15
การดูแลระยะหลังคลอด
การดูแลระยะหลังคลอดประกอบด้วยการดูแลทั้งสุขภาพของมารดาและการดูแลทารกดังนี้
สรุป
การติดเชื้อเอชไอวียังคงเป็นปัญหาสำคัญของสตรีวัยเจริญพันธุ์ ในประเทศไทยพบความชุกของการติดเชื้อ เอชไอวีในสตรีตั้งครรภ์ประมาณร้อยละ 1 และยังพบเด็กติดเชื้อรายใหม่เกิดขึ้นทุกวัน เกือบทั้งหมดเป็นการติดเชื้อที่ถ่ายทอดจากมารดาสู่ทารก สูติแพทย์ผู้ดูแลควรมีความตระหนักในการดูแลสตรีตั้งครรภ์ที่ติดเชื้อเอชไอวีทั้งในระยะก่อนตั้งครรภ์จนกระทั่งหลังคลอด เพื่อพัฒนาคุณภาพชีวิตของผู้ติดเชื้อและลดการติดเชื้อเอชไอวีจากมารดาสู่ทารกให้เหลือน้อยที่สุด ซึ่งจะก่อประโยชน์สูงสุดต่อตัวผู้ป่วย บุตรที่คลอดจากมารดาที่ติดเชื้อและสังคมโดยรวม
1. Bureau of Epidemiology. Results of HIV sero-surveillance, Thailand 1989-2004 (round 1-22). Department of Disease Control, Ministry of Public Health, Thailand. Available at: http://epid.moph.go.th/index/htm.
2. สมาน สยุมภูรุจินันท์. สถานการณ์ผู้ป่วยเอดส์และผู้ติดเชื้อเอดส์ที่มีอาการ ในประเทศไทย ณ วันที่ 31 ธันวาคม พ.ศ. 2547. รายงานเฝ้าระวังทางระบาดวิทยาประจำสัปดาห์ 2005;36:39-40.
3. Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse, DJ, Spong CY. Sexually transmitted diseases. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 1235-1257.
4. World Health Organization. Antiretroviral drugs for treating pregnant women and preventing HIV infection in infant: recommendations for a public health approach, 2010 version. Geneva, Switzerland: World Health Organization, 2010.
5. Cooper ER, Charurat M, Mofenson LM, Hanson IC, Pitt J, Diaz C, et al. Combination antiretroviral strategies for the treatment of pregnant HIV-1 infected women and prevention of perinatal HIV-1 transmission. J Acquir Immune Detic Syndr Hum Retroviral 2002; 29:480-94.
6. การป้องกันการถ่ายทอดเชื้อเอชไอวีจากมารดาสู่ทารกด้วยยาต้านไวรัส. ใน: ประพันธ์ ภานุภาค และคณะ, บรรณาธิการ. แนวทางการตรวจวินิจฉัยและการดูแลรักษาผู้ติดเชื้อเอชไอวีและผู้ป่วยเอดส์ระดับชาติ ปี พ.ศ. 2553. กรุงเทพฯ: โรงพิมพ์ชุมนุมสหกรณ์การเกษตรแห่งประเทศไทยจำกัด, 2553: 293-327.
7. Centers for Disease Control and Prevention. Achievements in public health: reduction in perinatal transmission of HIV infection: United States, 1985-2005. MMWR Morb Mortal Wkly Rep 2006:55:592-7.
8. งาน HIV ในแม่และเด็ก สำนักส่งเสริมสุขภาพ กรมอนามัย กระทรวงสาธารณสุข. รายงานจากระบบควบคุมกำกับการดำเนินงานการป้องกันการแพร่เชื้อ HIV จากแม่สู่ลูก พ.ศ. 2544-2549 http://pmtct.anamai.moph.go.th
9. Kroger AT, Atkinson WL, Marcuse EK, Pickering LK. Centers for Disease Control and Prevention: General on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP) (published errata appear in MMWR Morb Mortal Wkly Rep 2007;56(11):256). MMWR Recomm Rep 2006 ;55(RR-15):1-48.
10. Watts HD. Maternal therapy for HIV in pregnancy. Clin Obstet Gynecol 2011; 44:182-97.
11. Jonathan E. Kaplan, Henry Masur, King K, Holmes, Center for Disease Control and Prevention:USPHS/IDSA: Guidelines for the Prevention of Opportunistic Infections Among HIV-Infected Persons 2002:28-32.
12. Burgress J. Determinants of transmission of HIV from mother to child. Cli Obstet Gynecol 2001; 44:198- 209.
13. European Mode of Delivery Collaberation. Elective caesarean-section versus vaginal delivery in Prevention of vertical HIV-1 transmission: a randomized clinical trial. The European Mode of Delivery Collaboration. Lancet 1999; 353:1305-9.
14. Townsend CL, Cortina-Boria M, PEckham CS, de Ruiter A, Lyall H, Tookey PA. Low rates of mother-to-child transmission of HIV following effective pregnancy interventions in the United Kingdom and Ireland, 2000-2006. AIDS 2008; 22:937-81.
15. Panel on treatment of HIV-Infected Pregnant Women and Prevention of Perinatal Transmission. Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Maternal Health and Interventions to Reduce Perinatal HIV Transmission in United States. May 24, 2010; pp 1-117. Available at http://aidsinfo.nih.gov/ContentFiles/PerinatalGL.pdf.
16. John-Stewart G, Mbori-Ngacin D, Ekpini R, Janoff EN, Nkengasong J, Read JS, et al. Breast feeding and transmission of HIV-1. J Acquir Immune Defic Synd 2004; 35:162-202.
17. การป้องกันการถ่ายทอดเชื้อเอชไอวีจากแม่สู่ทารกด้วยยาต้านไวรัสเอชไอวี. ใน: กระทรวงสาธารณสุข. แนวทางการตรวจวินิจฉัยและการดูแลรักษาผู้ติดเชื้อเอชไอวีและผู้ป่วยเอดส์ระดับชาติ พ.ศ. 2553 (ฉบับร่าง)
 อาจารย์ชำนาญ (จิ้น) ได้ย้ายไปเป็นอาจารย์ที่มข.เรียบร้อยแล้ว ทางภาควิชารู้สึกถึงการสูญเสียกำลังสำคัญของการเรียนการสอน โดยเฉพาะการฝึกอบรมแพทย์ประจำบ้าน ขอให้อาจารย์จิ้นมีความสุขและประสบความสำเร็จในชีวิตครูที่ขอนแก่น และขอบคุณสำหรับการงานที่อ.จิ้นได้คุณูปการต่อภาควิชาสูติฯ มช. มาอย่างมาก
อาจารย์ชำนาญ (จิ้น) ได้ย้ายไปเป็นอาจารย์ที่มข.เรียบร้อยแล้ว ทางภาควิชารู้สึกถึงการสูญเสียกำลังสำคัญของการเรียนการสอน โดยเฉพาะการฝึกอบรมแพทย์ประจำบ้าน ขอให้อาจารย์จิ้นมีความสุขและประสบความสำเร็จในชีวิตครูที่ขอนแก่น และขอบคุณสำหรับการงานที่อ.จิ้นได้คุณูปการต่อภาควิชาสูติฯ มช. มาอย่างมาก