การรักษาเนื้องอกมดลูกโดยการใช้ยาและฮอร์โมน
การรักษาเนื้องอกมดลูกโดยการใช้ยาและฮอร์โมน
(Medical treatment in symptomatic leiomyomas)
พญ. ปองปวัน เชียรวิชัย
อาจารย์ที่ปรึกษา ผศ. พญ. อุบล แสงอนันต์
เนื้องอกมดลูก (Uterine fibroids, Leiomyomas, Uterine myomas) เป็นเนื้องอกของกล้ามเนื้อเรียบที่เจริญอยู่ในชั้นกล้ามเนื้อของมดลูก และเป็นเนื้องอกชนิดที่ไม่ร้ายแรง (Benign tumor) พบได้บ่อยในสตรีวัยเจริญพันธุ์ โดยเฉลี่ยพบได้ประมาณ 20-25% (1, 2) สาเหตุการเกิดเนื้องอกมดลูก ปัจจุบันยังไม่ทราบสาเหตุแน่ชัด แต่มีปัจจัยบางอย่างที่สัมพันธ์กับการเจริญของเนื้องอกได้ ได้แก่
- พันธุกรรม (Genetics) พบว่าประมาณ 40% ของสตรีที่มีเนื้องอกมดลูก มีโครโมโซมที่ผิดปกติ เช่น เกิดการสับเปลี่ยน (Translocation) ระหว่างโครโมโซมคู่ที่ 12 และ 14 หรือ การหายไปของโครโมโซมคู่ที่ 7 เป็นต้น (1)
- ฮอร์โมน โดยเนื้องอกมดลูกจะตอบสนองต่อทั้งฮอร์โมนเอสโตรเจนและโปรเจสเตอโรน โดยที่ในเนื้องอกมดลูกจะมีตัวรับเอสโตรเจน (Estrogen receptor) มากขึ้น และมีเอนไซม์อะโรมาเตสมากขึ้นเมื่อเทียบกับเซลล์กล้ามเนื้อมดลูกปกติ ทำให้เพิ่มการเปลี่ยนแอนโดรเจนเป็นเอสโตรเจนมากขึ้น ดังนั้นจึงมักพบภาวะนี้ได้บ่อยในวัยเจริญพันธุ์ และเมื่อเข้าสู่วัยหมดประจำเดือน ฮอร์โมนในร่างกายปริมาณลดลง ขนาดของเนื้องอกก็จะฝ่อลงไปด้วย (1, 2)
- โกรทแฟคเตอร์ต่างๆ (Growth factors) กล้ามเนื้อเรียบในมดลูกจะสร้างโกรทแฟคเตอร์ โปรตีน และโพลีแปปไทด์ต่างๆ ซึ่งส่งผลให้มีการแบ่งตัวของเซลล์กล้ามเนื้อและสารเนื้อเยื่อเกี่ยวพันนอกเซลล์ (Extracellular matrix) เพิ่มขึ้น (1)
นอกจากนี้ยังมีปัจจัยเสี่ยงอื่นๆ ที่สัมพันธ์กับเกิดเนื้องอกมดลูก ดังนี้
1.อายุ โดยจะพบเนื้องอกมดลูกได้มากขึ้น เมื่ออายุเพิ่มขึ้น โดยในสตรีช่วงอายุ 25-29 ปี พบได้ 4 ใน 1000 คน ขณะที่สตรีช่วงอายุ 40-44 ปี พบเพิ่มขึ้นเป็น 22 ใน 1000 คน(1)
2.เชื้อชาติ เนื้องอกมดลูกพบในหญิงชาวแอฟริกัน อเมริกัน ได้บ่อยกว่าหญิงผิวขาวประมาณ 2.9 เท่า(1)
3.น้ำหนัก จากการศึกษาพบว่า น้ำหนักที่เพิ่มขึ้น 10 กิโลกรัม จะเพิ่มความเสี่ยงต่อการเกิดเนื้องอกมดลูกประมาณ 21%(1) โดยอาจอธิบายได้ว่า ในผู้ที่มีไขมันในร่างกายเพิ่มขึ้น มีการเปลี่ยนแอนโดรเจนเป็นเอสโตรเจนในชั้นมากขึ้น ทำให้มีฮอร์โมนเอสโตรเจนในร่างกายมากขึ้น และกระตุ้นในเนื้องอกมดลูกมีขนาดเพิ่มขึ้นตามมา
3.ยาคุมกำเนิดชนิดฮอร์โมนรวม ไม่พบว่ามีความสัมพันธ์ต่อการเกิดเนื้องอกมดลูกเพิ่มขึ้นอย่างชัดเจน
4.การตั้งครรภ์ พบว่าสตรีที่ผ่านการตั้งครรภ์หลายครั้ง จะยิ่งลดโอกาสการเกิดเนื้องอกมดลูกได้ เนื่องจากช่วงหลังคลอด จะมีการปรับเปลี่ยนเรียงตัวของชั้นกล้ามเนื้อมดลูกใหม่ และเส้นเลือดบางส่วนที่ไปเลี้ยงเนื้องอกมดลูกได้โดนทำลายไป ทำให้เนื้องอกมดลูกสลายไปหรือลดขนาดลง(1)
5.การสูบบุหรี่ จะลดโอกาสการเกิดเนื้องอกลดมดลูกได้ เนื่องจากสารนิโคตินในบุหรี่ ไปยับยั้งเอนไซม์อะโรมาเตส ทำให้ลดการเปลี่ยนแอนโดรเจนเป็นเอสโตรเจน(1)
6.การบาดเจ็บเนื้อเยื้อ (Tissue injury) การบาดเจ็บของชั้นกล้ามเนื้อและหลอดเลือดซ้ำๆ จากสาเหตุต่างๆ เช่น การขาดเลือด การติดเชื้อ จะกระตุ้นให้มีการแบ่งตัวของเซลล์กล้ามเนื้อเรียบแบบเซลล์เดียว (Monoclonal smooth muscle) มากขึ้น ซึ่งจะเจริญต่อมาเป็นเนื้องอกมดลูกได้ (1)
ชนิดของกล้ามเนื้อมดลูก
แบ่งเป็น 3 ชนิดหลักๆตามตำแหน่งที่เนื้องอกเจริญอยู่ ได้แก่ Subserous myoma, Intramural myoma และ Submucous myoma โดยยังสามารถแบ่งย่อยตาม FIGO leiomyoma classification system ปี 2011 ได้ดังนี้
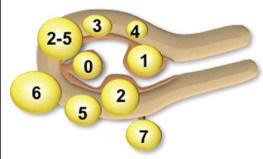
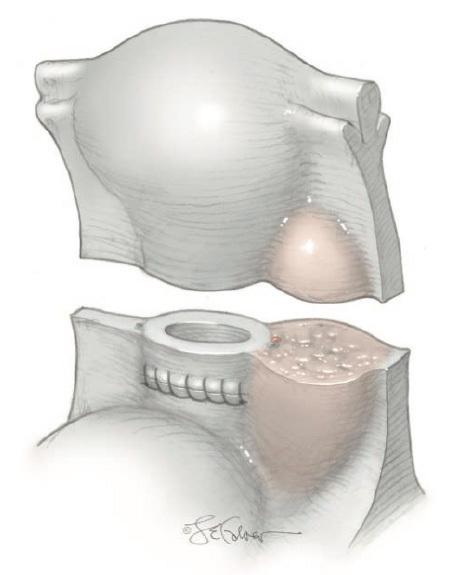
รูปที่ 1 กล้ามเนื้อมดลูกชนิดต่างๆ แบ่งตาม
FIGO classification(3)
|
Type 0 |
|
ยื่นอยู่ในโพรงมดลูกทั้งหมด |
|
Type 1 |
Submucosal |
แทรกอยู่ในชั้นกล้ามเนื้อมดลูก < 50% |
|
Type 2 |
|
แทรกอยู่ในชั้นกล้ามเนื้อมดลูก ³ 50% |
|
Type 3 |
Intramural |
อยู่ในชั้นกล้ามเนื้อทั้งหมด และชิดกับชั้นเยื่อบุ แต่ไม่ยื่นเข้าโพรงมดลูก |
|
Type 4 |
|
อยู่ในชั้นกล้ามเนื้อมดลูกเท่านั้น |
|
Type 5 |
|
แทรกอยู่ในชั้นกล้ามเนื้อมดลูก ³ 50% |
|
Type 6 |
Subserous |
แทรกอยู่ในชั้นกล้ามเนื้อมดลูก < 50% |
|
Type 7 |
|
เนื้องอกมีก้านยื่นออกมานอกมดลูก (pedunculated) |
|
Type 8 |
Other |
ไม่อยู่ในชั้นกล้ามเนื้อมดลูก เช่น cervical lesion, broad ligament/round ligament myoma, parasitic myoma เป็นต้น |
|
Transmural/Hybrid |
เนื้องอกเจริญอยู่มากกว่า 1 ตำแหน่ง |
วิธีการเรียก จะขึ้นตัวเลขที่สัมพันธ์กับชั้น endometrium ก่อน ตามด้วยตัวเลขที่สัมพันธ์กับชั้น serosal surface |
|
leiomyomas |
2-5 |
เนื้องอกแทรกอยู่ตั้งแต่ Submucosa ถึง subserosaโดยตัวก้อนแทรกอยู่ใน endometrium และ peritoneal cavities น้อยกว่าครึ่งหนึ่ง ตามลำดับ |
รูปที่ 2 แสดงตำแหน่งของเนื้องอกมดลูก (2)
อย่างไรก็ตาม เนื้องอกมดลูกมักไม่เกิดขึ้นแยกอยู่ในชั้นใดชั้นหนึ่งอย่างชัดเจน โดยขอบเขตของเนื้องอกจะคาบเกี่ยวกันในตำแหน่งที่ใกล้เคียงกัน เช่น submucous และ intramural เป็นต้น
อาการแสดง
1. เลือดออกผิดปกติทางช่องคลอด โดยส่วนใหญ่จะมีประจำเดือนมามากผิดปกติ สาเหตุสันนิษฐานว่าเกิดจาก หลอดเลือดดำฝอยบริเวณกล้ามเนื้อมดลูกมีการขยายตัว จึงทำให้มีเลือดออกมากผิดปกติ(2) โดยอาการจะมีมากขึ้นตามขนาดและจำนวนของเนื้องอกมดลูก ดังนั้นความรุนแรงของเลือดที่ออกจึงสามารถเกิดได้กับกล้ามเนื้อมดลูกทุกชนิด ไม่จำเพาะต่อ submucous myoma(1, 2)
2. ปวดท้องน้อย อาจพบเป็นลักษณะปวดประจำเดือนเพิ่มขึ้นซึ่งสัมพันธ์กับก้อนที่มีขนาดใหญ่ หรืออาการเจ็บขณะมีเพศสัมพันธ์ นอกจากนี้อาการปวดท้องน้อยแบบฉับพลันที่เกี่ยวข้องกับเนื้องอกมดลูก ได้แก่ ภาวะเสื่อมสภาพของเนื้องอก (Fibroid degeneration) และการบิดขั้วของเนื้องอกที่มีก้านยื่น(Torsion of pedunculated fibroid) ก็ยังพบได้ แต่ไม่บ่อยนัก(1, 2)
3. อาการทางระบบปัสสาวะและขับถ่าย ก้อนเนื้องอกมดลูกที่มีขนาดใหญ่ สามารถกดเบียดกระเพาะปัสสาวะและลำไส้ตรง ทำให้ปัสสาวะบ่อย กลั้นปัสสาวะไม่ได้ ปัสสาวะค้าง หรือถ่ายลำบากได้ และหากก้อนโตออกทางด้านข้างมาก อาจกดเบียดท่อไต ทำให้เกิดภาวะไตบวมน้ำได้(1, 2, 4)
4. การมีบุตรยาก เนื้องอกกล้ามเนื้อมดลูกอาจทำให้ท่อนำไข่ผิดรูป และเยื่อบุโพรงมดลูกมีการอักเสบและผิดรูปไป ส่งผลต่อการเดินทางของอสุจิ และการฝังตัวของตัวอ่อน ดังนั้นชนิดของเนื้องอกที่ส่งผลมักเป็นชนิดที่เจริญเข้าไปในเยื่อบุโพรงมดลูกด้วย ได้แก่ชนิด Submucous และ Intramural myoma(2)
การรักษา
1. ติดตามอาการ ผู้ป่วยที่ไม่มีอาการผิดปกติจากเนื้องอกมดลูกใดๆ ตามที่ได้กล่าวมาข้างต้น สามารถติดตามอาการได้ โดยการตรวจภายในเพื่อประเมินขนาดก้อนอย่างสม่ำเสมอ เฉลี่ยปีละครั้ง(2) โดยทั่วไปเนื้องอกมดลูกจะโตช้า โดยประมาณปีละ 0.5 เซนติเมตร(2) อย่างไรก็ตาม การทำนายการโตของก้อนทำได้ยาก ขึ้นกับหลายปัจจัย หากเป็นหญิงที่ใกล้วัยหมดประจำเดือน แม้จะมีอาการเล็กน้อยถึงปานกลาง จะแนะนำให้ตรวจติดตามอาการ เนื่องจากขนาดก้อนจะลดลงหลังหมดประจำเดือน รวมทั้งโอกาสเกิดก้อนเนื้องอกใหม่หรือมีอาการจากก้อนจะลดลง(1, 2, 5)
2. การรักษาด้วยยา (Medical treatment) ประกอบไปด้วยยาฮอร์โมนและยาที่ไม่ใช่ฮอร์โมน ซึ่งจะได้กล่าวในรายละเอียดต่อไป
3. การรักษาโดยใช้วิธีทางรังสีวิทยา (Radiologic Interventions) ได้แก่
- การทำให้ก้อนเนื้องอกขาดเลือดโดยการทำให้เส้นเลือดอุดตัน (Uterine artery embolization)
- การใช้คลื่นอัลตราซาวด์ความเข้มสูงร่วมกับคลื่นแม่เหล็กไฟฟ้าช่วยระบุตำแหน่ง เพื่อทำลายเนื้อเยื่อของก้อนเนื้องอก (Magnetic Resonance-guided Focused Ultrasound (MRgFUS)) โดยการใช้ความร้อนทำให้เกิดการตายของเนื้อเยื่อ(2)
4. การรักษาโดยการผ่าตัด (Surgical treatment)
- การผ่าตัดมดลูก (Hysterectomy) เป็นการรักษาเนื้องอกมดลูกที่ยังเป็นที่นิยมมากที่สุด เนื่องจากเป็นรักษาที่จำเพาะ และทำให้หายขาดได้ โดยทั่วไปจะเลือกผ่าตัดในผู้ป่วยที่รักษาเชิงอนุรักษ์ด้วยวิธีอื่นๆมาแล้วไม่ได้ผลเท่าที่ควร หรือผู้ที่มีบุตรเพียงพอแล้ว การผ่าตัดมดลูกสามารถทำได้หลายวิธี ได้แก่ การผ่าตัดเปิดหน้าท้อง ผ่าตัดผ่านช่องคลอด และการผ่าตัดผ่านกล้องทางหน้าท้อง ซึ่งเริ่มมีความนิยมมากขึ้น เนื่องจากแผลผ่าตัดเล็ก ฟื้นตัวเร็ว ภาวะแทรกซ้อนหลังผ่าตัดน้อยกว่าการผ่าตัดเปิดหน้าท้อง(2, 5)
- การผ่าตัดเฉพาะก้อนเนื้องอกมดลูก (Myomectomy) เป็นทางเลือกสำหรับผู้ป่วยที่ยังต้องการมีบุตร โดยมีวิธีผ่าตัด 3 วิธี ได้แก่ การผ่าตัดเปิดหน้าท้อง การผ่าตัดผ่านการส่องกล้อง และการผ่าตัดผ่านทางช่องคลอด ซึ่งวิธีสุดท้ายนี้เหมาะกับเนื้องอกที่เจริญเข้ามาในโพรงมดลูกหรือมีก้านยื่นออกมาในช่องคลอด เป็นวิธีผ่าตัดที่ฟื้นตัวเร็วที่สุด เนื่องจากไม่มีแผลทางหน้าท้อง ดังนั้นจึงควรเลือกวิธีที่เป็นอันดับแรก แต่หากเป็นเนื้องอกที่อยู่ในชั้นกล้ามเนื้อ(Intramural myoma) หรือเจริญอยู่ชั้นผิวนอกมดลูก (Subserous myoma) ควรเลือกผ่าตัดผ่านกล้อง หรือเปิดหน้าท้องแทน อย่างไรก็ตาม การผ่าตัดฉพาะเนื้องอกมดลูกนั้น อาจไม่ได้รักษาอาการให้หายขาด รวมทั้งมีโอกาสกลับเป็นซ้ำได้ประมาณ 15-30% (2, 5)
- การจี้สลายเนื้องอกในโพรงมดลูก (Endometrial ablation) เดิมเป็นการรักษาภาวะเลือดออกผิดปกติทางช่องคลอด แต่สามารถนำมารักษาเนื้องอกมดลูกได้ กรณีที่เนื้องอกอยู่ในโพรงมดลูก และทำให้เกิดเลือดออกผิดปกติ การรักษาร่วมกับวิธีผ่าตัดเฉพาะเนื้องอกมดลูกผ่านช่องคลอด (hysteroscopic resection) จะช่วยลดภาวะเลือดออกผิดปกติได้ดีขึ้นกว่าการผ่าตัดอย่างเดียว แต่การใช้วิธีจี้สลายเนื้องอกมดลูกก็มีข้อจำกัดกล่าวคือ สามารถรักษาได้เฉพาะเนื้องอกที่เจริญในโพรงมดลูกเท่านั้นและขนาดก้อนโตไม่เกิน 3 เซนติเมตร และการจี้ไม่สามารถรักษาอาการจากเนื้องอกอื่นๆได้ เช่น ภาวะปวดหน่วงท้อง อาการปัสสาวะบ่อยจากก้อนโตกดเบียด เป็นต้น
- การทำลายเนื้องอกมดลูก (Myolysis) เป็นการส่องกล้องผ่านหน้าท้องเพื่อทำลายเนื้องอกมดลูกด้วยวิธีการจี้โดยใช้ความร้อน(Bipolar electrosugery) เลเซอร์(laser vaporization) หรือจี้ความเย็น(Cryotherapy) ทะลุผ่านเนื้องอกมดลูก เพื่อให้เกิดเนื้อตายและเนื้องอกฝ่อไปจากการทำลายตัวเนื้องอกเองรวมทั้งทำลายเส้นเลือดที่ไปเลี้ยงเนื้องอกด้วย ซึ่งข้อดีของวิธีนี้คือ ไม่ต้องเย็บปิดแผลเหมือนการทำ Myomectomy แต่ทำให้เกิดพังผืดหลังการรักษามากกว่า และอาจไม่เหมาะกับผู้ที่ยังต้องการมีบุตรอยู่ (1, 2)
การรักษาด้วยยา (Medical treatment)
ยาฮอร์โมน
1. ยาคุมกำเนิดชนิดฮอร์โมนรวม (Estrogen-progestin contraceptive pills)
มีกลไกทำให้เยื่อบุโพรงมดลูกฝ่อ และลดการหลั่งพรอสตาแกลนดิน(2) จึงช่วยรักษาอาการเลือดออกผิดปกติที่เกิดจากเนื้องอกมดลูกได้ดี ทั้งประจำเดือนมามาก ประจำเดือนมากะปริบกะปรอย และยังช่วยลดอาการปวดประจำเดือนได้ แต่ไม่ได้ช่วยในแง่ของการลดขนาดก้อน ดังนั้นอาจไม่ช่วยลดอาการกดทับจากก้อนที่โตได้ ปัจจุบันยังเป็นที่นิยมสูง เนื่องจากใช้ง่าย มียาแพร่หลาย หากต้องการมีบุตร สามารถมีได้หลังหยุดยาทันที แนะนำให้ดูการตอบสนองหลังรับประทานยา 3-6 เดือน หากอาการไม่ดีขึ้น หรือก้อนโตขึ้นชัดเจน ควรเปลี่ยนเป็นวิธีอื่น(2, 5, 6)
2. ยาฮอร์โมนโปรเจสติน (Progestin-only therapy)
ช่วยรักษาเรื่องเลือดออกผิดปกติได้ดีเช่นกัน โดยออกฤทธิ์ทำให้เยื่อบุโพรงมดลูกฝ่อ และยังเหมาะกับผู้ที่ต้องการคุมกำเนิดไปด้วยขณะรักษา ได้แก่
- ยาคุมกำเนิดชนิดรับประทาน (Progestin-only pill)
- ยาคุมกำเนิดชนิดฉีดเข้ากล้าม (Depot medroxyprogesterone acetate; DMPA) จากการศึกษาพบว่าหากใช้ติดต่อกันนานกว่า 5 ปี สามารถลดขนาดเนื้องอกมดลูกได้ 90%(6)
- ห่วงคุมกำเนิดชนิดฮอร์โมน (Levonorgestrel intrauterine system; Mirena) ช่วยลดอาการประจำเดือนมามากได้ดี โดยพบว่าหลังใส่ห่วงคุมกำเนิดประมาณ 1 ปี สามารถลดภาวะเลือดออกผิดปกติได้ถึง 80-90% โดยที่ผู้ป่วยประมาณ 40% จะมีการขาดประจำเดือน(1) และยังช่วยลดขนาดเนื้องอกมดลูกได้อย่างมีนัยสำคัญ(6) แต่มีโอกาสห่วงหลุดได้สูงกว่าผู้ป่วยที่ไม่มีเนื้องอกมดลูก โดยโอกาสแปรผันตามขนาดของโพรงมดลูก ซึ่งโตขึ้นตามขนาดของเนื้องอก และหากมีเนื้องอกที่เจริญเข้ามาในโพรงมดลูก และทำให้โพรงมดลูกผิดรูปไป ถือเป็นข้อห้ามในการรักษาด้วยวิธีนี้(2)
3. Mifepristone (RU-486)
เนื่องจากเนื้องอกมดลูกมี Estrogen และ Progesterone receptor มากกว่ากล้ามเนื้อมดลูกปกติ ทำให้ตอบสนองต่อการกระตุ้นโดยฮอร์มนทั้งสองชนิดได้มากกว่า ดังที่ได้กล่าวไปแล้ว โปรเจสเตอโรนจึงเป็นตัวกระตุ้นการแบ่งตัวของเซลล์เนื้องอก ดังนั้นการยับยั้งการกระตุ้นบริเวณ Progesterone receptor จึงเป็นทางเลือกหนึ่งที่สามารถลดขนาดเนื้องอกมดลูกได้(7) Mifepristone (RU-486) เป็น Progesterone receptor modulator ที่ออกฤทธิ์แบบยับยั้งที่ Progesterone receptor เพียงอย่างเดียว บางครั้งจึงอาจเรียกว่าเป็น “Antiprogestin”(2) โดยสามารถลดขนาดเนื้องอกมดลูกได้มากเทียบเท่าการใช้ GnRH agonist บางการศึกษาพบว่าหากใช้ยาติดต่อกันทุกวันเป็นเวลา 6 เดือน จะสามารถลดขนาดเนื้องอกมดลูกได้ครึ่งหนึ่ง(1) นอกจากนี้ยังช่วยเรื่องของประจำเดือนมามาก โดยหากใช้ยาในขนาดต่ำ 5-10 มิลลิกรัม/วัน ผู้ป่วยจะเข้าสู่ภาวะขาดประจำเดือนได้ประมาณ 40-70 % โดยขนาดยาที่แนะนำให้ใช้คือรับประทาน 2.5-10 มิลลิกรัมต่อวัน เป็นเวลา 3-6 เดือน(2, 7) อย่างไรก็ตาม ปัจจุบันทางองค์การอาหารและยาแห่งสหรัฐอเมริกา หรือ FDA ยังไม่อนุมัติให้ใช้ Mifepristone ในการรักษาเนื้องอกมดลูก นอกจากนี้ Mifepristone และ Progesterone receptor modulator ตัวอื่นๆยังมีผลข้างเคียงคือ ทำให้เยื่อบุโพรงมดลูกหนาตัว เนื่องจากการได้รับเอสโตรเจนอย่างเดียว (Unopposed estrogen) เป็นเวลานานอย่างน้อย 3 เดือนหรือที่เรียกว่าภาวะ Progesterone Receptor Modulator Associated Endometrial Changes (PAEC) จากการศึกษาพบว่าไม่ใช่ลักษณะการแบ่งตัวผิดปกติแบบ Endometrial hyperplasia และภาวะนี้สามารถหายได้ หากหยุดใช้ยา การใช้ยากลุ่มนี้จึงยังไม่พบว่าสัมพันธ์ต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก(2, 7, 8)
4. Selective progesterone receptor modulators (SPRMs)
SPRMs เป็นอนุพันธุ์สเตียรอยด์สังเคราะห์ที่มีโครงสร้างคล้ายโปรเจสเตอโรน ออกฤทธิ์บริเวณ Progesterone receptor โดยสามารถเป็นได้ทั้งการกระตุ้นหรือยับยั้ง ขึ้นกับตัวรับและสิ่งแวดล้อมรอบๆของอวัยวะนั้นๆ(2, 8) โดยออกฤทธิ์ 3 อวัยวะได้แก่
- ต่อมใต้สมอง (Pituitary gland) โดยลดระดับ FSH ลดการออกฤทธิ์ของโปรเจสเตอโรน แต่ยังคงระดับของเอสโตรเจนในช่วง Mid-follicular range ไว้ ซึ่งต่างจาก GnRH agonist ส่งผลให้ไม่เกิดการตกไข่ และทำให้ไม่มีประจำเดือน หรือประจำเดือนออกลดลง และเนื่องจากเอสโตรเจนไม่ต่ำจึงทำให้ไม่มีผลข้างเคียงเกี่ยวกับอาการวัยทองหรือมวลกระดูกลดลง เหมือนกับ GnRH agonist(5)
- เนื้องอกมดลูก โดยการลดการแบ่งตัวของเซลล์เนื้องอก ส่งผลให้เนื้องอกมีขนาดลดลง
- เยื่อบุโพรงมดลูก ทำให้เลือดประจำเดือนออกลดลง และเข้าสู่ภาวะขาดประจำเดือน
ตัวอย่างยาที่สำคัญในกลุ่มนี้แก่ Ulipristal acetate (UPA) ซึ่งประเทศแคนาดาและฝั่งยุโรปอนุมัติให้ใช้รักษาเนื้องอกมดลูกได้ ในขณะที่ทาง FDA แห่งสหรัฐอเมริกายังไม่อนุมัติให้ใช้เพื่อจุดประสงค์อื่นนอกเหนือจากการใช้คุมกำเนิด แต่อยู่ในระหว่างการศึกษา(5, 7, 8)
จากการศึกษาพบว่า UPA มีประสิทธิภาพในการรักษาเรื่องของประจำเดือนมามากได้ดีเทียบเท่าGnRH agonist โดยผู้ใช้กว่า 90% มีประจำเดือนออกลดลง และยังพบว่าผู้ใช้ยาจะขาดประจำเดือนหลังใช้ยาประมาณ 5-7 วัน ในขณะที่ GnRH agonist ใช้เวลาประมาณ 21 วัน และกว่าครึ่งหนึ่งของผู้ใช้ยาพบว่าก้อนเนื้องอกลดลงประมาณ 50% นอกจากนี้อาการร้อนวูบวาบยังพบน้อยกว่าในกลุ่ม UPA อีกด้วย(7, 8)
ขนาดยาที่ใช้ในการศึกษาหนึ่ง จะใช้ UPA 5 -10 มิลลิกรัม โดยเริ่มรับประทานช่วง 4 วันแรกของรอบเดือน ทุกวันเป็นเวลา 3 เดือน และหยุดยาเพื่อให้มีรอบเดือน 2 ครั้ง แล้วจึงเริ่มยาใหม่อีก 3 เดือน จนครบ 4 ครั้ง พบว่าได้ผลดีทั้งเรื่องของเลือดออกผิดปกติ โดยพบว่าผู้ป่วยขาดประจำเดือนประมาณ 70% หลังได้ยาครบ 4 คอร์ส และขนาดของเนื้องอกมดลูกที่ลดลง 25% โดยที่ขนาดยังคงที่หลังหยุดยาไปแล้ว 6 เดือน อย่างไรก็ตามในช่วงแรกเริ่ม มีการกล่าวถึงผลข้างเคียงต่อตับของยา แต่ยังไม่มีการศึกษาที่ระบุว่าสัมพันธ์กับระยะเวลาที่ใช้ยาแต่อย่างใด และมีผู้ป่วยจำนวนน้อยมากที่พบว่ามีการบาดเจ็บต่อตับรุนแรง(9)
ด้วยเหตุนี้จึงแนะนำให้ตรวจค่าเอนไซม์ตับก่อนเริ่มยาแต่ละครั้ง และตรวจเดือนละครั้งระหว่างรับยาช่วง 2 คอร์สแรก รวมทั้งหลังหยุดยา 2-4 สัปดาห์อีก 1 ครั้ง หากพบว่าค่าขึ้นมากกว่า 2 เท่าของปกติ ควรหยุดยาและติดตามค่าเอนไซม์ต่อเป็นระยะ(8, 9)
ปัจจุบันขนาดยาที่แนะนำให้ใช้คือ 5 มิลลิกรัมต่อวัน โดยอาจให้ยาเป็นรอบๆในระยะสั้น ครั้งละ 3เดือน เช่น เพื่อลดขนาดก้อนเนื้องอกก่อนการผ่าตัด หรือให้ในระยะยาวกรณีใกล้เข้าสู่วัยหมดประจำเดือนแล้วก็ได้ โดยยังไม่มีการจำกัดระยะเวลาของการใช้ยา(8, 9)
5. GnRH agonist
นับเป็นยาที่มีประสิทธิภาพสูงและใช้กันมาอย่างแพร่หลาย โดยจะออกฤทธิ์แห่งเดียวคือต่อมใต้สมอง โดยช่วง 1 สัปดาห์แรกจะเป็นการกระตุ้นการหลั่ง GnRH ทำให้ระดับ LH และ FSH เพิ่มขึ้น (Flare effect) เมื่อกระตุ้นไปสักระยะจะทำให้ปริมาณตัวรับลดลง ทำให้ลดการตอบสนองต่อฮอร์โมน GnRH (Down regulation) ส่งผลให้ระดับเอสโตรเจนและโปรเจสเตอโรนในเลือดลดลง เสมือนว่าผู้ป่วยเข้าสู่วัยทองชั่วคราว(1, 2) จึงมีภาวะขาดประจำเดือน โดยภาวะเลือดออกผิดปกติมักดีขึ้นชัดเจนหลังเริ่มยาได้ประมาณ 6 เดือน(1) และช่วยลดขนาดก้อนได้ดี ขนาดเนื้องอกมดลูกจะลดลงชัดเจนเฉลี่ย 35-60% ช่วง 3 เดือนแรกของการรักษา (10) และช่วยให้ภาวะซีดดีขึ้น ลดการเติมเลือดก่อนการผ่าตัด(6) แต่ผลข้างเคียงของยาชนิดนี้คือ ผลจากระดับเอสโตรเจนที่ต่ำ ทำให้ผู้ป่วยมีอาการร้อนวูบวาบ ช่องคลอดแห้ง นอนไม่หลับ อารมณ์แปรปรวนได้ ซึ่งล้วนเป็นอาการของวัยทอง โดยอาการที่พบบ่อยที่สุดคือร้อนวูบวาบ พบประมาณ 80%(1) และผลข้างเคียงที่สำคัญคือเมื่อใช้ยาเป็นเวลานานคือ ภาวะมวลกระดูกลด โดยพบว่ามวลกระดูกลดลง 6% หลังใช้ยาติดต่อกันนานกว่า 6 เดือน(2) และส่วนใหญ่จะเป็นการสูญเสียที่สร้างใหม่ไม่ได้ พบน้อยกว่า 5% ที่กระดูกจะสร้างกลับมาเท่าเดิมหลังหยุดยา(2)
เพื่อป้องกันอาการของวัยทองและการเกิดกระดูกพรุน จึงแนะนำให้ใช้ยาเอสโตรเจนและโปรเจสเจอโรนร่วมด้วย หรือที่เรียกว่า Add-back therapy โดยระดับเอสโตรเจนที่ต้องการเพื่อลดผลข้างเคียงจาก GnRH agonist นั้นน้อยกว่าระดับที่จะกระตุ้นการโตขึ้นของเนื้องอกมดลูก ดังนั้นจึงไม่รบกวนการทำงานของ GnRH agonist ในการลดขนาดเนื้องอกมดลูกแต่อย่างใด(2) โดยจะเริ่มให้ Add-back therapy หลังเริ่ม GnRH agonist ไปแล้วประมาณ 1-3 เดือน โดยฮอร์โมนที่ให้จะใช้ขนาดต่ำคล้ายกับการเสริมฮอร์โมนในสตรีวัยหมดประจำเดือน เช่น Equine estrogen 0.3-0.625 มิลลิกรัม ร่วมกับ Medroxyprogesterone acetate(MPA) 2.5 มิลลิกรัมต่อวัน เป็นต้น(2)
เนื่องจาก GnRH agonist มีผลข้างเคียงหลายประการ ปัจจุบันจึงใช้รักษาเนื้องอกมดลูกในระยะสั้นๆไม่เกิน 6 เดือน โดยเฉพาะการให้เพื่อลดขนาดก้อนก่อนการผ่าตัด เพื่อให้ผ่าตัดได้ง่าย ลดภาวะแทรกซ้อนและการเสียเลือดขณะผ่าตัด ส่วนการใช้เพื่อรักษาอาการในระยะสั้นๆแล้วหยุดยา อาจไม่นิยมนักเนื่องจาก ขนาดเนื้องอกมดลูกจะกลับมาเท่าก่อนรักษาในเวลาประมาณ 3 เดือนหลังหยุดยา(1, 2, 7)
ตัวอย่างยาในกลุ่มนี้ได้แก่ Leuprolide acetate(Lupron), Goserelin(Zoladex), Triptorelin(Trelstar), Nafarelin(Synarel) แต่มีเพียง Leuprolide acetate เท่านั้นที่ได้รับอนุมัติจาก FDA ในการรักษาเนื้องอกมดลูก ส่วนยาตัวอื่นๆยังเป็นการใช้นอกข้อบ่งชี้อยู่ และมีการใช้น้อยกว่า(2) โดยขนาดยาที่ใช้มีดังนี้
- Leuprolide acetate 3.75 มิลลิกรัมฉีดเข้ากล้ามทุกเดือน หรือ 11.25 มิลลิกรัมทุก 3 เดือน
- Goserelin 3.6 มิลลิกรัมฉีดเข้าใต้ผิวหนังทุกเดือน หรือ 10.8 มิลลิกรัมทุก 3 เดือน
- Triptorelin 3.75 มิลลิกรัม ฉีดเข้ากล้ามทุกเดือน หรือ 11.25 มิลลิกรัมทุก 3 เดือน
- Nafarelin 200 ไมโครกรัม ฉีดพ่นจมูก 2 ครั้งต่อวัน
การเริ่มยาจะเริ่มช่วงมีประจำเดือน หรือช่วงระยะท้ายของ Luteal phase แต่ต้องแน่ใจว่าไม่ตั้งครรภ์(2)
6. GnRH antagonist
ข้อได้เปรียบคือ ยาจะออกฤทธิ์เร็วกว่า เนื่องจากไปยับยั้งการหลั่ง GnRH โดยไม่มีการกระตุ้นในช่วงแรก ทำให้ LH, FSH ไม่สูงกว่าค่าปกติมากช่วงเริ่มยา แต่ยังมีผลข้างเคียงเช่นเดียวกับ GnRH agonist ทั้งอาการร้อนวูบวาบหรือมวลกระดูกลดลง สำหรับยารุ่นแรกๆได้แก่ Cetrolerix และ Ganilerix ปัจจุบัน FDA ยังไม่อนุมัติให้ใช้สำหรับรักษาเนื้องอกมดลูก แต่จะใช้ในกระบวนการกระตุ้นไข่ และยังต้องฉีดทุกวัน จึงไม่เหมาะกับการรักษาระยะยาว(2) ปัจจุบันมีการพัฒนายาตัวใหม่คือ Elagolix เป็นรูปแบบรับประทาน ซึ่ง FDA อนุมัติให้ใช้รักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่แล้ว และยังอยู่ในระหว่างการศึกษาเพื่อนำมาใช้รักษาเนื้องอกมดลูก โดยพบว่าสามารถลดประจำเดือนมามากได้อย่างมีประสิทธิภาพ และการให้ Add-back therapy ยังช่วยลดอาการร้อนวูบวาบได้ดี(11)
7. Selective Estrogen Receptor Modulators (SERMs)
หลักการออกฤทธิ์จะคล้ายกับ SPRMs คือจะสามารถกระตุ้นหรือยับยั้งก็ได้ ขึ้นกับการตอบสนองของตัวรับสัญญาณของเอสโตรเจนที่อวัยวะนั้นๆ โดยทั่วไป SERMs เป็นที่รู้จักในแง่การรักษามะเร็งเต้านมที่มีตัวรับเอสโตรเจน (Positive estrogen receptor) เช่น Tamoxifen ในส่วนของยาที่ใช้รักษาเนื้องอกมดลูกจะใช้ Raloxifene แต่ประสิทธิภาพในการรักษายังไม่ชัดเจน แม้พบว่าอาจมีประโยชน์ในการลดขนาดเนื้องอก หากให้คู่กับ GnRH agonist(12) แต่การให้ Raloxifene เพียงอย่างเดียวก็ยังไม่มีการศึกษามากพอที่จะบอกประสิทธิภาพของยาได้ชัดเจน โดยขนาดยาที่ใช้ในการศึกษาที่ผ่านมาจะอยู่ในช่วง 60-180 มิลลิกรัมต่อวัน ติดต่อกัน 1-3 เดือน (7, 12)
8. Aromatase Inhibitors (Letrozole)
ในเนื้องอกมดลูกจะมี Aromatase receptor มากกว่ากล้ามเนื้อมดลูกข้างเคียง จึงถูกกระตุ้นได้มากกว่า กลไกของยาคือการยับยั้งการเปลี่ยนจากแอนโดรเจนเป็นเอสโตรเจน ทำให้ลดการกระตุ้นการแบ่งตัวของเซลล์เนื้องอก(6) จากการศึกษาที่ผ่านมาพบว่า Letrozole สามารถลดขนาดเนื้องอกมดลูกได้ดีหลังได้ยา 3 เดือน และผลข้างเคียงน้อยกว่ายาฮอร์โมนตัวอื่น อย่างไรก็ตามจำนวนการศึกษาที่ผ่านมายังไม่เพียงพอที่จะสนับสนุนให้ใช้ยา Letrozole ในการรักษาเนื้องอกมดลูกในปัจจุบัน(7)
9. Androgens
Danazol และ Gestrinone เป็นสเตียรอยด์สังเคราะห์ที่ออกฤทธิ์เป็นแอนโดรเจน ทำหน้าที่ยับยั้งการหลั่ง FSH และ LH ที่ต่อมใต้สมอง ลดการสร้างเอสโตรเจนที่รังไข่ และยังลดการฝังตัวของเยื่อบุโพรงมดลูกเจริญผิดที่ ทำให้ขาดประจำเดือน จึงช่วยแก้ปัญหาเลือดออกมากผิดปกติ ช่วยลดขนาดเนื้องอกมดลูกได้ ประมาณ 20-25%(7) และหลังได้รับยานาน 6 เดือนแล้วหยุดยา เมื่อติดตามไป 18 เดือนขนาดมดลูกยังคงเล็กกว่าก่อนการรักษา(13) แต่เนื่องจากเป็นยาที่ออกฤทธิ์เป็นฮอร์โมนเพศชาย จึงมีผลข้างเคียงค่อนข้างมาก ได้แก่ น้ำหนักขึ้น มีสิว ผิวมัน ขนดก อารมณ์แปรปรวน ร้อนวูบวาบ เป็นต้น(14)
ปัจจุบันยากลุ่มนี้ใช้สำหรับรักษาเยื่อบุโพรงมดลูกเจริญผิดที่เป็นหลัก แต่อาจนำมาประยุกต์ใช้ในการชักนำให้ประจำเดือนขาดเพื่อหยุดเลือดในกลุ่มผู้ป่วยเนื้องอกมดลูกที่มีประจำเดือนมามากได้ สำหรับ Gestrinone ยังมีผลในการลดขนาดเนื้องอกมดลูกด้วย แต่ยังมีการใช้เฉพาะฝั่งยุโรปและออสเตรเลียเท่านั้น ทางฝั่งอเมริกาและแคนาดายังไม่มีการนำเข้ามาใช้(13)
ยาที่ไม่ใช่ฮอร์โมน
10.ยาต้านการสลายลิ่มเลือด (Antifibrinolytic agents)
ได้แก่ Tranexamic acid ซึ่ง FDA อนุมัติให้ใช้รักษาภาวะประจำเดือนมามากผิดปกติ โดยเป็นรูปแบบรับประทาน จากการศึกษาก็พบว่าสามารถลดอาการเลือดประจำเดือนออกมากได้ดี (15) โดยแนะนำให้รับประทานครั้งละ 1 กรัม วันละ 3-4 ครั้ง เริ่มทานในช่วงที่มีประจำเดือนมามาก และพบว่าหากรับประทานมากกว่า 3 กรัมต่อวันติดต่อกัน 5 วัน จะช่วยลดปริมาณประจำเดือนได้ 35-55%(14) แต่สำหรับการนำมารักษาจำเพาะอาการเลือดออกผิดปกติที่สัมพันธ์กับเนื้องอกมดลูก ยังไม่มีการศึกษาเพียงพอ(2)
11. ยาต้านการอักเสบที่ไม่ใช่สเตียรอยด์ (Nonsteroidal anti-inflammatory drugs; NSAIDs) ยังไม่พบว่า NSAIDs มีประโยชน์ในการรักษาอาการเลือดออกผิดปกติจากเนื้องอกมดลูกได้เทียบเท่ายาตัวอื่นๆ จากหลายการศึกษายังไม่เป็นไปในทางเดียวกันว่า NSAIDs สามารถลดปริมาณเลือดออกได้อย่างมีนัยสำคัญหรือไม่(1, 2, 5, 16) แต่เนื่องจากยามีประสิทธิภาพลดอาการปวดประจำเดือนได้ดี จึงยังมีการใช้อย่างแพร่หลาย แต่ไม่แนะนำให้ใช้ตัวเดียวในการรักษา(2) สำหรับยาที่นิยมใช้ได้แก่ Mefenamic acid, Ibuprofen, Naproxen เป็นต้น(14)
เอกสารอ้างอิง
- Berek JS. Berek & Novak’s Gynecology. 15 ed. United States of America: LIPPINCOTT WILLIAMS & WILKINS, a WOLTERS KLUWER business; 2012.
- Barbara L. Hoffman, John O. Schorge, Karen D. Bradshaw, Lisa M. Halvorson, Joseph I. Schaffer, Corton MM. Williams Gynecology. 3rd ed. United States of America: McGraw-Hill Education; 2016.
- Munro MG, Critchley HOD, Fraser IS. The FIGO classification of causes of abnormal uterine bleeding in the reproductive years. Fertility and Sterility. 2011;95(7):2204-8.e3.
- Fletcher HM, Wharfe G Fau – Williams NP, Williams Np Fau – Gordon-Strachan G, Gordon-Strachan G Fau – Johnson P, Johnson P. Renal impairment as a complication of uterine fibroids: a retrospective hospital-based study. (1364-6893 (Electronic)).
- De La Cruz MS, Buchanan EM. Uterine Fibroids: Diagnosis and Treatment. (1532-0650 (Electronic)).
- Laughlin-Tommaso SK. Non-surgical Management of Myomas. Journal of Minimally Invasive Gynecology. 2018;25(2):229-36.
- Vilos GA, Allaire C, Laberge P-Y, Leyland N, Vilos AG, Murji A, et al. The Management of Uterine Leiomyomas. Journal of Obstetrics and Gynaecology Canada. 2015;37(2):157-78.
- Rabe TA-O, Saenger N, Ebert AA-OX, Roemer T, Tinneberg HR, De Wilde RA-O, et al. Selective Progesterone Receptor Modulators for the Medical Treatment of Uterine Fibroids with a Focus on Ulipristal Acetate. (2314-6141 (Electronic)).
- Laberge PY, Murji A, Vilos GA, Allaire C, Leyland N, Singh SS. Guideline No. 389-Medical Management of Symptomatic Uterine Leiomyomas – An Addendum. (1701-2163 (Print)).
- Carr BR, Marshburn Pb Fau – Weatherall PT, Weatherall Pt Fau – Bradshaw KD, Bradshaw Kd Fau – Breslau NA, Breslau Na Fau – Byrd W, Byrd W Fau – Roark M, et al. An evaluation of the effect of gonadotropin-releasing hormone analogs and medroxyprogesterone acetate on uterine leiomyomata volume by magnetic resonance imaging: a prospective, randomized, double blind, placebo-controlled, crossover trial. (0021-972X (Print)).
- Archer DF, Stewart EA, Jain RI, Feldman RA, Lukes AS, North JD, et al. Elagolix for the management of heavy menstrual bleeding associated with uterine fibroids: results from a phase 2a proof-of-concept study. (1556-5653 (Electronic)).
- Palomba S, Russo T Fau – Orio F, Jr., Orio F Jr Fau – Tauchmanova L, Tauchmanova L Fau – Zupi E, Zupi E Fau – Panici PLB, Panici Pl Fau – Nappi C, et al. Effectiveness of combined GnRH analogue plus raloxifene administration in the treatment of uterine leiomyomas: a prospective, randomized, single-blind, placebo-controlled clinical trial. (0268-1161 (Print)).
- Coutinho EM, Goncalves MT. Long-term treatment of leiomyomas with gestrinone. (0015-0282 (Print)).
- Sriprasert IA-OX, Pakrashi T, Kimble T, Archer DF. Heavy menstrual bleeding diagnosis and medical management. (2055-7426 (Electronic)).
- Lukes AS, Moore Ka Fau – Muse KN, Muse Kn Fau – Gersten JK, Gersten Jk Fau – Hecht BR, Hecht Br Fau – Edlund M, Edlund M Fau – Richter HE, et al. Tranexamic acid treatment for heavy menstrual bleeding: a randomized controlled trial. (1873-233X (Electronic)).
- Makarainen L Fau – Ylikorkala O, Ylikorkala O. Primary and myoma-associated menorrhagia: role of prostaglandins and effects of ibuprofen. (0306-5456 (Print)).