Genitourinary syndrome of menopause
Genitourinary syndrome of menopause
พญ.อภิชญา เตชะตา
อาจารย์ที่ปรึกษา รศ.พญ. ทวิวัน พันธศรี
วัยทอง หรือ วัยหมดประจำเดือน คือ ภาวะที่สตรีเข้าสู่วัยหมดประจำเดือน (1) โดยทั่วไปจะวินิจฉัยเมื่อประจำเดือนขาดหายไปอย่างน้อย 12 เดือน โดยทั่วไปอายุเฉลี่ยของการหมดประจำเดือนอยู่ที่ 52 ปี วัยทองเป็นช่วงเวลาที่การทำงานของรังไข่ลดลง ส่งผลให้ฮอร์โมนเอสโตรเจนในร่างกายลดต่ำลง
ในปัจจุบันอายุของเพศหญิงเพิ่มสูงขึ้นจากในอดีต ในขณะที่ช่วงอายุที่หมดประจำเดือนยังอยู่ในช่วงอายุเดิม ดังนั้นจึงมีประชากรเพศหญิงจำนวนมากที่ต้องได้รับผลกระทบจากวัยหมดประจำเดือนเป็นระยะเวลานานขึ้น โดยบางรายต้องอยู่กับภาวะหมดประจำเดือนมากถึง 30 ปี
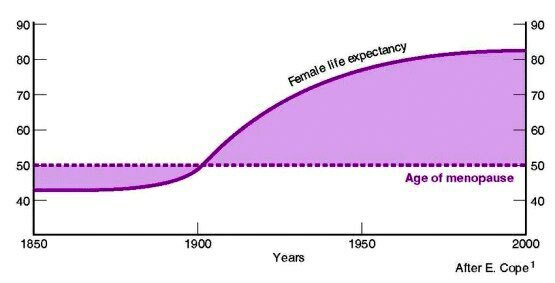
ผลกระทบทางสุขภาพในวัยหมดประจำเดือน
สามารถแบ่งออกเป็น 7 กลุ่ม ได้แก่
- Vasomotor symptoms
- Genitourinary syndrome of menopause
- Sexual dysfunction
- Osteoporosis
- Cardiovascular disease
- Breast cancer
- Dementia
ซึ่งในที่นี้จะกล่าวถึงเฉพาะในส่วนของ Genitourinary syndrome of menopause
Genitourinary syndrome of menopause (GSM)
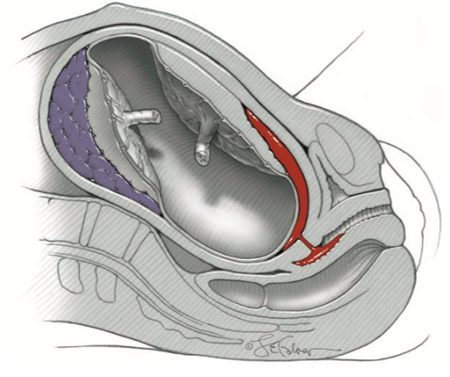
เป็นภาวะที่พบได้บ่อยในวัยหมดประจำเดือน เป็นผลจากการลดลงของฮอร์โมนเอสโตรเจนหลังจากที่ประจำเดือนหมด ส่งผลให้มีการเปลี่ยนแปลงของบริเวณอวัยวะเพศภายนอก (labia) และช่องคลอด (vagina) รวมถึงการเปลี่ยนแปลงของระบบทางเดินปัสสาวะ ได้แก่ ท่อปัสสาวะ (urethra) และกระเพาะปัสสาวะ (bladder)
จากการศึกษา (3-6) พบว่าหญิงวัยหมดประจำเดือนเกินครึ่งต้องเผชิญกับภาวะ GSM โดยพบว่า prevalence ของการเกิด GSM อยู่ที่ร้อยละ 50-84 (6) และในการศึกษาแบบ longtitudinal, population-based study (7) ซึ่งศึกษาในหญิงชาวออสเตรเลีย 438 ราย รายงานว่าอาการช่องคลอดแห้งพบเพิ่มขึ้นตามระยะเวลานับจากการหมดประจำเดือน โดยพบว่าในกลุ่มใกล้หมดประจำเดือน (perimenopausal woman) พบร้อยละ 4, กลุ่มหมดประจำเดือน 1 ปีพบ GSM ร้อยละ 25 และ กลุ่มหลังหมดประจำเดือน 3 ปีพบ GSM มากถึงร้อยละ 47
ปัจจัยเสี่ยงของภาวะ GSM (8)
- วัยหมดประจำเดือน (menopause)
- ภาวะเอสโตรเจนต่ำ (nonmenopausal hypoestrogenism)
- การผ่าตัดรังไข่ทั้งสองข้าง (bilateral oophorectomy)
- การสูบบุหรี่ (cigarette smoking)
- การดื่มสุรา (alcohol abuse)
- การลดความถี่ของการมีเพศสัมพันธ์ (decreased frequency and sexual abstinence)
- ภาวะรังไข่ล้มเหลว (ovarian failure)
- การไม่ออกกำลังกาย (lack of exercise)
- การไม่เคยคลอดบุตรทางช่องคลอด (absence of vaginal childbirth)
อาการและอาการแสดงของภาวะ GSM (7)
อาการและอาการแสดงของภาวะ GSM สามารถแบ่งออกเป็น 3 กลุ่มใหญ่ ได้แก่
- อาการและอาการแสดงด้านการเปลี่ยนแปลงของอวัยวะสืบพันธุ์ (external genitalia)
- อาการและอาการแสดงทางระบบทางเดินปัสสาวะ (urological symptom and sign)
- อาการและอาการแสดงที่เกี่ยวกับการมีเพศสัมพันธ์ (sexual symptom and sign)
1. อาการและอาการแสดงด้านการเปลี่ยนแปลงของอวัยวะสืบพันธุ์ (external genitalia)
การเปลี่ยนแปลงทางสรีระวิทยาของวัยหมดประจำเดือน ทำให้เกิดภาวะ vulvovaginal atrophy (VVA) นอกจากทำให้มีการเปลี่ยนแปลงโดยตรงต่อร่างกายของหญิงวัยนี้แล้ว ยังส่งผลทางด้านจิตใจและสังคม เนื่องจากการที่ช่องคลอดแห้งทำให้เกิดความรู้สึกสูงวัยมากขึ้น ความเป็นหญิงลดลง ก่อให้เกิดความกังวลและผิดหวังกับรูปลักษณ์ของตนเอง ส่งผลให้เกิดภาวะเครียดหรือซึมเศร้าได้ (9) ซึ่งผลที่ตามมาในระยะยาวคือปัญหาทางด้านความสัมพันธ์ในครอบครัว ทั้งนี้สามารถสรุปอาการ อาการแสดงและภาวะแทรกซ้อนของภาวะ VVA ได้ดังนี้
|
อาการและอาการแสดง (Symptoms and signs) |
ภาวะแทรกซ้อน (Complication) |
|
Gandhi. Genitourinary syndrome of menopause. AM J Obstet Gynecol 2016.
2. อาการและอาการแสดงทางระบบทางเดินปัสสาวะ (urological symptom and sign)
นอกจากอาการ VVA พบว่าปัญหาของระบบทางเดินปัสสาวะถือเป็นปัญหาที่สำคัญของหญิงวัยหมดประจำเดือน พบว่าในกลุ่มที่มาพบแพทย์ด้วยอาการ VVA มักพบปัญหาของระบบทางเดินปัสสาวะ เช่น ปัสสาวะบ่อย ปัสสาวะแสบขัด ปัสสาวะรีบ ร่วมด้วย ซึ่งสามารถสรุปอาการและอาการแสดงทางระบบทางเดินปัสสาวะ ได้ดังนี้
|
อาการและอาการแสดง (Symptoms and signs) |
ภาวะแทรกซ้อน (Complication) |
|
Gandhi. Genitourinary syndrome of menopause. AM J Obstet Gynecol 2016.
3. อาการและอาการแสดงที่เกี่ยวกับการมีเพศสัมพันธ์ (sexual symptom and sign)
ปัญหาที่เกี่ยวข้องกับการมีเพศสัมพันธ์เพิ่มขึ้นตามอายุและการลดลงของฮอร์โมนเอสโตรเจนจากการศึกษาพบว่า หญิงชาวอเมริกันที่มีช่วงอายุระหว่าง 50-74 ปีจำนวนมากถึง 9.7 ล้านคนต้องประสบกับปัญหาในการมีเพศสัมพันธ์ ซึ่งเป็นผลมาจากการที่ช่องคลอดแห้งจากวัยหมดประจำเดือน(10) โดยความยากของการแก้ปัญหาของอาการที่เกี่ยวข้องกับการมีเพศสัมพันธ์ คือ หญิงวัยหมดประจำเดือนเพียงร้อยละ 60 ที่มาปรึกษาแพทย์ ในขณะที่อีกกว่าร้อยละ 40 นั้นมักไม่แสดงออกถึงปัญหาและไม่ได้รับการรักษาจากแพทย์ (11) อาการและอาการแสดงของวัยหมดประจำเดือนที่เกี่ยวกับการมีเพศสัมพันธ์ ได้แก่
|
อาการและอาการแสดง (Symptoms and signs) |
|
Gandhi. Genitourinary syndrome of menopause. AM J Obstet Gynecol 2016.
การวินิจฉัย (7)
การวินิจฉัยภาวะ GSM อาศัยการซักประวัติ และการตรวจร่างกายเป็นหลัก การส่งตรวจเพิ่มเติมอื่นๆอาจพิจารณาส่งตรวจเป็นรายๆไปตามความจำเป็นและความเหมาะสม ทั้งนี้การส่งตรวจเพิ่มเติม
เพื่อช่วยวินิจฉัยภาวะ GSM ได้แก่
|
การส่งตรวจเพิ่มเติม (Tests) |
ผลการส่งตรวจ (Findings) |
|
• Endometrial stripe < 5 mm • Pelvic mass |
|
• Symptomatic pH: 5-7 (normal pH: 3.5-4.5) |
|
• Basal epithelial cells predominate and decreased percentage of superficial cells |
|
• Presence of leukocytes and paucity of Lactobacillus |
(Pap test) |
• Atrophy of cervix and stenosis of os |
|
• Pelvic and adnexal abnormalities |
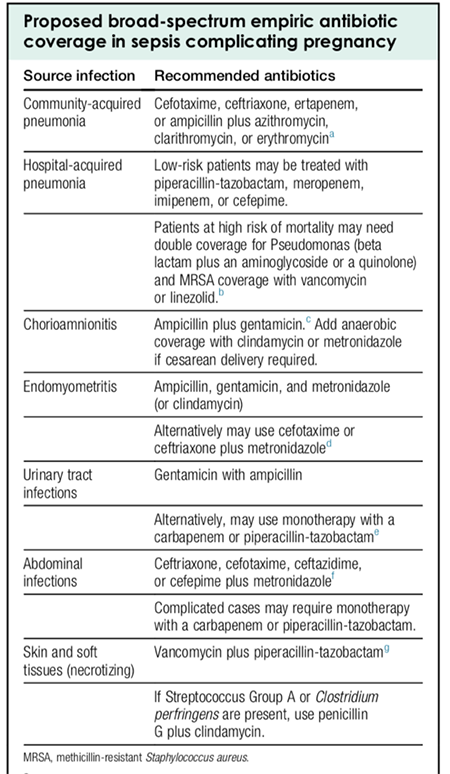
การรักษาภาวะ GSM (2, 8, 12-14)
การรักษาภาวะ GSM นั้นมีแนวทางการรักษาที่หลากหลาย การใช้ฮอร์โมนทดแทนถือเป็นทางเลือกที่ควรพิจารณาให้แก่ผู้ป่วยกลุ่มที่มีอาการระดับปานกลางถึงรุนแรง ส่วนในกลุ่มที่มีอาการเพียงเล็กน้อยพบว่าการใช้การรักษาด้วยวิธีทางเลือกอื่นๆ นอกเหนือจากการใช้ฮอร์โมนทดแทนนั้น ให้ผลลัพธ์หลังการรักษาที่น่าพึงพอใจ(4, 15) ดังนั้นการรักษาภาวะ GSM จึงควรพิจารณาให้การรักษาที่เหมาะสมโดยคำนึงถึงอาการ อาการแสดงและความรุนแรงในผู้ป่วยแต่ละราย
1. Lubricants
ช่วยลดอาการช่องคลอดแห้งและคันช่องคลอดได้ชั่วคราวระหว่างที่มีเพศสัมพันธ์ โดยออกฤทธิ์ได้ดีในช่วง 24 ชั่วโมงแรกของการใช้ ดังนั้นการรักษาด้วยวิธีนี้จึงเหมาะกับผู้ป่วยที่มีอาการเพียงเล็กน้อย หรือใช้ในช่วงแรกที่เริ่มใช้ฮอร์โมนเอสโตรเจนเพื่อรอให้ผลจากฮอร์โมนออกฤทธิ์
การใช้สารหล่อลื่นมีทั้งในรูปแบบ water, silicone ,mineral หรือ plant oil based วิธีการใช้คือ ป้ายบริเวณอวัยวะเพศด้านนอกและช่องคลอดก่อนการมีเพศสัมพันธ์ โดยการเลือกใช้ควรเลือกผลิตภัณฑ์ที่มีค่าความเป็นกรดประมาณ 4.5 ซึ่งเป็นค่าที่มีความใกล้เคียงกับสารคัดหลั่งปกติของช่องคลอด และ osmolality ไม่เกิน 380 mOsm/kg เพื่อป้องกันการระคายเคืองและการทำลายเยื่อบุช่องคลอด
2. Moisturizers
สำหรับสารให้ความชุ่มชื้นมีประโยชน์ในการรักษาช่องคลอดแห้ง โดยการเพิ่มความชุ่มชื้น สามารถใช้ได้ 2-3 ครั้งต่อสัปดาห์ และไม่จำเป็นต้องให้ก่อนการมีเพศสัมพันธ์
3. Estrogen therapy
เป็นการรักษาหลักของภาวะ GSM โดยเฉพาะ VVA จากการศึกษาพบว่า(16) การให้ฮอร์โมนเอสโตรเจนช่วยซ่อมแซมเยื่อบุช่องคลอด เพิ่มการหลั่งสารคัดหลั่ง ลดภาวะความเป็นด่างของ
ช่องคลอด และช่วยบรรเทาอาการ VVA ได้ทั้งหมด การให้การรักษาด้วยฮอร์โมนเอสโตรเจน ควรพิจารณาเลือกใช้ในผู้ป่วยที่ไม่มีข้อห้าม และควรใช้ขนาดยาต่ำที่สุดที่ควบคุมอาการได้ เพื่อป้องกันผลข้างเคียงโดยเฉพาะการเกิดมะเร็งเยื่อบุโพรงมดลูก
- Systemic estrogen therapy ได้แก่ ชนิดรับประทาน ชนิดแผ่นแปะผิวหนัง และชนิดห่วงสอดทางช่องคลอด นอกจากประโยชน์ในการใช้รักษาอาการร้อนวูบวาบของหญิงวัยหมดประจำเดือนแล้ว การให้ systemic estrogen therapy ยังสามารถรักษาอาการจากภาวะ GSM และป้องกันการเกิดภาวะกระดูกพรุนได้
- Topical estrogen therapy ได้แก่ การให้เอสโตรเจนทางช่องคลอด ซึ่งเป็นวิธีที่ North American Menopause Society (NAMS) และ International Menopause Society แนะนำเป็นการรักษาหลักของ
ภาวะ GSM โดยพบว่าการให้ topical estrogen therapy ในขนาดต่ำๆ ใช้ในการรักษาภาวะ GSM โดยช่วยลดความเป็นด่างของช่องคลอด ทำให้เซลล์เยื่อบุช่องคลอดดีขึ้น และป้องกันการติดเชื้อทางเดินปัสสาวะ นอกจากนี้ topical estrogen therapy ยังช่วยแก้ไขปัญหาเรื่องทางเดินปัสสาวะและปัญหาที่เกิดจากการมีเพศสัมพันธ์ในหญิงวัยหมดประจำเดือนได้ด้วย แต่ทั้งนี้ไม่ช่วยในการรักษาอาการร้อนวูบวาบและไม่สามารถป้องกันภาวะกระดูกพรุนได้ การให้ฮอร์โมนแบบเฉพาะที่ มีข้อดีคือไม่ผ่านระบบการดูดซึมของตับ (hepatic metabolism) ดังนั้นจึงไม่จำเป็นต้องได้รับฮอร์โมนโปรเจสเตอโรนร่วมด้วยในรายที่มีมดลูก และไม่จำเป็นต้องติดตามความหนาของเยื่อบุโพรงมดลูกในผู้ป่วยที่ไม่มีเลือดออกผิดปกติทางช่องคลอดหากใช้ติดต่อกันน้อยกว่า 2 ปี
ผลข้างเคียงจากการให้ฮอร์โมนเอสโตรเจนแบบ systemicในผู้ป่วยบางราย ได้แก่ คัดตึงเต้านม เลือดออกทางช่องคลอด คลื่นไส้ น้ำหนักตัวเพิ่ม ปวดศีรษะ ปวดหลัง ปวดท้อง กรณีใช้ฮอร์โมนแบบแปะผิวหนังพบว่าอาจมีการระคายเคืองได้ในผู้ป่วยบางราย กรณีใช้ฮอร์โมนแบบสอดทางช่องคลอดอาจก่อให้เกิดอาการคันช่องคลอด หรือมีสารคัดหลั่งทางช่องคลอดมาก
ข้อห้ามของการให้ฮอร์โมนเอสโตรเจน ได้แก่ ผู้ป่วยที่มีเลือดออกผิดปกติทางช่องคลอดที่ยังไม่ได้รับการวินิจฉัย มะเร็งเต้านม โรคลิ่มเลือดอุดตัน เยื่อบุโพรงมดลูกเจริญผิดปกติหรือมะเร็งเยื่อบุโพรงมดลูก ความดันโลหิตสูง โรคตับหรือท่อน้ำดี หญิงตั้งครรภ์ โรคไมเกรนที่มีอาการทางระบบประสาท หรือมีประวัติสูบบุหรี่ตั้งแต่อายุ > 35 ปี
4. Intravaginal dehydroepiandrosterone
Dehydroepiandrosterone หรือ DHEA เป็นฮอร์โมนเพศชนิดหนึ่ง จากการศึกษาแบบ randomized double-blind controlled พบว่า การใช้ DHEA แบบสอดทางช่องคลอดวันละ 1 ครั้ง ทำให้เยื่อบุช่องคลอดดีขึ้น ลดความเป็นด่างของช่องคลอด เพิ่มสารคัดหลังทางช่องคลอด และลดอาการปวดจากการ
มีเพศสัมพันธ์ แต่ยังต้องการการศึกษาขนาดใหญ่ และการติดตามผู้ป่วยระยะยาว
5. Selective estrogen receptor modulator
Selective estrogen receptor modulator หรือ SERM เป็นทางเลือกในการรักษา GSM โดยเป็นยารูปแบบรับประทาน สามารถใช้ในการรักษา GSM ได้แก่ อาการปวดขณะมีเพศสัมพันธ์ และอาการช่องคลอดแห้ง ยาที่ได้รับการยอมรับจากองค์การอาหารและยาของสหรัฐอเมริกา (FDA) ได้แก่ ospemifene โดยให้พิจารณาเลือกใช้ในผู้ป่วยกลุ่มที่ไม่สามารถให้ฮอร์โมนเอสโตรเจนได้
จากการศึกษาที่ผ่านมากพบว่า ospemifene ช่วยรักษาอาการช่องคลอดแห้งและการปวดจากการมีเพศสัมพันธ์ ซึ่งระยะเวลาที่สามารถใช้ได้อย่างปลอดภัยในปัจจุบัน คือ 52 สัปดาห์ โดยพบว่าไม่มีผู้ป่วยเกิดภาวะมะเร็งเยื่อบุโพรงมดลูกหลังจากที่ได้รับ SERM แต่พบว่ามีผู้ป่วยน้อยกว่าร้อยละ 1 ที่พบการเจริญผิดปกติของเยื่อบุโพรงมดลูก (endometrial hyperplasia)
เนื่องจาก SERM อาจเพิ่มการเกิดภาวะลิ่มเลือดอุดตัน ดังนั้นจึงควรหลีกเลี่ยงการใช้ในผู้ป่วยที่มีประวัติหรือมีความเสี่ยงของการเกิดภาวะลิ่มเลือดอุดตัน
ผลข้างเคียงที่พบได้จากการใช้ยา ได้แก่ ร้อนวูบวาบ ตกขาว กล้ามเนื้อเกร็ง และเหงื่อออกมาก
6. Synthetic steroid
Tibolone ซึ่งเป็นยากลุ่มสเตียรอยด์สังเคราะห์ชนิดรับประทาน ถูกนำมาใช้ในการรักษา GSM โดยพบว่าทำให้เยื่อบุช่องคลอดของหญิงวัยหมดประจำเดือนดีขึ้น และเพิ่มความรู้สึกทางเพศ
7. Oxytocin
จากการศึกษาแบบ randomized double-blind controlled พบว่า การใช้ยา oxytocin แบบเจลทำให้เยื่อบุช่องคลอดดีขึ้นและลดความเป็นด่างของช่องคลอด โดยจากการศึกษานี้ยังไม่พบการเกิดมะเร็งเยื่อบุโพรงมดลูกภายหลังการใช้ oxytocin ในทางปฏิบัติอาจจำเป็นต้องได้รับการศึกษาเพิ่มเติมเกี่ยวกับข้อดีและข้อเสียของการใช้ oxytocin ในการรักษา GSM
ยาที่ใช้ในการรักษาภาวะ GSM (2)
|
ชนิดยา |
ข้อบ่งชี้ |
วิธีการบริหารยา |
ผลข้างเคียง |
ข้อห้าม |
|
1. Systemic estrogens |
• อาการ VMS ระดับปานกลางถึงรุนแรง • อาการ VVA ระดับปานกลางถึงรุนแรง |
• รับประทาน • แผ่นแปะ • สอดช่องคลอด |
• พบบ้าง : ปวดศีรษะ คัดตึงเต้านม เลือดออกผิดปกติทางช่องคลอด ปวดท้อง ท้องอืด บวม ผมร่วง ติดเชื้อราในช่องคลอด คลื่นไส้อาเจียน • พบน้อย: โรคหลอดเลือดสมอง โรคหัวใจ มะเร็งมดลูก |
• เลือดออกผิดปกติทางช่องคลอดที่ยังไม่ได้รับการวินิจฉัย • สงสัยมะเร็งที่มี • โรคลิ่มเลือดอุดตัน • แพ้ยา • ตั้งครรภ์ |
|
2. Vaginal low dose estrogens |
• อาการ VVA • อาการปวดเวลามีเพศสัมพันธ์ระดับปานกลางถึงรุนแรง |
• สอดช่องคลอด |
• พบผลข้างเคียงน้อยมาก • มีผลต่อ metabolic syndrome น้อยกว่าการให้กลุ่ม systemic estrogen |
|
|
3. SERMs |
• อาการปวดเวลามีเพศสัมพันธ์ระดับปานกลางถึงรุนแรง • อาการ VVA |
• รับประทาน |
• พบบ้าง ร้อนวูบวาบ ตกขาว • พบน้อย โรคหลอดเลือดสมอง |
• เลือดออกผิดปกติทางช่องคลอดที่ยัง • สงสัยมะเร็งที่มีเอสโตรเจนเป็นตัวกระตุ้น • มีประวัติลิ่มเลือดอุดตัน • แพ้ยา • ตั้งครรภ์ |
|
4. DHEA |
• สอดช่องคลอด |
• ตกขาว • ผล papsmear ผิดปกติ |
• เลือดออกผิดปกติทางช่องคลอดที่ยังไม่ได้รับการวินิจฉัย • ยังไม่มีการศึกษาในกลุ่มผู้ป่วยมะเร็งเต้านม |
8. Laser therapies
การรักษาด้วยเลเซอร์ (fractional microablative carbon-dioxide laser therapy) ถูกนำมาใช้เป็นทางเลือกในการรักษา GSM เนื่องจากทำให้เกิดการสะสมไกลโคเจน คอลลาเจน และเพิ่มความหนาของเยื่อบุช่องคลอด จากการศึกษาพบว่าหลังให้การรักษาด้วยเลเซอร์ 12 สัปดาห์ อาการช่องคลอดแห้ง คันช่องคลอด ปัสสาวะแสบขัด และอาการปวดขณะมีเพศสัมพันธ์ลดลง และไม่พบผลข้างเคียงรุนแรงจากการรักษา แต่ยังต้องการการศึกษารูปแบบและผลการรักษาระยะยาวเพิ่มขึ้น
9. Lifestyle modifications
การใช้อุปกรณ์ช่วยเพิ่มความยืดหยุ่นของช่องคลอดหรือการเพิ่มจำนวนครั้งการมีเพศสัมพันธ์ สามารถใช้ในการรักษาภาวะ GSM โดยส่งผลให้มีเลือดไหลเวียนบริเวณช่องคลอดมากขึ้น ทำให้มีการยืดของผนังช่องคลอดและเกิดความยืดหยุ่นมากขึ้น นอกจากนี้น้ำอสุจิซึ่งประกอบไปด้วยฮอร์โมนเพศ พรอสตาแกลนดิน และกรดไขมันจำเป็นนั้น ทำให้เยื่อบุช่องคลอดอยู่ในสภาวะปกติ
การลดการสูบบุหรี่ช่วยลดอาการ GSM ได้ ดังนั้นจึงควรให้คำแนะนำแก่ผู้ป่วยให้ลดหรือเลิกสูบบุหรี่ ทั้งนี้การใส่ชุดชั้นในที่หลวมมากขึ้นพบว่าช่วยลดการเจริญของเชื้อโรคและลดภาวะแทรกซ้อน เช่น การติดเชื้อที่ช่องคลอด หรือการติดเชื้อทางเดินปัสสาวะได้
การให้คำปรึกษาและให้ความรู้ (counseling and education) เกี่ยวกับการดูแลภาวะ GSM เป็นสิ่งที่สำคัญ เนื่องจากทำให้ผู้ป่วยเกิดความเข้าใจเกี่ยวกับภาวะที่เผชิญอยู่ ทราบแนวทางแก้ไขปัญหา และการให้คำปรึกษาจะทำให้แพทย์ที่ให้การดูแลสามารถดูแลได้ครอบคลุมทั้งทางด้านร่างกายและจิตใจ
การรักษา GSM ในหญิงวัยหมดประจำเดือนที่เป็นมะเร็งเต้านมหรือมีความเสี่ยงสูงที่จะเป็นมะเร็งเต้านม
มะเร็งเต้านมเป็นมะเร็งที่พบได้บ่อยในวัยหมดประจำเดือน อายุเฉลี่ยที่ได้รับการวินิจฉัยว่าเป็นมะเร็งเต้านม คือ 62 ปี และมักพบผลบวกของ hormone receptor นอกจากนี้ยังพบว่าผู้ป่วยมะเร็งเต้านมมากถึงร้อยละ 60 มีอาการ GSM ร่วมด้วย แนวทางการดูแลจากคำแนะนำของ NAMS และ International Society for the Study of Women’s Sexual Health คือ หญิงกลุ่มนี้ให้เลือกใช้การรักษากลุ่มที่ไม่มีฮอร์โมนก่อน หากจำเป็นต้องได้รับฮอร์โมน ให้พิจารณาจากผล estrogen receptor และความเสี่ยงของการให้ฮอร์โมนอื่นๆ ทั้งนี้ให้พิจารณาให้ฮอร์โมนเฉพาะที่ในขนาดต่ำที่สุด
สรุป
ภาวะ GSM เป็นภาวะที่พบได้บ่อยในหญิงวัยหมดประจำเดือน และก่อให้เกิดอาการทั้งทางร่างกายและจิตใจ ที่รบกวนการใช้ชีวิตของหญิงวัยนี้ ดังนั้นแพทย์จึงควรที่จะต้องให้ความสำคัญและความใส่ใจในการดูแลภาวะ GSM โดยการวินิจฉัยสามารถทำได้จากการซักประวัติ ตรวจร่างกาย รวมถึงอาจมีการส่งตรวจพิเศษ และพิจารณาให้การรักษาที่เหมาะสมแก่ผู้ป่วยแต่ละราย
เอกสารอ้างอิง
- La Rosa VL, Ciebiera M, Lin L-T, Fan S, Butticè S, Sathyapalan T, et al. Treatment of genitourinary syndrome of menopause: the potential effects of intravaginal ultralow-concentration oestriol and intravaginal dehydroepiandrosterone on quality of life and sexual function. Menopausal Review. 2019;18:116-22.
- Kagan R, Kellogg-Spadt S, Parish SJ. Practical Treatment Considerations in the Management of Genitourinary Syndrome of Menopause. Drugs & aging. 2019;36(10):897-908.
- Mac Bride MB, Rhodes DJ, Shuster LT. Vulvovaginal atrophy. Mayo Clinic proceedings. 2010;85(1):87-94.
- Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause (New York, NY). 2013;20(9):888-902; quiz 3-4.
- Parish SJ, Nappi RE, Krychman ML, Kellogg-Spadt S, Simon JA, Goldstein JA, et al. Impact of vulvovaginal health on postmenopausal women: a review of surveys on symptoms of vulvovaginal atrophy. International journal of women’s health. 2013;5:437-47.
- Hodges AL, Holland AC, Dehn B, Pace DT. Diagnosis and Treatment of Genitourinary Syndrome of Menopause. Nursing for women’s health. 2018;22(5):423-30.
- Santoro N, Komi J. Prevalence and impact of vaginal symptoms among postmenopausal women. The journal of sexual medicine. 2009;6(8):2133-42.
- Gandhi J, Chen A, Dagur G, Suh Y, Smith N, Cali B, et al. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. American journal of obstetrics and gynecology. 2016;215(6):704-11.
- Nappi RE, Particco M, Biglia N, Cagnacci A, Di Carlo C, Luisi S, et al. Attitudes and perceptions towards vulvar and vaginal atrophy in Italian post-menopausal women: Evidence from the European REVIVE survey. Maturitas. 2016;91:74-80.
- Levine KB, Williams RE, Hartmann KE. Vulvovaginal atrophy is strongly associated with female sexual dysfunction among sexually active postmenopausal women. Menopause (New York, NY). 2008;15(4 Pt 1):661-6.
- Weinberger JM, Houman J, Caron AT, Patel DN, Baskin AS, Ackerman AL, et al. Female Sexual Dysfunction and the Placebo Effect: A Meta-analysis. Obstetrics and gynecology. 2018;132(2):453-8.
- Baber RJ, Panay N, Fenton A. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric : the journal of the International Menopause Society. 2016;19(2):109-50.
- Stuenkel CA, Davis SR, Gompel A, Lumsden MA, Murad MH, Pinkerton JV, et al. Treatment of Symptoms of the Menopause: An Endocrine Society Clinical Practice Guideline. The Journal of clinical endocrinology and metabolism. 2015;100(11):3975-4011.
- Simon JA, Goldstein I, Kim NN, Davis SR, Kellogg-Spadt S, Lowenstein L, et al. The role of androgens in the treatment of genitourinary syndrome of menopause (GSM): International Society for the Study of Women’s Sexual Health (ISSWSH) expert consensus panel review. Menopause (New York, NY). 2018;25(7):837-47.
- Rahn DD, Carberry C, Sanses TV, Mamik MM, Ward RM, Meriwether KV, et al. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstetrics and gynecology. 2014;124(6):1147-56.
- Palacios S, Castelo-Branco C, Currie H, Mijatovic V, Nappi RE, Simon J, et al. Update on management of genitourinary syndrome of menopause: A practical guide. Maturitas. 2015;82(3):308-13.