Gestational Trophoblastic Disease
นพ. ธนภัค วิเศษมงคลชัย
อาจารย์ที่ปรึกษา รศ.พญ. จารุวรรณ แซ่เต็ง
บทนำ
Gestational trophoblastic diseases (GTD) หรือ โรคของเนื้อรก เป็นกลุ่มโรคที่เกิดจากการแบ่งตัวที่ผิดปกติของ trophoblast ของเนื้อรก พยาธิกำเนิดของกลุ่มโรคนี้มีความเป็นเอกลักษณ์ มักจะต้องใช้ จุลพยาธิวิทยา(histology) แยกโรค โรคเนื้อรกเกือบทุกชนิดสร้าง beta subunit ของ human chorionic gonadotropin (beta hCG)ซึ่งสามารถแบ่งกลุ่มโรคของเนื้อรก ได้ดังนี้ (1)
- โรคของเนื้อรกที่ไม่ใช่มะเร็ง (Benign, non-neoplastic trophoblastic lesions) มักพบโดยบังเอิญจากการขูดมดลูก หรือ ตัดมดลูก
- Exaggerated placental site (EPS)
- Placental site nodule (PSN)
- ครรภ์ไข่ปลาอุก (Hydatidiform mole) กลุ่มนี้เกิดจากการปฏิสนธิที่ผิดปกติ ไม่ใช่มะเร็ง แต่เพิ่มโอกาสเกิดมะเร็งครรภ์ไข่ปลาอุก (Gestational trophoblastic neoplasia, GTN)
- Complete mole
- Partial mole
- มะเร็งครรภ์ไข่ปลาอุก (Gestational trophoblastic neoplasia, GTN)
- Invasive mole
- Choriocarcinoma
- Placental site trophoblastic tumor(PSTT)
- Epithelioid trophoblastic tumor(ETT)
นอกจากนี้ในปัจจุบัน ทาง World Health Organization (WHO) พยายามจะจำแนกโรค GTD ขึ้นมาอีกกลุ่ม “abnormal (nonmolar) villous lesions” ซึ่งมีลักษณะทาง histology คล้าย Partial hydatidiform mole อันได้แก่ hydropic villi และ mild trophoblastic proliferation แต่ไม่เพียงพอที่จะวินิจฉัย Partial hydatidiform mole ซึ่งอาจจะจำเป็นต้องใช้ลักษณะของยีน (DNA genotyping) ในการแยกโรคจาก Partial hydatidiform mole แต่ถ้าไม่สามารถทำได้ ผู้ป่วยควรได้รับการรักษาแบบ Partial hydatidiform mole (2)
โรคของเนื้อรกที่ไม่ใช่มะเร็ง (Benign, non-neoplastic trophoblastic lesions)
Exaggerated placental site (EPS)
EPS เกิดจากการเจริญแทรกซึมอย่างกว้างขวางของเซลล์เนื้อรก หรือ intermediate (extravillous) trophoblastic cells เข้าสู่ endometrium หรือ myometrium ซึ่งอาจเกิดจากกลุ่มเซลล์หรือ เซลล์เดียวก็ได้ โดยไม่พบโครงสร้างที่เสียหายของ endometrial glands และ stroma(3) คล้ายกับว่าเกิดจากกระบวนการทางสรีรวิทยาที่มากเกินไป มากกว่าเป็นรอยโรคจริงๆ เมื่อย้อมสีตรวจชิ้นเนื้อทางพยาธิวิทยา (immunohistochemistry) พบว่าการแสดงออกของรูปแบบการเรียงตัวโปรตีนของเซลล์ trophoblast ใน EPS เมื่อเทียบ trophoblast ในรกปกติ (normal placenta site)(4)
Placental site nodule (PSN)
PSN เป็นโรคที่มักพบโดยบังเอิญจากการขูดมดลูก, ตัดชิ้นเนื้อจากปากมดลูก หรือ จากการตัดมดลูก ในกลุ่มอายุวันเจริญพันธุ์ (Reproductive age) ร้อยละ 40 ของ PSN พบที่ปากมดลูกส่วนใน (endocervix), ร้อยละ 56 พบที่เยื่อบุโพรงมดลูกส่วนใน (endometrium) และร้อยละ 4 พบที่ท่อนำไข่ (fallopian tube) (4) ซึ่งเป็นตำแหน่งที่อยู่นอกมดลูก เชื่อว่า เกิดตามหลังการตั้งครรภ์นอกมดลูก
ลักษณะชิ้นเนื้อที่พบเป็นสีเหลือง หรือสีน้ำตาลอ่อน (tan) ขนาด 1 ถึง 14 มิลลิเมตร (เฉลี่ย 2.1 มิลลิเมตร) บางครั้งเห็นเป็นก้อนนูนหลายๆตำแหน่ง หากส่งตรวจชิ้นเนื้อจะพบเป็นก้อนที่มีขอบเรียบ ล้อมรอบด้วยขอบบาง ๆ ที่เป็นเซลล์ที่มีการอักเสบเรื้อรัง ในก้อนเต็มไปด้วยเศษเซลล์ตายที่ย้อมติดสีชมพู(hyalinized) หรือ สารนอกเซลล์ที่ลักษณะเหมือน fibrin (fibrinoid extracellular matrix) ซึ่งแยกออกจากเซลล์ trophoblasts (3, 4)
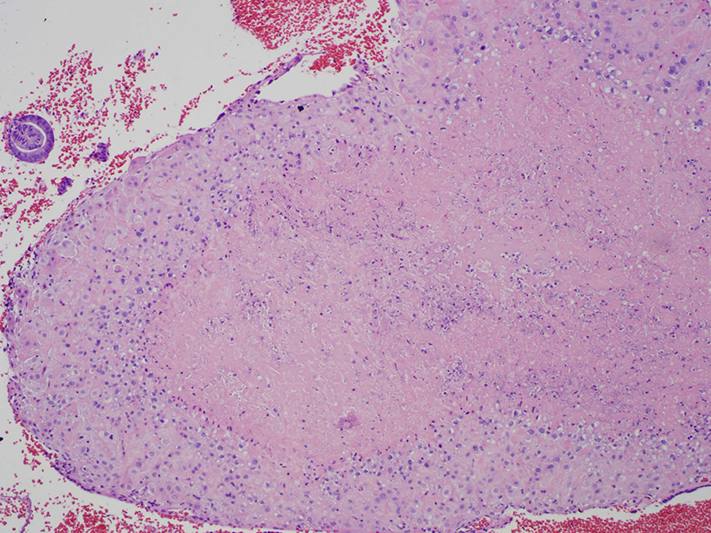
รูปที่ 1 แสดงพยาธิวิทยาของ Placental site nodule (1)
ครรภ์ไข่ปลาอุก (Hydatidiform mole)
ครรภ์ไข่ปลาอุกเป็นโรคของเนื้อรกที่พบบ่อยที่สุด ประมาณร้อยละ 80 ของ GTD เป็นภาวะที่ chorionic villi กลายเป็นถุงน้ำ ลักษณะคล้ายพวงองุ่น และไม่มีเส้นเลือดทารกอยู่ใน villi (ในภาษาลาติน Hydatid แปลว่า ถุงน้ำ ส่วน mole แปลว่า ก้อน)
อุบัติการณ์
อุบัติการณ์โรคของเนื้อรกมีความแตกต่างกันไปตามภูมิภาคต่าง ๆ ของโลก และความหลากหลายในการรวบรวม ข้อมูล โดยอุบัติการณ์ในญี่ปุ่นพบ 2 ราย ต่อการตั้งครรภ์ 1000 ซึ่งมากกว่าอุบัติการณ์ในยุโรป หรืออเมริกาเหนือถึง 3 เท่า คือประมาณ 0.6-1.1 ราย ต่อการตั้งครรภ์ 1000 ส่วนในไตหวันพบ 1:125 หากรวบรวมตามข้อมูลทางพยาธิวิทยา อุบัติการณ์ของ Complete mole ประมาณ 1:1,945 และ Partial mole ประมาณ 1:695 (5)
Complete mole
เป็นการตั้งครรภ์ไข่ปลาอุกที่ไม่มีส่วนของทารก มักมีโครโมโซมเป็น 46,XX โดยโครโมโซมทั้งหมดถ่ายทอดมาจากพ่อ ส่วน DNA ของเซลล์ mitochondria ถ่ายทอดมาจากแม่ Complete mole เกิดจากการปกติสนธิของสเปิร์ม (23,X) กับไข่ที่ว่างเปล่า แล้วแบ่งตัวเป็น 2 ชุด (duplicate) ร้อยละ 3-13 ของ Complete mole มีโครโมโซมเป็น 46,XY เกิดจากการปฏิสนธิของไข่ที่ว่างเปล่ากับสเปิร์ม 2 ตัว (23,X และ 23,Y ) มีปริมาณเล็กน้อยที่ Complete mole แบบ 46,XX เกิดจากไข่ที่ว่างเปล่ากับสเปิร์ม 2 ตัว (23,X และ 23,X) (6)
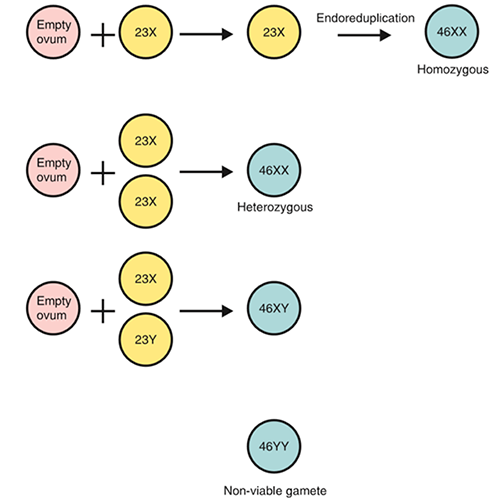
รูปที่ 2 โครโมโซมของ complete mole (5)
Partial mole
เป็นการตั้งครรภ์ไข่ปลาอุกที่มีส่วนของทารกที่ผิดปกติปนอยู่ด้วย โครโมโซมเป็นแบบ polyploid ร้อยละ 90 เป็นแบบ triploid (69,XXX, 69XXY, และส่วนน้อยแบบ 69,XYY) ซึ่งเกิดจากการปฏิสนธิของไข่(ovum) และสเปิร์ม 2 ตัว ส่วนอีกร้อยละ 10 พบโครโมโซมได้หลากหลายรูปแบบ (7) ตัวอ่อนที่พบใน partial mole มีลักษณะผิดปกติของ triploid ตั้งแต่การเจริญเติบโตช้า การผิดรูปของอวัยวะตั้งแต่กำเนิด เช่น นิ้วติดกัน(Syndactyly)และ ภาวะโพรงสมองคั่งน้ำ(Hydrocephaly)
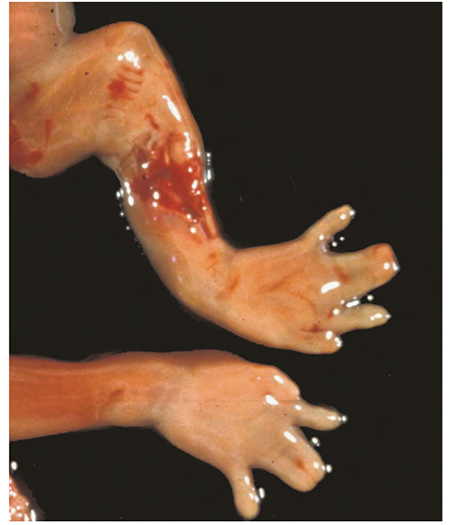
รูปที่ 3 ลักษณะนิ้วติดกัน (syndactyly) ของตัวอ่อนใน partial mole ที่มีโครโมโซมแบบ triploid (5)
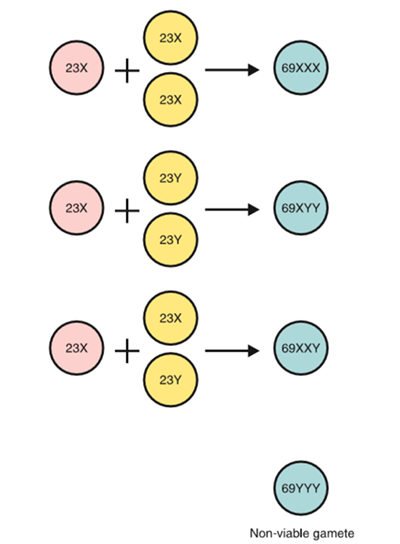
รูปที่ 4 โครโมโซมของ partial mole (5)
ปัจจัยเสี่ยง
- ประวัติครรภ์ไข่ปลาอุก สตรีที่เคยตั้งครรภ์ไข่ปลาอุก 1 ครั้ง เพิ่มความเสี่ยงที่จะตั้งครรภ์ไข่ปลาอุกในครรภ์ถัดไปถึง 10-15 เท่า หรือ ประมาณร้อยละ 1-1.5 (8-10) หากเคยตั้งครรภ์ขาปลาอุก 2 ครั้ง ความเสี่ยงที่จะตั้งครรภ์ไข่ปลาอุกในครรภ์ในครั้งถัดไปร้อยละ 11-25 (11) ซึ่งในครั้งถัดไปอาจจะเป็นครรภ์ไข่ปลาอุกแบบ complete mole หรือ partial mole ก็ได้
- อายุ สตรีที่อายุ <15 และ >35ปี มีโอกาสตั้งครรภ์แบบ complete mole เพิ่มขึ้น จากการศึกษาพบว่าสตรีที่อายุ >35ปี มีความเสี่ยงเพิ่มขึ้น 2 เท่า หากอายุ >40 เสี่ยงเพิ่มขึ้น 7.5 เท่า ประมาณ 1 ใน 3 ของสตรีตั้งครรภ์ที่อายุ >50 ปี พบเป็นครรภ์ไข่ปลาอุก เชื่อว่าในสตรีที่อายุมากขึ้นเพิ่มโอกาสเกิดการปฏิสนธิที่ผิดปกติมากขึ้น ส่วนใน partial mole พบว่าไม่สัมพันธ์กับอายุมารดา (5, 9, 12, 13)
- โภชนาการ ในสตรีที่รับประทานแคโรทีน(vitamin A precursor) และไขมันสัตว์ปริมาณน้อย เพิ่มโอกาสเกิด complete mole (14, 15)
- ประวัติประจำเดือนที่ไม่สม่ำเสมอ เพิ่มโอกาสเกิด partial mole (16)
- ประวัติการใช้ยาคุมกำเนิดแบบรับประทาน เพิ่มโอกาสเกิด partial mole (16)
พยาธิวิทยา
ครรภ์ไข่ปลาอุกจะมีลักษณะเป็นกระจุกของถุงน้ำอยู่รวมกันคล้ายพวงองุ่น ซึ่งถุงน้ำแต่ละอันเกิดจาก chorionic villi เสื่อมสภาพและมีน้ำขังอยู่ภายใน โดยอาจจะอยู่แทนที่เนื้อรกทั้งหมดหรือบางส่วน ขนาดของถุงน้ำมีได้ตั้งแต่ไม่กี่มิลลิเมตร ไปจนถึง 2-3 เซนติเมตร
ตารางที่ 1 แสดงพยาธิวิทยาและลักษณะทั่วไปทางพันธุกรรมของ hydatidiform mole (1, 17)
|
|
Complete mole |
Partial mole |
|
ตัวอ่อน(Fetal or embryonic tissue) |
ไม่มี |
พบ |
|
Hydatidiform swelling of chorionic villi |
กระจายทั่วไป |
อยู่เฉพาะที่ |
|
Trophoblastic hyperplasia |
กระจายทั่วไป |
อยู่เฉพาะที่ |
|
Scalloping ของ chorionic villi |
ไม่มี |
มี |
|
Trophoblastic stromal inclusions |
ไม่มี |
มี |
|
Immunochemistry (P57) |
ตรวจไม่พบ (negative) |
ตรวจพบ (positive) |
|
โครโมโซม |
46XX, 46XY |
69XXY, 69XYY, 69XXX |
|
โอกาสเป็น GTN |
ร้อยละ 15-20 |
ร้อยละ 1-5 |
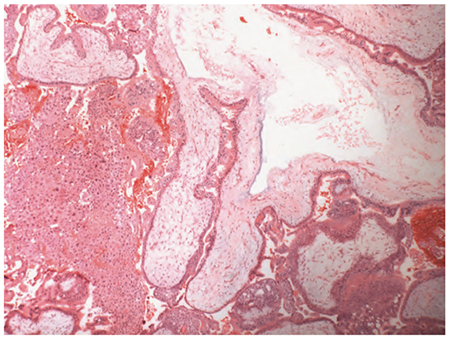
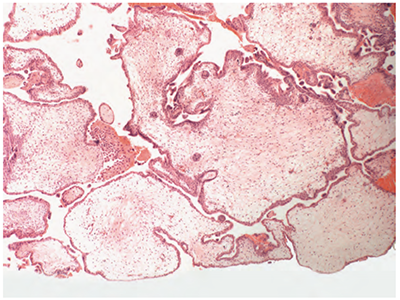
รูปที่ 4 ซ้าย: แสดงการบวมโดยทั่วไปของ villi และล้อมรอบไปด้วย trophoblastic hyperplasia ของ complete mole (5)
ขวา: แสดงถึงความแตกต่างของขนาด villi, trophoblastic inclusions และมี trophoblastic hyperplasia เล็กน้อย ของ partial mole (5)
ลักษณะทางคลินิก (5, 18)
ปัจจุบันสามารถวินิจฉัยครรภ์ไข่ปลาอุกได้เร็วขึ้นตั้งแต่ไตรมาสแรกของการตั้งครรภ์ โดยเฉพาะจากเทคนิคและคุณภาพของเครื่องอัลตราซาวน์ รวมถึงความไวในการตรวจหา hCG ทำให้อาการแสดงของครรภ์ไข่ปลาอุกบางอาการพบน้อยลงมาก อาการแสดงที่พบ ได้แก่
- เลือดออกผิดปกติทางช่องคลอด เป็นอาการที่พบบ่อยที่สุด เกิดจากการแยกตัวของ villi ที่ผิดปกติ ออกจากรก พบประมาณร้อยละ 84 ลักษณะของเลือดคล้ายน้ำลูกพรุน (prune juice)ในกลุ่มที่เป็น complete mole ซึ่งเกิดจากการที่เลือดคั่งอยู่ในโพรงมดลูกและผ่านกระบวนการ oxidation and liquefaction หากปล่อยไว้นานอาจพบว่ามีภาวะซีดร่วมด้วยได้ พบได้ประมาณร้อยละ 5
- ขนาดมดลูกโตมากกว่าอายุครรภ์ พบได้ประมาณร้อยละ 28 เป็นอาการที่ไม่จำเพาะ พบได้หลายโรค เช่น คำนวณอายุครรภ์ผิดพลาด, ครรภ์แฝด และ เนื้องอกมดลูก เป็นต้น มักพบในกลุ่ม complete mole มากกว่า partial mole และมักสัมพันธ์กับระดับ hCG > 100.000 mIU/mL
- อาการแพ้ท้องอย่างรุนแรง พบประมาณร้อยละ 8 อาการคลื่นไว้อาเจียนมักเกิดขึ้นเร็วและรุนแรงกว่าการตั้งครรภ์ปกติ แต่อย่างไรก็ตามก็อาจพบได้ในการตั้งครรภ์ที่ไม่ใช่ครรภ์ไข่ปลาอุก เช่น ครรภ์แฝด
- คอพอกเป็นพิษ พบประมาณร้อยละ 7 ในกลุ่ม complete mole อาการแสดงมักเกิดขึ้นตอนอายุครรภ์มากแล้ว มักพบในรายที่มี hCG >100,000 mIU/mL เป็นเวลาหลายสัปดาห์ อาการแสดงเช่น ใจสั่น(tachycardia) รู้สึกอุณหภูมิที่ผิวหนังสูงขึ้น(warm skin) และมือสั่น(tremor) เป็นต้น ในบางรายอาจมีภาวะ thyroid storm หลังจากได้ยาระงับความรู้สึก เนื่องจากมีการหลั่ง catecholamines จากต่อมหมวกไต ภาวะนี้เชื่อว่าเกิดจาก beta subunit ของ hCG ที่มีความเหมือนกับ TSH ทำให้มีฤทธิ์กระตุ้นไทรอยด์
- ครรภ์เป็นพิษ (Preeclampsia) ภาวะนี้หากเกิดจากครรภ์ไข่ปลาอุกมักพบที่อายุครรภ์น้อยกว่า 20 สัปดาห์ พบได้ประมาณร้อยละ 1-3.5
- ถุงน้ำรังไข่ (Theca lutein ovarian cyst) พบได้ประมาณครึ่งหนึ่งของกลุ่ม complete mole พบถุงน้ำรังไข่ขนาดมากกว่า 6 cm ทั่วไปพบ 6-12 cm ลักษณะเป็น multiloculated และเป็นทั้งสองข้าง พบในรายที่ hCG สูงๆ มักหายได้เองใน 2-4 เดือน
- พบเม็ด mole หลุดออกมาจากช่องคลอด มักพบในรายที่มดลูกโตขึ้นเร็วมาก ๆ ปัจจุบันพบน้อยมากจากการวินิจฉัยโรคได้เร็วขึ้น
- Trophoblastic Embolism พบได้น้อยมาก พบในรายที่มดลูกขนาดใหญ่ ร่วมกับมี hCG ที่สูงมากๆ มีอาการเจ็บแน่นหน้าอก หายใจหอบเหนื่อย หายใจเร็ว จนกระทั่งระบบหายใจล้มเหลว ขณะหัตถการ หรือภายใน 4 ชั่วโมงหลังทำหัตถการ หากออกซิเจนทางท่อช่วยหายใจร่วมกับใช่เครื่องช่วยหายใจ ภาวะระบบหายใจล้มเหลวมักหายเองใน 72 ชั่วโมง
ในกลุ่ม partial mole มักไม่มีอาการแสดงที่รุนแรง อาจมีเพียงภาวะแท้งไม่ครบ หรือแท้งค้าง แล้ววินิจฉัย partial moleจากผลทางพยาธิวิทยา
การวินิจฉัย
นอกจากอาศัยประวัติและการตรวจร่างกายข้างต้นแล้ว ยังมีการตรวจเพิ่มเติมที่ช่วยในการวินิจฉัยครรภ์ไข่ปลาอุก เช่น
1. การตรวจด้วยคลื่นความถี่สูง (อัลตราซาวน์) หากสงสัยครรภ์ไข่ปลาอุก การตรวจอัลตราซาวน์เป็นอีกวิธีที่ทำได้ง่ายและแม่นยำ โดยเฉพาะในกลุ่ม complete mole (18)
a. ลักษณะภาพอัลตราซาวน์ที่พบใน complete mole
- พบลักษณะคล้ายถุงน้ำปริมาณมากกระจายอยู่ในโพรงมดลูก (numerous discrete anechoic spaces; Snowstorm pattern)
- ไม่มีส่วนของตัวอ่อนหรือทารก
- ไม่มีน้ำคร่ำ
- อาจพบถุงน้ำรังไข่ทั้ง 2 ข้าง (Ovarian theca lutein cysts)
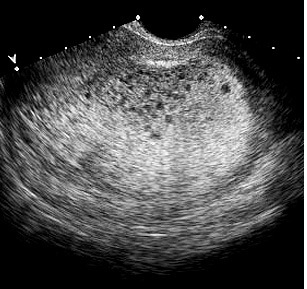
รูปที่ 5 แสดงลักษณะ snowstorm pattern ใน complete mole (18)
b. ลักษณะภาพอัลตราซาวน์ที่พบใน partial mole
- ในโพรงมดลูกเห็นความผิดปกติของรก เป็น Swiss cheese pattern เห็นเป็น cystic space สลับกับการเพิ่มขึ้นของ echogenicity of chorionic villi
- อาจพบส่วนของตัวอ่อน หรือทารก ซึ่งมักมีความผิดปกติร่วมด้วย
- มีน้ำคร่ำ แต่มักมีปริมาณน้อย
- มีอัตราส่วนของความยาวของถุงการตั้งครรภ์ ด้าน transverse ต่อ anteroposterior >1.5
- มักไม่พบถุงน้ำรังไข่ Theca lutein cysts
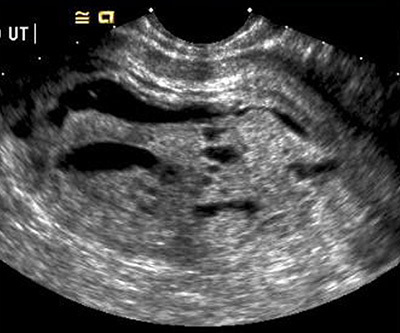
รูปที่ 6 แสดงลักษณะ swiss cheese pattern ใน partial mole (18)
2. การตรวจระดับ hCG ในครรภ์ไข่ปลาอุกมีปริมาณฮอร์โมน hCG มากกว่าการตั้งครรภ์ในโพรงมดลูกปกติหรือการตั้งครรภ์นอกมดลูกในอายุครรภ์ที่เท่ากัน โดยเฉพาะหากผล hCG >100,000 mIU/mL ควรทำอัลตราซาวน์เพื่อดูว่ามีลักษณะของครรภ์ปลาอุก หากผลอัลตราซาวน์ปกติ ควรตรวจซ้ำใน 1 สัปหาด์เพื่อแยกภาวะครรภ์แฝด หรือ การตั้งครรภ์ที่มี molar แฝงอยู่
3. การตรวจทางพยาธิวิทยา เป็นการตรวจมาตรฐานในการวินิจฉัยครรภ์ไข่ปลาอุก
แนวทางการรักษา (5, 19)
ประกอบด้วย 3 ขั้นตอน คือ
1. การประเมินผู้ป่วย
หลังวินิจฉัยควรประเมินอาการที่เป็นภาวะแทรกซ้อนของครรภ์ไข่ปลาอุก เช่น ภาวะครรภ์เป็นพิษ ภาวะคอพอกเป็นพิษ ระดับเกลือแร่ในกระแสเลือดผิดปกติ ภาวะซีด ดังนั้นสิ่งที่ควรตรวจประเมิน ได้แก่
- การซักระวัติและตรวจร่างกาย
- การตรวจทางห้องปฏิบัติการ เช่น การตรวจนับเม็ดเลือด การตรวจปัสสาวะ และตรวจระดับเกลือแร่ในกระแสเลือด
- การตรวจการทำงานของตับและไต
- การตรวจระดับ hCG
- การตรวจภาพรังสีทรวงอก
- การตรวจอัลตราซาวน์อุ้งเชิงกราน
2. การยุติการตั้งครรภ์
หลังจากตรวจประเมินผู้ป่วย และแก้ไขภาวะแทรกซ้อนแล้ว จึงพิจารณายุติการตั้งครรภ์ที่เหมาะสม ซึ่งมี 2 วิธี ได้แก่
- Suction curettage เป็นวิธีที่นิยมมากที่สุด โดยเฉพาะในรายที่ยังต้องการมีบุตร อีกทั้งยังไม่ต้องคำนึงถึงขนาดของมดลูก หากมดลูกขนาดมากกว่า 16 สัปดาห์ ควรเตรียมเลือดไว้ด้วย และเนื่องจาก trophoblast cell มี RhD factor ดังนั้นผู้ป่วยที่มีหมู่เลือด Rh ลบ ควรได้รับ Rh immune globulin
Suction curettage โดยมีขั้นตอน ดังนี้- Oxytocin infusion ควรให้ก่อนให้ยาระงับความรู้สึก และให้ต่อหลังทำหัตถการ
- Cervical dilatation ถ่างขยายปากมดลูก จนกว้างเพียงพอที่จะใส่ท่อดูดสุญญากาศ (cannula) ขนาดที่แนะนำ 12-14 mm มักมีเลือดที่ค้างในโพรงมดลูกออกมาในขั้นตอนนี้
- Suction curettage เป็นขั้นตอนการดูดเนื้อ mole ออกจากโพรงมดลูก หากเป็นไปได้แนะนำให้อัลตราซาวน์ดูตำแหน่งไปพร้อมๆกับการดูดชิ้นเนื้อ มดลูกจะลดขนาดลงอย่างรวดเร็ว และเลือดมักจะหยุดได้เองหลังดูดชื้อเนื้อครบ ควรสอดท่อดูดให้ปลายโผล่พ้น internal os เข้าไปเล็กน้อย ไม่ ควรใส่ลึกกว่านี้เพราะเมื่อดูด mole จนมดลูกลดขนาดลงปลายท่ออาจทำให้มดลูกทะลุได้ หากขนาดของมดลูกโตกว่า 14 สัปดาห์ ควรใช้อีกมือหนึ่งช่วยคลึง นวดบริเวณยอดมดลูก (Hansen maneuver) เพื่อกระตุ้นให้มดลูกหดรัดตัวและลดความเสี่ยงต่อมดลูกทะลุ
- Sharp curettage เมื่อคิดว่าดูดเนื้อ mole ออกหมดแล้วจึงขูดมดลูกเบาๆ เพื่อเอาเนื้อ mole ที่อาจจะตกค้างอยู่ออก
- การตัดมดลูกออก (Hysterectomy) พิจารณาทำในกรณีที่อายุมากกว่า 40 ปี หรือผู้ป่วยไม่ต้องการมีบุตรแล้วหรือ มีอาการตกเลือดรุนแรงจากมดลูกทะลุ โดยทำผ่าตัดเอามดลูกรวมทั้งเนื้อ mole ออก (mole in situ) ควรเก็บรังไข่ไว้แม้ว่าจะมี theca lutein cysts ถ้าหากถุงน้ำรังไข่ใหญ่มากอาจเจาะดูดเอาน้ำออก การตัดมดลูกออกไม่ได้ป้องกันการแพร่กระจายของโรค ดังนั้นยังต้องติดตามการรักษาและตรวจระดับ ฮอร์โมน hCG
3. การติดตามการรักษา
a. นัดติดตามอาการ
- ตรวจภายในทุก 2 สัปดาห์ เพื่อประเมินการลดลงของขนาดมดลูก และ ประเมินถุงน้ำรังไข่ที่ควรยุบลงไปเอง(หากมี)
- ระดับฮอร์โมน hCG
- ตรวจทุก 1 สัปดาห์ จนกว่าจะเข้าสู้ระดับปกติ (<5 IU) ติดต่อกัน 3 สัปดาห์
- จากนั้นตรวจทุก 1 เดือน ติดต่อกัน 6 เดือน
- ซึ่งโดยปกติแล้วระดับ hCG จะลดลงมาอยู่ในระดับปกติ ใช้เวลาประมาณ 9 สัปดาห์
- แต่หากระกับ hCG เพิ่มขึ้นมากกว่าร้อยละ 10 เป็นเวลา 2 สัปดาห์ (Increasing hCG levels)
- หรือ ลดลงน้อยกว่าร้อยละ 10 เป็นเวลา 3 สัปดาห์ (Plateaued hCG levels) จะถูกวินิจฉัยว่าเป็น Persistent GTD หรือ Postmolar GTN
b. การแนะนำคุมกำเนิด
- ควรคุมกำเนิดตลอดช่วงที่ยังต้องติดตามระดับ hCG
- ทางเลือกในการคุมกำเนิด
- ยาเม็ดคุมกำเนิด
- ถุงยางอนามัย
- ไม่ควรใส่ห่วงอนามัย เนื่องจาดเพิ่มโอกาสเกิดมดลูกทะลุ และติดเชื้อในโพรงมดลูก
c. การแนะนำการปฏิบัติตัวในครรภ์ถัดไป
- ควรฝากครรภ์ตั้งแต่ช่วงต้นของการตั้งครรภ์
- ควรได้รับการอัลตราซาวน์ทางช่องคลอดในไตรมาสแรกของการตั้งครรภ์ เพื่อยืนยันว่าเป็นการตั้งครรภ์ที่ปกติ
- หากครรภ์ถัดไปแท้งหรือคลอด ควรส่งนำรก หรือชิ้นส่วนของตัวอ่อน ส่งตรวจทางพยาธิวิทยา
- ตรวจวัดระกับ hCG หลังคลอด 6 สัปดาห์
มะเร็งครรภ์ไข่ปลาอุก (Gestational trophoblastic neoplasia, GTN)
GTN เป็นกลุ่มโรคมะเร็งที่เกิดจากการเจริญแบ่งตัวผิดปกติของเซลล์เนื้อรก (trophoblast) ซึ่งแบ่งตามลักษณะทางพยาธิวิทยา ออกเป็น 4 ชนิด ได้แก่ Invasive mole, choriocarcinoma, placental site trophoblastic tumor(PSTT), epithelioid trophoblastic tumor(ETT)
อุบัติการณ์
- ร้อยละ 50 ของ GTN เกิดหลังการตั้งครรภ์ไข่ปลาอุก
- ร้อยละ 25 เกิดตามหลังการแท้งบุตร หรือการตั้งครรภ์นอกมดลูก
- ร้อยละ 25 เกิดตามหลังกาตั้งครรภ์คลอดครบกำหนดและคลอดก่อนกำหนด
- GTN ที่เกิดตามหลัง complete mole มีร้อยละ 15 ที่ลุกลามเฉพาะที่ และ ร้อยละ 5 ที่ลุกลามแบบแพร่กระจาย
- GTN ที่เกิดตามหลัง partial mole พบได้ร้อยละ 1-4 มักเป็นชนิดที่ไม่แพร่กระจาย
- GTNที่เกิดตามหลังการตั้งครรภ์กลุ่ม nonmolar มักพบเป็นชนิด Choriocarcinoma
- พบ 5-200 รายต่อการตั้งครรภ์ 100,000 ราย ในเอเชียตะวันออกเฉียงใต้ และญี่ปุ่น
- พบ 2-7 รายต่อการตั้งครรภ์ 100,000 ราย ในยุโรป และอเมริกาเหนือ
ปัจจัยเสี่ยง
- มีประวัติการตั้งครรภ์ไข่ปลาอุก
- อายุมากกว่า 40 ปี
- เชื้อสายอาเซียน และอินเดียนอเมริกัน
Invasive mole
- เกิดตามหลังการตั้งครรภ์ไข่ปลาอุก
- เกิดจากมีการบวมของ chorionic villi และการแบ่งตัวจำนวนมากของ trophoblast ลุกล้ำเข้าชั้นกล้ามเนื้อมดลูก (myometrium)
- การวินิจฉัย Postmolar GTN ขึ้นกับระดับ hCG มากกว่าพยาธิวิทยา ดังนั้นสามารถเริ่มการรักษาด้วยยาเคมีบำบัดได้โดยไม่จำเป็นต้องรอผลทางพยาธิวิทยา
- แพร่กระจายผ่านทางกระแสเลือด มักไปที่ปอด และช่องคลอด
Choriocarcinoma (CCA)
- พบลักษณะทางพยาธิวิทยาเป็น Anaplastic trophoblastic tissue, Cytotrophoblasts และ syncytiotrophoblasts โดยไม่มี villi
- พบเยอะที่สุดใน GTN ที่เกิดตามหลังการตั้งครรภ์แบบ nonmolar
- เป็นชนิดที่การลุกลามและแพร่กระจายอย่างกว้างขาง มักกระจายไปที่ปอด ปีกมดลูก ช่องคลอด ตับ ไต ลำไส้เล็ก
Placental-site trophoblastic tumor (PSTT)
- เป็นชนิดที่พบน้อยมาก มักเกิดตามหลังการตั้งครรภ์แบบ nonmolar
- เกิดจากการเจริญแบ่งตัวอย่างมากของ mononuclear intermediate trophoblast cells ร่วมกับ oval nuclei และมี eosinophilic cytoplasm จำนวนมาก ไม่มี chorionic villi
- ลักษณะรอยโรคเป็นก้อนสีขาว น้ำตาลอ่อน ไปจนสีเหลือง (white-tan to yellow) ขนาดตั้งแต่ 1 ถึง 10 cm (เฉลี่ย 5 cm) ประมาณร้อยละ 50 ก้อนเบียดลึกลงไปถึงชั้นกล้ามเนื้อมดลูก (myometrium)
- แพร่กระจายผ่านทางระบบต่อมน้ำเหลือง ไม่สัมพันธ์กับ vascular invasion, necrosis หรือ hemorrhage
- เนื้องอกชนิดนี้สร้าง hCG ปริมาณน้อย ทำให้ตรวจพบได้ช้าและมักพบก้อนขนาดใหญ่ โดยพบว่าส่วนใหญ่จะมีเนื้องอกอยู่ที่มดลูก โดยมีการแพร่ กระจายประมาณ 30%
- มักไม่ค่อยตอบสนองต่อยาเคมีบำบัด
Epithelioid trophoblastic tumor (ETT)
- ETT เป็นอีกภาวะหนึ่งของ PSTT ที่พบได้ไม่บ่อย เจริญมากจาก neoplastic transformation ของ chorionic-type intermediate trophoblast อยู่รวมกับ eosinophilic cytoplasm , clear cytoplasm และ round nuclei ล้อมรอบไปด้วย extensive necrosis และ hyaline-like matrix
- รอยโรคมีสีขาว น้ำตาลอ่อน ไปจนสีน้ำตาล (white-tan to brown) ลักษณะเป็นก้อน หรือถุงน้ำที่มีเลือดออกอยู่ภายในกดเบียดเนื้อเยื้อรอบ ๆ
- ประมาณร้อยละ 50 พบรอยโรคที่ปาดมดลูก หรือ มดลูกส่วนล่าง และมีบางส่วนพบที่ fundus และ broad ligment
- ETT มีลักษณะคล้ายกับ PSTT คืออาจเกิดตามหลัง การคลอดครบกำหนดหลายปีได้
- ร้อยละ 50 ของ ETT มาด้วยอาการของการแพร่กระจายของโรค
ลักษณะทางคลินิก (5)
อาการในกลุ่มที่ไม่มีการแพร่กระจาย (Nonmetastatic Disease) ที่พบบ่อยได้แก่
- เลือดออกผิดปกติทางช่องคลอด
- ถุงน้ำรังไข่ Theca lutein cyst
- มดลูกยังคงมีขนาดใหญ่ (subinvolution) หรือ มดลูกขนาดใหญ่แบบไม่สมมาตร (asymmetric enlargement)
- ฮอร์โมน hCG ยังอยู่ในระดับสูง
- นอกจากนี้ trophoblast tumor อาจจะลุกลามทะลุชั้นกล้ามเนื้อมดลูก ทำให้เลือดออกในชั้น intraperitoneal หรืออาจลุกลามทะลุ uterine vessels ทำให้มีเลือดออกทางช่องคลอดได้
- ก้อนเนื้อที่มีขนาดใหญ่ที่อยู่ในมดลูก หากติดเชื้อแทรกซ้อนอาจทำให้มี ตกขาวผิดปกติทางช่องคลอด หรือปวดท้องน้อยเฉียบพลันได้
อาการในกลุ่มที่มีการแพร่กระจาย (Metastatic Disease)
- Lungs metastasis (80%) มาด้วยอาการเจ็บหน้าอก ไอ ไอเป็นเลือด หายใจลำบาก เหนื่อย หรือไม่มีอาการตรวจพบพยาธิสภาพในปอดจากการตรวจรังสีทรวงอก ได้แก่ alveolar pattern หรือ snowstorm pattern, discrete rounded densities, pleural effusion, embolic pattern(จาก pulmonary arterial occlusion) เป็นต้น
- Vaginal metastasis (30%) อาจพบแพร่กระจายมาที่ fornices และ suburethral มาด้วยอาการเลือดออกผิดปกติหรือมีหนองไหลออกทางช่องคลอด รอยโรคมักมีเลือดมาเลี้ยงปริมาณมาก มักมีเลือดออกมากหากตัดชิ้นเนื้อบริเวณรอยโรค
- Liver metastasis (10%) มักพบในรายที่มะเร็งลุกลามมากแล้ว การพยากรณ์โรคไม่ดี อาจมาด้วยอาการเจ็บบริเวณลิ้นปี่ หรือใต้ชายโครงขวา จากก้อนมะเร็งยืดขยายเยื่อหุ้มตับ รอยโรคที่ตับอาจทำให้ตับแตก เสียเลือกมากในช่องท้องได้
- Brain metastasis (10%) มักพบในกรณีมะเร็งลุกลามมากแล้ว รอยโรคที่สมองทำให้เกิดความบกพร่องทางระบบประสาทเฉพาะที่เฉียบพลันได้ มักพบว่ามีการแพร่กระจายไปที่ปอดหรือช่องคลอดร่วมด้วย
การแบ่งระยะของโรค (20)
ตารางที่ 2 FIGO ANATOMICAL STAGING OF GTN
|
Prognostic factors |
0 |
1 |
2 |
4 |
|
Age |
<40 |
≥40 |
||
|
Antecedent pregnancy |
Mole |
Abortion |
Term |
|
|
Interval from index pregnancy, months |
<4 |
4-6 |
7-12 |
>12 |
|
Pretreatment hCG mIU/mL |
< |
> – |
> – |
|
|
Largest tumor size including uterus, cm |
<3 |
3-4 |
5 |
|
|
Site of metastases including uterus |
Lung |
Spleen,kidney |
Gastrointestinal tract |
Brain, liver |
|
Number of metastases identified |
0 |
1-4 |
5-8 |
>8 |
|
Previous failed chemotherapy |
– |
– |
Single drug |
Two or more drug |
การรักษา (20)
การรักษา GTN แบ่งกลุ่มตาม WHO risk score
- WHO scores < 7 ถือเป็นกลุ่มที่มีความเสี่ยงต่ำ (low risk)
- WHO scores “≥” 7 ถือเป็นผู้ที่มีความเสี่ยงสูง (high risk)
- WHO scores “≥” 13 ถือเป็นผู้ที่มีความเสี่ยงสูงมาก (Ultra high risk)
Low-risk metastatic GTN
- เริ่มต้นรักษาด้วย single-agent chemotherapy (methotrexate หรือ actinomycin D)
- ล่าสุดเชื่อว่า actinomycin D เหนือกว่าการใช้ methotrexate
- จะพิจารณาใช้ multiple agent เมื่อ
- ระดับ hCG สูงมาก ๆ
- มีการแพร่กระจาย
- ดื้อต่อการใช้ single agent
- อาจพิจารณาในกลุ่มที่มี WHO score 5-6
- เมื่อระดับ hCG เข้าสู่ระดับปกติ ให้ยาต่ออีก 2-3 cycles (consolidation phase) เพื่อลดการกลับเป็นซ้ำ
High-risk metastatic GTN
- เริ่มต้นรักษาด้วย Multiple-agent chemotherapy (EMA-CO ; etoposide, methotrexate, actinomycin D, cyclophosphamide, vincristine)
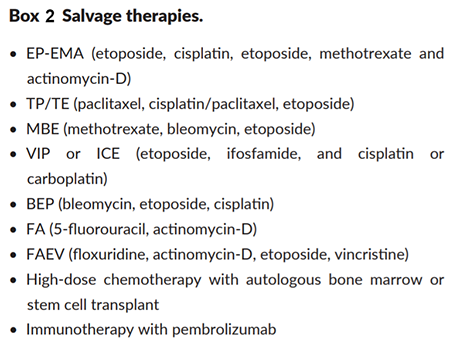
- มีร้อยละ 20 ที่ล้มเหลวในการใช้ยากลุ่ม EMA-CO แต่ก็สามารถใช้ยา Salvage therapies ซึ่งมีอัตราการรอดชีวิตเป็นร้อยละ 95
Ultra-high-risk metastatic GTN
- การเริ่มต้นด้วยยาเคมีบำบัดสูตรพื้นฐานอาจทำให้เนื้องอกโดนทำลายอย่างรวดเร็ว ทำให้มีภาวะเลือดออกมาก เลือดเป็นกรด กดการทำงานของไขกระดูก ติดเชื้อในกระแสเลือด การทำงานของอวัยวะล้มเหลวหลายระบบ เป็นเหตุให้เพิ่มอัตราการเสียชีวิต
- เพื่อหลีกเลี่ยงภาวะดังกล่าว แนะนำให้ Induction ด้วย etoposide 100 mg/m2 และ cisplatin 20 mg/ m2 ในวันที่ 1 และ 2 และให้ซ้ำทุกสัปดาห์ 1-3 สัปดาห์ จากนั้นค่อยเริ่มยาเคมีบำบัดสูตรปกติ
- ในรายที่มีการแพร่กระจายไปที่ตับ และ/หรือ แพร่กระจายไปที่สมอง หรือ very high-risk score แนะนำให้เริ่มด้วยสูตร EP/EMA ร่วมกับเพิ่ม consolidation phase เป็น 4 cycles
- ในกรณีที่มีการแพร่กระจายไปที่สมอง เพิ่ม methotrexate เป็น 1 g/m2 เพื่อช่วยให้ยาผ่าน blood–brain barrier
Role of surgery
- พิจารณาตัดมดลูกในรายที่มีเลือดออกมาก
- อาจจำเป็นในการผ่าตัดเปิดช่องท้องเพื่อหยุดเลือด
- เพื่อตัดเนื้องอกเพื่อเพิ่มการตอบสนองต่อยาเคมีบำบัด
Role of radiotherapy
- เพื่อรักษาการแพร่กระจายไปที่สมองในบางราย
PSTT/ETT
- ไม่ค่อยตอบสนองต่อยาเคมีบำบัด
- การตัดมดลูกเป็นทางเลือกหลักในการรักษา
- ในรายที่ต้องการมีบุตร ร่วมกับรอยโรคเฉพาะที่ สามารถเลือกวิธีอื่น เช่น
- การขูดมดลูก (Uterine curettage)
- การผ่าตัดผ่านกล้องโพรงมดลูก (Hysteroscopic resection)
- การรักษาด้วยยาเคมีบำบัด
- เว้นมีบุตรหลังการรักษาอย่างน้อย 48 เดือน
การติดตามการรักษา
- หลังจากรักษา GTN ครบ ควรติดตามระดับ hCG ทุกเดือน อย่างน้อย 12 เดือน เพื่อป้องกันการเป็นซ้ำ
- คุมกำเนิดอย่างมีประสิทธิภาพ
- การรักษา GTN ไม่มีผลต่อความสามารถในการมีบุตรในครรภ์ถัดไป

ตารางที่ 4 EMA-CO Chemotherapy
|
Regimen 1 |
||
|
Day 1 Etoposide |
100 mg/m2 intravenous infusion over 30 min |
|
|
Actinomycin-D |
0.5 mg intravenous bolus |
|
|
Methotrexate |
100 mg/m2 intravenous bolus 200 mg/m2 intravenous infusion over 12 h |
|
|
Day 2 Etoposide |
100 mg/m2 intravenous infusion over 30 min |
|
|
Actinomycin-D |
0.5 mg intravenous bolus |
|
|
Folinic acid rescue |
15 mg intramuscularly or orally every 12 h for four doses (starting 24 h after beginning the methotrexate infusion) |
|
|
Regimen 2 |
||
|
Day 8 Vincristine |
1 mg/m2 intravenous bolus (maximum 2 mg |
|
|
Cyclophosphamide |
600 mg/m2 intravenous infusion over 30 amin |
|
|
The two regimens alternate each week |
||
เอกสารอ้างอิง
- Baergen RN, Dizon DS. Gestational trophoblastic disease: Pathology. UpToDate, Waltham, MA. 2019.
- Kurman RJ, Carcangiu ML, Herrington S, Young RH. WHO classification of tumours of female reproductive organs: IARC; 2014.
- Shih I-m, Seidman JD, Kurman RJ. Placental site nodule and characterization of distinctive types of intermediate trophoblast. Human pathology. 1999;30(6):687-94.
- Shih I-M, Kurman RJ. The pathology of intermediate trophoblastic tumors and tumor-like lesions. International journal of gynecological pathology. 2001;20(1):31-47.
- Berek JS. Berek & Novak’s Gynecology 16th edition: Wolters Kluwer; 2019.
- Jacobs PA, WILSON CM, Sprenkle JA, Rosenshein NB, Migeon BR. Mechanism of Origin of Complete Hydatidiform Moles. Obstetrical & Gynecological Survey. 1981;36(5):271.
- Lage JM, Mark SD, Roberts DJ, Goldstein DP, Bernstein MR, Berkowitz RS. A flow cytometric study of 137 fresh hydropic placentas: correlation between types of hydatidiform moles and nuclear DNA ploidy. Obstetrics and gynecology. 1992;79(3):403-10.
- Bagshawe K, Dent J, Webb J. Hydatidiform mole in England and Wales 1973-83. The Lancet. 1986;328(8508):673-7.
- Sebire N, Foskett M, Fisher R, Rees H, Seckl M, Newlands E. Risk of partial and complete hydatidiform molar pregnancy in relation to maternal age. BJOG: An International Journal of Obstetrics & Gynaecology. 2002;109(1):99-102.
- Vargas R, Barroilhet LM, Esselen K, Diver E, Bernstein M, Goldstein DP, et al. Subsequent pregnancy outcomes after complete and partial molar pregnancy, recurrent molar pregnancy, and gestational trophoblastic neoplasia: an update from the New England Trophoblastic Disease Center. The Journal of reproductive medicine. 2014;59(5-6):188-94.
- Tuncer ZS, Bernstein MR, Wang J, Goldstein DP, Berkowitz RS. Repetitive hydatidiform mole with different male partners. Gynecologic oncology. 1999;75(2):224-6.
- Parazzini F, VECCHIA CL, Pampallona S. Parental age and risk of complete and partial hydatidiform mole. BJOG: An International Journal of Obstetrics & Gynaecology. 1986;93(4):582-5.
- Gockley AA, Melamed A, Joseph NT, Clapp M, Sun SY, Goldstein DP, et al. The effect of adolescence and advanced maternal age on the incidence of complete and partial molar pregnancy. Gynecologic oncology. 2016;140(3):470-3.
- Parazzini F, La Vecchia C, Mangili G, Caminiti C, Negri E, Cecchetti G, et al. Dietary factors and risk of trophoblastic disease. American journal of obstetrics and gynecology. 1988;158(1):93-9.
- Berkowitz RS, Cramer DW, Bernstein MR, Cassells S, Driscoll SG, Goldstein DP. Risk factors for complete molar pregnancy from a case-control study. American journal of obstetrics and gynecology. 1985;152(8):1016-20.
- Berkowitz RS, Bernstein MR, Harlow BL, Rice LW, Lage JM, Goldstein DP, et al. Case-control study of risk factors for partial molar pregnancy. American journal of obstetrics and gynecology. 1995;173(3):788-94.
- BERKOWITZ RS. The management of molar pregnancy and gestational trophoblastic tumors. Gynecologic oncology. 1993.
- Berkowitz RS, Goldstein DP, Horowitz NS. Hydatidiform Mole: Epidemiology, clinical features, diagnosis. UpToDate Waltham, MA, UpToDate. 2019.
- Berkowitz RS, Goldstein DP, Horowitz NS, Vora SR. Hydatidiform mole: Treatment and follow-up.
- Ngan HY, Seckl MJ, Berkowitz RS, Xiang Y, Golfier F, Sekharan PK, et al. Update on the diagnosis and management of gestational trophoblastic disease. International Journal of Gynecology & Obstetrics. 2018;143:79-85.


