การทำหมันหญิง (Female sterilization)
การทำหมันหญิง (Female sterilization)
นพ.ปกรณ์ จักษุวัชร
รศ.พญ.สุปรียา วงศ์ตระหง่าน
การทำหมันหญิง คือเป็นการคุมกำเนิดแบบถาวร โดยการทำให้ท่อนำไข่อุดตัน เพื่อป้องกันไม่ให้อสุจิเดินทางมาผสมกับไข่โดยมีหลากหลายเทคนิค เช่น การผูก รัด หนีบ หรือทำลาย ส่วนใดส่วนหนึ่งของท่อทำไข่ ซึ่งการทำหมันหญิงนี้ถือเป็นวิธีคุมกำเนิดที่นิยมวิธีหนึ่งในรายที่ต้องการคุมกำเนิดแบบถาวร
ช่วงเวลาที่ทำหมัน( Timing)
Post-partum sterilization เป็นการทำหมันหลังคลอด ถือเป็นช่วงเวลาการทำหมันหญิงที่ทำมากที่สุด โดยสามารถทำได้พร้อมกับการผ่าตัดคลอด หรือทำภายหลังไม่กี่วันจากคลอดทางช่องคลอด โดยทั่วไปแนะนำให้ทำภายใน 12-24 ชั่วโมงหลังคลอด(1) การทำมักนิยมทำเป็น mini-laparotomy เป็นส่วนใหญ่
Interval sterilization คือการทำหมัน ณ เวลาใดเวลาหนึ่งที่ไม่เกี่ยวข้องกับการตั้งครรภ์ (หลังคลอดไปแล้วมากกว่า 6 สัปดาห์) หรือเรียกว่า “การทำหมันแห้ง” โดยสามารถทำได้หลายช่องทาง เช่นการทำผ่าน laparoscope , การทำแบบ laparotomy หรือการทำผ่าน hysteroscope โดยการเลือกนั้นต้องพิจารณาจากหลายปัจจัย(1) ก่อนทำหัตถการควรสอบถามถึงความเสี่ยงต่อการตั้งครรภ์ เช่นประจำเดือนรอบสุดท้าย การมีเพศสัมพันธ์ และควรส่งตรวจการตั้งครรภ์ด้วย หากสงสัยว่าตั้งครรภ์ควรชะลอการทำหมันออกไปก่อน
Post-abortion sterilization ทำได้หลังจากคลอดหรือขูดมดลูกทันที โดยสามารถเลือกทำได้หลายช่องทั้ง เช่นการทำผ่าน laparoscope , การทำแบบ laparotomy แต่ไม่แนะนำการทำแบบผ่าน hysteroscope หลังจากการแท้งที่น้อยกว่า 6 สัปดาห์
การแนะนำผู้ป่วยก่อนทำหมัน (Pre-operative counseling)
- ผู้หญิงที่จะทำหมันควรได้รับคำปรึกษาก่อนทำหมันทุกราย ถึงความคาดหวัง ข้อดีข้อเสียของการเลือกทำหมันแต่ละวิธี รวมถึงประเมินความแน่ใจที่จะคุมกำเนิดแบบถาวรหรือซักหาปัจจัยที่อาจส่งผลต่อการเปลี่ยนใจหรือการตัดสินใจผิดพลาดภายหลังหลังจากทำหมันไปแล้วด้วย
- ผู้หญิงที่ต้องการทำหมัน ควรทราบว่าการทำหมันไม่สามารถป้องกันการตั้งครรภ์ได้100% ประสิทธิภาพของการทำหมันขึ้นอยู่กับแต่ละวิธิที่ทำ ซึ่งโดยเฉลี่ยพบการตั้งครรภ์หลังจากทำหมันได้ต่ำกว่าร้อยละ 1
- การทำหมันเป็นวิธีคุมกำเนิดแบบถาวร การผ่าตัดแก้หมัน(sterilization reversal) สามารถทำได้แต่ ค่อนข้างมีข้อจำกันและไม่ได้ประสบความสำเร็จในการแก้หมันทุกราย
- อธิบายข้อดีข้อเสียเปรียบเทียบกับการคุมกำเนิดด้วยวิธีอื่นๆ ที่สามารถคุมกำเนิดได้ยาวนานเช่น การทำหมันชาย, การใช้กลุ่ม long acting reversible contraceptive methods (LARC) เช่น การใส่ห่วงคุมกำเนิด,การใช้ยาฝัง เป็นต้น
- ปัจจัยเสี่ยงต่อการเกิดการตั้งครรภ์นอกมดลูก (ectopic pregnancy)
- ความเสี่ยงต่อการผ่าตัดและการให้ยาระงับความรู้สึก
- การทำหมันเป็นการคุมกำเนิดที่ไม่สามารถป้องกันโรคติดต่อทางเพศสัมพันธ์ได้ หากมีเพศสัมพันธ์ที่ปลอดภัย ควรใช้ถุงยางอนามัยร่วมด้วยทุกครั้ง
ความรู้สึกเสียใจภายหรือตัดสันใจผิดหลังจากทำหมัน (Sterilization regret)
หลังจากที่ทำหมันไปแล้ว มีผู้หญิงกลุ่มหนึ่งประมาณร้อยละ2-26 ที่รู้สึกตัดสินใจผิดพลาดต่อการทำหมัน โดยปัจจัยที่ทำให้เกิดที่สำคัญที่สุดคือ ผู้หญิงที่ทำหมันตั้งแต่อายุน้อยๆ แต่ยังไม่มีตัวเลขอายุที่ชัดเจน และผู้หญิงในกลุ่มประเทศที่พัฒนาแล้ว ส่วนปัจจัยอื่นๆที่เกี่ยวข้องเช่น ผู้หญิงผิวสี, สถานะการแต่งงาน, การทำหมันแบบ post-partum sterilization, ระยะห่างของการทำหมันจากลูกคนสุดท้องซึ่งพบได้บ่อยในผู้หญิงที่ทำในช่วงระยะเวลาสั้นกว่า, สิทธิการรักษา โดยพบมากกว่าในผู้หญิงที่ใช้สิทธิการทำหมันฟรี ส่วนปัจจัยที่ไม่เกี่ยวข้อง เช่น post-abortion sterilization, จำนวนบุตร(parity) เมื่อติดตามไป 5 ปี พบว่าจำนวนบุตรหรือการไม่มีบุตร ไม่เป็นปัจจัยต่อการเกิดความรู้สึกเสียใจภายหลังจากการทำหมันหรือการต้องการแก้หมัน (2, 3)
ความล้มเหลวในการทำหมัน (Failure sterilization)
ตารางแสดงอัตราความล้มเหลวของการทำหมันแต่ละวิธี
|
Contraceptive method |
Pregnancies per 1000 precedure |
||
|
1 to 2 years |
3 to 5 years |
7-12 years |
|
| Postpartum sterilization |
|
||
| Postpartion partial salpingectomy |
1.2 |
6.3 |
7.5 |
| Postpartu{TABULIZER-CARET-POSITION-MARK-F6ZX7E39DE6G}m titanium clip |
17 |
– |
– |
| Interval sterilization |
|
||
| Interval partial salpingectomy |
7.3 |
15.1 |
20.1 |
| Interval titanium clip |
4 |
– |
|
| Silicone band |
3 |
10 |
17.7 |
| Electrosurgery |
– |
3.2 |
– |
| Hysteroscope sterilization(Essure) |
– |
2.5 |
– |
(ดัดแปลงจาก Uptodate2015:Overview of female sterilization)
การทำหมันแบบผ่าตัดส่องกล้อง (Laparoscope female sterilization)
การทำหมันด้วยวิธี laparoscope ถือเป็นหัตถการที่ minimal invasive มักลงแผลที่หน้าท้องคล้ายกับการทำlaparoscope ในผู้ป่วยนรีเวชทั่วไป สามารภทำได้ทั้ง การทำหมันหลังคลอด, การทำหมันหลังแท้ง แต่มักได้รับความนิยมมากกว่าใน interval sterilization โดยเฉพาะในประเทศที่เจริญแล้ว โดยมากกมัก ใช้ 2 port คือ umbilical port กับ midline suprapubic port หรือในบางที่ อาจใช้เป็น port เดี่ยว(single port) ภายหลังทำสามารถมีประสิทธิภาพคุมกำเนิดได้ทันที สามารถหยุดวิธีคุมกำเนิดที่ใช้มาก่อนหน้าได้ทันทีภายหลังจากการทำหมัน
เทคนิคการทำให้ท่อนำไข่อุดตัน(Tubal occlusion techniques)
การทำให้ท่อนำไข่อุดตันในการผ่าตัดโดยใช้ laparoscope มีหลายวิธีด้วยกัน เทคนิคที่เลือกใช้มักขึ้นอยู่กับความพร้อมของเครื่องมือ ความถนัดและประสบการณ์ของแพทย์ผู้ผ่าตัดส่งกล้องเป็นหลัก ซึ่งประสิทธภาพในการคุมกำเนิดใกล้เคียงกัน คือ อัตราความล้มเหลวในการคุมกำเนิด น้อยกว่า ร้อยละ 1
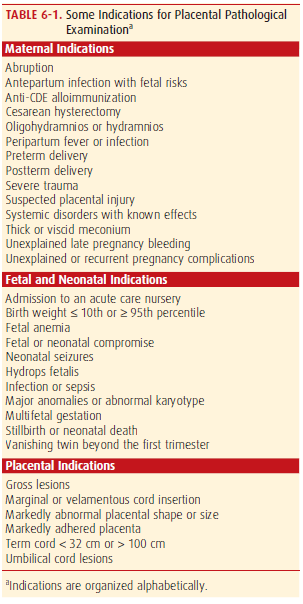
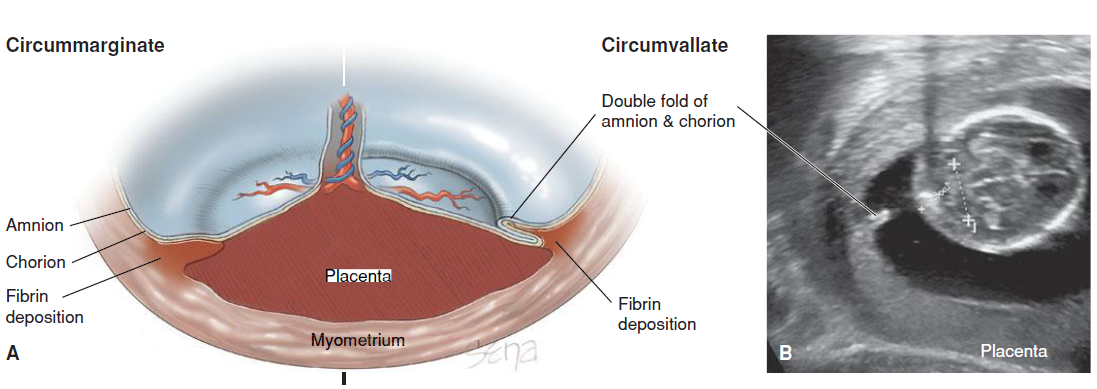
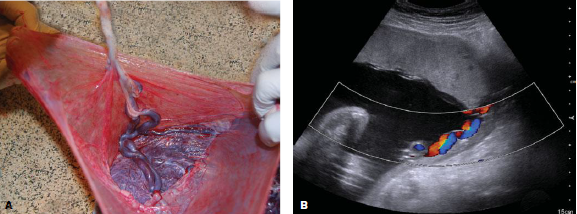
Electrosurgery การใช้จี้ไฟฟ้าทำลายท่อนำไข่ ปกติจะใช้เครื่องมือคือ Kleppinger bipolar electrosurgical grasping forceps จับ tubeไว้ ขั้นตอนการทำควรแน่ใจว่าสามารถจับท่อนำไข่ครอบคลุมตลอดความหนาของท่อนำไข่ และทำลายท่อนำไข่ได้อย่างสมบูรณ์ โดยใช้จี้ทำลายตลอดความยาวท่อนำไข่ส่วน mid-isthmus อย่างน้อย 3 เซนติเมตรซึ่งพบว่าอัตราการตั้งครรภ์ต่ำลงอยู่ที่ประมาณร้อยละ 0.32 เมื่อเทียบกับการจี้ท่อนำไข่สั้นกว่า3เซนติเมตรพบว่าอัตราการตั้งครรภ์สูงถึงร้อยละ 1.29(4)
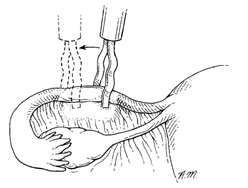
รูปที่ 1 การใช้จี้ไฟฟ้าทำลายท่อนำไข่
Mechanical methods
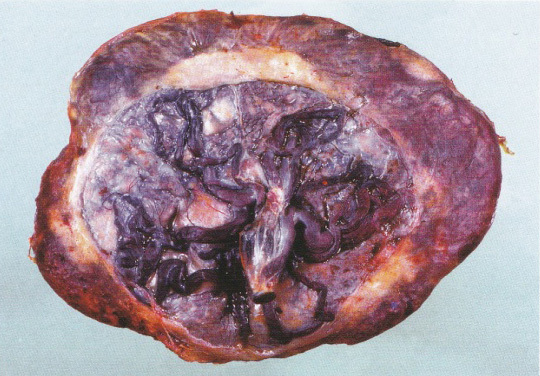
Silicone band เป็น non-reactive silicone rubber ร่วมกับมี 5% barium sulfate เพื่อทำให้เกิดการถ่ายติดภาพรังสี การทำจะใช้เครื่องมือที่จำเพาะในการจับท่อนำไข่และรัด Silicone band เข้าไปบริเวณ mid-isthmusโดยที่ให้ loopของท่อนำไข่ยาวประมาณ 1.5 -2 เซนติเมตร
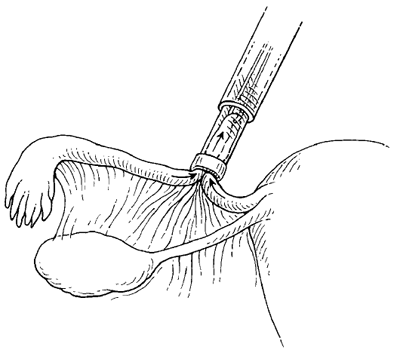
รูปที่ 2 การใช้ silicone band รัดท่อนำไข่
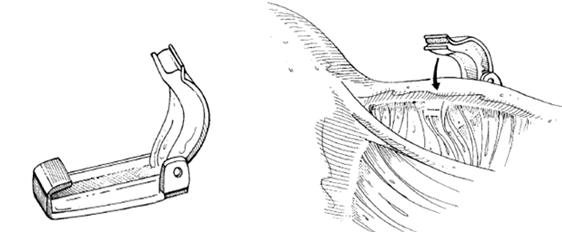
รูปที่ 3 การใช้ titanium clip หนีบท่อนำไข่
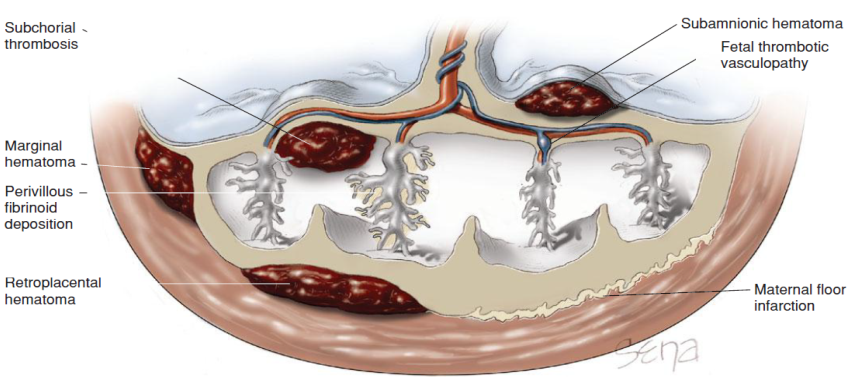
Titanium clip (Filshic clip) และ Spring clip (Lulka clip) การใช้ Titanium clip มีประสิทธิภาพที่ดีกว่า โดยพบอัตราการตั้งครรภ์น้อยกว่า คือร้อยละ 0.97 เทียบกับการใช้ Spring clip ซึ่งพบอัตราการตั้งครรภ์สูงถึงร้อยละ 2.81 (5)
ภาวะแทรกซ้องจากการผ่าตัด Laparoscope sterilization (Complication of Laparoscope sterilization)
โดยทั่วไปภาวะแทรกซ้อนที่เกิดขึ้นมักเป็นภาวะแทรกซ้อนโดยทั่วไปเช่นเดียวกับการผ่าตัด laparoscope โดยพบประมาณ ร้อยละ 0.9 เช่น iatrogenic complication (hematoma, hemorrhage, accidental punctions/laceration)เกิดร้อยละ0.4 , major medical complication(acute myocardial infarction, stroke, pulmonary embolism, perioperatiev shock และrespiratory complication)เกิดขึ้นร้อยละ 0.1 และไม่มีรายงานการเสียชีวิตจากการทำ Laparoscope sterilization(6, 7)
Hysteroscopic sterilization
การทำหมันผ่านการทำhysteroscope เป็นวิธีการทำหมันที่ invasive น้อยที่สุด สามารถทำแบบผู้ป่วยนอกได้ไม่จำเป็นต้องนอนโรงพยาบาลโดยสามารถทำได้หลายวิธีเช่น การใช้ corrosive agents, Mechanical obstruction devices, Destruction using thermal energy
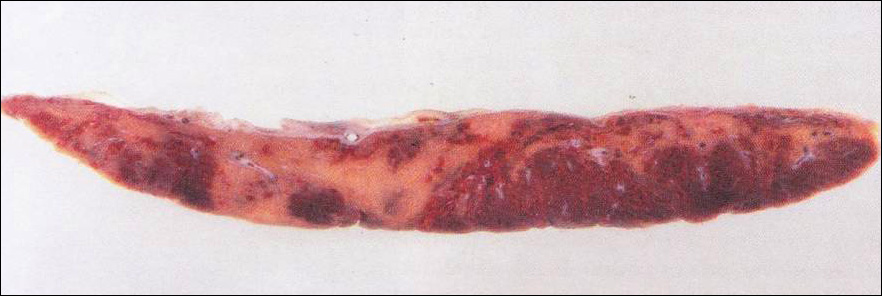
ปัจจุบันวิธีที่ใช้กันมากที่สุดคือการใช้ Mechanical obstruction devices เรียกว่า micro-insert หรือ Essure ลักษณะเป็นแท่งเกลียว แกนในทำจาก stainless steel และpolyethylene terephthalate(PET) แกนนอกทำด้วย nickel –titanium(nitinol)
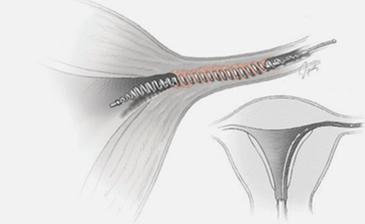
รูปที่ 4 แสดงตำแหน่งการใส่ และการเกิดพังผืดรอบ Essure
การใส่เครื่องมือจะถูกใส่ผ่านทาง hysteroscope guidance เข้าไปบริเวณท่อนำไข่ส่วนต้น(proximal fallopian tube) หลังจากใส่ PET fiber จะเป็นตัวกระตุ้นให้เกิด tissue growthรอบๆคลุมเครื่องมือไว้ ทำให้เกิดการอุดตันของท่อนำไข่
ประสิทธิภาพในการคุมกำเนิดด้วยการใส่Essure พบว่าใกล้เคียงกับการทำหมันด้วยวิธีอื่นๆ โดยพบอัตราการตั้งครรภ์เกิดขึ้นหลังจากทำหมัน ร้อยละ 0.1 โดยกลุ่มผู้หญิงที่ตั้งครรภ์มักเป็นกลุ่มที่ไม่ได้มาตรวจติดตามเพื่อยืนยันการอุดตันของท่อนำไข่เป็นส่วนใหญ่
ร้อยละ 76 (8, 9)
ข้อบ่งชี้และข้อห้ามในการทำ Hysteroscopic sterilization
ข้อบ่งชี้ คือ ต้องการทำหมันแบบถาวรและเลือกช่องทางการทำผ่าน hystroscope ในบางครั้งอาจทำเพื่อรักษาภาวะมีบุตรยากจากการที่ท่อ นำไข่บวมน้ำ(hydrosalpinx)ในรายที่วางแผนทำเด็กหลอดแก้ว(in vitro fertilization)
ข้อบ่งห้าม
- ยังไม่แน่ใจว่าต้องการคุมกำเนิดแบบถาวรหรือไม่ เนื่องจากไม่สามารถผ่าตัดแก้หมันได้หรือทำได้ยาก
- กำลังตั้งครรภ์ หรือสงสัยว่าตั้งครรภ์
- ระยะหลังคลอดน้อยกว่า 6 สัปดาห์ (post-partum period)
- กำลังหรือพึงหายจากการติดเชื้อในอุ้งเชิงกราน (Active/recent pelvic infection)
- มีพยาธิสภาพที่ท่อนำไข่หรือมดลูก (tubal or uterine pathology) อาจทำให้กีดขวางการมองเห็น tubal ostia
- แพ้ contrast media หรือ แพ้ nickel
ข้อดีและข้อเสียของการใช้ hysteroscope sterilization
ข้อดี
- ไม่มีรอยแผลผ่าตัดที่บริเวณหน้าท้อง
- อาการปวดหลังผ่านตัดน้อยกว่าการทำหมันวิธีอื่น(10, 11)
- สามารถทำได้ในผู้หญิงที่มีประวัติมีพังผืดในอุ้งเชิงกรานมาก ยากต่อการผ่าตัดผ่านหน้าท้อง
- เหมาะสมกับผู้หญิงที่มีโรคร่วมทางอยุรกรรม ที่อาจเสี่ยงสูงกว่าในการทำหมันที่ต้องใช้ยาดมสลบ เพราะไม่จำเป็นต้องใช้ยาดมสลบหรือสามารถใช้เป็น local anesthesia ได้เช่นการทำ paracervical block
- ค่าใช้จ่ายถูกกว่าเมื่อเทียบกับ laparoscope sterilization
ข้อเสีย
- ยังคงต้องใช้วิธีคุมกำเนิดด้วยวิธีอื่นๆต่อหลังจากทำหมันแล้วจนกระทั้งได้รับการยืนยันแล้วว่าท่อนำไข่มีการอุดตันที่สมบูรณ์ สำหรับผู้หญิงที่ใส่ห่วงคุมกำเนิดอยู่ไม่จำเป็นต้องนำออกก่อนทำเพราะไม่รบกวนต่อการทำและไม่ส่งผลต่อการแปลผล hysterosalpinggogram(12)
- ต้องนัดผู้ป่วยกลับมาทำ hysterosalpinggogram หรือ imaging อื่นๆ เพิ่อยืนยันว่าท่อนำไข่มีการอุดตันที่สมบูรณ์
- มีโอกาศที่ท่อนำไข่ข้างใดข้างหนึ่งจะไม่เกิดการอุดตัน ทำให้ต้องคุมกำเนิดด้วยวิธีอื่นหรือต้องกลับมาทำซ้ำครั้งที่สอง
- มีความเสียงต่อการเกิดการทะลุหรือการอยู่ผิดตำแหน่งของเครื่องมือซื่งอาจต้องนำไปสู่การผ่าตัดแก้ไข
- มีความเสี่ยงที่จะกระตุ้นทำให้เกิดอาการปวดอุ้งเชินกรานเรื้อรังหรือทำให้อาการปวดอุ้งเชินกรานที่มีอยู่เป็นมากขึ้น
- หลังทำอาจมีข้อจำกัดในการใช้ electrosurgery ในการทำหัตถการในอุ้งเชินกราน เช่นการทำ endometrial ablation
- หากทำการตรวจ MRI อาจทำให้พบว่าเครื่องมือรบกวนการอ่านภาพได้ ควรแจ้งแพทย์ทุกครั้ง
ช่วงเวลาที่เหมาะสมและการเตรียมเยื่อบุโพร่งมดลูก
ความสำเร็จของการทำหมันโดยใช้ hysteroscope พบว่าปัจจัยที่สำคัญที่สุดคือ สามารถมองเห็น tubal ostiaได้ชัดเจนหรือไม่ ดังนั้นควรทำในช่วงที่เยื่อบุโพรงมดลูกบาง ซึ่งถือเป็นช่วงที่ดีที่สุด อาจเตรียมโดยการให้ยาที่มีส่วนผสมของ progestin ก่อนทำหัตถการเช่น OCP, progesterone only pills หรือ การฉีด DMPA โดยเริ่มให้วันแรกของการมีประจำเดือน และให้ต่อเนื่องไปอย่างน้อย 2 สัปดาห์ ก่อนทำหัตถการซึ่งมีประโยชน์ทั้งในแง่การเตรียมเยื่อบุโพร่งมดลูกให้บาง และคุมกำเนิดก่อนทำหัตถการ สำหรับผู้หญิงที่มีข้อห้ามในการใช้ยาprogestin หรือไม่อยากใช้hormone อาจเลือกช่วงไม่กี่วันหลังมีประจำเดือนหรือช่วง follicular phase ของรอบเดือน
การดูแลหลังทำหมันและการตรวจติดตาม(Post-operative care and Follow up)
หลังทำสามารถดูแลเหมือนการผ่าตัดทั่วไป สามารถให้กลับบ้านได้ ไม่จำเป็นต้องนอนโรงพยาบาล ผู้หญิงหลายคนสามารถกลับไปทำงานประจำได้ภายในไม่กี่วันหลังจากทำหัตถการ ควรแนะนำผู้ป่วยหากมีอาการผิดปกติเช่น มีอาการปวดท้องมากไม่ดีขึ้น เลือดออกผิดปกติ หรือหากมีเครื่องมือหลุดผ่านออกมาทางช่องคลอดให้มาพบแพทย์
การตรวจยืนยันการอุดตันของท่อนำไข่ 12 สัปดาห์หลังจากทำหัตถการ ต้องได้รับการตรวจยืนยันว่าท่อนำไข่อุดตันสมบูรณ์ทั้ง 2 ข้าง โดยวิธีมารตฐานที่ทำคือการตรวจโดยการทำ Hysterosalpingogram(13) อย่างไรก็ตาม การทำ Hysterosalpingogram นั้น ต้องนัดผู้ป่วยกลับมา ใช้เวลาในการตรวจ การตรวจอาจทำให้รู้สึกเขินอาย และต้องเสียค่าใช้จ่าย ผู้เชี่ยวชาญหลายคนเสนอการใช้ทางเลือกอื่นในการตรวจเช่นการทำ ultrasoundทางช่องคลอด(TVUS) หรือการทำ pelvic radiograph โดยในปี 2015 FDA ได้ประกาศยอมรับการใช้ TVUS ในการตรวจสอบการอุดตันของท่อนำไข่ได้ แต่อย่างไรก็ตามการใช้ TVUS ในการตรวจนั้นจำเป็นต้องใช้แพทย์ผู้เชี่ยวชาญที่ได้รับการฝึกฝนและมีใบประกาศสำหรับการใช้TVUSตรวจยืนยันแล้วเท่านั้น
ภาวะแทรกซ้อนจากการทำหัตถการ (complication)
ในปี2015 FDA ได้รวบรวมข้อมูลเรื่องความปลอดภัยและประสิทธิภาพของการใส่ Essure พบผลแทรกซ้อนที่อาจเกี่ยวข้องกับการใส่ Essure ที่เกิดขึ้น(14, 15) เช่น
- ปวดท้อง/อุ้งเชิงกราน สาเหตุยังไม่ทราบแน่ชัด ในผู้หญิงที่ไม่มีประวัติปวดอุ้งเชิงกรานมาก่อนสามารถพบอาการปวดได้ แต่เมื่อตรวจติดตามไปเป็นระยะเวลา 3-5 ปีพบว่าอาการปวดจะดีขึ้นและหายไปในที่สุด ส่วนการใส่ Essureในผู้หญิงที่มีประวัติปวดอุ้งเชิงกรานมาก่อนพบว่าการใส่ Essure เป็นปัจจัยกระตุ้นให้อาการปวดเป็นมากขึ้นถึง 6 เท่า
- ประจำเดือนมาผิดปกติ เมื่อติดตามหลังทำนาน พบว่าจำเดือนมามากขึ้นร้อยละ 37.5 , รอบเดือนมาไม่สม่ำเสมอ ร้อยละ14.8, ประจำเดือนมาน้อยลง ร้อยละ 23.3, มีเลือดออกผิดปกติระหว่างรอบเดือน ร้อยละ 18.8
- การติดเชื้อ พบว่าความเสี่ยงเทียบเท่ากับการทำ hysteroscopeทั่วไป
- ท่อนำไข่หรือมดลูกทะลุ พบอัตราการเกิดได้ร้อยละ 0 – 1.8 ภายหลังเกิดอาจพบว่ามีอาการหรือไม่มีอาการแสดงก็ได้ อาการที่เกิดบ่อย มักมีอาการปวดท้อง/อุ้งเชิงกราน บางครั้งอาจตรวจพบภายหลังจากเนื่องจากการทำ hysterosalpingogram หรือมีการตั้งครรภ์เกิดขึ้น การทะลุอาจทำให้บาดเจ็บต่ออวัยวะข้างเคียงได้เช่น ลำไส้
ปัญหาที่เกิดที่เกี่ยวข้องกับเครื่องมือ เช่น
- Device incompatibility เช่น แพ้ nickel มีรายงานการแพ้ nickel โดยมีอาการผื่นผิวหนังอักเสบ(dermatitis) เกิดขึ้น
- เครื่องมือเคลื่อนหลุดเข้าช่องท้อง(intraperineal migration) คือการเคลื่อนของเครื่องมือผ่านไปที่ปลายท่อนำไข่ โดยตราจพบเครื่องมืออยู่ในช่องท้อง แต่ไม่พบหลักฐานการทะลุ
- เครื่องมือถูกขับออก (device expulsion) สามารถเกิดขึ้นได้ทั้ง 1และ2 ข้าง พบได้ร้อยละ 0.4-3 สาเหตุอาจเกิดจากการใส่เครื่องมือที่สั้นเกินไป
- เครื่องมือแตกหักชำรุด, เครื่องมืออยู่ผิดตำแหน่ง อย่างไรก็ตามการใช้ Essure ทำหมันโดยใช้hysteroscope ยังถือว่ามีความปลอดภัยสูง
การนำเครื่องมือออก (Device removal)
หลังจากการทำหมัน อาจพบอาการไม่พึงประสงค์หรือภาวะแทรกซ้อนที่ต้องนำไปสู่การนำเครื่องมือที่ใส่ไว้ออก เช่น ผู้ป่วยต้องการนำเครื่องมือออกเนื่องจากมีอาการเกิดใหม่หลังทำหมันเช่น อาการปวดท้อง รอบเดือนผิดปกติ อย่างไรก็ตามควรตรวจหาสาเหตุอื่นๆก่อนที่อาจทำให้เกิดนั้นๆก่อนทุกครั้ง
เครื่องมืออยู่ผิดที่(device malposition) หากตรวจพบเครื่องมือยังอยู่ในท่อนำไข่ การอุดตันของท่อสมบูรณ์ร่วมกับไม่มีอาการใดๆผิดปกติสามารถดูอาการต่อไปได้ ไม่จำเป็นต้องนำออก ยกเว้นในรายที่มีอาการเช่น ปวดท้อง, มีอาการทางระบบทางเดินอาหาร, ประจำเดือนมาผิดปกติ และตรวจพบว่าท่อนำไข่ไม่อุดตันหลังทำ หรือตรวจพยว่าเครื่องมืออยู่ในช่องท้อง แนะนำให้นำเครื่องมือออก เนื่องจากอาจเป็นสาเหตุกระตุ้นให้เกิดพังผืดในช่องท้องได้ สามารถนำออกทำได้หลายวิธี เช่น การใช้ hysteroscope, laparoscope หรือ laparotomy ขึ้นอยู่กับตำแหน่งของเครื่องมือ
การทำหมันหลังคลอด (Post-partum sterilization)
เป็นช่วงและวิธีการทำหมันที่นิยมมากที่สุด มากกว่าร้อยละ 50 ของการทำหมัน โดยมักทำแบบ mini-laparotomy หรือสามารถทำพร้อมกับการผ่านตัดคลอด(16)
การแนะนำการทำหมันในช่วงฝากครรภ์ (Prenatal counseling)
ควรให้คำแนะนำตั้งแต่ในช่วงของการฝากครรภ์ ถึงการคุมกำเนิดภายหลังจากคลอดบุตรแล้ว โดยปกติในทางปฏิบัติจะแนะนำเรื่องการทำหมันหลังคลอดในช่วงต้นของไตรมาสที่ 3 ของการตั้งครรภ์ ซึ่งเป็นช่วงเวลาที่ดีและเหมาะสมที่สุดในการตัดสินใจของหญิงตั้งครรภ์และครอบครัว การตัดสินใจทำหมันช่วงรอคลอดหรือหลังคลอดอาจมีปัจจัยหลายอย่างที่ทำให้หญิงตั้งครรภ์ตัดสินใจผิดพลาดในการทำหมัน เช่น การเจ็บครรภ์คลอด ประสบการณ์ที่ไม่ดีขณะคลอด เป็นต้น
ช่วงเวลาที่เหมาะสม (Timing)
โดยทั่วไปแนะนำให้ทำหลังจากคลอดบุตรทางช่องคลอดทันทีภายใน 12-24 ชั่วโมงหลังคลอด เนื่องจาก ยอดมดลูกยังอยู่ระดับสะดือไม่ลดลงต่ำมาก ทำให้ง่ายต่อการหาท่อนำไข่ และสามารถลงแผลอยู่ในสะดือทำให้ไม่เห็นแผลผ่าตัดที่หน้าท้อง ในผู้หญิงบางรายจะได้รับการทำ epidural anesthesia ในช่วงคลอดสามารถใช้ประโยชน์ได้ต่อ และไม่ต้องให้งดน้ำงดอาหารหลายครั้ง แต่อย่างไรก็ตามการทำหมันภายหลังจากคลอดบุตรในช่วง 48ชั่วโมง – 6 วันยังคงสามารถทำได้และปลอดภัย ไม่ได้เพิ่มอุบัติการณ์ความเสี่ยงต่อการผ่าตัดมากขึ้น
เทคนิคการผ่าตัดทำหมันหลังคลอด
การให้ยาระงับความรู้สึก สามารถใช้ได้ทั้ง reginal และ general anesthesia หรือเลือกให้เป็น local anesthesia ร่วมกับการให้ยา sedation
การลงแผลหน้าท้อง โดยทั่วไปนิยมลงแผลแบบ infraumbilical minilaparotomy แผลจะค่อนข้างเล็ก และสวยงามไม่เห็นรอยแผลหลังผ่าตัดเพราะแผลมักซ้อนเข้าไปในสะดือ การลงแผลจะลงยาว2-3cm ตามแนวขวาง(transverse incision) หรือตามแนวของรอยผิวหนัง(semicircular incision) จนกระทั้งสามารถระบุตำแหน่งของยอดมดลูกได้ จากนั้นเลื่อนขยับไปทางด้าน adnexa เพื่อหาท่อนำไข่ เมื่อเห็นท่อนำไข่แล้ว ให้ใช้ Babcock clamp จับแล้วยกออกมานอกช่องท้องแล้วไล่ไปตามท่อนำไข่จนพบ fimbria เพื่อเป็นการยืนยันว่าเป็นท่อนำไข่จริง
วิธีการทำให้ท่อนำไข่อุดตัน (Tubal occlusion methods) วิธีที่นิยมมากที่สุดต่อการทำ partial salpingectoy บริเวณ mid-ishmus มีเทคนิคการทำหลายแบบที่แนะนำ โดยวิธีที่นิยมทำมากที่สุดคือ Pomeroy Technique และ Parkland technique
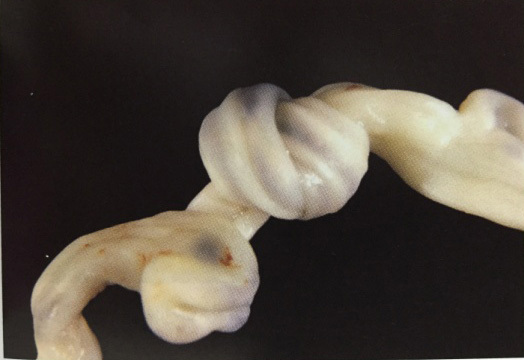
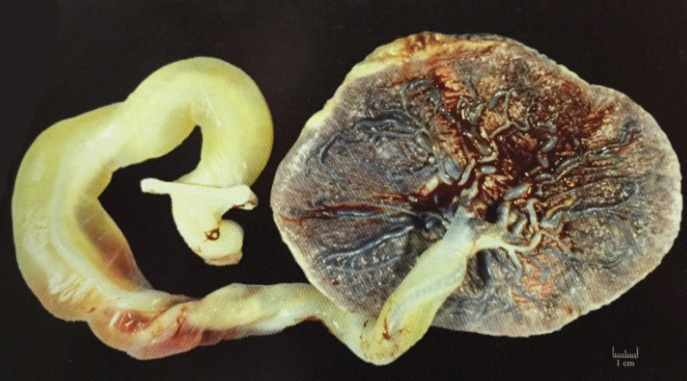
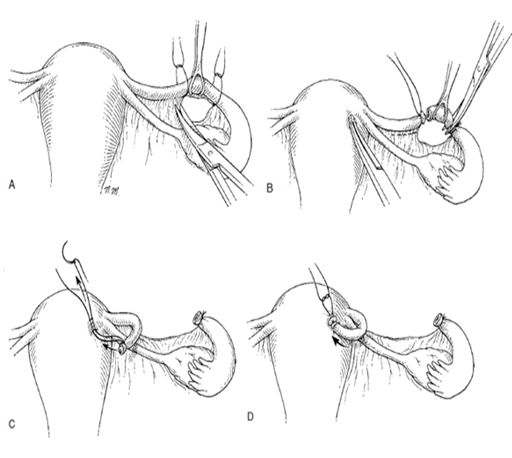
วิธีของ Pomeroy หรือ modified Pomeroy (Pomeroy technique)เป็นวิธีที่ง่ายและนิยมมากที่สุด อัตราความล้มเหลวต่ำ พบร้อยละ 0.4 โดยเมื่อพบท่อนำไข่แล้ว จากนั้นให้ยกท่อนำไข่ขึ้นทำเป็น loop และผูกด้วยไหมละลาย(absorbable suture) เบอร์ 1 ช้าๆ2 รอบ แล้วตัดท่อนำไข่เหนือรอยผูกออกโดย หากมีเลือดออกเพียงเล็กน้อยไปแพทย์หลายคนไม่แนะนำให้ใช้จี้ไฟฟ้าเพราะอาจจะทำให้ปลายท่อนำไข่แยกออกจากกันเร็วเกินไปก่อนที่จะมีการ healingของท่อนำไข่
การทำด้วยวิธี Pomeroy แบบดั้งเดิมให้ใช้ไหมเป็น Chromic แต่มีข้อแนะนำว่าการใช้chomicจะทำให้ไหมสลายช้าไป ทำให้ปลายท่อนำไข่ทั้งสองข้างแยกออกจากกันช้า ดังนั้น จึงมีการปรับเปลี่ยนการใช้ไหมแบบดั้งเดิม โดยการใช้ plain catgut แทนเรียกว่า modified Pomeroy เพื่อให้ไหมสลายได้แล้วแล้วเกิดการแยกกันของท่อนำไข่(17)
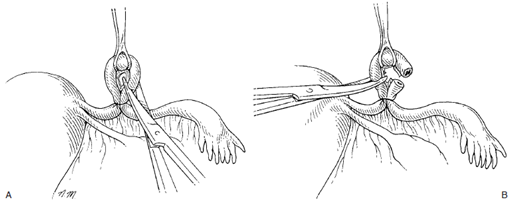
รูปที่ 5 แสดงการทำหมันด้วยวิธี Pomeroy
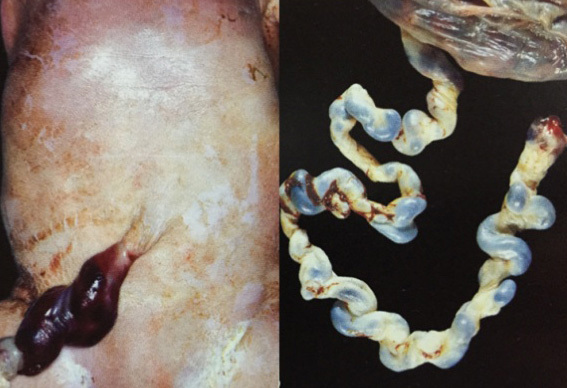
วิธีของ Parkland (Parkland technique) อัตารความล้มเหลวต่ำ พบร้อยละ 0.25 การทำเริ่มจากการเปิด mesosalpinx ส่วนmid-ischmus บริเวณที่ไม่มีเส้นเลือด จากนั้นผูกด้วยไหมละลาย เช่น chomic เบอร์ 0 ทั้งส่วนต้นแบะส่วนปลาย ให้ห่างกันประมาณ 2 เซนติเมตร แล้วตัดท่อนำไข่ระหว่างปลายที่ผูกไว้ออก ปลายท่อนำไข่จะแยกออกจากกันทันที
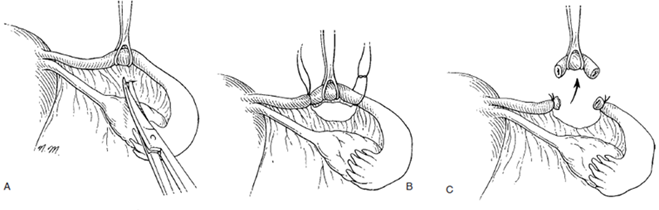
รูปที่ 6 แสดงการทำหมันด้วยวิธี Parkland
วิธีอื่นๆที่มีรายงานการทำแต่ปัจจุบันไม่ได้รับความนิยมแล้วเช่น Irving technique and Uchida technique ซึ่งทั้งสองวิธีถือเป็นวิธีที่มีประสิทธิภาพสูงมาก ยังไม่เคยมีรายงานความล้มเหลวหลังทำ แต่อย่างไรก็ตามทั้งสองวิธีเป็นการผ่าตัดที่ยากกว่า ใช้เวลานานกว่า และมีความเสี่ยงที่จะเสียเลือดมากกว่า โดยปกติไม่ได้ใช้ในการทำหมันทั่วไป อาจพิจารณาทำหมันในรายที่ทำพร้อมกับการผ่าตัดคลอดซึ่งมีพื่นที่ในการผ่าตัดกว้างง่ายต่อการผ่าตัดหรือในรายที่ล้มเหลวจากการทำหมันด้วยวิธีอื่นมาก่อน
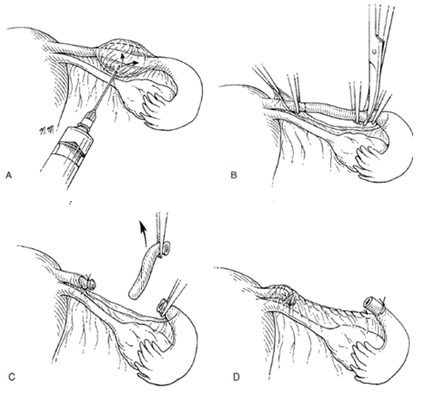
Irving technique เริ่มต้นทำ ลักษณะการทำแบบ Parkland technique แต่จะทำปลายท่อนำไข่ด้านติดกับมดลูก มาฝังไว้ในกล้ามเนื้อมดลูก โดยการ เจาะรูที่ผนังมดลูก แล้วนำเข็มติดปลายไหมที่ผูกท่อนำไข่แล้วเย็บผ่านรูผนังมดลูกที่ทำไว้ เพิ่อนำปลายท่อนำไข่ไปฝังไว้ในกล้ามเนื้อมดลูก ปลายท่อนำไข่อีกด้านหนึงอาจผูกทิ้งไว้หรือเย็บฝังไว้ใน mesosalpinx
รูปที่ 7 แสดงการทำหมันด้วยวิธี Irving
Uchida technique เริ่มจากการทำ hydrodisssectedด้วย vasoconstricting solution ที่ utero-tubal serosa จนโป่งเป็นกะเปาะยาวประมาณ 6 เซนติเมตร จากนั้น เปิด mesosalpinxบริเวณท่ไม่มีเส้นเลือด ออกยาวประมาน5เซนติเมตร จกานั้นมัดด้วยไหมละลายบริเวณส่วนต้นของท่อนำไข่ แล้วตัดออก นำส่วนปลายท่อมำไข่ด้สนติดกับมดลูกฝังกลับไปใน mesosalpinx แล้วเย็บปิด mesosalpinxและเย็บแบบ pursestring รอบๆปลายท่อนำไข่อีกด้านให้แน่น
รูปที่ 8 แสดงการทำหมันด้วยวิธี Uchida
Titanium clipไม่แนะนำให้ใช้ในการทำหมันหลังคลอดเพราะมีการศึกษาพบว่าสามารถลดระยะเวลาในการทำหมันลงได้ แต่มีประสิทธิภาพในการคุมกำเนิดต่ำ มีอัตราความล้มเหลวหลังทำสูงกว่าอย่างมีนัยสำคัญเมื่อเทียบกับการใช้Pomeroy technique(1.7% VS 0.4%)(18)
ภาวะแทรกซ้อน(Complication)
อุบัติการณ์การเกิดภาวะแทรกซ้อนของการทำหมันหลังคลอดแบบ mini-laparotomy ค่อนข้างต่ำมาก พบอุบัติการณ์การเกิด major morbidity ร้อยละ0.39 เช่น เสียเลือดมากกว่า 500 มิลลิตร, pulmonary embolism, stomach injury, febrile morbidity และอุบัติการณ์การเกิด minor morbidity ร้อยละ 0.8 เช่น ติดเชื้อระบบทางเดินปัสสาวะ, hematomaที่ผนังหน้าท้อง, wound dehiscence, ileus, uterine injury(19)
เอกสารอ้างอิง (Reference)
- Cunningham FG, Leveno KJ, Bloom SL, Spong CY, Dashe JS, et al. Williams JW. Williams obstetrics. 24rd ed. McGraw-Hill: New York, 2014:720-725
- Hillis SD, Marchbanks PA, Tylor LR, Peterson HB. Poststerilization regret: findings from the United States Collaborative Review of Sterilization. Obstetrics and gynecology. 1999;93(6):889-95.
- Curtis KM, Mohllajee AP, Peterson HB. Regret following female sterilization at a young age: a systematic review. Contraception. 2006;73(2):205-10.
- Peterson HB, Xia Z, Wilcox LS, Tylor LR, Trussell J. Pregnancy after tubal sterilization with bipolar electrocoagulation. U.S. Collaborative Review of Sterilization Working Group. Obstetrics and gynecology. 1999;94(2):163-7.
- Dominik R, Gates D, Sokal D, Cordero M, Lasso de la Vega J, Remes Ruiz A, et al. Two randomized controlled trials comparing the Hulka and Filshie Clips for tubal sterilization. Contraception. 2000;62(4):169-75.
- Jamieson DJ, Hillis SD, Duerr A, Marchbanks PA, Costello C, Peterson HB. Complications of interval laparoscopic tubal sterilization: findings from the United States Collaborative Review of Sterilization. Obstetrics and gynecology. 2000;96(6):997-1002.
- Mao J, Pfeifer S, Schlegel P, Sedrakyan A. Safety and efficacy of hysteroscopic sterilization compared with laparoscopic sterilization: an observational cohort study. Bmj. 2015;351:h5162.
- Cleary TP, Tepper NK, Cwiak C, Whiteman MK, Jamieson DJ, Marchbanks PA, et al. Pregnancies after hysteroscopic sterilization: a systematic review. Contraception. 2013;87(5):539-48.
- Levy B, Levie MD, Childers ME. A summary of reported pregnancies after hysteroscopic sterilization. Journal of minimally invasive gynecology. 2007;14(3):271-4.
- Duffy S, Marsh F, Rogerson L, Hudson H, Cooper K, Jack S, et al. Female sterilisation: a cohort controlled comparative study of ESSURE versus laparoscopic sterilisation. BJOG : an international journal of obstetrics and gynaecology. 2005;112(11):1522-8.
- Syed R, Levy J, Childers ME. Pain associated with hysteroscopic sterilization. JSLS : Journal of the Society of Laparoendoscopic Surgeons / Society of Laparoendoscopic Surgeons. 2007;11(1):63-5.
- Agostini A, Crochet P, Petrakian M, Estrade JP, Cravello L, Gamerre M. Hysteroscopic tubal sterilization (essure) in women with an intrauterine device. Journal of minimally invasive gynecology. 2008;15(3):277-9.
- American College of O, Gynecologists Committee on Gynecologic P. ACOG Committee Opinion No. 458: Hysterosalpingography after tubal sterilization. Obstetrics and gynecology. 2010;115(6):1343-5.
- Dhruva SS, Ross JS, Gariepy AM. Revisiting Essure–Toward Safe and Effective Sterilization. The New England journal of medicine. 2015;373(15):e17.
- Ouzounelli M, Reaven NL. Essure hysteroscopic sterilization versus interval laparoscopic bilateral tubal ligation: a comparative effectiveness review. Journal of minimally invasive gynecology. 2015;22(3):342-52.
- Chan LM, Westhoff CL. Tubal sterilization trends in the United States. Fertility and sterility. 2010;94(1):1-6.
- Rock JA, Jones HW, Te Linde RW. Te Linde’s operative gynecology. 10th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2008.
- Rodriguez MI, Seuc A, Sokal DC. Comparative efficacy of postpartum sterilisation with the titanium clip versus partial salpingectomy: a randomised controlled trial. BJOG : an international journal of obstetrics and gynaecology. 2013;120(1):108-12.
- Huber AW, Mueller MD, Ghezzi F, Cromi A, Dreher E, Raio L. Tubal sterilization: complications of laparoscopy and minilaparotomy. European journal of obstetrics, gynecology, and reproductive biology. 2007;134(1):105-9.