ภาวะเลือดออกหลังวัยหมดระดู (Postmenopausal bleeding)
ภาวะเลือดออกหลังวัยหมดระดู (Postmenopausal bleeding)
พ.ญ.ธนิยาภรณ์ เศรษฐิยานันท์
รศ.พญ.ประภาพร สู่ประเสริฐ
บทนำและคำจำกัดความ (Introduction and Definition)
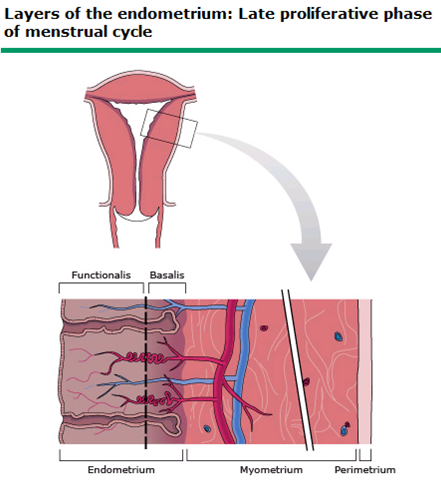
ภาวะเลือดออกหลังวัยหมดระดู หมายถึง สตรีที่มีภาวะที่มีเลือดออกทางช่องคลอดหลังจากที่ไม่มีระดูติดต่อกันอย่างน้อย 12 เดือน โดยที่สตรีผู้นั้นอยู่ในควรอยู่ในช่วงวัยหมดระดู โดยเฉลี่ยคืออายุ 51 ปี (ช่วงปกติอยู่ที่อายุ 45 ถึง 55 ปี) และภาวะนี้ยังสามารถใช้รวมถึง สตรีอายุน้อยที่มีภาวะรังไข่หยุดทำงานก่อนวัยอันควร(premature ovarian failure) หรือ ภาวะหมดประจำเดือนก่อนวัยอันควร (premature menopause)
ส่วนในสตรีที่รับประทานฮอร์โมนทดแทน (hormone replacement therapy) ความถี่และช่วงเวลาที่มีเลือดออกนั้น ขึ้นอยู่กับรูปแบบการให้ฮอร์โมน โดยถ้าได้รับฮอร์โมนทดแทนแบบ cyclical ( sequential regimen) ภาวะเลือดออกที่ผิดปกตินั้น หมายถึง สตรีที่มีเลือดออกไม่ตรงตามรอบหลังการให้โปรเจสติน(unscheduled bleeding) หรือมีเลือดออกตรงรอบ แต่มามาก หรือมานานผิดปกติ สำหรับการให้ฮอร์โมนทดแทนแบบ continuous combined regimen เลือดออกที่ผิดปกติจะหมายถึง การมีเลือดออกหลังได้รับฮอร์โมนทดแทนมากกว่า 6 เดือน หรือมีเลือดออกผิดปกติอีกหลังจากที่ระดูขาดหายไป
ทั้งนี้ภาวะเลือดออกหลังวัยหมดระดูดังที่กล่าวมาไม่ใช่ภาวะปกติ อาจเกิดจากสาเหตุที่อันตรายร้ายแรงได้อย่างเช่น มะเร็งเยื่อบุโพรงมดลูก ดังนั้น สตรีที่มีภาวะเลือดออกหลังจากหมดระดูไปแล้ว ควรได้รับการตรวจวินิจฉัยและสืบค้นหาสาเหตุที่ถูกต้อง เพื่อการดูแลรักษาอย่างเหมาะสมต่อไป
อุบัติการณ์ (Incidence)
ภาวะเลือดออกหลังวัยหมดระดู เป็นปัญหาที่พบบ่อยประมาณร้อยละ 5 ของผู้ป่วยทางนรีเวชทั้งหมด(1) โดยที่ภาวะเลือดออกหลังวัยหมดระดูนี้ พบได้ประมาณ 4 ถึง 11 เปอร์เซ็นต์ของสตรีที่อยู่ในวัยหมดระดู และ อุบัติการณ์จะลดลงตามจำนวนอายุที่วัยหมดระดูเพิ่มมากขึ้น(2)
สาเหตุ (Etiology)
สาเหตุของเลือดออกหลังวัยหมดระดูที่พบบ่อย แบ่งตามพยาธิสภาพกำเนิด ได้แก่ ภาวะเยื่อบุฝ่อบาง (ร้อยละ 59), ติ่งเนื้อในโพรงมดลูก (ร้อยละ 12), มะเร็งเยื่อบุโพรงมดลูก (ร้อยละ 10), เยื่อบุโพรงมดลูกหนาตัวมากว่าผิดปกติ( ร้อยละ9.8), ผลข้างเคียงจากฮอร์โมน (ร้อยละ 7), มะเร็งปากมดลูก (น้อยกว่าร้อยละ 1) ส่วนสาเหตุอื่นๆ เช่น hydrometra, hematometra, pyometra พบได้ประมาณร้อยละ 2 (3)
ภาวะเลือดออกหลังวัยหมดระดู ส่วนใหญ่จะอ้างถึงเลือดที่ออกจากโพรงมดลูก แต่ก็มีหลายสาเหตุที่ภาวะเลือดออกนี้อาจมาจากอวัยวะข้างเคียงได้ โดยที่สามารถจำแนกสาเหตุของภาวะเลือดออกหลังวัยหมดระดูตามตำแหน่งที่เกิด ได้ดังนี้
• สาเหตุที่มาจากอวัยวะสืบพันธุ์ (Gynecological cause)
สาเหตุนอกโพรงมดลูก (Extrauterine cause) ได้แก่
- ภาวะช่องคลอดแห้ง (vaginal atrophy) เนื่องจากขาดฮอร์โมนเอสโตรเจนซึ่งจะมีลักษณะ เยื่อบุช่องคลอดสีซีด แห้ง เรียบและมันวาวขึ้นเนื่องจาก เนื่องจากรอยย่น(rugae)ที่ลดลง ถ้ามีการอักเสบเกิดขึ้น เยื่อบุผิวที่บางจะเปื่อยยุ่ยง่าย และอาจมีจุดเลือดออก หรือมีแผลเกิดขึ้นทำให้มีเลือดออกได้ง่าย
- เนื้องอกมะเร็งบริเวณที่ปากมดลูก, ช่องคลอด หรือ อวัยวะเพศ
- เนื้องอกที่บริเวณท่อท่อนำไข่ หรือที่เนื้องอกที่รังไข่ที่สามารถฮอร์โมนเอสโตรเจนได้
สาเหตุจากโพรงมดลูก (Intrauterine cause) ได้แก่
- เยื่อบุโพรงมดลูกฝ่อบาง (endometrial atrophy) จากการขาดฮอร์โมนเอสโตรเจน ทำให้เยื่อบุโพรงมดลูกฝ่อบาง ในโพรงมดลูกมีของเหลวน้อยมากหรือไม่มีเลย ทำให้เกิดการเสียดสีระหว่างเยื่อบุโพรงมดลูก เกิดการอักเสบเรื้อรัง ซึ่งอาจส่งผลทำให้เกิดเลือดออกได้
- ติ่งเนื้อในพรงมดลูก (endometrial polyp) เป็นเนื้องอกที่ไม่อันตราย เป็นสาเหตุที่พบบ่อยที่ทำให้เกิดเลือดออกในช่วงใกล้หมดระดู หรือช่วงหมดระดูระยะเริ่มต้น ซึ่งเนื้องอกชนิดนี้ สามารถถูกกระตุ้นได้ด้วยฮอร์โมนเอสโตรเจน หรือได้รับยา tamoxifen
- เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (endometrial hyperplasia) อาการแสดงนำคือ มีเลือดออกผิดปกติจากโพรงมดลูก ในสตรีที่หมดระดูไปแล้ว จะขาดฮอร์โมนเอสโตรเจน ทำให้เยื่อบุโพรงมดลูกไม่เจริญขึ้น ดังนั้นภาวะเยื่อบุโพรงมดลูกที่หนาตัวผิดปกติ ถือว่าเป็นภาวะผิดปกติ จำเป็นต้องหาสาเหตุ ซึ่งอาจเกิดจากที่มี endogenous estrogenจากเนื้องอกที่รังไข่ หรือต่อมหมวกไต และอาจเกิดจาก exgenous estrogen ที่ได้รับจากภายนอกได้ เช่น ได้รับฮอร์โมนทดแทน (HRT) เพื่อรักษาวัยทอง หรือได้รับยาสมุนไพร หรืออาหารเสริมที่มีสาร phytoestrogen ในปริมาณมาก
จากการศึกษาแบบสุ่มในสตรีอยู่ในวัยหมดระดู จำนวน 376 คนที่ได้รับสารถั่วเหลือง และสารหลอก พบว่าหลังจากติดตามไปมากกว่า 5ปี สตรีที่ได้รับสารถั่วเหลือง มีภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติมากกว่าอย่างมีนัยสำคัญ (4) - มะเร็งเยื่อบุโพรงมดลูก (endometrial cancer) พบได้ประมาณร้อยละ 10 ของสตรีที่มีเลือดออกหลังวัยหมดระดู โดยอุบัติการณ์เพิ่มตามอายุที่มากขึ้น โดยที่ร้อยละ 90 ของสตรีที่เป็นมะเร็งเยื่อบุโพรงมดลูกจะมีอาการเลือดออกหลังวัยหมดระดู
- มะเร็งของกล้ามเนื้อมดลูก (uterine sarcoma) พบได้น้อยมาก ประมาณร้อยละ 3-5 ของมะเร็งมดลูกทั้งหมด โดยมากพบในสตรีสูงอายุ ซึ่งอาการที่พบบ่อยคือ มีเลือดออกผิดปกติทางช่องคลอด ซึ่งมะเร็งชนิดนี้อาจดูเหมือนเนื้องอกกล้ามเนื้อธรรมดาของมดลูก การวินิจฉัยมักได้จากการผ่าตัด หรือผลทางพยาธิวิทยาในภายหลัง
- เนื้องอกกล้ามเนื้อธรรมดาของมดลูก (uterine leiomyomas) พบได้ประมาณหนึ่งในสิบ ของสตรีที่อยู่ในวัยก่อนหมดระดู ดังนั้นภาวะเลือดออกผิดปกติจากเนื้องอกกล้ามเนื้อธรรมดาในวัยหมดระดู จึงพบได้น้อยมาก แต่ถ้านึกถึงภาวะนี้ต้องคำนึงถึงมะเร็งของกล้ามเนื้อมดลูกร่วมด้วยเสมอ
• สาเหตุที่ไม่ได้มาจากอวัยวะสืบพันธุ์ (Non-gynecological cause) ซึ่งอาจทำให้เข้าใจผิดว่าเลือดที่ออกมาจากอวัยวะสืบพันธุ์ได้ ยกตัวอย่างโรค ได้แก่
- โรคทางระบบทางเดินปัสสาวะ เช่น ท่อทางเดินปัสสาวะอักเสบ, มะเร็งที่กระเพาะปัสสาวะ
- โรคทางระบบทางเดินอาหาร เช่น ลำไส้อักเสบ, ริดสีดวงทวารหนัก หรือมีการแตกของ sigmoid colon แล้วเกิดท่อทะลุถึงมดลูกทำให้มีอาการเลือดออกผิดปกติทางช่องคลอดได้
- ความผิดปกติการแข็งตัวของเลือด
แนวทางการตรวจวินิจฉัย (Diagnostic evaluation)
เป้าหมายในการตรวจวินิจฉัยภาวะเลือดออกหลังวัยหมดระดู คือเพื่อต้องการแยกโรคสำคัญ คือ มะเร็งเยื่อบุโพรงมดลูก และภาวะเยื่อบุโพรงมดลูกก่อนการเป็นมะเร็ง (precancerous lesion of endometrium) ออกไปให้ได้ ซึ่งมีแนวทางการสืบค้นดังนี้
o การซักประวัติ และตรวจร่างกาย
การซักระวัติโดยทั่วไป
- ลักษณะของเลือดที่ออก (ปริมาณ, ระเวลา, ความถี่)
- ความผิดปกติในการปัสสาวะ หรืออุจจาระ
- การได้รับบาดเจ็บ หรืออุบัติเหตุ
- ประวัติโรคประจำตัว และประวัติมะเร็งในครอบครัว
- การได้รับฮอร์โมนทดแทน, การรับประทานอาหารเสริม และประวัติการใช้ยาประจำ เช่น ยาต้านการแข็งตัวของเลืด
- ประวัติการใส่สิ่งแปลกปลอม เช่น pessary เป็นต้น
การตรวจร่างกาย
- ประเมินค่า BMI (body mass index) เพื่อหาปัจจัยเสี่ยงของมะเร็งเยื่อบุโพรงมดลูก
- ตรวจอวัยวะสืบพันธุ์ภายใน และภายนอก โดยเฉพาะตรวจหาตำแหน่งที่เลือดออก ประเมินขนาดของมดลูก การกดเจ็บที่มดลูก การคลำก้อนภายในอุ้งเชิงกราน
- การตรวจอวัยวะใกล้เคียง เช่น ท่อปัสสาวะ หรือบริเวณทวารหนัก
การค้นหาปัจจัยเสี่ยงของการเป็นมะเร็งเยื่อบุโพรงมดลูก(5)
- พบว่าการใช้ปัจจัยเสี่ยงเพื่อคัดกรองการเป็นมะเร็งเยื่อบุโพรงมดลูก เป็นวิธีที่มีความวัย และความจำเพาะร้อยละ 68-82 (24) ปัจจัยเสี่ยงของมะเร็งเยื่อบุโพรงมดลูกได้แก่ (ตารางที่ 1)
ตารางที่ 1. แสดงปัจจัยเสียงของมะเร็งเยื่อบุโพรงมดลูก
{tabulizer:style[gr.alterora.elemental_1_red_orange.css]}
| ปัจจัยเสี่ยง(Risk factor) | ความเสี่ยงเพิ่มขึ้น (Relative risk) |
| การได้รับยาฮอร์โมนเอสโตรเจนเพียงอย่างเดียว (Unopposed estrogen) | 4-8 เท่า |
| สตรีที่ไม่เคยมีบุตร (Nulliparity) | 2-3 เท่า |
| หมดระดูช้า (Late menopause) | 2.4 เท่า |
| ภาวะอ้วน (Obesity): น้ำหนักเกินเกณฑ์ 15-25 กิโลกรัม | 3 เท่า |
| ภาวะอ้วน (Obesity): น้ำหนักเกินเกณฑ์มากกว่า 25 กิโลกรัม | 10 เท่า |
| เบาหวาน (Diabetes mellitus) | 2.8 เท่า |
| ได้รับยา tamoxifen | 2-3 เท่า |
| เยื่อบุโพรงมดลูกหนาตัว (Atypical endometrial hyperplasia) | 8-29 เท่า |
| มีประวัติคนในครอบครัวเป็นมะเร็งลำไส้ใหญ่ (Lynch II syndrome) | 20 เท่า |
o การสืบค้นเพิ่มเติม (Investigation)
การตรวจด้วยคลื่นความถี่สูงทางช่องคลอด (Transvaginal ultrasonography :TVUS)
การวัดความหนาของเยื่อบุโพรงมดลูกด้วยคลื่นความเสี่ยงสูงทางช่องคลอด เป็นวิธีการที่ไม่รุนแรง(non-invasive method) โดยวิธีการวัดความหนาของเยื่อบุโพรงมดลูกจะวัดในแนว sagittal view วัดจากด้านหน้าถึงด้านหลัง จากชั้น basalis ด้านหนึ่งถึงชั้น basalis อีกด้านหนึ่ง โดยไม่รวมของเหลวใดๆภายในโพรงมดลูก โดยวัดหากเยื่อบุโพรงมดลูกหนาไม่เกิน 5 มิลลิเมตร จะเกิดมะเร็งเยื่อบุโพรงมดลูกได้น้อยมาก จากการศึกษาในสตรีเกือบ 6000ราย จาก 35 งานวิจัยที่นำมาวิเคราะห์แบบ meta-analysis ในรายที่มีความหนาของเยื่อบุโพรงมดลูกน้อยกว่า 4 มิลลิเมตร พบว่ามีความวัย และความจำเพาะในการตรวจพบมะเร็งเยื่อบุโพรงมดลูกอยู่ที่ร้อยละ 96 และ 51 ตามลำดับ(6) The American College of Obstetricians and Gynecologist (ACOG) ได้แนะนำ ให้ใช้ความหนาของเยื่อบุโพรงมดลูกไม่เกิน 4 มิลลิเมตร อาจติดตามอาการโดยยังไม่ต้องตรวจชิ้นเนื้อจากโพรงมดลูก แต่หากวัดได้มากกว่า 4 มิลลิเมตร ควรตรวจด้วยวิธีอื่นๆเพิ่มเติม(7)
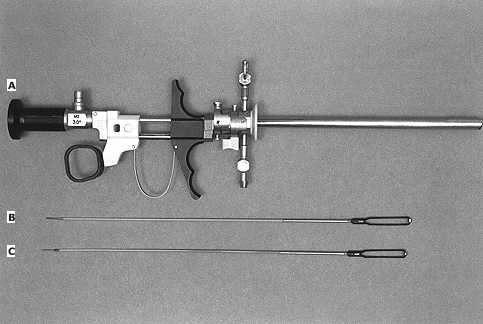
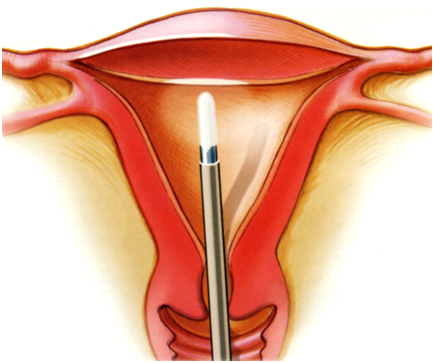
การสุ่มตรวจชิ้นเนื้อจากโพรงมดลูก (Endometrial Sampling)
การตรวจหาสาเหตุของภาวะเลือดออกจากโพรงมดลูกในวัยหมดระดูด้วยการสุ่มตรวจชิ้นเนื้อจากโพรงมดลูกด้วยเครื่องมือต่างๆ ได้มีการพัฒนามากขึ้นเพื่อมาแทนที่การขูดมดลูก (dilatation&curettage) เนื่องจากมีข้อดี ทั้งในเรื่องความสะดวก ไม่จำเป็นต้องทำในห้องผ่าตัด ทำให้มีค่าใช้จ่ายที่น้อยกว่า ไม่ต้องใช้ยาดมสลบในการทำหัตถการ และอาจไม่จำเป็นต้องขยายถ่างปากมดลูก ยกตัวอย่างเช่น vacumm-suction curettage (Vabra aspiration), suction piston biopsy (Pipelle biopsy) การใช้ suction piston biopsy จะมีความเจ็บปวดน้อยกว่า แต่ความถูกต้องในการตรวจหาพยาธิสภาพในโพรงมดลูก อยู่ระหว่างร้อยละ 83-89 และในรายที่เยื่อบุโพรงมดลูกหนาน้อยกว่า 5 มิลลิเมตร อาจได้ชิ้นเนื้อไม่เพียงพอที่จะอ่านแปลผล
การศึกษาในสตรี 7915 ราย จาก 39 งานวิจัยที่นำมาวิเคราะห์แบบ meta-analysis พบว่าการสุ่มตัดชิ้นเนื้อที่โพรงมดลูกด้วย pipelle piston biopsy มีความไวในการตรวจหามะเร็งเยื่อบุโพรงมดลูกมากกว่าเครื่องมือสุ่มตรวจชิ้นเนื้ออื่นๆ และยังมีความไวในการตรวจหา endometrial carcinoma และ endometrial hyperplasia ร้อยละ 99.6 และ 81 ตามลำดับ(8) ดังนั้นจึงสามารถใช้วิธีนี้ในการตรวจหาสาเหตุของการมีเลือดออกจากโพรงมดลูกในวัยหมดระดูเบื้องต้นได้
การขูดเยื่อบุโพรงมดลูกแบบ Dilatation and curettage
การขูดมดลูกเพื่อประเมินหาสาเหตุของการมีเลือดออกจากโพรงมดลูกในวัยหมดระดูมีการใช้ลดลง เนื่องจากมีวิธีการอื่นที่ทำได้ง่ายกว่า ดังที่กล่าวข้างต้น แต่ควรทำการขูดมดลูกในกรณีที่มีปัจจัยเสี่ยงของการเป็นมะเร็งเยื่อบุโพรงมดลูก และพบว่า
- ชิ้นเนื้อจากการสุ่มตัดชิ้นเนื้อจากโพรงมดลูก ไม่เพียงพอในการอ่านและแปรผล หรือผลชิ้นเนื้อจากการสุ่มตัดชิ้นเนื้อเป็น endometrial hyperplasia ซึ่งจำเป็นต้องประเมินว่ามีพยาธิสภาพของเยื่อบุโพรงมดลูกที่ตำแหน่งอื่นรุนแรงกว่าหรือไม่
- มีเลือดออกจากโพรงมดลูกซ้ำหรือไม่หยุด หลังให้การรักษาด้วยยา หรือตรวจติดตาม
- มีภาวะปากมดลูกตีบตัน (cervical stenosis) ไม่สามารถทำการสุ่มตัดชิ้นเนื้อจากโพรงมดลูกได้
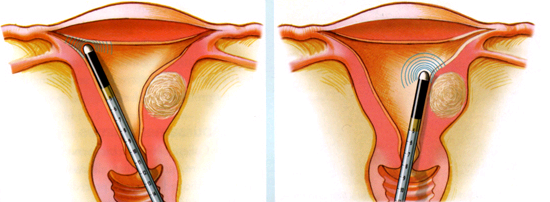
การใช้กล้องส่องโพรงมดลูก (Hysteroscopy)
เป็นการตรวจหารอยโรคโดยการมองในโพรงมดลูกโดยตรง ทำให้สามารถตัดชิ้นเนื้อในรอยโรคที่สงสัยได้ หลายการศึกษาแสดงให้เห็นว่า การส่องกล้องในโพรงมดลูกช่วยให้สามารถตรวจหารอยโรคเฉพาะที่ได้ดีกว่า ซึ่งในบางครั้งอาจพลาดจากการขูดมดลูกได้(9)
แต่อย่างไรก็ตามการส่องกล้องในโพรงมดลูก ต้องใช้ทักษะในการทำหัตถการ มีค่าใช้จ่ายที่สูง และยังเป็นวิธีที่รุนแรงมากกว่าวิธีอื่นๆที่กล่าวมา จึงแนะนำให้เลือกใช้ในรายที่มีรอยโรคที่ตรวจได้จากคลื่นความเสี่ยงสูง หรือมีปัจจัยเสี่ยงต่อมะเร็งเยื่อบุโพรงมดลูก
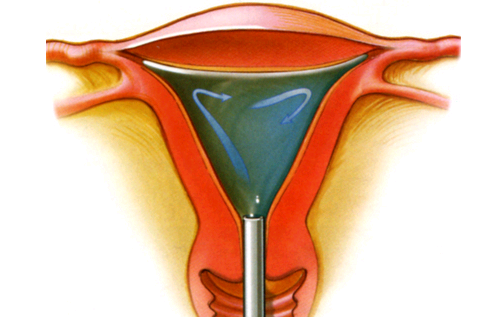
Saline infusion sonography (SIS)
เป็นเทคนิคการถ่ายภาพโดยใส่สารน้ำสเตอไรด์ ในโพรงมดลูก และทำการตรวจด้วยคลื่นความถี่สูงทางช่องคลอด (TVUS) ซึ่งทำให้เห็นรูปร่างของโพรงมดลูก และตรวจหารอยโรคเล็กๆ เช่น ติ่งเนื้อ(polyp) หรือ submucous myoma ในโพรงมดลูกได้ชัดเจนขึ้น ซึ่งรอยโรคเล็กๆนี้ อาจตรวจไม่พบจากการทำ TVUS อย่างเดียว หรือการขูดมดลูก แต่ข้อเสียของวิธีนี้ คือไม่ได้ผลชิ้นเนื้อทางพยาธิวิทยา ทำให้ต้องทำร่วมกับวิธีอื่นๆ
แผนภูมที่ 1แนวทางการรักษาภาวะเลือดออกจากโพรงมดลูกหลังวัยหมดระดู ตามคำแนะนำของราชวิลัยสูตินรีแพทย์แห่งประเทศไทย (RTCOG)
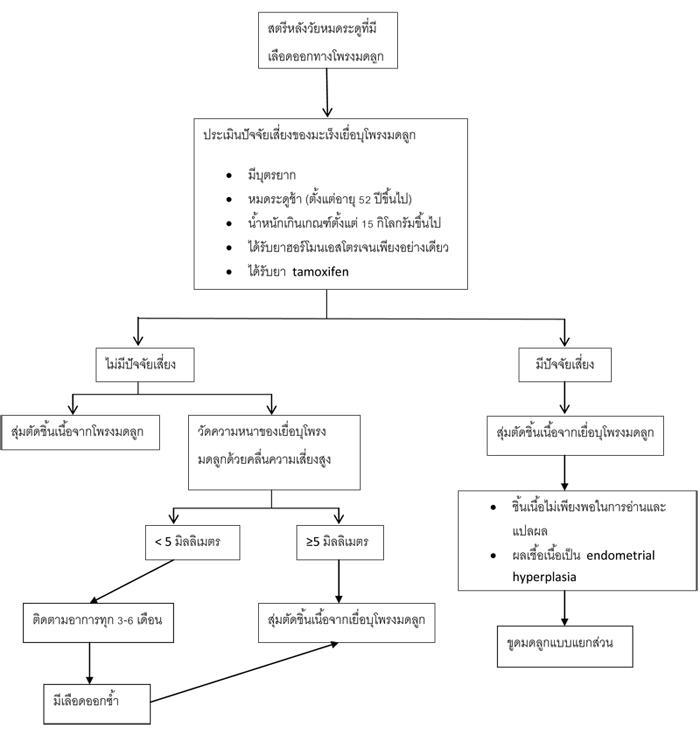
แนวทางการรักษา (Mannagement)
ภาวะเลือดออกในหญิงวัยหมดระดู ส่วนใหญ่จะมีปริมาณไม่มาก และสามารถหายได้เอง วัตถุประสงค์หลัก คือสามารถแยกภาวะมะเร็งเยื่อบุโพรงมดลูก และภาวะเยื่อบุโพรงมดลูกก่อนการเป็นมะเร็งออกไปให้ได้ นอกเหนือจากนี้การรักษามักไม่จำเป็น ยกเว้นในรายที่มีภาวะเลือกออกซ้ำ หรือเลือดออกไม่หยุด จำเป็นต้องได้รับการตรวจวินิจฉัยเพิ่มเติม
ในที่นี้จะขอกล่าวถึงแนวทางการรักษาภาวะเลือดออกหลังหมดระดู ในสาเหตุที่พบบ่อยตามคำแนะนำของราชวิลัยสูตินรีแพทย์แห่งประเทศไทย (RTCOG) ดังนี้
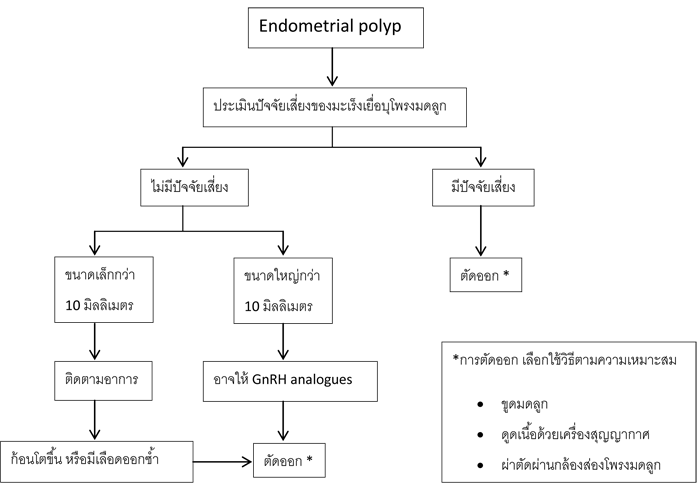
o ติ่งเนื้อที่โพรงมดลูก (Endometrial polyp)
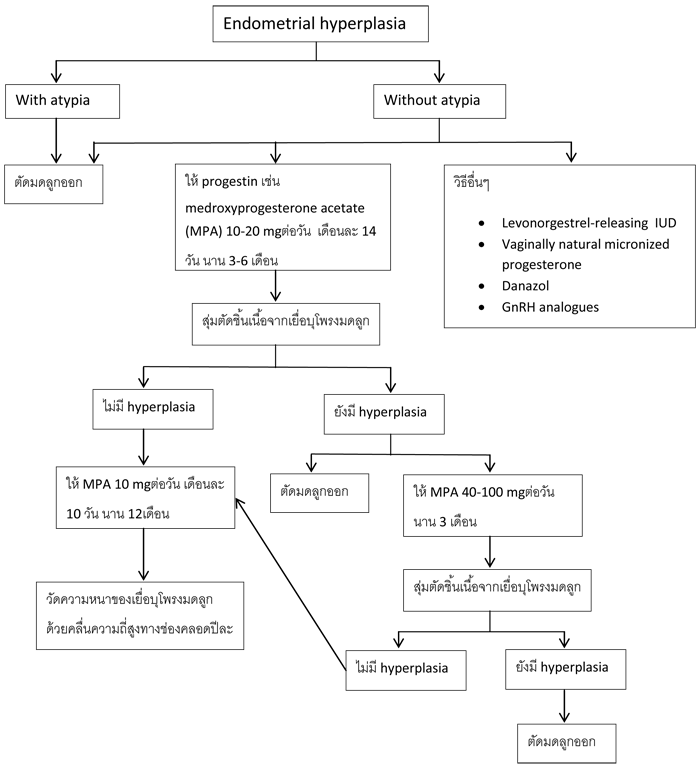
o ภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia)
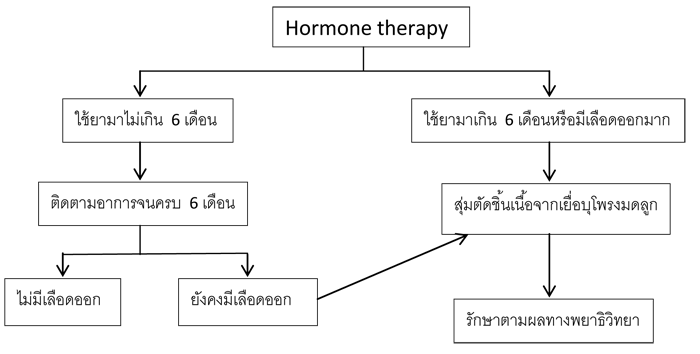
o ภาวะเลือดออกจากโพรงมดลูกจากการใช้ฮอร์โมน (Hormone therapy)
o ภาวะเยื่อบุโพรงมดลูกที่ฝ่อแล้ว (Atropic endometritis)
- ให้ติดตามการรักษา หรือให้ฮอร์โมนเอสโตรเจน หากใช้เป็นเวลานานควรให้โปรเจสตินร่วมด้วย
สรุป
- ภาวะเลือดออกหลังวัยหมดระดู ส่วนใหญ่จะอ้างถึงเลือดที่ออกจากโพรงมดลูก
- สาเหตุที่พบบ่อยของภาวะเลือดออกหลังวัยหมดระดู คือภาวะเยื่อบุโพรงมดลูกฝ่อบาง และติ่งเนื้อในโพรงมดลูก และมะเร็งเยื่อบุโพรงมดลูกพบได้ประมาณร้อยละ 10 ของสตรีที่มีเลือดออกหลังวัยหมดระดูทั้งหมด
- เป้าหมายสำคัญในการดูแลภาวะเลือดออกหลังวัยหมดระดูคือ จำเป็นต้องแยกภาวะมะเร็งของเยื่อบุโพรงมดลูกออกให้ได้ โดยที่การสืบค้นเบื้องต้นสามารถทำได้ทั้ง การสุ่มตรวจชิ้นเนื้อจากโพรงมดลูก หรือ การการตรวจด้วยคลื่นความถี่สูงทางช่องคลอด
- ภาวะเลือดออกในหญิงวัยหมดระดู ส่วนใหญ่จะมีปริมาณไม่มาก และสามารถหายได้เอง ถ้าแยกภาวะมะเร็งเยื่อบุโพรงมดลูกออกไปได้แล้ว ส่วนใหญ่การรักษามักไม่จำเป็น แต่ถ้ามีเลือดออกซ้ำ หรือเลือดออกไม่หยุด ควรได้รับการสืบค้นเพิ่มเติม
เอกสารอ้างอิง
- Moodley M, Roberts C. Clinical pathway for the evaluation of postmenopausal bleeding with an emphasis on endometrial cancer detection. J Obstet Gynaecol 2004; 24:736.
- Astrup K, Olivarius Nde F. Frequency of spontaneously occurring postmenopausal bleeding in the general population. Acta Obstet Gynecol Scand 2004; 83:203.
- Prendergast EN, Misch E, Chou YA, et al. Insufficient endometrial biopsy results in women with abnormal uterine bleeding. Obstet Gynecol 2014; 123 Suppl 1:180S.
- Unfer V, Casini ML, Costabile L, et al. Endometrial effects of longterm treatment with phytoestrogens: a randomized, doubleblind, placebocontrolled study. Fertil Steril 2004; 82:145.
- Lurian JR. Uterine cancer. In: Berek JS, editor. Berek & Novak’s Gynecology 14th ed. Baltimore: Lippincott Williams & Wilkins, 2007;1343-401
- SmithBindman R, Kerlikowske K, Feldstein VA, et al. Endovaginal ultrasound to exclude endometrial cancer and other endometrial abnormalities. JAMA 1998; 280:1510.
- The role of transvaginal ultrasonography in the evaluation of postmenopausal bleeding. ACOG Committee Opinion No. 440. American College of Obstetricians and Gynecologists. Obstet Gynecol 2009; 114:409.
- Dijkhuizen FP, Mol BW, Brölmann HA, Heintz AP. The accuracy of endometrial sampling in the diagnosis of patients with endometrial carcinoma and hyperplasia: a metaanalysis. Cancer 2000; 89:1765.
- Epstein E, Ramirez A, Skoog L, Valentin L. Dilatation and curettage fails to detect most focal lesions in the uterine cavity in women with postmenopausal bleeding. Acta Obstet Gynecol Scand 2001; 80:1131.