Torch infection in pregnancy
นพ. ระพีพัฒน์ เอื้อกิจรุ่งเรือง
รศ. สุชยา ลือวรรณ
การติดเชื้อในหญิงตั้งครรภ์เป็นอีกหนึ่งปัจจัยที่ทำให้ morbidity และ mortality ในหญิงตั้งครรภ์สูงขึ้น รวมถึงทารกในครรภ์ด้วย โดยการติดเชื้อที่ส่งผลทั้งมารดาและทารกในครรภ์จะสามารถเกิดการติดเชื้อได้ทั้งในช่วง ระหว่างการตั้งครรภ์ (antepartum) ระหว่างระยะคลอด (intrapartum) และระยะหลังคลอด (postpartum)(1)
Specific Causes of Some Fetal and Neonatal Infections
- Antepartum
- Transplacental
- Viruses: varicella-zoster, Coxsackie, human parvovirus B19, rubella, cytomegalovirus, human immunodeficiency virus
- Bacteria: listeria, syphilis, Borrelia
- Protozoa: toxoplasmosis, malaria
- Ascending infection
- Bacteria: group B streptococcus, coliforms
- Viruses: herpes simplex
- Intrapartum
- Maternal exposure
- Bacteria: gonorrhea, chlamydia, group B streptococcus, tuberculosis, mycoplasmas
- Viruses: herpes simplex, papillomavirus, human immunodeficiency virus, hepatitis B, hepatitis C
- Maternal exposure
- External contamination
- Bacteria: staphylococcus, coliforms
- Viruses: herpes simplex, varicella zoster
- Postpartum
- Human transmission: staphylococcus, herpes simplex virus
- Respirators and catheters: staphylococcus, coliforms
TORCH infection หรือการติดเชื้อกลุ่ม TORCH เป็นการติดเชื้อไวรัสและโปรโตซัวที่สำคัญที่ส่งผลต่อทั้งมารดาและทารกในครรภ์เป็นอย่างมาก ประกอบด้วย
- T : Toxoplasmosis
- O : Other : Parvovirus B19, Zika virus, syphilis
- R : Rubella
- C : Cytomegalovirus
- H : Herpes simplex virus
Toxoplasmosis
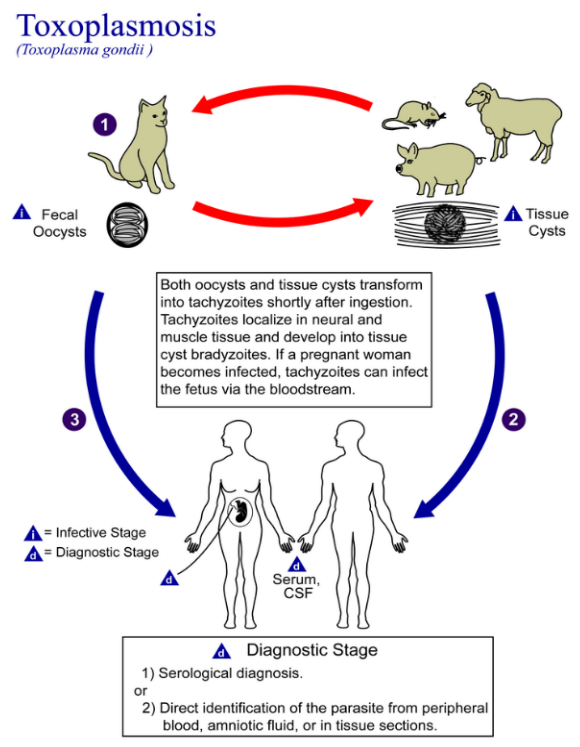
เป็นการติดเชื้อโปรโตซัว Toxoplasma gondii โดยที่โปรโตซัวชนิดนี้มีพาหะหลัก(definite host)คือแมว และมีช่วงชีวิต 3 ระยะคือ
Tachyzoite : เป็นระยะที่มีการติดเชื้อในช่วงแรก เชื้อจะมีการแบ่งตัว (replicated) และแทรกตัว (invade) ผ่านรกทำให้เกิดการติดเชื้อในทารกได้
Bradyzoite : เป็นการติดเชื้อในระยะพัก (latent phase)
Sporozoite : เป้นระยะที่มีการติดเชื้อในพาหะ (host) จะตรวจพบ oocysts ได้ และสามารถทนต่อสิ่งแวดล้อมภายนอกได้
สาเหตุของการติดเชื้อ เกิดจากการรับประทานอาหารที่ไม่สุกและมี oocysts ของเชื้อเข้าไป หรือเกิดจากการสัมผัสอุจจาระของแมวที่มีการติดเชื้อ
ระบาดวิทยาของโรค
อัตราการเกิดโรคอยู่ที่ประมาณ 0.8-10 รายต่อ 10,000 ประชากร(2) ความชุกของการติดเชื้อของทารกในครรภ์ขึ้นอยู่กับอายุครรภ์ โดยอายุครรภ์ที่ 13 สัปดาห์พบการติดเชื้อร้อยละ 6 ที่อายุครรภ์ 20 สัปดาห์พบการติดเชื้อร้อยละ 45 และที่อายุครรภ์ 36 สัปดาห์พบการติดเชื้อร้อยละ 72 แต่ทารกที่ติดเชื้อตั้งแต่อายุครรภ์น้อยจะเกิดความรุนแรงของโรคมากกว่า(3)
อาการทางคลินิก (clinical manifestation)
หญิงตั้งครรภ์และทารกในครรภ์มักไม่แสดงอาการในการติดเชื้อช่วงแรก บางรายหญิงตั้งครรภ์อาจมีอาการไข้ อ่อนเพลีย ปวดเมื่อยกล้ามเนื้อ ตุ่มผืน (maculopapular rash) หรือต่อมน้ำเหลืองโตได้ (lymphadenopathy)
หญิงตั้งครรภ์ที่มีการติดเชื้อจะเพิ่มความเสี่ยงต่อการคลอดก่อนกำหนด แต่ไม่เพิ่มภาวะทารกเจริญเติบโตช้าในครรภ์ (fetal growth restriction) ทารกที่เกิดมาอาจมีปัญหาน้ำหนักตัวน้อย ตับม้ามโต (hepatospleenomegaly) ตัวเหลือง (jaundice) หรือซีดได้ ทารกที่ติดเชื้อจะมีลักษณะอาการแสดงที่เด่นชัด 3 ประการคือ
1.Chorioretinitis 2. Intracranial calcifications 3. Hydrocephalus
การวินิจฉัย (diagnosis)
การตรวจหาการติดเชื้อโปรโตซัวชนิดนี้จากสารคัดหลั่งได้ยาก ในปัจจุบันใช้การตรวจ IgG และ IgM เพื่อบ่งบอกสถานะการติดเชื้อของหญิงตั้งครรภ์ได้ โดย
IgM จะมีค่า titer ที่สูงขึ้นเมื่อมีการติดเชื้อภายใน 10 วันแรก และจะค่อยลดลงจนไม่สามารถตรวจได้เมื่อการติดเชื้อผ่านไป 3-4 เดือน แต่ในผู้ป่วยบางรายอาจตรวจพบค่า titer ได้จบถึง 1 ปี
IgG จะมีค่า titer ที่สูงขึ้นในช่วง 1-2 สัปดาห์แรกหลังการติดเชื้อ และจะมีค่า titer สูงที่สุดในช่วง 1-2 เดือนแรก จากนั้น IgG จะคงอยู่ไปตลอด นอกจากนั้นยังมีการใช้ avidity test ในการประเมินระดับ IgG ด้วย โดยหากค่า avidity test ต่อ IgG นั้นมีระดับต่ำจะสัมพันธ์กับ acute infection หากค่า avidity test มีค่าสูง หมายถึงการติดเชื้อน่าจะผ่านมาอย่างน้อย 3-5 เดือนแล้ว
IgA และ IgE ใช้ร่วมในการประเมิน โดยค่า titer จะเพิ่มขึ้นในกลุ่มที่มีการติดเชื้อใหม่
หากสงสัยการติดเชื้อของทารกในครรภ์ การตรวจจำเป็นจะต้องใช้วิธี DNA amplification techniques จากน้ำคร่ำหรือเลือดของทารกในครรภ์ ร่วมกับการใช้ การตรวจคลื่นความถี่สูงในการประเมินร่วมด้วย(4)
การดูแลรักษา
ในปัจจุบันยังไม่มีการตรวจคัดกรองสำหรับการติดเชื้อ toxoplasmosis ยกเว้นในกลุ่มผู้ติดเชื้อ HIV หรือผู้ที่อาศัยในเขตที่มีการเกิดโรคเยอะ โดยที่จะคัดกรอง IgG ก่อนการตั้งครรภ์
การรักษาให้เพื่อเป้าหมายในการลดความเสี่ยงต่อการติดเชื้อของทารกในครรภ์ โดยยาที่ให้คือ spiramycin หากทารกได้รับการวินิจฉัยว่ามีการติดเชื้อแล้ว มีการศึกษาโดยให้ยาpyrimethamine, sulfonamides, และ folinic acid เพื่อลดจำนวนโปรโตซัว แต่ผลการรักษานั้นยังไม่แน่ชัด ในปัจจุบันยังไม่มีวัคซีนสำหรับการป้องกันการติดเชื้อโปรโตซัวนี้(5)
Parvovirus B19
เป็นการติดเชื้อไวรัสชนิด single-stranded DNA โดยในคนทั่วไปจะทำให้เกิดโรค fifth disease หรือ erythema infectiosum โดยเชื้อนี้จะเข้าไปเจริญในเซลล์ที่มีการเจริญเร็ว โดยเฉพาะ erythrocyte precursors ทำให้เกิดภาวะซีดได้ โดยเฉพาะทารกในครรภ์ โดยการแพร่กระจายของเชื้อจะแพร่กระจายผ่านสารคัดหลั่ง(1)
อาการแสดงทางคลินิก
ร้อยละ 20-30 ของหญิงตั้งครรภ์จะไม่มีอาการแสดงให้เห็น กลุ่มที่มีอาการแสดงจะมีอาการไข้ ปวดศีรษะ ปวดเอยกล้ามเนื้อ (flulike symptom) ในช่วงแรกจากนั้นจะเริ่มมีผื่นขึ้นบริเวณใบหน้า (slapped cheek) บางรายอาจมีอาการผื่นตามลำตัวหรือข้ออักเสบได้
ทารกมีโอกาสติดเชื้อไวรัสนี้ได้ถึง 1 ใน 3 ของมารดาที่ติดเชื้อระหว่างตั้งครรภ์ ซึ่งส่งผลให้เกิดการแท้ง ทารกบวมน้ำ(nonimmune hydrops)และ ทารกตายคลอดได้(stillbirth)(6)
การวินิจฉัย
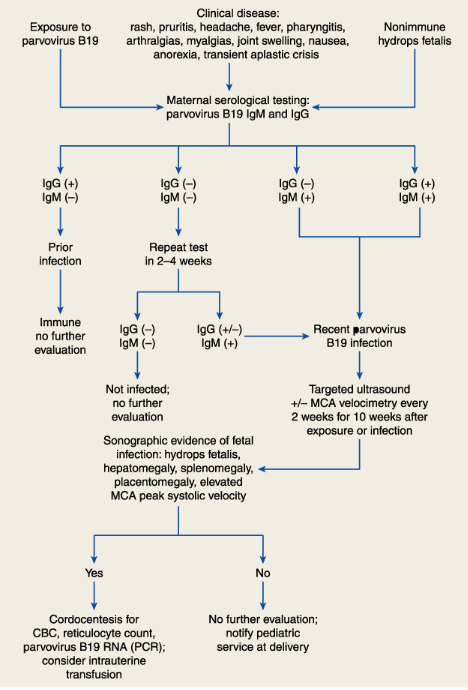
การตรวจ IgG และ IgM ใช้ในการบ่งบอกสถานะของหญิงตั้งครรภ์(6) นอกจากนั้นยังเป็นอีกปัจจัยในการติดตามทารกในครรภ์ที่มีโอกาสติดเชื้อได้ด้วย ดังแสดงในภาพ
แต่การตรวจ IgM จะเริ่มพบได้หลังจากเกิดการติดเชื้อไปแล้ว 7-10 วัน และจะคงอยู่ประมาณ 3-4 เดือน ส่วน IgG จะเริ่มตรวจได้หลังจาก IgM มีการสร้างไม่นานนัก
ปัจจุบันมีการตรวจ viral DNA โดยวิธี PCR ในหญิงที่มีอาการสงสัยการติดเชื้อไวรัสนี้ได้
การตรวจทารกในครรภ์สามารถส่ง viral DNA จาก amniotic fluid หรือ fetal blood จากการทำ cordocentesis ก็ได้(7)
การดูแลรักษา
ในปัจจุบันยังไม่มีการรักษาที่จำเพาะต่อโรค แต่หากตรวจพบหญิงตั้งครรภ์มีการติดเชื้อ ควรได้รับการดูแลโดยการทำ ultrasound เพื่อติดตามค่า MCA PSV เพื่อดูภาวะซีดของทารกในครรภ์ทุกๆ 2 สัปดาห์จนครบ 10 สัปดาห์หลังการติดเชื้อ หากทารกมีภาวะซีดจากการติดเชื้อจะมีข้อบ่งชี้ในการให้เลือดผ่านทางสายสะดือ (fetal transfusion)
การป้องกัน (prevention)
ในปัจจุบันยังไม่มีวัคซีนสำหรับการป้องกันไวรัสชนิดนี้ รวมถึงยาต้านไวรัสที่ใช้ในการรักษาเฉพาะโรคด้วย แนะนำให้อยู่ห่างจากผู้ป่วยที่สงสัยหรือได้รับการวินิจฉัยว่ามีการติดเชื้อนี้
Syphilis(8)
ซิฟิลิส เกิดจากการติดเชื้อ Treponema pallidum เป็นแบคทีเรียชนิดเกลียว สามารถติดเชื้อจากมารดาไปยังทารกได้โดยการแพร่ผ่านรกโดยตรง และขณะคลอดทางช่องคลอดที่มีรอยโรค
อาการแสดงของซิฟิลิส
แบ่งเป็นระยะต่าง ๆ ดังนี้
ซิฟิลิสปฐมภูมิ(primary syphilis) หลังจากได้รับเชื้อจะมีระยะฟักตัวจนเกิดแผล 3 – 90 วัน และจะมีอาการแสดงคือ มีแผลที่อวัยวะสืบพันธุ์ภายนอก บริเวณที่เชื้อเข้าสู่ร่างกาย ลักษณะเป็นแผลริมแข็งสีแดง ตุ่มแข็ง ไม่เจ็บ ขอบยกนูน พื้นแผลเรียบ ไม่มีเลือดออกก่อนจะเกิดแผล มักจะไม่มีหนองที่แผล มักพบต่อมน้ำเหลืองโตที่ขาหนีบทั้ง 2 ข้าง อาการหายไปได้เองใน 2-8 สัปดาห์
ซิฟิลิสทุติยภูมิ(secondary syphilis) เกิดตามหลังระยะปฐมภูมิประมาณ 4-10 สัปดาห์(หลังจากเกิดแผลริมแข็ง) มีเชื้อปริมาณสูงแพร่ไปทั่วร่างกาย และส่งผลกระทบต่อหลาย ๆ อวัยวะ อาการสำคัญคือมีผื่นขึ้นบนผิวหนังตามร่างกายแบบ diffuse macular rash และฝ่ามือและฝ่าเท้าแบบ target-like lesions ต่อมน้ำเหลืองโตทั่ว ๆ
ซิฟิลิสระยะแฝง(latent syphilis) แบ่งเป็น 2 ระยะ
- ระยะแฝงช่วงต้น(Early latent syphilis) คือไม่มีอาการ และมีประวัติได้รับเชื้อมาน้อยกว่า 1 ปี
- ระยะแฝงช่วงปลาย(Late latent syphilis/latent syphilis of unknown duration) คือไม่มีอาการ และมีประวัติได้รับเชื้อมากกว่า 1 ปี หรือไม่ทราบเวลาที่แน่นอนในการติดเชื้อ ในระยะแฝงช่วงปลายจะไม่ถ่ายทอดเชื้อทางเพศสัมพันธ์ แต่ในสตรีตั้งครรภ์สามารถถ่ายทอดเชื้อไปยังทารกได้
ซิฟิลิสระยะตติยภูมิ (tertiary or late syphilis) พบน้อยในสตรีตั้งครรภ์ พบหลังจากระยะปฐมภูมิ ประมาณ 3-10 ปี หรืออาจช้ากว่านี้ ในระยะนี้จะตรวจพบรอยโรคที่ผิวหนัง เยื่อบุ กระดูก ข้อต่อ เอ็น กล้ามเนื้อ ตับ ม้าม มีการทำลายของระบบประสาท(neurosyphilis) และระบบหัวใจหลอดเลือด(vascular syphilis) และอวัยวะอื่น ๆ
การวินิจฉัย
ใช้การตรวจทางห้องปฏิบัติการ ร่วมกับประวัติและการตรวจร่างกาย
- ตรวจหาเชื้อ Treponema pallidum นำน้ำเหลืองจากแผลไปส่องด้วยกล้อง dark field microscope
- การทดสอบแอนติบอดีที่ไม่จำเพาะ(nontreponemal test) ได้แก่ Venereal disease research laboratory (VDRL) และ Rapid plasma reagin (RPR) มีความจำเพาะต่ำ แต่ใช้ในการคัดกรองและติดตามผลการรักษา บอกค่าเป็น titer โดยทั่วไปในระยะทุติยภูมิค่ามักจะมากกว่า 1:32
- การทดสอบแอนติบอดีที่จำเพาะ(treponemal test) ได้แก่ fluorescent treponemal-antibody absorption tests(FTA-ABS), microhemagglutination assay for antibodies to T.pallidum (MHA-TP) หรือ Treponema pallidum passive particle agglutination (TPPA/TPHA) test, Treponama pallidum enzyme immunoassay (TP-EIA), และ Chemiluminescence immunoassay (CIA) ใช้ในการทดสอบเพื่อยืนยันการวินิจฉัย ให้ผลบวกได้นานหลังการรักษาแล้ว จึงไม่ใช้ในการติดตามการรักษา
การรักษา(9)
ซิฟิลิสช่วงต้น(Early infectious stage) ได้แก่ ซิฟิลิสปฐมภูมิ ทุติยภูมิ และ ระยะแฝงช่วงต้น
- Benzathine penicillin G 2.4 ล้านยูนิต IM ครั้งเดียว (ให้แบ่งฉีดเข้ากล้ามเนื้อสะโพกข้างละ 1.2 ล้านยูนิต และอาจลดอาการปวดจากการฉีด โดยผสมกับ 1%lidocaine ที่ไม่มี epinephrine จำนวน 0.5- 1ml) กรณีแพ้ยา penicillin ให้รักษาด้วย penicillin หลัง desensitization หรือ
- Ceftriaxone 1-2 gm IV หรือ IM วันละ 1 ครั้ง นาน 10-14 วัน หรือ
- Erythromycin sterate 500 mg กินวันละ 4 ครั้ง หลังอาหารนาน 14 วัน
Erythromycin ให้ผลการรักษาต่ำ ผ่าน blood brain barrier และ placental barrier ได้ไม่ดี ทารกต้องได้รับการตรวจเลือด และติดตามดูแลรักษาอย่างใกล้ชิด (CDC 2015 ไม่แนะนำให้ใช้ erythromycin แล้ว)
ซิฟิลิสช่วงปลาย(Late infectious stage) ได้แก่ ซิฟิลิสระยะแฝงช่วงปลาย ซิฟิลิสตติยภูมิ ซิฟิลิสระบบหัวใจและหลอดเลือด ยกเว้นซิฟิลิสระบบประสาท
- Benzathine penicillin G รวม 7.2 ล้านยูนิต, แบ่งให้ 3 ครั้ง ครั้งละ 2.4 ล้านยูนิต IM ห่างกันครั้งละ 1 สัปดาห์กรณีแพ้ยา penicillin ให้รักษาด้วย penicillin หลัง desensitization
ซิฟิลิสระบบประสาท(neurosyphilis) และซิฟิลิสที่เข้าดวงตา(ocular syphilis/uveitis)
- Aqueous crystalline penicillin G 3-4 ล้าน ยูนิต IV ทุก 4 ชั่วโมง (18-24 ล้านยูนิตต่อวัน) นาน 10 – 14 วัน หรือใช้ตำรับรอง
- Procaine penicillin G 2.4 ล้านยูนิต IM วันละครั้ง ร่วมกับ Probenecid 500 mg รับประทานวันละ 4 ครั้ง นาน 10–14 วัน
- Ceftriaxone 2 gm IV หรือ IM วันละ 1 ครั้ง นาน 10-14 วัน (ข้อมูลการใช้จำกัด ในสตรีตั้งครรภ์ และนำให้ใช้วิธี desensitization ในกรณีที่แพ้ penicillin)
Zika virus(1)
เป็นการติดเชื้อไวรัส RNA ในวงศ์ Flavivirdae ซึ่งมีพาหะหลัก (definite host) คือยุง นอกจากนั้นยังสามารถติดเชื้อจากสารคัดหลั่งทางเพศสัมพันธุ์ได้ด้วย
อาการแสดงทางคลินิก
ผู้ป่วยที่มีการติดเชื้อ Zika virus มักไม่แสดงอาการ หรือมีอาการเล็กน้อยเช่น ผื่น ไข้ ปวดศีรษะ ปวดเมื่อยตามข้อ หรือ เยื่อบุตาอักเสบได้ ในช่วงแรกของการติดเชื้อ เชื้อไวรัสสามารถตรวจพบได้จากเลือดของผู้ป่วยและเชื้อจะคงอยู่อย่างน้อยสัปดาห์ถึงเดือน ทารกที่ติดเชื้อ
การวินิจฉัย
การวินิจฉัยจะใช้การตรวจหสารพันธุกรรม RNA ของเชื้อจากเลือดหรือปัสสาวะของผู้ป่วย ส่วนการตรวจ IgM antibody assays สามารถใช้ตรวจได้แต่อาจให้ผลบวกในการติดเชื้อไวรัสตัวอื่นในวงศ์ Flavivirus ได้
ในปัจจุบันหญิงตั้งครรภ์ไม่จำเป็นต้องได้รับการตรวจคัดกรองทุกราย แต่ควรได้รับการตรวจคัดกรองในรายที่มีการเดินทางไปในเขตที่มีการแพร่ระบาดของเชื้อ Zika virus
การดูแลรักษาและการป้องกัน
ในปัจจุบันยังไม่มีการรักษาที่จำเพาะต่อโรค รวมทั้งวัคซีนในการป้องกันการติดเชื้อเช่นกัน
Rubella หรือ German measles(1)
หัดเยอรมัน (rubella) เป็น RNA togavirus การติดเชื้อในหญิงไม่ตั้งครรภ์ไม่มีความสำคัญมากนัก แต่หากเกิดการติดเชื้อช่วงไตรมาสแรกของการตั้งครรภ์ (14 สัปดาห์แรก)จะเพิ่มความเสี่ยงต่อการแท้งบุตรและทารกในครรภ์มีความพิการชนิดรุนแรงไวรัสนี้แพร่กระจายผ่านสารคัดหลั่งของ จมูกและคอ หญิงตั้งครรภ์ที่ไม่มีภูมิต้านทานหากสัมผัสกับ สารคัดหลั่งจะมีอัตราการติดเชื้อถึงประมาณร้อยละ 80 ใน ปัจจุบันประเทศพัฒนาแล้วอุบัติการณ์ของการติดเชื้อ หัดเยอรมันระหว่างตั้งครรภ์ลดลงเพราะมีการสร้างภูมิ ต้านทานด้วยวัคซีนแก่หญิงวัยเจริญพันธุ์ตั้งแต่ก่อนตั้งครรภ์
อาการแสดงทางคลินิก
สำหรับหญิงตั้งครรภ์ที่มีการติดเชื้อ อาการมักไม่รุนแรงเช่น ไข้ ผื่นชนิด maculopapular กระจายทั่ว ๆ โดยเริ่มจากใบหน้าลามสู่ลำตัวและแขนขา ปวดตามข้อ ข้ออักเสบ ต่อมน้ำเหลืองบริเวณหัวและคอโต เยื่อบุตาอักเสบอีกประมาณครึ่งหนึ่งของหญิงตั้งครรภ์ที่ติดเชื้อจะไม่มีอาการ
เมื่อมีการติดเชื้อจะมีระยะฟักตัวประมาณ 12 ถึง 23 วัน โดยทั่วไปภาวะเลือดมีไวรัส (viremia) จะเกิดประมาณ 1 สัปดาห์ก่อนผู้ป่วยแสดงอาการ ระยะแพร่เชื้อจะเกิดในช่วงภาวะเลือดมีไวรัส ได้แก่ 1 สัปดาห์ก่อนมีอาการ จนถึง 5 ถึง 7 วันหลังเริ่มมีผื่น
การวินิจฉัยโรค
การวินิจฉัยใช้การตรวจวิเคราะห์วิทยาเซรุ่ม (serology) ดังนี้
- ตรวจหาระดับ IgM antibody ด้วยวิธี enzymelinked immunoassay ซึ่งเริ่มพบ 4 ถึง 5 วันหลังจากเริ่มมีอาการแสดงทางคลินิกและคงอยู่จนถึงประมาณ 6 สัปดาห์หลังจากผื่นเริ่มขึ้น แต่สิ่งที่ต้องระวังคือระดับ IgM antibodyนี้ สามารถเพิ่มขึ้นได้เล็กน้อยอย่างชั่วคราวเมื่อมีการรับเชื้อใหม่ (reinfection)
- ตรวจหาระดับ IgG antibody ซึ่งมีระดับสูงสุดหลังจากเกิดผื่นประมาณ 1 ถึง 2 สัปดาห์ การเพิ่มขึ้นของระดับ antibody อย่างรวดเร็วนี้อาจก่อให้เกิดความซับซ้อนในการวินิจฉัยเว้นแต่ได้เจาะเก็บเลือดครั้งแรกภายใน 2 ถึง 3วันหลังจากเริ่มมีผื่นร่วมด้วย แต่หากไม่มีผลเลือดช่วง 2 ถึง 3วันหลังจากเริ่มมีผื่น การตรวจพบ IgG antibody ไม่สามารถแยกโรคระหว่างการติดเชื้อเฉียบพลันกับการมีอยู่แล้วของภูมิต้านทานได้
- การทดสอบ IgG ที่มีมาก (avidity) โดยหากพบว่ามีระดับสูงแสดงว่าการติดเชื้อที่เกิดขึ้นเกิดมานานอย่างน้อย 2 เดือนที่ผ่านมา
- การแยกเชื้อไวรัส หัดเยอรมัน จากปัสสาวะ เลือด ของเหลวจากบริเวณจมูกร่วมคอ (nasopharynx) และน้ำไขสันหลัง (spinal fluid) ซึ่งพบเป็นระยะเวลาได้ถึง 2 สัปดาห์หลังจากเริ่มมีผื่น
ผลกระทบต่อทารกในครรภ์
การติดเชื้อไวรัสหัดเยอรมันในครรภ์ทำให้ทารกในครรภ์เกิดความพิการอย่างรุนแรงโดยจะสูง ที่สุดหากหญิงตั้งครรภ์มีการติดเชื้อขณะอายุครรภ์น้อยกว่า 12 สัปดาห์แรก (ประมาณร้อยละ 90)(10) จากนั้นจะลดลงเรื่อย ๆ ประมาณร้อยละ 54 และ 25 หากหญิงตั้งครรภ์ติดเชื้อช่วง อายุครรภ์ 13-14 สัปดาห์และช่วงสิ้นสุดไตรมาสที่สอง ตามลำดับ
แนวทางการรักษาและการป้องกัน
ในปัจจุบันยังไม่มีการรักษาอย่างจำเพาะสำหรับการติดเชื้อหัดเยอรมัน
สำหรับหญิงตั้งครรภ์ควรหลีกเลี่ยงการสัมผัสผู้ป่วยที่มีไข้หรือสงสัยว่ามีการติดเชื้อ บุคคลใกล้ชิดที่ต้องสัมผัสผู้ป่วยแนะนำให้ป้องกันเชื้อโรคแพร่กระจายทางละอองเสมหะ และการสัมผัสเยื่อบุตา เยื่อบุปากและจมูก โดยการสวมผ้าปิดปากประมาณ 7 วันหลังเกิดผื่นเพื่อป้องกันการกระจายโรค
การป้องกันปฐมภูมิ (primary prevention) ทำได้โดยแนะนำให้ฉีดวัคซีนแก่หญิงวัยเจริญพันธุ์ทุกรายที่ยังไม่มีภูมิและไม่ตั้งครรภ์(11) ปัจจุบันวัคซีนที่ใช้คือ วัคซีน MMR เนื่องจากวัคซีนเป็นชนิดเชื้อมีชีวิต (attenuated live virus) หญิงที่ได้รับการฉีดวัคซีนต้องมีการคุมกำเนิดเพื่อป้องกันการตั้งครรภ์เป็นเวลา 1 เดือนหลังได้รับ
Cytomegalovirus(1)
CMV เป็นไวรัสชนิด DNA มีรายงานในประเทศพัฒนาแล้วพบว่าร้อยละ 0.2 ถึง 2.2 ของทารกแรกเกิดมีการ ติดเชื้อนี้(12) สำหรับประเทศไทยยังไม่มีรายงานอุบัติการณ์ทารกแรกเกิดติดเชื้อนี้แน่ชัด เมื่อมีการติดเชื้อจะตรวจพบไวรัสได้ ในสารคัดหลั่งทุกชนิดของร่างกาย ดังนั้นจึงแพร่กระจายเชื้อ ระหว่างบุคคลผ่านได้จากการสัมผัสสารคัดหลั่ง
เมื่อมีการติดเชื้อไวรัส CMV ครั้งแรกเชื้อจะซ่อนตัวอยู่ใน ร่างกายอย่างสงบ (latent) แต่สามารถถูกกระตุ้นให้กระจายเชื้อไวรัสออกได้อีกเป็นครั้งคราวคล้ายเชื้อไวรัสกลุ่มเริม โดยการกระตุ้นให้กระจายเชื้ออีกครั้งซึ่งเกิดได้แม้มีระดับ IgG antibody อยู่ในระดับสูงดังนั้นการตรวจพบ ว่าหญิงตั้งครรภ์มี IgG antibody แล้วก็ไม่สามารถป้องกันการกลับมาใหม่ (recurrence) การปลุกฤทธิ์คืน (reactivation) การติดเชื้อซ้ำ (reinfection) และไม่สามารถลดการติดเชื้อของทารกในครรภ์ตลอดจนทารกแรกเกิดได้อย่างสิ้นเชิง ยิ่งไปกว่านั้นการปลุกฤทธิ์คืนของโรคมักไม่มีอาการแต่ยังคงสามารถกระจายเชื้อต่อได้หญิงตั้งครรภ์ที่ไม่มีภูมิต้านทานหากเกิดการติดเชื้อแบบปฐมภูมิ (primary infection) ระหว่างการตั้งครรภ์มีความเสี่ยงสูงสุดที่ทารกในครรภ์จะมีการติดเชื้อ โดยพบทารกติดเชื้อ CMVตั้งแต่กำเนิดประมาณร้อยละ 25 ถึง 60 ของหญิงตั้งครรภ์ที่มีการติดเชื้อปฐมภูมิ โดยพบประมาณร้อยละ36, 40 และ 65 เมื่อมีการติดเชื้อในไตรมาสที่หนึ่ง สองและสามตามลำดับ สำหรับการติดเชื้อซ้ำพบทารกติดเชื้อ CMV ตั้งแต่กำเนิด ร้อยละ 0.15 ถึง 1
อาการแสดงทางคลินิก
หญิงตั้งครรภ์ภูมิคุ้มกันปกติส่วนใหญ่ไม่มีอาการ เพียงประมาณร้อยละ 10 ถึง 15 อาจมีอาการคล้ายกลุ่มอาการ mononucleosis ได้แก่ ไข้ คออักเสบ ต่อมน้ำเหลืองโตและข้ออักเสบได้ ในขณะที่หญิงตั้งครรภ์ที่มีภาวะภูมิคุ้มกันบกพร่อง (immunocompromise) อาจมีอาการที่รุนแรงขึ้นได้
ทารกที่ติดเชื้อ CMV แต่กำเนิดส่วนใหญ่ไม่มีอาการแสดง เพียงร้อยละ 10 แสดงอาการตามระบบได้แก่ ตัวเหลือง ตับม้ามโต จุดเลือดออกขนาดเล็กในชั้นผิวหนัง (petechiae) ผื่นจ้ำเขียวบนผิวหนัง (purpuric rash) เจริญเติบโตในครรภ์บกพร่อง (intrauterine growth retardation) น้ำหนักตัวน้อย หายใจลำบาก (respiratory distress) การอักเสบของคอรอยด์และเรตินา (chorioretinitis) ระดับความสามารถทางสมองและประสาทสั่งการบกพร่อง(mental and motor retardation) และ ภาวะซีดจากเม็ดเลือดแดงแตก (hemolytic anemia)
การวินิจฉัย
ในปัจจุบันยังไม่มีการตรวจคัดกกรองในหญิงตั้งครรภ์ทุกราย เว้นสงสัยการติดเชื้อ เช่น ตรวจพบลักษณะผิดปกติของทารกในครรภ์จากภาพคลื่นเสียงความถี่สูง หรือ หญิงตั้งครรภ์มีอาการคล้าย mononucleosis
การตรวจทางห้องปฏิบัติการเพื่อวินิจฉัยการติดเชื้อมี ดังนี้
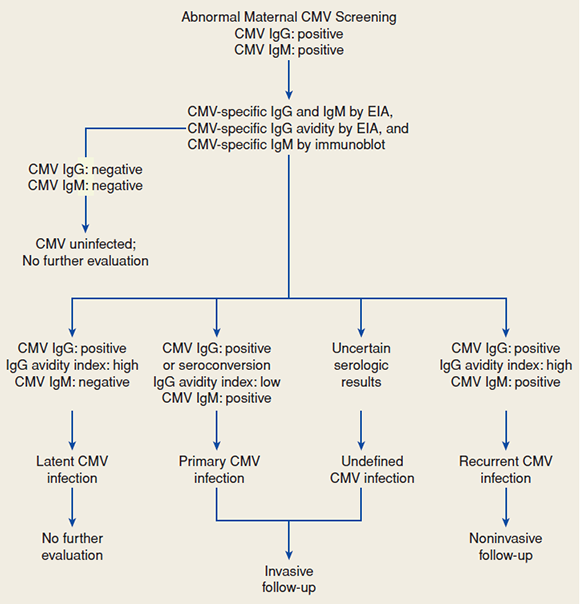
- การตรวจวิเคราะห์ CMV IgG antibody ในเลือดของหญิงตั้งครรภ์ 2 ครั้ง คือช่วง เฉียบพลัน (acute) และช่วงพักฟื้น (convalescent) ตรวจระดับ CMV IgM antibody มีความแม่นยำน้อยเนื่องจากไม่สามารถช่วยวินิจฉัยระยะเวลาที่มีการเปลี่ยนแปลงของระดับภูมิต้านทานได้อย่างถูกต้อง ระดับ CMV IgM อาจเพิ่มสูงขึ้นได้ นานมากกว่า 1 ปี และพบได้ช่วงการปลุกฤทธิ์คืนหรือการติดเชื้อซ้ำโดยเชื้อสายพันธุ์ใหม่
- การตรวจระดับ specific CMV IgG avidity มีประโยชน์อย่างมากในการยืนยันการติดเชื้อแบบปฐมภูมิ ระดับ anti-CMV IgG avidity สูง บ่งชี้ว่ามีการติดเชื้อแบบปฐมภูมิ ของหญิงตั้งครรภ์มาก่อนหน้าการเก็บเลือดตรวจมากกว่า 6 เดือน
- การเพาะเชื้อไวรัสมีส่วนช่วยได้ แต่ใช้เวลาอย่างน้อย 21 วันในการรายงานผลว่าเพาะเชื้อไม่ขึ้น
- วิธีตรวจมาตรฐานเพื่อวินิจฉัยการติดเชื้อ CMV แต่กำเนิด ได้แก่การเพาะเชื้อไวรัส การตรวจ CMV nucleic acid amplification จากน้ำคร่ำซึ่งมีความไวร้อยละ 70 ถึง 99 โดยความไวสูงสุดเมื่อทำการเจาะเยื่อถุงน้ำคร่ำ (amniocentesis) เพื่อเก็บน้ำคร่ำอย่างน้อย 6 สัปดาห์หลังหญิงตั้งครรภ์ติดเชื้อ แต่อย่างไรก็ตามหากได้ผลลบไม่ สามารถตัดการติดเชื้อของทารกในครรภ์ได้ทั้งหมด และอาจต้องเจาะซ้ำหากสงสัยการติดเชื้อมากหรือการเจาะหลอด เลือดสายสะดือ (cordocentesis) เพื่อนำเลือดทารกตรวจ CMV Ig M antibody หรือเพาะเชื้อไวรัสตรวจ CMV nucleic acid amplification
การดูแลรักษา
ในปัจจุบันยังไม่มีวัคซีนในการป้องกันการติดเชื้อนี้ ในคนไข้ที่มีการติดเชื้อในปัจจุบันจะเป็นการรักษาตามอาการ ยังไม่มียที่ใช้จำเพาะ มีงานวิจัยที่ศึกษาการใช้ยา ganciclovir กินและ valacyclovir แบบฉีด พบว่าได้ผลดีต่อทารกในครรภ์ แต่ในปัจจุบันยังไม่มีข้อเสนอแนะที่ชัดแจนในการใช้ยารักษา(13)
Herpes simplex virus
เกิดจากการติดเชื้อ Herpes simplex virus ซึ่งมี 2 ชนิด ชนิดที่ 1 มักทำให้เกิดการติดเชื้อบริเวณปาก หรือลำตัวเหนือสะดือ ชนิดที่ 2 มักทำให้เกิดการติดเชื้อบริเวณอวัยวะสืบพันธ์ภายนอก โดยที่ เชื้อ herpes simplex virus ชนิดที่ 1 จะมีความสัมพันธ์กับการติดเชื้อทางเพศสัมพันธุ์น้อยกว่าชนิดที่ 2 รวมทั้งในผู้ป่วยใหม่ที่มีการติดเชื้อ herpes simplex virus มักเกิดจากเชื้อชนิดที่ 1 มากกว่าด้วย
อาการแสดงทางคลินิก
- การติดเชื้อปฐมภูมิ(first episode primary infection) คือการติดเชื้อครั้งแรก โดยไม่มีหลักฐานว่าเคยติดเชื้อมาก่อน ระยะฟักตัว 6-8 วัน มีไข้อ่อนเพลีย ปวดเมื่อย และมีตุ่มน้ำเจ็บคัน อาการหายเองได้ใน 2-4 สัปดาห์
- first episode non-primary infection คือ มีอาการครั้งแรก แยกเชื้อเริมได้จากรอยโรค แต่มี antibody ต่อเชื้อเริมคนละสายพันธุ์ ช่วยให้อาการไม่รุนแรง
- การติดเชื้อซ้ำ(Reactivation หรือ Recurrence) อาการค่อนข้างน้อย หายเร็วกว่า มักเป็นบ่อยในช่วง 1 ปีแรกของการติดเชื้อเริม
การติดเชื้อจากแม่สู่ลูก
สามารถเกิดการติดเชื้อได้จาก 3 ทางคือ
- ติดเชื้อจากรอยโรคบริเวณอวัยวะเพศในระหว่างคลอด รวมถึงการที่เชื้อมีการกระจายเข้าสู่โพรงมดลูกหลังมีน้ำเดิน ร้อยละ 85
- ติดเชื้อระยะหลังคลอด พบได้น้อย ร้อยละ 10
- ติดเชื้อขณะอยู่ในครรภ์ ร้อยละ 5
อัตราการติดเชื้อสู่ทารกพบ 0.5-1 ใน 10000 ทารกแรกคลอด โดยที่ทารกที่มีการติดเชื้อ ร้อยละ 40 จะมีการติดเชื้อเฉพาะที่ เช่น ตา ผิวหนัง หรือปาก เป็นต้น ต่อมาจะเกิด encephalitis ร้อยละ 30 และสุดท้ายจะเกิดการติดเชื้อทั่วร่างกาย ร้อยละ 32
การวินิจฉัย(8, 9)
ในปัจจุบันยังไม่มีการตรวจคัดกรอบเชื้อ herpes ในหญิงตั้งครรภ์ทุกราย หากมีอาการจึงจะมีการตรวจเพิ่มเติม โดยเอาสารคัดหลังบริเวณที่มีรอยโรคไปทำการตรวจ PCR หรือเพาะเชื้อ โดย PCR มีความไวมากกว่าการเพาะเชื้อ
การตรวจ serological assay สามารถใช้ได้ โดย IgG จะตรวจพบหลังมีการติดเชื้อครั้งแรกภายใน 1-2 สัปดาห์
การดูแลรักษา
สำหรับการติดเชื้อและมีอาการครั้งแรก
- Acyclovir 400 mg รับประทานวันละ 3 ครั้ง นาน 7–10 วัน หรือ
- Valacyclovir 1 g รับประทานวันละ 2 ครั้ง นาน 7–10 วัน
กรณีการติดเชื้อซ้ำ
- Acyclovir 400 mg รับประทานวันละ 3 ครั้ง นาน 5 วัน หรือ
- Acyclovir 800 mg รับประทานวันละ 2 ครั้ง นาน 5 วัน หรือ
- Acyclovir 800 mg รับประทานวันละ 3 ครั้ง นาน 2 วัน หรือ
- Valacyclovir 500 mg รับประทานวันละ 2 ครั้ง นาน 3 วัน หรือ
- Valacyclovir 1 gm รับประทานวันละ 1 ครั้ง นาน 5 วัน
การให้ยาเพื่อป้องกันการกลับเป็นซ้ำ(suppressive therapy) ในช่วงท้ายของการตั้งครรภ์ ลดโอกาสที่จะต้องผ่าตัดคลอดทางหน้าท้องได้ โดยลดโอกาสการกลับเป็นซ้ำของโรค ให้ยาดังนี้ (แนะนำให้เริ่มตั้งแต่อายุครรภ์ 36 สัปดาห์)
- Acyclovir 400 mg รับประทาน 3 ครั้งต่อวัน หรือ
- Valacyclovir 500 mg รับประทาน 2 ครั้งต่อวัน
เอกสารอ้างอิง
- Williams JW. infectious disease. 2013(64):1239.
- JP D. Sources of Toxoplasma gondii infection in pregnancy. Until rates of congenital toxoplasmosis fall, control measures are essential. BMJ 321:127. 2000.
- SYROCOT (Systematic Review on Congenital Toxoplasmosis) Study Group. a metaanalysis of individual patients’ data Lancet. 2007;369:115.
- Sterkers Y PF, Albaba S, et al. Novel interpretation of molecular diagnosis of congenital toxoplasmosis according to gestational age at the time of maternal infection. J Clin Microbiol. 2012;3944, 2012.
- Hotop A HH, Gross U. Efficacy of rapid treatment initiation following primary Toxoplasma gondii infection during pregnancy. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2012.
- Bonvicini F PC, Salfi NC, et al. Gestational and fetal outcomes in B19 maternal infection: a problem of diagnosis. J Clin Microbiol. 2011;49(10):3514.
- Weiffenbach J BR, Gloning KP, et al. Serological and virological analysis of maternal and fetal blood samples in prenatal human parvovirus B19 infection. The Journal of infectious diseases. 2012;205(5):782.
- Cunningham FG LK, Bloom SL, Spong CY, Dashe JS, Hoffman BL, et al. sexual transmitted disease. Williams obstetrics 24th edition. 2013.
- Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR Recomm Rep 2015. 2015;64(RR-03):1-137.
- Zimmerman LA RS. Rubella (German measles). Harrison’s Principles of Internal Medicine, 18th edNew York, McGraw-Hill. 2012.
- Coonrod DV JB, Boggess KA, et al. The clinical content of preconception care: infectious diseases in preconception care. American journal of obstetrics and gynecology. 2008.
- Kenneson A CM. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007(17:253).
- Kimberlin DW LC, Sanchez PJ, et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: a randomized, controlled trial. J Pediatr 2003.


