Basic Cell Biology and Cancer Genetics
รัญชิดา สุวรรณสาร
อาจารย์ที่ปรึกษา: รศ. นพ. กิตติภัต เจริญขวัญ
The cell cycle (วัฏจักรของเซลล์)
แบ่งออกได้เป็น 4 ระยะหลัก (ดังรูปที่ 1) ได้แก่
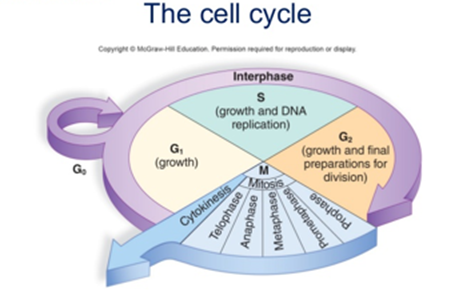
รูปที่ 1 แสดงวัฏจักรของเซลล์
แหล่งข้อมูล Mader SS, Windelspecht M. Human Biology. 14th edition. New York: McGraw-Hill Education; 2016.
1. G1 phase (ระยะเวลารวม 8-100 ชั่วโมง)
ในระยะนี้จะเกิดการสังเคราะห์เอนไซม์และโปรตีนที่จำเป็นต่อการสร้าง DNA ซึ่งกระบวนการนี้ถูกควบคุมและชักนำเซลล์เข้าสู่ S phase ซึ่งเป็นระยะต่อไป ด้วย G1 cyclin-dependent kinase-cyclin complexes (G1CdkC)
2. S phase (DNA synthesis)
เป็นระยะแห่งการสังเคราะห์ DNA โดย CdkC จะควบคุมให้เกิดการเพิ่มจำนวนของ DNA เพียง 1 ครั้ง ส่งผลให้การสร้างโครโมโซมในระยะนี้เพิ่มจากเดิมเป็น 1 เท่าตัวเท่านั้น
3. G2 phase
เกิดการสร้างโปรตีนและ RNA เพิ่มเติมที่จำเป็นต่อการแบ่งเซลล์ต่อไป นอกจากนี้มีการแก้ไขซ่อมแซม DNA ที่จำลองผิดพลาดจาก S phase ซึ่งหากเซลล์มีความบกพร่องในการซ่อมแซม DNA ในระยะนี้อาจส่งผลให้เกิดมะเร็งต่อไปได้
ระยะ G1 S และ G2 รวมเรียกว่า interphase
4. M phase (mitosis)
เป็นระยะแห่งการแบ่งตัวของโครโมโซมและนิวเคลียส ซึ่งในระยะนี้ DNA จะถูกแบ่งออกให้เซลล์ลูก (daughter cells) ทั้ง 2 เท่าๆกัน โดย mitosis ประกอบด้วย 5 ระยะดังนี้
4.1 Prophase – ในนิวเคลียสมีโครโมโซมที่เพิ่มจำนวนแล้วจากระยะ interphase แต่ละโครโมโซมประกอบด้วย sister chromatids ที่เชื่อมกันอยู่ โดย CdkC จะชักนำให้โครโมโซมรวมตัวกันและเห็นชัดขึ้น
ในไซโตพลาสซึมมี mitotic spindles อยู่ระหว่างเซนโทรเมียร์ทั้งสอง
4.2 Prometaphase – เยื่อหุ้มนิวเคลียสสลายไป โครโมโซมสามารถเชื่อมกับ mitotic spindles ที่อยู่ในไซโตพลาซึมได้
4.3 Metaphase – โครโมโซมเกิดการเรียงตัวกันกันเป็นแถวที่กึ่งกลางของเซลล์ แต่ละ sister chromatid เชื่อมกับ mitotic spindles ที่อยู่ฝั่งตรงข้ามกัน
4.4 Anaphase – anaphase promoting complex (APC) จะทำให้ sister chromatid แยกขาดออกจากกันไปอยู่ที่ขั้วเซลล์
4.5 Telophase – โครโมโซมอยู่ที่ขั้วเซลล์ เยื่อหุ้มนิวเคลียสเริ่มรวมตัวกันอีกครั้ง เกิดเป็นนิวเคลียส 2 อันถือเป็นสิ้นสุดระยะ mitosis
นอกจากนี้ยังมีระยะ cytokinesis ซึ่งเป็นช่วงที่มีการแบ่งตัวของไซโตพลาซึมโดยอาศัย contractile ring ของ actin และ myosin เกิดเป็น daughter cells 2 เซลล์ แต่ละเซลล์มี 1 นิวเคลียส(1, 2)
โดยหลังระยะ mitotic phase เซลล์นั้นสามารถออกจากวัฏจักรของเซลล์และอยู่ใน G0 phase ซึ่งอาจใช้เวลาเป็นวัน หรือสัปดาห์ หรือไม่กลับเข้าสู่วัฏจักรของเซลล์อีกเลยและไม่เกิดการแบ่งตัวอีกต่อไป
ตามปกติแล้ววัฏจักรเซลล์ของมนุษย์มักเสร็จสิ้นภายใน 24 ชั่วโมง
เซลล์ในวัฏจักรสามารถแบ่งออกได้เป็น 3 ชนิดดังนี้
- Terminally differentiated cell – เป็นเซลล์ที่พัฒนาเป็นชนิดจำเพาะแล้ว และไม่สามารถกลับเข้าสู่วัฏจักรของเซลล์ได้อีกต่อไป เช่น เซลล์เม็ดเลือดแดง เซลล์กล้ามเนื้อลาย เซลล์ประสาท เป็นต้น
- Quiescent cell – เป็นเซลล์ที่อยู่ในระยะ G0 ซึ่งสามารถถูกกระตุ้นอย่างเหมาะสมให้กลับเข้าสู่วัฏจักรของเซลล์ได้
- Dividing cell – เป็นเซลล์ที่ยังอยู่ในวัฏจักรของเซลล์ สามารถพบเหล่านี้ได้ที่ปากมดลูก ผิวหนัง ระบบทางเดินอาหาร
โดยทั่วไปแล้วเซลล์ในร่างกายแบ่งตัวแบบ mitosis ซึ่งเมื่อการแบ่งเซลล์สิ้นสุดลงแล้วจะได้โครโมโซม 2 ชุด (diploid) อย่างไรก็ตามเซลล์ยังมีการแบ่งตัวแบบ meiosis ซึ่งเซลล์เหล่านี้จะประกอบด้วยโครโมโซมเพียง 1 ชุด (haploid) การแบ่งตัวในลักษณะนี้จะพบได้ในเซลล์ที่ใช้ในการสืบพันธุ์ ได้แก่ sperm และ egg ความแตกต่างของการแบ่งตัวแบบ mitosis และ meiosis ดังแสดงในรูปที่ 2 (1)
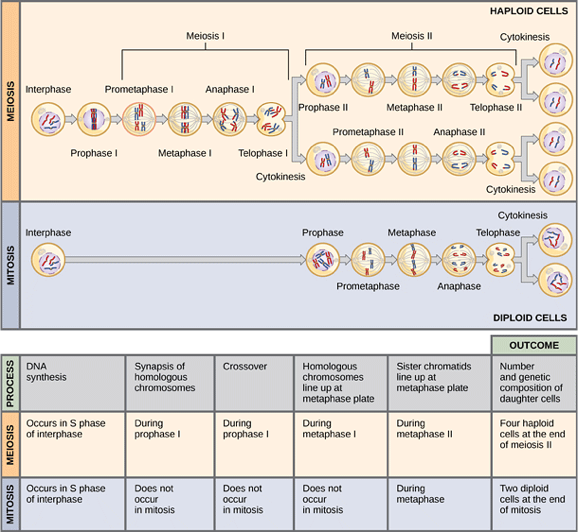
รูปที่ 2 แสดงการแบ่งเซลล์แบบ mitosis และ meiosis
แหล่งข้อมูล Openstax. Meiosis [Internet]. 2014 [cited 1 September 2017]. Available from:ttp://cnx.org/contents/d50f33f7-a993-4f12-b841-7d0db2a4f556@4
การเพิ่มจำนวนของเซลล์นั้นเกิดจากการควบคุมของยีนต่างๆในแต่ละระยะของเซลล์ โดยอาศัยการกระตุ้นของ cell division cycle (cdc) gene ซึ่งในวัฏจักรของเซลล์นั้นจะมีจุดตรวจสอบ (checkpoint) อยู่ 2 จุด คือ
- จุดรอยต่อระหว่าง G1 และ S phase – เซลล์ที่ปกติเท่านั้นที่จะสามารถเข้าสู่กระบวนการแบ่งตัวและเซลล์ที่ผิดปกติจะถูกกำจัดไปด้วยวิธี apoptosis ซึ่ง Cdk2-cyclin E complex จะทำหน้าที่กระตุ้นให้ เซลล์ออกจากระยะ G1 เข้าสู่ระยะ S ในทางตรงข้ามโปรตีน Rb, p53, p14, p15, p21 มีหน้าที่ยับยั้งไม่ให้เซลล์แบ่งตัว
- จุดรอยต่อระหว่าง G2 และ M phase – เกิดการซ่อมแซม DNA ที่บกพร่องให้สมบูรณ์ก่อนเกิดกระบวนการ mitosis ต่อไป (1, 3)
ยีนสามารถตอบสนองได้แบบ early-response หรือ delayed-response และทำหน้าที่เป็น nuclear transcription factors ทั้งนี้จะส่งผลให้เกิดการกระตุ้นยีนตัวอื่นๆต่อไปจนทำให้วัฏจักรเซลล์เป็นไปอย่างสมบูรณ์ ตัวอย่าง early response genes ได้แก่ c-Jun, c-Fos ซึ่งจะไปกระตุ้น delayed-response gene เช่น E2F ต่อไป
E2F นั้นถูกควบคุมโดยโปรตีน retinoblastoma (Rb) โดย Rb จะจับกับ E2F ทำให้ E2F ไม่สามารถกระตุ้นเซลล์ให้เกิดกระบวนการ transcription ต่อไปได้
อย่างไรก็ตาม Cdk4-cyclin D, Cdk6-cyclin D และ Cdk2-cyclin E complex จะกระตุ้นให้เกิด Rb phosphorylation ทำให้ Rb protein ไม่สามารถยับยั้ง E2F ได้ ส่งผลให้เกิดกระบวนการ transcription ทำให้เซลล์เข้าสู่ S, G2 และ M phase ต่อไป และเมื่อเซลล์เสร็จสิ้นกระบวนการ mitosis แล้ว Cdk-cyclin ต่างๆจะลดลงส่งผลให้เกิด Rb dephosphorylation ทำให้ E2F ถูกยับยั้งอีกครั้งในช่วงระยะแรกของ G1 phase ตามแสดงในรูปที่ 3
นอกจากนี้หากมีความเสียหายของ DNA แล้ว เซลล์จะตอบสนองด้วยการเพิ่มระดับของ p53 ที่มีหน้าที่กระตุ้น p21 เพื่อไปยับยั้งการทำงานของ Cdk2-cyclin E complex เพื่อซ่อมแซมเซลล์หรือกระตุ้น apoptosis ในกรณีที่ DNA มีความเสียหายมากเกินไป(1, 3)
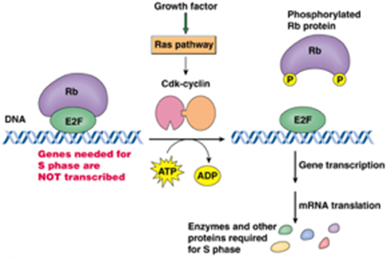
รูปที่ 3 แสดงกลไกของยีนที่ส่งผลต่อการกระตุ้นและการยับยั้งวัฏจักรของเซลล์
แหล่งข้อมูล Hardin J, Bertoni GP. Becker’s World of the Cell, Books a la Carte Edition. 9th Edition. London: Pearson; 2015.
จากกลไกข้างต้นจะเห็นว่า Cdk complex เป็นตัวสำคัญในการควบคุมวัฏจักรของเซลล์ ดังนั้นหากมีการทำงานของ Cdk complex ที่มากเกินไปอาจก่อให้เกิดเซลล์มะเร็งได้ ด้วยเหตุนี้หนึ่งในวิธีการรักษามะเร็งจึงรวมถึงการยับยั้งการทำงานของ Cdk complex เช่น Cdk4 inhibitor P1446A-05 มีหน้าที่ยับยั้ง Cdk4 ไม่ให้เซลล์ออกจากระยะ G1 เพื่อเข้าสู่ระยะ S ได้
วัฏจักรของเซลล์ยังถูกควบคุมด้วยอีกกลไกที่สำคัญ กล่าวคือในช่วงที่เซลล์เข้าสู่ระยะ S เกิดเป็น Cdk2-cyclin A complex ซึ่งส่งเสริมให้เกิดการสังเคราะห์ DNA นอกจากนี้โปรตีน p34 cdc2 จะก่อให้เกิด mitotic promoting factor (MPF) เพื่อให้เซลล์เกิดการ mitosis และการเกิด mitosis ต้องอาศัยการกระตุ้นของ cdc gene ที่ G2-M checkpoint ซึ่งเป็นเวลาที่เซลล์จะซ่อมแซม DNA ที่สร้างมาอย่างบกพร่อง
เซลล์ปกติจำเป็นต้องมีการรักษาสมดุลระหว่างการสร้างและการตายผ่านโดยกระบวนการ apoptosis หากการสร้างเซลล์มากกว่าการ apoptosis จะก่อให้เกิด cell hyperplasia ในทางกลับกันหากมีการ apoptosis มากกว่าการสร้างเซลล์ จะนำไปสู่ cell atrophy ซึ่งการเกิด apoptosis ต้องอาศัยพลังงานและกระตุ้นจากยีน หรือปัจจัยอื่นๆ เช่น ฮอร์โมน การฉายแสง การรับเคมีบำบัด หรือ reactive oxygen species ซึ่งกระบวนการ apoptosis นี่ถูกควบคุมโดยยีน TP53 ในขณะที่ BCL2 ซึ่งเป็น oncogene ทำหน้าที่ยับยั้ง apoptosis
จะเห็นได้ว่าวัฎจักรของเซลล์นั้นมีความซับซ้อน หากมีความไม่สมดุลหรือการทำงานที่บกพร่องของยีนที่กล่าวมาข้างต้นก็จะก่อให้เกิดเซลล์มะเร็งต่อไปได้ (1, 3)
Cancer genetics
ตามทฤษฎีของ Knudson ที่ว่าด้วยการเกิดมะเร็งนั้น ได้อธิบายว่าต้องเกิด “two-hit mutation” กล่าวคือต้องเกิดการ mutation ของ genome ทั้ง 2 allele ที่เข้าคู่กัน โดยเป็น genome ที่มีหน้าที่ควบคุมการแบ่งตัวของเซลล์ ซึ่งทฤษฎีนี้สามารถใช้อธิบายทั้งในกรณี hereditary และ non-hereditary cancer ใน heriditary cancer การเกิด mutation ครั้งที่ 1 จะเกิดกับ genome ของทุกเซลล์ ดังนั้นการเกิด mutation ครั้งที่ 2 ต้องเกิดใน allele ที่คู่กันเท่านั้นจึงจะเกิดเป็นเซลล์มะเร็งได้ อย่างไรก็ตามในกรณีของ non – hereditary cancer การเกิด mutation จะเกิดขึ้นได้เอง และการเกิด mutation ครั้งที่ 2 ต้องเกิดใน allele ที่เข้าคู่เช่นกัน (1-4)
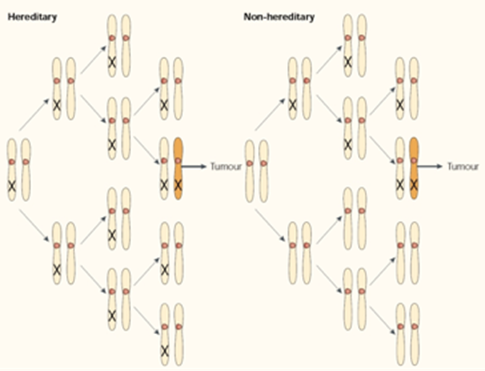
รูปที่ 4 แสดง Knudson’s hypothesis
แหล่งข้อมูล Knudson AG. Two genetic hits (more or less) to cancer. Nature Review Cancer. 2001; 1(2): 157-162.
Tumor-related genes
ปัจจุบันมีการค้นพบยีนที่เกี่ยวข้องกับการเกิดมะเร็ง โดยสามารถแบ่งได้เป็น 3 ประเภทหลัก ดังนี้
1. Gatekeeper genes – ทำหน้าที่ควบคุมการแบ่งจำนวนและการเพิ่มจำนวนของเซลล์ โดยแยกได้เป็น 2 ชนิด ได้แก่
A. Proto-oncogenes – เป็นยีนที่กระตุ้นให้เกิดการแบ่งเซลล์ ยับยั้งการเกิด apoptosis ซึ่งหากเกิดการ mutation ยีนเหล่านี้อาจก่อให้เกิดเซลล์มะเร็งได้
B. Tumor-supressor genes – เป็นยีนที่ยับยั้งไม่ให้เซลล์เพิ่มจำนวนมากเกินไป และในบางกรณีสามารถกระตุ้นกระบวนการ apoptosis ได้ การเกิด mutation ของยีนกลุ่มนี้สามารถนำไปสู่การเกิดเซลล์มะเร็งได้เช่นกัน
2. Caretaker genes – ทำหน้าที่ซ่อมแซม DNA และเพิ่มความมั่นคง ยกตัวอย่างเช่น MLH1, MSH2, MSH6
3. Landscaper genes – ทำหน้าที่ควบคุม microenvironment ต่างๆเกี่ยวข้องกับการเจริญเติบโตของเซลล์ (1, 3, 5)
นอกจากยีนที่ผิดปกติแล้ว ปัจจุบันยังมีการค้นพบว่า การติดเชื้อไวรัสสามารถก่อให้เกิดมะเร็งได้เช่นกัน ยกตัวอย่างเช่น Epstein Barr-virus ที่เพิ่มความเสี่ยงต่อการเกิด nasopharyngeal carcinoma และ lymphoma รวมไปถึง papillomavirus บางชนิดที่พบว่ามีความเกี่ยวข้องกับการเกิด cervical และ oropharyngeal squamous cell carcinoma นอกจากนี้การติดเชื้อไวรัส hepatitis B แบบเรื้อรังสามารถเพิ่มความเสี่ยงต่อการเกิด hepatocellular carcinoma ได้ (3, 4)
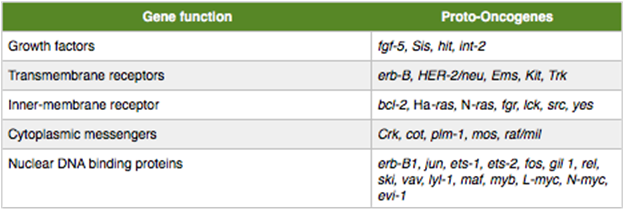
ตารางที่ 1 แสดงตัวอย่างของ Proto-oncogenes และ gene functions(1)
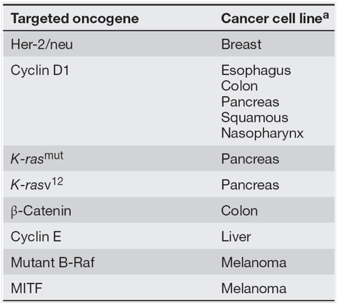
ตารางที่ 2 แสดงตัวอย่าง proto-oncogenes และมะเร็งที่เกี่ยวข้อง
แหล่งข้อมูล Chial H. Proto-oncogenes to Oncogenes to Cancer. Nature Education. 2008; 1(1):33.
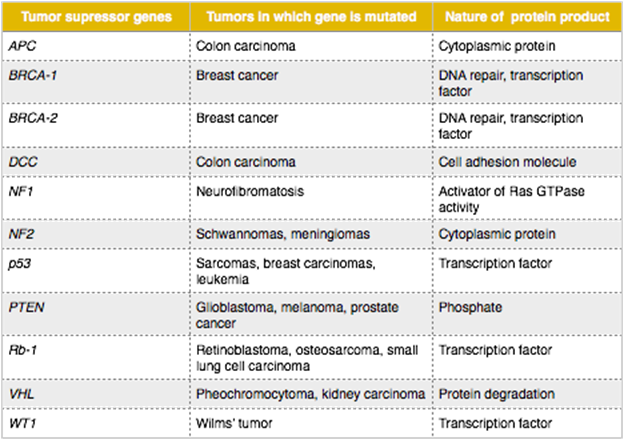
ตารางที่ 3 แสดง tumor suppressor gene และมะเร็งที่เกี่ยวข้อง (6)
มะเร็งที่ถ่ายทอดทางพันธุกรรม (Hereditary cancer)
มะเร็งบางชนิดเกิดขึ้นจากการถ่ายทอดทางพันธุกรรม ยกตัวอย่างเช่น มะเร็งรังไข่ มะเร็งเยื่อบุโพรงมดลูก เป็นต้น โดยการจะเกิดมะเร็งได้ต้องอาศัยการเกิด mutation ด้วย ลักษณะพิเศษของมะเร็งกลุ่มนี้คือ การวินิจฉัยได้ตั้งแต่อายุยังน้อย และมีประวัติครอบครัวที่เป็นมะเร็งมาก่อน
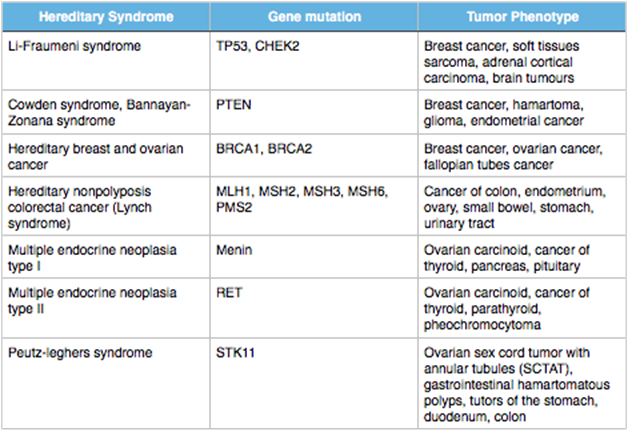
ตารางที่ 4 ตัวอย่างของ hereditary cancer syndrome(1)
ปัจจัยอื่นๆที่มีผลต่อการเกิดมะเร็ง
1. อายุ
อายุที่มากขึ้นมีผลต่อการเกิดมะเร็ง โดยทั่วไปมีการวินิจฉัยมะเร็งมากถึง 50% ในผู้ที่อายุมากกว่า 75 ปี อธิบายได้จากโอกาสการเกิด mutation ที่เพิ่มมากขึ้นจากอายุที่มากขึ้น
2. การสูบบุหรี่
การสูบบุหรี่สัมพันธ์กับการเกิดมะเร็งปอด ซึ่งต้องสูบในปริมาณที่มากพอและระยะเวลาที่นานพอ อีกทั้งการสูบบุหรี่ยังสัมพันธ์กับการเกิดมะเร็งปากมดลูก โดยมีสมมติฐานว่า การสูบบุหรี่จะส่งผลให้เกิดการเสียหายของ DNA ทำให้มีการเปลี่ยนแปลงของเซลล์ตามมา นอกจากนี้การสูบบุหรี่ทำให้ human papilloma virus (HPV) ไปยับยั้งการทำงานของยีน fragile histidine triad (FHIT) ซึ่งทำหน้าที่เป็น tumor suppressor gene อีกด้วย การสูบบุหรี่ยังทำให้ Langerhan cells ซึ่งเป็นเซลล์ระบบภูมิคุ้มกัน มีจำนวนลดลง ส่งผลให้เกิดโอกาสการติดเชื้อ HPV มากขึ้น
3. การได้รับรังสี (radiation)
การได้รับรังสีเพิ่มความเสี่ยงให้เกิดมะเร็งได้ เนื่องจากการได้รับรังสีสามารถทำให้เกิดการเสียหายของ DNA ทำให้มีการเปลี่ยนแปลงของเซลล์จนเกิดเป็นมะเร็งได้
4. ระบบภูมิคุ้มกัน
ตามปกติแล้วระบบภูมิคุ้มกันทำหน้าที่ในการเฝ้าระวังเซลล์ที่มีความเปลี่ยนแปลงผิดปกติ การทำงานที่บกพร่องของระบบภูมิคุ้มกันจึงมีผลต่อการเกิดมะเร็งได้ เช่น ในผู้ป่วยที่ได้รับการปลูกถ่ายไตหรือติดเชื้อ HIV มีความเสี่ยงเป็นมะเร็งปากมดลูกมากกว่าคนปกติ ผู้ป่วยที่ได้รับเคมีบำบัดมีความเสี่ยงต่อการเกิดมะเร็งเช่นกัน
5. การรับประทานอาหาร
การรับประทานอาหารไขมันสูงเพิ่มความเสี่ยงต่อการเป็นมะเร็งเต้านมและมะเร็งลำไส้ ขณะที่การรับประทานอาหารที่มีไฟเบอร์สูงสามารถลดโอกาสการเกิดมะเร็งลำไส้ได้ อย่างไรก็ตามการขาด folic acid รวมถึงการขาดวิตามินเอและซีเพิ่มความเสี่ยงต่อการเกิดมะเร็งปากมดลูกได้(1, 6, 7)
สรุป
การแบ่งตัวของเซลล์นั้นมีความซับซ้อนและต้องอาศัยยีนและโปรตีนชนิดต่างๆในการควบคุม การทำงานของยีนที่บกพร่องอาจส่งผลให้เซลล์แบ่งตัวผิดปกติและอาจก่อให้เกิดมะเร็งต่อไปได้ การเข้าใจในธรรมชาติของการแบ่งตัวของเซลล์และกลไกการเกิดมะเร็งจึงเป็นโอกาสที่ดีในการนำไปพัฒนาวิธีการรักษามะเร็งชนิดต่างๆต่อไป
เอกสารอ้างอิง
- Berek JS. Berek & Novak’s gynecology. 15th ed. Philadelphia: Lippincott Williams & Wilkins; 2012.
- Alberts B, Bray D, Hopkin K, Johnson AD, Lewis J, Raff M, et al. Essential cell biology. 4th ed. New York: Garland Science; 2014.
- Strachan T, Godship J, Chinnery P. Genetics and genomic in medicine. . New York:: Garland Science; 2015.
- Lodish H, Berk A, Zipursky L, Matsudaira P, Baltimore D, Darnell J. Molecular Cell Biology. 4th ed. New York: New York: W. H. Freeman; 2000.
- Lim W, Mayer B, Pawson T. Cell signalling principles and mechanisms. New York: Garland Science; 2015.
- Latchman D. Gene control. 2nd ed. New York: Garland Science; 2015.
- Peet A, Lieberman MA, Marks A. Mark’s Essentials of Medical Biochemistry A Clinical Approach. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 2015.


