ภาวะเลือดออกทางช่องคลอดในหญิงวัยก่อนเจริญพันธุ์
ภาวะเลือดออกทางช่องคลอดในหญิงวัยก่อนเจริญพันธุ์
พันธุ์ชิตา พงศ์ศุภสมิทธิ์
ทวิวัน พันธศรี
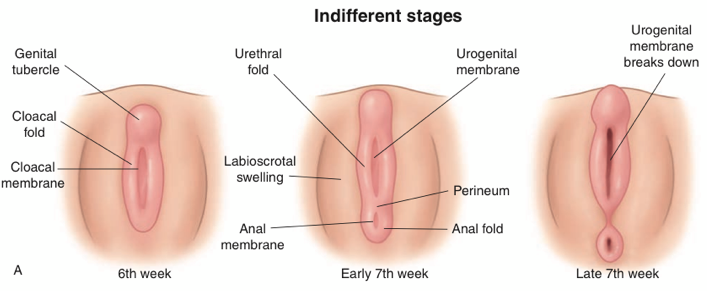
วัยก่อนเจริญพันธุ์ (Prepubertal age) คือ ช่วงเวลาก่อนมีการพัฒนาของลักษณะเฉพาะทางเพศของแต่ละเพศ (Secondary sex characteristic) และ ก่อนเริ่มมีความสามารถในการสืบพันธุ์
ภาวะเลือดออกทางช่องคลอด
ภาวะเลือดออกทางช่องคลอด ก่อนที่จะเข้าสู่ช่วงการมีประจำเดือนครั้งแรกซึ่งไม่ควรเกิดก่อนอายุ 9 ปี จำเป็นต้องได้รับการประเมิน อย่างเหมาะสม ซึ่งจำเป็นต้องเข้าใจถึงการเปลี่ยนแปลงของ hormone เมื่อเข้าสู่ช่วงวัยเจริญพันธุ์ (1-3) โดยการมีประจำเดือนครั้งแรก (Menarche) มักเกิดในช่วงวัยรุ่น ซึ่งเต้านมจะมีพัฒนาการอยู่ใน แทนเนอร์ระยะที่ 3-4
|
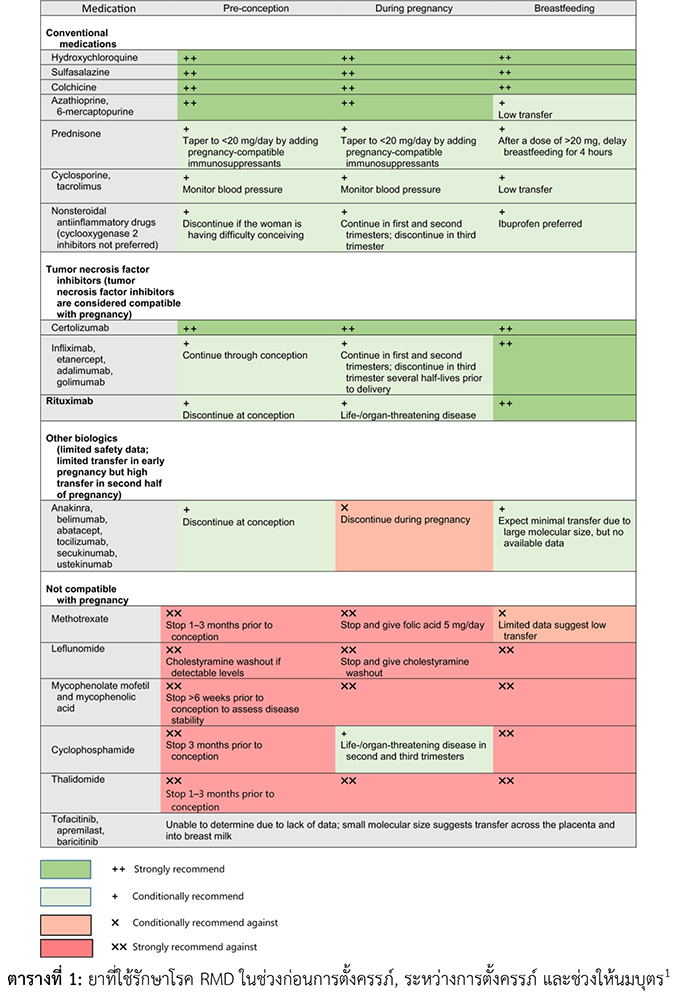
สาเหตุของภาวะเลือดออกทางช่วงคลอดในวัยก่อนเจริญพันธุ์ |
|
อวัยวะเพศภายนอก และ ปากช่องคลอด (Valvar and exernal) |
|
อวัยวะเพศภายนอก และ ปากช่องคลอดอักเสบ (Vulvitis with excoriation) |
|
การบาดเจ็บ (Trauma) |
|
ไลเคน สเคอโรซัส (Lichen sclerosus) |
|
หูด (Condylomas) |
|
หูดหงอดไก่ (Molluscum contangiosum) |
|
ช่องคลอด (Vagina) |
|
ช่องคลอดอักเสบ (Vaginitis) |
|
สิ่งแปลกปลอมในช่องคลอด (Vaginal foreign body) |
|
การบาดเจ็บ (Trauma) เช่น การทารุณกรรมทางเพศ (Abuse) และการสอดใส่ (penetration) |
|
เนื้องอก(Vaginal tumor) |
|
มดลูก (uterine) |
|
ภาวะเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด (Precocious puberty) |
|
เนื่องอกรังไข่ (Ovarian tumor) |
|
Granulosa cell tumor |
|
Germ cell tumor |
|
เอสโตรเจนจากภายนอก (Exogenous estrogen) |
|
ชนิดทา (Topical) |
|
ชนิดรับประทาน (Enteral) |
|
อื่นๆ |
|
McCune-Albright syndrome |
ตารางที่ 1 แสดงสาเหตุของภาวะเลือดออกในวัยก่อนเจริญพันธุ์ ดัดแปลงจาก Berek & Novak’s Gynecology (2019)
การวินิจฉัยแยกโรคภาวะเลือดออกทางช่องคลอดในวัยก่อนเจริญพันธุ์
ในเด็กวัยแรกเกิดสามารถมีเลือดออกทางช่องคลอดได้ปริมาณเล็กน้อย จากผลของการขาดฮอร์โมนเอสโตรเจน หลังจากที่ได้รับฮอร์โมนนี้ในระดับสูงจากแม่ขณะอยู่ในครรภ์ หลังจากช่วงวัยแรกเกิด สาเหตุของเลือดออกทางช่องคลอดที่ควรคำนึงถึง คือ การทารุณกรรมทางเพศ ภาวะเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด ภาวะเนื้องอกของรังไข่ทั้งชนิดธรรมดา และ ที่เป็นมะเร็ง รวมไปถึง เนื้องอกและความผิดปกติของอวัยวะเพศภายนอก ปากช่องคลอด ช่องคลอด และ ปากมดลูก (4-5)โดยที่สาเหตุของเลือดออกนี้ในวัยนี้สามารถเป็นได้ทั้งภาวะปกติ จนถึงภาวะมะเร็งที่อาจเป็นอัตรายถึงชีวิต ซึ่งแหล่งที่ทำให้เกิดเลือดออกบางทีต้องแยกกับ เลือดออกจากทางเดินปัสสาวะและเลือดออกจากทางเดินอาหาร ซึ่งนั้นทำให้กุมารแพทย์จำเป็นต้องมองหาสาเหตุจากทางเดินปัสสาวะ และ ทางเดินอาหาร เช่นการมีท้องผูก รอยแตกบริเวณรูทวาร (Anal fissure) หรือแม้กระทั่งภาวะลำไส้อักเสบเรื้อรัง (Inflammatory bowel disease) อย่างไรก็ตามสาเหตุสำคัญที่ต้องคำนึงถึง และได้รับการประเมินทุกครั้งในเด็กที่มาด้วยอาการของอวัยวะเพศภาวะนอก ปากช่องคลอด และ ช่องคลอด โดยเฉพาะในรายที่มีอาการมีเลือดออกจากอวัยวะเหล่านี้ คือ ภาวะทารุณกรรมทางเพศ (6) ซึ่งหากไม่ได้รับการวินิจฉัยอาจทำให้เด็กอยู่ในภาวะอันตราย
1. ความผิดปกติของอวัยวะเพศภายนอก และ ปากช่องคลอด (Vulvar lesion)
การระคายเคืองบริเวณอวัยวะเพศภายนอก สามารถทำให้เกิดอาการคัน และผิวหนังหลุดลอก การเปื่อยยุ่ยของผิวหนัง หรือการแตกของผิวหนัง ซึ่งทำให้เกิดเลือดออกได้ สาเหตุของอื่นที่สามารถสังเกตเห็นได้จากภายนอกของภาวะเลือดออกในวัยนี้ ได้แก่ ภาวะท่อปัสสาวะปลิ้น (Urethral prolapse ) หูด(Condyloma) ไลเคน สเคอโรซัส (Lichen sclerosus) หูดข้าวสุก (Molluscum contagiosum)
1.1 ภาวะท่อปัสสาวะปลิ้น (Urethral prolapse ) สามารถมาด้วยก้อนกดเจ็บ ที่อาจจะเปราะ หรือ มีเลือดซึมออกมาเล็กน้อย เป็นสาเหตุที่พบบ่อยมากที่สุดในเด็กสาวชาวแอฟริกันอเมริกันโดยภาวะนี้มักถูกสับสนกับก้อนของช่องคลอด อาการที่มาบ่อย คือ ก้อนรูปร่างเหมือนโดนัท ลักษณะสมมาตรอยู่รอบท่อปัสสาวะ การรักษา ทำได้โดยการใช้เอสโตรเจนทา แม้ว่านักเขียนบางท่านจะสนับสนุนการรักษาด้วยการผ่าตัดออก (7)
1.2 หูด (Condyloma) หากพบภาวะนี้จำเป็นต้องคำนึงถึงการถูกทารุณกรรมทางเพสก่อนทุกครั้ง แม้ว่าการเกิดหูดในช่วงอายุ 2-3 ปีแรก อาจเกิดได้จากการติดเชื้อระหว่างคลอดจากมารดาที่มีการติดเชื้อ Human papilloma virus ก็ตาม (8)
1.3 ไลเคน สเคอโรซัส (Lichen sclerosus) ทำให้มีเลือดออกภายนอก ได้จากการถลอก และ การมีเลือดออกใต้ชั้นผิวหนัง (Blood blister) ซึ่งอาจทำให้เข้าใจผิดว่าเป็นการทารุณกรรมทางเพศ (9) ภาวะนี้มักพบในหญิงวัยหมดประจำเดือน แต่ก็สามารถพบในวัยก่อนเจริญพันธุ์ได้เช่นเดียวกัน ยังไม่เป็นที่ทราบถึงสาเหตุที่แน่ชัด แต่พบว่ามักจะเกิดในครอบครัวเดียวกัน (10)
2. สิ่งแปลกปลอมในช่องคลอด (Foreign body) เป็นสาเหตุที่พบบ่อยของ อาการตกขาวจากช่องคลอด ซึ่งอาจมีลักษณะเป็นหนอง หรือมูกเลือด ในวัยเด็กเล็กจะมีการสำรวจรูเปิดต่างๆของร่างกาย รวมไปถึงช่องคลอด และอาจมีการนำสิ่งของขนาดเล็กสอดเข้าไป เช่น ของเล่นพลาสติก โดยที่บางครั้งสามารถคลำพบได้จากการตรวจสวนรูทวาร (per rectal examination) ซึ่งบางทีจะสามารถทำการรูดสิ่งของเหล่านี้ผ่านรูทวารออกมากทางปากช่องคลอดเพื่อนำออกมา สิ่งแปลกปลอมที่พบได้บ่อยที่สุดในช่องคลอด คือ กระดาษทิชชูชิ้นเล็กๆ (11)
การพบสิ่งแปลกปลอมในช่องคลอดอาจเป็นเครื่องบ่งบอกว่ามีการทารุณกรรมทางเพศ จึงถือเป็นเรื่องที่ควรคำนึงถึงทุกครั้ง
3. ภาวะเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด precocious puberty
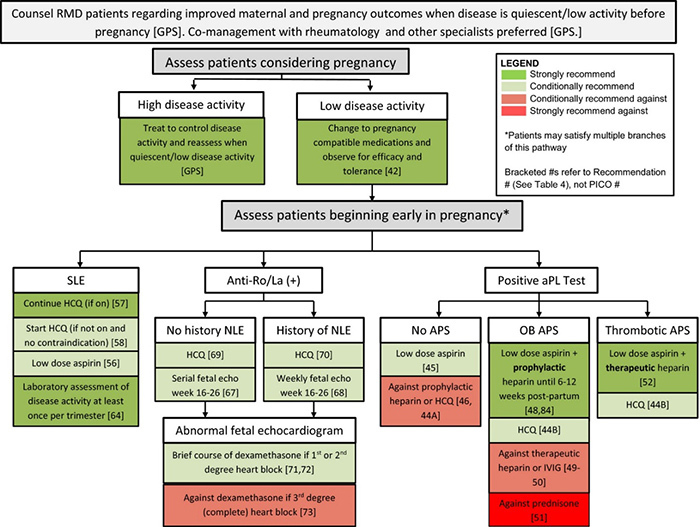
คือ ภาวะที่มีการเข้าสู่วัยเจริญพันธุ์ (Puberty) ได้แก่ การพัฒนาทางของลักษณะทางเพศ ก่อนอายุ 8 ปี อย่างไรก็ตามแนวทางการรักษาใหม่จาก Pediatric Endocrine Society แนะนำในประเมินในเด็กหญิงผิวขาวที่อายุ น้อยกว่า 7 ปี และเด็กผู้หญิง แอฟริกัน-อเมริกัน ที่อายุน้อยกว่า 6 ปี ที่มีการพัฒนาของ เต้านม หรือ ขนหัว
เหน่า (12)
การเข้าสู่ช่วงวัยเจริญพันธุ์ในเด็กหญิงจะใช้เวลาประมาณ 4.5 ปี โดยที่สัญญาณแรกของการเข้าสู่วัยเจริญพันธุ์จะเกิดขึ้นอย่างเป็นลำดับ คือ ความสูงที่เพิ่มขึ้นอย่างรวดเร็ว จากนั้นจะหน้าอกจะมีลักษณะตั้งเต้า (Breast budding) ซึ่งมักจะเป็นลักษณะแรกที่ถูกสังเกตได้เมื่อเข้าสู่วัยเจริญพันธุ์ ตามด้วยการเปลี่ยนแปลงของลักษณะขนหัวหน่าว ความเร็วในการเปลี่ยนแปลงส่วนสูงที่มากที่สุด (Peak growth velocity) และ การมีประจำเดือนครั้งแรก โดยที่การที่มีเลือดอออกทางช่องคลอดโดยที่ไม่มีการแสดงลักษณะทางเพศ ทุติยภูมิ (secondary sex characteristic) อาจเกิดจากการเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด (15-16)
สาเหตุภาวะเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด (Precocious puberty)
A. สาเหตุจากระบบประสาทส่วนกลาง Central (true) precocious puberty
1. เกิดขึ้นเอง Constitutional (idiopathic) precocious puberty
2. เนื้องอกของต่อมไฮโปทาลามัส Hypothalamic neoplasms (most commonly hamartomas)
3. ความผิดปกติแต่กำเนิด Congenital malformations
4. Infiltrative processes (Langerhans cell-type histiocytosis)
5. การฉายรังสี After irradiation
6. การบาดเจ็บ Trauma
7. การติดเชื้อ Infection
B. สาเหตุจากอวัยวะนอกระบบประสาทส่วนกลาง Precocious puberty of peripheral origin (precocious pseudopuberty)
1. Autonomous gonadal hypersecretion
a. Cysts
b. McCune-Albright syndrome
2. Congenital adrenal hyperplasia
a. 21-Hydroxylase (P450c21) deficiency
b. 11B-Hydroxylase (P450c11) deficiency
c. 3B-Hydroxysteroid dehydrogenase deficiency
3. Iatrogenic ingestion/absorption of estrogens or androgens
4. Hypothyroidism
5. Gonadotropin-secreting neoplasms
a. Human chorionic gonadotropin secreting
i. Ectopic germinomas (pinealomas)
ii.Choriocarcinomas
iii.Teratomas
iv. Hepatoblastomas
b. Luteinizing hormone-secreting (pituitary adenomas)
6. Gonadal neoplasms
a. Estrogen-secreting
i. Granulosa-theca cell tumors
ii. Sex-cord tumors
b. Androgen-secreting
i. Sertoli-Leydig cell tumors (arrhenoblastomas)
ii. Teratomas
7. Adrenal neoplasms
a. Adenomas
b. Carcinomas
ตารางที่ 2 แสดงสาเหตุภาวะเข้าสู่วัยเจริญพันธุ์ก่อนกำหนด (Precocious puberty) ดัดแปลงจาก Berek & Novak’s Gynecology (2019)
แผนภาพที่ 1 แสดงแนวทางการประเมินเด็กที่เข้าสู่วัยเจริญพันธุ์ก่อนกำหนด
ดัดแปลงจาก Berek & Novak’s Gynecology (2019)
4. การบาดเจ็บ (Trauma)
สามารถทำให้เกิดเลือดออกที่อวัยวะเพศได้ ทั้งนี้จำเป็นต้องซักประวัติอย่างรอบคอบจากทั้งครอบครัว คนดูแล และตัวเด็กเอง เพราะการบาดเจ็บที่เกิดจากการถูกทารุณกรรมทางเพศมักถูกมองข้าม หากมีการตรวจร่างกายที่ไม่ไปด้วยกันกับเหตุการณ์บาดเจ็บที่กล่าวอ้างควรคำนึงถึงการทารุณกกรมเด็ก และ ควรส่งปรึกษา หรือการส่งต่อกับเจ้าหน้าที่สังคมสงเคราะห์หรือหน่วยงานที่รับผิดชอบเรื่องทารุณกรรมทางเพศอย่างเหมาะสม (6) โดยปกติการบาดเจ็บจากการตกคร่อม (straddle injury) จะทำให้เกิดรอยบาดแผลบริเวณด้านหน้า และด้านข้างของอวัยวะเพศภายนอก เมื่อใดก็ตามที่บริเวณที่ได้รับบาดเจ็บ เป็นลักษณะถูกสอดใส่(Penetrating injury) ที่มีบาดแผลอยู่ที่ Fourchette หรือ บาดแผลลึกเข้าไปถึงบริเวณวงรอบของเยื่อพรหมจรรย์ (Hymen ring) มีโอกาสเป็นไปได้น้อยมากที่จะเกิดจากอุบัติเหตุธรรมดา (13)
5. การทารุณกรรม (Abuse) การตรวจประเมินเด็กที่สงสัยจะถูกทารุณกรรมทางเพศ จะดีที่สุดหากทำโดยผู้ตรวจซึ่งมีประสบการณ์ ในการประเมินจาก การตรวจร่างกาย ผลทางห้องปฏิบัติการ คำให้การ และพฤติกรรมของเด็ก อย่างไรก็ตามเด็กที่ถูกทารุณกรรมทางเพศส่วนมาก การตรวจร่างกายอวัยวะเพศมักปกติ หรือไม่จำเพาะ และมักจะไม่ได้มาด้วยการบาดเจ็บแบบฉับพลัน (6) รวมไปถึงรูปแบบการทารุณกรรมทางเพศบางอย่างเช่นการใช้นิ้วสอดใส่ และการลูบไล้ก็ไม่ทำให้เกิดแผลบริเวณอวัยวะเพศภายนอก
6. สาเหตุอื่น ที่สำคัญแต่พบได้น้อยของการเกิดเลือดออกทางช่องคลอด คือ เนื้องอกของช่องคลอด โดยเนื้องอกที่พบบ่อยในวัยก่อนเจริญพันธุ์ คือ เนื้องอกมะเร็งกล้ามเนื้อชนิด Rhabdomyosarcoma (Sarcoma botryoides) ซึ่งสัมพันธ์กับการมีเลือดออกทางช่องคลอด และพบก้อนลักษณะคล้ายพวงของผลองุ่น(Grape like cluster mass) เนื้องอกชนิดอื่นของช่องคลอดก็พบได้น้อยเช่นเดียวกัน อย่างไรก็ตามควรคำนึงถึงและทำการตรวจภายใต้การดมยาสลบผ่านกล้อง Vaginoscopy เมื่อไม่พบสาเหตุภายนอกอื่นของเลือดออกทางช่องคลอด
เนื้องอกของรังไข่ที่สร้างฮอร์โมนสามารถทำให้เกิดภาวะการเจริญของเยื่อบุผนังมดลูกมากขึ้นและเกิดการหลุดลอกเป็นสาเหตุของภาวะเลือดออกทางช่องคลอดได้ เช่นเดียวกันกับการได้รับฮอร์โมนเอสโตรเจนสจากภายนอก ก็สามารถทำให้เกิดเลือดออกทางช่องคลอดได้ สาเหตุอื่นที่พบได้น้อย คือ การใช้ฮอร์โมน เอสโตรเจนแบบทาเป็นระยะเวลานาน เพื่อรักษาภาวะผนังช่องคลอดอักเสบ หรือ ภาวะแคมติดกัน (Labia adhesion) รวมถึงการทานอาหารหรือผลิตภัณฑ์ที่มีส่วนของฮอร์โมนเอสโตรเจนแบบไม่ได้ตั้งใจ
การวินิจฉัยภาวะเลือดออกทางช่องคลอดในวัยก่อนเจริญพันธุ์
การตรวจร่างกาย
ถ้าหากไม่มีสาเหตุที่สามารถเหก็นได้จากภายนอก หรือบริเวณส่วนปลายของช่องคลอด การตรวจภายในสามารถทำได้ภายใต้การดมยาสลบโดยใช้กล้องส่องเพื่อดูลักษณะของช่องคลอด และปากมดลูกได้สมบูรณ์ ทั้งนี้การตรวจควรทำโดยผู้เชี่ยวชาญที่มีประสบการณ์ด้านนรีเวชของเด็กและวัยรุ่น
ภาพถ่ายทางรังสี
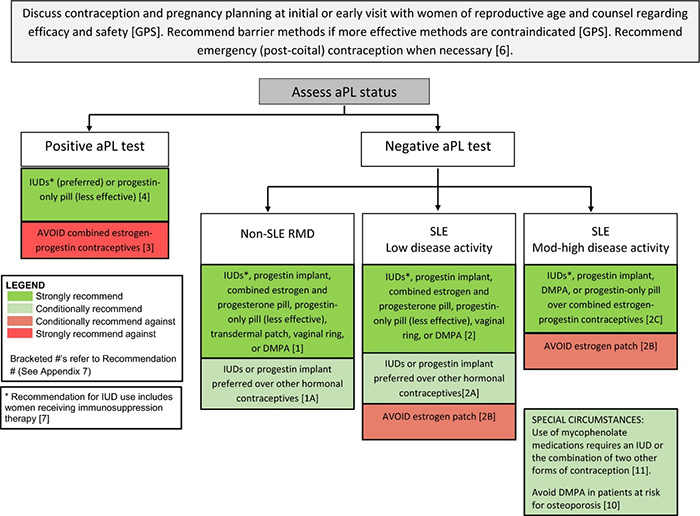
หากสงสัยภาวะเนื้องอกของรังไข่ หรือ ผนังมดลูก สามารถใช้วิธีการตรวจอัลตราซาว์อุ้งเชิงกรานผ่านทางหน้าท้อง (Transabdominal pelvic ultrasonographic) เพื่อให้ได้มาซึ่งข้อมูลที่มีประโยชน์ โดยสามารถให้ข้อมูลของลักษณะรังไข่ทั้งสองข้าง (ลักษณะปกติของรังไข่ในวัยก่อนเจริญพันธุ์ ขนาด และ ปริมาตร การพัฒนาของฟอลลิเคิล ลักณะเป็นถุงน้ำ หรือเป็นเนื้อด้าน ) รวมถึงขนาดและลักษณะของมดลูก โดยที่มดลูกของวัยก่อนเจริญพันธุ์จะมีลักษณะที่พิเศษ คือจะมีสัดส่วนของปากมดลูก(Cervix) ที่เท่ากันกับส่วนของยอดมดลูก (Fundus) และจะมีขนาดความยาวประมาณ 2-3.5 เซนติเมตร และ กว้างประมาณ 0.5 – 1 เซนติเมตร ส่วนยอดของมดลูกจะยืดขยายเมื่อได้รับฮอร์โมนเอสโตรเจนมากระตุ้น ทำให้เกิดลักษณะของมดลูกหลังมีประจำเดือนครั้งแรก ซึ่งส่วนยอดมดลูกจะยาวกว่าปากมดลูก (14) การทำอัลตราซาวด์ควรพิจารณทำเป็นอันดับแรกของภาพถ่ายทางรังสี การทำภาพถ่ายทางรังสีอื่น เช่น การตรวจด้วยคลื่นแม่เหล็กไฟฟ้า (Magnetic Resonance Imaging , MRI ) หรือ เอกเรย์คอมพิวเตอร์ (Computerized Tomography Scan /CT scan) ทำให้เกิดค่าใช้จ่ายที่ไม่จำเป็นและไม่ใช่เครื่องมือเบื้องต้นที่ใช้เพื่อการวินิจฉัย (15)
รูปแสดง Pelvic ultrasound (transabdominal) of a premenarchal 10-year-old-girl. U , Uterine corpus ; C , Cervix .
Note that body of uterus is about the same size as the cervix
ที่มา : Berek & Novak’s Gynecology (2019)
แนวทางการดูแลรักษา
การดูแลภาวะเลือดออกทางช่องคลอดในวัยก่อนเจริญพันธุ์นั้นขึ้นอยู่กับสาเหตุ หากภาวะเลือดออกที่เบื้องต้นเชื่อว่าเกิดจากสาตุที่ไม่จำเพาะของการอักเสบของช่องคลอดและอวัยวะเพศภายนอกยังคงมีอาการอยู่แม้ว่าจะได้รับการรักษาแล้ว ควรทำการตรวจเพื่อประเมินเรื่องของการมีสิ่งแปลกปลอมในช่องคลอด
ความผิดปกติของผิวหนัง (ภาวะระคายเคืองเรื้อรัง) และไลเคน สเคอโรซัส (Lichen sclerosus) อาจยากต่อการรักษา แต่สามารถรักษาด้วยการใช้สเตียรอยด์แบบทา โดยที่การรักษาไลเคน สเคอโรซัส (Lichen sclerosus) จะต้องใช้สเตียร์ที่มีความแรงสูง (high potency steroid) และต้องการการรักษาที่ต่อเนื่องเพื่อคุมอาการ
เอกสารอ้างอิง
- Biro FM, Greenspan LC, Galvez MP. Puberty in girls of the 2Istcentury. J Pediatr Adolesc Gynecol 201 2:25(5):289-294.
- Herman-Giddens ME, Slora E.J, Wasserman RC, et al. Secondary sexual characteristics and menses in young girls seen in office practice: a study from the Pediatric Research in Office Settings network.Pediatrics 1997:99(4):505-512.
- Wolf RM, Long D. Pubertal development. Pediatr Rev 2016:37(7):292-300.
- Marshall WA, Tanner .JM. Variations in pattern of pubertal changes in girls. Arch Dis Child 1969:44(235):291-303.
- Harlan WR, Harlan EA, Grillo GP. Secondary sex characteristics of girls 12 to 17 years of age: the U.S. Health Examination Survey.J Pediatr1980:96:1074-1078.
- Adams JA, Kellogg ND, Farst KJ, et al. Updated guidelines for the medical assessment and care of children who may have been sexually abused. J Pediatr Adolesc Gynecol 2015:29(2):81-87.
- Eyk NV, Allen L, Giesbrecht E, et al. Pediatric vulvovaginal disorders: a diagnostic approach and review of the literature. J Obster Gynaecol Can 2009:31(9):850-862.
- Unger ER, Fajman NN, Maloney EM, et al. Anogenital human papillomavirus in sexually abused and nonabused children: a multicenter study. Pediatrics 2011;128(3):e658-e665.
- Powell J, Wojnarowska F. Childhood ขulval lichen sclerosus and sexual abuse are not mutually exclusive diagnoses. BMJ 2000;320(7230):31 1.
- Powell J, Wojnarowska F, Winsey S, et al. Lichen sclerosus premenarche: autoimmunity and immunogenetics. Br J Dermatol 2000;142(3):481-484.
- Smith YR, Berman DR, Quint EH. Premenarchal vaginal discharge:findings of procedures to rule out foreign bodies. J Pediatr AdolescGynecol 2002;15(4):227-230.
- Kaplowitz PB, Oberfield SE. Reexamination of the age limit fordefining when puberty is precocious in girls in the United States:implications for evaluation and treatment, Drug and Therapeutics and Executive Committees of the Lawson Wilkins Pediatric Endocrine Society. Pediatrics 1999;104(4 Pt 1):936-941.
- Iqbal CW, Jrebi NY, Zielinski MD, et al. Patterns of accidental genital trauma in young girls and indications for operative management. J Pediatr Surg 2010;45(5):930-933.
- Ersen A, Onal H, Yildirim D, et al. Ovarian and uterine ultrasonography and relation to puberty in healthy girls between 6 and 16 years in the Turkish population: a cross-sectional study. J Pediatr Endocrinol Metab 2012:25(5-6):447-451.
- Hillard, P. J. A. (2019). Pediatric and adolescent gynecology. Berek & Novak’s Gynecology. J. S. Berek. Philadephia, Lippincott Williams & Wilkins: 165-178.