Rheumatic and Musculoskeletal Diseases in Pregnancy
(โรคข้อและกล้ามเนื้อกระดูกในหญิงตั้งครรภ์)
ปาณิศา ฮันตระกูล
อาจารย์ที่ปรึกษา ผศ.พญ. กุณฑรี ไตรศรีศิลป์
การจัดการสำหรับอนามัยการเจริญพันธุ์ในผู้ป่วยกลุ่มโรคข้อและกล้ามเนื้อกระดูก (rheumatic and musculoskeletal diseases; RMD) นั้นแตกต่างกับประชากรในกลุ่มปกติ ซึ่งเป็นสาเหตุให้แพทย์ผู้เชี่ยวชาญด้านโรคข้อและแพทย์ผู้ทำการดูแลผู้ป่วยในกลุ่มนี้จะต้องพูดคุยและให้คำปรึกษาแก่ผู้ป่วยเกี่ยวกับวิธีการคุมกำเนิด การตั้งครรภ์ และการให้นมบุตร รวมถึงการใช้ยาต่าง ๆ ด้วย ดังนั้นผู้ดูแลรักษาผู้ป่วยควรเป็นทีมสหสาขา ซึ่งประกอบไปด้วยสูตินรีแพทย์ทั่วไป rheumatologists แพทย์ผู้เชี่ยวชาญเฉพาะทางเวชศาสตร์มารดาและทารกในครรภ์ และแพทย์ผู้เชี่ยวชาญเฉพาะทางเวชศาสตร์การเจริญพันธุ์
การตั้งครรภ์สำหรับผู้ป่วยในกลุ่มโรคนี้ อาจนำไปสู่ผลร้ายที่รุนแรงสำหรับมารดาและทารกต่อไปในอนาคตได้ ดังนั้นควรมีการสนับสนุนและให้คำปรึกษาเกี่ยวกับวิธีการคุมกำเนิดในแต่ละบุคคล เพื่อให้สามารถคุมกำเนิดได้อย่างมีประสิทธิภาพ ตั้งครรภ์เมื่อพร้อม และปลอดภัยต่อโรคที่เป็นอยู่ เนื่องจากความเสี่ยงในการตั้งครรภ์นั้นขึ้นอยู่กับโรคที่ได้รับการวินิจฉัย ความรุนแรงของตัวโรค ยาที่ใช้รักษา รวมไปถึงผลการตรวจทางห้องปฏิบัติการของ anti‐Ro/SSA, anti‐La/SSB และ antiphospholipid (aPL) antibodies จึงทำให้การประเมินภาวะความรุนแรงของโรคก่อนการตั้งครรภ์นั้นสำคัญและมีความจำเป็นอย่างมาก
แต่อย่างไรก็ตาม การหลีกเลี่ยงการใช้ยาช่วงระหว่างตั้งครรภ์ในผู้ป่วยกลุ่มนี้คงเป็นไปได้ยาก ซึ่งยาที่ใช้รักษานั้นไม่ได้มีความปลอดภัยที่จะใช้ในการตั้งครรภ์หรือให้นมบุตรทุกตัว แต่การที่ผู้ป่วยไม่ได้ใช้ยาจนควบคุมโรคไว้ไม่ได้นั้น ก็สัมพันธ์กับผลของการตั้งครรภ์ที่ไม่ดี ซึ่งทำให้ต้องมีการศึกษาเกี่ยวกับวิธีการคุมกำเนิด การตั้งครรภ์ รวมไปถึงการให้นมบุตรในผู้ป่วยในกลุ่มนี้ โดยทาง American College of Rheumatology (ACR) ได้มีข้อแนะนำออกมาเป็น 2020 American College of Rheumatology Guideline for the Management of Reproductive Health in Rheumatic and Musculoskeletal Diseases1
Pregnancy: general assessment, counseling, and management
การเปลี่ยนแปลงระหว่างการตั้งครรภ์นั้น ส่งผลกระทบหลายอย่างในผู้ป่วยกลุ่ม RMD การตั้งครรภ์จะทำให้มีการเพิ่มของ intravascular volume จึงอาจทำให้หัวใจและไตที่ทำงานไม่ดีอยู่แล้วนั้นแย่ลงไปอีก อีกทั้งการเพิ่มของ GFR ประมาณ 50% ในการตั้งครรภ์นั้น ก็อาจทำให้ภาวะ proteinuria นั้นแย่ลงได้ นอกจากนี้การตั้งครรภ์ส่งเสริมให้มีภาวะ hypercoagulability จึงทำให้ผู้ป่วยในกลุ่ม RMD นี้เสี่ยงต่อภาวะ thrombosis มากขึ้น และที่สำคัญคือภาวะ pregnancy-induced hypertension syndromes นั้นอาจทำให้เกิดการสับสนกับภาวะ lupus nephritis, scleroderma renal crisis หรือ vasculitis flare หรือในทางตรงข้าม HELLP syndrome หรือภาวะ eclampsia นั้นอาจเหมือนกับภาวะ severe disease flare ได้เช่นกัน การแยกภาวะเหล่านี้ออกจากกันจึงต้องอาศัย rheumatologists และสูตินรีแพทย์ โดยเฉพาะแพทย์ผู้เชี่ยวชาญเฉพาะทางเวชศาสตร์มารดาและทารกในครรภ์ ในการทำงานร่วมกันเพื่อประเมินผู้ป่วยและให้การดูแลรักษาอย่างเหมาะสมต่อไป ซึ่งมีข้อแนะนำสำหรับการดูแลผู้ป่วยโรค RMD ตามแผนภูมิที่ 1
ข้อแนะนำทั่วไปสำหรับผู้ป่วยในกลุ่ม RMD
- แพทย์ต้องแนะนำและให้คำปรึกษาแก่ผู้ป่วย RMD เพื่อ maternal และ fetal outcomes ที่ดีต่อไป โดยโรคควรอยู่ในภาวะสงบหรือมี low activity disease อย่างน้อย 6 เดือนก่อนการตั้งครรภ์2, 3
- ผู้ป่วย RMD ที่วางแผนจะตั้งครรภ์ โดยได้รับยาที่ไม่สามารถใช้ในช่วงที่ตั้งครรภ์ได้ จะต้องได้รับการปรับเปลี่ยนยาก่อนที่จะตั้งครรภ์ ซึ่งควรมีช่วงระยะเวลาหนึ่งสำหรับการติดตามและประเมินประสิทธิภาพของยาว่าเพียงพอต่อการควบคุมโรคของผู้ป่วยก่อนการตั้งครรภ์
- สำหรับผู้ป่วย RMD ที่ตั้งครรภ์แล้วมีภาวะ active disease จะต้องได้รับยา steroid-sparing medication เนื่องจากการใช้แบบ continuous high-dose glucocorticoid นั้นจะเป็นอันตรายต่อมารดาและทารก4 โดยก่อนการตั้งครรภ์หรือช่วง early pregnancy นั้นแนะนำให้มีการตรวจ autoantibodies ต่าง ๆ ก่อน ไม่ว่าจะเป็น anti-Ro/SSA, anti-La/SSB และ aPL เพื่อจะได้ประเมินและวางแผนในการดูแลรักษาผู้ป่วยต่อไป
- ในผู้ป่วยกลุ่ม SLE, SLE-like disorders, Sjögren’s syndrome, systemic sclerosis และ rheumatoid arthritis แนะนำให้ตรวจ anti-Ro/SSA, anti-La/SSB สักครั้งหนึ่งก่อนการตั้งครรภ์หรือช่วง early pregnancy แต่ไม่แนะนำให้ตรวจซ้ำอีกในช่วงระหว่างการตั้งครรภ์
Scleroderma renal crisis
ภาวะ scleroderma renal crisis เป็นภาวะแทรกซ้อนทางไตที่รุนแรงในผู้ป่วย systemic sclerosis เป็นสาเหตุสำคัญของการเสียชีวิตที่เพิ่มมากขึ้น โดยผู้ป่วยจะมีลักษณะทางคลินิกที่สำคัญคือ มีความดันโลหิตสูงอย่างมาก (malignant hypertension) และมีภาวะไตวายอย่างรวดเร็ว โดยทั่วไปการใช้ยาในกลุ่ม angiotensin-converting enzyme inhibitors (ACEI) จะช่วยรักษาภาวะนี้ได้ สำหรับในหญิงตั้งครรภ์ที่มีภาวะนี้ มีข้อแนะนำดังต่อไปนี้
- แนะนำการใช้ angiotensin-converting enzyme inhibitor (ACEI) หรือ angiotensin receptor blockade (ARB) เพื่อรักษา active scleroderma renal crisis เนื่องจากความเสี่ยงในการเสียชีวิตของมารดาและทารกที่ไม่ได้รับการรักษาภาวะนี้ สูงกว่าความเสี่ยงที่เกิดจากการใช้ยากลุ่มนี้ในระหว่างการตั้งครรภ์ โดยเฉพาะยากลุ่ม ACEI สามารถเป็น renal-protective และช่วยชีวิตผู้ป่วยได้5 แต่อย่างไรก็ตาม ยากลุ่มนี้เป็นข้อห้ามสำหรับการใช้ในช่วงไตรมาสที่ 2 และ 3 ของการตั้งครรภ์ เพราะว่าจะทำให้เกิด oligohydramnios หรือทำลายไตของทารกอย่างถาวรได้6 จึงควรพิจารณาใช้ยานี้เฉพาะภาวะ active scleroderma renal crisis เท่านั้น
SLE (Systemic lupus erythematosus)
- แนะนำให้ตรวจ lupus anticoagulant (LAC), anticardiolipin antibody (aCL) และ anti-ß2 glycoprotein I antibody (anti-ß2GPI) อย่างน้อยหนึ่งครั้งในช่วงก่อนการตั้งครรภ์หรือช่วง early pregnancy แต่ไม่แนะนำให้ตรวจซ้ำอีกในช่วงระหว่างการตั้งครรภ์
- แนะนำให้ผู้ป่วย SLE รับประทานยา hydroxychloroquine (HCQ) ระหว่างการตั้งครรภ์ทุกคน หากผู้ป่วยรับประทานยาชนิดนี้อยู่แล้ว ให้รับประทานต่อ แต่หากผู้ป่วยยังไม่เคยได้รับยาชนิดนี้ ก็ให้เริ่มทันทีที่ทราบว่าตั้งครรภ์ ยกเว้นกลุ่มที่มีข้อห้ามในการกิน ซึ่งได้แก่ ผู้ที่แพ้ยา หรือผู้ที่ทนผลข้างเคียงของยาไม่ได้ โดยมีการศึกษาหลายฉบับที่สนับสนุนให้กินยาชนิดนี้ เพราะว่ามีความเสี่ยงต่อมารดาและทารกต่ำ นอกจากนี้ยังช่วยลดอัตราการกำเริบของโรค ลดการคลอดก่อนกำหนด (preterm birth) และลดภาวะทารกโตช้าในครรภ์ (IUGR; intrauterine growth restriction)7-11
- แนะนำให้ผู้ป่วย SLE รับประทานยา low-dose aspirin (81 หรือ 100 mg/day) โดยเริ่มในช่วงไตรมาสแรกของการตั้งครรภ์ ซึ่ง ACOG ได้แนะนำให้ทานเพื่อป้องกันภาวะครรภ์เป็นพิษในผู้ป่วยที่มีความเสี่ยงสูง การทาน low-dose aspirin จะช่วยป้องกันหรือชะลอการเกิด gestational hypertensive disease ในกลุ่มผู้ป่วย SLE หรือ APS (antiphospholipid syndrome) แต่อย่างไรก็ตาม การที่ได้รับ low-dose aspirin นั้นไม่ได้เพิ่มความเสี่ยงสำหรับการทำ anesthesia หรือในช่วง delivery12
- ผู้ป่วยกลุ่ม SLE ควรได้รับการติดตาม disease activity อย่างน้อยหนึ่งครั้งต่อหนึ่งไตรมาสการตั้งครรภ์ โดยติดตามเป็นประวัติของผู้ป่วย การตรวจร่างกาย และการตรวจทางห้องปฏิบัติการ ได้แก่ complete blood count (CBC), urinalysis, urine protein:creatinine ratio (UPCR) หรือ anti-dsDNA, C3 หรือ C4 levels ซึ่งอาจเป็นตัวบ่งบอกว่ามีการกำเริบของโรคหรือมีภาวะครรภ์เป็นพิษได้ถึงแม้ว่าจะไม่มีอาการก็ตาม
Antiphospholipid antibody-positive
Antiphospholipid antibody เป็นปัจจัยเสี่ยงสำคัญสำหรับการเกิด pregnancy loss และภาวะผิดปกติต่าง ๆ ของการตั้งครรภ์ โดยเฉพาะอย่างยิ่งในผู้ป่วยกลุ่ม SLE จึงควรได้รับการตรวจ anti-ß2GPI, aCL และ LAC
1) aPL-positive patients without thrombosis or obstetric complications
กลุ่มผู้ป่วย aPL-positive ที่ไม่มีอาการ ไม่จำเป็นต้องได้รับการรักษาแบบ prophylactic therapy เพื่อป้องกัน pregnancy loss แต่อย่างไรก็ตาม ผู้ป่วยควรได้รับ prophylactic aspirin 81 หรือ 100 mg/day เพื่อป้องกันภาวะครรภ์เป็นพิษ โดยควรเริ่มตั้งแต่ early pregnancy คือก่อนอายุครรภ์ 16 สัปดาห์ และควรได้ไปตลอดการตั้งครรภ์
2) Patients with obstetric and thrombotic APS
กลุ่มผู้ป่วย obstetric APS ได้แก่ กลุ่มผู้ป่วยที่เข้าได้กับ laboratory criteria สำหรับ APS (persistent moderate-to-high-titer aCL หรือ anti-ß2GPI หรือ persistent positive LAC) และมีประวัติ pregnancy complications ต่างๆ (≥3 consecutive losses ก่อนอายุครรภ์ 10 สัปดาห์, fetal loss หลังอายุครรภ์ 10 สัปดาห์เป็นต้นไปโดยไม่ทราบสาเหตุ, หรือคลอดในช่วงอายุครรภ์น้อยกว่า 34 สัปดาห์ เนื่องด้วยภาวะครรภ์เป็นพิษ IUGR หรือ fetal distress) โดยไม่มีประวัติ thrombosis มาก่อน
กลุ่มผู้ป่วย thrombotic APS ได้แก่ กลุ่มผู้ป่วยที่เข้าได้กับ laboratory criteria สำหรับ APS และมีประวัติ thrombotic event ไม่ว่าจะเป็น arterial หรือ venous
ซึ่งผู้ป่วย APS ทั้งกลุ่ม obstetric/thrombotic นั้นควรได้รับการรักษาด้วย heparin (ซึ่งมักจะเป็น LMWH) เพื่อทำให้ pregnancy outcome ดีขึ้น และลดความเสี่ยงในการเกิด thrombosis นอกจากนี้ยังมีข้อแนะนำดังนี้
- สำหรับ OB APS แนะนำให้ combined low-dose aspirin และ prophylactic-dose heparin13-15
- สำหรับ OB APS แนะนำให้ prophylactic-dose anticoagulation เป็นเวลา 6-12 สัปดาห์หลังคลอด16
- สำหรับ Thrombotic APS แนะนำให้ combined low-dose aspirin และ therapeutic-dose heparin ตลอดการตั้งครรภ์และช่วงหลังคลอด
- สำหรับผู้ป่วย aPL-positive ที่ไม่มี OB APS ไม่แนะนำการให้ combination of prophylactic-dose heparin และ low-dose aspirin
3) Other therapies for refractory OB APS
ผู้ป่วยกลุ่ม OB APS นอกจากจะได้รับ standard therapy ด้วย low-dose aspirin และ prophylactic heparin/LMWH แล้ว ยังมีการรักษาอื่น ๆ เสริมอีกในกรณีที่ผู้ป่วยไม่ตอบสนองต่อการรักษาด้วย standard therapy ซึ่งได้แก่ การใช้ IVIG, low-dose prednisolone, การเพิ่มปริมาณยาของ heparin/LMWH, และการใช้ HCQ เป็นทางเลือกในการรักษา ซึ่งมีแนวทางในการเลือกใช้ ดังต่อไปนี้
- ไม่แนะนำให้ใช้ IVIG หรือเพิ่ม dose LMWH เนื่องจากยังไม่มีการศึกษาที่บ่งบอกถึงประโยชน์ของการใช้ยาแบบนี้เพื่อป้องกัน pregnancy loss
- ไม่แนะนำให้เพิ่ม prednisolone ในกลุ่มผู้ป่วยที่ล้มเหลวต่อการรักษาด้วย standard therapy
- แนะนำให้เพิ่มยา HCQ สำหรับผู้ป่วย primary APS โดยการศึกษาที่ผ่านมาแนะนำว่ายาในกลุ่มนี้สามารถลดภาวะแทรกซ้อนต่าง ๆ ได้17
- ไม่แนะนำให้ใช้ยา HCQ ในผู้ป่วย aPL-positive ที่ไม่ได้เข้ากับ APS criteria และไม่ได้มีข้อบ่งชี้อื่น ๆ สำหรับยา HCQ (เช่น กลุ่มผู้ป่วย SLE ที่จำเป็นต้องได้รับ HCQ อยู่แล้ว)
Anti-Ro/SSA, anti-La/SSB in pregnancy
ภาวะ neonatal lupus erythematosus (NLE) เป็นภาวะของทารกที่พบได้ โดยสัมพันธ์กับมารดาที่มี anti-Ro/SSA และ anti-La/SSB autoantibodies โดยที่ anti-Ro/SSA จะมีความสำคัญมากกว่า เนื่องจากถ้ามีเฉพาะ isolated anti-La/SSB นั้นอาจเพิ่มความเสี่ยงต่อทารกไม่มากนัก แต่ถ้าพบทั้ง anti-Ro/SSA และ anti-La/SSB antibodies จะเพิ่มความเสี่ยงต่อทารกมากขึ้น18 จากการศึกษาที่ผ่านมา ทารกที่มารดามี anti-Ro/SSA และ/หรือ anti-La/SSB นั้นพบว่า ~10% มี NLE rash, 20% มี transient cytopenias, และ 30% มี mild transient transaminitis แต่ภาวะต่าง ๆ เหล่านี้สามารถหายไปได้เองเมื่อ antibody ของมารดาหายไป
สำหรับ complete (third-degree) heart block (CHB) สามารถเกิดได้ ~2% ของการตั้งครรภ์ของหญิงที่มี anti-Ro/SSA และ/หรือ anti-La/SSB ในกรณีที่ไม่เคยมีบุตรที่มี NLE มาก่อน แต่ถ้าเคยมีบุตรที่เป็น cutaneous/cardiac NLE มาก่อนนั้น อุบัติการณ์จะเพิ่มเป็น 13-18%19 โดยที่ low-titer antibodies นั้นจะมีความเสี่ยงต่อการเกิด CHB น้อยกว่า higher titers20 ซึ่ง CHB นั้นยากที่จะพบหลังจากอายุครรภ์ 26 สัปดาห์ โดยภาวะนี้เป็นแบบถาวร จึงจำเป็นต้องได้รับการวางแผนในการรักษาจาก pediatric cardiologists ซึ่งทารกที่มีภาวะ CHB ประมาณ 20% นั้นเสียชีวิตในครรภ์หรือเสียชีวิตในช่วงปีแรกของชีวิต นอกจากนั้นมากกว่าครึ่งหนึ่งของทารกจำเป็นต้องใช้ pacemaker18 ซึ่งข้อแนะนำสำหรับหญิงตั้งครรภ์ที่มี anti-Ro/SSA และ/หรือ anti-La/SSB antibodies มีดังต่อไปนี้
- ในกรณีที่ไม่เคยมีบุตรเป็น CHB หรือ NLE: แนะนำให้ serial fetal echocardiography (ไม่จำเป็นต้องทำทุกสัปดาห์) โดยเริ่มทำตั้งแต่อายุครรภ์ 16-18 สัปดาห์ จนกระทั่งอายุครรภ์ 26 สัปดาห์
- ในกรณีที่เคยมีบุตรเป็น CHB หรือ NLE: แนะนำให้ serial fetal echocardiography ทุกสัปดาห์ โดยเริ่มทำตั้งแต่อายุครรภ์ 16-18 สัปดาห์ จนกระทั่งอายุครรภ์ 26 สัปดาห์
- แนะนำให้ HCQ ตลอดการตั้งครรภ์ในผู้ป่วยกลุ่มที่มี anti-Ro/SSA และ/หรือ anti-La/SSB antibodies จากการศึกษาที่ผ่านมาพบว่า หญิงตั้งครรภ์ที่เคยมีบุตรเป็น cardiac NLE แล้วได้รับ HCQ นั้นจะลดความเสี่ยงที่บุตรครรภ์ปัจจุบันจะเป็น CHB21
- หญิงตั้งครรภ์ที่มี anti-Ro/SSA และ/หรือ anti-La/SSB antibodies โดยที่ทารกในครรภ์มีภาวะ first- หรือ second-degree heart block จะแนะนำให้ oral dexamethasone 4 mg/day แต่ถ้ามีภาวะ CHB จะไม่แนะนำให้ dexamethasone
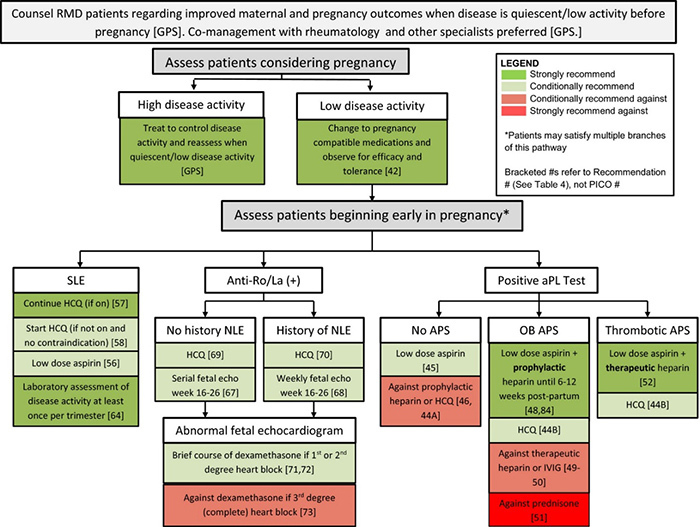
แผนภูมิที่ 1: ข้อแนะนำสำหรับการดูแลผู้ป่วยโรค RMD (การให้คำปรึกษา, การประเมินและดูแลรักษาช่วงตั้งครรภ์)1
Maternal medication use
ข้อแนะนำในการใช้ยาสำหรับหญิงตั้งครรภ์ที่มี Rheumatic and Musculoskeletal Diseases มีดังต่อไปนี้
- ผู้ป่วยกลุ่ม RMD ที่วางแผนจะตั้งครรภ์ ควรได้รับการประเมินเรื่องยาที่ใช้อยู่ก่อนการตั้งครรภ์ทุกราย
- ยากลุ่ม methotrexate (MTX), mycophenolate mofetil (MMF), cyclophosphamide (CYC), และ thalidomide เป็น teratogens จึงต้องหยุดยาก่อนที่จะตั้งครรภ์เป็นเวลา 3 เดือน22-25 แต่อย่างไรก็ตาม การหยุดยาเป็นเวลา 1 menstrual cycle ก็เพียงพอแล้ว แต่ส่วนมากจะแนะนำให้หยุดยา 3 เดือน
- สำหรับผู้หญิงที่ได้ยา leflunomide จะแนะนำให้ cholestyramine washout ก่อนการตั้งครรภ์ถ้าพบว่ามี serum levels of metabolite ในร่างกายอยู่ โดยถ้าไม่พบ metabolite ตัวนี้ใน serum แล้ว ก็ไม่เพิ่มความเสี่ยงในการเกิด pregnancy loss และ birth defects อื่น ๆ26
- แนะนำให้การรักษาด้วย cyclophosphamide (CYC) สำหรับภาวะ life-threatening ในช่วงไตรมาส 2 หรือ 327
- ในผู้หญิงที่มี inadvertent exposure ต่อ teratogenic medications ระหว่างการตั้งครรภ์ ควรได้รับการ refer ไปหา MFM specialist หรือ genetics counselor ทันที
- ยากลุ่ม HCQ, azathioprine/6-mercaptopurine, colchicine, และ sulfasalazine มักใช้รักษาผู้ป่วยกลุ่ม RMD โดยยาในกลุ่มเหล่านี้สามารถใช้ได้ตลอดการตั้งครรภ์9, 28-31
- ยากลุ่ม calcineurin inhibitors (tacrolimus และ cyclosporin) และ NSAIDs สามารถใช้ได้ในช่วงตั้งครรภ์23
- ไม่แนะนำให้ใช้ NSAIDs ในช่วงไตรมาสที่ 3 เพราะจะทำให้เกิด premature closure of ductus arteriosus32
- แนะนำการใช้ nonselective NSAIDs มากกว่า cyclooxygenase 2-specific inhibitors ในช่วงสองไตรมาสแรก
- แนะนำการใช้ low-dose glucocorticoid (≤10 mg/day of prednisolone or nonfluorinated equivalent) ในช่วงการตั้งครรภ์หากมีข้อบ่งชี้ และสามารถเพิ่ม dose ของ nonfluorinated glucocorticoids ไปจนถึง <20 mg/day ได้หากจำเป็นที่จะต้องใช้ แต่อย่างไรก็ตาม ไม่แนะนำการใช้ stress-dose glucocorticoids ในช่วง vaginal delivery แต่แนะนำการใช้ stress-dose glucocorticoids ถ้าเป็น cesarean delivery
- ยากลุ่ม tumor necrosis factor inhibitor เช่น infliximab, etanercept, adalimumab, หรือ golimumab สามารถใช้ในช่วงตั้งครรภ์ โดยถ้าผู้ป่วยสามารถควบคุมโรคได้ดี จะแนะนำให้หยุดยาเหล่านี้ในช่วงไตรมาสที่สาม เนื่องจากยาเหล่านี้สามารถผ่านรกแล้วไปสะสมในทารกได้
- ในช่วงก่อนการตั้งครรภ์ ผู้ป่วยสามารถรักษาด้วย rituximab ได้ และสามารถใช้ในช่วงตั้งครรภ์ได้หากผู้ป่วยมีภาวะ severe life- or organ-threatening disease แต่ต้องคำนึงว่าการได้รับยานี้ในช่วงครึ่งหลังของการตั้งครรภ์ ส่งผลให้ทารกมีความเสี่ยงสูงที่จะมีจำนวน B cells น้อยกว่าปกติในช่วงแรกคลอด33
Medication use during breastfeeding
การส่งเสริมการเลี้ยงลูกด้วยนมแม่เป็นเรื่องที่สำคัญมากในปัจจุบัน โดยที่ American Academy of Pediatrics แนะนำให้ exclusive breastfeeding เป็นระยะเวลา 6 เดือนแรกและให้นมแม่ต่อเนื่องเป็นเวลา 1 ปี34 เนื่องด้วยผู้หญิงที่เป็นโรคในกลุ่ม RMD มักจะมีอาการกำเริบในช่วงหลังคลอดได้ และจำเป็นต้องได้รับการรักษา ดังนั้นจึงเป็นเรื่องสำคัญที่ต้องชั่งน้ำหนักระหว่างการใช้ยาเพื่อควบคุมโรคในมารดาและความเสี่ยงที่ทารกจะได้รับยาผ่านน้ำนมแม่
ปริมาณยาที่มารดากิน สามารถพบได้ใน serum ของทารก โดยขึ้นกับหลายปัจจัย ไม่ว่าจะเป็น ความเข้มข้นของยาที่พบได้ในนมแม่ ปริมาณน้ำนมที่ทารกกิน ความสามารถในการดูดซึมยาผ่านระบบทางเดินอาหารของทารก ซึ่งข้อแนะนำในการใช้ยาสำหรับมารดาในกลุ่มโรค RMD ที่ต้องการเลี้ยงลูกด้วยนมแม่ มีดังต่อไปนี้
- ควรส่งเสริมการเลี้ยงลูกด้วยนมแม่ในผู้หญิงกลุ่มโรค RMD ทุกราย
- ผู้หญิงที่ได้รับยา HCQ, colchicine, sulfasalazine, rituximab, และ TNF inhibitors ทุกตัว สามารถให้นมบุตรได้35-39
- ถ้าได้รับยา prednisolone <20 mg/day สามารถให้นมบุตรได้ แต่ถ้าได้รับ prednisolone ≥20 mg/day ควรเลื่อนการให้นมบุตรออกไปก่อน หรือทิ้งน้ำนมที่สะสมในช่วง 4 ชั่วโมงหลังการได้รับ glucocorticoid ไปก่อน
- ผู้หญิงที่ได้รับยา azathioprine/6-mercaptopurine, calcineurin inhibitors, NSAIDs และ non-TNF inhibitor biologic agents (anakinra, rituximab, belimumab, abatacept, tocilizumab, secukinumab, และ ustekinumab) สามารถให้นมบุตรได้40-42
- ไม่แนะนำการใช้ CYC, leflunomide, MMF, thalidomide, และ MTX ในขณะที่ให้นมบุตร ถึงแม้ว่า MTX สามารถผ่านเข้าน้ำนมได้เพียงเล็กน้อย แต่ยาตัวนี้อาจไปสะสมในเนื้อเยื่อของทารกได้43, 44
ตามที่กล่าวมาในข้างต้น ทำให้เห็นว่า ทีมรักษาผู้ป่วยหญิงในกลุ่มโรค RMD นั้นจำเป็นต้องรู้ข้อบ่งชี้และข้อห้ามในการใช้ยาต่าง ๆ เนื่องจากยาที่ใช้รักษาบางตัวนั้นเป็นอันตรายต่อทารกในครรภ์ได้ โดยจะต้องพิจารณาการใช้ยาทั้งในช่วงก่อนการตั้งครรภ์, ระหว่างการตั้งครรภ์ และช่วงให้นมบุตร ซึ่งสามารถสรุปเป็นข้อแนะนำการใช้ยาได้ตามตารางที่ 1
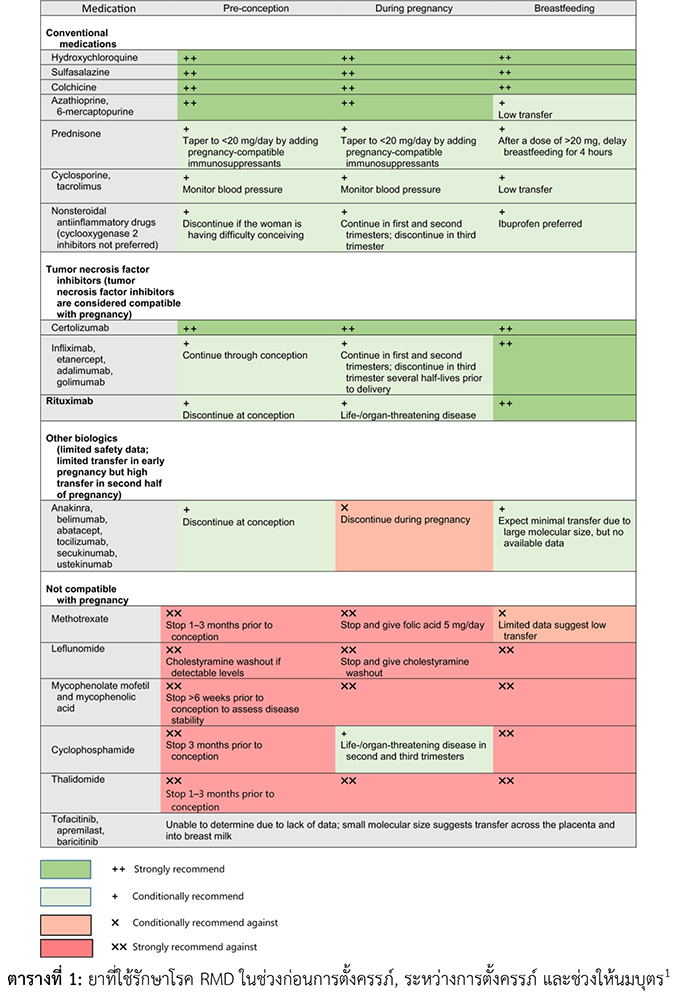
ตารางที่ 1: ยาที่ใช้รักษาโรค RMD ในช่วงก่อนการตั้งครรภ์, ระหว่างการตั้งครรภ์ และช่วงให้นมบุตร1
Contraception
การคุมกำเนิดในผู้หญิงกลุ่มโรค RMD เป็นเรื่องที่สำคัญ เพื่อเป็นการหลีกเลี่ยง unplanned pregnancy ซึ่งจะส่งผลกระทบให้ตัวโรคมีความรุนแรงมากขึ้น ทำให้เกิด adverse pregnancy outcomes ไม่ว่าจะเป็น pregnancy loss, severe prematurity หรือ growth restriction ซึ่งข้อแนะนำวิธีการคุมกำเนิดสำหรับผู้ป่วยหญิงในกลุ่มโรค RMD นั้น สรุปออกมาตามแผนภูมิที่ 2 รวมทั้งจะต้องพิจารณาถึงความปลอดภัยและประสิทธิภาพของวิธีการคุมกำเนิดแต่ละประเภทด้วย โดยเป็นไปตามตารางที่ 2
ผู้ป่วยในกลุ่มโรค RMD ที่ไม่ได้เป็น RMD/aPL-positive จะแนะนำคุมกำเนิดด้วย IUDs หรือ subdermal progestin implant (long-acting reversible contraceptives; LARC) เนื่องจากเป็นวิธีที่มี failure rates ต่ำที่สุด
SLE patients
- ในผู้ป่วยที่สามารถควบคุมโรคได้ หรือมี low disease activity และไม่ใช่ aPL-positive จะแนะนำให้คุมกำเนิดด้วย IUDs หรือ subdermal progestin implant
- ไม่แนะนำให้ใช้ transdermal estrogen-progestin patch เนื่องจากแบบ patch นั้นผู้ป่วยจะ expose ต่อ estrogen ในปริมาณที่มากกว่าแบบ oral/transvaginal methods45, 46 โดยปริมาณ estrogen ที่มากขึ้นจะเพิ่มความเสี่ยงในการกำเริบของโรคและการเกิด thrombosis ในอนาคต
- ในผู้ป่วยที่มี moderate/severe disease activity รวมไปถึงผู้ป่วยที่มี nephritis จะแนะนำให้คุมกำเนิดด้วย progestin-only หรือ IUD มากกว่าที่จะใช้ combined estrogen-progestin contraception
Antiphospholipid antibody-positive patients
- ผู้ป่วยที่มี aPL-positive เป็นข้อห้ามของการใช้ estrogen-containing contraceptives (e.g. combined estrogen-progestin) เนื่องจาก estrogen จะไปเพิ่มความเสี่ยงของการเกิด thromboembolism
- แนะนำให้ใช้ IUDs (levonorgestrel หรือ copper) หรือ progestin-only pill ในผู้ป่วยที่ aPL-positive
- ไม่แนะนำให้ใช้ DMPA เนื่องจากอาจมีผลเรื่อง thrombogenicity ได้
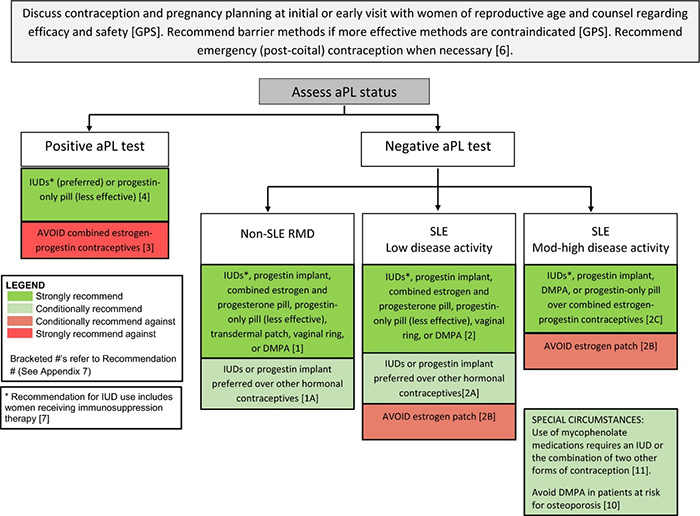
แผนภูมิที่ 2: ข้อแนะนำวิธีการคุมกำเนิดสำหรับผู้ป่วยหญิงในกลุ่มโรค RMD1
Other special RMD situations
- สำหรับผู้ป่วย RMD ที่ได้รับยา immunosuppressive therapy จะแนะนำให้คุมกำเนิดด้วย IUD (copper หรือ progestin) ถึงแม้ตามทฤษฎีแล้วการใช้ IUD จะเพิ่มความเสี่ยงในการติดเชื้อก็ตาม
- สำหรับผู้ป่วย RMD ที่มีความเสี่ยงในการเกิด osteoporosis จากการใช้ glucocorticoid หรือจากโรคของผู้ป่วยเอง จะไม่แนะนำให้ใช้ DMPA เนื่องจากข้อมูลในการศึกษาที่ผ่านมาพบว่า bone mineral density จะลดลง 7.5% ในช่วงระยะเวลา 2 ปีที่ใช้ DMPA ในกลุ่มประชากรปกติ47 ถึงแม้ว่ายังไม่มีข้อมูลว่าการใช้ DMPA จะเพิ่มความเสี่ยงของกระดูกหัก แต่อย่างไรก็ตาม ACOG ให้คำแนะนำว่าควรระมัดระวังการใช้ DMPA ในกลุ่มผู้หญิงที่มีความเสี่ยงสำหรับ osteoporosis48
- ผู้ป่วย RMD ที่รับการรักษาด้วย MMF จะแนะนำให้คุมกำเนิดด้วย IUD alone หรือ 2 other methods of contraception (เช่น คุมกำเนิดโดยการใช้ estrogen-progestin contraceptives หรือ progestin implant ร่วมกับ barrier contraceptive) เนื่องจาก MMF อาจไปลดระดับ estrogen และ progesterone ใน serum ได้
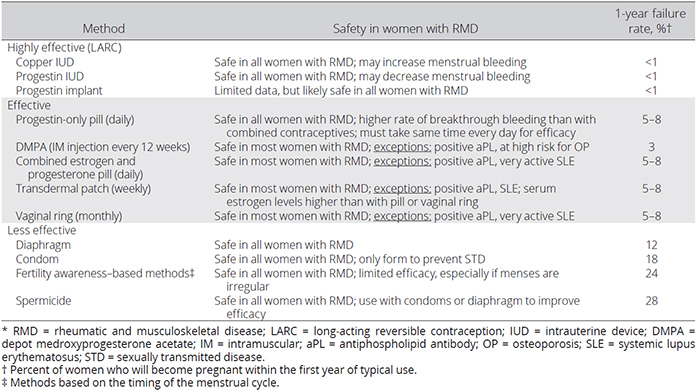
ตารางที่ 2: ความปลอดภัยและประสิทธิภาพของวิธีการคุมกำเนิดประเภทต่างๆ สำหรับผู้ป่วยหญิงในกลุ่มโรค RMD1
สำหรับผู้หญิงในกลุ่มโรคข้อและกล้ามเนื้อกระดูก (Rheumatic and Musculoskeletal Diseases) ที่อยู่ในวัยเจริญพันธุ์นั้น มีความจำเป็นที่บุคลากรทางการแพทย์ต้องให้คำแนะนำและคำปรึกษาเกี่ยวกับวิธีการคุมกำเนิด การตั้งครรภ์ การใช้ยา รวมไปถึงการให้นมบุตร ซึ่งต้องได้รับการดูแลจากทั้ง rheumatologists และสูตินรีแพทย์ (อาจรวมไปถึงผู้เชี่ยวชาญเฉพาะทางเวชศาสตร์มารดาและทารกในครรภ์) เพื่อทำให้เกิดผลลัพธ์ที่ดีทั้งต่อตัวผู้ป่วยเอง อีกทั้งทารกที่อยู่ในครรภ์ด้วย
เอกสารอ้างอิง
- Sammaritano LR, Bermas BL, Chakravarty EE, Chambers C, Clowse MEB, Lockshin MD, et al. 2020 American College of Rheumatology Guideline for the Management of Reproductive Health in Rheumatic and Musculoskeletal Diseases. Arthritis & Rheumatology. 2020;72(4):529-56.
- Stojan G, Baer AN. Flares of systemic lupus erythematosus during pregnancy and the puerperium: prevention, diagnosis and management. Expert Rev Clin Immunol. 2012;8(5):439-53.
- Yang H, Liu H, Xu D, Zhao L, Wang Q, Leng X, et al. Pregnancy-related systemic lupus erythematosus: clinical features, outcome and risk factors of disease flares–a case control study. PLoS One. 2014;9(8):e104375.
- Palmsten K, Rolland M, Hebert MF, Clowse MEB, Schatz M, Xu R, et al. Patterns of prednisone use during pregnancy in women with rheumatoid arthritis: Daily and cumulative dose. Pharmacoepidemiol Drug Saf. 2018;27(4):430-8.
- Zanatta E, Polito P, Favaro M, Larosa M, Marson P, Cozzi F, et al. Therapy of scleroderma renal crisis: State of the art. Autoimmun Rev. 2018;17(9):882-9.
- Bullo M, Tschumi S, Bucher BS, Bianchetti MG, Simonetti GD. Pregnancy outcome following exposure to angiotensin-converting enzyme inhibitors or angiotensin receptor antagonists: a systematic review. Hypertension. 2012;60(2):444-50.
- Liu EL, Liu Z, Zhou YX. Feasibility of hydroxychloroquine adjuvant therapy in pregnant women with systemic lupus erythematosus. Biomedical Research-tokyo. 2018;29:980-3.
- Leroux M, Desveaux C, Parcevaux M, Julliac B, Gouyon JB, Dallay D, et al. Impact of hydroxychloroquine on preterm delivery and intrauterine growth restriction in pregnant women with systemic lupus erythematosus: a descriptive cohort study. Lupus. 2015;24(13):1384-91.
- Eudy AM, Siega-Riz AM, Engel SM, Franceschini N, Howard AG, Clowse MEB, et al. Effect of pregnancy on disease flares in patients with systemic lupus erythematosus. Ann Rheum Dis. 2018;77(6):855-60.
- Clowse ME, Magder L, Witter F, Petri M. Hydroxychloroquine in lupus pregnancy. Arthritis Rheum. 2006;54(11):3640-7.
- Kroese SJ, de Hair MJH, Limper M, Lely AT, van Laar JM, Derksen R, et al. Hydroxychloroquine Use in Lupus Patients during Pregnancy Is Associated with Longer Pregnancy Duration in Preterm Births. J Immunol Res. 2017;2017:2810202.
- ACOG Committee Opinion No. 743 Summary: Low-Dose Aspirin Use During Pregnancy. Obstet Gynecol. 2018;132(1):254-6.
- Bao SH, Sheng SL, Liao H, Zhou Q, Frempong ST, Tu WY. Use of D-dimer measurement to guide anticoagulant treatment in recurrent pregnancy loss associated with antiphospholipid syndrome. Am J Reprod Immunol. 2017;78(6).
- van Hoorn ME, Hague WM, van Pampus MG, Bezemer D, de Vries JI. Low-molecular-weight heparin and aspirin in the prevention of recurrent early-onset pre-eclampsia in women with antiphospholipid antibodies: the FRUIT-RCT. Eur J Obstet Gynecol Reprod Biol. 2016;197:168-73.
- Clark CA, Spitzer KA, Crowther MA, Nadler JN, Laskin MD, Waks JA, et al. Incidence of postpartum thrombosis and preterm delivery in women with antiphospholipid antibodies and recurrent pregnancy loss. J Rheumatol. 2007;34(5):992-6.
- ACOG Practice Bulletin No. 196 Summary: Thromboembolism in Pregnancy. Obstet Gynecol. 2018;132(1):243-8.
- Ruffatti A, Tonello M, Hoxha A, Sciascia S, Cuadrado MJ, Latino JO, et al. Effect of Additional Treatments Combined with Conventional Therapies in Pregnant Patients with High-Risk Antiphospholipid Syndrome: A Multicentre Study. Thromb Haemost. 2018;118(4):639-46.
- Brito-Zerón P, Izmirly PM, Ramos-Casals M, Buyon JP, Khamashta MA. The clinical spectrum of autoimmune congenital heart block. Nat Rev Rheumatol. 2015;11(5):301-12.
- Izmirly PM, Rivera TL, Buyon JP. Neonatal lupus syndromes. Rheum Dis Clin North Am. 2007;33(2):267-85, vi.
- 20. Kan N, Silverman ED, Kingdom J, Dutil N, Laskin C, Jaeggi E. Serial echocardiography for immune-mediated heart disease in the fetus: results of a risk-based prospective surveillance strategy. Prenat Diagn. 2017;37(4):375-82.
- Izmirly PM, Costedoat-Chalumeau N, Pisoni CN, Khamashta MA, Kim MY, Saxena A, et al. Maternal use of hydroxychloroquine is associated with a reduced risk of recurrent anti-SSA/Ro-antibody-associated cardiac manifestations of neonatal lupus. Circulation. 2012;126(1):76-82.
- Feldkamp M, Carey JC. Clinical teratology counseling and consultation case report: low dose methotrexate exposure in the early weeks of pregnancy. Teratology. 1993;47(6):533-9.
- Kainz A, Harabacz I, Cowlrick IS, Gadgil SD, Hagiwara D. Review of the course and outcome of 100 pregnancies in 84 women treated with tacrolimus. Transplantation. 2000;70(12):1718-21.
- Sifontis NM, Coscia LA, Constantinescu S, Lavelanet AF, Moritz MJ, Armenti VT. Pregnancy outcomes in solid organ transplant recipients with exposure to mycophenolate mofetil or sirolimus. Transplantation. 2006;82(12):1698-702.
- Vargesson N. Thalidomide-induced teratogenesis: History and mechanisms. Birth Defects Research Part C: Embryo Today: Reviews. 2015;105(2):140-56.
- Bérard A, Zhao JP, Shui I, Colilla S. Leflunomide use during pregnancy and the risk of adverse pregnancy outcomes. Ann Rheum Dis. 2018;77(4):500-9.
- Tuin J, Sanders JS, de Joode AA, Stegeman CA. Pregnancy in women diagnosed with antineutrophil cytoplasmic antibody-associated vasculitis: outcome for the mother and the child. Arthritis Care Res (Hoboken). 2012;64(4):539-45.
- Diav-Citrin O, Blyakhman S, Shechtman S, Ornoy A. Pregnancy outcome following in utero exposure to hydroxychloroquine: a prospective comparative observational study. Reprod Toxicol. 2013;39:58-62.
- Connell W, Miller A. Treating inflammatory bowel disease during pregnancy: risks and safety of drug therapy. Drug Saf. 1999;21(4):311-23.
- Indraratna PL, Virk S, Gurram D, Day RO. Use of colchicine in pregnancy: a systematic review and meta-analysis. Rheumatology (Oxford). 2018;57(2):382-7.
- Saavedra M, Sánchez A, Morales S, Ángeles U, Jara LJ. Azathioprine during pregnancy in systemic lupus erythematosus patients is not associated with poor fetal outcome. Clin Rheumatol. 2015;34(7):1211-6.
- Koren G, Florescu A, Costei AM, Boskovic R, Moretti ME. Nonsteroidal antiinflammatory drugs during third trimester and the risk of premature closure of the ductus arteriosus: a meta-analysis. Ann Pharmacother. 2006;40(5):824-9.
- Chakravarty EF, Murray ER, Kelman A, Farmer P. Pregnancy outcomes after maternal exposure to rituximab. Blood. 2011;117(5):1499-506.
- Breastfeeding and the Use of Human Milk. Pediatrics. 2012;129(3):e827.
- Motta M, Tincani A, Faden D, Zinzini E, Lojacono A, Marchesi A, et al. Follow-Up of Infants Exposed to Hydroxychloroquine Given to Mothers during Pregnancy and Lactation. Journal of Perinatology. 2005;25(2):86-9.
- Ben-Chetrit E, Scherrmann JM, Levy M. Colchicine in breast milk of patients with familial Mediterranean fever. Arthritis Rheum. 1996;39(7):1213-7.
- Bragnes Y, Boshuizen R, de Vries A, Lexberg Å, Østensen M. Low level of Rituximab in human breast milk in a patient treated during lactation. Rheumatology (Oxford). 2017;56(6):1047-8.
- Berlin CM, Jr., Yaffe SJ. Disposition of salicylazosulfapyridine (Azulfidine) and metabolites in human breast milk. Dev Pharmacol Ther. 1980;1(1):31-9.
- Fritzsche J, Pilch A, Mury D, Schaefer C, Weber-Schoendorfer C. Infliximab and adalimumab use during breastfeeding. J Clin Gastroenterol. 2012;46(8):718-9.
- Gardiner SJ, Gearry RB, Roberts RL, Zhang M, Barclay ML, Begg EJ. Comment: Breast-feeding during maternal use of azathioprine. Ann Pharmacother. 2007;41(4):719-20; author reply 20.
- Bramham K, Chusney G, Lee J, Lightstone L, Nelson-Piercy C. Breastfeeding and tacrolimus: serial monitoring in breast-fed and bottle-fed infants. Clin J Am Soc Nephrol. 2013;8(4):563-7.
- Matro R, Martin CF, Wolf D, Shah SA, Mahadevan U. Exposure Concentrations of Infants Breastfed by Women Receiving Biologic Therapies for Inflammatory Bowel Diseases and Effects of Breastfeeding on Infections and Development. Gastroenterology. 2018;155(3):696-704.
- Transfer of drugs and other chemicals into human milk. Pediatrics. 2001;108(3):776-89.
- Johns DG, Rutherford LD, Leighton PC, Vogel CL. Secretion of methotrexate into human milk. Am J Obstet Gynecol. 1972;112(7):978-80.
- Galzote RM, Rafie S, Teal R, Mody SK. Transdermal delivery of combined hormonal contraception: a review of the current literature. Int J Womens Health. 2017;9:315-21.
- van den Heuvel MW, van Bragt AJ, Alnabawy AK, Kaptein MC. Comparison of ethinylestradiol pharmacokinetics in three hormonal contraceptive formulations: the vaginal ring, the transdermal patch and an oral contraceptive. Contraception. 2005;72(3):168-74.
- Clark MK, Sowers M, Levy B, Nichols S. Bone mineral density loss and recovery during 48 months in first-time users of depot medroxyprogesterone acetate. Fertility and Sterility. 2006;86(5):1466-74.
- Committee Opinion No. 642: Increasing Access to Contraceptive Implants and Intrauterine Devices to Reduce Unintended Pregnancy. Obstet Gynecol. 2015;126(4):e44-8.


