Intrauterine devices: ห่วงอนามัย
Intrauterine devices: ห่วงอนามัย
น.พ. ธรรมพจน์ จีรากรภาสวัฒน์
อ. พ.ญ. ทวิวัน พันธศรี
ห่วงอนามัย (intrauterine device) เป็นการคุมกำเนิดที่ปลอดภัยและมีประสิทธิภาพดีวิธีหนึ่ง เป็นหนึ่งในสามวิธีของการคุมกำเนิดที่ใช้ความร่วมมือจากผู้ใช้น้อยที่สุด ได้แก่ ยาฝังคุมกำเนิด การผ่าตัดทำหมัน และการใช้ห่วงอนามัย ซึ่งในปัจจุบันมีรูปลักษณ์และวัสดุภัณฑ์ที่ใช้ทำห่วงอนามัยหลากหลาย เพื่อเพิ่มประสิทธิภาพในการคุมกำเนิด ซึ่งข้อดีของห่วงอนามัย ได้แก่ มีประสิทธิภาพในการคุมกำเนิดสูง สามารถคุมกำเนิดได้นานหลายปี และเมื่อหยุดใช้ความสามารถในการกลับมีบุตรนั้นสามารถกลับคืนมาได้รวดเร็ว(1)
ความนิยมของการใช้ห่วงอนามัยคิดเป็นร้อยละ 23 ของประชาการหญิงทั่วโลก โดยในประเทศสหรัฐอเมริกามีแนวโน้มของความนิยมการใช้ห่วงอนามัยมากขึ้น สังเกตได้จาก ในปี ค.ศ. 2002 มีผู้ใช้ร้อยละ 2 ของประชากรหญิงที่คุมกำเนิด ซึ่งเพิ่มสูงขึ้นเป็นร้อยละ 7.7 ในปี ค.ศ.2009 แต่ในทวีปเอเชีย มีผู้ใช้ถึงร้อยละ 27 และทวีปยุโรปร้อยละ 17 สาเหตุที่ทำให้การใช้ห่วงอนามัยในการคุมกำเนิดนั้นไม่เป็นที่นิยมมากนัก เนื่องจากในอดีตมีการเผยแพร่ว่าการใช้ห่วงอนามัย เพิ่มความเสี่ยงให้เกิดการตั้งครรภ์นอกมดลูก การติดเชื้อในโพรงมดลูก และภาวะมีบุตรยาก และจากข้อมูลปี ค.ศ. 2008 พบว่ามีผู้ใช้ห่วงอนามัยในการคุมกำเนิดราว 150ล้านคนทั่วโลก โดยที่ 100ล้านคนเป็นผู้ใช้จากประเทศจีน(2)
กลไกการทำงานของห่วงอนามัยในการคุมกำเนิด
กลไกการทำงานของห่วงอนามัยในการคุมเนิดนั้น คาดว่าเกิดจากกลไกการอักเสบจากวัสดุแปลกปลอม กล่าวคือ การทำงานของห่วงอนามัยนั้นไม่ใช่การป้องกันการฝังตัวของตัวอ่อนเท่านั้น หากแต่เกิดจากการที่มีวัสดุแปลกปลอมในโพรงมดลูก ทำให้เกิดการกระตุ้นกระบวนการอักเสบภายในร่างกาย ซึ่งกระบวนการนี้เองเป็นพิษต่อตัวอสุจิไข่ และขัดขวางการฝังตัวของตัวอ่อน นอกจากนั้นยังมีกลไกอื่นๆ เช่น ในห่วงอนามัยชนิดหุ้มทองแดง (copper IUD)มีการปล่อยอนุมูลทองแดงอิสระ และเกลือของทองแดง ซึ่งกระตุ้นให้เกิดกระบวนการอักเสบต่อเซลล์ภายในโพรงมดลูก (cytotoxic inflammatory reaction) โดยกระตุ้นการสร้างสาร prostaglandin ซึ่งเป็นพิษต่อตัวอสุจิ และไข่ นอกจากนั้นยังขัดขวางการเคลื่อนตัวของอสุจิ ปฏิกิริยา acrosomal reaction และในกรณีที่เป็นห่วงอนามัยชนิดหลั่งสารโปรเจสติน (progestin-releasing IUD) จะเพิ่มกลไกการหนาตัวของมูกบริเวณปากมดลูกเพื่อป้องกันการเคลื่อนตัวของอสุจิ และยังทำให้ผนังเยื่อบุโพรงมดลูกบางตัวลงไม่พร้อมสำหรับการฝังตัวอ่อน และยังเพิ่มการแสดง glycoderlin A ที่ต่อมบริเวณเยื่อบุโพรงมดลูก ซึ่งยับยั้งการจับตัวของอสุจิที่ผนังของไข่อีกด้วย นอกจากนั้นฮอร์โมนโปรเจสตรินเองยังส่งผลต่อการยับยั้งการตกไข่ ประมาณร้อยละ 25(1)
ชนิดของห่วงอนามัย แบ่งได้ 4ประเภทใหญ่ (1) ดังนี้
- ห่วงอนามัยชนิดหุ้มทองแดง (copper IUDs)
- ห่วงอนามัยชนิดหลั่งสารโปรเจสตริน (progestin-releasing IUDs)
- ห่วงอนามัยชนิดไม่เคลือบสาร (unmedicated or inert IUDs)
- ห่วงอนามัยชนิดไม่โครง (frameless IUD)
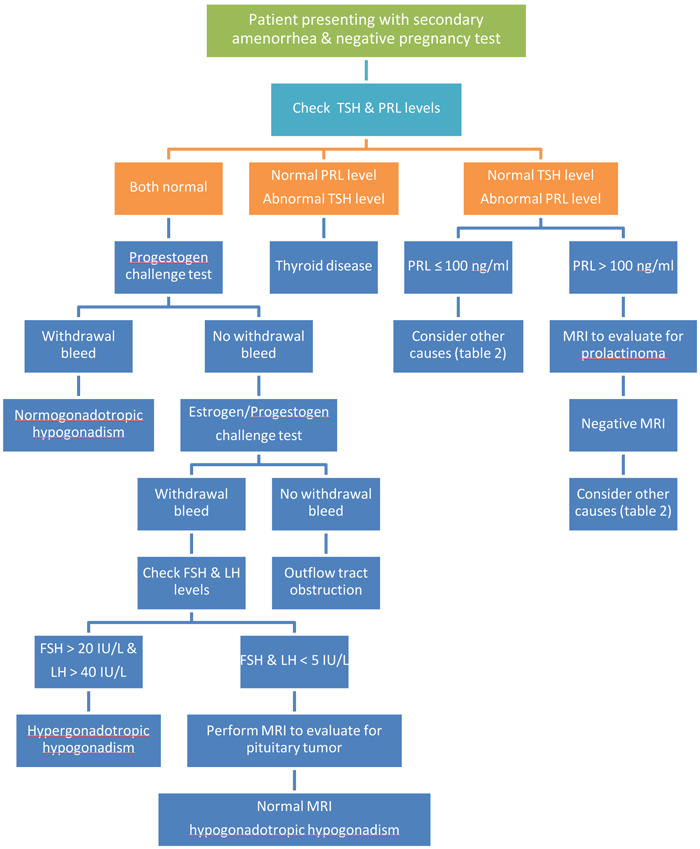
1. ห่วงอนามัยชนิดหุ้มทองแดง (copper IUDs) ซึ่งชนิดที่มีจำหน่ายในท้องตลาดคือรุ่น TCu380A (Paragard®) ซึ่งเป็นห่วงอนามัยรูปตัว T ซึ่งมีขดลวดทองแดงขนาดเล็กพันบริเวณแกนตั้งและแกนนอนทั้งสองข้างของห่วงอนามัย คิดเป็นพื้นที่ผิว 380 ตารางเมตร และบริเวณปลายแกนตั้งมีปุ่มกลมขนาด 3มิลลิเมตร เพื่อป้องกันห่วงอนามัยหลุดออกจากปากมดลูก และมีไหมสีขาวชนิด monofilament ผูกต่อยาวมาจากปลายปุ่มกลมนั้น นอกจากนั้นห่วงอนามัยชนิดนี้ยังเคลือบด้วยสารแบเรียมซัลเฟต ซึ่งสามารถตรวจพบได้ด้วยการเอ็กซเรย์ และไม่มีส่วนประกอบของลาเท็กซ์นอกจากนี้ยังมีรุ่น MultiloadCu375 ซึ่งเป็นห่วงอนามัยรูปก้างปลา มีขดลวดทองแดงพันในแกนตั้ง คิดเป็นพื้นที่ผิว 375ตารางเมตร
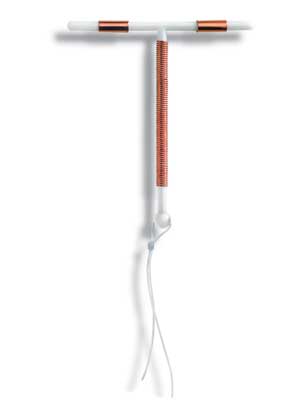
Picture from : http://www.safeandeffective.org/pages/copper-t-iud
จากการศึกษาพบว่าระดับสารทองแดงในเลือดมีค่าสูงกว่าปกติเล็กน้อยในผู้ใช้ห่วงอนามัยชนิดนี้ แต่ค่าสารทองแดงที่สูงดังกล่าวไม่ส่งผลให้เกิดอาการผิดปกติทางคลินิก (3)
ห่วงอนามัยชนิดหุ้มทองแดงมีประสิทธิภาพได้นาน 5-10ปี (รุ่น MultiloadCu375 อายุการใช้งาน 5ปี, และรุ่น TCu380 อายุการใช้งาน 10ปี)
ประสิทธิภาพของห่วงอนามัยชนิดนี้ หากผู้ใช้มีการตรวจสอบว่าสายของห่วงอนามัยยังอยู่ภายในช่องคลอดดีนั้น พบว่าโอกาสการตั้งครรภ์ภายในหนึ่งปีแรกของการใส่ห่วงอนามัยชนิดนี้ เท่ากับร้อยละ 0.6 หลังจากนั้นโอกาสการตั้งครรภ์ภายหลังปีที่ 7 ของการใช้ เท่ากับร้อยละ 1.4-1.6และภายหลังการใช้ปีที่ 8และ 12เท่ากับร้อยละ 2.2และประสิทธิภาพในการคุมกำเนิดจะลดลงหากปริมาณพื้นที่ผิวของสารทองแดงน้อยกว่า 380 ตารางเมตร(1, 4)
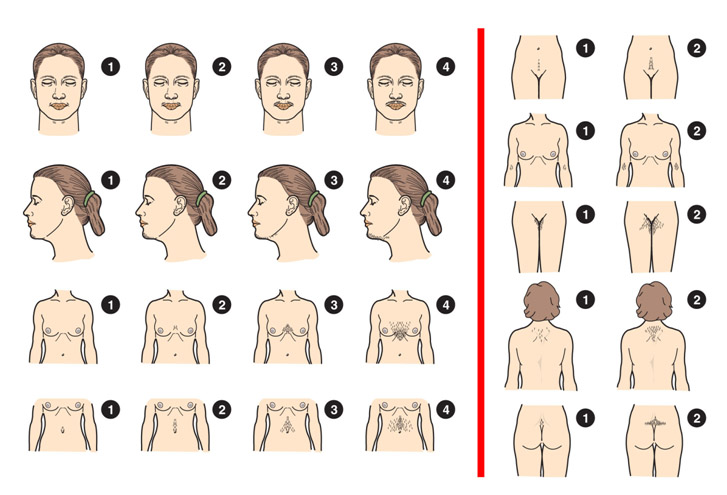
2. ห่วงอนามัยชนิดหลั่งสารโปรเจสติน (progestin-releasing IUDs) ซึ่งปัจจุบันใช้สารโปรเจสติน ชนิด levonorgestrelซึ่งมี 2ขนาด คือ
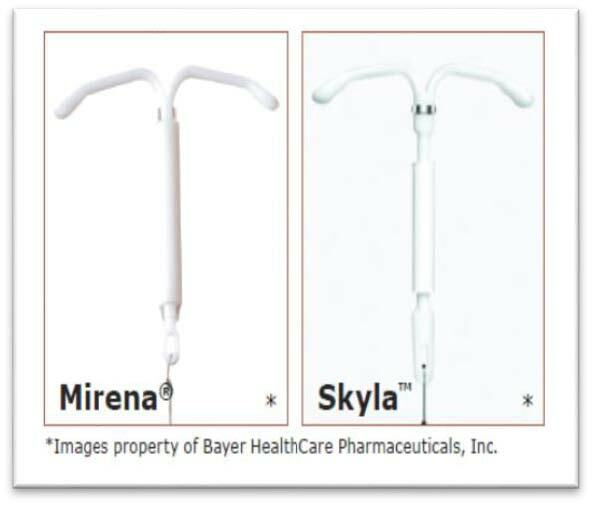
Picture from: https://www.arhp.org/Publications-and-Resources/Patient-Resources/Fact-Sheets/AAHormonalIUD
a. Levonorgestrel-releasing IUD (LNg 20) (Mirena®) ประกอบด้วยสาร Levonorgestrel52มิลลิกรัม ซึ่งจะหลั่งสาร Levonorgestrelในอัตรา 20ไมโครกรัมต่อวัน หลังจากใช้งานไปประมาณ 5 ปี ระดับสาร Levonorgestrelที่หลั่งออกมาจะลดปริมาณลงเหลือ 10-14 ไมโครกรัมต่อวัน และห่วงอนามัยชนิดนี้ยังเคลือบสารแบเรียมซัลเฟตซึ่งสามารตรวจพบได้ด้วยการเอ็กซเรย์ และไม่มีส่วนประกอบของลาเท็กซ์ผสมอยู่
คุณสมบัติของห่วงอนามัยชนิดนี้พบว่าที่บริเวณเยื่อบุโพรงมดลูกมีความเข้มข้นของสาร Levonorgestrelสูงกว่าการใช้ยาฝังคุมกำเนิดที่หลั่งสาร Levonorgestrelถึง 1000 เท่า และภายหลังการใส่ห่วงอนามัยชนิดนี้ระดับความเข้มข้นของสาร Levonorgestrelในกระแสเลือดจะสูงขึ้นที่ระดับ 100-200 พิโคกรัมต่อมิลลิลิตร ในช่วงสัปดาห์แรก และหลังจากนั้นจะค่อยๆลดระดับลง (5, 6)ซึ่งแตกต่างจากการใช้ยาฝังคุมกำเนิดและยาเม็ดคุมกำเนิดชนิดรับประทาน ซึ่งระดับความเข้มข้นของสาร Levonorgestrelจะสูงขึ้นไปที่ 350และ 1500-2000 พิโคกรัมต่อมิลลิลิตร ตามลำดับ ซึ่งอาจส่งผลข้างเคียงต่อผู้ใช้บางราย
ประสิทธิภาพของห่วงอนามัยชนิดนี้ โอกาสการตั้งครรภ์ในปีแรก เท่ากับร้อยละ 0.1-0.2และภายหลังการใช้ที่ 5 ปี เท่ากับร้อยละ 0.5-1.1ซึ่งหวงอนามัยชนิด LNg20 มีอายุการใช้งานที่ 5ปี แต่ไม่เกิน 7ปี(1, 4)
b. Levonorgestrel-releasing IUD (LNg14) (Skyla®) ประกอบด้วยสารLevonorgestrel13.5มิลลิกรัม ซึ่งจะหลั่งสาร Levonorgestrel ในอัตรา 14ไมโครกัรมต่อวันหลังจากนั้นจะค่อยๆลดระดับลงไปที่ 5 ไมโครกรัมต่อวันภายใน 3ปี ซึ่งข้อได้เปรียบของห่วงอนามัยชนิดนี้คือเรื่องขนาดที่เล็กกว่าชนิด LNg 20 โดยขนาดของเครื่องมือที่ใช้ใส่ห่วงอนามัยเส้นผ่าศุนย์กลางต่างกันคือ 3.8มิลลิเมตรกับ 4.75มิลลิเมตร ซึ่งเหมาะสมสำหรับผู้ใช้ที่มีขนาดของโพรงมดลูกค่อนข้างเล้ก หรือปากมดลูกตีบ นอกจากนี้ที่ตัวห่วงอนามัยมีวงแหวนเงินฝังอยู่สามารถตรวจพบได้ทั้งจากการอัลตราซาวน์หรือเอ็กซเรย์
ประสิทธิภาพของห่วงอนามัยชนิด LNg 14 คือโอกาสตั้งครรภ์ในปีแรก เท่ากับร้อยละ 0.41 และภายใน 3 ปีเท่ากับร้อยละ 0.9 โดยอายุการใช้งานอยู่ที่ 3 ปี (1)และสามารถพบเลือดออกกระปริบกระปรอยได้ในระยะ 6 เดือนแรกหลังใส่ห่วงอนามัย ทั้งนี้มีการศึกษารายงานเบื้องต้นว่าการใช้ห่วงอนามัยชนิด LNg14 และ LNg20 นั้นสามารถลดปริมาณประจำเดือน และลดการเกิดเลือดออกกระปริบกระปรอยได้เมื่อใช้ต่อไป แต่มีรายงานว่าการใช้ห่วงอนามัยชนิด LNg14 มีโอกาสทำให้เกิดภาวะขาดประจำเดือนได้น้อยกว่าชนิด LNg20 คิดเป็นร้อยละ 13และ 24 ตามลำดับ(1)
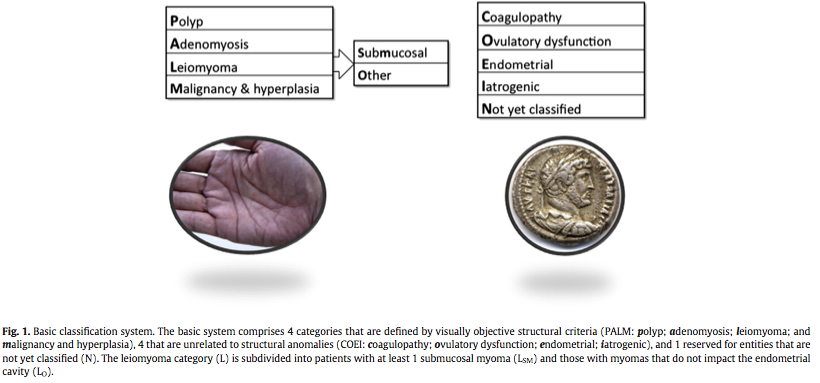
3. ห่วงอนามัยชนิดไม่เคลือบสาร (unmedicated or inert IUDs) ซึ่งผลิตจากพลาสติก หรือแสตนเลส มีการฉาบสารแบเรียมซัลเฟตซึ่งสามารถตรวจพบห่วงอนามัยได้จากการเอ็กซเรย์ และโดยทั่วไปมักมีสายของห่วงอนามัยประกอบอยู่ด้วย แต่ก็มีห่วงอนามัยบางรุ่นที่ไม่มีสายของห่วงอนามัยซึ่งมักเป็นที่นิยมในประเทศจีน ซึ่งข้อดีของการใช้ห่วงอนามัยชนิดนี้คือไม่จำเป็นต้องเปลี่ยนห่วงอนามัย(1)

Picture from : http://www.teara.govt.nz/en/object/26988/iuds
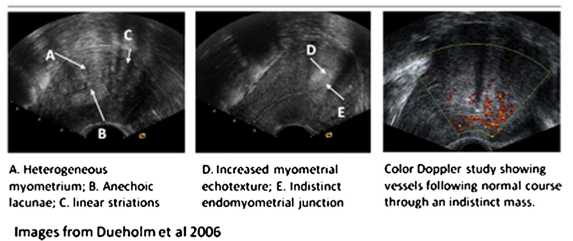
4. ห่วงอนามัยชนิดไม่มีโครง (frameless IUD) (Gynefix® or Fibroplant®) เป็นห่วงอนามัยที่ไม่มีโครงพลาสติกตรงกลางที่สำหรับใช้ขดลวดทองแดงพัน ซึ่งมีจำหน่ายทั่วโลก ยกเว้นประเทศสหรัฐอเมริกา เช่น Gynefixทำจากแท่งทองแดงทรงกระบอกร้อยอยู่ในเส้นไหม polypropylene หรือ Fibroplantหลอดหลั่งสาร Levonorgestrel 14-20 ไมโครกรัมต่อวัน ซึ่งในอดีตก่อนปี ค.ศ.1996 พบว่าโอกาสการเลื่อนหลุดของห่วงอนามัยชนิดนี้สูงมาก ซึ่งภายหลังได้ปรับปรุงให้ห่วงอนามัยชนิดนี้มีตะขอเกี่ยวยึดไว้กับชั้นกล่ามเนื้อมดลูกได้ ข้อดีของห่วงอนามัยชนิดนี้คือมีขนาดเล็ก มีประสิทธิภาพเทียบเท่า และผู้ใช้สามารถทนต่อผลข้างเคียงได้ดีกว่า แต่ข้อเสียคือแพทย์ผู้ใส่ห่วงอนามัยให้นั้นจำเป็นต้องมีทักษะและได้รับการฝึกฝนเทคนิควิธีการใส่มาพอสมควร (1)
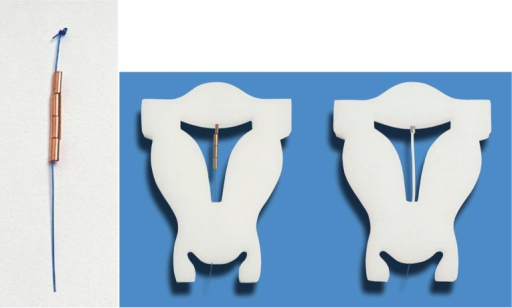
Picture from: http://openi.nlm.nih.gov/detailedresult.php?img=3645905_ijwh-5-215Fig6&req=4
การเลือกใช้ห่วงอนามัย
คุณสมบัติของผู้ที่จะใช้ห่วงอนามัย(1, 4)
- มีความต้องการจะคุมกำเนิดด้วยวิธีที่มีประสิทธิภาพสูง
- ผู้ใช้จำเป็นต้องมีความเสี่ยงต่ำในการติดต่อโรคติดต่อทางเพศสัมพันธ์
- มีความต้องการจะคุมกำเนิดระยะยาวอย่างน้อย 1ปีขึ้นไป
- มีความต้องการที่จะสามารถกลับมาตั้งครรภ์ได้หากหยุดใช้ห่วงอนามัย
- มีความจำเป็นที่จะต้องหลีกเลี่ยงวิธีการคุมกำเนิดที่มีฮอร์โมนเอสโตรเจน
- มีความจำเป็นอื่นๆ ที่ต้องใช้ห่วงอนามัยในการบำบัดรักษา โดยมิได้หวังผลเพื่อการคุมกำเนิด
- มีความจำเป็นเลือกใช้ห่วงอนามัยชนิดหุ้มทองแดงเพื่อการคุมกำเนิดแบบฉุกเฉิน
ข้อห้ามในการเลือกใช้ห่วงอนามัย (1)
- โพรงมดลูกผิดรูปอย่างรุนแรง (Severe uterine distortion) ซึ่งมักเกิดจากความผิดปกติด้านโครงสร้างของโพรงมดลูก เช่น Bicornuate uterus, ปากมดลูกตีบ (cervical stenosis), ก้อนเนื้อของกล้ามเนื้อมดลูกที่ทำให้โพรงมดลูกผิดรูป ซึ่งปัจจัยเหล่านี้เพิ่มความยากในการใส่ห่วงอนามัย และเพิ่มโอกาสห่วงอนามัยหลุดได้ง่าย ซึ่งทางบริษัทผู้ผลิตแนะนำขนาดความลึกของโพรงมดลูกที่เหมาะสมคือ 6-9 เซนติเมตร
- มีการติดเชื้อในอวัยวะในอุ้งเชิงกรานอยู่ (Active pelvic infection) เช่น ภาวะอุ้งเชิงกรานอักเสบ (pelvic inflammatory disease), เยื่อบุโพรงมดลูกอักเสบ (endometritis), ปากมดลูกอักเสบเป็นหนอง (mucopurulent cervicitis), หรือวัณโรคในอุ้งเชิงกราน (pelvic tuberculosis) หากมีการติดเชื้อในอุ้งเชิงกรานดังกล่าวควรรักษาให้หายสนิทอย่างน้อย 3เดือน จึงพิจารณาให้ใส่ห่วงอนามัย ซึ่งแนะนำให้ใช้ห่วงอนามัยชนิดเคลือบสาร Levonorgestrelมากกว่าชนิดหุ้มทองแดง
- ทราบหรือสงสัยว่าตั้งครรภ์ เนื่องจากการใส่ห่วงอนามัยเพิ่มโอกาสแท้ง และแท้งติดเชื้อ
- Wilson’s disease หรือมีภาวะแพ้ทองแดง ในกรณีเลือกใช้ห่วงอนามัยชนิดหุ้มทองแดง
- เลือดออกผิดปกติจากโพรงมดลูกที่ยังไม่ทราบสาเหตุแน่ชัด เนื่องจากภายหลังการใส่ห่วงอนามัยอาจมีเลือดออกกระปริดกระปรอยทางช่องคลอดได้ ดังนั้นในรายที่มีปัญหาเลือดออกผิดปกติจากโพรงมดลูกที่ยังไม่ทราบสาเหตุที่แน่ชัด ควรได้รับการตรวจวินิจฉัยทางพยาธิวิทยาให้แน่ชัดก่อน
- อื่นๆ เช่น โรคมะเร็งเต้านมที่ยังได้รับการบำบัดรักษาอยู่ ไม่แนะนำให้ใช้ห่วงอนามัยชนิดเคลือบสาร Levonorgestrelแม้ว่าในปัจจุบันยังไม่มีรายงานการเกิดมะเร็งเต้านมในผู้ป่วยที่ใช้ห่วงอนามัยชนิดเคลือบสาร Levonorgestrelก็ตาม แต่อย่างไรก็ตามระดับสาร Levonorgestrelในกระแสเลือด ของที่ผู้ใส่ห่วงอนามัยชนิดหลั่งสาร Levonorgestrelนั้นต่ำกว่าวิธีการคุมกำเนิดด้วยฮอร์โมนอื่นๆ มาก จึงอาจนำมาใช้ในกรณีที่จำเป็นได้หรือมีประวัติปวดท้องประจำเดือน หรือประจำเดือนมามากมาก่อน ไม่ควรเลือกใช้ห่วงอนามัยชนิดหุ้มทองแดง
ปัจจัยในการพิจารณาเลือกใช้ห่วงอนามัยชนิดหุ้มทองแดงหรือชนิดหลั่งสาร levonorgestrel
- ประวัติของรอบเดือน ความสม่ำเสมอ ปริมาณประจำเดือน และอาการปวดท้องประจำเดือน
- โรคประจำตัว
- ความต้องการของผู้ใช้ในเรื่องต้องการลดปริมาณประจำเดือน หรือบรรเทาอาการปวดท้องประจำเดือน
- ความรับรู้หรือความรู้สึกของผู้ใช้ห่วงอนามัย หากหลังการใส่ห่วงอนามัยแล้วมีภาวะขาดประจำเดือน หรือเลือดออกกระปริบกระปรอย
ปัญหาและผลข้างเคียงจากการใช้ห่วงอนามัย(7)
1. การเลื่อนหลุดของห่วงอนามัย (Expulsion)
- โอกาสในการเลื่อนหลุดสูงสุดในช่วงปีแรกหลังการใส่ และโอกาสลดลงหลังจากนั้น โดยโอกาสเลื่อนหลุดของห่วงอนามัยชนิด TCU380 เท่ากับร้อยละ 3 – 10 ชนิด LNg20 เท่ากับร้อยละ 3 – 6 และชนิด LNG14 เท่ากับร้อยละ 3.2 (4, 7)
- ปัจจัยเสี่ยงที่เพิ่มโอกาสเลื่อนหลุดของห่วงอนามัย คือ มีประวัติเคยมีห่วงอนามัยเลื่อนหลุดมาก่อน ประจำเดือนมามาก ปวดท้องประจำเดือนรุนแรง หรือใส่ห่วงอนามัยทันทีภายหลังการแท้งในไตรมาสที่สอง หรือภายหลังการคลอด
- ผู้ป่วยมักมีอาการ ปวดบีบท้องน้อย (cramping) ตกขาวผิดปกติ มีเลือดออกผิดปกติระหว่างรอบเดือน หรือภายหลังการมีเพศสัมพันธ์ มีอาการเจ็บปวดขณะมีเพศสัมพันธ์ (dyspareunia) ทั้งฝ่ายชายและฝ่ายหญิง ผู้ใช้คลำได้สายของห่วงอนามัยยาวขึ้นหรือคลำไม่ได้
- การรักษาให้ตรวจภายในดูว่ามีสายหรือห่วงอนามัยอยู่บริเวณปากมดลูกหรือในช่องคลอด หรือไม่ หากมีให้นำออกและงดนำกลับมาใช้ซ้ำ หากไม่พบแนะนำให้ทำการตรวจอัลตราซาวน์ หรือเอ็กซเรย์อุ้งเชิงกราน เพื่อค้นหาและยืนยันว่ามีหรือไม่มีห่วงอนามัยอยู่ภายในโพรงมดลูก
2. การเลื่อนหลุดของห่วงอนามัยซ้ำซ้อน (recurrent expulsion)
- หากพบว่าผู้ใช้ห่วงอนามัยมีปัญหาเรื่องการหลุดซ้ำซ้อน ควรสืบหาสาหตุว่าเกิดจากเทคนิคการใส่ หรือความผิดปกติที่โพรงมดลูก เช่น severe flexion โพรงมดลูกรูปร่างผิดปกติ หรือปากมดลูกด้านในเปิดกว้างออก (patulous internal os) (8)
- หากผู้ใช้ต้องการใส่ห่วงอนามัยซ้ำ แนะนำให้ใส่ห่วงอนามัย ร่วมกับอัลตราซาวน์นำ ว่าใส่ห่วงอนามัยในตำแหน่งของยอดของโพรงมดลูก (uterine fundus)ได้เหมาะสม
3. ตำแหน่งของห่วงอนามัยไม่เหมาะสม (malposition)
- ตำแหน่งของห่วงอนามัยที่เหมาะสมคือ บริเวณยอดโพรงมดลูก (uterine fundus) ซึ่งพบว่าตำแหน่งของห่วงอนามัยที่ไม่เหมาะสม (malposition) พบได้ประมาณร้อยละ 10ของผู้ใช้ ซึ่งไม่จำเป็นต้องนำห่วงอนามัยออกทุกครั้งไป
- ผู้ป่วยมักมีอาการปวดบีบท้องน้อย ซึ่งไม่เคยมีอาการมาก่อน ประจำเดือนมามากผิดปกติ เลือดออกผิดปกติระหว่างรอบเดือน
- การรักษาขึ้นกับอาการและตำแหน่งของห่วงอนามัย หากผู้ป่วยมีอาการผิดปกติดังกล่าวแนะนำให้นำห่วงอนามัยออก แต่หากผู้ป่วยไม่มีอาการ แนะนำให้ตรวจด้วยอัลตราซาวน์หรือเอ็กซเรย์เพื่อดูตำแหน่งของห่วงอนามัย หากห่วงอนามัยอยู่ในตำแหน่งส่วนล่างของโพรงมดลูก (lower uterine segment) หรือใกล้กับตำแหน่งยอดของโพรงมดลูก ไม่จำเป็นต้องนำห่วงอนามัยออก และโอกาสการเกิดห่วงเลื่อนหลุดนั้นน้อย แต่หากห่วงอนามัยนั้นอยู่ต่ำกว่าตำแหน่งของ internal osแนะนำให้นำห่วงอนามัยออก(7)
4. ไม่พบสายของห่วงอนามัย(strings not visible) (4, 7)
- เหตุการณ์ที่น่าจะเกิดขึ้นเมื่อตรวจภายใน แล้วไม่พบสายของห่วงอนามัย เรียงลำดับจากมากไปน้อยดังนี้
- ห่วงอนามัยยังอยู่ในโพรงมดลูก แต่สายของห่วงอนามัยบิดม้วนเข้าไปอยู่ภายในปากมดลูก หรือสายของห่วงอนามัยขาดหายไป
- ห่วงอนามัยหลุด
- ห่วงอนามัยหลุดทะลุเข้าไปในชั้นกล้ามเนื้อมดลูก หรือภายในช่องท้อง
- การรักษา หากพบเหตุการณ์เช่นนี้ แนะนำให้ทดสอบการตั้งครรภ์ก่อน
- หากไม่ตั้งครรภ์ แนะนำให้ใช้ cytobrushใส่เข้าไปในปากมดลูก เพื่อตรวจสอบว่ามีสายของห่วงอยามัยขดอยู่ภายในปากมดลูกหรือไม่
- หากไม่พบสายของห่วงอนามัยในปากมดลูก แนะนำให้ทำอัลตราซาวน์ เพื่อยืนยันว่ามีห่วงอนามัยในโพรงมดลูกหรือไม่
- แต่หากไม่พบจากการอัลตราซาวน์ แนะนำให้เอ็กซเรย์ช่องท้องและอุ้งเชิงกราน ท่า Anteroposterior (AP) และท่า lateral upright หากไม่พบว่าห่วงอนามัยอยู่ภายนอกโพรงมดลูก แสดงว่าห่วงอนามัยหลุดไปแล้ว และสามารถใส่ห่วงอนามัยอันใหม่ได้ทันที หากผู้ใช้ต้องการ
5. ห่วงอนามัยแตกหัก (broken IUD) ยังไม่มีข้อมูลแน่ชัด หากไม่ได้นำชิ้นส่วนของห่วงอนามัยที่แตกหักออก แต่มีโอกาสเพิ่มความเสี่ยงในการติดเชื้อ ภาวะมีบุตรยาก ปวดท้องน้อยเรื้อรัง ตกขาวผิดปกติ และหากไม่ทราบตำแหน่งที่แน่ชัดของห่วงอนามัยที่แตกหัก ให้ทำอัลตราซาวน์ เอ็กซเรย์ หรือ ส่องกล้องภายในโพรงมดลูก (Hysteroscope) เพื่อทราบตำแหน่งของชิ้นส่วนห่วงอนามัยที่แตกหัก และสามารถใช้เครื่องดูดสูญญากาศ (manual vacuum extraction), alligator หรือ Bozeman uterine packing forceps, hysteroscopeหรือ curettage ก็ได้ (7)
6. มดลูกทะลุ (Perforation) (4, 7)
- โอกาสเกิดเหตุการณ์นี้ ระหว่างการใส่ห่วงอนามัย อยู่ที่ 1 : 1000 ราย
- ซึ่งปัจจัยเสี่ยงมาจากเทคนิคการใส่, retroverted uterus, อยู่ในช่วงให้นมบุตร หรือมีจุดเปราะบางที่ผนังกล้ามเนื้อมดลูก
- มักไม่มีอาการทันทีหลังใส่ห่วงอนามัยเสร็จสิ้น ผู้ป่วยมักกลับมาพบแพทย์ด้วยเรื่องปวดท้อง เลือดออกผิดปกติทางช่องคลอด สายของห่วงอนามัยสั้นลง
- การวินิจฉัยด้วยอัลตราซาวน์ หรือการเอ็กซเรย์ พบห่วงอนามัยอยู่นอกโพรงมดลูก
- ให้รักษาด้วยยาปฏิชีวนะเช่นเดียวกับภาวะอุ้งเชิงกรานอักเสบ และแนะนำให้นำห่วงอนามัยที่อยู่นอกโพรงมดลูกออก เนื่องจากมีโอกาสเกิดพังพืดในช่องท้อง บาดเจ็บต่ออวัยวะข้างเคียงเช่นไส้ตรง กระเพาะปัสสาวะ และหลอดเลือด เป็นต้น โดยวิธีที่แนะนำคือ หากห่วงอนามัยอยู่ในช่องท้องแล้วให้ นำออกด้วยวิธี laparoscope แต่หากยังฝังติดกับชั้นกล้ามเนื้อมดลูก ให้นำออกผ่านทาง Hysteroscope
ตารางที่ 1 แสดงการเปรียบเทียบคุณสมบัติของห่วงอนามัยชนิดต่างๆ
|
|
TCu380* |
Mutiload |
LNg 20* |
LNg 14* |
Inert |
|
|
Expiration time (years) |
10 |
5 |
5 |
3 |
Not expire |
|
|
Exogenous hormone |
No |
No |
Yes |
Yes |
No |
|
|
Efficacy
|
First year |
0.5 -0.8 % |
0.1 – 0.2 % |
0.41 % |
3 % |
|
|
Continuous use |
1.6 % |
0.5 – 1.1 % |
0.9 % |
|
||
|
Amenorrhea |
No |
Yes (50% of user within 2 years) |
Less than LNg 20 |
No |
||
|
Unscheduled bleeding |
No |
Yes |
Yes |
No |
||
|
Dysmenorrhea |
Increased in first year and then decreased |
Decreased in both of normal coagulation and bleeding diatheses (9, 10) |
No |
|||
|
Heavy bleeding |
||||||
|
STD protection** |
No |
Yes |
Yes |
No |
||
|
Endometrial cancer |
Decreased |
Decreased (Prefer in patient with tamoxifen use) |
Decreased |
No data |
||
|
Endometriosis treatment |
No |
Yes |
Less data |
No |
||
|
Emergency contraception |
Yes Within 5 days after intercourse |
No |
No |
No |
||
|
Price*** (Baht) |
862 |
560 |
7,164 |
– |
– |
|
|
Back-up contraception |
No |
First 7 day after insertion**** |
|
|||
* TCu380 = Copper IUD 380 mm2 , LNg 20 = Levonorgestrel releasing IUD 20 mcg/day, LNg 14= Levonorgestrel releasing IUD 14 mcg/day
** Sexually transmitted diseases protection
***Price in MaharajNakorn Chiang Mai Hospital2015
****Conditions for back up contraception as described in part of postprocedure counselling
7. คู่นอนรู้สึกถึงสายของห่วงอนามัยขณะมีเพศสัมพันธ์ โดยปกติแนะนำให้ตัดสายของห่วงอนามัยยาว 3 – 4 เซนติเมตร ซึ่งหากตั้นสั้นเกินไปคู่นอนมักมีอาการเจ็บหรือระคายเคืองระหว่างมีเพศสัมพันธ์ วิธีการแก้ไขให้ตัดสายของห่วงอนามัยชิดติดกับปากมดลูก
8. อาการปวดท้องน้อยที่เกิดขึ้นใหม่ คือการใส่ห่วงอนามัยได้ระยะหนึ่ง ไม่เคยมีอาการปวดท้องน้อย หลังจากนั้นมีอาการปวดท้องน้อยบีบรุนแรง ควรตรวจสอบว่าไม่มีการติดเชื้อในอุ้งเชิงกราน ตั้งครรภ์นอกมดลูก แท้งคุกคามหรือแท้งไม่สมบูรณ์ หรือห่วงอนามัยหลุด หรือมดลูกทะลุ แต่หากเป็นอาการปวดท้องประจำเดือน มักพบได้บ่อยในรายที่ใช้ห่วงอนามัยชนิดหุ้มทองแดง แต่หากอาการปวดไม่มากแนะนำให้รักษาด้วยด้วยยาลดการอักเสบกลุ่ม NSAID แต่หากปวดมากอาจแนะนำให้เปลี่ยนมาใช้ห่วงอนามัยชนิดหลั่งสาร Levonorgestrelหรือเปลี่ยนวิธีการคุมกำเนิด
9. เลือดออกผิดปกติทางช่องคลอด (Abnormal uterine bleeding)
- TCU380 IUD มักสัมพันธ์กับประจำเดือนที่มากขึ้น และอาการปวดประจำเดือน สามารถให้ยากลุ่ม NSAID เพื่อลดปริมาณประจำเดือนและอาการปวดได้ แต่หากอาการไม่ดีขึ้นหรือมีภาวะโลหิตจางแนะนำให้นำห่วงอนามัยออก แล้วเปลี่ยนเป็นห่วงอนามัยชนิดหลั่งสาร levonorgestrelแทน
- LNg20 IUD โดยทั่วไปมักจะลดปริมาณประจำเดือนและอาการปวดท้องประจำเดือน แต่ภายในระยะ 6เดือนแรกหลังการใส่ห่วงอนามัย อาจมีเลือดออกผิดปกติระหว่างรอบเดือนได้บ่อย รวมไปถึงภาวะขาดประจำเดือน พบว่าใน 6เดือนแรก มีโอกาสขาดประจำเดือน(amenorrhea) ได้ถึงร้อยละ 44 และประจำเดือนมาน้อย (Oligomenorrhea) ร้อยละ 25และเลือดออกผิดปกติระหว่างรอบเดือน ร้อยละ 11โดยแนะนำให้ผู้ใช้ทดสอบการตั้งครรภ์หากมีภาวะขาดประจำเดือน
10. ตกขาว ผู้ใส่ห่วงอนามัยมักพบอาการตกขาวมากขึ้นได้ และมักไม่ติดเชื้อ
11. การติดเชื้อ
- ภาวะอุ้งเชิงกรานอักเสบ (Pelvic inflammatory disease : PID) เพิ่มโอกาสเกิดภาวะนี้ภายหลังการใส่ห่วงอนามัย ภายใน 20วันแรก โดยโอกาสเกิดเท่ากับ 1.4 : 1000 ราย
จากการแนะนำของ CDC(13)หากอาการไม่รุนแรงแนะนำให้รักษาด้วยยาฏิชีวนะแบบรับประทาน และยังไม่ต้องนำห่วงอนามัยออก หลังจากนั้นประเมินอาการของผู้ภายภายใน 48 – 72 ชั่วโมง หากอาการไม่ดีขึ้น หรือมีความจำเป็นต้องให้ยาปฏิชีวนะทางหลอดเลือดดำ ให้นำห่วงอนามัยออกและส่งเพาะเชื้อจากห่วงอนามัย
แต่หากผู้ป่วยต้องการนำห่วงอนามัยออก แนะนำให้ให้การรักษาด้วยยาฏิชีวนะก่อน เพื่อลดความเสี่ยงภาวะติดเชื้อในกระแสเลือด
หากผู้ป่วยต้องการใส่ห่วงอนามัยใหม่อีกครั้ง ให้ใส่ได้ใหม่หลังการรักษาหายดีแล้วครบ 3เดือน - พบการติดเชื้อ Actinomyces จากการตรวจ PAP smear
พบการรายงานลักษณะนี้ได้ร้อยละ 7 แต่หากผู้ป่วยไม่มีอาการของการติดเชื้อยังไม่แนะนำให้ให้การรักษา แต่หากมีอาการติดเชื้อในโพรงมดลูก ให้นำห่วงอนามัยออกทันที เนื่องจากเชื้อ actinomycesมักเจริญบนวัตถุแปลกปลอม และให้การรักษาด้วยยากลุ่ม Penicillin หรือ tetracyclinesในรายที่แพ้ Penicillin (14)
12. ตั้งครรภ์ มีโอกาสพบได้สูงภายใน 1ปีแรกหลังใส่ห่วงอนามัย โยมีปัจจัยเสี่ยงจากห่วงอนามัยอยู่ในตำแหน่งที่ไม่เหมาะสม (malposition) สิ่งสำคัญหากทราบว่าตั้งครรภ์ คือต้องได้รับการตรวจยืนยันว่าไม่ใช่ตั้งครรภ์นอกมดลูกก่อน
- ไตรมาสแรกของการตั้งครรภภ์
- มีความต้องการตั้งครรภ์ต่อ ให้ตรวจภายในพบสายของห่วงอนามัย ให้นำห่วงอนามัยออกทันที เพื่อลดความเสี่ยงของการแท้ง ติดเชื้อ คลอดก่อนกำหนด แต่หากไม่พบสายของห่วงอนามัย ให้ใช้อัลตราซาวน์นำและใช้ Alligator forceps คีบห่วงอนามัยออก และแนะนำให้ให้ยาปฏิชีวะนะก่อนทำหัตถการ
- ต้องการยุติการตั้งครรภ์ หรือมีภาวะแท้งบุตรแล้ว ให้ยุติการตั้งครรภ์และนำห่วงอนามัยออกพร้อมกัน และควรให้ยา Doxycycline 100 mg 2ครั้งต่อวันหรือยา Ampicillin(500) 4 ครั้งต่อวัน กลับไปรับประทานนาน 5-7 •วัน
- ไตรมาสที่สองของการตั้งครรภ์ หากทิ้งห่วงอนามัยไว้เพิ่มโอกาสคลอดก่อนกำหนดมากขึ้น 4เท่า เพิ่มโอกาสติดเชื้อ หรือแท้งบุตรได้ และยังไม่มีข้อมูลแน่ชัดเกี่ยวกับผลของฮอร์โมน levonorgestrelที่หลั่งจากห่วงอนามัยต่อทารกในครรภ์
- ช่วงแรกของไตรมาสที่สอง หากตรวจพบสายของห่วงอนามัยให้ดึงสายเพื่อนำห่วงอนามัยออก โอกาสบาดเจ็บต่อรกและถุงน้ำค่อนข้างน้อย แต่หากไม่พบสายของห่วงอนามัยให้ทำการตรวจอัลตราซาวน์ดูก่อนว่าตำแหน่งของห่วงอนามัยไม่ชิดกับรกและถุงน้ำ จึงให้ใช้อุปกรณ์ในการคีบออกภายใต้การทำอัลตราซาวน์นำ
- ช่วงหลังของไตรมาสที่สอง ให้ทิ้งห่วงอนามัยไว้
13. ผลข้างเคียงจากฮอร์โมน Levonorgestrel เช่น ภาวะขนดก ปวดศีรษะ น้ำหนักขึ้น สิว อารมณ์ไม่ปกติ เจ็บคัดตึงเต้านม สามารถพบได้ และพบได้น้อยกว่าในห่วงอนามัยชนิด LNg14
การเลือกใช้ห่วงอนามัยชนิดต่างๆในสถานการณ์จำเพาะ
1. สตรีที่มีภาวะภูมิคุ้มกันบกพร่อง (immunocompromised women) (1, 15)
- การใส่ห่วงอนามัยไม่เพิ่มความเสี่ยงการเกิดภาวะอุ้งเชิงกรานอักเสบ หรือแม้ในผู้ป่วยติดเชื้อเอชไอวีรายที่มีค่า CD4 ต่ำ
- ไม่ก่อให้เกิดปฏิกิริยากับยาต้านไวรัส
- ห่วงอนามัยชนิดที่แนะนำคือ ชนิดหลั่งสาร Levonorgestrelซึ่งช่วยป้องกันโรคติดต่อทางเพศสัมพันธ์อื่นๆ แต่อย่างไรก็ตามในผู้ป่วยติเชื้อเอชไอวีแนะนำให้ใช้ร่วมกับถุงยางอนามัย
- ภายหลังการใส่ห่วงอนามัย ควรเฝ้าระวังภาวะอุ้งเชิงกรานอักเสบอนย่างใกล้ชิด
2. สตรีวัยรุ่น (1)
- เป็นวิธีการคุมกำเนิดระยะยาวที่ให้ผลดี ปลอดภัย และผู้ใช้ให้ความร่วมมือในการใช้สูง
- ระยะเวลาของกลับคืนของการเจริญพันธุ์ภายหลังการนำห่วงอนามัยออกนั้น รวดเร็ว
- แนะนำให้ใช้ถุงยางอนามัยร่วมด้วยเพื่อป้องกันโรคติดต่อทางเพศสัมพันธ์
- การใส่ห่วงอนามัยไม่มีผลต่อการลดลงของมวลกระดูก
3. สตรีที่ไม่มีบุตร (Nulliparous women)
- ประสิทธิภาพในการคุมกำเนิด และอัตราการติดเชื้อ ไม่แตกต่างกันระหว่างห่วงอนามัยชนิดหุ้มทองแดง และชนิดหลั่งสาร Levonorgestrel
- แต่ห่วงอนามัยชนิดหุ้มทองแดง เพิ่มโอกาสในการเกิดอาการปวดท้อง ประจำเดือนมามาก และการเลื่อนหลุดของห่วงอนามัยในสตรีที่ไม่มีบุตร ได้มากกว่าสตรีที่บุตรแล้ว (16)
- แนะนำการใช้ห่วงอนามัยชนิด LNg14มากกว่าเนื่องจากมีขนาดเล็ก ทำให้ผู้ใช้สามารถทนต่ออาการข้างเคียง เช่นอาการปวดขณะใส่ห่วงอนามัย ได้มากกว่า
4. มีประวัติตั้งครรภ์นอกมดลูกมาก่อน
- สามารถเลือกใช้ห่วงอนามัยทั้งชนิดหุ้มทองแดง และชนิดหลั่งสาร Levonorgestrelได้เทียบเท่ากัน(1)
- การใส่ห่วงอนามัยไม่ได้เพิ่มโอกาสการตั้งครรภ์นอกมดลูก เนื่องจากกลไกการป้องกันการปฏิสนธิ แต่พบว่าหากมีการตั้งครรภ์เกิดขึ้น ในผู้ใส่ห่วงคุมกำเนิดจะเกิดการตั้งครรภ์นอกมดลูกได้มากกว่าผู้ที่ไม่ใส่ห่วงคุมกำเนิด(17)
5. สตรีหลังแท้งบุตร จาก Cochrane review 2014 พบว่าการใส่ห่วงอนามัยภายหลังการแท้งทันทีนั้น มีความเสี่ยงเกิดการเลื่อนหลุดของห่วงอนามัยได้มากกว่ากลุ่มที่ใส่ห่วงอนามัยภายหลังการแท้ง 3-5สัปดาห์ แต่กลับพบว่าในสตรีที่ใส่ห่วงอนามัยภายหลังการแท้งทันทีนั้น ใส่ห่วงอนามัยเพื่อการคุมกำเนิดได้นานถึง 6เดือนเป็นอย่างน้อย เมื่อเทียบกับกลุ่มที่นัดมาใส่ห่วงอนามัยภายหลังการแท้ง ซึ่งกลุ่มที่นัดนั้น มักไม่มาตามนัดและไม่ได้คุมกำเนิด จึงเพิ่มโอกาสการตั้งครรภ์อันไม่พึงประสงค์มากขึ้น และแนะนำว่าการใส่ห่วงอนามัยภายหลังการแท้งทันที ปลอดภัย ใส่ได้ง่ายเนื่องจากปากมดลูกเปิดอยู่แล้ว และความเสี่ยงมดลูกทะลุและการติดเชื้อไม่เพิ่มขึ้น(18)
6. ใช้สำหรับการคุมกำเนิดฉุกเฉิน แนะนำให้ใส่ห่วงอนามัยชนิดหุ้มทองแดง ภายใน 120 ชั่วโมงภายหลังการมีเพศสัมพันธ์ที่ไม่ได้ป้องกัน โอกาสล้มเหลวเท่ากับร้อยละ 0.09และร้อยละ 80ใส่ห่วงอนามัยชนิดหุ้มทองแดงต่อเพื่อการคุมกำเนิด แต่สำหรับห่วงอนามัยชนิดหลั่งสาร Levonorgestrelนั้นข้อมูลด้านนี้ค่อนข้างจำกัด(19)
7. สตรีเป็นโรคความผิดปกติของลิ้นหัวใจ
- องค์การอนามัยโลก ปี 2006แนะนำว่าผู้ป่วยกลุ่มนี้สามารถใส่ห่วงอนามัยได้ เนื่องจากการใส่ห่วงอนามัยไม่เพิ่มความเสี่ยงการเกิดภาวะ bacteremia หรือการเกิดภาวะอุ้งเชิงกรานอักเสบ สามารถใช้ห่วงอนามัยได้ทั้งชนิดหุ้มทองแดง และชนิดหลั่งสาร Levonorgestrel(20)
- American Heart Association แนะนำว่าไม่จำเป็นต้องให้ยาปฏิชีวนะในการป้องกันภาวะติดเชื้อที่ลิ้นหัวใจ (infective endocarditis) ในผู้ป่วยที่ใส่ห่วงอนามัย
- ในผู้ป่วยรายที่ได้รับการผ่าตัดเปลี่ยนลิ้นหัวใจ และจำเป็นต้องได้รับยาต้านการแข็งตัวของเลือด แนะนำให้ใช้ห่วงอนามัยชนิดหลั่งสาร Levonorgestrelซึ่งสามารถช่วยลดอาการประจำเดือนมามากได้ (21)
8. ผู้ป่วยที่ใช้ยาต้านการแข็งตัวของเลือด หรือมีภาวะการแข็งตัวของเลือดผิดปกติ แนะนำให้ใส่ห่วงอนามัยชนิดหลั่งสาร Levonorgstrelมากที่สุด (9)
9. ลดความเสี่ยงในการเป็นมะเร็งนรีเวช จาก meta-analysis พบว่าการใส่ห่วงอนามัยชนิด LNg20 ลดความเสี่ยงการเกิดมะเร็งเยื่อบุโพรงมดลูก และมะเร็งปากมดลูก อย่างมีนัยสำคัญทางสถิติ เมื่อเทียบกับผู้ที่ไม่ได้ใส่ห่วงอนามัย (endometrial cancer: pooled adjusted OR 0.6, 95% CI 0.4–0.7 ) (cervical cancer OR 0.55, 95% CI 0.42-0.70)(22)
10. ใช้ในการรักษามะเร็งเยื่อบุโพรงมดลูกระยะเริ่มต้น อ้างอิงตาม NCCN guideline 2014(23)
- ผู้ป่วยต้องการมีบุตร
- ให้ตรวจประเมินว่าผลการตรวจทางพยาธิวิทยาต้องเป็น well differentiated (grade 1) endometrioidที่ได้จากการขูดมดลูก และได้รับการตรวจยืนยันโดยพยาธิแพทย์ผู้เชี่ยวชาญ
- ตรวจประเมินระยะของโรคว่ามะเร็งยังคงอยู่เฉพาะภายในชั้นเยื่อบุโพรงมดลูก และลุกลามเข้าสู่ชั้นกล้ามเนื้อมดลูกน้อยกว่าครึ่งหนึ่ง (stage IA) ด้วยการตรวจด้วยเครื่อง magnetic resonance imaging (MRI)
- ไม่มีรอยโรคที่อวัยวะอื่น ที่สงสัยว่าเกิดจากมะเร็งลุกลามหรือแพร่กระจาย
- ไม่มีข้อห้ามในการรักษาด้วยยา หรือ ตั้งครรภ์
- ผู้ป่วยได้รับการให้ข้อมูลเกี่ยวกับโรค และทราบดีแล้วว่าการรักษาด้วยยา และไม่ได้รับการผ่าตัดไม่ใช่การรักษาตามมาตรฐาน
- สามารถให้การรักษาด้วยยา megestrol, medoxyprogesterone, Levonorgestrel IUD
- ติดตามการักษาด้วยการขูดมดลูก หรือ endometrial biopsy ทุก 3 – 6 เดือน หากภายหลัง 6เดือนผลชิ้นเนื้อพยาธิวิทยาปกติ อนุญาตให้ตั้งครรภ์ได้ และรับการรักษาด้วยการผ่าตัดเมื่อคลอดบุตร และในขณะที่ยังไม่ตั้งครรภ์ต้องตรวจชิ้นเนื้อพยาธิวิทยาทุก 3 – 6 เดือนหากผลผิดปกติต้องรักษาด้วยการผ่าตัดทันที
11. ใช้ในการรักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ (endometriosis) จากการศึกษาพบว่าการใส่ห่วงอนามัยชนิด LNg 20 สามารถบรรเทาอาการปวดท้องน้อย และอาการปวดประจำเดือนได้เหมือนกับการใช้ GnRH agonist และลดโอกาสการกลับเป็นซ้ำของภาวะเยื่อบุโพรงมดลุกเจริญผิดที่ ในผู้ป่วยภายหลังการผ่าตัดแบบอนุรักษ์มดลูก และจากการศึกษา Cochrane review 2013 พบว่าการใส่ห่วงอนามัยชนิด LNgภายหลังการผ่าตัดเทียบกับกลุ่มที่สังเกตอาการอย่างเดียว สามารถลดอาการปวดท้องประจำเดือนได้อย่างมีนัยสำคัญทางสถิติ (RR 0.22, 95% CI0.08 to 0.60, 95 women, I2 =0%, moderate strength of evidence)(24) แต่ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ (endometriosis) ที่มีรอยโรคไกลจากมดลูก เช่น endometriotic cyst ที่รังไข่จะได้ผลการรักษาน้อย
12. ผู้ป่วยวัยหมดประจำเดือน
- กรณีใส่ห่วงอนามัยชนิดหุ้มทองแดง ให้นำห่วงอนามัยออกภายหลังขาดประจำเดือน 1ปี
- กรณีใส่ห่วงอนามัยชนิดหลั่งสาร Levonorgestrelแนะนำให้นำห่วงอนามัยออกช่วงอายุ 51-52 ปี แต่หากในรายที่ต้องการใช้ฮอร์โมนทดแทน และห่วงอนามัยที่ใส่ยังไม่หมดอายุ แนะนำให้ใส่ห่วงอนามัยต่อจนครบวันหมดอายุ ร่วมกับการให้เอสโตรเจนทดแทนได้ สามารถช่วยลดความเสี่ยงการเกิดมะเร็งเยื่อบุโพรงมดลูกได้ (1)
13. มีความจำเป็นต้องเข้าตรวจด้วยเครื่อง magnetic resonance imaging (MRI) สามารถทำได้อย่างปลอดภัย
เอกสารอ้างอิง
- Gillian Dean ABG. Intrauterine contaception (IUD) : overview. wwwuptodatecom. 2014.
- Group ECW. Intrauterine devices and intrauterine systems. Human Reproduction Update. 2008;14(3):197-208.
- Speroff L DP. A Clinical Guide for Contraception. third ed. Philadelphia: Lippincott Williams & Wilkins; 2001.
- Berek JS. Berek&Novak’s Gynecology. fifteenth ed. Philadelphia: Lippincott williams@Wilkins; 2012.
- Nilsson C, Lahteenmaki P, Luukkainen T, Robertson D. Sustained intrauterine release of levonorgestrel over five years. Fertility and sterility. 1986;45(6):805-7.
- Seeber B, Ziehr SC, Gschlieβer A, Moser C, Mattle V, Seger C, et al. Quantitative levonorgestrel plasma level measurements in patients with regular and prolonged use of the levonorgestrel-releasing intrauterine system. Contraception. 2012;86(4):345-9.
- Giallian Dean ABG. Intrauterine contraception: Management of side effects and complications. wwwuptodatecom. 2015.
- El-Zeneiny A, Ammar A, Badawi S. Expulsion of the intrauterine devices Lippes loop size 30 mm. The Journal of the Egyptian Medical Association. 1969;52(1):46.
- Kadir RA, Chi C. Levonorgestrel intrauterine system: bleeding disorders and anticoagulant therapy. Contraception. 2007;75(6):S123-S9.
- Chi C, Huq FY, Kadir RA. Levonorgestrel-releasing intrauterine system for the management of heavy menstrual bleeding in women with inherited bleeding disorders: long-term follow-up. Contraception. 2011;83(3):242-7.
- Guleria K, Agarwal N, Mishra K, Gulati R, Mehendiratta A. Evaluation of endometrial steroid receptors and cell mitotic activity in women using copper intrauterine device: Can Cu‐T prevent endometrial cancer? Journal of Obstetrics and Gynaecology Research. 2004;30(3):181-7.
- Dorjgochoo T, Shu XO, Li HL, Qian HZ, Yang G, Cai H, et al. Use of oral contraceptives, intrauterine devices and tubal sterilization and cancer risk in a large prospective study, from 1996 to 2006. International Journal of Cancer. 2009;124(10):2442-9.
- Ralph L, McCoy S, Hallett T, Padian N. Research on hormonal contraception and HIV–Authors’ reply. The Lancet. 2014;383(9914):305-6.
- Fiorino AS. Intrauterine contraceptive device-associated actinomycotic abscess and Actinomyces detection on cervical smear. Obstetrics & Gynecology. 1996;87(1):142-9.
- Thailand National guidlines on HIV/AIDS treatment and prevention 2014. กรุงเทพมหานคร: กรมอนามัยม, กระทรวงสาธารณสุข; 2014.
- Schiesser M, Lapaire O, Tercanli S, Holzgreve W. Lost intrauterine devices during pregnancy: maternal and fetal outcome after ultrasound‐guided extraction. An analysis of 82 cases. Ultrasound in obstetrics & gynecology. 2004;23(5):486-9.
- Sivin I. Dose-and age-dependent ectopic pregnancy risks with intrauterine contraception. Obstetrics & Gynecology. 1991;78(2):291.
- Okusanya BO, Oduwole O, Effa EE. Immediate postabortal insertion of intrauterine devices. The Cochrane Library. 2014.
- Cheng L, Che Y, Gülmezoglu AM. Interventions for emergency contraception. Cochrane Database Syst Rev. 2012;8.
- Organization WH. Medical Eligibility Criteria for Contraceptive Use http://www.who.int/reproductive-health/publications/mec/. [updated 2010]. 3rd:[
- Nishimura RA, Carabello BA, Faxon DP, Freed MD, Lytle BW, O’Gara PT, et al. ACC/AHA 2008 Guideline update on valvular heart disease: focused update on infective endocarditis: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 2008;52(8):676-85.
- Hubacher D, Reyes V, Lillo S, Pierre-Louis B, Zepeda A, Chen P-L, et al. Preventing copper intrauterine device removals due to side effects among first-time users: randomized trial to study the effect of prophylactic ibuprofen. Human Reproduction. 2006;21(6):1467-72.
- Network NCC. Uterine neoplasm. NCCN Clinical Practice Guideline in Oncology. 2014;1:Endo1-2.
- Abou‐Setta AM, Houston B, Al‐Inany HG, Farquhar C. Levonorgestrel‐releasing intrauterine device (LNG‐IUD) for symptomatic endometriosis following surgery. The Cochrane Library. 2013.