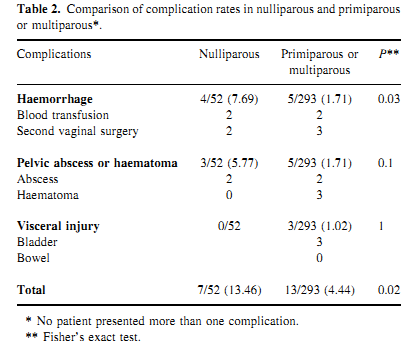
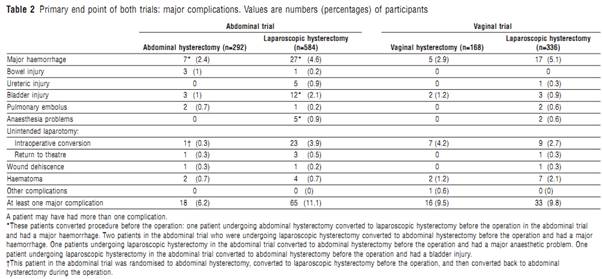
ภาวะเลือดออกผิดปกติจากโพรงมดลูก
ภาวะเลือดออกผิดปกติจากโพรงมดลูก (Abnormal uterine bleeding)
น.พ. ธนัท จิรโชติชื่นทวีชัย
อ.พ.ญ. ทวิวัน พันธศรี
บทนำ
ภาวะเลือดออกผิดปกติจากโพรงมดลูกนับเป็นหนึ่งในภาวะที่พบได้บ่อยที่สุด พบได้ประมาณหนึ่งในสามของผู้ป่วยที่มาตรวจกับสูตินารีแพทย์(1) พบว่าส่งผลกระทบต่อคุณภาพชีวิต การทำงาน ค่าใช้จ่ายในการรักษาในแต่ละปี ตลอดจนพบส่งผลกระทบต่อภาวะการเจริญพันธุ์ (Fertility) อันเป็นผลข้างเคียงมาจากการรักษาโรค เช่นการผ่าตัดมดลูก (Hysterectomy) การผ่าตัดเนื้องอกมดลูก(myomectomy) หรือการจี้ทำลายเยื่อบุโพรงมดลูก (endometrial ablation)(2)
อาการเริ่มต้นที่นำผู้ป่วยมาพบแพทย์ คือภาวะเลือดออกผิดปกติทางช่องคลอด ซึ่งการประเมินผู้ป่วยจากการซักประวัติ และการตรวจร่างกาย จะนำไปสู่การหาว่าสาเหตุว่า เลือดออกจากอวัยวะใด ไล่ตั้งแต่ ปากช่องคลอด ช่องคลอด ปากมดลูก มดลูก ท่อนำไข่ หรือเกิดจากรังไข่ โดยต้องแยกออกจากอวัยวะข้างเคียงคือ ท่อปัสสาวะ และทวารหนักด้วย
โดยสาเหตุของภาวะเลือดออกผิดปกติทางช่องคลอด ที่พบมากที่สุด คือ ภาวะมีเลือดออกผิดปกติจากโพรงมดลูกซึ่งแบ่งตามช่วงอายุได้อีกสามช่วงคือ
- ช่วงก่อนมีประจำเดือน (premenarche)
- ช่วงวัยเจริญพันธุ์ (reproductive-age)แบ่งย่อยออกเป็นสองกลุ่มกลุ่มตั้งครรภ์และกลุ่มไม่ตั้งครรภ์
- ช่วงหลังหมดประจำเดือน (postmenopausal)
การจำกัดความ (Terminology)
เนื่องจากเกิดความสับสนในการใช้คำที่แสดงถึงอาการแสดงของ ภาวะเลือดออกผิดปกติจากโพรงมดลูกทั้งเช่นmetrorrhagia, menometrorrhagia, dysfunctional uterine bleedingทำให้เกิดความผิดพลาดในการสื่อความหมายทั้งกับทีมแพทย์ เจ้าหน้าที่ และผู้ป่วย ทำให้เกิดข้อตกลงใหม่ ของ FIGO (International Federation of Gynecology and Obstetrics) ที่ทำให้สามารถแบ่ง สาเหตุของภาวะเลือดออกผิดปกติจากโพรงมดลูกในหญิงวัยเจริญพันธุ์ได้อย่างเป็นระบบ
ภาวะเลือดออกผิดปกติจากโพรงมดลูกเฉียบพลัน(Acute AUB) คือ ภาวะที่มีประจำเดือนออกผิดปกติจนระทั่งต้องได้รับการรักษาเพื่อป้องกันภาวะเสียเลือด(3, 4)
ภาวะเลือดออกผิดปกติจากโพรงมดลูกเรื้อรัง(Chronic AUB) คือภาวะที่ประจำเดือนที่มีความผิดปกติของระยะเวลาปริมาณและหรือความถี่ในระยะเวลามากกว่า 6 เดือน(3, 4)
ภาวะเลือดออกระหว่างรอบประจำเดือน (Intermenstrual bleeding, IMB) เป็นคำที่ถูกนำมาใช้แทน ”metrorrhagia”
ภาวะขาดประจำเดือน (Amenorrhea ) คือภาวะที่ประจำเดือนไม่มามากกว่า 6 เดือน
ตารางที่ 1 (5) คำที่ถูกยกเลิกจากการจัดระบบใหม่ของ FIGO
- Dysfunctional uterine bleeding Epimenorrhagia
- Epimenorrhea
- Functional uterine bleeding
- Hypermenorrhea
- Hypomenorrhea
- Menometrorrhagia
- Menorrhagia
- Metrorrhagia
- Metropathica hemorrhagica
- Oligomenorrhea
- Polymenorrhagia
- Polymenorrhea
- Uterine hemorrhage
ดัดแปลงจาก Munro. FIGO system for abnormal uterine bleeding. Am J ObstetGynecol2012.
ความหมายของภาวะประจำเดือนที่ “ปกติ” ในหญิงวัยเจริญพันธุ์ แบ่งออกเป็น4 กลุ่มโดยแบ่งตามคำจำกัดความดังแสดงในตารางที่ 2
- ความถี่ของรอบประจำเดือนผิดปกติ (disturbance of menstrual frequency) : infrequent or frequent
- ความไม่สม่ำเสมอของรอบรอบประจำเดือน (irregular menstrual bleeding) : absent or irregular
- ระยะเวลาของแต่ละรอบประจำเดือนผิดปกติ (abnormal duration of flow ) : prolonged or shortened
- ปริมาณประจำเดือนต่อรอบผิดปกติ (abnormal menstrual volume) : heavy or light
โดยในแต่ละกลุ่มอาจเกิดร่วมกันได้ จึงสามารถใช้คำผสมกันได้ เช่น heavy and prolonged menstrual bleeding, heavy and frequent menstrual bleeding เป็นต้น(2)
ตารางที่ 2(5) ความหมายของภาวะประจำเดือนที่ “ปกติ” ในหญิงวัยเจริญพันธุ์
{tabulizer:style[gr.alterora.elemental_1_red_orange.css]}
| คำจำกัดความ | ค่าปกติ (5th-95th percentiles) | |
| ความถี่ของรอบประจำเดือน | ถี่ | <24 td=””> |
| ปกติ | 24-38 วัน | |
| ห่าง | >38 วัน | |
| ความสม่ำเสมอของรอบรอบประจำเดือน | ประจำเดือนขาด | ไม่มีประจำเดือน |
| ความแปรปรวนของแต่ละรอบในช่วง 12 เดือน | สม่ำเสมอ | <20 td=””> |
| ไม่สม่ำเสมอ | >20 วัน | |
| ระยะเวลาของรอบประจำเดือน | นาน | >8 วัน |
| ปกติ | 4.5-8 วัน | |
| สั้น | <4.5 td=””> | |
| ปริมาณประจำเดือนต่อรอบ | มาก | >80 ml |
| ปกติ | 5-80 ml | |
| น้อย | <5 ml=”” td=””> | |
ดัดแปลงจาก Munro. FIGO system for abnormal uterine bleeding. Am J ObstetGynecol2012.
FIGO CLASSIFICATION SYSTEM
มีการแบ่งออกเป็น 9 กลุ่ม ตามตัวอักษร PALM-COEIN [pahm-koin] ดังแสดงในตารางที่ 3(3)
- PALM – Polyp, Adenomyosis, Leiomyoma, Malignancy and hyperplasiaกลุ่มนี้สาเหตุส่วนใหญ่ สามารถตรวจได้ชัดเจน( structural abnormalities)จากการตรวจทางรูปภาพ ( imaging techniques ) หรือตรวจผลชิ้นเนื้อทางพยาธิวิทยา (histopathology )(3)
- COEIN – Coagulopathy, Ovulatory Disorders, Endometrium, Iatrogenic, and Not Classified กลุ่มนี้สาเหตุส่วนใหญ่ ไม่สามารถตรวจได้ชัดเจน( non-structural abnormalities) จากการตรวจทางรูปภาพ ( imaging techniques )หรือตรวจผลชิ้นเนื้อทางพยาธิวิทยา (histopathology )แต่ช่วยให้สามารถจัดเข้ากลุ่มได้ง่ายต่อการเข้าใจมากขึ้น(3)
ตารางที่ 3 (3)
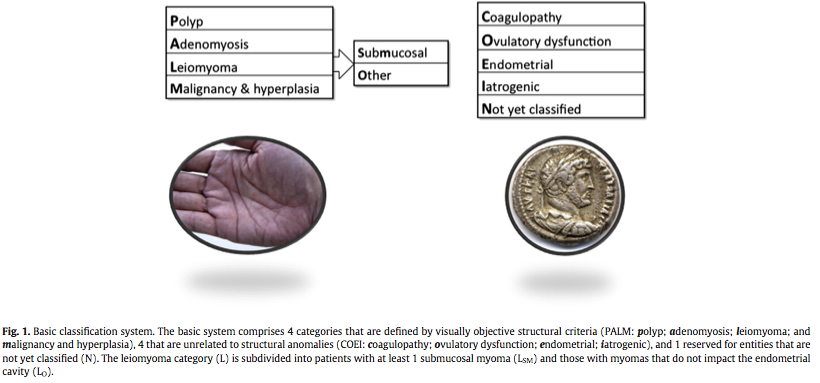
Munro. FIGO system for abnormal uterine bleeding. Am J ObstetGynecol2012
Structural abnormalities
Polyps (AUB-P)
คือติ่งเนื้อที่ยื่นออกมาจากเยื่อบุโพรงมดลูก หรือปากมดลูก โดยไม่สนใจขนาด ตำแหน่ง หรือลักษณะรูปร่าง วินิจฉัยจากการตรวจ ultrasound หรือการส่องกล้องผ่าทางโพรงมดลูก ( hysteroscopy ) โดยมีผลตรวจชิ้นเนื้อทางพยาธิวิทยา (histopathology ) หรือไม่มีก็ได้ควรแยกลักษณะ polypoidออก เนื่องจากเป็นเยื่อบุโพรงมดลูกปกติที่อาจพบได้
Adenomyosis (AUB-A)
ผู้ป่วยจะมาตรวจด้วยอาการปวดประจำเดือนมากร่วมกับอาจมีประจำเดือนมามากขึ้นเดิมการวินิจฉัยต้องอาศัยผลจากชิ้นเนื้อจากการตัดมดลูกว่ามีลักษณะของเยื่อบุโพรงมดลูกภายใน myometrium แต่การวินิจฉัยวิธีนี้มีข้อจำกัดในทางคลินิก จึงนิยมใช้การตรวจ ultrasound หรือmagnetic resonance imaging (MRI) มาช่วยซึ่งโดยทั่วไป แต่เนื่องจาก MRI มีค่าใช้จ่ายสูง การใช้ ultrasound จึงเป็นที่นิยมมากกว่าโดยลักษณะทาง ultrasound ของAdenomyosisที่ตรวจพบมีดังนี้(6)
- diffuse heterogeneous myometrial echogenicity, including striations and an indistinct endomyometrial junction
- anechoic lacunae and/or cysts
- focal abnormal myometrialechotexture/indistinct borders
- globular and/or asymmetric uterus unrelated to leiomyoma
ตารางที่ 4 (7)
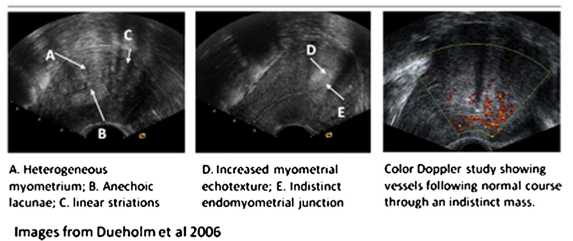
Munro MGet al. The FIGO classification of causes of abnormal uterine bleeding in the reproductive years. Fertility and sterility. 2011
Leiomyomas (AUB-L)
เป็นเนื้องอกมดลูกที่ไม่ค่อยมีอาการพบได้บ่อยในผู้ป่วยหญิงวัยเจริญพันธุ์โดยพบมากถึง 1 ใน 3 ของผู้หญิงที่มีอายุมากกว่า35 ปีขึ้นไป และพบมากถึง 70% เมื่ออายุถึง 50 ปี(2, 8)
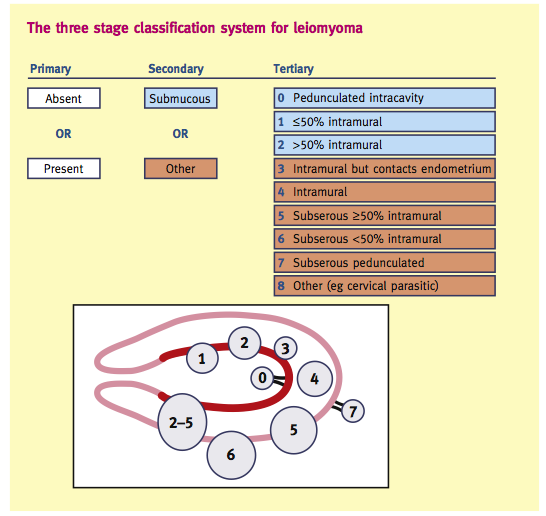
วิธีการจัดกลุ่มแบ่งเป็น 3 ขั้นตอน(9) ดังแสดงในตารางที่ 5
- ประเมินจาก ultrasound ว่ามีหรือไม่มี myoma
- ประเมินว่าเป็นชนิด “submucous” หรือไม่ จำเป็นต้องแยกก่อน เนื่องจาก submucousmyomaพบว่าเป็นสาเหตุของ AUB มากที่สุด กลุ่มอื่นที่ไม่ใช่จึงจัดเข้ากุ่ม “o” other
- แบ่งsubmucousmyomaออกเป็น 3 กลุ่มย่อยตามระดับการ involve myometrium และแบ่งกลุ่ม “other” ออกเป็น 5 กลุ่มย่อย 3-4 แบ่งตามตำแหน่งของ Intramural ใน myometrium, 5-7 แบ่งตามตำแหน่งที่สัมพันธ์กับ serosaและmyometrium8 คือกลุ่มที่ไม่สามารถจัดเข้าพวกได้ เช่น cervical และ parasitic leiomyomasในกลุ่มที่เบียดทั้ง endometrium และ serosa สามารถเข้าได้กับทั้งกลุ่ม submucousและ subserousให้ตัวเลขสองกลุ่มต่อกันได้ เช่น “2-5 “
ตารางที่ 5 (2)
Maybin JA et al. Re-definition and re-classification of menstrual disorders.2013
Malignancy and pre-malignant conditions (AUB-M)
เป็นสาเหตุที่พบน้อย แต่สำคัญ จึงจำเป็นต้องแยกภาวะนี้ออกมาให้ได้ โดยเฉพาะกลุ่มผู้ป่วยที่มีความเสี่ยงต่อ ภาวะendometrial hyperplasia เช่น ผู้ป่วย obesity หรือ PCOS (polycystic ovarian syndrome )และจัดกลุ่มความรุนแรงตามระบบ WHO หรือ FIGO ตามปกติ
Non-structural
Coagulopathies (AUB-C)
กลุ่มโรคที่รบกวนการแข็งตัวของเลือดการทำงานของเกล็ดเลือดพบว่าผู้ป่วยี่มีภาวะ heavy menstrual bleeding (HMB) ตรวจพบความผิดปกติของระบบการแข็งตัวของเลือดได้ประมาณ 13% ซึ่งโรคที่พบบ่อยที่สุดคือ vWD (Von Willebrand disease ) (10)โดยประมาณ 90% สามารถซักประวัติเพื่อค้นหาผู้ป่วยและส่งตรวจเพิ่มเติมต่อไปได้
ตารางที่ 6(11)
การซักประวัติเบื้องต้นเพื่อหาผู้ป่วยที่อาจมีภาวะการแข็งตัวของเลือดผิดปกติ
- ประจำเดือนมามากประมาณนี้ตั้งแต่ครั้งแรกที่มีประจำเดือน
- มีประวิติอย่างน้อย 1 ข้อดังต่อไปนี้
- เคยมีปัญหาเลือดออกมากผิดปกติหลังทำฟัน
- เคยมีปัญหาเลือดออกมากผิดปกติหลังผ่าตัด
- มีปัญหาตกเลือดหลังคลอด
- มีประวิติอย่างน้อย 2 ข้อดังต่อไปนี้
- จุดจ้ำเลือด 1-2 ครั้งต่อเดือน
- เลือดกำเดาออก 1-2 ครั้งต่อเดือน
- เลือดออกตามไรฟันบ่อยๆ
- ประวัติครอบครัวมีเลือดออกผิดปกติ(12)
โดยผู้ป่วยที่มีประวัติต้องสงสัยควรได้รับการตรวจหาภาวะvWD (Von Willebranddisease )และปรึกษาแพทย์โลหิตวิทยาต่อไป
ดัดแปลงจาก ACOG committee opinion no. 557: Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women
Ovulatory dysfunction (AUB-O)
เป็นหนึ่งในสาเหตุที่พบได้บ่อยโดยเฉพาะในผู้ป่วยกลุ่มช่วงเริ่มมีประจำเดือน และช่วงใกล้หมดประจำเดือน โดยผู้ป่วยจะมีประจำเดือนผิดปกติ ประจำเดือนมาไม่สม่ำเสมอ (AUB) หรือประจำดือนมามาก (HMB)(13) โดยอดีตนิยมเรียกภาวะนี้ว่า DUB (dysfunctional uterine bleeding )อาการแสดงมีตั้งแต่ ประจำเดือนขาด มาเล็กน้อย มาไม่สม่ำเสมอ จนถึงมามากจนเกิดภาวะซีด สาเหตุเกิดจากจากโปรเจสเตอโรน ที่สร้างจาก corpus luteumตามรอบเดือนทุก 22-35 วัน มีความผิดปกติ หรือเรียกว่าภาวะ “luteal out of phase” (13, 14) โดยเกิดได้จากหลายสาเหตุ เช่นภาวะอ้วน, ภาวะเครียดหรือป่วยเรื้อรัง, ภาวะanorexia, การออกกำลังกายอย่างหนัก, ภาวะน้ำหนักลดอย่างรวดเร็ว, ภาวะโรคทางต่อมไร้ท่อ เช่นภาวะ hypothyroid, hyperprolactin PCOS ( polycystic ovarian syndrome ) หรืออาจเกิดจากการรักษาการใช้ยาsteroidsหรือยาระบบที่มีผลปรับระดับโดปามีน เช่น phenothiazines, tricyclic antidepressantsทำให้เกิดภาวะไข่ไม่ตกได้
Endometrial (AUB-E)
เป็นภาวะที่วินิจฉัยเมื่อไม่สงสัยภาวะอื่น( diagnosis by exclusion )โดยจะนึกถึงในผู้ป่วยที่มีประจำดือนมามาก (HMB) แต่มีการตกไข่ปกติ มีรอบเดือนสม่ำเสมอ ไม่มีภาวะการแข็งตัวของเลือดผิดปกติ และไม่พบติ่งเนื้อ หรือเนื้องอกผิดปกติในมดลูก สาเหตุจากเยื่อบุโพรงมดลูกที่ทำให้เกิดประจำเดือนมาไม่สม่ำเสมอ เกิดจากปัจจัยภายในโพรงมดลูกเอง เช่น ภาวะอักเสบรุนแรงช่วงประจำเดือน ภาวะการติดเชื้อภายในโพรงมดลูกเช่น Chlamydia trachomatis (15) การซ่อมแซม การหดตัวของหลอดเลือด หรือการแข็งตัวของเลือดบริเวณเยื่อบุโพรงมดลูกผิดปกติ เช่นการสร้างendothelin-1 และ prostaglandin F2αไม่พอหรือการสร้างplasminogen activator มากเกินไป(16)โดยบ่อยครั้งจะพบภาวะนี้เกิดร่วมกับ ภาวะอื่นเช่น adenomyosis, polyps, leimyomas types3-8 ซึ่งโดยตัวพยาธิสภาพที่มีบางครั้งไม่สามารถอธิบายเหตุผลที่ทำให้เกิดประจำดือนมามาก(HMB)ได้ แต่อย่างไรก็ตามในปัจจุบัน ยังไม่มีวิธีการยืนยันการวินิจฉัยได้อย่างชัดเจน เพราะฉะนั้น จึงเป็นการวินิจฉัยเมื่อแยกโรคอื่นไปแล้วนั่นเอง
Iatrogenic causes (AUB-I)
เป็นสาเหตุที่เกิดจากการใช้ยา การทำหัตถการ หรือการใช้อุปกรณ์ในทางการแพทย์ เพื่อทำการรักษา ที่ทำให้เกิดภาวะเลือดออกผิดปกติจากโพรงมดลูก (AUB) เช่นการใช้ยาฮอร์โมนเพื่อการคุมกำเนิดทั้งยาคุมกำเนิดชนิดกินชนิดฉีดชนิดฝังหรือห่วงคุมกำเนิดชนิดที่มีฮอร์โมนโปรเจสโตเจน(LNG-IUS) ซึ่งพบบ่อยว่ามีเลือดออกกระปริดกระปรอยได้ในช่วง 6 เดือนแรกของการใช้ห่วงคุมกำเนิด(17) การใช้ยากลุ่มgonadotropin-releasing hormone therapy, aromatase inhibitors, selective estrogen receptor modulators ( SERMs ) หรือ progesterone receptor modulators ก็พบว่าเป็นสาเหตุของเลือดออกผิดปกติได้
แต่ในกลุ่มผู้ป่วยที่ใช้ยาละลายลิ่มเลือด (anticoagulant) เช่น warfarin, heparin แล้วมีประจำดือนมามาก (HMB) นั้นจะจัดเข้าอยู่ในกลุ่ม AUB-C ดังที่กล่าวไปแล้วเช่นเดียวกับการใช้ยาที่รบกวนการทำงานของ dopamine metabolism ซึ่งทำให้เกิดการตกไข่ผิดปกติก็จัดอยู่ในกลุ่ม AUB-O
Notyet classified (AUB-N)
ในผู้ป่วยบางรายที่เราไม่สามารถจัดกลุ่มแยกสาเหตุของภาวะเลือดออกผิดปกติจากโพรงมดลูกได้ไม่ว่าจากการจำกัดความที่ไม่ชัดเจนความจำกัดในการส่งตรวจเพิ่มเติมหรือสาเหตุที่พบได้น้อยเช่นภาวะกลุ่มเส้นเลือดผิดปกติบริเวณมดลูก arteriovenous malformations (AVM) ภาวะmyometrial hypertrophyหรือความผิดปกติจากระบบชีวเคมี อื่นๆที่ยังไม่สามารถตรวจยืนยันได้ในปัจจุบัน ซึ่งในอนาคตสาเหตุในกลุ่มนี้อาจแยกได้ชัดเจนขึ้นต่อไป เมื่อมีการศึกษาเพิ่มเติม หรืออาจไปแทนที่กลุ่มเดิมที่มีอยู่ก็เป็นได้ (3)
ตัวอย่างการประเมินคะแนนตามระบบ PALM-COEIN
ตารางที่ 7(3)
“0” แทนไม่มีพยาธิสภาพ, “1” แทนมีพยาธิสภาพ, “?” ใช้เมื่อยังไม่ได้ประเมิน
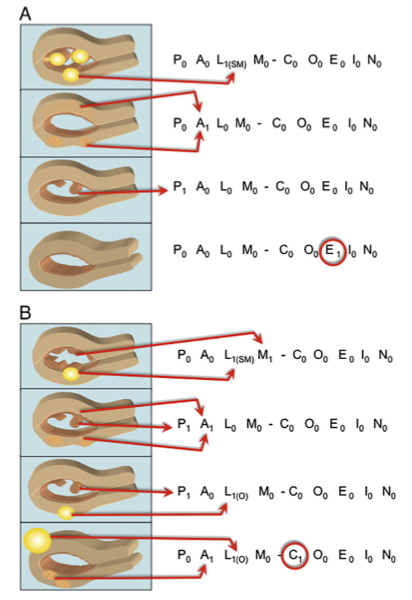
M.G. Munro et al. International Journal of Gynecology and Obstetrics 113 (2011) 3–13
การประเมินผู้ป่วยเบื้องต้น
- พิจารณาหาตำแหน่งที่เลือดออก โดยแยกสาเหตุเลือดออกทางช่องคลอด ซึ่งทำให้เกิดความสับสนกับภาวะเลือดออกผิดปกติจากโพรงมดลูกเบื้องต้น ต้องแยกจากระบบสืบพันธุ์เพศหญิงส่วนล่าง ปากช่องคลอด ช่องคลอด ปากมดลูก ระบบทางเดินอาหารส่วนล่าง หรือระบบทางเดินปัสสาวะ โดยแยกจากประวัติ และการตรวจร่างกาย
- พิจารณาสาเหตุของภาวะเลือดออกกับการตั้งครรภ์ โดยผู้ป่วยควรได้รับการตรวจหาภาวะตั้งครรภ์ก่อนเสมอ
- ประเมินผู้ป่วยตามภาวะก่อนหรือหลังหมดประจำเดือน ซึ่งสาเหตุที่พบบ่อยในแต่ละกลุ่มช่วงอายุจะแตกต่างกัน
เมื่อแยกว่าเป็นภาวะเลือดออกผิดปกติจากโพรงมดลูก (Abnormal uterine bleeding) แล้วเราจะประเมินแยกออกเป็นสองกลุ่มคือกลุ่มเฉียบพลัน (acute AUB) และกลุ่มเรื้อรัง (chronic AUB)โดยแยกกันโดยระยะเวลาที่ประจำเดือนมีความผิดปกติมากกว่า 6 เดือน โดยในกลุ่มเฉียบพลันที่มาตรวจมักพบว่ามีปริมาณเลือดออกมากจึงมีวิธีการประเมินผู้ป่วยที่แนะนำดังนี้(11)
การประเมินภาวะเลือดออกผิดปกติจากโพรงมดลูกเฉียบพลัน (acute AUB) แบ่งเป็น 3 ขั้นตอน
- ประเมินภาวะฉุกเฉิน จากภาวะเลือดออกทางช่องคลอดก่อน ภาวะความดันต่ำ ภาวะช็อก หรือภาวะขาดน้ำอย่างรุนแรงจากการเสียเลือดก่อน เพื่อพิจารณาให้สารน้ำ เลือดหรือองค์ประกอบของเลือด หลังจากที่อาการคงที่จึงประเมินหาสาเหตุต่อไปตามลำดับ
- ประเมินหาสาเหตุ วิธีการประเมินหาสาเหตุนี้ไม่แตกต่างกับในกลุ่มเรื้อรัง โดยใช้วิธีการพิจารณาตามระบบ PALM-COEIN ของ FIGO ดังที่กล่าวไปแล้วข้างต้น
- ประเมินวิธีการการรักษา โดยเลือกวิธีการรักษาให้เหมาะสมกับผู้ป่วยแต่ละรายไป ตามสาเหตุที่พบ
การซักประวัติ
1. ประวัติทางสูตินรีเวชวิทยา
- ประวัติประจำเดือน
- ประวัติเรื่องเพศสัมพันธ์
- การคุมกำเนิด
- การตรวจรักษาโรคทางนรีเวช
2. ประวัติโรคประจำตัว
- โรคหลอดเลือดและการใช้ยาละลายลิ่มเลือด
- ประวัติโรคตับ โรคไต
- ประวัติโรคภายในครอบครัว ภาวะเลือดออกง่าย หยุดยาก (ดังตารางที่ 6)
- ประวัติการใช้ยารักษาโรคต่างๆ
การตรวจร่างกาย
- สัญญาณชีพ ภาวะซีด ภาวะเสียเลือดมาก หรือขาดน้ำ
- การตรวจร่างกาย เพื่อหาตำแหน่งเลือดออก ตั้งแต่ ปากช่องคลอด ช่องคลอด ปากมดลูก รูปัสสาวะ รูทวารหนัก
-
การตรวจภายใน เพื่อคลำลักษณะ ขนาดมดลูก เนื้องอกมดลูก ตำแหน่งที่เจ็บปวดประเมินปริมาณเลือดที่ยังออกต่อเนื่อง ประเมินก้อน และตำแหน่งที่เจ็บปวดบริเวณปีกมดลูก
การตรวจวินิจฉัยเพิ่มเติม
การตรวจเพิ่มเติมทางห้องปฎิบัติการที่แนะนำ ในผู้ป่วยที่มี ภาวะเลือดออกผิดปกติจากโพรงมดลูกเฉียบพลันดังแสดงในตารางที่ 8
ตารางที่ 8 (11)
{tabulizer:style[gr.alterora.elemental_1_red_orange.css]}
| การตรวจวินิจฉัยเพิ่มเติม | การส่งตรวจทางห้องปฎิบัติการ |
| การส่งตรวจเบื้องต้น | CBC |
| Blood type, Cross match | |
| Pregnancy test | |
| การตรวจหาภาวะการแข็งตัวของเลือดผิดปกติ | PT, aPTT, Fibrinogen |
| การตรวจภาวะ vWD | vWD factor antigen |
| Factor VIII | |
| Ristocetin cofactor essay | |
| การตรวจวินิจฉัยอื่นๆ | TSH, Liver function tests, Iron study, Chlamydia |
ดัดแปลงจาก ACOG committee opinion no. 557: Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women
ในกลุ่มผู้ป่วยที่มีอายุมากกว่า 45 ปีขึ้นไป ผู้ป่วยหลังหมดประจำเดือน หรือผู้ป่วยอายุน้อยกว่า 45 ปีแต่ มีความเสี่ยงต่อมะเร็งเยื่อบุโพรงมดลูก เช่น ผู้ป่วยที่มีภาวะอ้วน มีภาวะไข่ไม่ตกเรื้อรัง รักษาด้วยยาแล้วไม่หาย หรือ เคยต้องได้รับการรักษาด้วย Tamoxifen ควรต้องได้รับการตรวจชิ้นเนื้อเยื่อบุโพรงมดลูก (Endometrial sampling)(18) สำหรับผู้ป่วยหลังหมดประจำเดือนที่ไม่สามารถตรวจได้ เช่น ตรวจไม่ได้ชิ้นเนื้อ อาจตรวจมีทางเลือกในการตรวจ Transvaginal ultrasound เพื่อประเมินความหนาของเยื่อบุโพรงมดลูก ในกรณีที่น้อยกว่าหรือเท่ากับ 4 มิลลิเมตร โอกาสที่จะเป็นโรคมะเร็งน้อยมาก จึงอาจไม่ต้องตรวจชิ้นเนื้อเยื่อบุโพรงมดลูกได้(19, 20)
การตรวจวินิจฉัยโรคด้วยภาพและการส่องกล้อง
จากประวัติและการตรวจร่างกายเมื่อสงสัยหรือตรวจพบก้อนผิดปกติในอุ้งเชิงกรานหรือตรวจเบื้องต้นเพื่อหาข้อมูลเพิ่มเติมในกรณีที่การตรวจเบื้องต้นไม่พบสาเหตุอื่นแน่ชัด
วิธีการตรวจทางภาพ
- Pelvic ultrasound เป็นวิธีที่นิยม เนื่องจากเป็นวิธีที่มีประสิทธิภาพ ราคาไม่แพง สามารถตรวจติดตามการรักษาได้ง่าย โดยการตรวจผ่านทางช่องคลอดมักใช้เป็นวิธีแรกถ้าเป็นไปได้ หรือตรวจผ่านทางหน้าท้อง ในผู้ป่วยที่ไม่เคยมีเพศสัมพันธ์ โดยการตรวจประเมินตั้งแต่ ความหนาโพรงมดลูก พยาธิสภาพภายในโพรงมดลูก เช่น endometrial polyps, submucosalmyomas, intramural myomasและการตรวจประเมินปีกมดลูกทั้งสองข้าง
- Saline infusion sonography (SIS) เป็นการตรวจโดยการฉีด sterile saline เข้าไปในโพรงมดลูกก่อนแล้วจึงทำtransvaginal ultrasound เพื่อประเมินดูพยาธิสภาพภายในโพรงมดลูก ซึ่งทำให้สามารถเห็นพยาธิสภาพได้ชัดเจนขึ้นโดยเฉพาะ endometrial polyps หรือsubmucosal leiomyoma ที่มีขนาดเล็ก(20, 21)
- Magnetic resonance imaging(MRI)เป็นวิธีที่มีประสิทธิภาพสูงมีความชัดเจนแต่มีราคาสูงจึงไม่เป็นที่นิยมในการตรวจประเมินทั่วไป
- Hysteroscopyเป็นการส่องกล้องเข้าไปดูภายในโพรงมดลูกโดยสามารถตัดชิ้นเนื้อจี้ไฟฟ้าเพื่อเป็นการผ่าตัดรักษาหรือเพื่อการส่งตรวจทางพยาธิวิทยาได้อีกด้วย(22)
การรักษา
การพิจารณาวิธีการรักษานั้นขึ้นอยู่กับสภาพของผู้ป่วย ปริมาณเลือดที่ออก สาเหตุของเลือดที่ออก ความต้องการบุตร โรคประจำตัว โดยขั้นตอนแรกสุดเป้าหมายการรักษานั้นคือ ควบคุมเลือดที่ออกอยู่อย่างต่อเนื่อง และลดปริมาณเลือดประจำเดือนในรอบถัดไป โดยการใช้ยารักษาเป็นทางเลือกแรก และวางแผนในกรณีที่จำเป็นต้องผ่าตัดรักษา(11)
การใช้ยาในการรักษาภาวะเลือดออกผิดปกติจากโพรงมดลูกเฉียบพลัน
ตารางที่ 9(11)
{tabulizer:style[gr.alterora.elemental_1_red_orange.css]}
| ยา | ปริมาณยาที่แนะนำ | การบริหารยา | ข้อควรระวังการใช้ยาตาม (FDA labeling) |
| Conjugated equine estrogen | 25 มิลลิกรัม | ทางหลอดเลือดดําทุก 4-6 ชั่วโมงจนครบ 24 ชม. | ในผู้ป่วยที่มีประวัติมะเร็งเต้านม หลอดเลือดอุดตัน (DVT, Stroke) โรคตับ ควรใช้ยาด้วยความระมัดระวัง |
| Combined oral contraceptives | ยาคุมกําเนิดชนิด monophasic ที่มีปริมาณ Ethinylestradiol อย่างน้อย 35 ไมโครกรัม | 1เม็ดวันละ3 ครั้ง จนครบ 7วัน | ในผู้ป่วยที่มีประวัติสูบบุหรี่ (อายุมากกว่า 35 ปี ) หลอดเลือดอุดตัน (DVT,Pulmonaryembolism,Stroke,CAD) ประวัติมะเร็งเต้านมโรคตับไมเกรนที่มีออร่า เบาหวานที่มีภาวะแทรกซ้อนทางหลอดเลือด โรคลิ้นหัวใจ |
| Medroxyprogesterone acetate | 20 มิลลิกรัม | 1เม็ดวันละ3 ครั้ง จนครบ 7วัน | ในผู้ป่วยที่มีประวัติหลอดเลือดอุดตัน (DVT,Pulmonaryembolism,Stroke,CAD)ประวัติมะเร็งเต้านมโรคตับ |
| Tranexamic acid | กิน 1.3 กรัมหรือ 10มิลลิกรัม/กิโลกรัม ทางหลอดเลือดดํา (สูงสุดไม่เกิน 600 มิลลิกรัม/ครั้ง ) | วันละ 3 ครั้ง จนครบ 5 วัน (ทุก 8 ชั่วโมง) | ในผู้ป่วยที่มีประวัติหลอดเลือดอุดตันและควรระมัดระวังในการใช้ร่วมกันกับยาคุมกำเนิดชนิดรวม |
ดัดแปลงจาก ACOG committee opinion no. 557: Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women
หลังจากภาวะเลือดออกเฉียบพลันสามารถควบคุมได้ การวางแผนรักษาในระยะยาวสามารถพิจารณาได้หลายวิธีในการควบคุมภาวะเลือดออกผิดปกติจากโพรงมดลูก(23)
- ห่วงคุมกำเนิดชนิดที่มีฮอร์โมนโปรเจสโตโรน (Levonorgeatrel IUDs)
- ยาคุมกําเนิด โดยกินตามวิธีปกติ ตามรอบแผงยาคุมกำเนิด 21 หรือ 28 วันต่อรอบเดือน หรืออาจพิจารณากินยาคุมกําเนิดแบบต่อเนื่อง
- การใช้ยาโปรเจสติน (progestin therapy) ได้ทั้งวิธีกิน หรือฉีดเข้ากล้ามเนื้อ
- การให้ยาช่วยลดการสลายตัวของลิ่มเลือด (Tranexamic acid)
- การใช้ยากลุ่ม NSAIDsโดยระวังการใช้ในกลุ่มผู้ป่วยที่การทำงานของเกล็ดเลือดผิดปกติ
- การปรึกษาแพทย์โลหิตวิทยา ในการรักษาภาวะเลือดออก ที่เกิดจากภาวะการแข็งตัวของเลือดผิดปกติหรือในกรณีที่ไม่สามารถควบคุมปริมารของประจำเดือนได้
- การใช้ยากลุ่ม Desmopressinผ่านทางจมูก หลอดเลือดดำ หรือฉีดใต้ผิวหนัง การให้ Recombinant factor VIII หรือ von Willebrand factorอาจช่วยในผู้ป่วยโรคvWDที่ไม่สามารถควบคุมภาวะเลือดออกรุนแรงได้ (24)
การใช้ยาในการรักษาควบคุมภาวะเลือดออกผิดปกติจากโพรงมดลูก
ตารางที่10 (23)
{tabulizer:style[gr.alterora.elemental_1_red_orange.css]}
| ยา | หลักการทำงานของยา | การบริหารยา | ผลไม่พึงประสงค์ |
| Levonorgestrelreleasing intrauterine system (LNGIUS) | ป้องกันการเจริญของเยื่อบุโพรงมดลูก | ใส่เข้าไปในโพรงมดลูก | เลือดออกกระปริดกระปรอยในช่วง 6เดือนแรก หรือไม่มีประจำเดือน ปวดศีรษะ สิว คัดตึงเต้านม อาจมีภาวะแทรกซ้อนหากใส่แล้วมีการทะลุผ่านชั้นมดลูก |
| Tranexamic acid | ลดการสลายตัวของลิ่มเลือด | กิน 2เม็ด 3-4 ครั้งต่อวัน ตั้งแต่วันที่1-4 ของรอบเดือน | ท้องอืด ท้องเสีย ปวดศีรษะ |
| NSAIDs | ลดระดับ prostaglandin | กินตั้งแต่วันแรก หรือ 1วันก่อนรอบเดือนมา จนกระทั่งเลือดประจำเดือนหยุด | ท้องอืด ท้องเสีย แผลในกระเพาะอาหาร |
| Combined oral contraceptives | ป้องกันการเจริญของเยื่อบุโพรงมดลูก | กินวันละ1 เม็ด จนครบ21วัน แล้วเว้นยา 7 วัน | ปวดศีรษะคลื่นไส้อาเจียนคัดตึงเต้านม หลอดเลือดอุดตัน |
| Oral progestogen (norethisterone) | ป้องกันการเจริญของเยื่อบุโพรงมดลูก | กิน 15 มิลลิกรัม ตั้งแต่วันที่ 5-26 ของรอบเดือน | น้ำหนักขึ้น ท้องอืด ปวดศีรษะ สิว คัดตึงเต้านม |
| Injected or implanted progestogen | ป้องกันการเจริญของเยื่อบุโพรงมดลูก | ฉีดเข้ากล้ามเนื้อทุก 3เดือน หรือฝังใต้ชั้นผิวหนัง 3-5 ปี | น้ำหนักขึ้นเลือดออกกระปริดกระปรอยอาจมีมวลกระดูกลดลง แต่กลับมาเป็นปกติหลัหยุดยา |
| Gonadotrophinreleasing hormone analogue (GnRHa) | ยับยั้งการสร้างฮอร์โมน estrogen และ progesterone | ฉีด 1เข็มทุกเดือน เป็นเวลา 3-6 เดือน หากใช้นานกว่า 6เดือน พิจารณาการให้ฮอร์โมนทดแทน (add back therapy) | มีอาการวัยทอง ร้อนวูบวาบ เหงื่อแตก ช่องคลอดแห้ง อาจมีภาวะกระดูพรุนหากใช้ติดต่อกันนานเกิน 6เดือน |
ดัดแปลงจาก National Collaborating Centre for Women’s and Children’s Health (Great Britain), National Institute for Health and Clinical Excellence (Great Britain). Heavy menstrual bleeding. London: RCOG Press; 2007. xxiii, 164 p. p.
การรักษาโดยการทำหัตถการและการผ่าตัด
ความจำเป็นในการทำหัตถการและการผ่าตัดขึ้นอยู่กับปัจจัยหลายอย่าง ตั้งแต่สภาพผู้ป่วย การตอบสนองต่อการรักษาด้วยยา ความต้องการมีบุตร โรคประจำตัว ความรุนแรงของภาวะเลือดออกผิดปกติ ข้อห้ามในการใช้ยา โดยหัตถการในการรักษามีหลายวิธีดังนี้
- การขูดมดลูก (dilation and curettage; D&C)
- การตัดติ่งเนื้องอกเยื่อบุโพรงมดลูก (polypectomy)
- การใส่สายสวนปัสสาวะในโพรงมดลูกเพื่อห้ามเลือด (IntracavitaryTamponade)โดยใส่น้ำ 30มิลลิลิตรใน balloon Foley’s ใส่ไว้ตั้งแต่ 2-48 ชั่วโมง จนสามารถแก้สาเหตุของเลือดออกได้
- การจี้ทำลายเยื่อบุโพรงมดลูก (endometrial ablation)เป็นวิธีที่ใช้เมื่อผู้ป่วยมีภาวะเลือดออกเรื้อรั้ง โดยเฉพาะที่เกิดจากสาเหตุ AUB-E และ AUB-O ผู้ป่วยไม่ต้องการมีบุตร มีมดลูกขนาดปกติ หรือมีก้อนเนื้องอกมดลูกขนาดเล็ก โดยใช้คลื่นไมโครเวฟ ( microwave endometrial ablation; MEA) หรือใช้ความร้อนจี้ (thermal balloon endometrial ablation ;TBEA)ข้อดีคือระยะพักฟื้นตัวสั้นกว่า(23, 25)
- การฉีดสารไปอุดหลอดเลือดแดง (artery embolization) คือการฉีด polyvinyl alcohol spheres ไปอุด Uterine artery โดยเหมาะในภาวะกลุ่มเส้นเลือดผิดปกติบริเวณมดลูก(AVM) (3,(23)
- การตัดมดลูก (hysterectomy)มีก้อนเนื้องอกมดลูกขนาดใหญ่ เลือดออกมาก รักษาวิธีอื่นไม่ได้ผล โดยทางเลือกแรกเป็นการผ่าตัดมดลูกทางช่องคลอด(23)
- การผ่าตัดเนื้องอกมดลูก(myomectomy)มีก้อนเนื้องอกขนาดใหญ่ แต่ยังต้องการมีบุตร โดยสามารถทำได้ทั้งทางช่องคลอด ผ่าตัดหน้าท้อง การส่องกล้องผ่าตัด ขึ้นอยู่กับตำแหน่ง และขนาดของเนื้องอกมดลูกอาจเป็นซ้ำและต้องการการผ่าตัดอีกครั้ง(23)
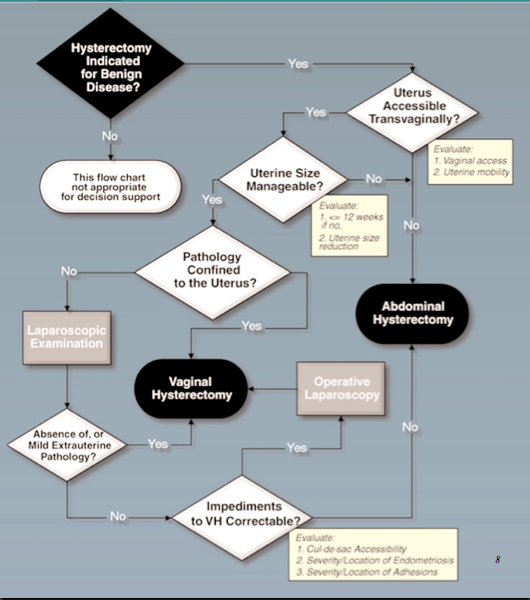
แผนผังสรุปการเมินผู้ป่วยภาวะเลือดออกผิดปกติจากโพรงมดลูก(25)
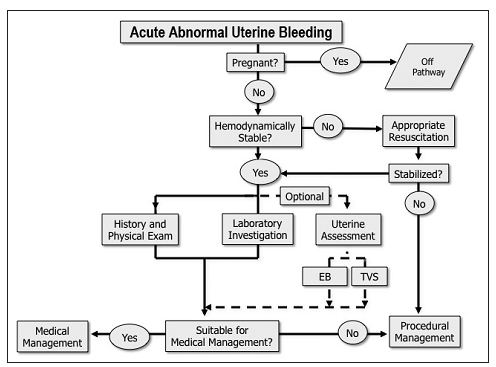
Munro MG, Southern California Permanente Medical Group’s Abnormal Uterine Bleeding Working G. Acute uterine bleeding unrelated to pregnancy: a Southern California Permanente Medical Group practice guideline. The Permanente journal. 2013 Summer
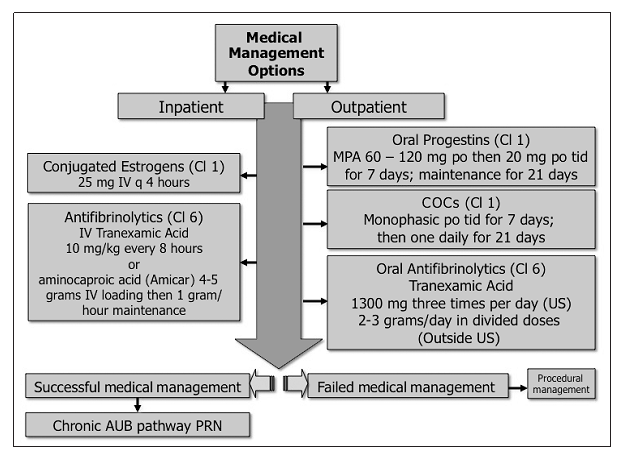
Munro MG, Southern California Permanente Medical Group’s Abnormal Uterine Bleeding Working G. Acute uterine bleeding unrelated to pregnancy: a Southern California Permanente Medical Group practice guideline. The Permanente journal. 2013 Summer
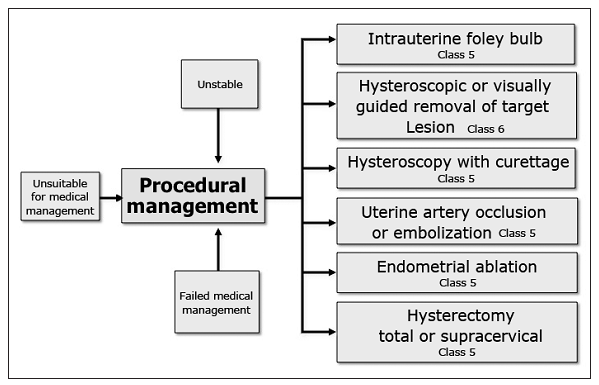
Munro MG, Southern California Permanente Medical Group’s Abnormal Uterine Bleeding Working G. Acute uterine bleeding unrelated to pregnancy: a Southern California Permanente Medical Group practice guideline. The Permanente journal. 2013 Summer
เอกสารอ้างอิง
- Spencer CP, Whitehead MI. Endometrial assessment re-visited. British journal of obstetrics and gynaecology. 1999 Jul;106(7):623-32. PubMed PMID: 10428515. Epub 1999/07/31. eng.
- Maybin JA, Munro MG, Fraser IS, Critchley HOD. Re-definition and re-classification of menstrual disorders. Obstetrics, Gynaecology & Reproductive Medicine. 2013;23(11):331-6.
- Munro MG, Critchley HO, Broder MS, Fraser IS. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. 2011 Apr;113(1):3-13. PubMed PMID: 21345435. Epub 2011/02/25. eng.
- Fraser IS, Critchley HO, Broder M, Munro MG. The FIGO recommendations on terminologies and definitions for normal and abnormal uterine bleeding. Seminars in reproductive medicine. 2011 Sep;29(5):383-90. PubMed PMID: 22065325. Epub 2011/11/09. eng.
- Munro MG, Critchley HO, Fraser IS. The FIGO systems for nomenclature and classification of causes of abnormal uterine bleeding in the reproductive years: who needs them? American journal of obstetrics and gynecology. 2012 Oct;207(4):259-65. PubMed PMID: 22386064. Epub 2012/03/06. eng.
- Dueholm M, Lundorf E, Hansen ES, Sorensen JS, Ledertoug S, Olesen F. Magnetic resonance imaging and transvaginal ultrasonography for the diagnosis of adenomyosis. Fertility and sterility. 2001 Sep;76(3):588-94. PubMed PMID: 11532486. Epub 2001/09/05. eng.
- Munro MG, Critchley HO, Fraser IS. The FIGO classification of causes of abnormal uterine bleeding in the reproductive years. Fertility and sterility. 2011 Jun;95(7):2204-8, 8 e1-3. PubMed PMID: 21496802. Epub 2011/04/19. eng.
- Baird DD, Dunson DB, Hill MC, Cousins D, Schectman JM. High cumulative incidence of uterine leiomyoma in black and white women: ultrasound evidence. American journal of obstetrics and gynecology. 2003 Jan;188(1):100-7. PubMed PMID: 12548202. Epub 2003/01/28. eng.
- Wamsteker K, Emanuel MH, de Kruif JH. Transcervical hysteroscopic resection of submucous fibroids for abnormal uterine bleeding: results regarding the degree of intramural extension. Obstetrics and gynecology. 1993 Nov;82(5):736-40. PubMed PMID: 8414318. Epub 1993/11/01. eng.
- Shankar M, Lee CA, Sabin CA, Economides DL, Kadir RA. von Willebrand disease in women with menorrhagia: a systematic review. BJOG : an international journal of obstetrics and gynaecology. 2004 Jul;111(7):734-40. PubMed PMID: 15198765. Epub 2004/06/17. eng.
- ACOG committee opinion no. 557: Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women. Obstetrics and gynecology. 2013 Apr;121(4):891-6. PubMed PMID: 23635706. Epub 2013/05/03. eng.
- Kouides PA, Conard J, Peyvandi F, Lukes A, Kadir R. Hemostasis and menstruation: appropriate investigation for underlying disorders of hemostasis in women with excessive menstrual bleeding. Fertility and sterility. 2005 Nov;84(5):1345-51. PubMed PMID: 16275228. Epub 2005/11/09. eng.
- Hale GE, Hughes CL, Burger HG, Robertson DM, Fraser IS. Atypical estradiol secretion and ovulation patterns caused by luteal out-of-phase (LOOP) events underlying irregular ovulatory menstrual cycles in the menopausal transition. Menopause. 2009 Jan-Feb;16(1):50-9. PubMed PMID: 18978637. Epub 2008/11/04. eng.
- Hale GE, Manconi F, Luscombe G, Fraser IS. Quantitative measurements of menstrual blood loss in ovulatory and anovulatory cycles in middle- and late-reproductive age and the menopausal transition. Obstetrics and gynecology. 2010 Feb;115(2 Pt 1):249-56. PubMed PMID: 20093896. Epub 2010/01/23. eng.
- Toth M, Patton DL, Esquenazi B, Shevchuk M, Thaler H, Divon M. Association between Chlamydia trachomatis and abnormal uterine bleeding. Am J Reprod Immunol. 2007 May;57(5):361-6. PubMed PMID: 17430500. Epub 2007/04/14. eng.
- Gleeson NC. Cyclic changes in endometrial tissue plasminogen activator and plasminogen activator inhibitor type 1 in women with normal menstruation and essential menorrhagia. American journal of obstetrics and gynecology. 1994 Jul;171(1):178-83. PubMed PMID: 8030696. Epub 1994/07/01. eng.
- Irvine GA, Campbell-Brown MB, Lumsden MA, Heikkila A, Walker JJ, Cameron IT. Randomised comparative trial of the levonorgestrel intrauterine system and norethisterone for treatment of idiopathic menorrhagia. British journal of obstetrics and gynaecology. 1998 Jun;105(6):592-8. PubMed PMID: 9647148. Epub 1998/07/01. eng.
- Smith RA, von Eschenbach AC, Wender R, Levin B, Byers T, Rothenberger D, et al. American Cancer Society guidelines for the early detection of cancer: update of early detection guidelines for prostate, colorectal, and endometrial cancers. Also: update 2001–testing for early lung cancer detection. CA: a cancer journal for clinicians. 2001 Jan-Feb;51(1):38-75; quiz 7-80. PubMed PMID: 11577479. Epub 2001/10/02. eng.
- ACOG Committee Opinion No. 426: The role of transvaginal ultrasonography in the evaluation of postmenopausal bleeding. Obstetrics and gynecology. 2009 Feb;113(2 Pt 1):462-4. PubMed PMID: 19155921. Epub 2009/01/22. eng.
- Szpurek D, Sroka L, Moszynski R, Sajdak S. [Clinical assessment of sonohysterography in the diagnosis and management of abnormal uterine bleeding]. Ginekologia polska. 2002 Nov;73(11):980-4. PubMed PMID: 12722386. Epub 2003/05/02. Analiza przydatnosci klinicznej sonohysterografii u chorych z nieprawidlowymi krwawieniami z macicy. pol.
- Khan F, Jamaat S, Al-Jaroudi D. Saline infusion sonohysterography versus hysteroscopy for uterine cavity evaluation. Annals of Saudi medicine. 2011 Jul-Aug;31(4):387-92. PubMed PMID: 21808116. Pubmed Central PMCID: 3156516. Epub 2011/08/03. eng.
- Bradley LD. Diagnosis of abnormal uterine bleeding with biopsy or hysteroscopy. Menopause. 2011 Apr;18(4):425-33. PubMed PMID: 21701428. Epub 2011/06/28. eng.
- National Collaborating Centre for Women’s and Children’s Health (Great Britain), National Institute for Health and Clinical Excellence (Great Britain). Heavy menstrual bleeding. London: RCOG Press; 2007. xxiii, 164 p. p.
- Kadir RA, Lukes AS, Kouides PA, Fernandez H, Goudemand J. Management of excessive menstrual bleeding in women with hemostatic disorders. Fertility and sterility. 2005 Nov;84(5):1352-9. PubMed PMID: 16275229.
- Munro MG, Southern California Permanente Medical Group’s Abnormal Uterine Bleeding Working G. Acute uterine bleeding unrelated to pregnancy: a Southern California Permanente Medical Group practice guideline. The Permanente journal. 2013 Summer;17(3):43-56. PubMed PMID: 24355890. Pubmed Central PMCID: 3783080.