การป้องกันโรคกระดูกพรุนในหญิงวัยหมดประจำเดือน
(Prevention of osteoporosis in postmenopause)
น.พ. ภักดี แก้วแปงจันทร์
อาจารย์ที่ปรึกษา: อาจารย์อินทิรา ศรีประเสริฐ
บทนำ

โรคกระดูกพรุนหรือภาวะมวลกระดูกต่ำพบในกลุ่มประชากรชาวอเมริกันทั้งชายและหญิงประมาณ 44 ล้านคน ในจำนวนนี้พบว่า 55% เป็นประชากรที่มีอายุมากกว่า 50 ปีขึ้นไป โดยส่วนมากพบในคนผิวขาว (Caucasian) และคนเอเชีย( Asians) ที่เป็นผู้หญิงวัยหมดประจำเดือน (Postmenopausal) และยังพบว่าเกิดกระดูกหักขึ้นถึง 1.5 ล้านคนต่อปี [1]
โรคกระดูกพรุนเป็นโรคที่ทำให้ความแข็งแรงของกระดูกลดลง มีการเปลี่ยนแปลงในลักษณะโครงสร้างของกระดูก ซึ่งมีผลทำให้กระดูกไม่สามารถรับน้ำหนักหรือแรงกดดันได้ตามปกติ ทำให้เกิดอาการกระดูกหักง่ายกว่าปกติ ความชุกของโรคกระดูกพรุนมีมากขึ้นตามอายุขัยของประชากรที่มากขึ้น เพิ่มโอกาสเสียงที่จะทำให้กระดูกหักได้ง่ายขึ้น
การป้องกันโรคกระดูกพรุนในหญิงวัยหมดประจำเดือนจึงมีความสำคัญที่จะช่วยลดการเสื่อมลงของกระดูกและการลดลงของมวลกระดูกก่อนที่จะนำไปสู่การเกิดโรคกระดูกพรุน โดยจะทำให้ลดการหักของกระดูกลงได้และเพิ่มคุณภาพชีวิตที่ดีขึ้น โดยการป้องกันโรคกระดูกพรุนสามารถทำได้ทั้งแบบใช้ยารักษา และแบบไม่ใช้ยารักษา โดยในที่นี้จะเน้นกล่าวเฉพาะการดูแลจัดการการป้องกันโรคกระดูกพรุนในสตรีวัยหมดประจำเดือน
ความสำคัญของโรคกระดูกพรุน
ระบาดวิทยา
ข้อมูลจากองค์การอนามัยโลกพบว่าความชุกของโรคกระดูกพรุนทั่วโลกในผู้หญิงเท่ากับร้อยละ 4 ในกลุ่มอายุ 50-59 ปี และเพิ่มขึ้นเป็นร้อยละ 8, 25 และ 48 ในกลุ่มอายุ 60-69, 70-79 และมากกว่า 80 ปี ตามลาดับ [2]
คำจำกัดความของโรคกระดูกพรุน
องค์การอนามัยโลก
องค์การอนามัยโลก[3] ได้ให้นิยามของโรคกระดูกพรุนไว้ว่าเป็น “โรคกระดูกที่เกิดขึ้นทั่วร่างกาย (systemic skeletal disease) ซึ่งมีมวลกระดูกต่ำ (low bone mass) ร่วมกับการเสื่อมของโครงสร้างระดับจุลภาพของกระดูก (microarchitecture deterioration) ส่งผลให้กระดูกมีความเปราะบางและหักง่าย” และได้กำหนดเกณฑ์ในการวินิจฉัยโรคกระดูกพรุนโดยอาศัยการตรวจความหนาแน่นของกระดูก (ในที่นี้มีความหมายเดียวกันกับมวลกระดูก) โดยจะให้การวินิจฉัยโรคกระดูกพรุนเมื่อมีความหนาแน่นของกระดูกต่ำกว่า -2.5 ของส่วนเบี่ยงเบนมาตรฐาน (T-score ≤ -2.5) เมื่อเปรียบเทียบกับค่าเฉลี่ยและส่วนเบี่ยงเบนมาตรฐานของมวลกระดูกในวัยสาวซึ่งถือว่าเป็นช่วงที่มีมวลกระดูกสูงสุด (peak bone mass)
National Institute of Health (NIH) แห่งประเทศสหรัฐอเมริกา
National Institute of Health แห่งประเทศสหรัฐอเมริกา[4] ได้นิยามของโรคกระดูกพรุนว่าเป็น “โรคของกระดูกที่มีความแข็งแกร่งของกระดูก (bone strength) ลดลง ส่งผลให้เพิ่มความเสี่ยงต่อกระดูกหัก โดยความแข็งแกร่งของกระดูก (bone strength) ในนิยามนี้ประกอบด้วย 2 ส่วนหลัก ได้แก่ ความหนาแน่นของกระดูก (bone density) และคุณภาพของกระดูก (bone quality)” และจากข้อจากัดของประเมินคุณภาพของกระดูก การวินิจฉัยโรคกระดูกพรุนยังอิงตามผลตรวจความหนาแน่นของกระดูกเป็นพื้นฐาน
พยาธิกำเนิด (Patogenesis)
การผลัดเปลี่ยนกระดูก (bone turnover) เกิดขึ้นตลอดเวลาโดยปกติจะมีการสร้างใหม่โดย osteoblast และมีการสลายกระดูกโดย osteoclast ซึ่งจะทำงานอย่างสมดุลกันเรียกว่า มี coupling ของการสร้างและทำลายกระดูก หากมีความไม่สมดุลย์ (Uncoupling) เกิดขึ้นจะทำให้มีภาวะผิดปกติเกิดขึ้น เช่น ถ้าการสลายมากกว่าการสร้างใหม่จะทาให้เกิดภาวะกระดูกพรุน หากมีการสร้างมากกว่าการสลายจะก่อให้เกิดภาวะ osteopetrosis (กระดูกจะหนาขึ้น medullary canal แคบลง)
โดยทั่วไปความหนาแน่นกระดูกจะเพิ่มสูงสุด (peak bone mass) ในอายุระหว่าง 30-35 ปี [5] โดย 90% ของมวลกระดูกจะสะสมในช่วงที่มีการเจริญเติบโตเร็วก่อนเป็นวัยรุ่นนั้นเอง[6] โดยปกติผู้ชายจะมี peak bone mass ที่สูงกว่าผู้หญิงประมาณ 15-20% หลังจากนั้นปริมาณมวลกระดูกจะเริ่มลดลงช้า ๆ ประมาณ 0.5-1%[7] ต่อปี แต่ในผู้หญิงเมื่อถึงวัยหมดประจำเดือน (post menopause) อัตราการลดลงของมวลกระดูกจะลดลงอย่างรวดเร็ว อาจสูงถึง 3-6%[8] ต่อปี หลังจากนั้น 6-10 ปี อัตราการสูญเสียมวลกระดูกจะกลับมาช้าลงอยู่ที่ 0.5%-1% ต่อปีอีก นอกจากจะมีปัจจัยอื่น ๆ อาทิ การขาดวิตามินดี แคเชี่ยม หรือไม่ได้ออกกำลังกายตามสมควร จะทำให้การลดลงของมวลกระดูกยังคงที่ในอัตราสูง
การสูญเสียมวลกระดูกเกิดจากความผิดปกติของระบบการปรับแต่งกระดูก ซึ่งมีสามเหตุหลายประการ แต่ที่สำคัญคือ ภาวะการขาดฮอร์โมนเอสโตรเจน (postmenopausal bone loss) และ การเสื่อมถอยของ Cells (age-related bone loss)
ใน postmenoparsal osteoporosis การขาดเอสโตรเจนถือเป็นปัจจัยส่งเสริมที่สำคัญ ที่กระตุ้น osteoclast ให้ทำงานมากขึ้น ทำให้มี increase bone turnover ถึงแม้ soteoblast จะมาสร้างกระดูกทดแทน แต่ก็กินเวลานาน ไม่สามารถไล่ทัน bone resorption จึงทำให้เห็นการลดลงของมวลกระดูก เป็นกลไกที่ทำให้กระดูกหักได้ง่ายขึ้นใน postmenoparsal osteoporosis
สำหรับใน senile osteoporosis จะเป็นไปในทางตรงข้าม คือ bone remodeling activity (bone turnover) จะช้าลงเชื่อว่าเกิดมาจากตัว osteblast เองที่ไม่สามารถสร้าง bone ได้พอเพียงเพราะอะไรยังไม่แน่ชัด
การเพิ่มค่ามวลกระดูกสูงสุด (MAXIMIZING PEAK BONE MASS)
ค่ามวลกระดูกสูงสุด (PEAK BONE MASS:PBM) คือค่ามวลกระดูกสูงสุดที่พบในช่วงชีวิตของเรา ซึ่งยังไม่ทราบแน่ชัดว่าค่าสูงสุดจะอยู่ในช่วงอายุเท่าไร แต่โดยส่วนมากจะอยู่ในอายุช่วงประมาณ 30 ปี ซึ่งอาจจะแตกต่างกันไปในแต่ละคน ขึ้นอยู่กับพันธุกรรม และความแตกต่างของฮอร์โมน นอกจากนี้ยังขึ้นอยู่กับวิธีการวัดหาค่า PBM อีกด้วย [9]
จากการศึกษาในฝาแฝดเหมือน พบว่า 60-70 เปอร์เซ็นต์ของความแตกต่างของค่า PBM จะแปรผันตามลักษณะทางพันธุกรรม เช่น เชื้อชาติ, เพศและขนาดของร่างกาย[10] ส่วนอีก 30-40 เปอร์เซ็นต์ จะขึ้นอยู่กับปัจจัยทางด้านสภาพแวดล้อม เช่น อาหาร, การออกกำลังกาย, ลักษณะนิสัย, โรค และยา ในการศึกษาผู้หญิงที่วัยก่อนหมดประจำเดือนที่มีสุขภาพสมบูรณ์จำนวน 668 คน ที่มีลักษณะน้ำหนักตัวน้อย, เริ่มมีประจำเดือนเมื่ออายุ 15 ปี หรือหลังจากนั้น,ไม่ค่อยได้ออกกำลังกาย พบว่ามีโอกาสที่จะมีค่ามวลกระดูกต่ำ[11]
ส่วนในการศึกษาอื่นๆ ของผู้หญิงวัยก่อนหมดประจำเดือนที่สูบบุหรี่, มีค่าดัชนีมวลกายต่ำ ที่เป็นคนผิวขาวหรือคนเอเชีย ล้วนมีปัจจัยเสี่ยงที่จะมีค่า BMD ต่ำ พบว่าการสูบบุหรี่มีส่วนเกี่ยวข้องกับการลดต่ำลงของค่า BMD และการลดลงของความหนาของกระดูกส่วน Cortex ในคนอายุ 18-20 ปี[12] ในปัจจุบันผู้ป่วยที่มีความผิดปกติตั้งแต่กำเนิด เช่น โรค Osteogenesis imperfect และโรค Cystic fibrosis ประสบความสำเร็จในรักษาตั้งแต่ในวัยเด็กมากขึ้น ทำให้คุณภาพชีวิตดีขึ้นและป้องการการลดลงของค่ามวลกระดูกในช่วงวัยผู้ใหญ่ลงได้ ,
จากคำกล่าวของศาสตราจารย์ Charles E. Dent ที่ว่า”senile osteoporosis is a pediatric disease” แสดงให้เห็นถึงความสำคัญของการทำให้ค่าความมวลกระดูกสูงได้ตั้งแต่วัยเด็กจะสามารถช่วยลดการเสื่อมสภาพ การลดลงของค่า BMD จนนำไปสู่การเกิดโรคกระดูกพรุนในวัยชราได้[13]
อาการและอาการแสดงทางคลินิก
ภาวะโรคกระดูกพรุนส่วนใหญ่ผู้ป่วยจะไม่มีอาการและจะมาพบแพทย์เมื่อมีภาวะแทรกซ้อนคือ กระดูกหัก ซึ่งมักพบบ่อยบริเวณสะโพก กระดูกสันหลัง และกระดูกข้อมือ เป็นส่วนใหญ่ซึ่งกระดูกหักเหล่านี้ โดยเฉพาะกระดูกหักบริเวณสะโพกนาไปสู่อันตราย (mortality) หลังกระดูกหักประมาณ 15% ในปีแรก และประมาณ 70% ของผู้ป่วยไม่สามารถช่วยเหลือตนเองได้เช่นเดิม[14] ส่วนกระดูกสันหลังยุบ (spinal compression fracture) มีผู้ป่วยหลายรายไม่ได้รับการวินิจฉัย ผู้ป่วยเหล่านี้จะมีอาการปวดหลังเรื้อรัง หลังค่อม (kyphosis) และทาให้ผู้ป่วยเคลื่อนไหวและช่วยตัวเองได้น้อยลง
การวินิจฉัยโรคกระดูกพรุน
1. Dual energy X-ray absorptometry (DXA)
การวินิจฉัยโรคกระดูกพรุนในผู้หญิงอาศัยเกณฑ์การวินิจฉัยขององค์การอนามัยโลก[15,16] ซึ่งตรวจโดยเครื่อง dual energy X-ray absorptiometry (DXA) เท่านั้น ซึ่งอาศัยการเปรียบเทียบค่าความหนาแน่นกระดูกกับค่ามวลกระดูกสูงสุด (peak bone mass) ในผู้หญิงวัยสาว และให้ถือค่าน้อยกว่าหรือเท่ากับ -2.5 ของส่วนเบี่ยงเบนมาตรฐานในการวินิจฉัยโรคกระดูกพรุน (ตามตารางที่ 1) ทั้งนี้เนื่องจากพบความเสี่ยงเพิ่มขึ้น 1.4 – 2.6 เท่าทุก 1 ส่วนเบี่ยงเบนมาตรฐานที่ลดลง[17,18]
ตารางที่ 1 แสดงการวินิจฉัยโรคกระดูกพรุนตามความหนาแน่นกระดูก

2. Quantitative ultrasound ที่กระดูกส้นเท้า
สำหรับ quantitave ultrasound (QUS) เป็นเครื่องมือที่ใช้วัดความหนาแน่นของกระดูกส้นเท้า สามารถประเมิน broadband ultrasonic attenuation (BUA) และ speed of sound (SOS) ทั้ง BUA และ SOS ไม่ใช้ในการประเมินความหนาแน่นของกระดูก แต่มีความสัมพันธ์ของการเกิดกระดูกหักในผู้หญิงวัยหมดประจาเดือน[19,20] อย่างไรก็ตาม ณ ปัจจุบันยังไม่มีข้อแนะนำในการวินิจฉัยโรคกระดูกพรุน ยกเว้นใช้ร่วมดัชนีความเสี่ยงทางคลินิก เช่น อายุ น้ำหนัก ในกรณีคัดกรอง ส่วนในกรณีที่สถานพยาบาลไม่มี หรือไม่สามารถส่งตัวผู้ป่วยไปตรวจด้วยเครื่อง DXA การใช้ผลตรวจ T-score จาก QUS ร่วมกับอายุและน้าหนัก อาจใช้พิจารณาให้การรักษาได้เมื่อมีโอกาสเสี่ยงของการเกิดโรคกระดูกพรุนจากการคานวณ nomogram ตั้งแต่ร้อยละ 30 ขึ้นไป[21]
3. Quantitative CT scan (QCT)
มีความแม่นยำสูงโดยเฉพาะอย่างยิ่งบริเวณกระดูกสันหลัง สามารถวัดความหนาแน่นของกระดูกได้ทั้ง cortical และ cancellous bone ขณะนี้กาลังมีการพัฒนาเครื่อง CT ที่สามารถวัด peripheral bone ได้ แต่เนื่องจากได้รับปริมาณรังสีในการวัดสูง ไม่ใช่เกณฑ์มาตรฐานตามองค์การอนามัยโลก และราคาแพง จึงไม่แนะนำให้ส่งตรวจ
ทำไมถึงต้องมีการป้องกันโรคกระดูกพรุน
โรคกระดูกพรุนหรือภาวะที่มีค่า BMD ต่ำจะเน้นเรื่องการป้องกันมากกว่าการรักษา เนื่องจากว่าเมื่อเกิดกระบวนการเปลี่ยนแปลงโครงสร้างระดับจุลภาพของกระดูกและนำไปสู่การเสื่อมแล้วนั้น จะทำให้มีการสูญเสียมวลกระดูกร่วมด้วยและไม่สามารถทำให้กลับคืนมาสู่สภาวะปกติได้ ดังนั้นในการรักษาอาจจะทำได้แค่ทำให้ค่า BMD เพิ่มสูงขึ้นหรือคงระดับไว้ได้และลดความเสี่ยงต่อการหักของกระดูกลงได้ แต่จะไม่สามารถทำให้คุณภาพและความแข็งแรงของกระดูกกลับไปเป็นดังเดิมได้
ค่าความหนาแน่นของมวลกระดูก(BMD) ในผู้ใหญ่หมายถึงค่าความสัมพันธ์ของค่ามวลกระดูกสูงสุด (Peak bone mass (PBM))และค่าอัตราการสูญเสียมวลกระดูก(Rate of bone loss) ดังนั้นการป้องกันโรคกระดูกพรุนจึงเน้นเรื่องการเพิ่มค่ามวลกระดูกสูงสุดให้ร่างกายและลดอัตราการสูญเสียกระดูกลง ซึ่งเป็นหัวใจหลักในการดูแลรักษาความแข็งแรงของกระดูกและป้องกันการหักของกระดูก
การป้องกันโรคกระดูกพรุน
หมายถึงการให้ยา หรือ Interventions ใด ๆ แก่ผู้ที่ยังไม่เป็นโรคกระดูกพรุนและยังไม่มีกระดูกหักจากโรคกระดูกพรุน โดยมีวัตถุประสงค์เพื่อป้องกันหรือชะลอไม่ให้ผู้นั้นเป็นโรคกระดูกพรุน โดยป้องกันไม่ให้มวลกระดูกลดลง ซึ่งปัจจุบันกลยุทธ์ในการป้องกันโรคกระดูกพรุนจะเน้นไปในทางการไม่ใช้ยา (non-pharmacologic strategy) เพราะมีความคุ้มค่าทางเศรษฐศาสตร์มากกว่า การป้องกันแบ่งออกเป็นสองช่วงเวลาคือ ในวัยเยาว์จะเป็นการสร้างให้มวลกระดูกมีปริมาณมากที่สุด และในวัยทองเพื่อป้องกันการลดลงของมวลกระดูก ในที่นี้วัยทองหมายถึงผู้หญิงวัยหมดประจำเดือนและผู้ชายอายุมากกว่า 50 ปี
การเสริมสร้างมวลกระดูกสูงสุด
การเสริมสร้างมวลกระดูกสูงสุด (peak bone mass) ตั้งแต่วัยเยาว์ มีประโยชน์มากในการสะสมต้นทุนให้กระดูกแข็งแรงและมีคุณภาพที่ดี สามารถทำได้โดย
- การออกกำลังกายโยการลงน้ำหนัก (weight bearing exercises) และการออกำลังกายโดยใช้แรงต้าน (resistive exercises)
- การรับประทานอาหารที่มีแคลเซียมตามข้อกำหนดตามวัย
- การรับแสงแดดอย่างเพียงพอ เพื่อให้ผิวหนังสร้างวิตามินดี
- การลดพฤติกรรมเสี่ยงต่อโรคกระดูกพรุน ได้แก่
- งดสูบบุหรี่
- งดดื่มกาแฟหรือเครื่องดื่มที่มีส่วนผสมของคาแฟอีน
- หลีกเลี่ยงอาหารเค็มจัดและมีโปรตีนสูง
- ไม่ดื่มสุราเกินขนาด
- ปรับวิถีชีวิตให้มีกิจกรรมการเคลื่อนไหวทางกาย (physical activities)
- ควบคุมโรคเรื้อรังที่เป็นปัจจัยเสี่ยงต่อโรคกระดูกพรุน
- ระมัดระวังการใช้ยาที่เป็นปัจจัยเสี่ยงต่อโรคกระดูกพรุน
- ควมคุมน้ำหนักตัวให้พอเหมาะโยดัชนีมวลกายอยู่ระหว่าง 20-30 กก/ตรม.
การป้องกันการสลายของมวลกระดูก
หลังจากที่ร่างกายสร้างมวลกระดูกสูงสุดแล้ว อัตราการสร้างกากระดูก (rate of bone formation) จะช้ากว่าอัตราการสลายกระดูก (rate of bone resorption) ซึ่งอัตราดังกล่าวจะเพิ่มขึ้นเร็วมากโดยเฉพาะอย่างยิ่งในผู้หญิงวัยหมดประจำเดือน ในช่วงดังกล่าวสามารถลดอัตราการสลายกรุดูดได้โดย
- การป้องกันโดยการไม่ใช้ยา (non-pharmacologic management)
- การป้องกันโดยการใช้ยา (pharmacologic management)
1 การรักษาโดยไม่ใช้ยา (non-pharmacologic treatment)
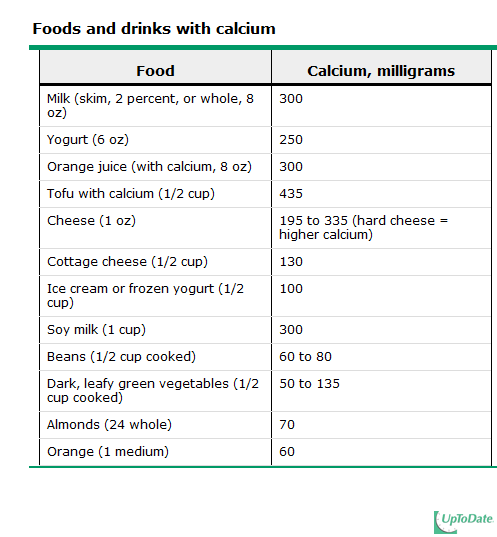
1.1 การได้รับปริมาณแคลเซียมที่เพียงพอ
แหล่งอาหารที่ดีของแคลเซียมได้แก่ นมและผลิตภัณฑ์จากนม ซึ่งจะได้แคลเซียมทั้งในด้านปริมาณและคุณภาพ ร่างกายสามารถดูดซึมแคลเซียมจากนมได้ดีกว่าอาหารชนิดอื่น ผักบางชนิดโดยเฉพาะผักใบสีเขียวเข้มจะมีแคลเซียมในปริมาณปานกลาง แต่ร่างกายสามารถดูดซึมแคลเซียมไปใช้ประโยชน์ได้ดี
จากการศึกษาในฝาแฝดเหมือน ที่อายุระหว่าง 6 – 14 ปี ที่ได้รับแคลเซียมเสริม 1000 มิลลิกรัมต่อวัน เป็นเวลาต่อเนื่อง 3 ปี พบว่ามีการเพิ่มขึ้นของค่ามวลกระดูก BMD อย่างมีนัยสำคัญเมื่อเทียบกับกลุ่มที่ไม่ได้ให้[23]
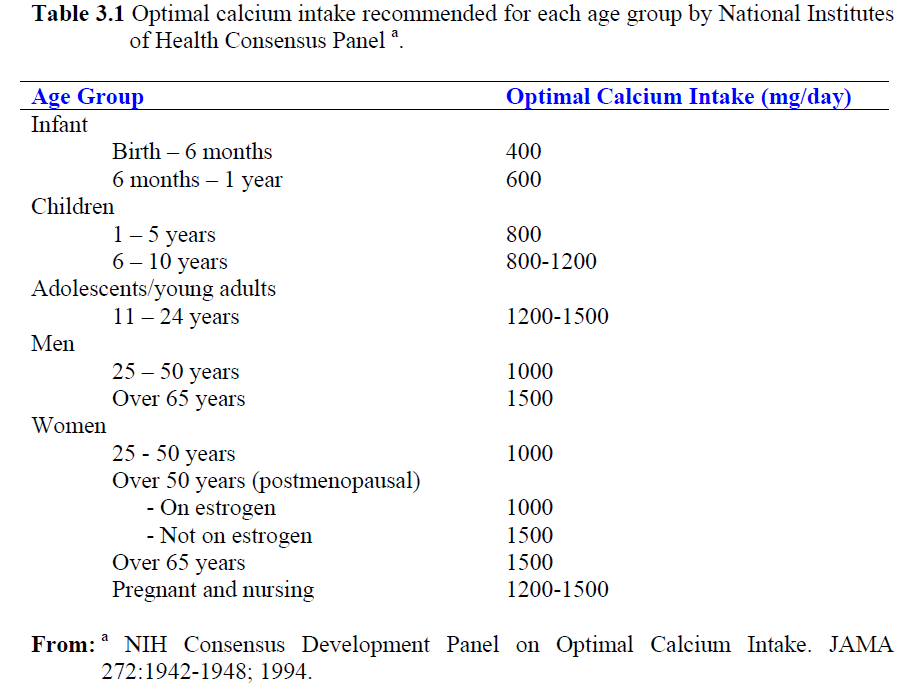
องค์กร The Recommended Dietary Allowance (RDA) แนะนำให้ผู้หญิงวัยหมดประจำเดือนให้ได้รับแคลเซียมปริมาณ 1200 มิลลิกรัมต่อวัน ของอาหารที่รับประทานและแคลเซียมเสริมที่ให้เพิ่มเข้าไป ส่วนในหญิงวัยก่อนหมดประจำเดือนหรือในผู้ชายทั่วไปแนะนำให้ได้รับแคลเซียมประมาณ 1000 มิลลิกรัมต่อวัน น่าจะเพียงพอต่อความต้องการของร่างกาย [24,25,26,27]
สำหรับคนที่เคยมีประวัติว่าเป็นโรคนิ่วในไตมาก่อน ควรจะได้รับการประเมินก่อนที่จะได้รับแคลเซียมเสริมเข้าไป
1.2 วิตามินดี
วิตามินดีและแคลเซียมมีความสำคัญต่อภาวะความสมดุลของระบบกระดูกของร่างกาย โดยที่วิตามินดีจะช่วยทำให้ร่างกายสามารถดูดซึมแร่ธาตุแคลเซียมได้ดีขึ้นในบริเวณลำไส้เล็กซึ่งเป็นแร่ธาตุที่มีความสำคัญต่อการสร้างกระดูกรวมถึงยังช่วยเสริมสร้างการทำหน้าที่ของกล้ามเนื้อให้ดีขึ้น ภาวะที่มีระดับของวิตามินดีในร่างกายต่ำ จะส่งผลให้มีการดูดซึมแคลเซียมได้ลดลง ทำให้ร่างกายขาดแคลเซียม ส่งผลกระตุ้นให้ฮอร์โมนพาราไทรอยด์ (Parathyroid hormone) สูงขึ้น เพื่อกระตุ้นให้เกิดกระบวนการการสลายกระดูก (Bone resorption) เพื่อให้มีประมาณแคลเซียมในกระแสเลือดเพิ่มขึ้น
จากการศึกษาในกลุ่มเด็กผู้หญิงก่อนเข้าสู่วัยเจริญพันธุ์ จำนวน 106 คน พบว่าการให้วิตามินดีเสริมเข้าไปตั้งแต่ในวัยเด็กจะทำให้มีปริมาณของมวลกระดูกที่บริเวณคอของกระดูกต้นขา (Femoral neck) เพิ่มมากขึ้นเมื่อเทียบกับกลุ่มเปรียบเทียบที่ไม่ได้รับวิตามินดี[28]
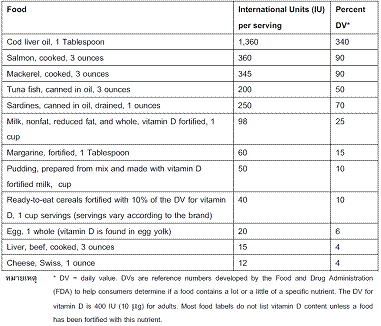
การได้รับวิตามินดีที่เพียงพอจะช่วยป้องกันการเกิดโรคกระดูกพรุน การเกิดกระดูกหัก และการหกล้ม. การได้รับวิตามินดีวันละ 400-800 IU เป็นปริมาณที่เพียงพอต่อการป้องกันการขาดวิตามินดี ซึ่งการได้รับวิตามินดีดังกล่าวอาจได้รับจากอาหาร จากการสัมผัสแสงแดด หรือได้รับจากการเสริมวิตามินดี[29,30]
องค์กร The Recommended Dietary Allowance (RDA) แนะนำให้เด็กที่อายุ 1 – 18 ปีและคนวัยผู้ใหญ่จนกระทั้งถึงอายุ 70 ปีขึ้นไป ให้ได้รับวิตามินดี 600 IU (15 mg) ต่อวัน ส่วนผู้สูงอายุที่อายุ 71 ปีขึ้นไปให้ได้รับวิตามินดี 800 IU (20 mg) ต่อวัน[24] ส่วนผู้ที่มีความเสี่ยงสูงต่อภาวะวิตามินดีต่ำ (low serum 25-hydroxyvitamin D) รับประทานได้น้อย ไม่ค่อยได้รับแสงแดดอาจพิจารณาให้วิตามินดีเสริมในปริมาณที่มากกว่านี้หรือเจาะตรวจหาระดับวิตามินดีในร่างกาย serum 25-hydroxyvitamin D เป็นระยะได้
การศึกษา meta-analysis พบว่าการให้วิตามินดีเสริมเพียงอย่างเดียวทั้งชนิดดั้งเดิม (native) และอนุพันธ์ (analogs) ไม่สามารถลดอุบัติการณ์ของกระดูกสะโพก กระดูกสันหลัง และกระดูกหักที่ตำแหน่งใดๆ ได้ ในขณะที่การให้วิตามินดีขนาด 700-800 IU ต่อวัน ร่วมกับแคลเซียมจะลดอุบัติการณ์ของกระดูกสะโพก และกระดูกที่ตำแหน่งอื่นนอกเหนือจากกระดูกสันหลัง (non-vertebral fracture) ได้ [31] นอกจากนี้มีการศึกษา meta-analysis ที่พบว่าการให้วิตามินดีขนาด 700 IU ต่อวัน ร่วมกับแคลเซียม 500 มิลลิกรัมต่อวัน สามารถลดการเกิดหกล้มในผู้สูงอายุได้[32]
ควรพิจารณาวิตามินดีชนิดดั้งเดิม (native หรือ inactive form) เป็นลำดับแรก ทั้งนี้เนื่องจากมีประสิทธิผลเทียบเท่ากับกับอนุพันธ์ของวิตามินดี (analogs) หรือวิตามินดีชนิดพร้อมออกฤทธิ์ (active form) สำหรับในผู้ที่มีภาวะขาดวิตามินดี (vitamin D deficiency) (ในที่นี้หมายถึงระดับ 25(OH)D < 10 ng/ml) หรือมีภาวะพร่องวิตามินดี (vitamin D insufficiency) (ในที่นี้หมายถึงระดับ 25(OH)D < 30 ng/ml) และเป็นผู้สูงอายุที่มีอายุตั้งแต่ 65 ปีขึ้นไป การสร้าง 1,25(OH)2D ซึ่งเป็นวิตามินที่พร้อมออกฤทธิ์จากการรับแสงแดดหรือจากไตจะมีประสิทธิภาพไม่เพียงพอ อาจจะพิจารณาให้เป็น อนุพันธ์ของวิตามินดีแทนได้ เช่น alfacalcidol ในขนาดไม่เกินวันละ 1 ไมโครกรัม หรือ calcitriol ในขนาดไม่เกินวันละ 0.5 ไมโครกรัม ทั้งนี้ต้องตรวจวัดระดับแคลเซียมในเลือดและปัสสาวะ เนื่องจากมีความเสี่ยงของการเกิดภาวะแคลเซียมสูงในเลือด (hypercalcemia) และภาวะแคลเซียมสูงในปัสสาวะ (hypercalciuria) โดยแนะนาให้ตรวจภายใน 1-3 เดือนหลังการรักษา
ตารางแสดงปริมาณวิตามินดีในอาหารประเภทต่าง ๆ
1.3 การปรับเปลี่ยนพฤติกรรมที่เสี่ยงต่อการเป็นโรคกระดูกพรุน
การลดเลิกพฤติกรรมเสี่ยงต่อโรคกระดูกพรุนต่างๆ โดยพยายามปฏิบัติตัวดังต่อไปนี้
- งดสูบบุหรี่
จากการศึกษา Meta-analysis พบว่าการสูบบุหรี่สัมพันธ์กับการลดลงของมวลกระดูก (BMD) และเพิ่มอัตราของการเกิดกระดูกหัก [33,34]
- •ไม่ดื่มสุราเกินขนาด
จากการศึกษาพบว่าการดื่มสุราเกินขนาดจะไปมีผลยับยังความแข็งแรงของกระดูก[35] แต่มีบางการศึกษากลับพบว่าการดื่มสุราในประมาณที่พอดีจะทำให้เพิ่มระดับมวลกระดูกที่สูงขึ้นได้ [36,37] แต่อย่างไรก็ตามก็ไม่ควรที่จะแนะนำให้ดื่มสุราเพื่อผลในการเพิ่มมวลกระดูก
- งดดื่มกาแฟหรือเครื่องดื่มที่มีส่วนผสมของคาเฟอีน
- หลีกเลี่ยงอาหารเค็มจัดและมีโปรตีนสูง
- ปรับวิถีชีวิตให้มีกิจกรรมการเคลื่อนไหวทางกาย (physical activities)
- ควบคุมโรคเรื้อรังที่เป็นปัจจัยเสี่ยงต่อโรคกระดูกพรุน
- ระมัดระวังการใช้ยาที่เป็นปัจจัยเสี่ยงต่อโรคกระดูกพรุน
เช่น ยาในกลุ่ม Glucocorticoids และ Anticonvulsants
1.4 การออกกำลังกาย
การออกกำลังกายควรจะแนะนำสาหรับผู้ป่วยที่เป็นโรคกระดูกพรุน เนื่องจากมีหลักฐานที่แสดงให้เห็นว่าการออกกำลังกายช่วยลดการสูญเสียมวลกระดูก
การออกกำลังกายยังช่วยทำให้สุขภาพโดยทั่วไปแข็งแรง เพิ่มความแข็งแกร่งของกล้ามเนื้อ ช่วยการทรงตัว และลดความเสี่ยงของการเกิดกระดูกหัก อย่างไรก็ตามหลักฐานปรากฏเด่นชัดในผู้หญิงทั้งวัยก่อนและหลังหมดประจาเดือน ในขณะที่ในผู้ชายยังมีหลักฐานไม่ชัดเจน[38,39] การออกกำลังกายชนิดที่มีการแบกรับน้ำหนักที่เหมาะสม (appropriate weight-bearing exercise), high impact aerobic exercise และการออกกำลังที่ออกแรงต้าน (resistance exercise) จะช่วยเพิ่มความหนาแน่นของกระดูกในผู้หญิงได้[40,41,42] การออกกำลังกายที่ได้ประโยชน์ในโรคกระดูกพรุนมีดังต่อไปนี้
การออกกำลังต้านแรง โดยการยกน้ำหนัก (ได้แก่ การยก dumbbell การใส่น้ำหนักในเข็มขัดหรือในสนับข้อเท้า เป็นต้น) การบริหารร่างกายกับเครื่องยกน้ำหนักควรออกกำลังกายที่ความเข้มร้อยละ 70-80 ของขนาดสูงสุดของการเต้นของหัวใจ แต่ละชุดของการออกกำลังกายควรยกน้ำหนักขึ้นลง 10-15 ครั้งโดยใช้น้ำหนักขาดต่ำหรือปานกลางที่สามารถยกขึ้นได้
การเดินหรือเต้นออกกำลังกายชนิดแอโรบิก ไม่ว่าจะเป็นการเต้น การเดินขึ้นลงขั้นบันได การเดินเร็ว การวิ่ง การกระโดด การเดินย้ำเท้าอยู่กับที่ การเต้นรำที่ความเข้มร้อยละ 50-70 ของขนาดสูงสุดของการเต้นของหัวใจ
ควรออกกำลังบริหารร่างกายสัปดาห์ละ 2-3 ครั้ง แต่ละครั้งใช้เวลา 50-60 นาที (10 นาทีอบอุ่นร่างกาย 20 นาทีสำหรับเดินหรือเต้นออกกำลังกาย 15 นาทีสำหรับยกน้ำหนักและ 10 นาทีสำหรับการยืดและคลายกล้ามเนื้อ
ข้อควรระวังในการแนะนำผู้ป่วยที่เป็นโรคกระดูกพรุนออกกำลังกาย ผู้ป่วยเหล่านี้ควรได้รับการตรวจสภาพความแข็งแรงของร่างกาย และควรแนะนำการออกกาลังกายที่เหมาะสมกับสภาพร่างกายของผู้ป่วยแต่ละราย การออกกาลังกายร่วมกับการได้รับฮอร์โมนและ/หรือได้รับแคลเซียมเสริมพบว่ามีการเพิ่มของมวลกระดูกมากกว่าการออกกาลังกายอย่างเดียว
1.5 การป้องกันการหกล้ม
- ผู้สูงอายุทุกรายควรได้รับการประเมินความเสี่ยงต่อการหกล้ม โดยซักประวัติการหกล้มใน 1 ปีที่ผ่านมา ความถี่ของการหกล้ม ลักษณะของการหกล้ม
- ผู้สูงอายุที่หกล้มจะต้องได้รับการประเมิน/ตรวจ ท่าเดิน การทรงตัวของร่างกาย รวมทั้งหาสาเหตุของความผิดปกติ
- ผู้สูงอายุที่หกล้มจนเกิดกระดูกหักจะต้องหาสาเหตุของการหกล้ม ประเมินความเสี่ยงของการเกิดกระดูกหักในอนาคต แก้ไขและให้การรักษาสาเหตุ และควรมีโปรแกมสำหรับป้องกันการหกล้ม
2. การรักษาโดยการใช้ยา (pharmacologic treatment)
ในประเทศสหรัฐอเมริกา โดยองค์การอาหารและยา The Food and Drug Administration (FDA) ได้มีการศึกษาเรื่องแนวทางในการใช้ยาเพื่อใช้ป้องกันและรักษาโรคกระดูกพรุน โดยทำการศึกษาวิจัยออกมาเพื่อให้สนับสนุนแนวทางดังกล่าว
โดยการศึกษาเกี่ยวกับการใช้ยาในการป้องกันโรคกระดูกพรุนในผู้หญิงวัยหมดประจำเดือน โดยใช้กลุ่มการทดลองเป็นผู้หญิงที่สามารถช่วยเหลือตัวเองได้ มีภาวะขาดประจำเดือนมา 1 – 2 ปี อายุตั่งแต่ 45 ปีขึ้นไป และยังไม่มีภาวะกระดูกพรุนหรือถูกตัดรังไข่ออกไปโดยที่ตรวจพบมีฮอร์โมน FSH สูงและฮอร์โมน Estradiol ต่ำ โดยศึกษาติดตามไป 2 ปี แบบ Randomized , Double-blind ใช้กลุ่มควบคุมและกลุ่มที่ใช้ยา ผลการศึกษาพบว่ากลุ่มที่ใช้ยาป้องกัน พบมีการลดการหักของกระดูกลงได้และยังมีการเพิ่มขึ้นของมวลกระดูก BMD อย่างมีนัยสำคัญ [43]
ปัจจุบันมียาที่ได้รับการรับรองว่ามีประสิทธิภาพในการป้องกันโรคกระดูกพรุนและใช้กันอย่างแพร่หลายแล้ว โดยองค์กรอาหารและยาของสหัฐอเมริกา The Food and Drug Administration (FDA) ดังตาราง
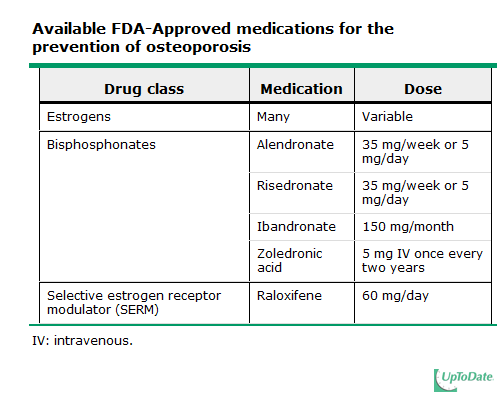
โดยปกติแล้วหญิงที่อยู่ในช่วงหมดประจำเดือนทุกรายไม่จำเป็นต้องใช้ยาในการป้องกันโรคกระดูกพรุน แต่จะใช้ป้องกันเฉพาะรายที่มีข้อบ่งชี้เท่านั้น สำหรับการรักษาผู้ป่วยโรคกระดูกพรุนโดยการใช้ยาจะต้องทำควบคู่ไปกับการรักษาโดยไม่ใช้ยาเสมอ โดยมีข้อบ่งชี้ในการพิจารณาใช้ยาดังนี้
ข้อบ่งชี้หลัก
สำหรับผู้หญิงวัยหมดประจำเดือนและผู้ชายที่มีอายุตั้งแต่ 50 ปีขึ้นไป ต้องให้การรักษาโรคกระดูกพรุน เมื่อมีข้อบ่งชี้ข้อใดข้อหนึ่งหรือทั้ง 2 ข้อดังนี้
- มีกระดูกสันหลังหัก หรือกระดูกสะโพกหัก อันเนื่องมาจากภยันตรายที่ไม่รุนแรง
- ตรวจความหนาแน่นของกระดูกด้วยเครื่อง axial DXA (central DXA) ที่ lumbar spine BMD
หรือ femoral neck BMD หรือ total hip BMD แล้วพบว่ามี T-score ≤ -2.5
2.1 Bisphosphonates
เป็น antiresorptive agent ที่มีประสิทธิภาพสูงลดการสร้าง การทำงานของ osteoclast และเร่งให้มีการทำลายตนเอง (apoptosis) ของ osteoclast [44]
โดยส่วนใหญ่แล้วยาในกลุ่ม Bisphosphonates จะเป็นชนิดรับประทาน ซึ่งจะได้รับประทานให้ถูกวิธีจึงจะเกิดประสิทธิภาพสูงสุด คือ
- ต้องรับประทานด้วยน้ำเปล่าเท่านั้น
- ต้องรับประทานตอนเช้าช่วงที่ท้องว่าง หลังจากที่ไม่ได้ทานทั้งอาหาร น้ำดื่มหรือยามาทั้งคืน
- ต้องไม่รีบรับประทานอาหารตามหลังจากรับประทานยา โดยทิ้งช่วงห่างประมาณ 1.5 ชั่วโมงในยา alendronate, risedronate และประมาณ 1 ชั่วโมงในยา ibandronate
โดยปกติแล้วการดูดซึมยาจะทำได้ประมาณ 1% ของขนาดที่รับประทานเข้าไป และถูกรบกวนการดูดซึมยาได้ง่ายจากอาหารที่รับประทานเข้าไป[45] เช่น
- ดื่มน้ำชนิดอื่นที่ไม่ใช่น้ำเป่าตาม เช่น น้ำแร่ กาแฟ น้ำผลไม้
- การที่ยังมีอาหารคงค้างอยู่ในกระเพาะอาหาร เช่น ระยะเวลาในการงดน้ำงดอาหารไม่เพียงพอ การทำงานของระบบกระเพาะอาหารบกพร่องในการบีบตัว (gastroparesis)
- การที่รับประทานอาหารตามหลังจากการรับประทานยาเร็วเกินไป
ผลข้างเคียงของยาชนิดรับประทานส่วนมากจะทำให้เกิดการระคายเคืองต่อหลอดอาหาร (esophageal irritation , gastro-esophageal reflux) จึงแนะนำให้หลังจากรับประทานยาแล้วให้อยู่ในท่านั่งหรือท่ายืนไปก่อนจนกว่าจะมีการแตกตัวของยา ปัจจุบันมีการศึกษาว่าการลดความถี่ของการรับประทานยาหรือเปลี่ยนไปใช้ชนิดฉีดแทนจะช่วยลดปัญหาผลข้างเคียงดังกล่าวได้ [46]
ส่วนชนิดยาฉีดจะมีผลข้างเคียง เช่น ไข้ หวัด น้ำหมูก ปวดศรีษะ ปวดตามข้อ และปวดตามกล้ามเนื้อทั่วร่างกาย
ยากลุ่ม bisphosphonates จัดเป็นยาลำดับแรกในการรักษาและมีแนวทางการใช้ยาดังนี้
• Alendronate
ปัจจุบันพบว่า Alendronate มีประสิทธิภาพในการใช้ทั้งป้องกันและการรักษาโรคกระดูกพรุนในผู้หญิงวัยหมดประจำเดือน โดยพบว่าขนาดของยาที่ใช้ในการป้องกันโรคกระดูกพรุนจะเป็นแค่ครึ่งหนึ่งของขนาดยาที่ใช้ในการรักษา โดยขนาดที่แนะนำคือ 5 มิลลิกรัมต่อวันหรือ 35 มิลลิกรัมต่อสัปดาห์ (5 mg/day or 35 mg/week)
จากการศึกษาแบบ randomized,double-blind ในผู้หญิง 447 คน ที่มีภาวะหมดประจำเดือนมาแล้ว 6 – 36 เดือน ให้ได้รับ Alendronate ขนาด 5 , 10 และ 20 มิลลิกรัมต่อวัน เป็นเวลา 3 ปี พบว่ามีการเพิ่มขึ้นของความหนาแน่นของมวลกระดูกที่บริเวรกระดูกสันกลังส่วนเอว (lumbar spine) กระดูกท่อนขาส่วนบน (femoral neck, and trochanter) 1 – 4 เปอร์เซ็นต์ สอดคล้องกับอีกการศึกษาหนึ่งที่เป็นแบบ Randomized ก็พบการการให้ Alendonate ขนาด 5 มิลลิกรัมต่อวัน ในหญิงวัยหมดประจำเดือนเป็นเวลา 2 ปี ที่อายุต่ำกว่า 60 ปี มีความหนาแน่นของมวลกระดูกเพิ่มขึ้นที่บริเวณกระดูสันหลังส่วนเอว (lumbar spine) 3.5 เปอร์เซ็นต์ และที่บริเวณกระดูกสะโพก (hip bone) 1.9 เปอร์เซ็นต์ [47-51]
• Risedronate
พบว่ามีประสิทธิภาพในการเพิ่มความหนาแน่นของกระดูก ลดความเสี่ยงของการเกิดกระดูกหักในผู้หญิงวัยหมดประจำเดือนได้
จากการศึกษาพบว่าการให้ Risedronate 5 มิลลิกรัมต่อวัน เป็นเวลา 2 ปี ในผู้หญิงวัยหมดประจำเดือนที่มีความหนาแน่นของมวลกระดูกปกติ พบว่ามีการเพิ่มขึ้นของความหนาแน่นของมวลกระดูกบริเวณสันหลัง (lumbar) 1.4 เปอร์เซ็นต์ ส่วนกลุ่มที่ควบคุมพบมีการลดลงของความหนาแน่นของมวลกระดูก 4.3 เปอร์เซ็นต์ [52,53]
โดยขนาดที่แนะนำคือ 5 มิลลิกรัมต่อวันหรือ 35 มิลลิกรัมต่อสัปดาห์ (5 mg/day or 35 mg/week)
• Ibandronate
ชนิดรับประทานวันละครั้ง จะเพิ่มความหนาแน่นของกระดูกลดความเสี่ยงของการเกิดกระดูกหักที่กระดูกสันหลัง ส่วนผลในการลดการหักของกระดูกตำแหน่งอื่นนอกเหนือจากกระดูกสันหลัง มีหลักฐานว่าได้ผลในผู้ที่ความหนาแน่นของกระดูกคอสะโพก T-score ต่ำกว่า -3.0 การให้ชนิดรับประทานเดือนละครั้งและชนิดฉีดทุก 3 เดือน เพิ่มความหนาแน่นของกระดูกได้เช่นเดียวกับชนิดรับประทานวันละครั้ง และช่วยให้ผู้ป่วยมีความสม่ำเสมอในการรักษามากยิ่งขึ้น[54]
โดยขนาดที่แนะนำคือ 150 มิลลิกรัมต่อเดือน (150 mg/month)
• Zoledroic acid
ชนิดฉีดเข้าหลอดเลือดดำปีละครั้ง จะเพิ่มความหนาแน่นของกระดูก ลดความเสี่ยงของการเกิดกระดูกหักที่กระดูกสันหลัง กระดูกสะโพก และกระดูกตำแหน่งอื่นนอกเหนือจากกระดูกสันหลังในผู้หญิงวัยหมดประจาเดือนที่เป็นโรคกระดูกพรุน รวมทั้งลดอัตราตายในผู้ป่วยที่เกิดกระดูกสะโพกหักที่ได้รับการผ่าตัด[55]
โดยขนาดที่แนะนำคือ 5 มิลลิกรัมทางหลอดเลือดดำทุก ๆ 2 ปี (5 mg intravenously [IV] once every two years)
2.2 Selective estrogen receptor modulators ( SERM )
• Raloxifene
ปัจจุบัน Raloxifene เป็นตัวเดียวในกลุ่มนี้ที่แนะนำให้ใช้ในการป้องกันโรคกระดูกพรุนในผู้หญิงวัยหมดประจำเดือน โดยสามารถช่วยป้องกันการสูญเสียมวลกระดูก และลดความเสี่ยงของการเกิดกระดูกสันหลังหัก[56,57] ส่วนผลข้างเคียงอื่น ๆ จะช่วยลดความเสี่ยงการเกิดมะเร็งเต้านมแต่จะเพิ่มความเสี่ยงในการเกิดโรคหลอดเลือดอุดตัน ( thromboembolic events ) และภาวะร้อนวูบวาบ (hot flashes) แต่ไม่มีผลต่อโรคหัวใจและเยื่อบุโพรงมดลูก
2.3 ฮอร์โมนทดแทน (hormone replacement therapy)
• Estrogen
ฮอร์โมนทดแทนเป็นทางเลือกหนึ่งในการรักษาโรคกระดูกพรุนในวัยหมดประจำเดือน ซึ่งมีการสูญเสียมวลกระดูกอย่างรวดเร็วอันเนื่องมาจากการขาดเอสโตรเจน และเมื่อพิจารณาแล้วว่าประโยชน์มากกว่าความเสี่ยง รวมทั้งพิจารณาถึงความเหมาะสม และอาการข้างเคียงถ้าเลือกใช้ยาอื่นๆ
การรักษาด้วยเอสโตรเจน(estrogen therapy,ET) หรือฮอร์โมนทดแทน (hormone [replacement]therapy,H[R]T) ในการรักษาผู้หญิงวับหมดประจำเดือนได้รับการรับรองให้ใช้ในรายที่จำเป็นต้องรักษาอาการหมดประจำเดือนด้วยเช่น ร้อนวูบวาบ อารช่องคลอดแห้ง และใช้เพื่อป้องกันภาวะกระดูกพรุน การใช้ฮอร์โมนเอสโตรเจนในคนที่ยังได้ได้ตัดมดลูก จะต้องมีฮอร์โมนโปรเจสตินร่วมด้วยเพื่อป้องกันภาวะเยื่อบุมดลูกหนาตัว
จากการแนะนำของ Women’s Health Initiative (WHI) พบว่าการรับประทานฮอร์โมนเอสโตรเจน (conjugated equine estrogens (CEE)) ขนาด 0.625 มิลลิกรัมต่อวัน (0.625 mg/day) โดยอาจจะมีส่วนผสมของฮอร์โมนโปรเจสเตอร์โรน (medroxyprogesterone acetate (MPA))ร่วมด้วยหรือไม่ก็ได้ สามารถลดความเสี่ยงของการเกิดกระดูกหักที่กระดูกสันหลัง กระดูกสะโพก และกระดูกตำแหน่งอื่นนอกเหนือจากกระดูกสันหลังในหญิงวัยหมดประจำเดือนได้[58,59] และการศึกษานี้ได้รายงานผลการใช้ฮอร์โมนเอสโตรเจน conjugated equine estrogen (CEE) ร่วมกับ medroxy progesterone acetate (MPA) เป็นเวลา 5 ปี พบว่าสามรถลดอุบัติการณ์ของการหักของกระดูกสันหลังและกระดูกสะโพกที่มีอาการทางคลินิกลงได้ 34% และลดการหักของกระดูกอื่น ๆ ได้ 23%
Women’s Health Initiative (WHI) ได้รายงานถึงผลเสียของการใช้ฮอร์โมนทดแทนว่าทำให้มีความเสี่ยงในการวินิจฉัยโรคมะเร็งเต้านมเพิ่มขึ้น และทำให้เกิดหลอดเลือดดำอุดตันและโรคหลอดเลือดหัวใจเพิ่มขึ้น หลังจากนั้นได้มีการวิเคราะห์ข้อมูลเดิมของ WHI ขึ้นมาใหม่กลับพบว่า การใช้ฮอร์โมนทดแทนชนิดรวม (CEE ร่วมกับ MPA) ในผู้หญิงวัยหมดประจำเดือนน้อยกว่า 10 ปี จะลดความเสี่ยงในการเกิดโรคหลอดเลือดหัวใจ และถ้าเป็นการใช้เอสโตรเจนชนิดเดียวติดต่อกันเป็นเวลา 7.1 ปี กลับพบว่าความเสี่ยงของการเกิดมะเร็งเต้านมน้อยกว่าผู้ที่ไม่ได้ใช้ฮอร์โมน
ในปัจจุบันยังไม่แนะนำให้ใช้ฮอร์โมนเอสโตรเจน (Estrogen) เป็นยาตัวแรกในการรักษา แต่ให้ใช้เพื่อป้องกันโรคกระดูกพรุนในสตรีวัยหมดประจำเดือนเฉพาะที่มีความเสี่ยงในการเกิดผลข้างเคียงของยากลุ่มอื่นเท่านั้น
อาจพิจารณาให้ฮอร์โมนทดแทนเป็นลำดับแรกเพื่อป้องกันโรคกระดูกพรุน หรือลดความเสี่ยงต่อกระดูกหักในผู้ที่มีคุณลักษณะดังนี้[60-62]
- ผู้ที่หมดประจำเดือนก่อนกำหนด (premature ovarian failure หรือ premature menopause หมายถึง หมดประจำเดือนก่อนอายุ 40 ปี)
- ผู้ที่ได้รับการตัดรังไข่ทั้งสองข้าง (bilateral oophorectomy) ก่อนเข้าสู่วัยหมดประจาเดือน โดยเฉพาะอย่างยิ่งในผู้ที่ได้รับการผ่าตัดก่อนอายุ 45 ปี
- มีภาวะฮอร์โมนเอสโตรเจนต่ำ (hypoestrogenic state) ตั้งแต่เยาว์วัย หรือก่อนเข้าสู่วัยหมดประจำเดือน และยังไม่ได้รับการแก้ไขอย่างเหมาะสม เช่น gonadal dysgenesis, ออกกำลังกายมากเกินควร (intense exercise) ได้รับยากดการทำงานของรังไข่เป็นระยะเวลานาน เช่น GnRH agonist หรือ antagonist
ควรใช้ฮอร์โมนทดแทนโดยพิจารณาถึงข้อบ่งชี้ในผู้หญิงวัยหมดประจาเดือนที่อายุต่ำกว่า 60 ปี ที่ไม่ปรากฏข้อห้ามต่อการใช้ฮอร์โมนเพศ เนื่องจากความเสี่ยงที่พบจากการศึกษาของ WHI นั้นมักพบในผู้หญิงที่มีอายุเกินกว่า 60 ปี
ถึงแม้จะยังไม่มีหลักฐานสนับสนุนที่ชัดเจน แต่การให้ฮอร์โมนทดแทนในผู้หญิงที่หมดประจาเดือนก่อนกำหนด (premature ovarian failure หรือ premature menopause การหมดประจำเดือนก่อนอายุ 40 ปี) น่าจะมีประโยชน์มากกว่าความเสี่ยง โดยเฉพาะประโยชน์จากการป้องกันโรคกระดูกพรุนและการเกิดโรคหลอดเลือดโคโรนารี่
การหยุดฮอร์โมนจะทำให้เกิดการเสียมวลกระดูกปีละ 3-6% มีข้อมูลยืนยังว่าหลังจากหยุดใช้ฮอร์โมนประโยชน์ในการลดความเสี่ยงของการเกิดกระดูกหักจะหมดไปอย่างรวดเร็ว (catch-up phenomenon) และอุบัติการณ์ของกระดูกหักจะเพิ่มขึ้นจนเท่ากับคนที่ไม่ได้ใช้ฮอร์โมนภายในระยะเวลาหนึ่งปีหยังหยุดใช้ฮอร์โมน[63]
สำหรับระยะเวลาการให้ฮอร์โมนทดแทนเพื่อรักษาโรคกระดูกพรุนว่าควรให้นานเท่าใด ควรพิจารณาร่วมกับผู้รับการรักษา ถึงประโยชน์และความเสี่ยงที่อาจเกิดขึ้นเป็นรายๆ ไป
เอกสารอ้างอิง
- National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis, 2008 http://www.nof.org/sites/default/files/pdfs/NOF_Clinicians_Guide2008.pdf (Accessed on June 17, 2009).
- Riggs BL, Melton LJ, 3rd. Involutional osteoporosis. N Engl J Med. 1986 Jun 26;314:1676-86.
- Limpaphayom KK, Taechakraichana N, Jaisamrarn U, Bunyavejchevin S, Chaikittisilpa S, Poshyachinda M, et al. Prevalence of osteopenia and osteoporosis in Thai women. Menopause 2001;8:65-9.
- Pongchaiyakul C, Apinyanurag C, Soontrapa S, Sonntrapa S, Pongchaiyakul C, Nguyen TV, Rajatanavin R. Prevalence of osteoporosis in Thai men. J Med Assoc Thai 2006;89:160-9.
- Heaney RP,Arams S, Daws on – Hughes B, peak bone mass. Osteoporosis lnt 2000;11:985-1009
- Consensus development panel of NIH.Osteoporosis prevention, deahnosis and therapy. NIH consensus Statement 2000 March 27-29;17 (1):1-36
- Rodin A, Murby B, Smith MA, Caleffi M,et al.
- Lindsay R. Estrogen deficiency. In Rigg Bl and Melton III LJ(eds). Osteoporosis: etiology, diagnosis and management. 2 nd eds. Lippincott-Raven Publishers 1995, Philadelphia.
- Heaney RP, Abrams S, Dawson-Hughes B, et al. Peak bone mass. Osteoporos Int 2000; 11:985
- Pocock NA, Eisman JA, Hopper JL, et al. Genetic determinants of bone mass in adults. A twin study. J Clin Invest 1987; 80:706.
- Hawker GA, Jamal SA, Ridout R, Chase C. A clinical prediction rule to identify premenopausal women with low bone mass. Osteoporos Int 2002; 13:400.
- Lorentzon M, Mellström D, Haug E, Ohlsson C. Smoking is associated with lower bone mineral density and reduced cortical thickness in young men. J Clin Endocrinol Metab 2007; 92:497.
- Dent, CE. Keynote address: Problems in metabolic bone disease. Proceedings of the International Symposium on Clinical Aspects of Metabolic Bone Disease 1973; 1-7.
- Lane JIM,Russel L,Khan SN:osteoporosis. Clin Orthop 372:139-150,2000
- World Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. No. 843 of technical reports series. Geneva, 1994
- Kanis JA, Melton LJ 3rd, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res 1994;9:1137-41
- Ryan PJ. Overview of the role of BMD measurements in managing osteoporosis. Semin Nucl Med 1997;27:197-209.
- Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996;312:1254-9.
- Hans D, Dargent-Molina P, Schott AM, Sebert JL, Cormier C, Kotzki PO, et al. Ultrasonographic heel measurements to predict hip fracture in elderly women: the EPIDOS prospective study. Lancet 1996;348:511-4.
- Frost ML, Blake GM, Fogelman I. A comparison of fracture discrimination using calcaneal quantitative ultrasound and dual X-ray absorptiometry in women with a history of fracture at sites other than the spine and hip. Calcif Tissue Int 2002;71:207-11.
- Pongchaiyakul C, Panichkul S, Songpatanasilp T, Nguyen TV. A nomogram for predicting osteoporosis risk based on age, weight and quantitative ultrasound measurement. Osteoporos Int 2007;18:525-31.
- Nugaram R, Atmaca A, Kleerekoper M. Evaluation of the patient with osteoporosis or at risk for osteoporosis. In: Marcus R, Feldman D, Nelson DA, Rosen CJ, editors. Osteoporosis. 3rd ed. Sandiego: Elsevier Academic Press; 2008. p. 1437-47
- Johnston CC Jr, Miller JZ, Slemenda CW, et al. Calcium supplementation and increases in bone mineral density in children. N Engl J Med 1992; 327:82.
- Institute of Medicine. Report at a Glance, Report Brief: Dietary Reference Intakes for Calcium and Vitamin D, released 11/30/2010. http://www.iom.edu/Reports/2010/Dietary-Reference-Intakes-for-Calcium-and-Vitamin-D/Report-Brief.aspx (Accessed on December 01, 2010).
- Looker AC, Loria CM, Carroll MD, et al. Calcium intakes of Mexican Americans, Cubans, Puerto Ricans, non-Hispanic whites, and non-Hispanic blacks in the United States. J Am Diet Assoc 1993; 93:1274.
- Looker AC, Harris TB, Madans JH, Sempos CT. Dietary calcium and hip fracture risk: the NHANES I Epidemiologic Follow-Up Study. Osteoporos Int 1993; 3:177.
- Looker AC. Interaction of science, consumer practices and policy: calcium and bone health as a case study. J Nutr 2003; 133:1987S.
- Zamora SA, Rizzoli R, Belli DC, et al. Vitamin D supplementation during infancy is associated with higher bone mineral mass in prepubertal girls. J Clin Endocrinol Metab 1999; 84:4541.
- Bischoff-Ferrari HA, Dawson-Hughes B, Willett WC, Staehelin HB, Bazemore MG, Zee RY, Wong JB. Effect of vitamin D on falls: A Meta-analysis. JAMA 2004;291:1999-2006.
- Institute of Medicine FaNB. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, DC: National Academy Press. 1997.
- Bischoff-Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson-Hughes B. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005;293:2257-64.
- Bischoff-Ferrari HA, Orav EJ, Dawson-Hughes B. Effect of cholecalciferol plus calcium on falling in ambulatory older men and women: a 3-year randomized controlled trial. Arch Intern Med 2006;166:424-30.
- Ward KD, Klesges RC. A meta-analysis of the effects of cigarette smoking on bone mineral density. Calcif Tissue Int 2001; 68:259.
- Kanis JA, Johnell O, Oden A, et al. Smoking and fracture risk: a meta-analysis. Osteoporos Int 2005; 16:155.
- Kanis JA, Johnell O, Oden A, et al. Smoking and fracture risk: a meta-analysis. Osteoporos Int 2005; 16:155. Kanis JA, Johansson H, Johnell O, et al. Alcohol intake as a risk factor for fracture. Osteoporos Int 2005; 16:737.
- Sampson HW. Alcohol and other factors affecting osteoporosis risk in women. Alcohol Res Health 2002; 26:292.
- Felson DT, Zhang Y, Hannan MT, et al. Alcohol intake and bone mineral density in elderly men and women. The Framingham Study. Am J Epidemiol 1995; 142:485.
- Bonaiuti D, Shea B, Iovine R, Negrini S, Robinson V, Kemper HC, et al. Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Database Syst Rev. 2002(3):CD000333.
- Huuskonen J, Vaisanen SB, Kroger H, Jurvelin JS, Alhava E, Rauramaa R. Regular physical exercise and bone mineral density: a four-year controlled randomized trial in middle-aged men. The DNASCO study. Osteoporos Int 2001;12:349-55.
- Englund U, Littbrand H, Sondell A, Pettersson U, Bucht G. A 1-year combined weight-bearing training program is beneficial for bone mineral density and neuromuscular function in older women. Osteoporos Int 2005;16:1117-23.
- Judge JO, Kleppinger A, Kenny A, Smith JA, Biskup B, Marcella G. Homebased resistance training improves femoral bone mineral density in women on hormone therapy. Osteoporos Int 2005;16:1096-108.
- Nichols DL, Sanborn CF, Love AM. Resistance training and bone mineral density in adolescent females. J Pediatr 2001;139:494-500.
- FDA Division of Metabolic and Endocrine Drug Products. Guidelines for preclinical and clinical evaluation of agents used in the prevention or treatment of postmenopausal osteoporosis, April 1994. http://www.fda.gov/downloads/ScienceResearch/SpecialTopics/WomensHealthResearch/UCM131206.pdf (Accessed on November 03, 2011).
- Luckman SP,Hughes DE,Coxon FP,et al: Nitrogen – containing bisphosphonates inhibit the mevlonate pathway and prevent post – translational prenylation, of GTP binding proteins, including Ras. J Bone Mineer Res 13:581-589,1998
- Felson DT, Zhang Y, Hannan MT, et al. Alcohol intake and bone mineral density in elderly men and women. The Framingham Study. Am J Epidemiol 1995; 142:485.
- Simon JA, Lewiecki EM, Smith ME, et al. Patient preference for once-weekly alendronate 70 mg versus once-daily alendronate 10 mg: a multicenter, randomized, open-label, crossover study. Clin Ther 2002; 24:1871.
- McClung M, Clemmesen B, Daifotis A, et al. Alendronate prevents postmenopausal bone loss in women without osteoporosis. A double-blind, randomized, controlled trial. Alendronate Osteoporosis Prevention Study Group. Ann Intern Med 1998; 128:253.
- Ravn P, Weiss SR, Rodriguez-Portales JA, et al. Alendronate in early postmenopausal women: effects on bone mass during long-term treatment and after withdrawal. Alendronate Osteoporosis Prevention Study Group. J Clin Endocrinol Metab 2000; 85:1492.
- Hosking D, Chilvers CE, Christiansen C, et al. Prevention of bone loss with alendronate in postmenopausal women under 60 years of age. Early Postmenopausal Intervention Cohort Study Group. N Engl J Med 1998; 338:485.
- Ravn P, Bidstrup M, Wasnich RD, et al. Alendronate and estrogen-progestin in the long-term prevention of bone loss: four-year results from the early postmenopausal intervention cohort study. A randomized, controlled trial. Ann Intern Med 1999; 131:935.
- McClung MR, Wasnich RD, Hosking DJ, et al. Prevention of postmenopausal bone loss: six-year results from the Early Postmenopausal Intervention Cohort Study. J Clin Endocrinol Metab 2004; 89:4879.
- Mortensen L, Charles P, Bekker PJ, et al. Risedronate increases bone mass in an early postmenopausal population: two years of treatment plus one year of follow-up. J Clin Endocrinol Metab 1998; 83:396.
- Fogelman I, Ribot C, Smith R, et al. Risedronate reverses bone loss in postmenopausal women with low bone mass: results from a multinational, double-blind, placebo-controlled trial. BMD-MN Study Group. J Clin Endocrinol Metab 2000; 85:1895.
- McClung MR, Wasnich RD, Recker R, et al. Oral daily ibandronate prevents bone loss in early postmenopausal women without osteoporosis. J Bone Miner Res 2004; 19:11.
- Biennial [corrected] IV zoledronic acid (Reclast) for prevention of osteoporosis. Med Lett Drugs Ther 2009; 51:49.
- Gertz BJ, Holland SD, Kline WF, et al. Studies of the oral bioavailability of alendronate. Clin Pharmacol Ther 1995; 58:288.
- Baker DE. Alendronate and risedronate: what you need to know about their upper gastrointestinal tract toxicity. Rev Gastroenterol Disord 2002; 2:20.
- Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288:321.
- Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291:1701.
- Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et al. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women’s Health Initiative randomized controlled trial. JAMA 2004;291:1701-12.
- Position Statement by the North American Menopause Society. Estrogen and progestogen use in postmenopausal women: July 2008 position statement of The North American Menopause Society. Menopause 2008;15:584-602.
- FDA News Release. FDA updates hormone therapy information for postmenopausal women. February 10, 2004. Available at: http://www.fda.gov/bbs/topics/NEWS/2004/NEW1022.html. Accessed August 5, 2010.
- Tremollieres FA, Pouilles JM, Ribot C. Withdrawal of hormone replacement therapy is associated with significant vertebral bone loss in postmenopausal women. Osteoporosis Int 2001;12;385-901.