Ovulation Induction Drugs for Anovulatory Patients
Ovulation Induction Drugs for Anovulatory Patients
พญ.ปิยธิดา ภุมรา
อาจารย์ที่ปรึกษา อ.พญ.อุษณีย์ แสนหมี่
บทนำ
ภาวะความผิดปกติเกี่ยวกับการตกไข่พบได้ 18-25% ในคู่สมรสที่มาตรวจด้วยเรื่องภาวะมีบุตรยาก (1) ซึ่งมักจะมีปัญหาเรื่อง oligomenorrhea ร่วมด้วย ในหญิงกลุ่มนี้จึงมีโอกาสที่จะตั้งครรภ์ได้ด้วยตนเองค่อนข้างน้อย เนื่องจากไม่มีการตกไข่ ดังนั้นเป้าหมายในการรักษาภาวะเจริญพันธ์ในหญิงกลุ่มนี้ จึงอยู่ที่การพยายามให้มีการเจริญของฟอลลิเคิลเพียงหนึ่งใบ และทำให้มีการตั้งครรภ์และคลอดทารกหนึ่งคนที่แข็งแรงสมบูรณ์ ซึ่งจะแตกต่างกับการกระตุ้นไข่ในหญิงที่มีบุตรยากจากสาเหตุอื่นๆ นอกเหนือจากภาวะไม่ตกไข่
ชนิดของภาวะไม่ตกไข่ตามองค์การอนามัยโลก (WHO classification)
WHO class 1: Hypogonadotropic hypogonadal anovulation
เป็นภาวะที่เกิดจากไฮโปธาลามัสหลั่ง GnRH น้อยลงหรือต่อมใต้สมองไม่ตอบสนองต่อ GnRH พบได้ประมาณ 5-10% (2) ถ้าเจาะเลือดมาตรวจจะพบว่าระดับ gonadotropin และ estradiol ต่ำ สาเหตุนั้นอาจเกิดจากภาวะเครียด, การออกกำลังกายอย่างหนักติดต่อกันนานๆ, anorexia nervosa หรือมีภาวะพร่องฮอร์โมน GnRH ตั้งแต่เกิด เช่น Kallmann syndrome เป็นต้น จะเห็นได้ว่าพฤติกรรมบางอย่างก็อาจเป็นสาเหตุที่ทำให้เกิดภาวะไม่ตกไข่ และการขาดประจำเดือนได้ ดังนั้น การปรับเปลี่ยนพฤติกรรมจึงเป็นสิ่งที่ควรทำเป็นอันดับแรก ซึ่งจะสามารถทำให้เกิดการตกไข่ได้เอง โดยที่ไม่ต้องใช้ยาใด ๆ
WHO class 2: Normogonadotropic normoestrogenic anovulation
เป็นภาวะไม่ตกไข่ที่พบมากที่สุด ประมาณ 70-85% โดยสาเหตุที่สำคัญ ได้แก่ polycystic ovarian syndrome (PCOS) ตรวจระดับ FSH และ estrogen ในกระแสเลือดจะปกติ และพบ LH อยู่ในเกณฑ์ปกติหรือสูงกว่าปกติได้ (3) ในรายที่มีภาวะอ้วนร่วมกับ PCOS พบว่าการลดน้ำหนักจะทำให้ภาวะไม่ตกไข่ดีขึ้น ได้โดยไม่ต้องใช้ยากระตุ้น (4) นอกจากนี้ในรายที่มีบุตรยาก ก่อนการตั้งครรภ์ควรมีการตรวจคัดกรองภาวะเบาหวานไปด้วยเลย เพื่อลดภาวะแทรกซ้อนที่จะเกิดขึ้นระหว่างตั้งครรภ์ (5)
WHO class 3: Hypergonadotropic hypoestrogenic anovulation
พบประมาณ 5-10% สาเหตุเบื้องต้นเกิดจากภาวะรังไข่ล้มเหลว ได้แก่ Turner’s syndrome, primary ovarian insufficiency ถ้าเจาะเลือดมาตรวจจะพบระดับ gonadotropin สูงและ estradiol ต่ำ กลุ่มนี้มักจะไม่ตอบสนองต่อการรักษาด้วยการใช้ยากระตุ้นไข่ เนื่องจากความผิดปกตินั้นอยู่ที่รังไข่โดยตรง จำเป็นต้องอาศัยไข่บริจาคร่วมกับการทำเด็กหลอดแก้ว
การรักษาภาวะไม่ตกไข่ควรเริ่มจากการรักษาตามสาเหตุที่ตรวจพบ เช่น การปรับเปลี่ยนวิถีชีวิตประจำวัน ไม่อดอาหาร ไม่ออกกำลังหักโหม กรณี hyperprolactinemic anovulation ก็ควรรักษาด้วย dopamine agonist ก่อน ส่วนในรายที่รักษาตามสาเหตุแล้วไม่ได้ผล หรือตรวจไม่พบสาเหตุที่ชัดเจนจึงพิจารณารักษาด้วยยากระตุ้นไข่ โดยยาที่นิยมใช้ในปัจจุบันที่จะกล่าวในบทความนี้ ได้แก่ clomiphene citrate, aromatase inhibitor และ gonadotropin
Clomiphene citrate
Clomiphene citrate เป็นอนุพันธ์ของ Triphenylethylene ซึ่งมีโครงสร้างคล้าย estradiol มาก และชอบที่จะจับกับ estrogen receptor ยาถูกดูดซึมที่ทางเดินอาหาร ทำลายที่ตับ และขับออกทางอุจจาระ เมื่อยาเข้าสู่ร่างกายจะไปออกฤทธิ์โดยจับกับ estrogen receptors ที่ไฮโปธาลามัสทำให้ไม่เกิด negative feedback จาก estradiol ในร่างกาย (6) จึงกระตุ้นให้ไฮโปธาลามัสหลั่ง GnRH มากขึ้น กระตุ้นต่อมใต้สมองให้หลั่ง FSH และ LH มากขึ้น ไปกระตุ้นรังไข่ให้สร้างฟอลลิเคิล
ข้อบ่งชี้ในการใช้ยา (7)
- Normogonadotropic normoestrogenic anovulation (WHO class 2) เช่น ในรายที่เป็น PCOS ถือเป็นข้อบ่งชี้หลักในการใช้ยา และมักจะตอบสนองต่อยาได้ดี จะไม่ได้ผลในคนที่เป็น Hypogonadotropic hypogonadal anovulation (WHO class 1)
- Luteal phase defect เป็นภาวะที่ corpus luteum ไม่สามารถสร้าง progesterone ได้เพียงพอ ยากระตุ้นไข่จะช่วยได้โดยการที่ทำให้จำนวนไข่มากขึ้น เกิด corpus luteam มากกว่าหนึ่งใบ ทำให้ progesterone มากขึ้นด้วย พบว่ามีอัตราการตั้งครรภ์เทียบเท่ากับการให้ progesterone
- Unexplained infertility ใช้ในการรักษาผู้ป่วยมีบุตรยากที่หาสาเหตุไม่ได้
- Mild stimulation IVF
รูปที่ 1 ตัวอย่างยา Clomiphene citrate
ข้อห้ามใช้ยา โรคตับ หรือมีถุงน้ำรังไข่ที่สงสัยเป็นมะเร็ง
ชื่อการค้า Clomid, Duinum, Serophene
การบริหารยา
โดยปกติแล้วจะให้เริ่มกินยาในวันที่ 3-5 หลังจากมีประจำเดือน การเริ่มยาเร็ว จะสามารถกระตุ้นไข่ได้มากกว่า 1 ฟอง จึงนิยมให้ตั้งแต่วันที่ 3 โดยเฉพาะในรายที่ต้องการทำ IVF ขนาดยาที่ให้เริ่มที่ 50 mg ต่อวันเป็นเวลา 5 วัน ถ้ายังไม่มีการตกไข่หลังจากได้ยาไปแล้ว 1 รอบ จะเพิ่มขนาดยาเป็น 100 mg ต่อวันขนาดสูงสุดอยู่ที่ 250 mg ต่อวัน (100 mg เป็นขนาดสูงสุดที่รับรองโดย FDA แล้ว และ ACOG กำหนดไว้ว่าไม่ควรใช้เกินกว่า 150 mg ต่อวัน) (8) จะเกิด LH surge ในวันที่ 5-12 หลังได้ยา clomiphene dose สุดท้าย ดังนั้นควรแนะนำให้มีเพศสัมพันธ์วันเว้นวันไปประมาณ 1 สัปดาห์ เริ่มจากได้รับยา dose สุดท้ายไปแล้ว 5 วัน แต่ถ้ายังไม่มีการตั้งครรภ์เกิดขึ้นในรอบแรก ก็อาจจะลองใช้วิธีนี้ได้อีก 4-6 รอบ โดยพบว่าการให้ยาเกิน 6 รอบเดือนไม่เพิ่มอัตราการตั้งครรภ์ และการให้ยานานกว่า 12 รอบเดือนอาจเพิ่มความเสี่ยงของการเกิดมะเร็งรังไข่ได้ ACOG จึงได้แนะนำว่าไม่ควรใช้ยานี้ในการกระตุ้นไข่มากกว่า 12 รอบ (9)
ผลข้างเคียงของยา
อาการที่พบบ่อยที่สุดคือร้อนวูบวาบ (ร้อยละ 10) (10) นอกจากนี้อาจพบอาการอืดแน่นท้อง (ร้อยละ 5), คัดตึงเต้านม (ร้อยละ 2), คลื่นไส้อาเจียน (ร้อยละ 2) ปวดศีรษะและอาการทางสายตา (ร้อยละ 1) เช่น มองไม่ชัด เห็นภาพซ้อน ซึ่งอาการเหล่านี้หายได้เองหลังหยุดยา แต่มีรายงานการเกิด optic neuropathy แบบถาวร ดังนั้นหากมีอาการทางสายตาควรหยุดยาทันที
การประเมินผลการใช้ยา สามารถทำได้หลายวิธี ดังต่อไปนี้
- Basal Body Temperature เป็นการวัดอุณหภูมิร่างกายหลังตื่นนอนตอนเช้า ถ้าเปลี่ยนจาก uniphasic เป็น biphasic แสดงว่ามีการตกไข่เกิดขึ้น แต่อย่างไรก็ตามวิธีนี้ อาจจะไม่สะดวกกับผู้ป่วยบางราย และไม่สามารถกำหนดช่วงเวลาที่เหมาะสมในการมีเพศสัมพันธ์ได้ เนื่องจากอุณหภูมิอาจเปลี่ยนหลังจากตกไข่ไปแล้ว 1-5 วัน
- การวัดระดับ midluteal serum progesterone ซึ่งหมายถึงช่วงระยะเวลา 1 สัปดาห์หลังจากมีการตกไข่ หรือ 1 สัปดาห์ก่อนระยะเวลาที่คาดว่าจะเป็นประจำเดือน ซึ่งถ้ามีค่ามากกว่า 3 ng/mL (หรือจะให้ดีคือมากกว่า 10 ng/mL) จะบ่งบอกว่ามีการตกไข่เกิดขึ้นแล้ว
- การวัด LH surge โดยใช้ urinary kit มีประโยชน์ในการประเมินระยะเวลาตกไข่ โดยเฉพาะอย่างยิ่งในรายที่ไม่ต้องการใช้วิธีการวัดอุณหภูมิ นอกจากนี้ยังใช้ในการคาดคะเนช่วงเวลาที่เหมาะสมต่อการมีเพศสัมพันธ์ หลักการคือ หลังจากได้ clomiphene ครบแล้วจะมี LH surge เกิดขึ้นภายใน 5-12 วัน และถ้าใช้การตรวจปัสสาวะด้วยชุดตรวจนี้จะทำให้ทราบเวลาที่เกิด LH surge ซึ่งเราคาดว่าจะมีการตกไข่ตามมาใน 14-26 ชั่วโมง และไม่เกิน 48 ชั่วโมง (11) ซึ่งเป็นระยะเวลาที่ดีที่สุดถ้าหากมีเพศสัมพันธ์จะมีโอกาสตั้งครรภ์ได้สูงสุด คือ ภายใน 2 วันหลังจากเริ่มมี LH surge
- การใช้คลื่นเสียงความถี่สูงทางช่องคลอด (Transvaginal ultrasound) สามารถใช้เพื่อติดตามจำนวนและขนาดของฟอลลิเคิล และเป็นวิธีที่ใช้เพื่อกำหนดระยะเวลาในการให้ยาตัวอื่นเพิ่มเติม เช่น hCG เพื่อให้สามารถระบุวันตกไข่ที่แน่นอนได้ นอกจากนี้ยังสามารถหาหลักฐานของการตกไข่โดยดูจากการติดตามฟอลลิเคิลที่โตขึ้นจนกระทั่งฟอลลิเคิลนั้นแฟบลงซึ่งบ่งบอกว่าได้เกิดการตกไข่ไปแล้ว และยังสามารถบอกโอกาสที่จะเกิดครรภ์แฝด หรือ ภาวะ ovarian hyperstimulation syndrome (OHSS)
ผลการรักษา
Clomiphene citrate ทำให้มีอัตราการตกไข่ 60-85% โดยพบว่าในรายที่มี free androgen index ต่ำ, BMI ต่ำและ ovarian volume น้อยเป็นสิ่งที่จะช่วยทำนายได้ว่าจะประสบความสำเร็จในการตกไข่ ส่วนเรื่องการตั้งครรภ์นั้นมีอัตราการตั้งครรภ์เกิดขึ้น 30-40% ในกลุ่มที่เป็น oligomenorrhea ก็จะประสบความสำเร็จมากกว่าในกลุ่มที่เป็น amenorrhea (12)
การที่มีความแตกต่างกันมากของอัตราการตกไข่ที่สูง (60-80%) กับอัตราการตั้งครรภ์ที่ต่ำ (30-40%) อธิบายจาก antiestrogen effect ของยาต่อเยื่อบุโพรงมดลูกและมูกบริเวณปากมดลูก โดยทำให้เยื่อบุโพรงมดลูกบางไม่เหมาะกับการฝังตัวของตัวอ่อน และมูกที่ปากมดลูกมีปริมาณและคุณสมบัติแย่ลง ยาไม่เพิ่มอัตราการแท้ง, ไม่เพิ่มการตั้งครรภ์นอกมดลูกและไม่ทำให้เกิดความพิการแต่กำเนิด รวมทั้งไม่มีผลต่อพัฒนาการของทารก ครรภ์แฝดนั้นเกิดขึ้นได้ประมาณ 7-9% ในขณะที่การตั้งครรภ์แฝดสามเกิดได้ประมาณ 0.3% ส่วนความเสี่ยงที่จะเกิด ovarian hyperstimulation syndrome นั้นมีน้อยกว่า 1%
Aromatase inhibitors
Aromatase เป็น cytochrome P450-dependence enzyme ที่มีหน้าที่เปลี่ยน androgen ไปเป็น estrogen ซึ่งจะเกิดขึ้นบริเวณ peripheral ได้แก่ กล้ามเนื้อ, ไขมันและตับ ยาในกลุ่ม aromatase inhibitors จึงยับยั้งไม่ให้เกิดการเปลี่ยน testosterone และ androstenedione เป็น estradiol และ estrone ทำให้ลด negative feedback ของ estrogen ทำให้หลั่ง gonadotropins เพิ่มขึ้นจึงสามารถใช้ในการกระตุ้นไข่ได้ในรายที่มีปัญหาไม่ตกไข่ และจะเห็นว่าการออกฤทธิ์ไม่มีผลต่อ estrogen receptor จึงไม่มีผลต่อเยื่อบุโพรงมดลูก หรือมูกบริเวณปากมดลูกซึ่งแตกต่างจากยา clomiphene citrate ที่มีฤทธิ์ antiestrogen ที่อวัยวะดังกล่าว (13)
ข้อบ่งชี้ในการใช้ยา
พิจารณาเช่นเดียวกับ clomiphene citrate จึงถือเป็นอีกทางเลือกหนึ่งในกรณีที่ดื้อต่อ clomiphene citrate คือเมื่อใช้แล้วไม่ได้ไข่ ซึ่งพบได้ประมาณ 20-25% หรือในรายที่ใช้ clomiphene citrate แล้วมีเยื่อบุโพรงมดลูกบางมากจากผล antiestrogen
ชื่อการค้า Letrozole, Anastrozole
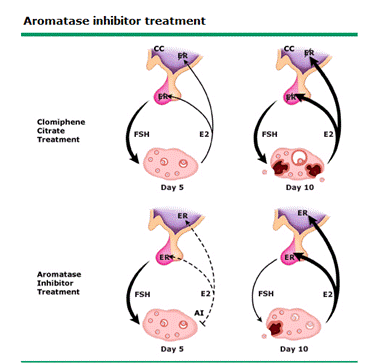
รูปที่ 2 แสดงความแตกต่าง ในการกระตุ้นไข่ระหว่าง Clomiphene citrate และ Aromatase inhibitor
รูปที่ 3 ตัวอย่างยา Aromatase inhibitors
การบริหารยา รับประทาน 2.5 mg ต่อวัน ในวันที่ 3-7 ของรอบเดือน จากการศึกษาพบว่า aromatase inhibitors ทำให้เกิดการตกไข่ประมาณ 75% และไม่ทำให้เยื่อบุโพรงมดลูกบาง แต่ราคาค่อนข้างแพงและข้อมูลด้านความปลอดภัยของยาต่อทารกยังค่อนข้างน้อย
ผลข้างเคียงของยา ได้แก่ ปวดกระดูก (20%), ร้อนวูบวาบ (18%), ปวดหลัง (17%), คลื่นไส้ (15%) และหายใจลำบาก (14%)
Gonadotropin
เริ่มมีการนำ Gonadotropin มาใช้ทางคลินิกในปี 1961 โดยสกัดจากปัสสาวะของหญิงวัยหมดประจำเดือนคือ human menopausal gonadotropin (hMG) มีสัดส่วนของ LH ต่อ FSH bioactivity เป็น 1:1 ซึ่งเป็นแบบเดียวกันกับในร่างกายจึงกระตุ้นให้เกิดการตกไข่ได้ (14) ต่อมาได้มีการพัฒนาให้ยาดังกล่าวบริสุทธิ์มากขึ้น จนกระทั่งในปี 1996 ได้มีการสกัด recombinant FSH ขึ้น ซึ่งมีประสิทธิภาพเท่า ๆ กัน แต่บริสุทธิ์กว่า และฉีดเข้าชั้นใต้ผิวหนังได้เลย ไม่ต้องฉีดเข้ากล้ามเหมือนแต่ก่อน
ข้อบ่งชี้ในการใช้ยา
- Normogonadotropic anovulatory (WHO class 2) ที่ไม่ตอบสนองต่อการรักษาด้วย clomiphene citrate
- Hypogonadotropic anovulatory (WHO class 1) แต่ในรายที่ pituitary ยังสามารถทำงานได้ตามปกติ อาจให้การรักษาด้วย pulsatile GnRH ได้ด้วย
ชื่อการค้า Urinary FSH (Menogon), Recombinant FSH (Puregon, Gonal-F)
รูปที่ 4 ตัวอย่างยา Gonadotropin
การบริหารยา
เป้าหมายของการกระตุ้นไข่ด้วย gonadotropin ก็เช่นเดียวกันกับ clomiphene citrate คือทำให้เกิดฟอลลิเคิลที่เจริญเติบโตเพียงฟอลลิเคิลเดียว สำหรับขนาดและวิธีการให้ยาจะพิจารณาเป็นราย ๆ เนื่องจากว่าความไวต่อการกระตุ้นจาก FSH ของรังไข่ในแต่ละรายนั้นไม่เท่ากัน ดังนั้นจึงมีวิธีการให้ยาได้หลายวิธีการดังต่อไปนี้
Step up protocol เป็นวิธีการให้ gonadrotropin แบบดั้งเดิม โดยขนาดเริ่มต้นของ FSH ที่ให้คือ 150 IU/day อย่างไรก็ตาม การบริหารยาดังกล่าวสัมพันธ์กับการเกิดครรภ์แฝดได้ถึง 36% และเกิด ovarian hyperstimulation syndrome ได้ถึง 14% ต่อรอบ (15) ซึ่งในหญิงที่มีภาวะ PCOS ผู้มีความเสี่ยงต่อการเกิดภาวะแทรกซ้อนอยู่แล้วจึงแนะนำให้ใช้แบบขนาดต่ำ ๆ มากกว่า (16) โดยการที่ค่อย ๆ ให้ FSH ช้า ๆ จะช่วยไม่ให้เกิดการกระตุ้นไข่ที่มากเกินไป ดังนั้นจะใช้วิธีฉีด FSH 37.5-75 IU/day เข้าทางกล้ามเนื้อ หรือผิวหนัง แต่อาจจะเพิ่มขนาดยาได้ถ้าพบว่าผ่านไป 14 วัน ไม่มีการตอบสนองต่อยาโดยการติดตามจากภาพจากคลื่นเสียงความถี่สูง และระดับ estradiol โดยจะเพิ่มทีละ 37.5 IUต่อสัปดาห์และเพิ่มได้สูงสุดถึง 225 IU/day
Step down protocol เป็นวิธีที่เลียนแบบฮอร์โมนในร่างกายได้ใกล้เคียงกับภาวะรอบเดือนปกติมากกว่า โดยจะเริ่มให้ FSH 150-250 IU/day ทันทีที่มีประจำเดือน ไม่ว่าจะเป็นประจำเดือนตามรอบเดือนปกติหรือ withdrawal bleeding จากการให้ progesterone ให้ยาไปจนกระทั่งเห็นฟอลลิเคิลขนาดมากกว่า 10 มิลลิเมตรจากภาพคลื่นเสียงความถี่สูงทางช่องคลอด หลังจากนั้นลดขนาดยาลงทีละ 37.5 IU ทุก 3 วันจนกระทั่งใช้อยู่ที่ 75 IU/day ให้ในขนาดนี้ไปเรื่อยๆ จนได้ขนาดไข่ที่ต้องการ แล้วจึงให้ hCG (Human chorionic gonadotropin) เพื่อกระตุ้นให้เกิดการเจริญเต็มที่และเกิดการตกไข่ตามมา
Modified regimen เป็นการให้ clomiphene citrate 50-100 mg/day นาน 5 วัน เริ่มวันที่ 3-5 ของรอบเดือน ตามด้วยการฉีด gonadotropin 75-150 IU/day นาน 3 วัน ข้อดีคือประหยัดและปลอดภัยมากกว่า แต่ผลการรักษาไม่ดีเท่าการฉีด gonadotropin เพียงอย่างเดียว
การจะเลือกใช้ FSH ชนิดใดในการกระตุ้นไข่นั้นยังเป็นหัวข้อที่ยังถกเถียงกันอยู่ ที่ผ่านมาได้มีการรวบรวมงานวิจัยเป็น meta-analysis จากงานวิจัยที่เป็น randomized controlled trials เปรียบเทียบระหว่างการใช้ uFSH กับ rFSH ในหญิงที่มีภาวะ PCOS ที่ไม่ตอบสนองต่อ clomiphene citrate พบว่า ไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติ ทั้งในแง่ของอัตราการตกไข่ (OR 1.19; 95% CI 0.78-1.80), อัตราการตั้งครรภ์ (OR 0.95; 95% CI 0.64-1.41), อัตราการแท้ง (OR 1.26; 95% CI 0.59-2.70), อัตราการเกิดครรภ์แฝด (OR 0.44; 95% CI 0.16-1.21) และการเกิด ovarian hyperstimulation syndrome (OR 1.55; 95% CI 0.50-4.84) (17)
ข้อแตกต่างอย่างหนึ่งของ uFSH กับ rFSH คือ uFSH มีการทำงานของ LH อยู่ด้วย ดังจะเห็นได้ว่า ถ้านำ rFSH ไปใช้ในหญิงที่เป็น hypogonadrotopic hypogonadal anovulation พบว่าหญิงเหล่านี้จะมี LH ในระดับที่ต่ำมาก คือ น้อยกว่า 0.5 IU/L และต้องได้ hCG หรือ recombinant LH 75 IU/day เพื่อคงระดับของ estradiol ไว้และเพื่อให้ฟอลลิเคิลเจริญต่อไปได้ (18)
การประเมินผลการรักษา
ติดตามดูฟอลลิเคิลจากการทำคลื่นเสียงความถี่สูงทางช่องคลอด โดยจะเริ่มทำการตรวจในช่วงท้ายของ follicular phase และมักจะติดตามดูทุก 2-3 วัน โดยให้ความสนใจไปที่ฟอลลิเคิลที่เริ่มมีการเจริญและโตขึ้น hCG จะเริ่มให้ในวันที่พบว่ามีฟอลลิเคิลอย่างน้อย 1 ฟอลลิเคิลที่มีลักษณะโตเต็มที่ โดยจะวัดจากขนาดคือมีขนาด 18 mm แต่ถ้าพบว่ามีฟอลลิเคิลขนาดใหญ่กว่า 15 mm ตั้งแต่ 3 ฟอลลิเคิลขึ้นไป ควรหยุดการกระตุ้นก่อน และยังไม่ให้ hCG ระหว่างนี้ให้แนะนำผู้ป่วยให้ใช้การคุมกำเนิดแบบ barrier method เช่น ถุงยางอนามัยก่อน ทั้งนี้เพื่อป้องกันไม่ให้เกิดภาวะ ovarian hyperstimulation syndrome และเพื่อไม่ให้มีการตั้งครรภ์แฝด
ผลการรักษา
มีการศึกษาในสถาบันแห่งหนึ่งซึ่งติดตามการรักษาหญิงที่เป็น PCOS ที่ใช้ gonadotropin แบบ low dose step-up protocol ในการกระตุ้นไข่มาเป็นเวลา 10 ปี พบว่าอัตราการตกไข่อยู่ที่ 72% และอัตราการตั้งครรภ์อยู่ที่ 45% (16) มีภาวะแทรกซ้อนจาก ovarian hyperstimulation syndrome ค่อนข้างน้อยเมื่อเทียบกับวิธีปกติ และอัตราการตั้งครรภ์ก็พอ ๆ กัน (19)
สำหรับการใช้ gonadrotopin ในกรณีที่ใช้ clomiphene citrate แล้วไม่ได้ผลถือว่าเป็นวิธีการที่เหมาะสมในการกระตุ้นให้มีการตกไข่ ซึ่งเมื่อใช้วิธีนี้แล้วพบว่า ภายใน 2 ปีอัตราการเกิดรอดมีชีพสะสมอยู่ที่ 71% และในครรภ์แฝดเป็น 7% (20) ดังนั้น จึงเป็นวิธีการที่ควรนำมาใช้เนื่องจากมีประสิทธิภาพดี ก่อนที่จะไปทำวิธีการที่ยุ่งยากมากกว่าเช่นการทำ IVF เป็นต้น ปัจจัยที่อาจจะทำให้วิธีการนี้ไม่ประสบความสำเร็จนั้นส่วนมากจะเกิดจากความอ้วน และภาวะ insulin resistance นั้นเอง (20-22)
ผลข้างเคียงของการใช้ยากระตุ้นไข่
1. การตั้งครรภ์แฝด
ความเสี่ยงต่อการเกิด multiple gestation นั้นเพิ่มขึ้นในกลุ่มที่ใช้ clomiphene citrate (6.9-9%) และถ้าใช้ gonadotropin ยิ่งเพิ่มมากขึ้นไปอีก (23)
2. ภาวะรังไข่ถูกกระตุ้นมากไป (Ovarian hyperstimulation syndrome: OHSS)
เป็นเรื่องที่ต้องให้ความสำคัญเนื่องจากเป็นภาวะแทรกซ้อนที่อันตรายถึงชีวิตที่อาจเกิดขึ้นในหญิงที่มากระตุ้นไข่ อาการและอาการแสดงมีได้หลายระดับ ได้แก่ การตรวจพบว่ามีรังไข่ขนาดใหญ่และพบเป็นถุงน้ำอยู่ภายใน มีภาวะความเข้มข้นของเลือดสูงขึ้น และมีการรั่วของสารน้ำออกนอกเส้นเลือด ซึ่งอาจจะทำให้เกิดไตวาย หรือภาวะขาดน้ำจนช็อค หรือเกิดหลอดเลือดอุดตันและมีลิ่มเลือดลอยไปอุดส่วนต่าง ๆ ของร่างกาย เกิดภาวะระบบหายใจล้มเหลว และเสียชีวิตได้ ซึ่งภาวะดังกล่าวจะเกิดน้อยในกลุ่มที่ได้รับการกระตุ้นไข่ด้วย clomiphene citrate แต่เกิดในกลุ่มที่กระตุ้นไข่ด้วย gonadotropin ได้บ่อยกว่า ภาวะนี้หายได้เองใน 10-14 วัน การรักษาจึงเป็นแบบรักษาตามอาการ
3. การเกิดมะเร็ง
มะเร็งรังไข่ สำหรับยาบางตัวที่ใช้ในการรักษาภาวะมีบุตรยากนั้น อาจจะเพิ่มความเสี่ยงของการเกิดเนื้องอกรังไข่ และบางส่วนเป็น borderline ovarian tumors (9, 24) แต่ไม่ใช่ว่าจะพบได้ในทุกการศึกษา (25-27) ในปัจจุบันได้มีการศึกษาโดยมุ่งไปที่ clomiphene และ gonadotropin ว่าจะเพิ่มความเสี่ยงต่อการเกิดมะเร็งหรือไม่ โดยในการศึกษาหนึ่งพบว่าความเสี่ยงจะเกิดขึ้นเพียงในบางกรณี คือ ในหญิงที่ได้รับการรักษาด้วย clomiphene มาแล้ว 12 รอบขึ้นไปเท่านั้น (9) จากการรวบรวมข้อมูลการศึกษาพบว่าการรักษาภาวะมีบุตรยากโดยการใช้ยานั้นไม่ได้มีผลโดยตรงต่อการเพิ่มความเสี่ยงของมะเร็งรังไข่ แต่ด้วยภาวะมีบุตรยากเองนั้น ก็เป็นความเสี่ยงของการเกิดมะเร็งด้วยตัวของโรคเองอยู่แล้ว (24, 28-30) ดังนั้นจึงมักจะพบความสัมพันธ์ของการเกิดมะเร็งรังไข่ในหญิงที่มีภาวะมีบุตรยากและใช้ยากระตุ้นไข่นั่นเอง (31) สำหรับสมมุติฐานดังกล่าวมาจากการสังเกตหญิงที่ไม่เคยมีบุตรมาก่อนและมีภาวะมีบุตรยาก มักจะเป็นกลุ่มที่มีความเสี่ยงสูงต่อการเกิดมะเร็งรังไข่ โดยที่ไม่มีความเกี่ยวข้องกับการใช้ยากระตุ้นไข่เลย (30-32) อย่างไรก็ตาม จากการที่พบว่าภาวะมะเร็งรังไข่นั้นเพิ่มมากขึ้นในหญิงที่มีการใช้ clomiphene มามากกว่า 12 เดือน ทำให้มีการจำกัดให้ใช้ยาดังกล่าวเพียง 6 เดือนในบางประเทศ ส่วนในสหรัฐอเมริกา ACOG ได้แนะนำว่าควรใช้ clomiphene รักษาภาวะมีบุตรยากไม่เกิน 12 รอบ และเช่นเดียวกันกับการใช้ gonadotropin ก็ควรใช้ลดลงด้วยเช่นกัน
มะเร็งเต้านม เท่าที่มีการศึกษาในปัจจุบันพบว่ายากระตุ้นไข่ไม่เพิ่มความเสี่ยงของการเกิดมะเร็งเต้านม (25, 26, 33-37) แต่ยังไม่สามารถสรุปได้ชัดเจนเนื่องจากการศึกษามีข้อจำกัดอยู่หลายอย่าง เช่น ข้อมูลที่ได้นั้นมาจากการสำรวจกลุ่มประชากรน้อยเกินไป ในแต่ละกลุ่มการศึกษาขาดการรวบรวมชนิดของยา ขนาดยา หรือแม้แต่สาเหตุของการเกิดภาวะมีบุตรยาก นอกจากนี้ยังตัวกวนจากความเสี่ยงบางอย่างที่มีผลต่อการเกิดมะเร็งเต้านมอยู่แล้วด้วย ซึ่งควรจะมีการศึกษาเพิ่มเติมต่อไป
มะเร็งเยื่อบุโพรงมดลูก มีการศึกษาพบว่าผู้ป่วยมีบุตรยากที่ได้รับ clomiphene เป็นมะเร็งเยื่อบุโพรงมดลูกมากขึ้น ซึ่งอาจไม่ได้สัมพันธ์กับยาแต่สัมพันธ์กับการที่หญิงมีบุตรยากนั้นมีภาวะไม่ตกไข่เรื้อรังอยู่เดิม ซึ่งเป็นปัจจัยเสี่ยงที่สำคัญของการเกิดมะเร็งเยื่อบุโพรงมดลูกอยู่แล้ว
มะเร็งชนิดอื่น ๆ เช่น melanoma, มะเร็งต่อมธัยรอยด์, มะเร็งลำไส้และมะเร็งปากมดลูก ไม่พบว่าเพิ่มความเสี่ยงไม่ว่าจะเป็นการใช้ clomiphene หรือ gonadotropin (38) รวมทั้งไม่เพิ่มการเกิดมะเร็งในเด็กที่มารดาได้รับยากระตุ้นไข่ แต่การติดตามเรื่องของผลจากยาเป็นสิ่งที่ต้องศึกษาต่อไป
บทสรุป
ภาวะไม่ตกไข่ เป็นสาเหตุที่พบได้บ่อยในผู้ที่มาตรวจด้วยภาวะมีบุตรยาก หลังจากรักษาสาเหตุแล้วถ้ายังไม่ได้ผล การใช้ยากระตุ้นไข่ก็เป็นการรักษาที่มีประสิทธิภาพสูง โดยเป้าหมายของการรักษานั้นคือการกระตุ้นฟอลลิเคิลเพียงหนึ่งเดียวที่จะสามารถเจริญต่อไปและเกิดการตกไข่ได้ในที่สุด สำหรับวิธีการที่จะใช้กระตุ้นไข่นั้น แพทย์ผู้รักษาควรเลือกวิธีการโดยดูจากสาเหตุของการไม่ตกไข่เป็นหลัก และพิจารณาร่วมกับประสิทธิภาพ ราคา ความเสี่ยง และผลข้างเคียงต่าง ๆ ที่อาจจะเกิดขึ้นได้ ดังนี้
สำหรับหญิงที่มีภาวะ hypogonadotropic anovulation (WHO class 1) แนะนำให้ใช้ pulsatile GnRH ในรายที่ต่อมใต้สมองปกติ หรือให้เป็น gonadotropin โดยให้ทั้ง LH และ FSH เนื่องจากส่วนใหญ่มักจะไม่ตอบสนองต่อการให้ FSH เพียงอย่างเดียว
สำหรับหญิงที่มีภาวะ normogonadotropin anovulation (WHO class 2) ซึ่งส่วนใหญ่คือกลุ่มที่มีภาวะ PCOS clomiphene citrate เป็นยาตัวแรกที่นำมาใช้ ถ้าหากไม่ได้ผล ขั้นต่อไปคือการให้ gonadotropin ซึ่งในกรณีนี้การให้แต่ FSH ก็อาจจะเพียงพอแล้ว
สำหรับหญิงที่มาภาวะ hypergonadotropic anovulation (WHO class 3) พบว่าไม่มียากระตุ้นไข่ตัวใดจะสามารถนำมาใช้รักษาได้อย่างมีประสิทธิภาพ แต่การใช้เทคโนโลยีช่วยการเจริญพันธุ์ โดยการทำเด็กหลอดแก้ว หรือ IVF ร่วมกับการใช้ไข่บริจาคจะประสบความสำเร็จค่อนข้างมาก
Reference
- Hull MG, Glazener CM, Kelly NJ, Conway DI, Foster PA, Hinton RA. Population study of causes, treatment, and outcome of infertility. Br Med J (Clin Res Ed). 1985;291(6510):1693-7.
- De Souza MJ, Miller BE, Loucks AB, Luciano AA, Pescatello LS, Campbell CG. High frequency of luteal phase deficiency and anovulation in recreational women runners: blunted elevation in follicle-stimulating hormone observed during luteal-follicular transition. J Clin Endocrinol Metab. 1998;83(12):4220-32.
- Laven JS, Imani B, Eijkemans MJ, Fauser BC. New approach to polycystic ovary syndrome and other forms of anovulatory infertility. Obstet Gynecol Surv. 2002;57(11):755-67.
- Norman RJ, Davies MJ, Lord J, Moran LJ. The role of lifestyle modification in polycystic ovary syndrome. Trends Endocrinol Metab. 2002;13(6):251-7.
- Boomsma CM, Eijkemans MJ, Hughes EG, Visser GH, Fauser BC, Macklon NS. A meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome. Hum Reprod Update. 2006;12(6):673-83.
- Li RH, Ng EH. Management of anovulatory infertility. Best Pract Res Clin Obstet Gynaecol. Jun 13.
- Use of clomiphene citrate in women. Fertil Steril. 2006;86(5):S187-93.
- ACOG Practice Bulletin. Management of infertility caused by ovulatory dysfunction. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2002;99(2):347-58.
- Rossing MA, Daling JR, Weiss NS, Moore DE, Self SG. Ovarian tumors in a cohort of infertile women. N Engl J Med. 1994;331(12):771-6.
- Goldstein SR, Siddhanti S, Ciaccia AV, Plouffe L, Jr. A pharmacological review of selective oestrogen receptor modulators. Hum Reprod Update. 2000;6(3):212-24.
- Miller PB, Soules MR. The usefulness of a urinary LH kit for ovulation prediction during menstrual cycles of normal women. Obstet Gynecol. 1996;87(1):13-7.
- Imani B, Eijkemans MJ, te Velde ER, Habbema JD, Fauser BC. A nomogram to predict the probability of live birth after clomiphene citrate induction of ovulation in normogonadotropic oligoamenorrheic infertility. Fertil Steril. 2002;77(1):91-7.
- Mitwally MF, Casper RF. Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate. Fertil Steril. 2001;75(2):305-9.
- Lunenfeld B. Historical perspectives in gonadotrophin therapy. Hum Reprod Update. 2004;10(6):453-67.
- Fauser BC, Van Heusden AM. Manipulation of human ovarian function: physiological concepts and clinical consequences. Endocr Rev. 1997;18(1):71-106.
- White DM, Polson DW, Kiddy D, Sagle P, Watson H, Gilling-Smith C. Induction of ovulation with low-dose gonadotropins in polycystic ovary syndrome: an analysis of 109 pregnancies in 225 women. J Clin Endocrinol Metab. 1996;81(11):3821-4.
- Bayram N, van Wely M, van Der Veen F. Recombinant FSH versus urinary gonadotrophins or recombinant FSH for ovulation induction in subfertility associated with polycystic ovary syndrome. Cochrane Database Syst Rev. 2001(2):CD002121.
- Human recombinant luteinizing hormone is as effective as, but safer than, urinary human chorionic gonadotropin in inducing final follicular maturation and ovulation in in vitro fertilization procedures: results of a multicenter double-blind study. J Clin Endocrinol Metab. 2001;86(6):2607-18.
- Calaf Alsina J, Ruiz Balda JA, Romeu Sarrio A, Caballero Fernandez V, Cano Trigo I, Gomez Parga JL. Ovulation induction with a starting dose of 50 IU of recombinant follicle stimulating hormone in WHO group II anovulatory women: the IO-50 study, a prospective, observational, multicentre, open trial. BJOG. 2003;110(12):1072-7.
- Eijkemans MJ, Imani B, Mulders AG, Habbema JD, Fauser BC. High singleton live birth rate following classical ovulation induction in normogonadotrophic anovulatory infertility (WHO 2). Hum Reprod. 2003;18(11):2357-62.
- Mulders AG, Eijkemans MJ, Imani B, Fauser BC. Prediction of chances for success or complications in gonadotrophin ovulation induction in normogonadotrophic anovulatory infertility. Reprod Biomed Online. 2003;7(2):170-8.
- Mulders AG, Laven JS, Imani B, Eijkemans MJ, Fauser BC. IVF outcome in anovulatory infertility (WHO group 2)–including polycystic ovary syndrome–following previous unsuccessful ovulation induction. Reprod Biomed Online. 2003;7(1):50-8.
- Fauser BC, Devroey P, Macklon NS. Multiple birth resulting from ovarian stimulation for subfertility treatment. Lancet. 2005;365(9473):1807-16.
- Ness RB, Cramer DW, Goodman MT, Kjaer SK, Mallin K, Mosgaard BJ. Infertility, fertility drugs, and ovarian cancer: a pooled analysis of case-control studies. Am J Epidemiol. 2002;155(3):217-24.
- Venn A, Watson L, Bruinsma F, Giles G, Healy D. Risk of cancer after use of fertility drugs with in-vitro fertilisation. Lancet. 1999;354(9190):1586-90.
- Modan B, Ron E, Lerner-Geva L, Blumstein T, Menczer J, Rabinovici J. Cancer incidence in a cohort of infertile women. Am J Epidemiol. 1998;147(11):1038-42.
- Calderon-Margalit R, Friedlander Y, Yanetz R, Kleinhaus K, Perrin MC, Manor O. Cancer risk after exposure to treatments for ovulation induction. Am J Epidemiol. 2009;169(3):365-75.
- Kashyap S, Moher D, Fung MF, Rosenwaks Z. Assisted reproductive technology and the incidence of ovarian cancer: a meta-analysis. Obstet Gynecol. 2004;103(4):785-94.
- Brinton LA, Lamb EJ, Moghissi KS, Scoccia B, Althuis MD, Mabie JE. Ovarian cancer risk after the use of ovulation-stimulating drugs. Obstet Gynecol. 2004;103(6):1194-203.
- Brinton LA, Lamb EJ, Moghissi KS, Scoccia B, Althuis MD, Mabie JE. Ovarian cancer risk associated with varying causes of infertility. Fertil Steril. 2004;82(2):405-14.
- Rodriguez C, Tatham LM, Calle EE, Thun MJ, Jacobs EJ, Heath CW, Jr. Infertility and risk of fatal ovarian cancer in a prospective cohort of US women. Cancer Causes Control. 1998;9(6):645-51.
- Rossing MA, Tang MT, Flagg EW, Weiss LK, Wicklund KG. A case-control study of ovarian cancer in relation to infertility and the use of ovulation-inducing drugs. Am J Epidemiol. 2004;160(11):1070-8.
- Ricci E, Parazzini F, Negri E, Marsico S, La Vecchia C. Fertility drugs and the risk of breast cancer. Hum Reprod. 1999;14(6):1653-5.
- Rossing MA, Daling JR, Weiss NS, Moore DE, Self SG. Risk of breast cancer in a cohort of infertile women. Gynecol Oncol. 1996;60(1):3-7.
- Doyle P, Maconochie N, Beral V, Swerdlow AJ, Tan SL. Cancer incidence following treatment for infertility at a clinic in the UK. Hum Reprod. 2002;17(8):2209-13.
- Brinton LA, Scoccia B, Moghissi KS, Westhoff CL, Althuis MD, Mabie JE, et al. Breast cancer risk associated with ovulation-stimulating drugs. Hum Reprod. 2004;19(9):2005-13.
- Gauthier E, Paoletti X, Clavel-Chapelon F. Breast cancer risk associated with being treated for infertility: results from the French E3N cohort study. Hum Reprod. 2004;19(10):2216-21.
- Althuis MD, Scoccia B, Lamb EJ, Moghissi KS, Westhoff CL, Mabie JE. Melanoma, thyroid, cervical, and colon cancer risk after use of fertility drugs. Am J Obstet Gynecol. 2005;193(3 Pt 1):668-74.