Update in Polycystic Ovary Syndrome
Update in Polycystic Ovary Syndrome
จัดทำโดย: พ.ญ.พิชชาพร ไพโรจน์
อาจารย์ที่ปรึกษา: อ.นพ. ณัฐพัชร์ จันทรสกา
ภาวะถุงน้ำในรังไข่หลายใบ หรือ Polycystic ovary syndrome (PCOS) เป็นปัญหาสาธารณสุขที่สำคัญ ซึ่งมีความเกี่ยวข้องกับระบบต่อมไร้ท่อ ระบบสืบพันธุ์ ระบบหัวใจและหลอดเลือด ผิวหนัง และจิตวิทยา PCOS เป็นหนึ่งในภาวะที่พบบ่อยที่สุด โดยพบภาวะนี้ในสตรีวัยเจริญพันธุ์ประมาณ 10% โดยที่ยังมีเคสอีกจำนวนมากที่ไม่ได้รับการวินิจฉัย สตรีที่มีภาวะ PCOS มีอาการแสดงที่หลากหลาย เช่น ด้านจิตใจ (ความวิตกกังวล ภาวะซึมเศร้า การนอนหลับและการรับประทานอาหารที่ผิดปกติ) โรคผิวหนัง (ขนดก รอยดำบริเวณข้อพับ และสิว) ระบบสืบพันธุ์ (รอบประจำเดือนผิดปกติ ภาวะมีบุตรยาก มะเร็งเยื่อบุโพรงมดลูก และภาวะแทรกซ้อนในการตั้งครรภ์) ลักษณะทางเมแทบอลิซึม (ภาวะดื้ออินซูลิน ภาวะเมแทบอลิกซินโดรม, เบาหวานประเภท 2) และเพิ่มความเสี่ยงโรคหัวใจและหลอดเลือด
การวินิจฉัยและการรักษา PCOS ยังคงท้าทาย รวมถึงการกำหนดเกณฑ์การวินิจฉัยแต่ละบุคคลอย่างแม่นยำ เนื่องจากความหลากหลายทางคลินิก (clinical heterogeneity) ความแตกต่างทางชาติพันธุ์ และความแปรปรวนต่างๆ ตลอดช่วงชีวิต ปัจจัยเหล่านี้มีส่วนทำให้เกิดการเปลี่ยนแปลงในการวินิจฉัย และการดูแลสตรีที่มีภาวะ PCOS
เกณฑ์การวินิจฉัย PCOS เดิมใช้ revised consensus Rotterdam criteria ซึ่งปัจจุบันได้เปลี่ยนและพัฒนาเป็น evidence-based criteria ซึ่งในบทความนี้จะกล่าวถึง International Evidence-based Guideline for the assessment and management of polycystic ovary syndrome 2023 ซึ่งเป็นแนวทางที่ออกมาล่าสุด
การคัดกรอง การวินิจฉัย และการประเมินความเสี่ยง
การวินิจฉัย
ปัจจุบันภาวะ PCOS ใช้เกณฑ์วินิจฉัยตาม International Evidence-based Guideline for the assessment and management of polycystic ovary syndrome 2023 โดยการวินิจฉัยผู้ป่วยว่าเป็น PCOS ต้องมีลักษณะเข้าได้ตามเกณฑ์ 2 ใน 3 ข้อดังต่อไปนี้
- มีลักษณะทางคลินิกของภาวะฮอร์โมนแอนโดรเจนมากกว่าปกติหรือตรวจพบระดับฮอร์โมนแอนโดรเจนในเลือดสูงกว่าปกติ (clinical/biochemical hyperandrogenism)
- มีความผิดปกติของการตกไข่ (ovulatory dysfunction)
- การตรวจด้วยคลื่นเสียงความถี่สูงพบลักษณะ Polycystic ovaries หรือระดับฮอร์โมน anti-mullerian hormone (AMH) เพิ่มขึ้น
โดยก่อนวินิจฉัยภาวะ PCOS จำเป็นต้องแยกโรคอื่นที่ทำให้เกิดลักษณะดังกล่าวให้ได้ก่อนเสมอ
หากมีอาการรอบประจำเดือนผิดปกติร่วมกับภาวะฮอร์โมนแอนโดรเจนเกิน ไม่จำเป็นต้องใช้การตรวจด้วยคลื่นเสียงความถี่สูงหรือ AMH ในการวินิจฉัย ส่วนการวินิจฉัยในวัยรุ่นจำเป็นต้องมีทั้งภาวะฮอร์โมนแอนโดรเจนเกินและความผิดปกติของการตกไข่ โดยไม่แนะนำให้ใช้การตรวจด้วยคลื่นเสียงความถี่สูงและ AMH ในวัยรุ่นเนื่องจากมีความจำเพาะต่ำ
Irregular cycles and ovulatory dysfunction
นิยามของรอบประจำเดือนไม่สม่ำเสมอและความผิดปกติของการตกไข่ (Irregular cycles and ovulatory dysfunction)
- เป็นปกติในปีแรกหลังจากเริ่มมีประจำเดือนครั้งแรก เป็นส่วนหนึ่งของการเปลี่ยนผ่านวัยแรกรุ่น
- > 1 ถึง <3 ปีหลังจากมีประจำเดือนครั้งแรก: <21 หรือ> 45 วัน
- > 3 ปีหลังจากมีประจำเดือนครั้งแรกจนถึงวัยหมดประจำเดือน: <21 หรือ> 35 วันหรือ <8 รอบต่อปี
- > 1 ปี หลังมีประจำเดือนครั้งแรก: > 90 วันในรอบเดือนไหนก็ได้
หากพบภาวะขาดประจำเดือนปฐมภูมิ (Primary amenorrhea) เมื่ออายุ 15 ปี หรือ > 3 ปีหลังเกิด thelarche (การพัฒนาเต้านม) เมื่อมีรอบประจำเดือนผิดปกติ การวินิจฉัย PCOS ควรได้รับการพิจารณาและประเมินตามแนวทางเหล่านี้
ลักษณะทางคลินิกของภาวะฮอร์โมนแอนโดรเจนมากกว่าปกติ (Clinical hyperandrogenism)
อาการและอาการแสดงของฮอร์โมนแอนโดรเจนที่มากเกินอย่างรุนแรงอาจส่งผลให้เกิดภาวะ virilization คือ ผู้หญิงที่มีลักษณะความเป็นชาย เช่น ศีรษะล้านแบบผู้ชาย ขนดกรุนแรง และภาวะคลิตอริสมีขนาดใหญ่ (clitoromegaly) ซึ่งพบได้น้อยในภาวะถุงน้ำในรังไข่หลายใบ (PCOS) อาการแสดงที่พบได้บ่อยในภาวะ PCOS มักเป็นอาการระดับเล็กน้อยถึงปานกลางของภาวะฮอร์โมนแอนโดรเจนเกิน คือ ขนดก (hirsutism) สิว (acne) และผมร่วงในรูปแบบผู้หญิง (female pattern hair loss)
ตามคำแนะนำควรซักประวัติและการตรวจร่างกายอย่างละเอียดเพื่อหาอาการและอาการแสดงของภาวะฮอร์โมนแอนโดรเจนเกิน โดยในผู้ใหญ่มักพบ สิว (acne) ผมร่วง (female pattern hair loss) และภาวะขนดก (hirsutism) ส่วนในวัยรุ่นมักพบ สิวแบบรุนแรง (severe acne) และภาวะขนดก (hirsutism)
คำแนะนำตามหลักฐานเชิงประจักษ์ (evidence-based recommendations)
- การพบภาวะขนดก (hirsutism) เพียงอย่างเดียว สามารถสงสัยถึงภาวะระดับฮอร์โมนแอนโดรเจนในเลือดสูง(Biochemical hyperandrogenism) และภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ในผู้ใหญ่ได้
- อาการผมร่วงในรูปแบบผู้หญิง (female pattern hair loss) และสิว (acne) เพียงอย่างเดียว (โดยไม่พบภาวะขนดก) ถือเป็นตัวทำนายที่ค่อนข้างต่ำต่อการเกิดภาวะระดับฮอร์โมนแอนโดรเจนในเลือดสูง (Biochemical hyperandrogenism)
การประเมินภาวะขนดก (hirsutism) แนะนำใช้ modified Ferriman Gallwey score (mFG) หากได้ 4–6 คะแนน สามารถใช้ประเมินได้ว่ามีภาวะขนดก (hirsutism) ซึ่งคะแนนประเมินอาจขึ้นอยู่กับเชื้อชาติ โดยในประเทศไทย สตรีไทยที่มีคะแนนขนรวมตามระบบ mFG ตั้งแต่ 3 คะแนนขึ้นไปควรได้รับการวินิจฉัยว่ามีภาวะขนดก2 และการดูแลกำจัดขนของผู้ป่วยเองอาจจะจำกัดการประเมินทางคลินิกได้ ซึ่งมีบริเวณที่ประเมินทั้งหมด 9 ตำแหน่ง ประกอบด้วย บริเวณเหนือริมฝีปากบน คาง ท่อนแขนส่วนบน หน้าอก หน้าท้องส่วนบน หน้าท้องส่วนล่าง หลังส่วนบน หลังส่วนล่าง และต้นขา โดยแต่ละบริเวณจะมีการให้คะแนนตั้งแต่ 0 ถึง 4 ซึ่งคะแนน 0 หมายถึง ไม่พบขนเส้นใหญ่และหยาบ (terminal hair) เลย ขณะที่คะแนน 4 หมายถึง มีขนเส้นใหญ่และหยาบจำนวนมาก คะแนนเต็มของเกณฑ์ คือ 36 โดยการกำหนดภาวะขนดกควรพิจารณาเฉพาะขนส่วนปลายเท่านั้น (terminal hair) ซึ่งขนมักจะมีความยาวมากกว่า 5 มม. หากไม่ได้รับการรักษา อาจมีรูปร่างและเนื้อสัมผัสที่แตกต่างกันไปแต่โดยทั่วไปจะมีสีเข้ม
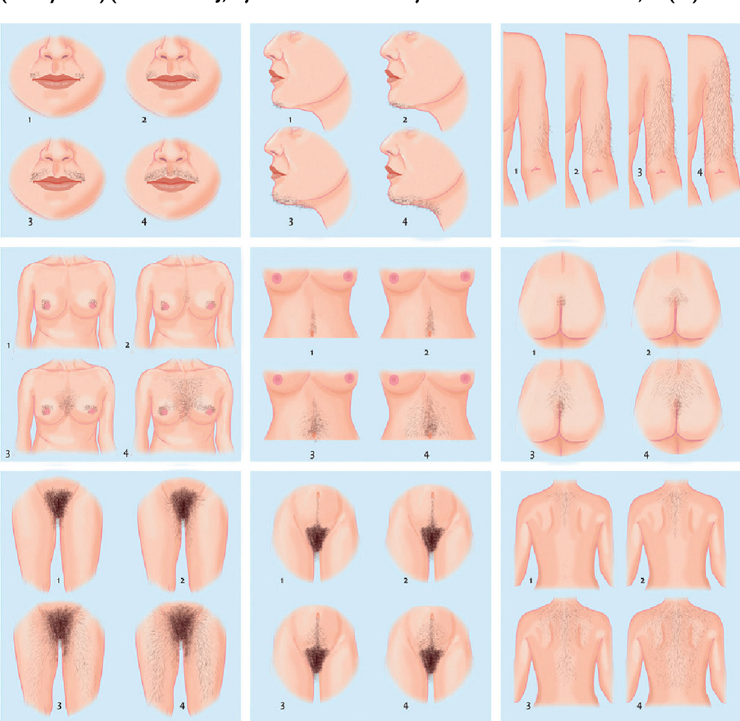
รูปที่ 1 Modified Ferriman-Gallwey score, ประเมิน 9 ตำแหน่ง แต่ละบริเวณมีการให้คะแนนตั้งแต่ 0 ถึง 4 คะแนน
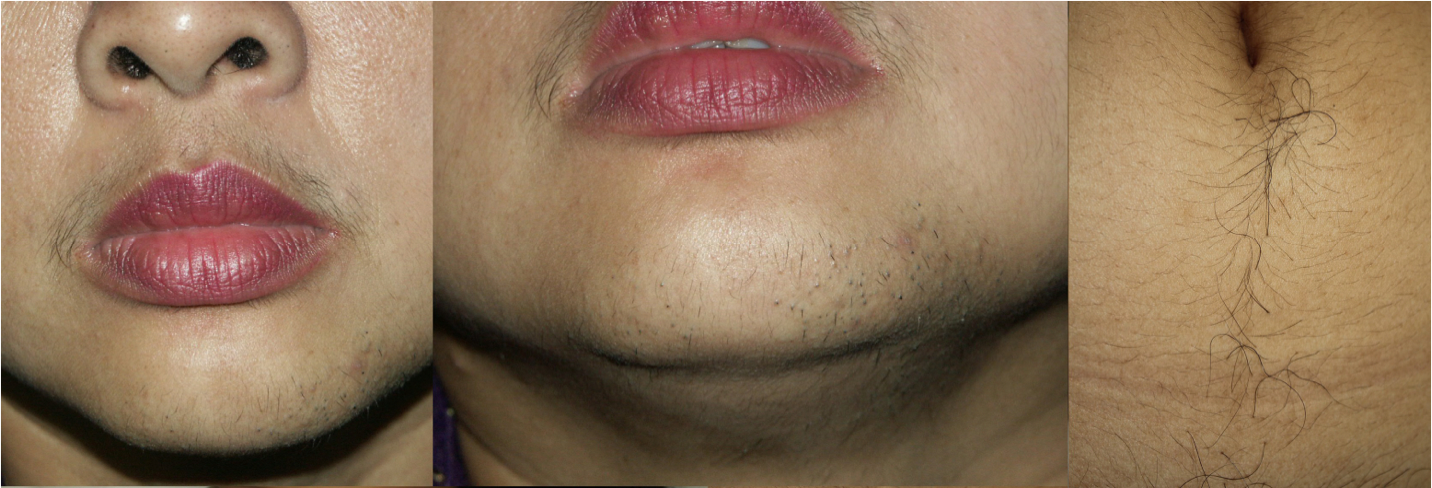
รูปที่ 2 Hirsutism เส้นขนหนาและยาวขึ้น ในตําแหน่งเหนือริมฝีปากบน คาง และท้องส่วนล่าง
การประเมินอาการผมร่วงในรูปแบบผู้หญิง (female pattern hair loss) พิจารณาใช้ Ludwig or Olsen visual scales
- Type 1 ผมบางด้านบนศีรษะอย่างเห็นได้ชัด โดยจากแนวผมด้านหน้ามา 1-3 ซม. จะยังมีเส้นผมอยู่
- Type 2 ผมบางบริเวณเดิมกับ Type 1 แต่บางมากขึ้น
- Type 3 ศีรษะล้าน
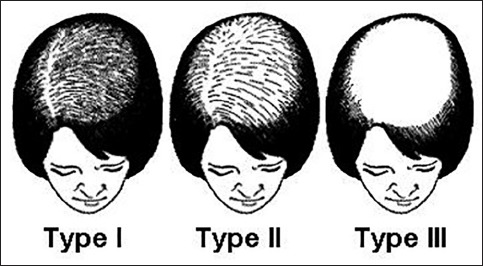
รูปที่ 3 Ludwig or Olsen visual scale
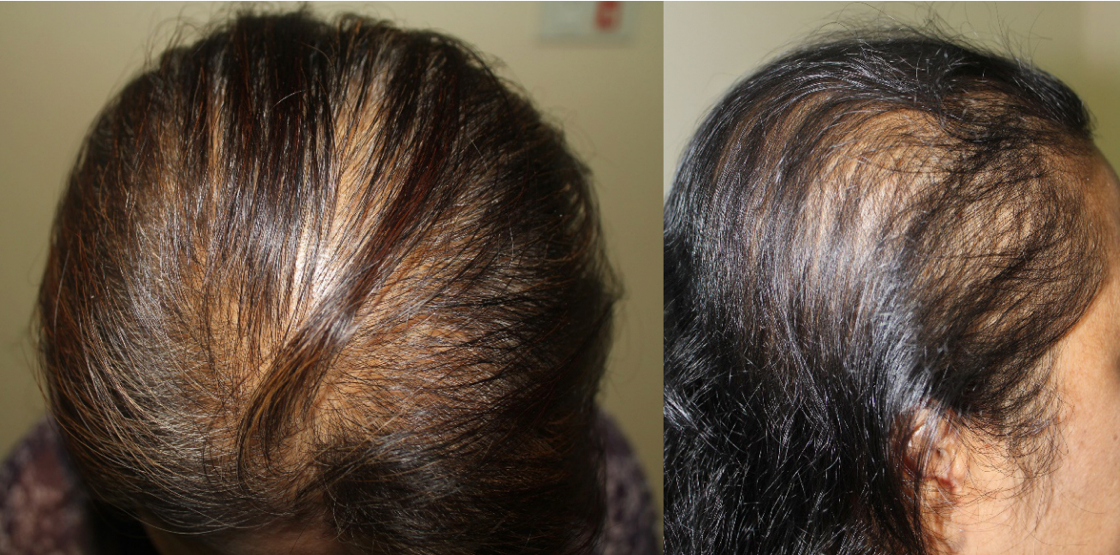
รูปที่ 4 Female pattern hair loss ผมบางบริเวณด้านบนของศีรษะ (central distribution)
ภาวะฮอร์โมนแอนโดรเจนในเลือดสูง (Biochemical hyperandrogenism)
สำหรับการตรวจหาภาวะฮอร์โมนแอนโดรเจนเกินในภาวะถุงน้ำในรังไข่หลายใบ (PCOS) สามารถตรวจวัดค่าในเลือดได้จากหลายตัว เช่น Total testosterone, Free testosterone, Androstenedione, Dehydroepiandrosterone sulfate (DHEAS) เป็นต้น ซึ่งมีประโยชน์ในผู้ป่วยที่มีอาการทางคลินิก เช่น สิว ผิวมัน ขนดก อาการเพียงเล็กน้อย อาการไม่ชัดเจน หรือไม่มีอาการเลย
ซึ่งตามคำแนะนำ ให้พิจารณาส่ง Total testosterone หรือ Free testosterone ก่อนเป็นอันดับแรก หากไม่สามารถแปลผลได้ อาจพิจารณาส่ง Androstenedione หรือ Dehydroepiandrosterone sulfate (DHEAS) แต่จะมีความจำเพาะ (specificity) ต่ำกว่า โดยในภาวะถุงน้ำในรังไข่หลายใบ (PCOS) total testosterone มักมีค่าสูงขึ้นแต่ไม่เกิน 150 ng/dL3 (≤ 5.2 nmol/L) หาก total testosterone มีค่า ≥ 200 ng/dL (≥ 6.9 nmol/L) ควรพิจารณาถึงเนื้องอกรังไข่ (ovarian tumor) หรือเนื้องอกต่อมหมวกไต (Adrenal tumor)
โดยก่อนส่งเจาะเลือด หากผู้ป่วยทานยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมอยู่ ควรแนะนำให้หยุดทานนานมากกว่า 3 เดือนก่อนส่งเจาะเลือดและคุมกำเนิดด้วยวิธีอื่นแทน เนื่องจากยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมสามารถลดระดับของ Total testosterone ในเลือดได้
Polycystic ovarian morphology (PCOM)
การตรวจหาลักษณะของถุงน้ำในรังไข่หลายใบ หรือ Polycystic ovarian morphology (PCOM) สามารถตรวจด้วยคลื่นเสียงความถี่สูง (ultrasound) หรือตรวจระดับฮอร์โมน Anti-mullerian hormone (AMH) ในเลือดได้
การตรวจด้วยคลื่นเสียงความถี่สูง(ultrasound)
การตรวจด้วยคลื่นเสียงความถี่สูงจะประเมินจำนวน follicle โดยประเมินได้จาก Follicle number per ovary (FNPO) และ Follicle number per cross-section (FNPS) หรือประเมินขนาดรังไข่จากการวัด Ovarian volume (OV) ซึ่งการประเมินโดยใช้ Follicle number per ovary (FNPO) ถือเป็นตัวบ่งชี้ที่แม่นยำที่สุดสำหรับตรวจ PCOM ในผู้ใหญ่ และการตรวจนั้นแนะนำให้ตรวจด้วยคลื่นเสียงความถี่สูงทางช่องคลอด (transvaginal ultrasound, TVS) จะมีความแม่นยำที่สุด
โดยเกณฑ์วินิจฉัย PCOM แบบเดิมตาม Rotterdam criteria ค.ศ.2003 ระบุว่า ตรวจด้วยคลื่นเสียงความถี่สูงพบว่ามีรังไข่หลายใบ โดยพบรังไข่อย่างน้อย 1 ข้างมีถุงน้ำไม่ต่ำกว่า 12 ใบ แต่ละถุงน้ำมีขนาดเส้นผ่านศูนย์กลาง 2-9 มิลลิเมตร หรือตรวจพบปริมาตรรังไข่มากกว่า 10 มิลลิลิตรขึ้นไป
ซึ่งตาม Evidence-based Guideline 2023 ได้ปรับเปลี่ยนเกณฑ์วินิจฉัย PCOM ในผู้ใหญ่เป็นดังนี้
- รังไข่อย่างน้อย 1 ข้าง ตรวจพบ Follicle number per ovary (FNPO) ≥ 20
- รังไข่อย่างน้อย 1 ข้าง ตรวจพบ Follicle number per section (FNPS) ≥ 10 หรือ Ovarian volume (OV) ≥ 10 ml ใช้เกณฑ์นี้กรณีที่คุณภาพของเครื่องตรวจหรือคุณภาพของภาพไม่เพียงพอที่จะประเมินจำนวน follicle ของรังไข่ทั้งหมดได้อย่างถูกต้อง หรือเป็นการตรวจคลื่นเสียงความถี่สูงทางหน้าท้อง (transabdominal ultrasound, TAS)
โดยแต่ละถุงน้ำมีขนาดเส้นผ่านศูนย์กลาง 2-9 มิลลิเมตร และควรแยกลักษณะของถุงน้ำรังไข่อื่นๆ ออก เช่น ovarian cysts, corpus luteum, dominant follicles (≥ 10 mm) ไม่ควรรวมอยู่ในการคำนวณปริมาตรรังไข่ (ovarian volume)
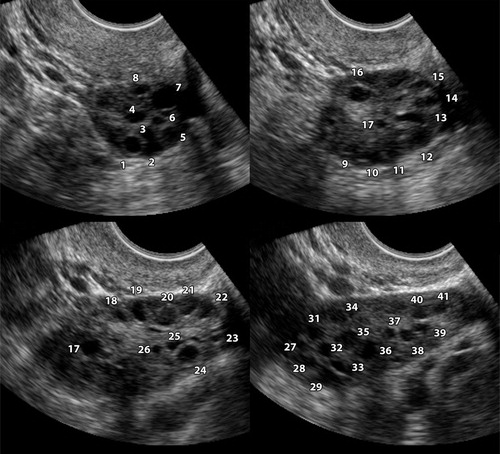
รูปที่ 5 ลักษณะของถุงน้ำรังไข่หลายใบ หรือ Polycystic ovarian morphology (PCOM) จากการตรวจด้วยคลื่นเสียงความถี่สูง
Anti-mullerian hormone (AMH)
Anti-mullerian hormone (AMH) คือ โพลีเปปไทด์ของ transforming growth factor beta (TGF-B) ที่สร้างจาก granulosa cell ของ preantral และ small antral follicle (AFs) ในรังไข่ ซึ่งสูงขึ้นอย่างมีนัยสำคัญในสตรีที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) และระดับของ AMH ในเลือดยังมีความสัมพันธ์กับ antral follicle count (AFC) ที่วัดได้จากการตรวจด้วยคลื่นเสียงความถี่สูง ดังนั้นใน Evidence-based Guideline 2023 จึงระบุให้ AMH เป็นอีกหนึ่งทางเลือกที่ใช้สำหรับการตรวจ Polycystic ovarian morphology (PCOM) ในผู้ใหญ่ แต่ไม่แนะนำให้ใช้เป็น single test ในการวินิจฉัยภาวะถุงน้ำในรังไข่หลายใบ (PCOS) และไม่แนะนำให้ใช้ตรวจในวัยรุ่น (adolescents)
ภาวะที่ต้องวินิจฉัยแยกโรคก่อนที่จะให้การวินิจฉัยภาวะถุงน้ำรังไข่หลายใบ
การส่งตรวจทางห้องปฏิบัติการเพื่อวินิจฉัยแยกโรคอื่นที่แนะนำให้ส่งตรวจในทุกราย มีดังนี้
- Thyroid stimulating hormone (TSH) เพื่อแยกโรคไทรอยด์ (Thyroid disease)
- Prolactin เพื่อแยกภาวะ Hyperprolactinemia
- 17-OH progesterone เพื่อแยกภาวะ Non-classic congenital adrenal hyperplasia
หากมีอาการที่บ่งชี้ถึงโรคอื่น เช่น Cushing’s syndrome, Androgen producing tumors, Hypogonadotrophic hypogonadism สามารถพิจารณาส่งตรวจทางห้องปฏิบัติการอื่นๆ เพิ่มเติมได้ตามโรคที่สงสัย

รูปที่ 6 แสดงขั้นตอนการประเมินวินิจฉัยภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ตาม International Evidence-based Guideline for the assessment and management of polycystic ovary syndrome 2023
การประเมินความเสี่ยงต่อโรคอื่น (Risk assessment)
เนื่องจากภาวะถุงน้ำในรังไข่หลายใบ (PCOS) มีความเกี่ยวข้องกับหลายระบบในร่างกาย เช่น ระบบต่อมไร้ท่อ ระบบสืบพันธุ์ ระบบหัวใจและหลอดเลือด ผิวหนัง และจิตวิทยา ดังนั้น สตรีที่มีภาวะ PCOS มักจะมีความเสี่ยงในการเกิดโรคอื่นๆ ตามมาได้ในหลายระบบ ซึ่งแพทย์ควรให้ความสำคัญและต้องประเมิน โดยโรคที่มักพบได้บ่อย ได้แก่
โรคหัวใจและหลอดเลือด (Cardiovascular disease)
ขณะนี้ภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ได้รับการยืนยันแล้วว่าเป็นกลุ่มที่มีความเสี่ยงสูงต่อการเกิดโรคหัวใจและหลอดเลือด ดังนั้น ผู้หญิงทุกคนที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ควรได้รับการประเมินปัจจัยเสี่ยงของโรคหัวใจและหลอดเลือด สิ่งที่ควรประเมิน ได้แก่ น้ำหนัก, ดัชนีมวลกาย (BMI), เส้นรอบวงเอว (Waist Circumference), ระดับไขมันในเลือด (Lipid profile: cholesterol, LDL, HDL and triglyceride level), วัดความดันโลหิตทุกปี และตรวจระดับน้ำตาลในเลือด
ภาวะก่อนเป็นโรคเบาหวาน (Impaired glucose tolerance) และ โรคเบาหวานชนิดที่ 2 (type 2 diabetes)
ผู้ป่วยที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) จะมีความเสี่ยงเกิด Impaired glucose tolerance และโรคเบาหวานชนิดที่ 2 เพิ่มมากขึ้น โดยความเสี่ยงไม่ขึ้นกับอายุและดัชนีมวลกาย ดังนั้นสตรีที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ควรได้รับการประเมินภาวะน้ำตาลในเลือด และตรวจติดตามทุกๆ 1 ถึง 3 ปี ซึ่งความถี่ขึ้นอยู่กับปัจจัยเสี่ยงอื่นๆ ของโรคเบาหวาน (ดัชนีมวลกาย > 25 กก./ม.2 หรือ ในคนเอเชียดัชนีมวลกาย > 23 กก./ม.2, มีประวัติ Impaired glucose tolerance หรือมีโรคเบาหวานในครอบครัว, ความดันโลหิตสูง) การส่งตรวจที่แนะนำคือ 75g oral glucose tolerance test (OGTT) (ค่าปกติ < 140 mg/dL) ซึ่งเป็นการตรวจที่แม่นยำที่สุด หากไม่สามารถส่งตรวจได้ อาจพิจารณาส่งตรวจ fasting plasma glucose และ/หรือ glycated haemoglobin (HbA1c) แทนได้ สตรีทุกคนที่มีภาวะ PCOS หากไม่ได้รับการตรวจน้ำตาลก่อนตั้งครรภ์ ควรตรวจ OGTT เมื่อฝากครรภ์ครั้งแรกและควรได้รับการตรวจซ้ำในช่วง 24-28 สัปดาห์ของการตั้งครรภ์ เนื่องจากภาวะ PCOS ถือเป็น high-risk condition ในการตั้งครรภ์
โรคหยุดหายใจขณะหลับจากการอุดกั้น (obstructive sleep apnea : OSA)
ความชุกของโรคหยุดหายใจขณะหลับจากการอุดกั้น (obstructive sleep apnea : OSA) ในสตรีที่มีภาวะ PCOS สูงขึ้นอย่างมีนัยสำคัญ ดังนั้นสตรีที่มีภาวะ PCOS ควรได้รับการคัดกรองหรือประเมินอาการของ OSA ด้วย เช่น นอนกรน ตื่นมาไม่สดชื่น ง่วงนอนตอนกลางวัน เหนื่อยล้า เป็นต้น หากมีอาการเหล่านี้ผู้ป่วยควรได้รับการส่งต่อเพื่อรักษาต่อไป
เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia), โรคมะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer)
สตรีวัยก่อนหมดประจำเดือน (premenopausal women) ที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) มีความเสี่ยงของมะเร็งเยื่อบุโพรงมดลูกเพิ่มขึ้น 2-6 เท่า การตรวจด้วยคลื่นเสียงความถี่สูงทางช่องคลอด (transvaginal ultrasound) และ/หรือการตรวจชิ้นเนื้อเยื่อบุโพรงมดลูก (endometrial biopsy) แนะนำให้ตรวจในผู้ป่วยที่เยื่อบุโพรงมดลูกหนาขึ้นเป็นเวลานาน และ/หรือมีปัจจัยเสี่ยงอื่นๆ ได้แก่ ภาวะประจำเดือนขาดเป็นเวลานาน เลือดออกทางช่องคลอดผิดปกติ หรือน้ำหนักเกิน อย่างไรก็ตามความเสี่ยงที่แท้จริงยังอยู่ในระดับต่ำ ดังนั้น Routine screening สำหรับมะเร็งเยื่อบุโพรงมดลูกในผู้ป่วย PCOS จึงยังไม่จำเป็น
ภาวะทางด้านจิตใจ (Psychological features)
เนื่องจากภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ส่งผลต่อลักษณะภายนอกของผู้ป่วย เช่น อ้วน สิว ขนดก เป็นต้น ซึ่งมักส่งผลให้ผู้ป่วยมีความมั่นใจในตนเองน้อยลง (Low self-esteem), ไม่ชอบภาพพจน์ของตัวเอง (Negative body image), พฤติกรรมการทานอาหารที่ผิดปกติ (Eating disorder) ซึ่งแพทย์ควรตระหนักและให้ความสำคัญเรื่องภาวะทางด้านจิตใจมากขึ้น โดยเฉพาะโรคซึมเศร้าและโรควิตกกังวล ซึ่งพบว่ามีความชุกที่มาก (high prevalence) ในผู้ป่วย PCOS ดังนั้น Routine screening สำหรับโรคซึมเศร้าและโรควิตกกังวลจึงแนะนำให้ทำในสตรีที่มีภาวะ PCOS ทุกราย หากจำเป็นต้องได้รับการรักษาควรให้การรักษาด้วยจิตบำบัด (Psychological therapy) และ/หรือการรักษาด้วยยา (Pharmacological treatment) ตามแนวทางปฏิบัติที่เหมาะสม
การรักษา
การปรับเปลี่ยนพฤติกรรมสุขภาพ (Lifestyle interventions)
การปรับเปลี่ยนพฤติกรรมเป็นการรักษาที่สำคัญและควรทำเป็นอย่างแรก พฤติกรรมการดำเนินชีวิตที่ดีต่อสุขภาพ (healthy lifestyle) ไม่ว่าจะเป็นการทานอาหารเพื่อสุขภาพหรือการออกกําลังกายเป็นประจำ ควรแนะนําให้ปฏิบัติในสตรีทุกคนที่มีภาวะ PCOS เพื่อควบคุมให้มีน้ำหนักอยู่ในเกณฑ์ปกติ ทำให้ระดับอินซูลินในเลือดลดลง ลดภาวะดื้อต่ออินซูลิน ส่งผลลดระดับของแอนโดนได้ จึงสามารถลดภาวะขนดก ช่วยปรับรอบประจำเดือน เพิ่มโอกาสในการมีบุตร ช่วยลดความเสี่ยงของโรค metabolic syndrome และเพื่อคุณภาพชีวิตที่ดีในระยะยาว
การศึกษาพบว่าการลดน้ำหนักได้อย่างน้อยร้อยละ 5 ก็มีประโยชน์ในหลายๆ ระบบ ไม่ว่าจะเป็นเรื่อง metabolic syndrome, ระบบสืบพันธุ์ และภาวะทางจิตใจ ซึ่งการทานอาหารเพื่อสุขภาพหรือการออกกําลังกายไม่ได้มีการศึกษาแน่ชัดว่าแบบใดดีที่สุดสำหรับผู้ป่วย PCOS จึงสามารถจะปรับเปลี่ยนพฤติกรรมแบบใดก็ได้ที่ผู้ป่วยสามารถปฏิบัติได้ในระยะยาว
สิ่งที่เพิ่มเข้ามาใน Evidence-based Guideline 2023 คือ เพิ่มความตระหนักเรื่องการไม่ตีตราเรื่องน้ำหนัก (Weight stigma) เมื่อพูดถึงการปรับเปลี่ยนพฤติกรรม เนื่องจากการศึกษาพบว่าสตรีที่มีภาวะ PCOS มักต้องเผชิญกับการถูกตีตราเรื่องน้ำหนักจากแพทย์และสมาชิกในครอบครัว ดังนั้น ควรส่งเสริมการยอมรับและเคารพในความหลากหลายของรูปร่าง และให้ความสำคัญเรื่องการปรับเปลี่ยนพฤติกรรมสุขภาพและส่งเสริมให้มีผลลัพธ์ด้านสุขภาพที่ดี (healthy lifestyle) โดยไม่จำเป็นที่น้ำหนักต้องลดลงก็ได้
แนวทางการรักษาในผู้ป่วยที่ยังไม่ต้องการมีบุตร
โดยหลักของการรักษาสตรีที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS) ที่ยังไม่ต้องการมีบุตร คือ
- ให้ความรู้ความเข้าใจแก่ผู้ป่วยถึงลักษณะของตัวโรคและความเสี่ยงต่างๆ ที่อาจเกิดขึ้นได้ (Education)
- ส่งเสริมการปรับเปลี่ยนพฤติกรรมให้มีน้ำหนักอยู่ในเกณฑ์ปกติและมี healthy lifestyle (Lifestyle interventions)
- การรักษาด้วยยาเพื่อลดภาวะแอนโดรเจรเกิน และรักษาเรื่องประจำเดือนไม่สม่ำเสมอ (Pharmacological therapy)
ยาทางเลือกแรก (First line pharmacology treatment)
ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม – Combined oral contraceptive pills (COCPs)
ยาเม็ดคุมกำเนิดช่วยรักษาเรื่องขนดกและเรื่องประจำเดือนไม่สม่ำเสมอ แนะนำให้ใช้เอสโตรเจนขนาดที่ต่ำที่สุดที่ยังมีประสิทธิภาพในการรักษา เช่น 20-30 ไมโครกรัมของ ethinyloestradiol หรือเทียบเท่า โดยยาเม็ดคุมกำเนิดที่มีขนาด 35 micrograms EE รวมกับ cyproterone acetate ไม่ถือเป็น First line สำหรับการรักษาภาวะ PCOS เนื่องจากเพิ่มความเสี่ยงภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ (Venous Thromboembolism: VTE) โดยการรักษาภาวะขนดกแนะนำให้ใช้ยาเม็ดคุมกำเนิดร่วมกับการรักษาด้านความงามเพิ่มเติมควบคู่กันนานอย่างน้อย 6 เดือน กรณีต้องการป้องกันความเสี่ยงเรื่องเยื่อบุโพรงมดลูกหนาตัว อาจพิจารณารักษาด้วยยาเม็ดคุมกำเนิดชนิดฮอร์โมนเดี่ยว (Progesterone-only oral contraceptive pills) ได้
ข้อห้ามโดยเด็ดขาด (Absolute Contraindications) ของยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม (COCPs)
- Breast cancer
- History of migraine with aura
- Deep vein thrombosis/pulmonary emboli
- Known thrombogenic mutations
- Multiple risk factors for CVD
- History of ischaemic heart disease, stroke
- Complicated valvular heart disease
- Neuropathy
- Severe cirrhosis and malignant liver tumours
- Women up to 6 weeks postpartum with other risk factors for venous thromboembolism (VTE) (e.g. immobility, transfusion at delivery, BMI > 30 kg/m2, postpartum haemorrhage, immediately post-caesarean delivery, preeclampsia, smoking)
ยาทางเลือกที่สอง (Second line pharmacology treatment)
Metformin
การใช้ยา Metformin เพียงตัวเดียวสามารถพิจารณาให้ได้ในผู้ที่มีภาวะ PCOS และมี BMI ≥ 25 kg/m2 เพื่อรักษาภาวะเมแทบอลิกต่างๆ ไม่ว่าจะเป็นภาวะดื้ออินซูลิน ลดระดับน้ำตาลและไขมันในเลือด ซึ่งยามีผลข้างเคียงต่อระบบทางเดินอาหารที่ไม่รุนแรง โดยทั่วไปอาการจะขึ้นอยู่กับขนาดยาและสามารถหายได้เอง แนะนำเริ่มยาในขนาดต่ำ โดยเพิ่มครั้งละ 500 มก. ทุก 1-2 สัปดาห์ ขนาดยาสูงสุดที่แนะนำต่อวันคือ 2.5 กรัมในผู้ใหญ่ และ 2 กรัมในวัยรุ่น และยาสามารถในใช้ระยะยาวได้อย่างปลอดภัย
ในรายที่มีข้อห้ามใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม (COCPs) สามารถพิจารณาให้ Metformin เพื่อรักษาเรื่องประจำเดือนไม่สม่ำเสมอได้ และรักษาภาวะขนดกด้วยวิธีอื่นเพิ่มเติมแทน
การใช้ยา Metformin ร่วมกับ COCP อาจมีประโยชน์มากที่สุดในกลุ่มที่มีความเสี่ยงต่อภาวะเมแทบอลิกสูง เช่น BMI > 30 kg/m2 , มีปัจจัยเสี่ยงของโรคเบาหวาน, Impaired glucose tolerance หรือกลุ่มชาติพันธุ์ที่มีความเสี่ยงสูง
Anti-androgen
อาจพิจารณาให้ยาต้านแอนโดรเจนเพื่อรักษาภาวะขนดกในสตรีที่มีภาวะ PCOS หากไม่ตอบสนองต่อการรักษาจากการใช้ยาเม็ดคุมกำเนิดร่วมกับการรักษาด้านความงามควบคู่กันนานมากกว่า 6 เดือน การใช้ยาต้านแอนโดรเจนแนะนำใช้ร่วมกับการคุมกำเนิดที่มีประสิทธิภาพ เนื่องจากหากตั้งครรภ์ขณะใช้ยาอาจส่งผลให้ทารกเกิดภาวะ male fetal virilisation การจ่ายยาควรต้องคำนึงถึงผลข้างเคียงของยาแต่ละตัวก่อนที่จะเลือกใช้ ตัวอย่างยา เช่น spironolactone 25-100 มก./วัน เป็นยาที่มีผลข้างเคียงน้อยที่สุด, cyproterone acetate, finasteride, flutamide, bicalutamide เป็นต้น
สรุปแนวทางการรักษาสตรีที่มีภาวะถุงน้ำในรังไข่หลายใบ (PCOS)
- Lifestyle + COCP + Metformin: มีประโยชน์มากที่สุดในกลุ่มที่มีความเสี่ยงต่อภาวะเมแทบอลิกสูง เช่น BMI > 30 kg/m2, มีปัจจัยเสี่ยงของโรคเบาหวาน, Impaired glucose tolerance
- COCP + Anti-androgen: หากไม่ตอบสนองต่อการรักษาภาวะขนดกจากการใช้ยาเม็ดคุมกำเนิดร่วมกับการรักษาด้านความงามควบคู่กันนานมากกว่า 6 เดือน
- Lifestyle + Metformin พิจารณาใช้ในผู้ป่วยที่ BMI ≥ 25 kg/m2 เพื่อรักษาภาวะเมแทบอลิก
การรักษาอื่นๆ ที่แนะนำ
Mechanical laser and light therapies
การรักษาภาวะขนดกแนะนำให้รักษาด้วยเลเซอร์ได้ ซึ่งจำนวนครั้งของการกำจัดขนในสตรีที่มีภาวะ PCOS อาจจะมากกว่าของ idiopathic hirsutism ซึ่งการกำจัดขนจะส่งผลดีต่อภาวะซึมเศร้า ความวิตกกังวล และคุณภาพชีวิตของผู้ป่วยอีกด้วย
Anti-obesity medications
อาจพิจารณาใช้ยาเพื่อลดน้ำหนักในผู้ที่มีภาวะ PCOS และ BMI > 30 kg/m2 เช่น liraglutide, semaglutide, orlistat เป็นต้น
Bariatric/metabolic surgery
การผ่าตัดกระเพาะอาหารเพื่อลดน้ำหนัก (Bariatric surgery) อาจพิจารณาในสตรีที่มีภาวะ PCOS และ BMI > 35 kg/m2 หรือ BMI 30 – 34.9 kg/m2 ร่วมกับมีโรคเมแทบอลิกอื่นๆ เพื่อช่วยลดน้ำหนัก ช่วยป้องกันและรักษา โรคความดันโลหิตสูง, โรคเบาหวาน , ภาวะขนดก, รอบประจำเดือนผิดปกติ และเพิ่มอัตราการตั้งครรภ์ในสตรีที่มีภาวะ PCOS
สรุป Key guideline ที่เปลี่ยนแปลงจาก ปี 2018 – 2023
- Evidence โดยรวมมีการศึกษามากขึ้นและน่าเชื่อถือมากขึ้น
- ส่วนที่เป็น Evidence-based recommendations มีเพิ่มมากขึ้น
- เพิ่ม Anti-mullerian hormone (AMH) เป็นอีกหนึ่งทางเลือกที่ใช้สำหรับการตรวจ Polycystic ovarian morphology (PCOM) แทนการตรวจด้วยคลื่นเสียงความถี่สูงในผู้ใหญ่
- แนะนำการกำจัดขนด้วยการเลเซอร์เนื่องจากเป็นวิธีที่มีประสิทธิภาพ
- กําหนดภาวะ PCOS เป็นภาวะที่มีความเสี่ยงสูงในระหว่างตั้งครรภ์
- การศึกษาพบความชุกและความรุนแรงของภาวะซึมเศร้าและความวิตกกังวลเพิ่มขึ้นในสตรีที่มีภาวะ PCOS
- การรักษาเน้นรูปแบบการดูแลแบบองค์รวม ให้ตระหนักเรื่องภาวะทางด้านจิตใจเพิ่มมากขึ้น และหลีกเลี่ยงเรื่อง weight stigma
เอกสารอ้างอิง
- Teede, H., Tay, C. T., Laven, J. S., Dokras, A., Moran, L. J., Piltonen, T., Costello, M., Boivin, J., Redman, L. M., Boyle, J., Norman, R. J., Mousa, A., & Joham, A. E. (2023). Recommendations from the 2023 international evidence-based guideline for the assessment and management of polycystic ovary syndrome. European Journal of Endocrinology, 189(2), G43–G64. https://doi.org/10.1093/ejendo/lvad096
- Cheewadhanaraks S, Peeyananjarassri K, Choksuchat C. Clinical Diagnosis of Hirsutism in Thai Women. J Med Assoc Thai 2004;87:459.
- Sheehan, M. T. (2004). Polycystic ovarian Syndrome: Diagnosis and management. Clinical Medicine & Research, 2(1), 13–27.
- van Zuuren EJ, Pijl H. Hirsutism. Ned Tijdschr Geneeskd. 2007 Oct 20;151(42):2313-8
- Pakornphadungsit K, Suchonwanit P, Sriphojanart T. Polycystic Ovary Syndrome in Dermatological Practice. Thai J Dermatol, 2016; 32: 240-254.
- Gupta, M., & Mysore, V. (2016). Classifications of patterned hair loss: a review. Journal of Cutaneous and Aesthetic Surgery, 9(1), 3. https://doi.org/10.4103/0974-2077.178536


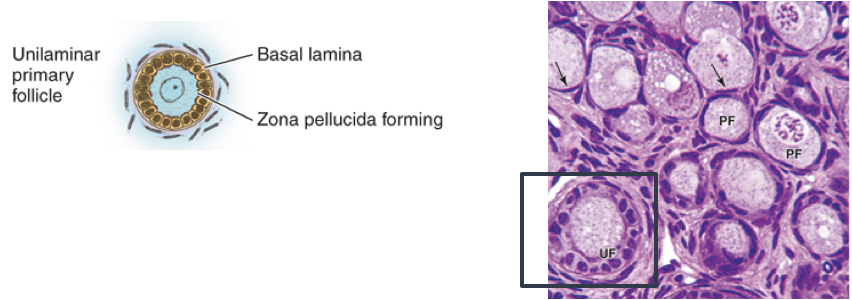
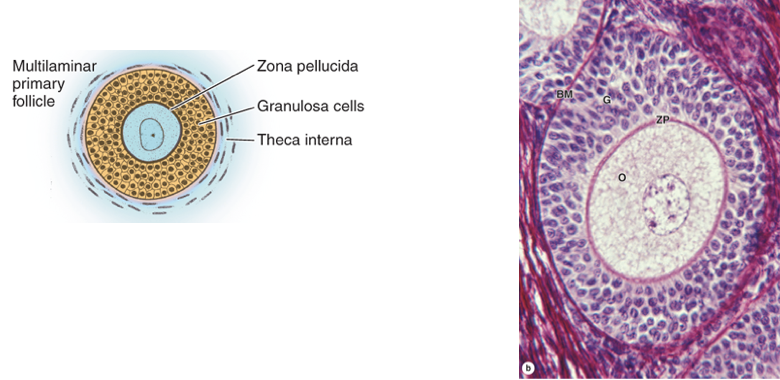
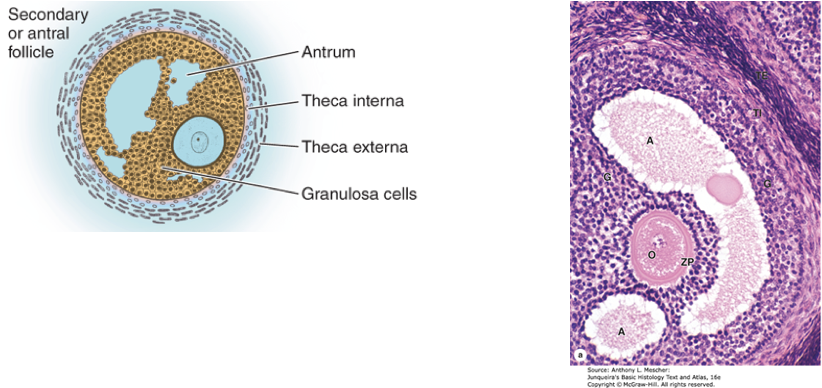
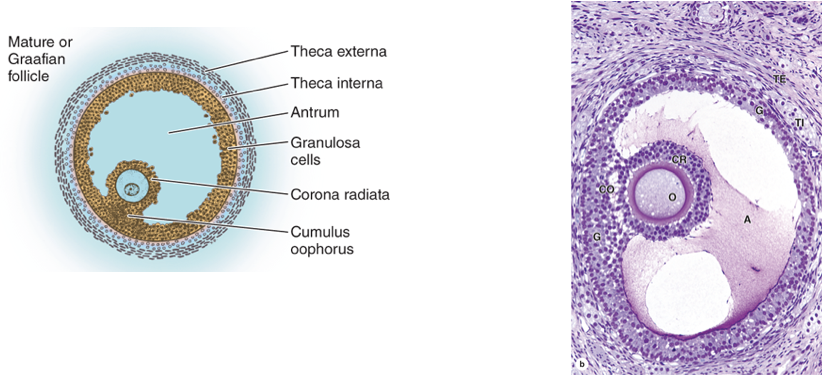
 รูปที่ 1 แสดงการพัฒนาของฟอลลิเคิลในแต่ละระยะ
รูปที่ 1 แสดงการพัฒนาของฟอลลิเคิลในแต่ละระยะ
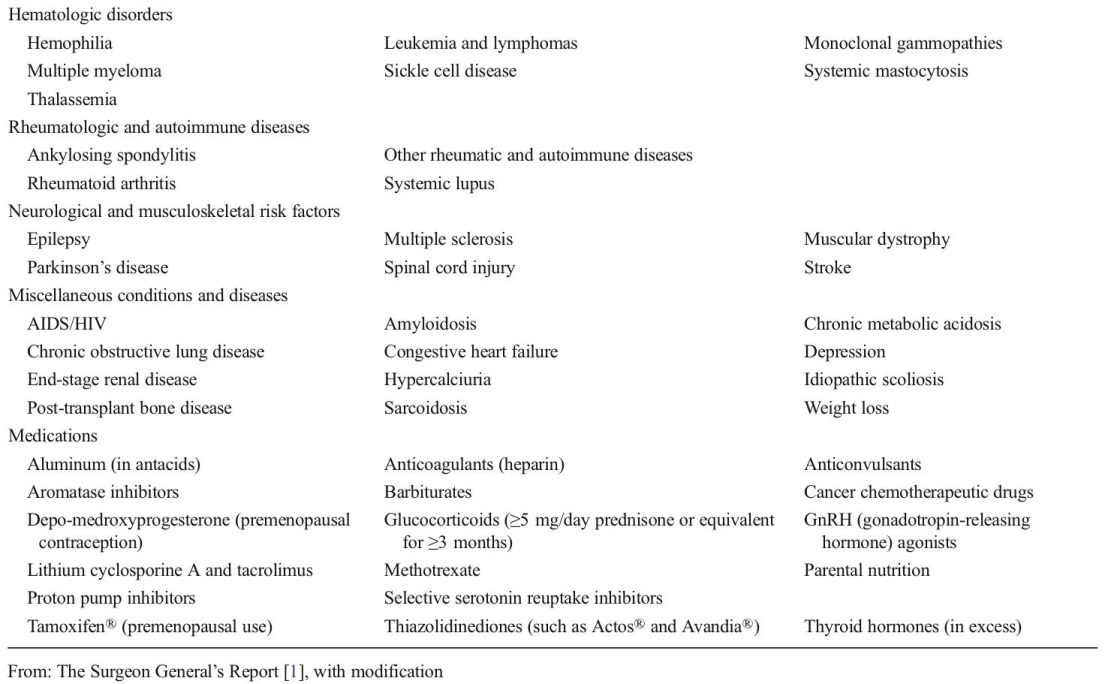 ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)
ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)