Neonatal Resuscitation:2010
American Heart Association Guidelines
for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care
นพ.ขจร อาชวานันทกุล
อ.เกษมศรี ศรีสุพรรณดิฐ
17 กุมภาพันธ์ 2554
Neonatal Resuscitation:2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care
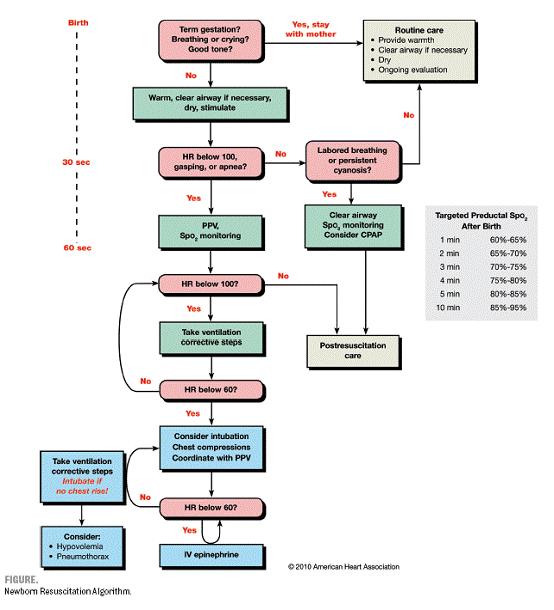
แนวปฏิบัติดังต่อไปนี้อ้างอิงจาก International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendation1 ซึ่งนอกจากจะนำไปใช้ปฏิบัติกับทารกแรกคลอดเป็นหลักแล้ว ยังสามารถนำมาประยุกต์ใช้ได้ในทารกขวบปีแรก
ทารกแรกคลอดประมาณร้อยละ10 มีความจำเป็นจะต้องได้รับการช่วยหายใจ (ventilation) และน้อยกว่าร้อยละ1จำเป็นต้องได้รับการกู้ชีพ (resuscitation)2,3 หากดูตามร้อยละแล้วอาจพบว่าทารกส่วนน้อยเท่านั้นที่ต้องการการช่วยเหลือหลังคลอด แต่เนื่องจากอัตราการคลอดที่ค่อนข้างสูงหากดูตามจำนวน จะพบว่าทารกจำนวนไม่น้อยที่ต้องการช่วยเหลือหลังคลอด
ทารกแรกคลอดที่ไม่จำเป็นต้องทำการกู้ชีพสามารถประเมินได้จาก 3 ลักษณะดังต่อไปนี้
1. คลอดครบกำหนดหรือไม่
2. ร้องหรือหายใจหรือไม่
3. muscle tone ดีหรือไม่
หากพบว่าดีทั้ง 3 ลักษณะดังกล่าว ให้จัดอยู่ในกลุ่มที่ไม่ต้องทำการกู้ชีพ ไม่จำเป็นต้องแยกทารกจากมารดา ให้เช็ดตัวให้แห้ง สัมผัสแบบผิวหนังต่อผิวหนังกับมารดา (skin-to-skin) ห่อตัวเพื่อรักษาความอบอุ่น และสังเกตการหายใจ การเคลื่อนไหว และ สีผิวหนังต่อไป
หากมีลักษณะใดลักษณะหนึ่งที่ผิดปกติ ทารกควรได้รับการช่วยเหลือตามขั้นตอนดังต่อไปนี้
ก. ดูแลเบื้องต้น (ให้ความอบอุ่น, เปิดทางเดินหายใจหากจำเป็น, เช็ดตัวให้แห้ง, กระตุ้น)
ข. ช่วยหายใจ
ค. กดหน้าอกนวดหัวใจ
ง. ให้ epinephrine และ/หรือ volume expansion
ใน 60 วินาที ทารกควรได้รับการดูแลเบื้องต้น ประเมินซ้ำ และเริ่มช่วยหายใจหากจำเป็น
ในการพิจารณาว่าทารกควรได้รับการดูแลในขั้นต่อไปหรือไม่นั้น สามารถประเมินได้จาก 2 สัญญาณชีพ คือ การหายใจ (ไม่หายใจ – apnea, หายใจหอบ – gasping, หายใจแรงหรือหายใจตามปกติ – labored or unlabored breathing) และอัตราการเต้นของหัวใจ (มากกว่าหรือน้อยกว่า 100 ครั้งต่อนาที) ในการประเมินอัตราการเต้นของหัวใจนั้น สามารถทำได้จากการฟังเสียงหัวใจเต้นที่หน้าอก (precordeal pulse) เป็นระยะ หรือประเมินโดยการจับชีพจรจากสายสะดือก็ได้4,5
การใช้เครื่อง pulse oximeter จะช่วยให้สามารถประเมินชีพจรได้อย่างต่อเนื่อง โดยไม่ขัดขวางการกู้ชีพแต่การจะติดตั้งเครื่องดังกล่าว อาจต้องใช้เวลา 1-2 นาที และอาจจะใช้การได้ไม่ดีนัก ในภาวะ poor cardiac output หรือ poor perfusion เมื่อมีการทำ positive-pressure ventilation หรือมีการให้ออกซิเจน ควรมีการประเมิน 3 สัญญาณชีพคือ อัตราการเต้นของหัวใจ, การหายใจ และ state of oxygenation โดย state of oxygenation สามารถประเมินจาก pulse oximeter ซึ่งจะกล่าวในรายละเอียดต่อไปภายหลัง สิ่งที่ใช้ประเมินการตอบสนองต่อการกู้ชีพได้ไวที่สุดคือการเพิ่มขึ้นของอัตราการเต้นของหัวใจ
การเตรียมความพร้อมสำหรับการกู้ชีพ
การเฝ้าระวัง เตรียมพร้อม และสามารถลงมือปฏิบัติได้อย่างถูกต้อง นับเป็นสิ่งสำคัญต่อความสำเร็จของการกู้ชีพทารกแรกคลอด โดยในทุกการคลอด ควรมีบุคคลอย่างน้อย 1 คนรับผิดชอบในการดูแลทารกแรกคลอด โดยบุคคลดังกล่าวต้องมีความสามารถในการทำการกู้ชีพเบื้องต้น ซึ่งได้แก่การให้ positive-pressure ventilation และการกดหน้าอกนวดหัวใจได้ และบุคคลนั้นหรือมีบุคคลอื่นซึ่งสามารถทำการกู้ชีพโดยสมบูรณ์ได้แก่ การใส่ท่อช่วยหายใจ (endotracheal intubation) และการให้ยาอื่นๆที่จำเป็น พร้อมให้การช่วยเหลือได้อย่างทันท่วงที6
ในกรณีที่ทราบล่วงหน้าว่ามีความเสี่ยงในการทำการกู้ชีพทารกแรกคลอด ก่อนที่ทารกจะคลอด ควรมีการเตรียมบุคลากรที่มีความชำนาญ และอุปกรณ์ที่จำเป็นไว้ล่วงหน้า7
ในกรณีการคลอดก่อนกำหนด ต้องมีการเตรียมความพร้อมมากเป็นพิเศษ เนื่องจากทารกคลอดก่อนกำหนดอาจมีปัญหาในหลายกรณีเช่น ปอดยังไม่เจริญสมบูรณ์ ทำให้การช่วยหายใจทำได้ยาก และมีความเสี่ยงที่ปอดจะได้รับบาดเจ็บจาก positive-pressure ventilation ได้มากกว่า , เส้นเลือดในสมองเปราะบาง แตกได้ง่ายกว่า, ผิวหนังบาง ทำให้สูญเสียความร้อนได้ง่ายกว่า, มีความเสี่ยงต่อการติดเชื้อสูงกว่า, ปริมาณเลือดในร่างกายน้อย ทำให้เกิดความเสี่ยงต่อ hypovolumic shock ได้ง่ายกว่า
ขั้นตอนการดูแลเบื้องต้น
ขั้นตอนการดูแลเบื้องต้นในการกู้ชีพได้แก่ การให้ความอบอุ่น โดยจัดเด็กให้อยู่ใต้เครื่องให้ความอบอุ่น จัดศีรษะให้อยู่ในท่า “sniffing” เพื่อเปิดทางเดินหายใจ ทำทางเดินหายใจให้โล่งด้วย bulb syringe หรือ suction catheter ถ้าจำเป็น เช็ดตัวให้แห้ง และกระตุ้นให้เด็กร้อง หรือหายใจ
มีการศึกษาเกี่ยวกับขั้นตอนการดูแลเบื้องต้น ได้สรุปไว้ดังนี้
การควบคุมอุณหภูมิ
ในทารกคลอดก่อนกำหนดที่มีน้ำหนักน้อยมาก (น้อยกว่า 1,500 กรัม) มักเกิดภาวะอุณหภูมิต่ำแม้จะมีการป้องกันการสูญเสียความร้อนด้วยวิธีทั่วๆไปแล้วก็ตาม8 ด้วยเหตุนี้จึงควรใช้วิธีอื่นๆเพิ่มเติมด้วย ได้แก่ ปรับอุณหภูมิห้องคลอดให้อยู่ที่ 26oC, 9 ห่อทารกด้วยแผ่นพลาสติก (ชนิดห่ออาหาร หรือใช้ในการแพทย์ ที่กันความร้อนได้)10,11 วางทารกบนเบาะให้ความร้อน (exothermic mattress)12 ใต้ต่อเครื่องให้ความร้อน (radiant heat)13 และต้องมีการติดตามอุณหภูมิทารกอย่างใกล้ชิด
มีการรายงานถึงทารกที่เกิดจากมารดามีไข้ พบว่ามีความเสี่ยงต่อการเกิด neonatal respiratory depression, neonatal seizure และ cerebral palsy สูงกว่าทารกทั่วไป14,15 จากการศึกษาในสัตว์ทดลอง พบว่า ภาวะอุณหภูมิที่สูงเกินระหว่าง หรือภายหลัง ischemia มีความสัมพันธ์กับอันตรายต่อสมองที่เพิ่มขึ้น การลดอุณหภูมิจะช่วยลดอันตรายต่อสมองได้16 ดังนั้นจึงควรรักษาอุณหภูมิให้อยู่ในระดับที่พอเหมาะ ไม่มากหรือน้อยจนเกินไป
การทำให้ทางเดินหายใจโล่ง
กรณีน้ำคร่ำใส
มีหลักฐานว่า nasopharynx suction อาจกระตุ้นให้เกิดภาวะหัวใจเต้นช้าระหว่างการกู้ชีพได้17,18 และ tracheal suction ในทารกที่ใส่ท่อช่วยหายใจต่อกับเครื่องช่วยหายใจใน neonatal intensive care unit (NICU) มีความสัมพันธ์กับการลดลงของ pulmonary compliance และ pulmonary oxygenation นอกจากนี้หากทำเป็นกิจวัตรโดยไม่จำเป็น (ไม่มีสารคัดหลั่งในจมูกหรือปาก) ยังทำให้ลด cerebral blood flow velocity อีกด้วย 19,20 อย่างไรก็ตามในกรณีที่มีสารคัดหลั่งชัดเจน suction จะช่วยลด respiratory resistance21 ได้ ดังนั้นจึงแนะนำ suction ทันทีภายหลังการคลอด (ด้วย bulb syringe) เฉพาะในทารกที่มีการอุดตันทางเดินหายใจชัดเจน หรือในทารกที่ต้องการ positive-pressure ventilation เท่านั้น
กรณีน้ำคร่ำมีขี้เทาปน
การสำลักขี้เทาก่อนคลอด, ระหว่างคลอด หรือระหว่างการกู้ชีพเป็นสาเหตุของ meconium aspiration syndrome (MAS) ในอดีตได้มีการพยายามใช้หลากหลายวิธีเพื่อลดการเกิด MAS เช่น การใช้ oropharyngeal suction ก่อนคลอดไหล่ จนกระทั่งมีการศึกษาพบว่าวิธีดังกล่าวไม่มีประโยชน์22 มีการแนะนำให้ใส่ท่อช่วยหายใจ และ direct tracheal suction ในทารกทุกรายที่มีน้ำคร่ำปนขี้เทา จนกระทั่งมีการศึกษาพบว่าวิธีดังกล่าวไม่มีประโยชน์ในกรณีที่ทารกแรกเกิดตื่นตัวดี23 (vigorous) และแม้ว่าในกรณีที่เด็กไม่ตื่นตัว จะมีความเสี่ยงต่อการเกิด MAS เพิ่มขึ้น24,25 แต่ก็พบว่าการทำ tracheal suction ก็ไม่ได้ลดการเกิด MAS หรือการเสียชีวิตในทารกกลุ่มนี้แต่อย่างใด26,27 มีเพียงหลักฐานเดียวที่พบว่า direct tracheal suction มีประโยชน์ในทารกน้ำคร่ำปนขี้เทา อ้างอิงจากากการศึกษาในอดีต ซึ่งต่อมาพบว่าการศึกษาดังกล่าวมี selective bias ในกลุ่มทดลองที่ใส่ท่อช่วยหายใจ28-30
เนื่องจากยังคงไม่มีการศึกษาที่น่าเชื่อถือใดๆในการสนับสนุนให้เปลี่ยนแนวปฏิบัติที่ใช้อยู่ในปัจจุบัน ดังนั้นจึงยังคงแนะนำให้ทำ endotracheal suction อยู่ ในทารกที่มีน้ำคร่ำปนขี้เทาและไม่ตื่นตัว อย่างไรก็ตามหากการใส่ท่อช่วยหายใจใช้เวลายาวนานหรือไม่สำเร็จ ควรให้การช่วยหายใจด้วย bag-mask ก่อน โดยเฉพาะในกรณีที่ทารกหัวใจเต้นช้า
การประเมินความต้องการและการให้ออกซิเจน
มีหลักฐานสนับสนุนว่า ระดับออกซิเจนในกระแสเลือดที่ต่ำกว่าปกติ ในช่วง 10นาทีแรกคลอด ไม่ได้มีผลเสียต่อทารก โดยทั่วไปค่า oxyhemoglobin saturation จะอยู่ที่ 70-80% ในระยะเวลาหนึ่งหลังคลอด ส่งผลให้ทารกมีภาวะ cyanosis ได้เป็นปกติในช่วงเวลานี้ มีการศึกษาพบว่าสีผิวของทารกในระยะแรกคลอด ไม่ใช่ตัวชี้วัดสำหรับ oxyhemoglobin saturation ที่ดี และการไม่พบภาวะ cyanosis ก็ไม่ได้หมายความว่า state of oxygenation ของทารกอยู่ในระดับปกติ
การให้ ออกซิเจนที่เหมาะสม ถือเป็นอีกส่วนสำคัญในการกู้ชีพทารกแรกคลอดเพราะการให้ออกซิเจนไม่ว่าจะมากหรือน้อยจนเกินไป ล้วนแต่เป็นอันตรายต่อทารก
Pulse Oximetry
มีหลายการศึกษาได้รายงานเกี่ยวกับระดับ oxygen saturation ที่เหมาะสมของทารก ทั้งจากที่คลอดทางช่องคลอดและผ่าตัดคลอด ในช่วงเวลาต่างกัน ได้ผลดังตารางที่แสดงไว้ในแนวปฎิบัติ31-36
ปัจจุบันมีเครื่อง pulse oximeter รุ่นใหม่ๆ ซึ่งออกแบบ probe ให้มีขนาดเฉพาะกับทารก สามารถอ่านผลได้ภายในเวลา 1-2 นาที37-39 โดยเครื่องเหล่านี้สามารถใช้ได้ดีทั้งในทารกคลอดครบกำหนด และก่อนกำหนด ไม่ว่าจะต้องการการกู้ชีพหรือไม่ ตราบใดที่ cardiac output ยังคงดีเพียงพอที่เครื่องจะสามารถจับชีพจรได้ โดยแนะนำให้วัดระดับออกซิเจนทุกครั้ง ที่คาดว่าจะต้องทำการกู้ชีพ,2 ให้ positive-pressure ventilation, มี cyanosis เป็นเวลานาน หรือเมื่อมีการให้ออกซิเจน
ตำแหน่งที่เหมาะสมในการติด probe แนะนำเป็นบริเวณข้อมือ หรือฝ่ามือด้านในข้างขวา (wrist or medial surface of palm) 39 และพบว่าการติด probe ที่ทารกก่อน แล้วจึงค่อยต่อ probe เข้ากับเครื่องจะช่วยให้อ่านผลได้เร็วที่สุด38
การให้ออกซิเจน
มีการศึกษาพบว่าการกู้ชีพโดยใช้ความเข้มข้นที่ room air ให้อัตราการรอดชีวิตที่สูงกว่าใช้ออกซิเจนเข้มข้น 100%40,41 แต่ยังไม่มีการศึกษาเปรียบเทียบระหว่างความเข้มข้นออกซิเจนที่ระดับอื่นๆนอกเหนือจากนี้ และมีการศึกษาหนึ่งพบว่า การเริ่มต้นกู้ชีพทารกคลอดก่อนกำหนดด้วยออกซิเจนแบบ room air แล้วจึงค่อยปรับความเข้มข้นภายหลัง มีโอกาสเกิดภาวะระดับออกซิเจนในกระแสเลือดต่ำหรือสูงกว่าปกติได้น้อยกว่าเริ่มต้นโดยใช้ความเข้มข้นที่ room air หรือออกซิเจนเข้มข้น 100%42
เนื่องจากข้อมูลในปัจจุบันยังคงมีจำกัด จึงมีการแนะนำว่าในการกู้ชีพทารกแรกคลอดไม่ว่าจะคลอดครบหรือก่อนกำหนดควรให้ oxygen saturation อยู่ในช่วงที่เหมาะสมตามตารางที่แสดงไว้ในแนวปฏิบัติ โดยเริ่มการกู้ชีพโดยใช้ความเข้มข้นที่ room air หรือออกซิเจนปน แล้วจึงค่อยปรับความเข้มข้นจนกระทั่งได้ SpO2 อยู่ในระดับที่ต้องการ หากไม่สามารถปรับความเข้มข้นของออกซิเจนได้ ควรเริ่มโดยใช้ความเข้มข้นที่ room air ก่อน หากทารกมีภาวะหัวใจเต้นช้า (น้อยกว่า 60 ครั้งต่อนาที) ภายหลังการกู้ชีพด้วยออกซิเจนที่ระดับต่ำนานมากกว่า 90 วินาที จึงค่อยปรับความเข้มข้นเป็น 100% จนกว่าอัตราการเต้นของหัวใจจะกลับเป็นปกติ
Positive-Pressure Ventilation (PPV)
ให้พิจารณาเริ่ม positive-pressure ventilation หากภายหลังการดูแลเบื้องต้นแล้วทารกยังคงไม่หายใจ, หายใจเหนื่อย หรืออัตราการเต้นของหัวใจยังคงน้อยกว่า 100 ครั้งต่อนาที
การเริ่มหายใจ และการช่วยหายใจ
การเริ่มหายใจเข้า ไม่ว่าจะหายใจเองหรือช่วยหายใจ จะทำให้เกิด functional residual capacity (FRC)43-46 สำหรับความดัน, ระยะเวลาการหายใจเข้า (inflation time) และ flow rate ที่เหมาะสมจากการทำ positive-pressure ventilation ระหว่างการกู้ชีพเพื่อให้ได้ FRC ที่เหมาะสม ยังไม่เป็นที่ทราบแน่ชัด มีการศึกษาในสัตว์ทดลองพบว่าปอดของทารกคลอดก่อนกำหนด เกิดการบาดเจ็บได้ง่ายจากการให้ inflation ปริมาณมากทันทีหลังคลอด47,48 การช่วยหายใจมักทำที่อัตรา 40-60 ครั้งต่อนาที แต่ยังไม่มีการศึกษาถึงผลลัพธ์จากการช่วยหายใจที่อัตราอื่นๆ
ประสิทธิภาพของการช่วยหายใจ สามารถประเมินได้จากอัตราการเต้นของหัวใจ49 หากอัตราการเต้นของหัวใจไม่ดีขึ้น ควรประเมินการเคลื่อนไหวของผนังทรวงอก สำหรับความต้องการ initial peak inflation pressure นั้นค่อนข้างแปรปรวน และทำนายได้ยาก ดังนั้นจึงควรปรับตามความเหมาะสมในทารกแต่ละราย และประเมินการตอบสนองจากอัตราการเต้นของหัวใจและการเคลื่อนไหวของผนังทรวงอกเป็นหลัก และควรมีการวัด inflation pressure ควบคู่ไปด้วย โดยทั่วไป inflation pressure ที่ 20 cmH2O มักเพียงพอ แต่ในบางกรณี เช่น ทารกคลอดครบกำหนดที่ไม่สามารถหายใจได้เอง อาจต้องใช้ inflation pressure 30-40 cmH2O ขึ้นไปจึงจะเพียงพอ44,46,50 ดังนั้นอาจกล่าวได้ว่า จุดมุ่งหมายของการวัด inflation pressure คือเพื่อให้ทราบค่าความดันที่น้อยที่สุด ที่สามารถเพิ่มอัตราการเต้นของหัวใจได้ อย่างไรก็ตาม ยังไม่มีข้อแนะนำเกี่ยวกับ inflation time ที่เหมาะสมชัดเจน โดยสรุป การช่วยหายใจควรทำที่อัตรา 40-60 ครั้งต่อนาที เพื่อเพิ่ม หรือคงอัตราการเต้นของหัวใจให้มากกว่า 100 ครั้งต่อนาที
สำหรับการใช้ colorimetric CO2 detector ระหว่างการช่วยหายใจด้วย mask มีรายงานว่าอาจมีประโยชน์ในแง่ของการตรวจสอบภาวะอุดตันทางเดินหายใจ51,52 อย่างไรก็ตามยังไม่มีการยืนยันถึงประโยชน์ที่เหนือกว่า ในการนำ CO2 detector มาใช้เมื่อเปรียบเทียบกับการประเมินจากจากการตรวจร่างกายเพียงอย่างเดียว
End-Expiratory Pressure
มีผู้เชี่ยวชาญหลายท่าน แนะนำให้ใช้ continuous positive airway pressure (CPAP) กับทารกที่สามารถหายใจได้เอง แต่ยังมีการหายใจติดขัดภายหลังการคลอด อย่างไรก็ตามในเรื่องนี้ ได้มีการศึกษาเฉพาะในทารกคลอดก่อนกำหนดเท่านั้น การนำ CPAP มาใช้ พบว่าช่วยลดอัตราการใส่ท่อช่วยหายใจและเครื่องช่วยหายใจ แต่เพิ่มอัตราการเกิด pneumothorax53 จึงแนะนำให้เลือกใช้ CPAP หรือการใส่ท่อช่วยหายใจ และเครื่องช่วยหายใจ ในกรณีทารกคลอดก่อนกำหนดและมีปัญหา respiratory distress ส่วนในกรณีทารกคลอดครบกำหนดและมีปัญหา respiratory distress นั้น ยังไม่มีหลักฐานที่สนับสนุนหรือคัดค้านในการใช้ CPAP
แม้ว่า positive end-expiratory pressure (PEEP) มักถูกใช้บ่อยในการใช้เครื่องช่วยหายใจใน NICU แต่ก็ยังไม่มีการศึกษาที่ยืนยันประโยชน์ของการใช้ PEEP ที่แน่ชัด อย่างไรก็ตาม หากเครื่องช่วยหายใจสามารถตั้ง PEEP ได้ ก็แนะนำให้ใช้และคิดว่าน่าจะเป็นประโยชน์
อุปกรณ์ช่วยหายใจ
Laryngeal Mask Airway
Laryngeal mask airway ได้ถูกออกแบบให้มีขนาดที่เหมาะสมกับทารกที่มีน้ำหนักมากกว่า2,000 กรัม หรืออายุครรภ์มากกว่า 34 สัปดาห์54-56 แต่ยังมีข้อมูลที่จำกัด สำหรับทารกที่มีน้ำหนักน้อยกว่า 2,000 กรัม หรืออายุครรภ์น้อยกว่า 34 สัปดาห์54-56 พิจารณาให้ใช้ laryngeal mask ในกรณีที่ไม่สามารถใช้ facemask หรือใส่ท่อช่วยหายใจได้ และยังไม่มีข้อมูลสำหรับการใช้ laryngeal mask ในกรณีน้ำคร่ำมีมีขี้เทาปน, ระหว่างกดหน้าอกนวดหัวใจ หรือเพื่อให้ยาในกรณีฉุกเฉิน
การใส่ท่อช่วยหายใจ
การใส่ท่อช่วยหายใจระหว่างการกู้ชีพสามารถทำได้หลายช่วงดังต่อไปนี้
ก. ใส่ตั้งแต่ต้น ในกรณีทารกมีน้ำคร่ำปนขี้เทาปนและไม่ตื่นตัว
ข. ใส่เมื่อช่วยหายใจด้วย bag-mask ไม่สำเร็จ หรือคาดว่าจะต้องช่วยหายใจเป็นเวลายาวนาน
ค. ใส่เมื่อกดหน้าอกนวดหัวใจ
ง. ใส่ในกรณีพิเศษอื่นๆเช่น congenital diaphragmatic hernia หรือ extremely low birth weight
อัตราการเต้นของหัวใจที่เพิ่มขึ้นภายหลังการใส่ท่อช่วยหายใจและให้ positive-pressure ventilation เป็นตัวบ่งชี้ที่ดีว่าท่อช่วยหายใจอยู่ในตำแหน่งที่ถูกต้อง49 และการช่วยหายใจประสบผลสำเร็จ การตรวจ CO2 จากลมหายใจออก ใช้ยืนยันตำแหน่งท่อช่วยหายใจได้เช่นกัน57-60 โดยหากตรวจพบ CO2 แสดงว่าท่อช่วยหายใจอยู่ในทางเดินหายใจ แต่หากตรวจไม่พบ CO2 อาจเป็นไปได้ว่าท่อช่วยหายใจอยู่ในทางเดินอาหาร57-61 ทั้งนี้ทั้งนั้นควรระวังในกรณีที่ทารกมี pulmonary blood flow น้อย หรือไม่มีเลย เพราะอาจทำให้ตรวจไม่พบ CO2 แม้ว่าตำแหน่งท่อช่วยหายใจจะอยู่ทางเดินหายใจแล้ว
ตัวชี้วัดอื่นๆที่ใช้ในการบอกตำแหน่งของท่อช่วยหายใจได้แก่ condensation ภายในท่อช่วยหายใจ, การเคลื่อนไหวของทรวงอก, ฟังได้เสียงการหายใจเท่ากันทั้ง2ข้าง เป็นต้น
การกดหน้าอกเพื่อนวดหัวใจ (Chest Compression)
อัตราการเต้นของหัวใจที่น้อยกว่า 60 ครั้งต่อนาที ภายหลังได้รับการช่วยหายใจด้วยออกซิเจนที่เหมาะสมนาน 30 วินาที เป็นข้อบ่งชี้ในการเริ่มการกดหน้าอกเพื่อนวดหัวใจ เนื่องจากการช่วยหายใจนับเป็นส่วนที่สำคัญที่สุดสำหรับการกู้ชีพทารกแรกคลอด ดังนั้นก่อนเริ่มการกดหน้าอกเพื่อนวดหัวใจ จึงควรแน่ใจว่าได้มีการช่วยหายใจที่เหมาะสมแล้ว
การกดควรทำที่ตำแหน่ง 1 ใน 3 จากขอบล่างของ sternum และกดที่ความลึกประมาณ 1 ใน 3 ของความยาวในแนวหน้า-หลังของทรวงอก62-64 วิธีการกดหน้าอกเพื่อนวดหัวใจแนะนำให้ทำตาม 2 วิธีดังนี้
- 2 thumb-encircling hands technique โดยใช้ฝ่ามือทั้ง 2 ข้างประคองรอบทรวงอกของทารก กดหน้าอกทารกด้วยนิ้วโป้งทั้ง 2 ข้าง
- 2-finger technique โดยใช้ 2 นิ้ว กดบริเวณหน้าอกและใช้ฝ่ามืออีกข้างรองด้านหลังของทารก
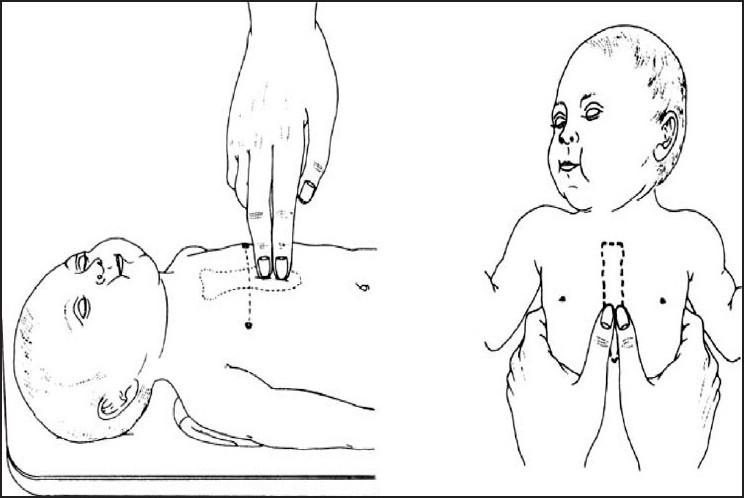
ภาพที่1:วิธีการกดหน้าอกเพื่อนวดหัวใจ 2-finger technique (ซ้าย), 2 thumb-encircling hands technique (ขวา)
แนะนำให้ใช้ 2 thumb-encircling hands technique กับทารกแรกเกิด เนื่องจากเป็นวิธีที่ให้ peak systolic pressure และ coronary perfusion pressure ที่สูงกว่า65-69 ในขณะที่ 2-finger technique อาจสะดวกกว่าในกรณีที่ต้องใช้พื้นที่ในการทำหัตถการบริเวณสะดือ เช่นการใส่ umbilical catheter อย่างไรก็ตาม หากทารกใส่ท่อช่วยหายใจแล้ว และมีผู้ช่วยยืนอยู่บริเวณศีรษะเด็กก็สามารถทำ 2 thumb-encircling hands technique โดยไม่ขัดขวางการทำหัตถการบริเวณสะดือเท่าใดนัก
การกดหน้าอกเพื่อนวดหัวใจควรสอดคล้องไปกับการช่วยหายใจ70 โดยจังหวะที่ปล่อยนิ้วควรให้ทรวงอกสามารถขยายได้จนเต็มที่ โดยให้นิ้วที่ใช้กดยังคงแนบอยู่กับหน้าอกทารกตลอดเวลา จังหวะในการช่วยที่ได้ผลดีที่สุดควรมีอัตราของการกดต่อการช่วยหายใจเท่ากับ 3:1 คือ กดหน้าอกได้ 90 ครั้ง และช่วยหายใจได้ 30 ครั้ง รวมเป็น 120 ครั้ง ใน 1 นาที ใช้เวลาห่างของแต่ละครั้งประมาณครึ่งวินาที
การศึกษาในสัตว์ทดลอง และกลุ่มทดลองที่ไม่ใช่ทารกแรกเกิดพบว่า อัตราการกดหน้าอกเพื่อนวดหัวใจต่อการช่วยหายใจที่ 15:2 หรือ 30:2 จะได้ผลดีกว่า ในกรณีที่ทราบแน่ชัดว่า ภาวะหัวใจหยุดเต้นมีสาเหตุมาจากหัวใจเป็นหลัก71 การศึกษาในเด็กเล็กพบว่าหากภาวะหัวใจหยุดเต้นมีสาเหตุจากอย่างอื่นที่ไม่ใช่จากหัวใจ แนะนำให้ทำการกู้ชีพโดยเน้นที่การช่วยหายใจเป็นสำคัญจะได้ผลดีกว่า จึงอาจสรุปได้ว่า แนะนำให้ใช้อัตราการกดหน้าอกเพื่อนวดหัวใจต่อการช่วยหายใจที่ 3:1 ใน การกู้ชีพทารกแรกคลอดที่สงสัยสาเหตุจากการหายใจ และพิจารณาปรับเพิ่มเช่น 15:2 ในกรณีที่สงสัยสาเหตุจากหัวใจ
ควรประเมินการหายใจ, อัตราการเต้นของหัวใจ และระดับออกซิเจนเป็นระยะ และทำการกดหน้าอกเพื่อนวดหัวใจควบคู่ไปกับการช่วยหายใจต่อเนื่องไปจนกว่าอัตราการเต้นของหัวใจจะมากกว่า 60 ครั้งต่อนาที และควรหลีกเลี่ยงเหตุใดๆที่อาจขัดขวางการกดหน้าอกเพื่อนวดหัวใจ
การให้ยา
การให้ยาในการกู้ชีพทารกแรกคลอดพบได้ไม่บ่อยนัก ภาวะหัวใจเต้นช้าในทารกแรกคลอดมักมีสาเหตุจากการหายใจที่ไม่เพียงพอ หรือภาวะออกซิเจนในกระแสเลือดต่ำเป็นเวลานาน ซึ่งการช่วยหายใจถือเป็นขั้นตอนที่สำคัญที่สุดในการแก้ไขภาวะดังกล่าว อย่างไรก็ตาม หากอัตราการเต้นของหัวใจยังคงต่ำกว่า 60 ครั้งต่อนาที แม้ว่าจะได้รับการช่วยหายใจที่เหมาะสม (มักจะต้องใส่ท่อช่วยหายใจ) ด้วยออกซิเจนเข้มข้น 100% และการกดหน้าอกเพื่อนวดหัวใจแล้ว อาจมีความจำเป็นต้องให้ epinephrine หรือ volume expansion หรือทั้ง 2 อย่าง สำหรับ buffer, narcotic antagonist หรือ vasopressor อาจมีประโยชน์ภายหลังการกู้ชีพแต่ยังคงไม่แนะนำให้ใช้ตั้งแต่อยู่ในห้องคลอด
อัตราและขนาดการให้ epinephrine
แนะนำให้ epinephrine ทางหลอดเลือดดำ ในแนวปฏิบัติเดิมเคยแนะนำให้ให้ epinephrine ขนาดแรกทางท่อช่วยหายใจ เนื่องจากสามารถให้ได้รวดเร็วกว่าการให้ทางหลอดเลือดดำ แต่จากการศึกษาในสัตว์ทดลองพบว่า หากให้ epinephrine ทางท่อช่วยหายใจจะต้องใช้ขนาดยาที่มากกว่าที่แนะนำไว้ในแนวปฏิบัติเดิมจึงจะได้ผล72,73 หากใช้ตามขนาดที่แนะนำจะไม่ก่อให้เกิดผลใด74 เนื่องจากยังไม่มีข้อมูลที่สนับสนุนการให้ epinephrine ทางท่อช่วยหายใจ ปัจจุบันจึงแนะนำให้ epinephrine ทางหลอดเลือดดำโดยเร็วที่สุดเท่าที่จะสามารถทำได้
ขนาดที่แนะนำทางหลอดเลือดดำคือ 0.01-0.03 มก./กก. ต่อการให้หนึ่งครั้ง การให้ในขนาดที่สูงกว่าที่แนะนำอาจทำให้เกิดความดันโลหิตสูง, ลดการทำงานของกล้ามเนื้อหัวใจ และอาจส่งผลเสียต่อการทำงานของระบบประสาท75-78 หากต้องการให้ epinephrine ทางท่อช่วยหายใจ อาจต้องมีการปรับขนาดยาให้สูงขึ้น เป็น 0.05-0.1 มก./กก. แต่ยังไม่มีการรับรองในแง่ของผลลัพธ์ หรือความปลอดภัยในการให้ทางช่องทางนี้ ในการให้ยาทั้ง 2 ช่องทาง แนะนำให้ใช้ epinephrine ที่ความเข้มข้น 1:10,000 (0.1 มก./มล.)
Volume expansion
ในกรณีที่มี หรือคาดว่ามีการเสียเลือดเช่น ผิวหนังมีสีซีด, poor perfusion, ชีพจรเบา และอัตราการเต้นของหัวใจไม่ตอบสนองต่อการกู้ชีพ ควรเริ่มให้ volume expansion79 โดยแนะนำให้ใช้เป็น isotonic crystalloid solution หรือเลือด ขนาดที่แนะนำคือ 10 มก./กก. โดยอาจให้ซ้ำในทารกกคลอดก่อนกำหนด และควรระวังไม่ให้ในอัตราเร็วจนเกินไปเพราะอาจทำให้เกิด intraventricular hemorrhage ได้
การดูแลภายหลัง resuscitation
ทารกที่ผ่านการกู้ชีพมีโอกาสแย่ลงภายหลังจากที่สัญญาณชีพกลับสู่ภาวะปกติแล้ว ดังนั้นจึงควรจัดให้ทารกอยู่ในสถานที่ที่สามารถตรวจติดตามและเฝ้าระวังได้อย่างใกล้ชิด
Naloxone
ไม่แนะนำให้ใช้ naloxone เป็นส่วนหนึ่งของการกู้ชีพเบื้องต้นภายในห้องคลอด สำหรับทารกแรกเกิดที่มีภาวะ respiratory depression ควรมุ่งความสำคัญไปที่การกู้อัตราการเต้นของหัวใจ และระดับออกซิเจนโดยการช่วยหายใจมากกว่า
Glucose
แม้ว่าจะยังไม่ทราบระดับที่แน่ชัด แต่พบว่าทารกแรกคลอดที่มีระดับน้ำตาลในเลือดต่ำ
มีความเสี่ยงต่อการบาดเจ็บของสมองและส่งผลเสียภายหลังจากที่มีภาวะการขาดออกซิเจนหรือขาดเลือด80,81 ในทางกลับกันระดับกลูโคสที่สูงภายหลังภาวะขาดออกซิเจนหรือขาดเลือด ไม่ได้ส่งผลเสียใดๆ82-84 ดังนั้นจึงแนะนำให้ให้กลูโคสทางหลอดเลือดดำเร็วที่สุดเท่าที่จะสามารถทำได้ ภายหลังการกู้ชีพเพื่อหลีกเลี่ยงภาวะน้ำตาลในเลือดต่ำ
Induced Therapeutic Hypothermia
มีหลายการศึกษาพบว่าการควบคุมอุณหภูมิของทารกแรกคลอดที่อายุครรภ์มากกว่า 36 สัปดาห์ ที่มี moderate to severe hypoxic-ischemic encephalopathy ให้อยู่ในระดับต่ำที่ 33.5oC-34.5oC มีผลช่วยลดความพิการและความผิดปกติของพัฒนาการทางสมองได้อย่างมีนัยสำคัญ85-89 โดยเริ่มควบคุมให้อยู่ในอุณหภูมิต่ำที่ 6 ชั่วโมงหลังคลอด นาน 72 ชั่วโมง จากนั้นจึงค่อยๆปรับสู่อุณหภูมิปกติอย่างช้าๆภายในเวลาอย่างน้อย 4 ชั่วโมง แต่ก็มีรายงานถึงผลเสียบางอย่างที่อาจพบได้จากการควบคุมอุณหภูมิดังกล่าว เช่น ภาวะเกล็ดเลือดต่ำ หรือความต้องการ inotropic support ที่มากขึ้น
แนวทางในการไม่ดำเนินการหรือการยุติการกู้ชีพ
แนวทางในการดูแลทารกที่อยู่ในภาวะก้ำกึ่งระหว่างความเป็นและความตาย หรือในภาวะที่มีแนวโน้มในการเกิดความพิการหรือเสียชีวิตสูง มีความแตกต่างกันไป ขึ้นอยู่กับข้อจำกัดด้านทรัพยากรในแต่ละพื้นที่
การไม่ดำเนินการกู้ชีพ
ในภาวะที่ทารกมีความเสี่ยงสูงที่จะเกิดความพิการหรือมีข้อจำกัดทางทรัพยากร และเป็นความเห็นที่ตรงกันระหว่างทีมผู้รักษาและผู้ปกครอง การพิจารณาไม่ดำเนินการกู้ชีพถือว่ายอมรับได้90-92 โดยมีข้อแนะนำดังต่อไปนี้
ก. ไม่ควรดำเนินการกู้ชีพในทารกที่มีอายุครรภ์, น้ำหนักแรกคลอด, ความพิการที่รุนแรงหรือมีแนวโน้มที่จะเสียชีวิตสูง เช่น อายุครรภ์น้อยกว่า 23 สัปดาห์ หรือน้ำหนักแรกคลอดน้อยกว่า 400 กรัม, ภาวะทารกไม่มีกระโหลกศีรษะ, ทารกมีโครโมโซมผิดปกติชนิดรุนแรง เช่น trisomy 13 เป็นต้น
ข. ควรดำเนินการกู้ชีพ ในกรณีที่ทารกมีแนวโน้มสูงที่จะรอดชีวิต หรือมีความพิการที่ไม่รุนแรง เช่น ทารกอายุครรภ์มากกว่า 25 สัปดาห์ และทารกที่มีความพิการแต่กำเนิดส่วนใหญ่
ค. ในภาวะที่พยากรณ์โรค และโอกาสรอดชีวิตที่ไม่แน่นอน หรือก้ำกึ่ง ความเห็นจากผู้ปกครองจะเป็นส่วนสำคัญในการช่วยตัดสินใจ และวางแผนการดูแลรักษา
ในการประเมินความเสี่ยงของการเสียชีวิตและความพิการควรอ้างอิงจากข้อมูลที่มีหลักฐานสนับสนุนเป็นสำคัญ
การยุติการกู้ชีพ
สามารถยุติการกู้ชีพได้ ในกรณีที่ทารกไม่มีการเต้นของหัวใจตั้งแต่แรกคลอด และยังคงไม่เต้นต่อเนื่องนาน 10 นาที93-95 หากต้องการดำเนินการกู้ชีพต่อ ควรพิจารณาเฉพาะในกรณีที่ทราบสาเหตุของการหยุดเต้นของหัวใจ, อายุครรภ์, ภาวะแทรกซ้อนที่ชัดเจน และผู้ปกครองสามารถยอมรับความเสี่ยงของความพิการที่อาจเกิดตามมาภายหลังได้
สรุป
การเฝ้าระวัง เตรียมพร้อม และสามารถลงมือปฏิบัติได้อย่างถูกต้อง นับเป็นสิ่งสำคัญต่อความสำเร็จของการกู้ชีพทารกแรกคลอด ดังนั้นการศึกษาแนวปฎิบัติให้เข้าใจ การเฝ้าระวังและการเตรียมพร้อมสำหรับการกู้ชีพทารกแรกคลอดในทุกๆการคลอด นับเป็นสิ่งสำคัญที่ควรมีในสูติแพทย์ทุกคน เพื่อที่จะสามารถดูแลทารกในภาวะฉุกเฉินได้อย่างถูกต้องและเหมาะสม
REFERENCES
1. 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Circulation. In Press
2. Perlman JM, Risser R. Cardiopulmonary resuscitation in the delivery room: associated clinical events. Arch Pediatr Adolesc Med. 1995;149:20 –25
3. Barber CA, Wyckoff MH. Use and efficacy of endotracheal versus intravenous epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. Pediatrics. 2006;118:1028 –1034
4. Owen CJ, Wyllie JP. Determination of heart rate in the baby at birth. Resuscitation.
2004;60:213–217
5. Kamlin CO, Dawson JA, O’Donnell CP, Morley CJ, Donath SM, Sekhon J, Davis PG. Accuracy of pulse oximetry measurement of heart rate of newborn infants in the delivery
room. J Pediatr. 2008;152:756 –760
6. Am Academy of Pediatrics, Am College of Obstetricians and Gynecologists. In: Lockwood
C, Lemons J, eds. Guidelines for Perinatal Care. 6th ed. Elk Grove Village, IL: Am Academy of Pediatrics;2007:205
7. Kattwinkel J, ed. Textbook of Neonatal Resuscitation. 6th ed. Elk Grove Village: Am Academy of Pediatrics; In Press
8. Cramer K, Wiebe N, Hartling L, Crumley E, Vohra S. Heat loss prevention: a systematic review of occlusive skin wrap for premature neonates. J Perinatol. 2005;25: 763–769
9. Kent AL, Williams J. Increasing ambient operating theatre temperature and wrapping in polyethylene improves admission temperature in premature infants. J Paediatr Child Health. 2008;44:325–331
10. Vohra S, Frent G, Campbell V, Abbott M, Whyte R. Effect of polyethylene occlusive skin wrapping on heat loss in very low birth weight infants at delivery: a randomized trial. J Pediatr. 1999;134:547–551
11. Vohra S, Roberts RS, Zhang B, Janes M, Schmidt B. Heat Loss Prevention (HeLP) in the delivery room: A randomized controlled trial of polyethylene occlusive skin wrapping in very preterm infants. J Pediatr. 2004;145:750 –753
12. Singh A, Duckett J, Newton T, Watkinson M. Improving neonatal unit admission temperatures in preterm babies: exothermic mattresses, polythene bags or a traditional approach? J Perinatol. 2010;30: 45– 49
13. Meyer MP, Bold GT. Admission temperatures following radiant warmer or incubator transport for preterm infants 28 weeks: a randomised study. Arch Dis Child Fetal Neonatal Ed. 2007;92:F295–F297
14. Petrova A, Demissie K, Rhoads GG, Smulian JC, Marcella S, Ananth CV. Association of maternal fever during labor with neonatal and infant morbidity and mortality. Obstet Gynecol. 2001;98:20 –27
15. Lieberman E, Lang J, Richardson DK, Frigoletto FD, Heffner LJ, Cohen A. Intrapartum maternal fever and neonatal outcome. Pediatrics. 2000;105(1 Pt 1):8 –13
16. Coimbra C, Boris-Moller F, Drake M, Wieloch T. Diminished neuronal damage in the rat brain by late treatment with the antipyretic drug dipyrone or cooling following cerebral ischemia. Acta Neuropathol. 1996;92:447– 453
17. Gungor S, Kurt E, Teksoz E, Goktolga U, Ceyhan T, Baser I. Oronasopharyngeal suction versus no suction in normal and term infants delivered by elective cesarean section: a prospective randomized controlled trial. Gynecol Obstet Invest. 2006; 61:9 –14
18. Waltman PA, Brewer JM, Rogers BP, May WL. Building evidence for practice: a pilot study of newborn bulb suctioning at birth. J Midwifery Womens Health. 2004;49: 32–38
19. Perlman JM, Volpe JJ. Suctioning in the preterm infant: effects on cerebral blood flow velocity, intracranial pressure, and arterial blood pressure. Pediatrics. 1983; 72:329 –334
20. Simbruner G, Coradello H, Fodor M, Havelec L, Lubec G, Pollak A. Effect of tracheal suction on oxygenation, circulation, and lung mechanics in newborn infants. Arch Dis Child. 1981;56:326 –330
21. Prendiville A, Thomson A, Silverman M. Effect of tracheobronchial suction on respiratory resistance in intubated preterm babies. Arch Dis Child. 1986;61:1178 –1183
22. Vain NE, Szyld EG, Prudent LM, Wiswell TE, Aguilar AM, Vivas NI. Oropharyngeal and nasopharyngeal suctioning of meconiumstained neonates before delivery of their shoulders: multicentre, randomised controlled trial. Lancet. 2004;364:597– 602
23. Wiswell TE, Gannon CM, Jacob J, Goldsmith L, Szyld E, Weiss K, Schutzman D, Cleary GM, Filipov P, Kurlat I, Caballero CL, Abassi S, Sprague D, Oltorf C, Padula M. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial. Pediatrics. 2000;105(1 Pt 1): 1–7
24. Rossi EM, Philipson EH, Williams TG, Kalhan SC. Meconium aspiration syndrome: intrapartum and neonatal attributes. Am J Obstet Gynecol. 1989;161:1106 –1110
25. Usta IM, Mercer BM, Sibai BM. Risk factors for meconium aspiration syndrome. Obstet Gynecol. 1995;86:230 –234
26. Gupta V, Bhatia BD, Mishra OP. Meconium stained amniotic fluid: antenatal, intrapartum and neonatal attributes. Indian Pediatr. 1996;33:293–297
27. Al Takroni AM, Parvathi CK, Mendis KB, Hassan S, Reddy I, Kudair HA. Selective tracheal suctioning to prevent meconium aspiration syndrome. Int J Gynaecol Obstet. 1998;63:259 –263
28. Carson BS, Losey RW, Bowes WA, Jr, Sime1408 mons MA. Combined obstetric and pediatric approach to prevent meconium aspiration syndrome. Am J Obstet Gynecol. 1976; 126:712–715
29. Ting P, Brady JP. Tracheal suction in meconium aspiration. Am J Obstet Gynecol. 1975;122:767–771
30. Gregory GA, Gooding CA, Phibbs RH, Tooley WH. Meconium aspiration in infants—a prospective study. J Pediatr. 1974;85: 848–852
31. Toth B, Becker A, Seelbach-Gobel B. Oxygen saturation in healthy newborn infants immediately after birth measured by pulse oximetry. Arch Gynecol Obstet. 2002;266: 105–107
32. Gonzales GF, Salirrosas A. Arterial oxygen saturation in healthy newborns delivered at term in Cerro de Pasco (4340 m) and Lima (150 m). Reprod Biol Endocrinol. 2005;3:46
33. Altuncu E, Ozek E, Bilgen H, Topuzoglu A, Kavuncuoglu S. Percentiles of oxygen saturations in healthy term newborns in the first minutes of life. Eur J Pediatr. 2008; 167:687– 688
34. Kamlin CO, O’Donnell CP, Davis PG, Morley CJ. Oxygen saturation in healthy infants immediately after birth. J Pediatr. 2006; 148:585–589
35. Mariani G, Dik PB, Ezquer A, Aguirre A, Esteban ML, Perez C, Fernandez Jonusas S, Fustinana C. Pre-ductal and post-ductal O2 saturation in healthy term neonates after birth. J Pediatr. 2007;150:418–421
36. Rabi Y, Yee W, Chen SY, Singhal N. Oxygen saturation trends immediately after birth. J Pediatr. 2006;148:590 –594
37. Hay WW, Jr, Rodden DJ, Collins SM, Melara DL, Hale KA, Fashaw LM. Reliability of conventional and new pulse oximetry in neonatal patients. J Perinatol. 2002;22: 360 –366
38. O’Donnell CP, Kamlin CO, Davis PG, Morley CJ. Feasibility of and delay in obtaining pulse oximetry during neonatal resuscitation. J Pediatr. 2005;147:698–699
39. Dawson JA, Kamlin CO, Wong C, te Pas AB, O’Donnell CP, Donath SM, Davis PG, Morley CJ. Oxygen saturation and heart rate during delivery room resuscitation of infants 30 weeks’ gestation with air or 100% oxygen. Arch Dis Child Fetal Neonatal Ed. 2009;94:F87–F91
40. Davis PG, Tan A, O’Donnell CP, Schulze A. Resuscitation of newborn infants with 100% oxygen or air: a systematic review and meta-analysis. Lancet. 2004;364: 1329 –1333
41. Rabi Y, Rabi D, Yee W. Room air resuscitation of the depressed newborn: a systematic review and meta-analysis. Resuscitation. 2007;72:353–363
42. Escrig R, Arruza L, Izquierdo I, Villar G, Saenz P, Gimeno A, Moro M, Vento M. Achievement of targeted saturation values in extremely low gestational age neonates resuscitated with low or high oxygen concentrations: a prospective, randomized trial. Pediatrics. 2008;121:875– 881
43. Karlberg P, Koch G. Respiratory studies in newborn infants. III. Development of mechanics of breathing during the first week of life. A longitudinal study. Acta Paediatr. 1962;(Suppl 135):121–129
44. Vyas H, Milner AD, Hopkin IE, Boon AW. Physiologic responses to prolonged and slow-rise inflation in the resuscitation of the asphyxiated newborn infant. J Pediatr. 1981;99:635– 639
45. Vyas H, Field D, Milner AD, Hopkin IE. Determinants of the first inspiratory volume and functional residual capacity at birth. Pediatr Pulmonol. 1986;2:189 –193
46. Boon AW, Milner AD, Hopkin IE. Lung expansion, tidal exchange, and formation of the functional residual capacity during resuscitation of asphyxiated neonates. J Pediatr. 1979;95:1031–1036
47. Hillman NH, Moss TJ, Kallapur SG, Bachurski C, Pillow JJ, Polglase GR, Nitsos I, Kramer BW, Jobe AH. Brief, large tidal volume ventilation initiates lung injury and a systemic response in fetal sheep. Am J Respir Crit Care Med. 2007;176:575–581
48. Polglase GR, Hooper SB, Gill AW, Allison BJ, McLean CJ, Nitsos I, Pillow JJ, Kluckow M. Cardiovascular and pulmonary consequences of airway recruitment in preterm lambs. J Appl Physiol. 2009;106:1347–1355
49. Dawes GS. Foetal and Neonatal Physiology. A Comparative Study of the Changes at Birth. Chicago: Year Book Medical Publishers, Inc; 1968
50. Lindner W, Vossbeck S, Hummler H, Pohlandt F. Delivery room management of extremely low birth weight infants: spontaneous breathing or intubation? Pediatrics. 1999;103(5 Pt 1):961–967
51. Leone TA, Lange A, Rich W, Finer NN. Disposable colorimetric carbon dioxide detector use as an indicator of a patent airway during noninvasive mask ventilation. Pediatrics. 2006;118:e202–204
52. Finer NN, Rich W, Wang C, Leone T. Airway obstruction during mask ventilation of very low birth weight infants during neonatal resuscitation. Pediatrics. 2009;123: 865– 869
53. Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med. 2008;358:700 –708
54. Trevisanuto D, Micaglio M, Pitton M, Magarotto M, Piva D, Zanardo V. Laryngeal mask airway: is the management of neonates requiring positive pressure ventilation at birth changing? Resuscitation. 2004;62: 151–157
55. Gandini D, Brimacombe JR. Neonatal resuscitation with the laryngeal mask airway in normal and low birth weight infants. Anesth Analg. 1999;89:642– 643
56. Esmail N, Saleh M, et al. Laryngeal mask airway versus endotracheal intubation for Apgar score improvement in neonatal resuscitation. Egyptian Journal of Anesthesiology. 2002;18:115–121
57. Hosono S, Inami I, Fujita H, Minato M, Takahashi S, Mugishima H. A role of end-tidal CO monitoring for assessment of tracheal intubations in very low birth weight infants during neonatal resuscitation at birth. J Perinat Med. 2009;37:79–84
58. Repetto JE, Donohue P-CP, Baker SF, Kelly L, Nogee LM. Use of capnography in the delivery room for assessment of endotracheal tube placement. J Perinatol. 2001;21: 284 –287
59. Roberts WA, Maniscalco WM, Cohen AR, Litman RS, Chhibber A. The use of capnography for recognition of esophageal intubation in the neonatal intensive care unit. Pediatr Pulmonol. 1995;19:262–268
60. Aziz HF, Martin JB, Moore JJ. The pediatric disposable end-tidal carbon dioxide detector role in endotracheal intubation in newborns. J Perinatol. 1999;19:110 –113
61. Garey DM, Ward R, Rich W, Heldt G, Leone T, Finer NN. Tidal volume threshold for colorimetric carbon dioxide detectors available for use in neonates. Pediatrics. 2008;121: e1524 –1527
62. Orlowski JP. Optimum position for external cardiac compression in infants and young children. Ann Emerg Med. 1986;15: 667– 673
63. Phillips GW, Zideman DA. Relation of infant heart to sternum: its significance in cardiopulmonary resuscitation. Lancet. 1986; 1:1024 –1025
64. Braga MS, Dominguez TE, Pollock AN, Niles D, Meyer A, Myklebust H, Nysaether J, Nadkarni V. Estimation of optimal CPR chest compression depth in children by using computer tomography. Pediatrics. 2009; 124:e69–e74
65. Menegazzi JJ, Auble TE, Nicklas KA, Hosack GM, Rack L, Goode JS. Two-thumb versus two-finger chest compression during CRP in a swine infant model of cardiac arrest. Ann Emerg Med. 1993;22:240 –243
66. Houri PK, Frank LR, Menegazzi JJ, Taylor R. A randomized, controlled trial of twothumb vs two-finger chest compression in a swine infant model of cardiac arrest. Prehosp Emerg Care. 1997;1:65– 67
67. Udassi JP, Udassi S, Theriaque DW, Shuster JJ, Zaritsky AL, Haque IU. Effect of alternative chest compression techniques in infant and child on rescuer performance. Pediatr Crit Care Med. 2009;10:328 –333
68. David R. Closed chest cardiac massage in the newborn infant. Pediatrics. 1988;81: 552–554
69. Thaler MM, Stobie GH. An improved technique of external caridac compression in infants and young children. N Engl J Med. 1963;269:606–610
70. Berkowitz ID, Chantarojanasiri T, Koehler RC, Schleien CL, Dean JM, Michael JR, Rogers MC, Traystman RJ. Blood flow during cardiopulmonary resuscitation with simultaneous compression and ventilation in infant pigs. Pediatr Res. 1989;26:558–564
71. Kitamura T, Iwami T, Kawamura T, Nagao K, Tanaka H, Nadkarni VM, Berg RA, Hiraide A. Conventional and chest-compression-only cardiopulmonary resuscitation by bystanders for children who have out-ofhospital cardiac arrests: a prospective, nationwide, population-based cohort study. Lancet. 2010;375:1347–1354
72. Mielke LL, Frank C, Lanzinger MJ, Wilhelm MG, Entholzner EK, Hargasser SR, Hipp RF. Plasma catecholamine levels following tracheal and intravenous epinephrine administration in swine. Resuscitation. 1998; 36:187–192
73. Roberts JR, Greenberg MI, Knaub MA, Kendrick ZV, Baskin SI. Blood levels following intravenous and endotracheal epinephrine administration. JACEP. 1979;8: 53–56
74. Hornchen U, Schuttler J, Stoeckel H, Eichelkraut W, Hahn N. Endobronchial instillation of epinephrine during cardiopulmonary resuscitation. Crit Care Med. 1987;15: 1037–1039
75. Berg RA, Otto CW, Kern KB, Hilwig RW, Sanders AB, Henry CP, Ewy GA. A randomized, blinded trial of high-dose epinephrine versus standard-dose epinephrine in a swine model of pediatric asphyxial cardiac arrest. Crit Care Med. 1996;24:1695–1700
76. Burchfield DJ, Preziosi MP, Lucas VW, Fan J. Effects of graded doses of epinephrine during asphxia-induced bradycardia in newborn lambs. Resuscitation. 1993;25: 235–244
77. Perondi MB, Reis AG, Paiva EF, Nadkarni VM, Berg RA. A comparison of high-dose and standard-dose epinephrine in children with cardiac arrest. N Engl J Med. 2004;350:1722–1730
78. Patterson MD, Boenning DA, Klein BL, Fuchs S, Smith KM, Hegenbarth MA, Carlson DW, Krug SE, Harris EM. The use of high-dose epinephrine for patients with out-of-hospital cardiopulmonary arrest refractory to prehospital interventions. Pediatr Emerg Care. 2005;21:227–237
79. Wyckoff MH, Perlman JM, Laptook AR. Use of volume expansion during delivery room resuscitation in near-term and term infants. Pediatrics. 2005;115:950 –955
80. Salhab WA, Wyckoff MH, Laptook AR, Perlman JM. Initial hypoglycemia and neonatal brain injury in term infants with severe fetal acidemia. Pediatrics. 2004;114:361–366
81. Ondoa-Onama C, Tumwine JK. Immediate outcome of babies with low Apgar score in Mulago Hospital, Uganda. East Afr Med J. 2003;80:22–29
82. Klein GW, Hojsak JM, Schmeidler J, Rapaport R. Hyperglycemia and outcome in the pediatric intensive care unit. J Pediatr. 2008;153:379 –384
83. LeBlanc MH, Huang M, Patel D, Smith EE, Devidas M. Glucose given after hypoxic ischemia does not affect brain injury in piglets. Stroke. 25:1443–1447, 1994; discussion 1448
84. Hattori H, Wasterlain CG. Posthypoxic glucose supplement reduces hypoxic-ischemic brain damage in the neonatal rat. Ann Neurol. 1990;28:122–128
85. Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards AD, Ferriero DM, Polin RA, Robertson CM, Thoresen M, Whitelaw A, Gunn AJ. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomized trial. Lancet. 2005;365:663– 670
86. Shankaran S, Laptook AR, Ehrenkranz RA, Tyson JE, McDonald SA, Donovan EF, Fanaroff AA, Poole WK, Wright LL, Higgins RD, Finer NN, Carlo WA, Duara S, Oh W, Cotton CM, Stevenson DK, Stoll BJ, Lemons JA, Guillet R, Jobe AH. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med. 2005;353: 1574 –1584
87. Azzopardi DV, Strohm B, Edwards AD, Dyet L, Halliday HL, Juszczak E, Kapellou O, Levene M, Marlow N, Porter E, Thoresen M, Whitelaw A, Brocklehurst P. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med. 2009;361: 1349 –1358
88. Eicher DJ, Wagner CL, Katikaneni LP, Hulsey TC, Bass WT, Kaufman DA, Horgan MJ, Languani S, Bhatia JJ, Givelichian LM, Sankaran K, Yager JY. Moderate hypothermia in neonatal encephalopathy: safety outcomes. Pediatr Neurol. 2005;32:18 –24
89. Lin ZL, Yu HM, Lin J, Chen SQ, Liang ZQ, Zhang ZY. Mild hypothermia via selective head cooling as neuroprotective therapy in term neonates with perinatal asphyxia: an experience from a single neonatal intensive care unit. J Perinatol. 2006;26: 180 –184
90. Field DJ, Dorling JS, Manktelow BN, Draper ES. Survival of extremely premature babies in a geographically defined population: prospective cohort study of 1994–9 compared with 2000 –5. BMJ. 2008;336: 1221–1223
91. Tyson JE, Parikh NA, Langer J, Green C, Higgins RD. Intensive care for extreme prematurity–moving beyond gestational age. N Engl J Med. 2008;358:1672–1681
92. Paris JJ. What standards apply to resuscitation at the borderline of gestational age? J Perinatol. 2005;25:683– 684
93. Jain L, Ferre C, Vidyasagar D, Nath S, Sheftel D. Cardiopulmonary resuscitation of apparently stillborn infants: survival and long-term outcome. J Pediatr. 1991;118: 778 –782
94. Casalaz DM, Marlow N, Speidel BD. Outcome of resuscitation following unexpected apparent stillbirth. Arch Dis Child Fetal Neonatal Ed. 1998;78:F112–F115
95. Laptook AR, Shankaran S, Ambalavanan N, Carlo WA, McDonald SA, Higgins RD, Das A. Outcome of term infants using apgar scores at 10 minutes following hypoxic-ischemic encephalopathy. Pediatrics. 2009; 124:1619 –1626



