Premature Ovarian Insufficiency
Premature Ovarian Insufficiency
พญ.สุปรีชญา พันธุ์เสนีย์
อ.พญ.อุษณีย์ แสนหมี่
Premature ovarian insufficiency (POI) คือ ภาวะที่รังไข่ของสตรีที่มีอายุน้อยกว่า 40 ปี ไม่สามารถทำหน้าที่ได้อย่างสมบูรณ์ พบได้ประมาณร้อยละ 1 ของประชากรทั่วไป(1) เดิมเรียกภาวะนี้ว่า Premature menopause หรือ Premature ovarian failure อย่างไรก็ตามมีการศึกษาพบว่าหลังจากการวินิจฉัยภาวะดังกล่าว Primary ovarian insufficiency ผู้ป่วยร้อยละ 50-75(2) มีการกลับมาทำงานของรังไข่ได้เป็นครั้งคราวอีกทั้งยังพบว่าผู้ป่วยสามารถตั้งครรภ์ได้เองโดยไม่ต้องใช้เทคโนโลยีช่วยการเจริญพันธุ์ถึงร้อยละ 5-10 และสามารถเกิดได้หลายปีหลังจากการวินิจฉัยดังนั้นการใช้คำว่า Premature ovarian insufficiencyแทนPremature menopauseและPremature ovarian failure จึงเหมาะสมมากกว่า
Natural Menopauseคือการที่รังไข่หยุดทำงานอย่างถาวรโดยธรรมชาติและไม่มีประจำเดือนติดต่อกันอย่างน้อย 12 เดือน โดยพบว่าอายุเฉลี่ยที่เข้าสู่วัยหมดประจำเดือนคือ 51±4 ปี(3) ดังนั้นสตรีที่เข้าสู่วัยหมดประจำเดือนก่อนอายุ 40 ปี ถือว่าเป็นภาวะที่เกิดก่อนกำหนด
Premature ovarian insufficiency เกิดจาก2 กลไกหลัก คือ
- Follicle depletion ไม่มี primordial follicles เหลือในรังไข่เลยโดยอาจเกิดจากไม่สร้างตั้งแต่อยู่ในครรภ์หรือทำลายไปอย่างรวดเร็ว เช่น Turner’s syndrome, toxin-induce เป็นต้น
- Follicle dysfunction รังไข่ยังคงมี folliclesอยู่ แต่มีความผิดปกติบางอย่างทำให้ไม่ทำงาน เช่นgene mutation, enzyme deficiency,ovarian autoimmunityและ Iatrogenic factors เป็นต้น
การวินิจฉัย
จะให้การวินิจฉัย POI เมื่อครบเกณฑ์ทุกข้อดังต่อไปนี้(4, 5)
- อายุน้อยกว่า 40 ปี
- มีรอบเดือนห่าง (oligomenorrhea) หรือขาดประจำเดือน (amenorrhea) เป็นเวลาอย่างน้อย4 เดือน
- FSH อยู่ใน menopausal range จากการตรวจ 2 ครั้งห่างกันอย่างน้อย 4 สัปดาห์
อาการและอาการแสดง
- รอบเดือนผิดปกติเป็นอาการนำที่พบบ่อยที่สุด ส่วนใหญ่จะมาด้วยรอบเดือนผิดปกติหลังจากที่เคยมาปกติอย่างสม่ำเสมอ โดยอาจเป็นลักษณะรอบเดือนห่าง (oligomenorrhea), ขาดประจำเดือน (amenorrhea) หรือเลือดออกผิดปกติที่ไม่มีสาเหตุ (dysfunction uterine bleeding)(6) มีเพียงร้อยละ 10 เท่านั้นที่มาด้วยไม่เคยมีรอบเดือนมาก่อน (primary amenorrhea) โดยครึ่งหนึ่งของผู้ป่วยกลุ่มนี้สัมพันธ์กับความผิดปกติของโครโมโซม(7)
ร้อยละ 50 ของภาวะ POI จะมีช่วงที่รังไข่กลับมาทำงานได้เป็นพักๆ และไม่แน่นอนมากกว่าที่จะหยุดทำงานไปเลย ดังนั้นผู้ป่วยส่วนใหญ่จึงมาด้วยรอบเดือนผิดปกติ ไม่สม่ำเสมอมากกว่าที่จะมาด้วยไม่มีรอบเดือนเลย จึงไม่จำเป็นต้องมีอาการขาดประจำเดือน (amenorrhea) ร่วมด้วยเสมอไปในการวินิจฉัยภาวะนี้(4) - อาการวัยทอง (menopausal symptoms)(8)เป็นอาการที่สัมพันธ์กับการขาดเอสโตรเจน ได้แก่ อาการร้อนวูบวาบ (hot flushs), เหงื่อออกกลางคืน (night sweats), ช่องคลอดแห้ง, เจ็บเวลามีเพศสัมพันธ์ (dyspareunia), sleep disturbance, อารมณ์แปรปรวน หงุดหงิดง่าย เป็นต้น อาการเหล่านี้อาจเป็นเพียงชั่วคราว เป็นพักๆ และมีความรุนแรงแปลตามระดับเอสโตรเจนที่สร้างจากรังไข่ที่กลับมาทำงานได้เป็นพักๆ และบางรายอาจไม่มีอาการเหล่านี้เลยก็ได้ โดยเฉพาะในรายที่มาด้วย primary amenorrhea
สาเหตุ
1) Idiopathic ร้อยละ 75-90 (นับเป็นส่วนใหญ่) ของภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควรนั้นไม่ทราบสาเหตุ(4) จะเรียกว่าเป็น idiopathicหรือ unexplained POI หรือบางตำราเรียกว่า spontaneous POI
2) Genetic disorders พบเป็นสาเหตุร้อยละ 10-12(9)
Turner syndrome(monosomy X หรือmosaicism)เป็นความผิดปกติของโครโมโซมที่พบบ่อยที่สุดเกิดแบบ sporadic มีอุบัติการณ์1:2,500ของทารกเกิดมีชีพ(10) และยังพบเป็นสาเหตุที่ตรวจพบบ่อยที่สุดของ POIลักษณะของรังไข่ที่จำเพาะของ Turner Syndrome เรียกว่า Streak gonad ซึ่งไม่มี follicle หรือมี atretic follicle เพียงเล็กน้อยเท่านั้น เชื่อว่ามีการทำลายfollicle ตั้งแต่อยู่ในครรภ์ ความรุนแรงของความผิดปกติของรังไข่มีหลายระดับ ส่วนใหญ่ทำให้เกิด primary amenorrhea และไม่มีการพัฒนาเข้าสู่วัยสาว อย่างไรก็ตามผู้ป่วยบางส่วนสามารถเข้าสู่วัยสาวได้และมาด้วย secondary amenorrhea กรณีตรวจพบมี Y chromosome พบมีโอกาสเกิด gonadal neoplasia ได้ประมาณร้อยละ 45(11) จึงแนะนำให้ตัดรังไข่ออกในกรณีดังกล่าว
X-chromosome abnormality อื่นๆ เช่น deletion, translocation เป็นต้น(12)
Fragile X Syndromeพบเป็นสาเหตุร้อยละ 2-5ของPOIที่ไม่มีประวัติในครอบครัวมาก่อน แต่ในกลุ่มที่มีญาติสายตรงเป็นเหมือนกันพบเป็นสาเหตุได้ถึง 12-14%(13-15) เกิดจากความผิดปกติของ fragile-X-mental-retardation-1 (FMR1) gene กล่าวคือ โดยปกติ FMR1 gene จะมี CGGrepeatsประมาณ30 ครั้ง หากมี CCG repeats มากกว่า 200 ครั้ง เรียกว่า mutation แต่หากมี CGG repeats55-200ครั้ง เรียกว่า premutation โดยพบว่าไม่ว่าจะมีความผิดปกติแบบ mutation หรือ premutation ก็สามารถทำให้เกิด POI ได้ ควรถามประวัติเกี่ยวกับภาวะปัญญาอ่อน, dementia, tremor และ ataxia ในครอบครัวด้วย ซึ่งเข้าได้กับภาวะ fragile X syndrome บ่งบอกว่าผู้ป่วยน่าจะมี premutation ของ FMR1 geneหลายองค์กรแนะนำให้ทำการตรวจ FMR1 premutation ในคนที่มีภาวะ POI ทุกรายโดยเฉพาะในรายที่มีประวัติคนในครอบครัวเป็นPOI ที่หาสาเหตุไม่ได้(16, 17) และจำเป็นต้อง genetic counseling ต่อไป
Autosomal gene mutations มียีนมากมายที่คาดว่าความผิดปกติของยีนนั้นเป็นสาเหตุของ POI เช่น FSHR, LHR, FSHb, LHb, inhibin A, GALT เป็นต้น และยังมีอีกหลายยีนที่ยังต้องการการศึกษาต่อไป ปัจจุบันยังไม่แนะนำให้ตรวจหายีนเหล่านี้เป็น routine
3) Autoimmune disease คนที่เป็นโรค autoimmune อื่นๆ จะพบมี POI ร่วมด้วยได้บ่อย และ POI เองก็มักพบมีโรค autoimmune อื่นด้วยได้บ่อยกว่าประชากรทั่วไปเช่นกัน (autoimmune polyglandular syndrome) โดยพบว่าร้อยละ 14 ของภาวะPOI มีความผิดปกติของระบบต่อมไร้ท่ออื่นร่วมด้วย(18) เช่น hypothyroidism, hypoparathyroidism และ adrenal insufficiency และอาจพบร่วมกับ dry eye syndrome, myasthenia gravis, rheumatoid arthritis และ systemic lupus erythematosus (SLE)
4) Infection เป็นภาวะที่พบน้อยมาก เช่น mump oophoritis แม้จะได้รับการวินิจฉัยว่าติดเชื้อ ส่วนน้อยมากเท่านั้นที่จะเกิดภาวะรังไข่ทำงานบกพร่องตามมา โดยส่วนใหญ่มักจะหายดีและรังไข่ยังทำงานได้ตามปกติเชื้ออื่นๆ เช่น malaria, varicella, shigella, CMV, herpes simplex, HIV ฯลฯ(12)
5) Iatrogenic
Chemotherapy โดยเฉพาะ Alkylating agent (เช่น Cyclophosphamide, procarbazine) ซึ่งมีผลทำให้ primordial follicle ลดลง เกิด POI ตามหลังการให้เคมีบำบัดดังกล่าวได้ถึง 40%(19) ซึ่งเป็นได้ทั้งแบบชั่วคราวและแบบถาวร ปัจจัยที่มีผลต่อการเกิด POI ได้แก่ อายุที่ได้รับเคมีบำบัด ซึ่งพบว่าผู้ป่วยที่อายุน้อย เกิดได้น้อยกว่าผู้ป่วยที่อายุมาก เนื่องจากเหลือ remaining oocytes อยู่มากกว่า นอกจากนี้ยังขึ้นกับชนิดและขนาดของยาเคมีบำบัดด้วย
Radiation therapy มีผลทำลายรังไข่โดยตรงความรุนแรงขึ้นอยู่กับ radiation field, ขนาดรังสีที่ได้รับ และอายุของผู้ป่วยตอนได้รับการฉายแสง
6) Environment
การสัมผัสกับสารบางอย่างมีผลให้เกิดการทำลาย follicle ในรังไข่ได้ เช่น 2-bromopropane ที่อยู่ในน้ำยาทำความสะอาด(20) , ยาฆ่าแมลง, โลหะหนัก, ควันบุหรี่ ฯลฯ(12)
การวินิจฉัย
เป็นที่ทราบกันดีว่ารังไข่มีหน้าที่เป็นทั้ง reproductive organ และ endocrine organ การที่รังไข่ทำงานบกพร่องจะนำไปสู่ภาวะแทรกซ้อนหลายอย่างได้แก่โรคหัวใจและหลอดเลือด , โรคกระดูกพรุนและ Infertilityเป็นต้น ดังนั้นหากสามารถวินิจฉัยภาวะ POI ได้รวดเร็ว จะสามารถให้การดูแลและป้องกันการเกิดภาวะแทรกซ้อนที่รุนแรงได้ อย่างไรก็ตามมีการศึกษาพบว่ามากกว่าครึ่งของ POI ต้องพบแพทย์อย่างน้อยสามครั้งจึงได้รับการวินิจฉัยและร้อยละ 25 ของผู้ป่วยมีอาการประจำเดือนผิดปกติมานาน5 ปี(21)ดังนั้น ในผู้ป่วยวัยเจริญพันธุ์ที่มาพบแพทย์ด้วยอาการประจำเดือนผิดปกติ ควรคิดถึงภาวะ premature ovarian insufficiency ไว้ด้วยเสมอ
การซักประวัติ
- ประวัติประจำเดือนโดยละเอียด
- อาการจากการขาดเอสโตรเจน ดังที่กล่าวไปแล้วข้างต้น
- ประวัติน้ำนมไหล แสดงถึงภาวะ hyperprolactinemia ซึ่งเป็นสาเหตุหนึ่งของรอบเดือนผิดปกติได้
- ประวัติการใช้ยาฮอร์โมน, ประวัติผ่าตัดรังไข่ การได้รับยาเคมีบำบัดหรือรังสีรักษา
- ประวัติครอบครัวเป็น POI ควรซักประวัติในผู้ป่วยทุกรายเนื่องจากพบว่า10-15% ของผู้ป่วยจะมีญาติสายตรงเป็นเหมือนกัน
- ประวัติครอบครัวเป็น fragile X syndrome : ภาวะปัญญาอ่อน, dementia, tremor และ ataxia
- ประวัติครอบครัวเป็น autoimmune diseases เช่น polyglandular autoimmunesyndrome
- อาการของ primary adrenal insufficiency ได้แก่ เบื่ออาหาร น้ำหนักลด อ่อนเพลีย อ่อนแรง ปวดท้องน้อย หรือผิวสีเข้มขึ้น เป็นต้น ซึ่งโรคนี้พบเป็นสาเหตุประมาน 3%ของ POI และเพิ่มโอกาสการเกิด POI มากกว่าคนปกติถึง 300 เท่า
การตรวจร่างกาย
- Secondary sexual characteristic ได้แก่ Tanner stage ของเต้านม , pubic hair
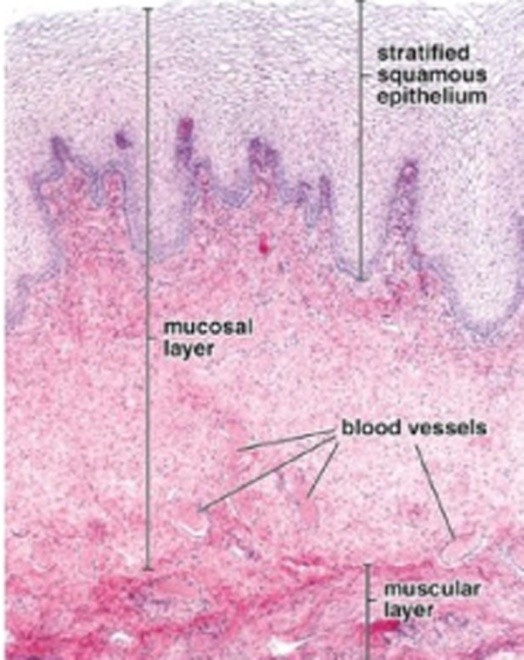
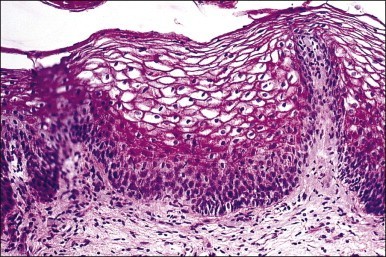
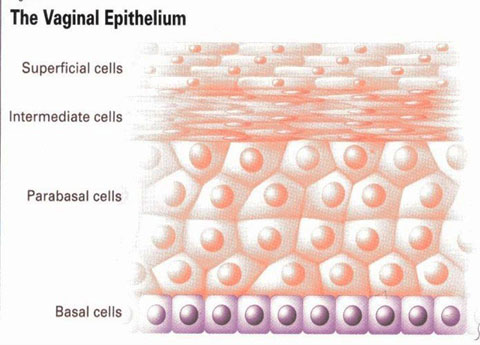
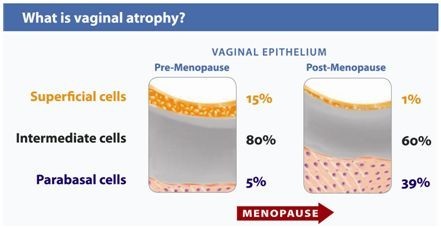
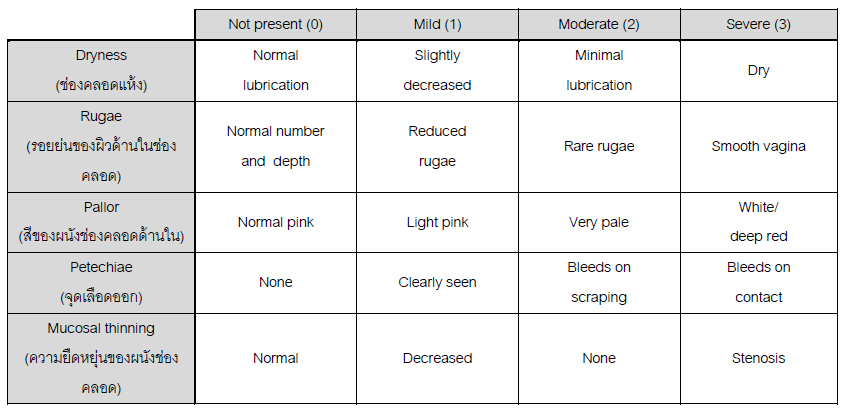
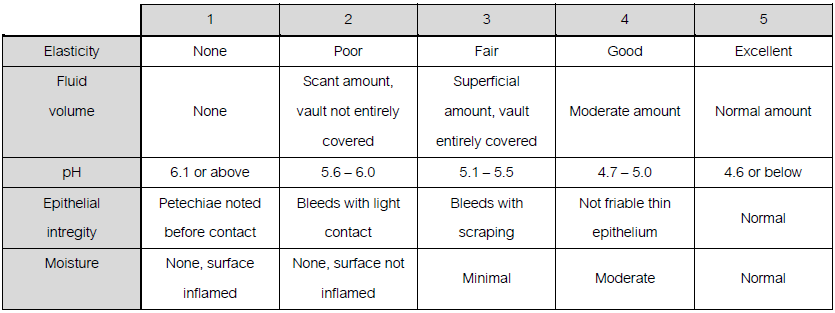
- Sign of vaginal atrophyแต่บางครั้งอาจตรวจภายในไม่พบความผิดปกติรวมถึงมีcervical mucus ลักษณะ ใส เป็นน้ำ ไม่เหนียว และปริมาณค่อนข้างมาก บ่งบอกถึงระดับเอสโตรเจนในเลือดที่ปกติ หากเป็นการตรวจตามหลัง recent ovarian function
- การตรวจอื่นๆตาม physical featuresของโรคเฉพาะ
46, XX idiopathicPOI ส่วนมากจะมีการเข้าสู่วัยเจริญพันธุ์ได้ตามปกติ และมีประจำเดือนปกติมาก่อน นอกจากนี้มักไม่พบความผิดปกติจากการตรวจร่างกาย อย่างไรก็ตาม ผู้ป่วยบางส่วนจะสัมพันธ์กับโรคหรือกลุ่มอาการอื่น ทำให้พบความผิดปกติได้ ได้แก่- ลักษณะของ Turner syndrome ได้แก่short stature, low posterior hairline, high arched palate, shield chest with widely spaced nipples, a wide carrying angle, short fourth และ fifth metacarpals
- Goiterที่เกิดจาก Hashimoto’s thyroiditis หรือ Graves’ disease
- Skin hyperpigmentation , vitiligo สัมพันธ์กับ autoimmune primary adrenal insufficiency
- Ptosis พบได้ใน BPES (Blepharophimosis/ptosis/epicanthus inversus syndrome) เป็นกลุ่ม geneticPOI ที่พบได้น้อย
การตรวจทางห้องปฏิบัติการ
- Pregnancy test ควรทำในหญิงวัยเจริญพันธุ์ทุกคนที่มีประวัติขาดประจำเดือนหรือประจำเดือนมาผิดปกติ เพื่อแยกสาเหตุจากการตั้งครรภ์ซึ่งพบได้บ่อยที่สุด
- Serum prolactin
- Serum TSH
- Ovarian Function Evaluation
serum FSH และ serum estradiol ใน POIจะพบ FSH เพิ่มขึ้น ร่วมกับการพบระดับ estradiol ที่ต่ำลง และเพื่อยืนยันการวินิจฉัย ควรตรวจระดับ FSH ซ้ำห่างกันอย่างน้อย 1เดือน FSH cut-off level ยังไม่มีค่าที่แน่นอน ESHRE GDG แนะนำให้ใช้ 25 mIU/ml
Progestin challenge test ปัจจุบันไม่แนะนำให้ใช้แล้ว เนื่องจากพบว่าเกือบร้อยละ50ของผู้ป่วยPOIมี withdrawal bleeding(6)ทำให้การวินิจฉัยล่าช้าออกไป
การสืบค้นเพิ่มเติม
เมื่อได้การวินิจฉัยว่าเป็นภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควร การตรวจเพิ่มเติมที่แนะนำเพื่อหาสาเหตุ(4) ได้แก่ การตรวจ
- karytype analysis (นับ 30 cells) ควรนับ 30 เซลล์เพื่อตรวจหาภาวะ mosaicism ด้วย การตรวจพบมี Y chromosome จะเพิ่มความเสี่ยงในการเกิดมะเร็งของรังไข่ได้ ดังนั้นควรตรวจโครโมโซมทุกราย โดยเฉพาะในรายที่อายุน้อยกว่า 30 ปี(12)
- FMR1 premutation พบว่าร้อยละ 2-5 ของ 46,xx POI ตรวจพบมี FMR1 premutation และถ้ามีประวัติครอบครัวร่วมด้วยจะพบได้ถึงร้อยละ 12-14 พบได้ทั้งแบบ sporadic type และ familial type ควรตรวจหาภาวะนี้ในผู้ป่วย POI ทุกราย โดยเฉพาะในรายที่มีประวัติครอบครัวเป็น POI, mental retardation, dementia, tremor และ ataxia
- adrenal antibodies โดยตรวจ 21-hydroxylase autoantobodies (21OH-Ab) หรือ adrenocortical antibodies (ACA) พบว่าประมาณร้อยละ 4 ของ POI คัดกรองพบมี adrenal antibodies ถ้าตรวจแล้วผลเป็นบวก ควรส่งตรวจการทำงานของ adrenal gland (Addison’s disease)
ส่วนการตรวจอื่นๆ ให้พิจารณาเป็นรายๆ ไปว่าจากการซักประวัติและตรวจร่างกายแล้วคิดถึงสาเหตุใด จึงส่งตรวจเพิ่มเพื่อให้ได้การวินิจฉัยยืนยัน เช่น โรค autoimmune ต่างๆ
การดูแลรักษา
ภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควรไม่เพียงแต่กระทบต่อภาวะการเจริญพันธ์เท่านั้น แต่ยังมีผลเสียระยะยาวต่อสุขภาพ เพิ่มความเสี่ยงของการเกิดโรคหัวใจและหลอดเลือดและภาวะกระดูกพรุน จากการขาดฮอร์โมนเอสโตรเจน จึงนับเป็นโรคเรื้อรังที่ต้องอาศัยการดูแลระยะยาว
Emotional health เมื่อให้การวินิจฉัย prematureovarian insufficiency สิ่งแรกที่สำคัญที่สุดคือ การให้ข้อมูลที่ถูกต้องแก่ผู้ป่วย ทั้งรายละเอียดของโรค ภาวะแทรกซ้อนที่อาจเกิดตามมาได้ เช่น อาการวัยทอง ภาวะกระดูกพรุน โรคหลอดเลือดหัวใจ เป็นต้น แนวทางการรักษา รวมถึงโอกาสตั้งครรภ์ได้เองนอกจากนี้ ยังต้องเตรียมรับมือและดูแลทางอารมณ์ของผู้ป่วยหลังจากทราบการวินิจฉัย ผู้ป่วยส่วนใหญ่จะรู้สึกตกใจ สับสนและรู้สึกเหมือนถูกทำลายอนาคต(22) เรื่องที่กระทบจิตใจมากที่สุดคือเรื่องการมีบุตร(23) การวางแผนสร้างครอบครัว
Hormone replacement therapy (HRT) ภาวะขาดเอสโตรเจนจะเพิ่มความเสียงในการเกิดภาวะแทรกซ้อนทั้งทางด้านร่างกายและจิตใจ ได้แก่
- อาการวัยทอง ได้แก่ vasomotor flushes, vaginal dryness ดังที่ได้กล่าวไปแล้ว
- osteopenia และ osteoporosis เพิ่มความเสี่ยงการเกิด osteoporotic fracture โดยเฉพาะวัยรุ่นที่เป็นโรคก่อนเข้าสู่ peak adult bone mass มีการศึกษาพบว่า bone density ที่ lumbar spine, femoral neck และ total hip ในกลุ่มที่เป็น POI จะน้อยกว่าในกลุ่มที่ไม่เป็นโรคอย่างมีนัยสำคัญ
- เพิ่ม cardiovascular morbidity/mortality
- impair cognitive function และเพิ่มโอกาสเกิด dementia
ดังนั้น POI จึงควรได้รับฮอร์โมนทดแทนแม้จะไม่มีอาการจากการขาดฮอร์โมนก็ตาม(24, 25) เนื่องจากประโยชน์ที่ได้รับชัดเจน เช่นลดความเสี่ยงของการเกิดกระดูกหัก และลดอัตราตายจากโรคหลอดเลือดหัวใจขาดเลือดโดยให้ไปจนกระทั่งถึงอายุ 50 ปี (อายุเฉลี่ยของวัยหมดระดู)(26)
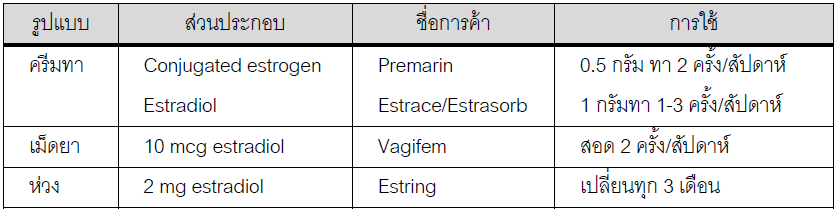
แนะนำให้เอสโตรเจนในรูปแบบของแผ่นแปะและใส่ทางช่องคลอดมากกว่ารูปแบบรับประทาน เพื่อหลีกเลี่ยง first pass effect ที่ตับ ลดความเสี่ยงของภาวะ thromboembolism โดยทั่วไปนิยมให้แผ่นแปะขนาด estradiol100 ไมโครกรัม/วัน และต้องให้โปรเจสเตอโรนร่วมด้วยในขนาดวันละ 10 มิลลิกรัมนาน 12 วันต่อเดือนเพื่อป้องกันการเกิดมะเร็งเยื่อบุโพรงมดลูก ไม่แนะนำให้ใช้ยาคุมกำเนิดแทนเนื่องจากขนาดของฮอร์โมนสูงกว่าระดับปกติที่สร้างขึ้นจากรังไข่และควรหยุดใช้ฮอร์โมนทดแทนเมื่อตรวจพบว่าตั้งครรภ์ซึ่งสามารถเกิดขึ้นได้ร้อยละ 5-10
นอกจากนี้ควรแนะนำการดูแลสุขภาพทั่วไปเพื่อลดความเสี่ยงของโรคหัวใจและหลอดเลือดเช่น การรับประทานอาหารที่มีประโยชน์ ปลอดภัยต่อสุขภาพ การออกกำลังกายอย่างสม่ำเสมอ หลีกเลี่ยงภาวะอ้วน และตรวจสุขภาพเป็นประจำ เป็นต้น
Bone health เมื่อเทียบกับสตรีทั่วไปแล้วคนที่มีภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควรจะมีมวลกระดูกน้อยกว่า เสี่ยงต่อการเกิดภาวะกระดูกพรุนและกระดูกหักได้ง่ายกว่า ดังนั้นต้องให้ข้อมูลกับผู้ป่วย รวมทั้งวิธีลดความเสี่ยง ได้แก่ การออกกำลังกายที่ต้องลงน้ำหนัก เช่น การเดิน การวิ่ง อย่างสม่ำเสมอ, รับประทานอาหารให้ได้ปริมาณแคลเซียม 1,200 มิลลิกรัมต่อวัน, ควรสัมผัสแสงแดดเพื่อให้ได้ปริมาณวิตามินดี 800-1,000 IU ต่อวัน ควรหลีกเลี่ยงการให้ยาในกลุ่ม bisphosphonates ในคนที่ต้องการมีบุตรเนื่องจากยาคงอยู่ในกระดูกเป็นเวลานาน(20) และยังไม่ทราบผลของยาต่อทารกในครรภ์
Associated disorders มีหลายภาวะที่อาจพบร่วมกับภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควร ซึ่งอาจไม่ได้เกิดขึ้นณ.ขณะเดียวกัน จึงจำเป็นต้องเฝ้าระวังภาวะต่างๆ ที่อาจเกิดตามมา รวมทั้งให้การตรวจวินิจฉัยและรักษาได้ทันที ได้แก่ภาวะดังต่อไปนี้
Adrenal insufficiency หรือ Addison disease พบได้ประมาณร้อยละ 4 ซึ่งพบบ่อยกว่าประชากรทั่วไป 100 เท่า(27) ดังนั้นจึงแนะนำให้ทำการตรวจหา adrenal antibodies ในคนที่มีภาวะรังไข่ทำงานบกพร่องก่อนวัยอันควรทุกราย ถ้าผลการตรวจเป็นบวก พบว่าร้อยละ 50 จะเกิดภาวะ adrenal insuficiency ได้(28) จำเป็นต้องได้รับการตรวจ corticotropin stimulation test ทุกปีเพื่อประเมินการทำงานของต่อมหมวกไต และจะต้องแนะนำผู้ป่วยทุกรายเกี่ยวกับอาการของ adrenal insufficiency เพื่อที่จะได้รีบมาโรงพยาบาล เนื่องจากเป็นภาวะอันตรายต่อชีวิตได้
Thyroid autoimmunity พบได้ประมาณร้อยละ 14-27(29) ส่วนใหญ่คือ Hashimoto thyroiditis
Dry eye syndrome พบได้ถึงร้อยละ 20(30) ควรส่งพบจักษุแพทย์เพื่อช่วยดูแลร่วมกัน
โรคอื่นๆ ที่อาจพบร่วม ได้แก่ myasthenia gravis, rheumatoid arthritis และ systemic lupus erythematosus แต่เนื่องจากพบได้ไม่บ่อย ดังนั้นการจะตรวจเพิ่มเติมควรขึ้นกับอาการและอาการแสดงเป็นหลัก ไม่จำเป็นต้องตรวจคัดกรองในทุกโรคข้างต้น
Family planning ผู้ป่วยสามารถที่จะตั้งครรภ์เองได้ร้อยละ 5-10 แสดงว่ารังไข่สามารถกลับมาทำงานได้เป็นบางครั้ง แต่น้อยมากที่จะกลับมาทำงานปกติและมีรอบเดือนมาอย่างสม่ำเสมอเลย จนถึงปัจจุบันยังไม่มีตัวชี้วัดใดที่จะบ่งบอกว่าใครที่รังไข่จะสามารถกลับมาทำงานได้เอง และยังไม่มีการรักษาใดที่จะทำให้รังไข่กลับมาทำงานได้ตามปกติ ดังนั้นในผู้ป่วยที่ไม่ต้องการตั้งครรภ์จำเป็นต้องคุมกำเนิด แต่ยังไม่มีการศึกษาถึงประสิทธิภาพของวิธีการคุมกำเนิดในผู้ป่วยกลุ่มนี้ มีรายงานการตั้งครรภ์แม้ใช้ยาเม็ดคุมกำเนิดอยู่(31) เชื่อว่าน่าจะเป็นจากยาไม่สามารถกดระดับ FSH ที่สูงมากในผู้ป่วยกลุ่มนี้(4) บางคนแนะนำให้ใช้ barrier method หรือห่วงคุมกำเนิดจะดีกว่า(31)
Fertility มักพบว่าผลกระทบในเรื่องการมีบุตรเป็นเรื่องที่ผู้ป่วยให้ความกังวลมากที่สุด ในรายที่ต้องการมีบุตรมีทางเลือกได้แก่(32)
- ใช้ไข่บริจาค (oocyte donation) เป็นวิธีที่มีโอกาสในการประสบความสำเร็จในการตั้งครรภ์สูงที่สุด
- รอมีเองตามธรรมชาติ ซึ่งมีโอกาสร้อยละ 5-10 แต่เนื่องจากไม่สามารถคำนวณวันตกไข่ได้ ดังนั้นต้องมีเพศสัมพันธ์อย่างสม่ำเสมอ ประมาณ 2-3 ครั้งต่อสัปดาห์ (เนื่องจากอสุจิสามารถมีชีวิตอยู่ในระบบสืบพันธ์ของหญิงได้นาน 3 วัน)
- รับบุตรบุญธรรม
- ovarian transplantation ในกรณีที่ผู้ป่วยมีแฝดเหมือนที่รังไข่ยังทำงานได้ปกติ(33)
เอกสารอ้างอิง
- Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol. 1986;67(4):604-6.
- Nelson LM, Anasti JN, Kimzey LM, Defensor RA, Lipetz KJ, White BJ, et al. Development of luteinized graafian follicles in patients with karyotypically normal spontaneous premature ovarian failure. J Clin Endocrinol Metab. 1994;79(5):1470-5.
- van Noord PA, Dubas JS, Dorland M, Boersma H, te Velde E. Age at natural menopause in a population-based screening cohort: the role of menarche, fecundity, and lifestyle factors. Fertil Steril. 1997;68(1):95-102.
- Nelson LM. Clinical practice. Primary ovarian insufficiency. N Engl J Med. 2009;360(6):606-14.
- Rafique S, Sterling EW, Nelson LM. A new approach to primary ovarian insufficiency. Obstet Gynecol Clin North Am. 2012;39(4):567-86.
- Rebar RW, Connolly HV. Clinical features of young women with hypergonadotropic amenorrhea. Fertil Steril. 1990;53(5):804-10.
- Sadeghi MR. New hopes for the treatment of primary ovarian insufficiency/premature ovarian failure. J Reprod Infertil. 2013;14(1):1-2.
- Conway GS. Premature ovarian failure. Br Med Bull. 2000;56(3):643-9.
- Kalantari H, Madani T, Zari Moradi S, Mansouri Z, Almadani N, Gourabi H, et al. Cytogenetic analysis of 179 Iranian women with premature ovarian failure. Gynecol Endocrinol. 2013;29(6):588-91.
- Hook EB, Warburton D. The distribution of chromosomal genotypes associated with Turner’s syndrome: livebirth prevalence rates and evidence for diminished fetal mortality and severity in genotypes associated with structural X abnormalities or mosaicism. Hum Genet. 1983;64(1):24-7.
- Michala L, Goswami D, Creighton SM, Conway GS. Swyer syndrome: presentation and outcomes. BJOG. 2008;115(6):737-41.
- Vujovic S, Ivovic M, Tancic-Gajic M, Marina L, Barac M, Arizanovic Z, et al. Premature ovarian failure. Srp Arh Celok Lek. 2012;140(11-12):806-11.
- Gersak K, Meden-Vrtovec H, Peterlin B. Fragile X premutation in women with sporadic premature ovarian failure in Slovenia. Hum Reprod. 2003;18(8):1637-40.
- Wittenberger MD, Hagerman RJ, Sherman SL, McConkie-Rosell A, Welt CK, Rebar RW, et al. The FMR1 premutation and reproduction. Fertil Steril. 2007;87(3):456-65.
- van Kasteren YM, Hundscheid RD, Smits AP, Cremers FP, van Zonneveld P, Braat DD. Familial idiopathic premature ovarian failure: an overrated and underestimated genetic disease? Hum Reprod. 1999;14(10):2455-9.
- McConkie-Rosell A, Finucane B, Cronister A, Abrams L, Bennett RL, Pettersen BJ. Genetic counseling for fragile x syndrome: updated recommendations of the national society of genetic counselors. J Genet Couns. 2005;14(4):249-70.
- ACOG committee opinion. No. 338: Screening for fragile X syndrome. Obstet Gynecol. 2006;107(6):1483-5.
- Jin M, Yu Y, Huang H. An update on primary ovarian insufficiency. Sci China Life Sci. 2012;55(8):677-86.
- Cox L, Liu JH. Primary ovarian insufficiency: an update. Int J Womens Health. 2014;6:235-43.
- Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc. 2008;83(9):1032-45.
- Alzubaidi NH, Chapin HL, Vanderhoof VH, Calis KA, Nelson LM. Meeting the needs of young women with secondary amenorrhea and spontaneous premature ovarian failure. Obstet Gynecol. 2002;99(5 Pt 1):720-5.
- Groff AA, Covington SN, Halverson LR, Fitzgerald OR, Vanderhoof V, Calis K, et al. Assessing the emotional needs of women with spontaneous premature ovarian failure. Fertil Steril. 2005;83(6):1734-41.
- Boughton MA. Premature menopause: multiple disruptions between the woman’s biological body experience and her lived body. J Adv Nurs. 2002;37(5):423-30.
- Current evaluation of amenorrhea. Fertil Steril. 2004;82 Suppl 1:S33-9.
- Pines A, Sturdee DW, Birkhauser MH, Schneider HP, Gambacciani M, Panay N. IMS updated recommendations on postmenopausal hormone therapy. Climacteric. 2007;10(3):181-94.
- Welt CK. Primary ovarian insufficiency: a more accurate term for premature ovarian failure. Clin Endocrinol (Oxf). 2008;68(4):499-509.
- Bakalov VK, Vanderhoof VH, Bondy CA, Nelson LM. Adrenal antibodies detect asymptomatic auto-immune adrenal insufficiency in young women with spontaneous premature ovarian failure. Hum Reprod. 2002;17(8):2096-100.
- Betterle C, Volpato M, Rees Smith B, Furmaniak J, Chen S, Greggio NA, et al. I. Adrenal cortex and steroid 21-hydroxylase autoantibodies in adult patients with organ-specific autoimmune diseases: markers of low progression to clinical Addison’s disease. J Clin Endocrinol Metab. 1997;82(3):932-8.
- Hoek A, Schoemaker J, Drexhage HA. Premature ovarian failure and ovarian autoimmunity. Endocr Rev. 1997;18(1):107-34.
- Smith JA, Vitale S, Reed GF, Grieshaber SA, Goodman LA, Vanderhoof VH, et al. Dry eye signs and symptoms in women with premature ovarian failure. Arch Ophthalmol. 2004;122(2):151-6.
- Alper MM, Jolly EE, Garner PR. Pregnancies after premature ovarian failure. Obstet Gynecol. 1986;67(3 Suppl):59S-62S.
- Baker V. Life plans and family-building options for women with primary ovarian insufficiency. Semin Reprod Med. 2011;29(4):362-72.
- Silber SJ, Grudzinskas G, Gosden RG. Successful pregnancy after microsurgical transplantation of an intact ovary. N Engl J Med. 2008;359(24):2617-8.