The Premenstrual Syndrome And Premenstrual Dysphoric Disorder (PMS and PMD)
The Premenstrual Syndrome And Premenstrual Dysphoric Disorder (PMS and PMD)
น.พ.ปกรณ์ จักษุวัชร
อาจารย์ที่ปรึกษา พ.ญ.อุบล แสงอนันต์
กลุ่มอาการก่อนมีประจำเดือน
เริ่มตั้งแต่ในปี ค.ศ.1900 จนถึงต้น ค.ศ. 2000 ในยุโรปเริ่มมีการพบว่าผู้หญิงในช่วงที่เป็นประจำเดือนมีความสัมพันธ์กับพฤติกรรมต่อต้านสังคม(antisocial behavior)เช่นใน ปีค.ศ.1845มีคดีแม่บ้านที่ถูกว่าจ้างมาทำงานให้กับนายจ้างครอบครัวหนึ่งได้ฆาตกรรมลูกของนายจ้าง แต่พ้นข้อกล่าวหาโดยศาลตัดสินว่าเป็นความวิกลจริตจากการมี Obstructed menstruationในปี ค.ศ. 1984 Dalton พบว่า ระยะก่อนมีประจำเดือนสัมพันธ์กับอุบัติการณ์การเกิดอาชญากรรม การถูกคุมขังจากการเมาสุรา การแสดงการกระทำที่ไม่เหมาะสม การเจ็บป่วยจากการทำงาน และการนอนโรงพยาบาลด้วยสาเหตุจากอุบัติเหตุ เพิ่มมากขึ้น จึงเริ่มมีการศึกษามากขึ้นถึงความสัมพันธ์ สาเหตุ และการรักษา ของอาการผิดปกติก่อนมีประจำเดือน(1)
คำจำกัดความ
การมีอาการผิดปกติทางร่างกายและพฤติกรรม(physical and behavioral symptom)ที่เกิดขึ้นก่อนมีประจำเดือนในแต่ละรอบ ซึ่งรบกวนการใช้ชีวิตประจำวันหรือการทำงาน ตามด้วยช่วงเวลาที่ไม่มีอาการ เรียกว่า “premenstrual syndrome” (PMS) แต่ถ้าเป็นPremenstrual dysphoric disorder(PMDD)คือ รูปแบบของ PMSที่รุนแรง และมีอาการที่แตกต่างออกไปอย่างชัดเจน โดยจะมีลักษณะอาการเด่นในเรื่องของอารมณ์หงุดหงิด โกรธ เครียด เป็นทุกข์ และแปรปรวน(2)
อาการของPMS โดยปกติมักเกิดขึ้นในช่วง 7-10 วันสุดท้ายของรอบประจำเดือน
- อาการทางกายที่พบได้บ่อยคือ ท้องอืด รู้สึกแขนขาไม่มีแรง เจ็บเต้านม และ ปวดศีรษะ
- อาการทางพฤติกรรมที่พบได้บ่อยคือ การเปลี่ยนแปลงของอารมณ์,หงุดหงิดง่าย,ซึมเศร้า,กินมากกว่าปกติ,หลงลืมง่าย และไม่มีสมาธิ
- อาการอื่นที่พบได้ เช่น อาการเครียดวิตกกังวล, ร้องไห้ง่าย, กระหายน้ำ, สิวขึ้น, ร้อนวูบวาบ, ใจสั่น, เวียนศีรษะ และขาบวม(3)
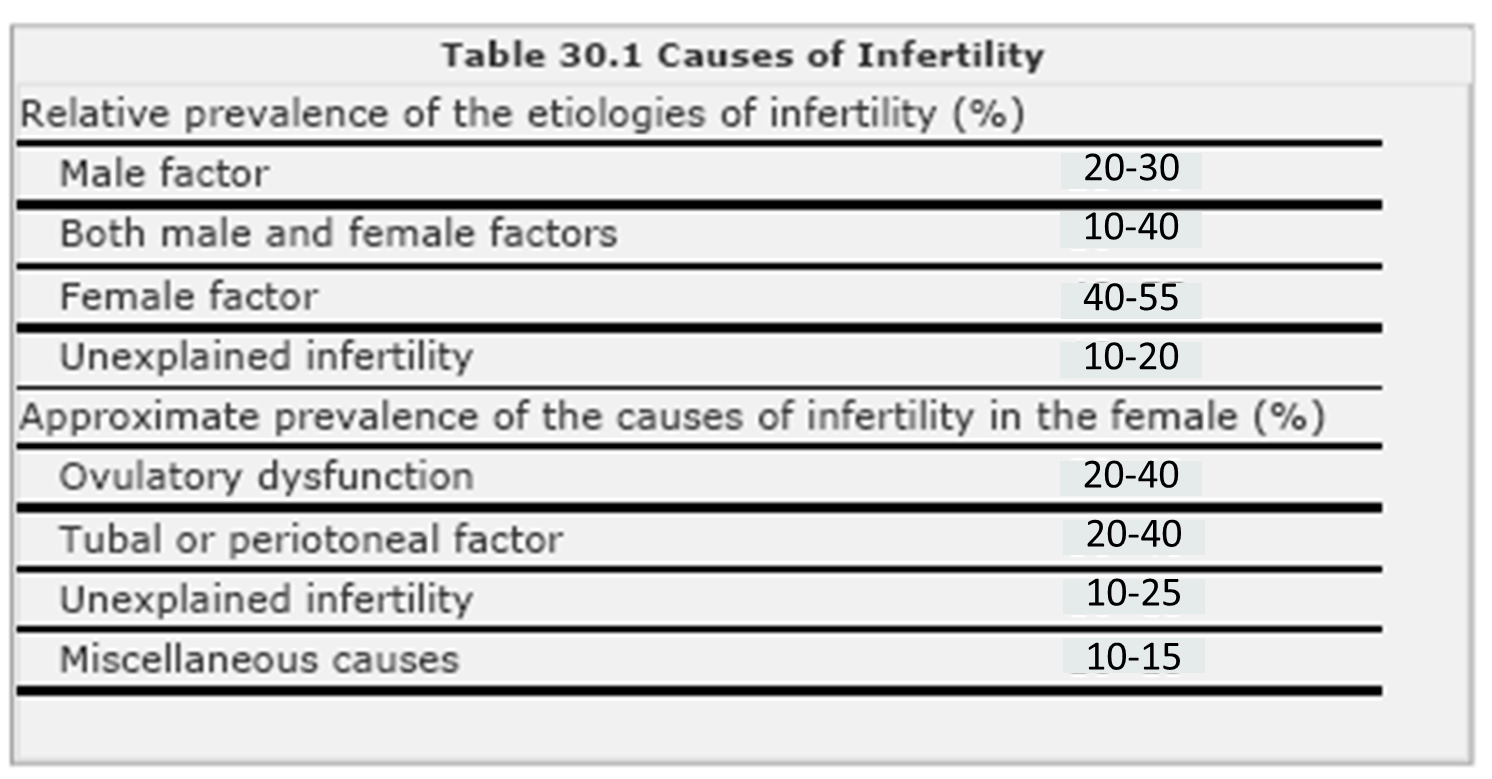
อุบัติการณ์ (Incidence)
อาการก่อนมีประจำเดือนสามารถพบได้เป็นทั่วไป โดยพบได้มากกว่าร้อยละ 75 ผู้หญิงที่มีรอบเดือนมาสม่ำเสมอ แต่พบความสำคัญในเชิงคลินิก ที่เข้าได้ตามเกณฑ์การวินิจฉัย โดยพบอุบัติการณ์เกิดPMS ร้อยละ 3-8 และ PMDD ร้อยละ2 (3, 4)
การวินิจฉัย (Diagnosis)
การวินิจฉัยโรคทั้ง PMSและPMDD ขึ้นอยู่กับอาการที่จำเพาะ,ช่วงเวลา, ความรุนแรง และการวินิจฉัยแยกโรคอื่นออกไปก่อน ซึ่งทั้ง
2 โรค ต้องการการจดบันทึกอาการต่างๆในแต่ละวัน และอาการตามรอบประจำเดือนเหล่านั้นต้องมีความเกี่ยวของตามช่วงของ luteal phasesและ menstrual phasesในแต่ละรอบประจำเดือน และมีหลักฐานว่ามีการสูญเสียหน้าที่ทางสังคมและเศรษฐกิจ โดยหลังจากให้บันทึกอาการในแต่ละวันตามรอบประจำเดือนพบว่า ผู้หญิงจำนวนมากเกือบร้อยละ40 ซึ่งเชื่อว่าเป็น PMS แต่ไม่ได้มีอาการในรูปแบบที่เป็นตามรอบประจำเดือนชัดเจน ซึ่งอาจต้องการการตรวจวินิจฉัยสำหรับโรคอื่นๆต่อไปเช่น mood disordersหรือ anxiety disorder
วิธีการวินิจฉัยที่ได้รับความนิยม คือวีธีการวินิจฉัยที่เสนอโดย University California at San Diego(UCSD)โดยการวินิจฉัยจะใช้การบันทึกอาการในแต่ละวันแบบไปข้างหน้า โดยที่จะต้องวินิจฉัยแยกโรคทางอายุรกรรมและโรคทางจิตเวชอื่นๆออกก่อน และนำมาวิเคราะห์ตามระยะของรอบประจำเดือนโดยใช้การตรวจUrinary steroid metabolites
เครื่องมือที่ใช้ในการสำรวจอาการ เรียกว่า Calendar of Premenstrual Experiences(COPE) ได้รวบรวมอาการที่พบได้บ่อยไว้ เป็นอาการทางกาย 10 อาการ และอาการทางพฤติกรรม12 อาการ โดยแบ่งระดับความรุนแรงเป็น 4 ระดับ และระบุช่วงของประจำเดือนในแต่ละรอบเดือนไว้(1)
ตัวอย่าง ปฏิทินบันทึกอาการตามรอบประจำเดือน (1)

COPE เป็นที่นิยมใช้กันอย่างแพร่หลาย เพราะสามารถวิเคราะห์ข้อมูลต่างๆที่แสดงให้เห็นตามช่วงเวลาได้อย่างแท้จริง เมื่ออาการดังกล่าวเข้าได้กับรูปแบบของPMS/PMDD แล้ว จึงนำมาวินิจฉัยโดยใช้เกณฑ์การวินิจฉัยต่อไป
เกณฑ์การวินิจฉัย (Diagnostic Criteria)
Premenstrual syndrome (PMS)
เกณฑ์การวินิจฉัย PMS ที่ได้รับความนิยมที่สุด คือเกณฑ์การวินิจฉัยตาม University of California at San Diego(1)
- Self-report of 1 or more affective symptoms and 1 or more somatic symptoms during the 5 days preceding menses in each of three menstrual cycles:
- Affective symptoms: depression, angry outbursts, irritability, anxiety, confusion, social withdrawal
- Somatic symptoms: breast tenderness, abdominal bloating, headache, swellingof extremities
- Relief from symptoms within 4 days after the onset of menses, without recurrence before cycle day 12.
- Absence of any medications, hormone therapy, drug or alcohol use.
- Socioeconomic dysfunction, as indicated by one of the following:
- Discord in the relationship with a partner, confirmed by the partner
- Parenting difficulties
- Poor work/school performance or attendance
- Increased social isolation
- Legal problems
- Suicidal ideation
- Seeking medical care for somatic symptoms
Premenstrual Dysphoric Disorder (PMDD)
เกณฑ์การวินิจฉัย PMDD ที่ได้รับความนิยมที่สุดคือเกณฑ์การวินิจฉัยตาม Diagnostic and Statistical Mental disorder fifth edition (DSM-V) ของ American Psychiatric Association(6)
A. In the majority of menstrual cycles, at least five symptoms must be present in the final week before the onset of menses, start to improve within a few days after the onset of menses, and become minimal or absent in the week postmenses.
B. One (or more) of the following symptom must be present:
- marked affective lability (e.g., mood swings; feeling suddenly sad or tearful, or increased sensitivity to rejection)
- Marked irritability or anger or increased interpersonal conflicts.
- Marked depressed mood, feeling of hopelessness, or self-deprecating thoughts
- Marked anxiety, tension, and/or feelings of being keyed up or on edge
C. One (or more) of the following symptoms must additionally be present, to reach a total of five symptoms when combined with symptoms from Criterion B above.
- Decreased interest in usual activities(e.g., work, school, friends, hobbies).
- Subjective difficulty in concentration.
- Lethargy, easy fatigability, or marked lack of energy.
- Marked change in appetite; overeating; or specific food craving.
- Hypersomnia or insomnia.
- A sense of being overwhelmed or out of control.
- Physical symptoms such as breast tenderness or swelling, joint or muscle pain, a sensation of “bloating.” or weight gain.
Note: The symptom in Criteria A-C must have been met for most menstrual cycles that occurred in the preceding year.
D. The symptoms are associated with clinically significant distress or interference with work, school, usual social activities, or relationships with others (e.g., avoidance of social activities; decreased productivity and efficiency at work, school, or home).
E. The disturbance is not merely an exacerbation of the symptom of another disorder, such as major depressive disorder, panic disorder, persistent depressive disorder (dysthymia), or personality disorder (although it may co-occur with any of these disorder).
F. Criterion A should be confirmed by prospective daily rating during at least two symptomatic cycles.(Note: The diagnosis may be made provisionally prior to this confirmation)
G. The symptoms are not attributable to the physiological effects of a substance (e.g., a drug of abuse, a medication, other treatment) or another medical condition (e.g., hyperthyroidism)
ความแตกต่างระหว่าง Premenstrual symptoms กับ PMS/PMDD และการวินิจฉัยแยกโรค
สิ่งสำคัญในการวินิจฉัย PMS คือ มีอาการทางกายและอาการทางอารมณ์ทั้งสองอย่างเกิดขึ้นร่วมกัน และจะต้องไม่มีโรคทางจิตเวชอื่นอยู่เดิม ส่วนในการวินิจฉัย PMDDนั้น ไม่จำเป็นต้องมีอาการทางกายก็ได้ และอาจทำให้โรคทางจิตเวชอื่นๆที่เป็นอยู่เดิมเป็นมากขึ้นได้
การวินิจฉัยแยกโรคอาจต้องมองหาโรคทั้งทางกาย เช่น thyroid disorders (hyper- or hypothyroidism), perimenopause ,anemia , และโรคทางจิตเวช เช่น major psychiatric disorder, mood disorders เช่น major depressive disorder, minor depressive disorder or dysthymic disorder.
ในผู้หญิงที่มีอาการและอาการไม่ดีขึ้นหรือหายไป ในช่วง follicular phase ของรอบประจำเดือน ควรได้รับการประเมินเพื่อมองหาโรคทางจิตเวชอื่นๆเช่น โรคอารมณ์แปรปรวน หรือโรควิตกกังวล โดยมีแนวทางการวินิจฉัย Premenstrual symptoms, PMS/PMDD และการวินิจฉัยแยกโรคดังนี้(รูปภาพที่ 1).(7)
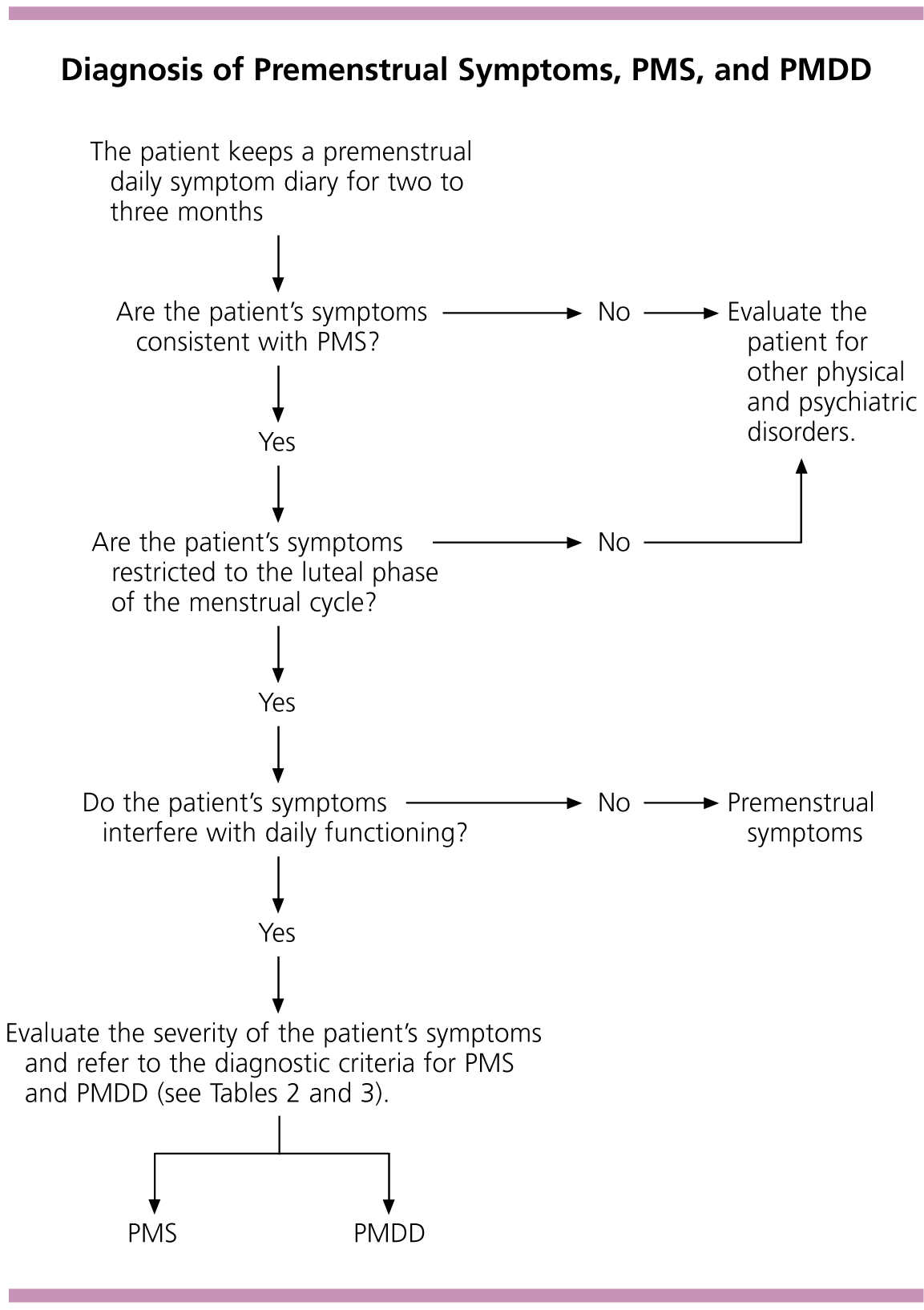
รูปภาพที่ 1 แนวทางการวินิจฉัย Premenstrual symptoms, PMS/PMDD และการวินิจฉัยแยกโรค.(7)
(ดัดแปลงจาก Dickerson LM, Mazyck PJ, Hunter MH. Premenstrual syndrome. American family physician. 2003;67(8):1743-52.)
พยาธิสรีรวิทยา(Pathophysiology)
จากหลักฐานทางวิทยาศาสตร์ สำหรับกลไกการเกิด PMS และ PMDD ยังอธิบายได้ค่อนข้างยาก แต่ยังพอมีทฤษฎีที่อธิบายการเกิดได้ดีและเป็นที่ยอมรับ พอรวบรวมได้ดังนี้
1) ความผิดปกติหรือผลกระทบของการเปลี่ยนแปลงในรอบประจำเดือนของovarian steroid hormone ต่อกลไก central neurotransmitter
หลักการเรื่องของ ovarian steroid hormone กับการเกิด PMS มีความน่าเชื่อถือสูงการศึกษาพบว่าอาการของ PMS ไม่ได้เป็นสาเหตุโดยตรงจากระบบต่อมไร้ท่อในช่วง luteal phase แต่เป็นผลจากการตอบสนองที่ผิดปกติต่อการเปลี่ยนแปลงระดับของ ovarian steroid hormone
มีรายงานการรักษาผู้หญิงที่เป็น PMS ที่ไม่ตอบสนองต่อการรักษาด้วยยา แต่มีอาการดีขึ้นหลังจากทำ oophorectomy และพบว่าผู้หญิงที่เป็น PMS มีอาการดีขึ้นอย่างรวดเร็วหลังจากกดhypothalamic-pituitary-ovarian axis โดยการรักษาด้วยยา long acting gonadotropin-releasing hormone(GnRH) agonist แต่การศึกษาเปรียบเทียบระดับของ estrogen และ progesterone ในเลือด ยังไม่สามารถอธิบายถึงความแตกต่าง ในผู้หญิงที่เป็นและไม่เป็น PMS/PMDD
ในระยะแรกของการมีประจำเดือนที่เกิดจากการชักนำโดยการให้ progesterone antagonist ในช่วงของ luteal phaseไม่ได้ช่วยลดหรือเปลี่ยนแปลงอาการของPMS หรือแม้แต่การให้ hCGเพื่อรักษาระดับของ progesterone ไว้ด้วยก็ตาม
ในผู้หญิงที่รักษาโดยการให้ GnRH agonist อาการยังคงเกิดขึ้นอีกเมื่อได้รับ exogenous estrogen หรือ progesterone ที่ได้ให้เพิ่มในการศึกษา แต่ไม่เกิดขึ้นในรายที่ให้ยา placebo และไม่เกิดในผู้หญิงปกติที่ได้รับการรักษาอย่างเดียวกัน
การศึกษายังได้มีการเก็บข้อมูลในเรื่องของระดับtestosterone, Follicle stimulating hormone (FSH), luteinizing hormone(LH), prolactin, sex hormone binding globulin และ aldosterone ในเลือดในทุกระยะของรอบประจำเดือน ซึ่งไม่พบความแตกต่างเมื่อเปรียบเทียบกันในผู้หญิงที่เป็นและไม่เป็นPMS
2) การเปลี่ยนแปลงของ Neurotransmitters
Opioid
การติดตามดูระดับของb-endorphinกลางรอบประจำเดือน และระยะ luteal phaseพบว่าผู้หญิงที่เป็น PMSมีระดับของb-endorphinต่ำกว่าเมื่อเปรียบเทียบกับผู้หญิงปกติ
Gammaaminobutyric Acid (GABA)
ผลจากการเกิด progesterone metabolism ได้ allopregnanolone โดยจับกับ GABA-A receptorและการรักษาด้วยยาalprazolam (shortacting benzodiazepine) มีประสิทธิภาพของในการช่วยลดอาการวิตกกังวลของ PMS จึงคิดว่าอาจจะมีการรบกวนต่อ GABA-ergic system แล้วส่งผลให้เกิดอาการ PMS ขึ้น อย่างไรก็ตาม การศึกษาได้มีการเปรียบเทียบ ระดับของ anxiolytic progesterone metabolitesพบว่าไม่มีความแตกต่างกันในผู้หญิงที่เป็นและไม่เป็นPMS
Serotonin neurotransmitter system
อาการทางด้านอารมณ์ของPMS สัมพันธ์กับการขาด serotonin พบว่าความเข้มข้นของwhole blood serotonin และ platelet serotonin uptake และ imipramine binding (a marker of CNS binding and serotonergic activity) ในช่วงของ luteal phase จะมีระดับต่ำกว่าในผู้หญิงที่เป็น PMS และอาการ PMS ถูกกระตุ้นจากการขาด trypophan จากอาหารอย่างเฉียบพลัน ซึ่งจะกดกระบวนการสร้าง serotonin ในสมอง และสามารถรักษาให้อาการดีขึ้นได้ด้วย fenfluramine (serotonin agonist) หรือ fluoxetine (Serotonin reuptake inhibitor:SRI)
3 ) ปัจจัยอื่นๆ
พันธุกรรม (Genetic) ปัจจัยด้านพันธุกรรมอาจเป็นสาเหตุของการเกิดPMSและPMDDมีการศึกษาขนานใหญ่ในประชากรฝาแฝด พบว่าในคู่ฝาแฝดมีโอกาสสูงที่จะเป็นPMSทั้งคู่ โดยมีปัจจัยทางด้านสิ่งแวดล้อมร่วมด้วยและยังพบอีกว่ามีความสัมพันธ์ของอาการของรอบประจำเดือน ระหว่างแม่และลูกสาวและระหว่างพี่สาวและน้องสาว ซึ่งสนับสนุนเรื่องปัจจัยด้านพันธุกรรมมีผลต่อเกิด PMS แต่อย่างไรก็ตาม ปัจจัยทางด้านพันธุกรรมถือเป็นเพียงปัจจัยหนึ่งเท่านั่น ยังมีอีกหลายปัจจัยที่แตกต่างกันเช่น ลักษณะเฉพาะบุคคล,ระดับความเครียด,กลไกการเลียนแบบพฤติกรรม ซึ่งยังมีหลักฐานจากการศึกษาน้อยในการสนับสนุนสมมติฐาน
แอลกอฮอล์ พบว่าผู้หญิงที่เป็นPMSดื่มแอลกอฮอล์มากกว่าผู้หญิงปกติ และในผู้หญิงที่มีประวัติอาศัยอยู่ในครอบครัวที่มีคนติดแอลกอฮอร์มักมีอาการของpremenstrual anxiety และ อาการทางพฤติกรรมอื่นๆมากกว่า แต่ยังไม่มีหลักฐานแสดงชัดเจนในเรื่องของความสัมพันธ์ระหว่างผู้หญิงที่ติดแอลกอฮอร์กับผู้หญิงที่เป็นPMS
วิตามิน มีการศึกษาเปรียบเทียบระดับ วิตามินAและวิตามินE ในผู้หญิงที่เป็นและไม่เป็นPMSพบว่าไม่มีความแตกต่างกันอย่างมีนัยสำคัญและมีการศึกษาทดลองโดยการรักษาด้วยวิตตามินB6 พบว่า ไม่ได้ช่วยให้อาการหายหรือดีขึ้น
การรักษา(Treatment)
หลักสำคัญในการรักษาให้มีประสิทธิภาพของโรคPMS และPMDDคือการวินิจฉัยที่ถูกต้อง โดยอย่างแรกต้องอาศัยหลักฐานของการมีอาการของผู้ป่วยในแต่ละรอบประจำเดือน เช่น การใช้แบบสำรวจCOPEหรือการจดบันทึกตามปฏิทิน โดยทำอย่างน้อย2-3 รอบประจำเดือน
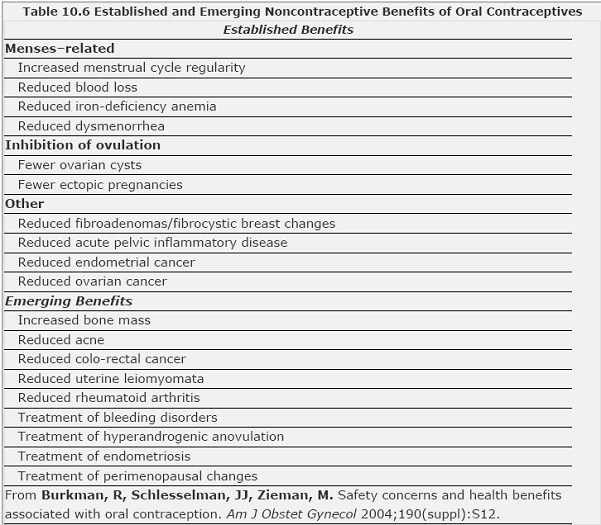
ยาที่มีหลักฐานพิสูจน์แล้วว่ามีประสิทธิภาพในการรักษา PMSและ PMDD คือ SRIs, alprazolam, GnRH agonist oral contraceptives (Drospirenone combined with low estrogen)(Table 1)(8) และอื่นๆที่มีหลักฐานว่าช่วยในการรักษา เช่น ออกกำลังกาย ,วิธีการผ่อนคลาย และspironolactone(ตารางที่ 1)(1)
ตารางที่ 1 ตารางแสดงหลักฐานการศึกษาผลของการรักษา PMS /PMDD

Placebo Response
มีคำกล่าวที่ว่า “Placebo is more than pill”หรือplaceboเป็นอะไรที่มากกว่าแค่เม็ดยา กระบวนการของผลจากplacebo เริ่มตั้งแต่ความเชื่อมั่นในตัวแพทย์ผู้รักษา และพื้นฐานของการดูแลสุขภาพเดิมของผู้ป่วยเอง แพทย์ควรเข้าใจอาการของผู้ป่วยและขจัดความเชื่อที่ผิด และให้ความหวังต่อผลสำเร็จในการรักษา
Demonstrated Effective
Serotonin Reuptake Inhibitor (SRIs)
มีหลักฐานมากมายที่พิสูจน์ว่าการให้ยา SRIs มีประสิทธิภาพสูงในการรักษาPMS และPMDD(grading recommendation A) (9, 10) การให้กิน fluoxetine 20 mgวันละครั้ง ช่วยลดอาการทั้งอาการทางกายและอาการทางอารมณ์ และยังสามารถใช้ยาได้โดยไม่มีปัญหา(well-tolerated)รวมทั้งยาในกลุ่ม SRIs ตัวอื่นๆก็มีประสิทธิภาพดีเช่นกัน เช่น sertraline (50-150mg วันละครั้ง),paroxetine (20-30 mgวันละครั้ง), citalopram (20-30mgวันละครั้ง), venlafaxine(50-200mgวันละครั้ง) รวมถึงยาที่เป็นยากลุ่มinhibits of both serotonin and norepinephrineก็มีประสิทธิภาพดีในการรักษาเช่นกัน
การให้ SRIsและยาร่วมรักษาอื่นๆ โดยปกติจะให้แบบกินต่อเนื่องทุกวันแต่มีการศึกษาที่ให้กินยา เฉพาะช่วง luteal phaseหรือเริ่มกินเมื่อเริ่มมีอาการ พบว่า ประสิทธิภาพในการรักษาลดน้อยลงกว่าการให้กินยาแบบย่อเนื่อง(10) แต่อาจได้ผลดีกว่าในแง่การลดค่าใช้จ่ายและเกิดผลข้างเคียงได้น้อยกว่า(11) ในบางการศึกษา ให้การรักษาระยะสั้นๆเพียง 3 วันพบว่ามีประสิทธิภาพในการรักษาได้ดีเช่นกัน อย่างไรก็ตาม ยังคงมีผู้หญิงบางคน ยังคงต้องการยาขนาดที่สูงกว่าปกติและต่อเนื่อง ถึงจะประสบความสำเร็จในการรักษา(12, 13)
Alprazolam
ยาในกลุ่ม Benzodiazepine เป็นยาอีกตัวหนึ่งที่ช่วยในการรักษา PMS และ PMDD ได้ดี ถึงแม้ว่ายาอาจจะมีข้อจำกัดในการช่วยลดอาการซึมเศร้า และเนื่องจากการกินยาเป็นเวลานาน อาจทำให้ติดยาได้อีกด้วย โดยทั่วไป จะพิจารณาให้เป็นทางเลือกที่ 2 และดีมากถ้าหากใช้ยาในช่วงระยะเวลาสั้นๆ
Gonadotropin Releasing Hormone Agonist
มีการนำยามาใช้ประโยชน์ในทางคลินิก เพื่อรักษาPMSและPMDDครั้งแรกตั้งแต่ค.ศ. 1984 ซึ่งโดยทั่วไปในการใช้GnRHagonist จะมีประสิทธิภาพในการรักษาอาการทางกายและอารมณ์โกรธหรือหงุดหงิดง่าย ได้ดีกว่าการรักษาอาการที่เด่นในเรื่อง อาการซึมเศร้าหรือเป็นทุกข์ไม่สบายใจ (depressive and dysphoria symptom)
เป็นที่รู้กันว่าการรักษาด้วยGnRH agonistอาจทำให้เกิดอาการของภาวะestrogen ต่ำ(hypoestrogenism)เช่น ร้อนวูบวาบ (hot flushes)ซึ่งในผู้ป่วยบางรายอาจมีอาการมากและเป็นนานได้ และการใช้ยาเป็นเวลานาน อาจส่งผลข้างเคียงตามมาได้ เช่น การสูญเสียมวลกระดูก(bone mineral depletion)อย่างไรก็ตามข้อจำกัดเหล่านั้นสามารถแก้ไขได้โดยการให้ add-backtreatmentด้วยestrogenขนาดต่ำๆหรือestrogenและprogestinซึ่งการให้ add back treatment ไม่ทำให้ประสิทธิภาพโดยรวมลดน้อยลง(14, 15)
Possibly Effective
Oral Contraceptives
การให้กินยาคุมกำเนิดชนิดเม็ดนั้นเป็นอีกวิธีหนึ่งที่ใช้กันมานานในการรักษา PMSและPMDD โดยพื้นฐานความคิดที่ว่า การให้ยาเข้าไปทดแทนเพื่อไม่ให้มีการเปลี่ยนแปลงของระดับhormone ในรอบประจำเดือนผลที่ได้ถึงความสำเร็จในการรักษายังไม่เป็นที่แน่ชัด มีการศึกษาในระยะแรกพบว่า oral contraceptives ช่วยในเรื่องของการลดอาการปวดเต้านมและอาการท้องอืดแน่นได้ แต่ไม่ได้ช่วยทำให้อาการทางด้านอารมณ์ดีขึ้น มีหลายการศึกษาได้ใช้ oral contraceptives ที่ประกอบด้วยprogestin drospirenone(grading recommendation A)ในการรักษาผลที่ได้พบว่าประสิทธิภาพในการรักษาค่อนข้างดีและยังสามารถช่วยรักษาและลดอาการต่างๆได้หลากหลายมากขึ้นเช่น อาการทางด้านอารมณ์และอาการทางด้านพฤติกรรม โดยเฉพาะอย่างยิ่งเมื่อใช้เม็ดยาที่ไม่มีhormone(pill free) ในช่วงเวลาสั้นๆ ไม่เกิน 4วัน หรืออาจจะให้แบบกินต่อเนื่อง ซึ่งให้ผลการรักษาไม่แตกต่างกัน(16)และมีการศึกษาพบว่าการกิน oral contraceptives ที่เป็น Levonogestrel แบบกินต่อเนื่องทุกวัน พบว่ามีประสิทธิภาพดีในการรักษา PMDD(17, 18) โดยการกินoral contraceptives แบบต่อเนื่องเป็นการรักษาระดับhormoneให้คงที่และเป็นการขจัดการมีรอบประจำเดือนและการมีประจำเดือนได้ด้วย
Spironolactone
เป็นยากลุ่มpotassium-sparing diureticที่มีสูตรโครงสร้างโมเลกุลคล้ายกับ steroid hormone และเป็นยาตัวหนึ่งที่ใช้กันในวงกว้างในการรักษาPMSในการศึกษาทดลองพบว่าการรักษาด้วยspironolactoneมีประสิทธิภาพมากกว่าในการให้placeboเพื่อลดอาการหงุดหงิด,ซึมเศร้า,ท้องอืด,เจ็บเต้านมและความอยากอาหาร
Exercise และ Relaxation Technique
มีบางหลักฐานสำหรับการทำ aerobic exercise, relaxation,และ reflexologyสามารถช่วยลดอาการของPMSได้ แต่ข้อมูลที่มีอยู่ในปัจจุบันในเรื่องของประสิทธิภาพการรักษานั้นยังไม่เป็นที่แน่ชัด ซึ่งผลที่เกิดขึ้นอาจเป็นเพียงจาก placebo response เท่านั้น
แนวทางการเลือกการรักษา (Choices Of Treatment)
- เมื่อมีอาการเพียงเล็กน้อยและมีหลักฐานว่ามีการสูญเสียหน้าที่ทางสังคมและเศษฐกิจ ผู้ป่วยควรได้รับคำแนะนำและอาจพิจารณาให้ออกกำลังกายแบบแอโรบิค (aerobic exercise) เป็นการรักษาได้
- ถ้ามีอาการอืดแน่นท้องและfluid retention เป็นอาการเด่นอาจตัดสินใจลองรักษาด้วย spironolactone
- ผู้หญิงที่ต้องการคุมกำเนิดร่วมด้วย อาจให้การรักษาด้วยoral contraceptives โดยให้ลดช่วงกินpill freeให้สั้นกว่าปกติ หรือสามารถกินแบบต่อเนื่องได้
- ผู้หญิงที่เข้าได้กับเกณฑ์การวินิจฉัยของPMSหรือ PMDD รวมทั้งมีการสูญเสียหน้าที่ทางด้านสังคมและเศษฐกิจอาจมีแนวทางเลือกในการรักษาโดยการรักษาด้วย SRIs(fluoxetine, sertraline, paroxetine, veniafaxine)โดยอาจให้กินต่อเนื่องทุกวันหรือกินเฉพาะช่วงluteal phaseโดยทั่วไปผลข้างเคียงของยากลุ่มSRIsเช่น คลื่นไส้อาเจียน, สั่น, ปวดศีรษะ เมื่อการใช้ยามีผลข้างเคียงมากเป็นข้อจำกัดในการรักษา อาจลองลดขนาดยาหรือเลือกใช้ยาทางเลือกอื่นๆในการรักษาแทน
ปัญหาทางด้านเพศ โดยเฉพาะการที่ไม่ถึงจุดสุดยอด(anorgasmia) หรือ ขาดความสนใจทางเพศ เป็นผลข้างเคียงที่อาจเกิดขึ้นได้และส่งชัดเจนที่สุดในการรักษาด้วยยาSRIsดังนั้นผู้หญิงทุกคนที่ได้รับการรักษาควรได้รับการแนะนำถึงปัญหาต่างๆที่อาจจะเกิดขึ้นได้ก่อนเริ่มให้การรักษาด้วย เพราะการรักษาด้วยยากลุ่มSRIsนั้นแม้ว่าบ่อยครั้งให้ยาในขนาดต่ำๆก็ไม่ได้ช่วยลดผลข้างเคียงจากยาได้ - มีผู้หญิงที่เป็น PMSประมาณร้อยละ30-40อาจไม่ตอบสนองต่อการรักษาด้วยยากลุ่มSRIsแม้กินต่อเนื่องหลายรอบประจำเดือนแล้ว อาจลองปรับเปลี่ยนยาตัวอื่นในกลุ่มSRIsและบ่อยครั้งมักได้ผลดี
- ผู้หญิงที่ล้มเหลวในการรักษาด้วย ยากลุ่ม SRIsทั้งการให้กินเฉพาะช่วง luteal phaseหรือกินทุกวัน อาจพิจารณายาทางเลือกอื่นๆเช่น alprazolamขนาดต่ำๆ
- ในคนไข้ที่มีอาการของPMSรุนแรงและไม่มีโรคหรือภาวะอื่น อาจพิจารณาให้ GnRH agonistและแนะนำให้ add-back treatmentเช่น estrogen หรือ estrogenคู่กับprogestinซึ่งการให้ GnRH agonistควบคู่กับ add back therapy เกิน 6เดือน จะไม่มีความเสี่ยงของการลดลงของมวลกระดูก
- ในผู้หญิงที่ได้รับการวินิจฉัยว่าเห็น PMSหรือ PMDDและไม่สำเร็จต่อการรักษาด้วยยาอาจต้องพิจารณาโรคหรือภาวะอื่นๆเช่น Major depressive, Generalized anxiety disorder หรือการใช้สารบางชนิด
- การผ่าตัดรักษา โดยการทำ oophorectomyอาจเลือกในรายที่มีอาการรุนแรงและไม่ตอบสนองต่อการรักษาด้วยยา ซึ่งมีประสิทธิภาพดีในการรักษา(19)โดยมีแนวทางในการเลือกผู้ป่วยดังนี้(20)
- การวินิจฉัยว่าเป็นPMDD ต้องยืนยันจากการบันทึกอาการแบบไปข้างหน้า(prospective symptom record)
- การรักษาด้วยยาที่มีประสิทธิภาพ มีเพียงยาเพียงตัวเดียวคือ GnRH agonistและต้องใช้ต่อเนื่องอย่างน้อย 6เดือน
- อาการผลข้างเคียงจากการรักษาด้วย GnRH agonist ไม่ดีขึ้นด้วยการให้add back therapy
- มีบุตรเพียงพอแล้ว
เอกสารอ้างอิง
- Fritz MA, Speroff L. Clinical gynecologic endocrinology and infertility. 8th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2011. 568–79 p.
- Steiner M, Born L. Diagnosis and treatment of premenstrual dysphoric disorder: an update. International clinical psychopharmacology. 2000;15 Suppl 3:S5-17.
- Hartlage SA, Freels S, Gotman N, Yonkers K. Criteria for premenstrual dysphoric disorder: secondary analyses of relevant data sets. Archives of general psychiatry. 2012;69(3):300-5.
- Borenstein J, Chiou CF, Dean B, Wong J, Wade S. Estimating direct and indirect costs of premenstrual syndrome. Journal of occupational and environmental medicine / American College of Occupational and Environmental Medicine. 2005;47(1):26-33.
- Mortola JF, Girton L, Beck L, Yen SS. Diagnosis of premenstrual syndrome by a simple, prospective, and reliable instrument: the calendar of premenstrual experiences. Obstetrics and gynecology. 1990;76(2):302-7.
- American Psychiatric Association., American Psychiatric Association. DSM-5 Task Force. Diagnostic and statistical manual of mental disorders : DSM-5. 5th ed. Washington, D.C.: American Psychiatric Association; 2013.
- Dickerson LM, Mazyck PJ, Hunter MH. Premenstrual syndrome. American family physician. 2003;67(8):1743-52.
- Biggs WS, Demuth RH. Premenstrual syndrome and premenstrual dysphoric disorder. American family physician. 2011;84(8):918-24.
- Marjoribanks J, Brown J, O’Brien PM, Wyatt K. Selective serotonin reuptake inhibitors for premenstrual syndrome. The Cochrane database of systematic reviews. 2013;6:CD001396.
- Shah NR, Jones JB, Aperi J, Shemtov R, Karne A, Borenstein J. Selective serotonin reuptake inhibitors for premenstrual syndrome and premenstrual dysphoric disorder: a meta-analysis. Obstetrics and gynecology. 2008;111(5):1175-82.
- Halbreich U, Bergeron R, Yonkers KA, Freeman E, Stout AL, Cohen L. Efficacy of intermittent, luteal phase sertraline treatment of premenstrual dysphoric disorder. Obstetrics and gynecology. 2002;100(6):1219-29.
- Yonkers KA, Holthausen GA, Poschman K, Howell HB. Symptom-onset treatment for women with premenstrual dysphoric disorder. Journal of clinical psychopharmacology. 2006;26(2):198-202.
- Landen M, Erlandsson H, Bengtsson F, Andersch B, Eriksson E. Short onset of action of a serotonin reuptake inhibitor when used to reduce premenstrual irritability. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 2009;34(3):585-92.
- Wyatt KM, Dimmock PW, Ismail KM, Jones PW, O’Brien PM. The effectiveness of GnRHa with and without ‘add-back’ therapy in treating premenstrual syndrome: a meta analysis. BJOG : an international journal of obstetrics and gynaecology. 2004;111(6):585-93.
- Mitwally MF, Gotlieb L, Casper RF. Prevention of bone loss and hypoestrogenic symptoms by estrogen and interrupted progestogen add-back in long-term GnRH-agonist down-regulated patients with endometriosis and premenstrual syndrome. Menopause. 2002;9(4):236-41.
- Lopez LM, Kaptein AA, Helmerhorst FM. Oral contraceptives containing drospirenone for premenstrual syndrome. The Cochrane database of systematic reviews. 2012;2:CD006586.
- Freeman EW, Halbreich U, Grubb GS, Rapkin AJ, Skouby SO, Smith L, et al. An overview of four studies of a continuous oral contraceptive (levonorgestrel 90 mcg/ethinyl estradiol 20 mcg) on premenstrual dysphoric disorder and premenstrual syndrome. Contraception. 2012;85(5):437-45.
- Halbreich U, Freeman EW, Rapkin AJ, Cohen LS, Grubb GS, Bergeron R, et al. Continuous oral levonorgestrel/ethinyl estradiol for treating premenstrual dysphoric disorder. Contraception. 2012;85(1):19-27.
- Cronje WH, Vashisht A, Studd JW. Hysterectomy and bilateral oophorectomy for severe premenstrual syndrome. Human reproduction. 2004;19(9):2152-5.
- Johnson SR. Premenstrual syndrome, premenstrual dysphoric disorder, and beyond: a clinical primer for practitioners. Obstetrics and gynecology. 2004;104(4):845-59.