Cervical cancer in pregnancy
สุชิน กันทาวงศ์
อ.ที่ปรึกษา: อ.ฉลอง ชีวเกรียงไกร
Introduction
มะเร็งปากมดลูกเป็นโรคมะเร็งชนิดหนึ่งที่พบบ่อยในหญิงตั้งครรภ์ มีอุบัติการณ์ประมาณ 0.8 -1.5 ต่อการคลอดหนึ่ง 1000 ราย (1,2) ครึ่งหนึ่งได้รับการวินิจฉัยก่อนคลอด และอีกครึ่งหนึ่งได้รับการวินิจฉัยภายใน12 เดือนหลังคลอด(3)
ส่วนใหญ่จะพบโรคในระยะแรกๆ เนื่องจากมีการตรวจคัดกรองมะเร็งปากมดลูกในช่วงที่มาฝากครรภ์(3,4) การดำเนินของโรคและ prognosis ของโรคในหญิงตั้งครรภ์และหญิงที่ไม่ได้ตั้งครรภ์ไม่ได้แตกต่างกัน(4,5)
ยังไม่มีข้อมูลจาก randomized trail ใหญ่ๆ ที่มากพอที่จะใช้เป็นข้อมูลแนะนำการดูแลหญิงตั้งครรภ์ที่เป็นมะเร็งปากมดลูก ดังนั้นแนวทางในการดูแลผู้ป่วยในปัจจุบันจึงได้อาศัยข้อมูลมาจากการศึกษาแบบ randomized trail ในหญิงที่ไม่ๆได้ตั้งครรภ์ และข้อมูลจาการศึกษาแบบ observational study ในหญิงตั้งครรภ์ ดังนั้นในการวางแผนการรักษาต้องพิจารณาเป็นรายๆไป
Presentation
อาการและอาการแสดงของโรคมะเร็งปากมดลูกในหญิงตั้งครรภ์ขึ้นอยู่กับระยะของโรคและขนาดของรอยโรค ส่วนใหญ่ในระยะ IA และ 50% ในระยะ IB ผู้ป่วยมักไม่มีอาการผิดปกติ(5) ส่วนในระยะ IB ที่มีอาการมักมาด้วยเรื่องมีเลือดออกผิดปกติจากช่องคลอด และผู้ป่วยที่อยู่ในระยะโรคลุกลามก็มักจะมีอาการปวดท้องน้อย ปวดเอวชาร้าวลงขา ปวดสีข้าง ซีด หรือ หายใจเหนื่อย ซึ่งมักจะคล้ายกับอาการปกติที่พบได้บ่อยในหญิงตั้งครรภ์ จึงทำให้วินิจฉัยจากอาการได้ยาก
นอกจากนี้การตรวจหาความผิดปกติโดยการตรวจร่างกายก็ค่อนข้างยากเนื่องจากมีการเปลี่ยนแปลงที่ปากมดลูก เช่น cervical decidualization , ectropion และ stromal edema และในระยะท้ายๆ ของการตั้งครรภ์ก็จะมีข้อจำกัดจาก cervical ripening เมื่อใดที่พบ gross lesion ที่น่าสงสัยก็ควรทำ biopsy และเมื่อพบมะเร็งปากมดลูกควรส่งตัวมาพบ gynecologic oncologist
Diagnostic evaluation
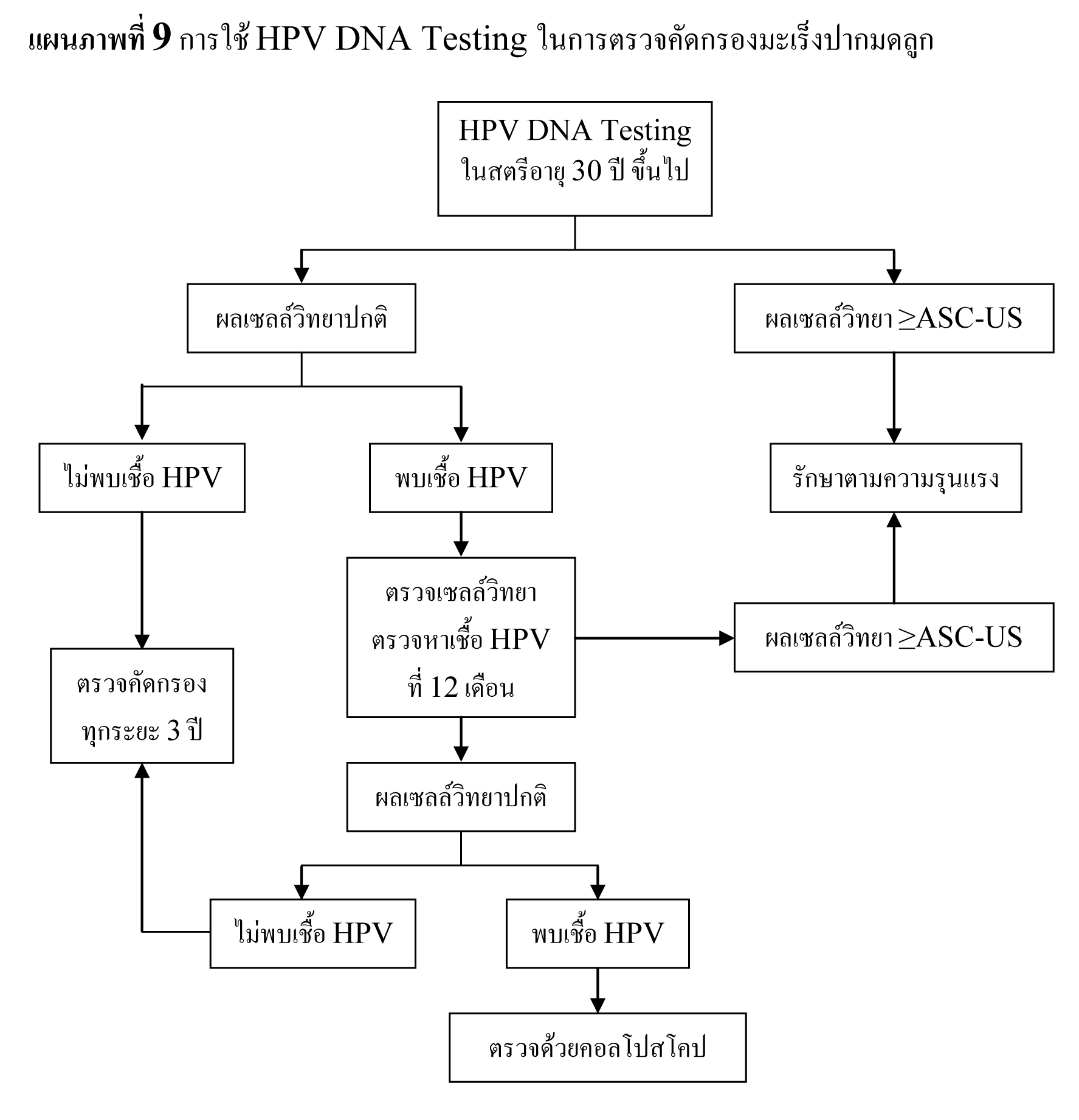
Abnormal cervical cytology
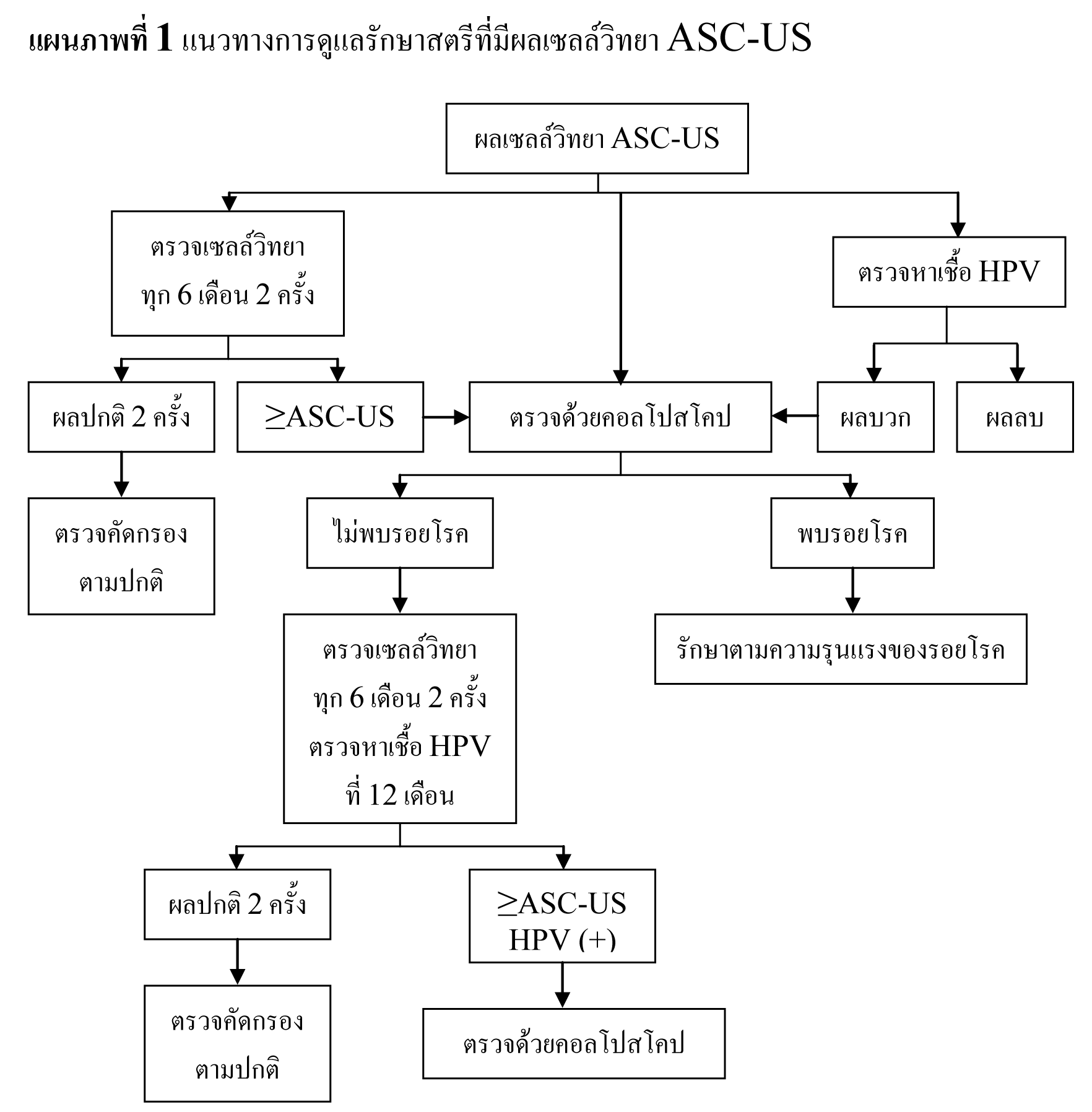
การดูแลผู้ป่วยที่มี abnormal cytology ให้ปฏิบัติตาม 2006 Bethesda consensus guideline(7)
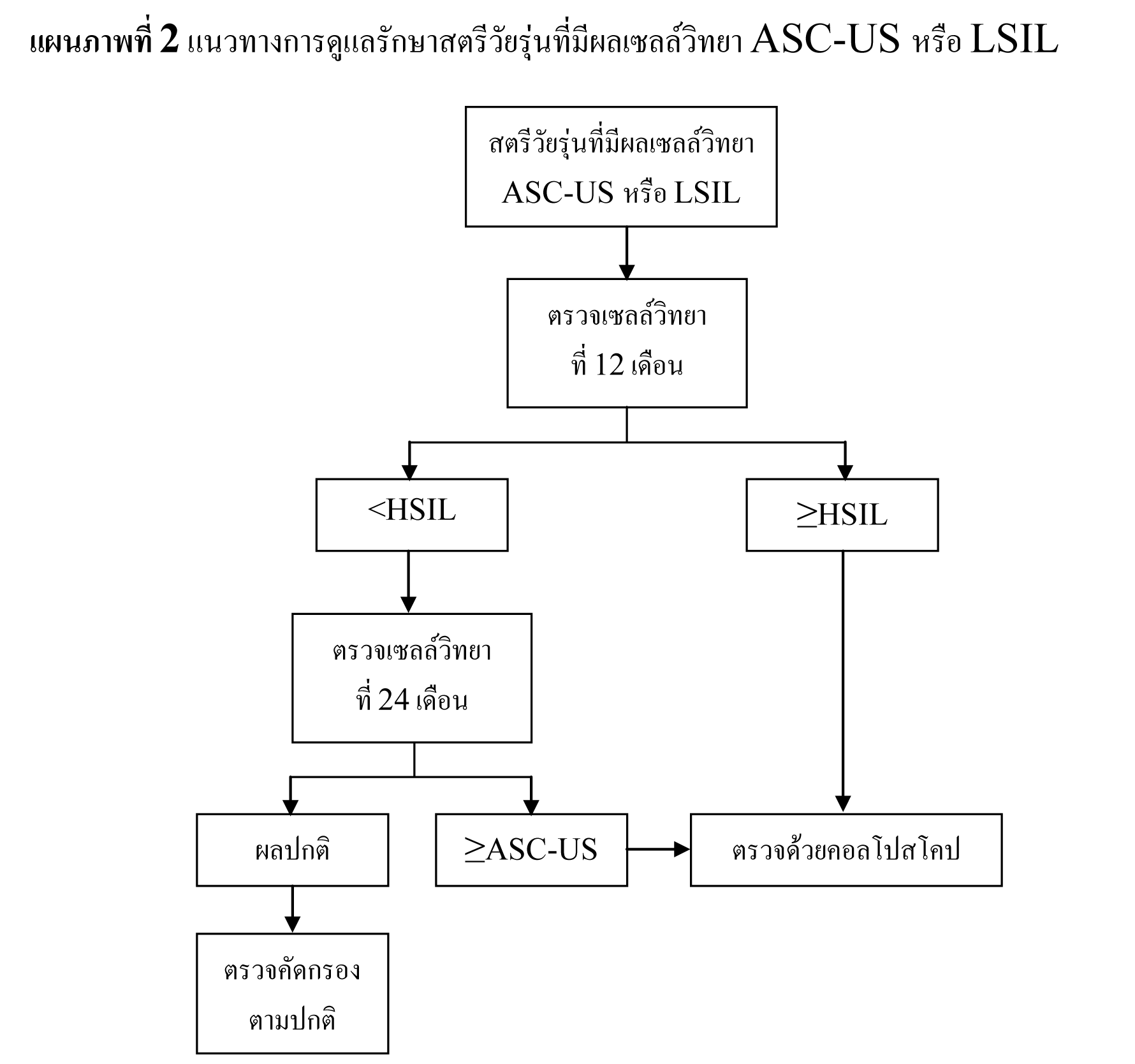
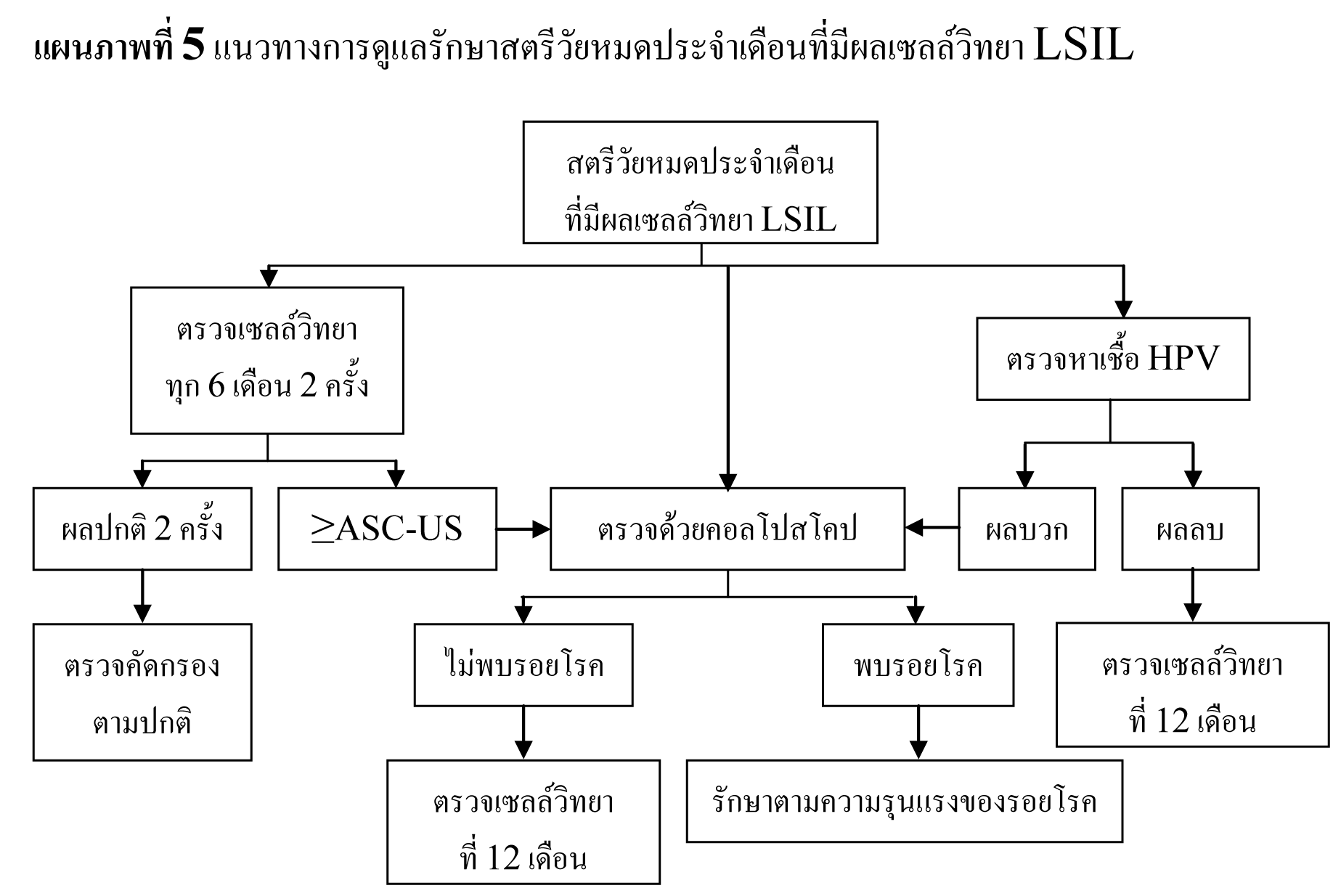
ในหญิงที่อายุน้อยกว่า 20 ปี ซึ่งมีความชุกในการติดเชื้อ HPV สูง และมี abnormal cytology เพียงเล็กน้อย เช่น ASC-US , LSIL มีโอกาสที่รอยโรคจะหายเองได้ถึง 90 % และมีโอกาสน้อยที่จะกลายเป็น invasive cancer ดังนั้นจึงไม่จำเป็นต้องทำ colposcopy ในระหว่างตั้งครรภ์ แต่ควรตรวจทาง cytology ซ้ำอีกทีหลังคลอด
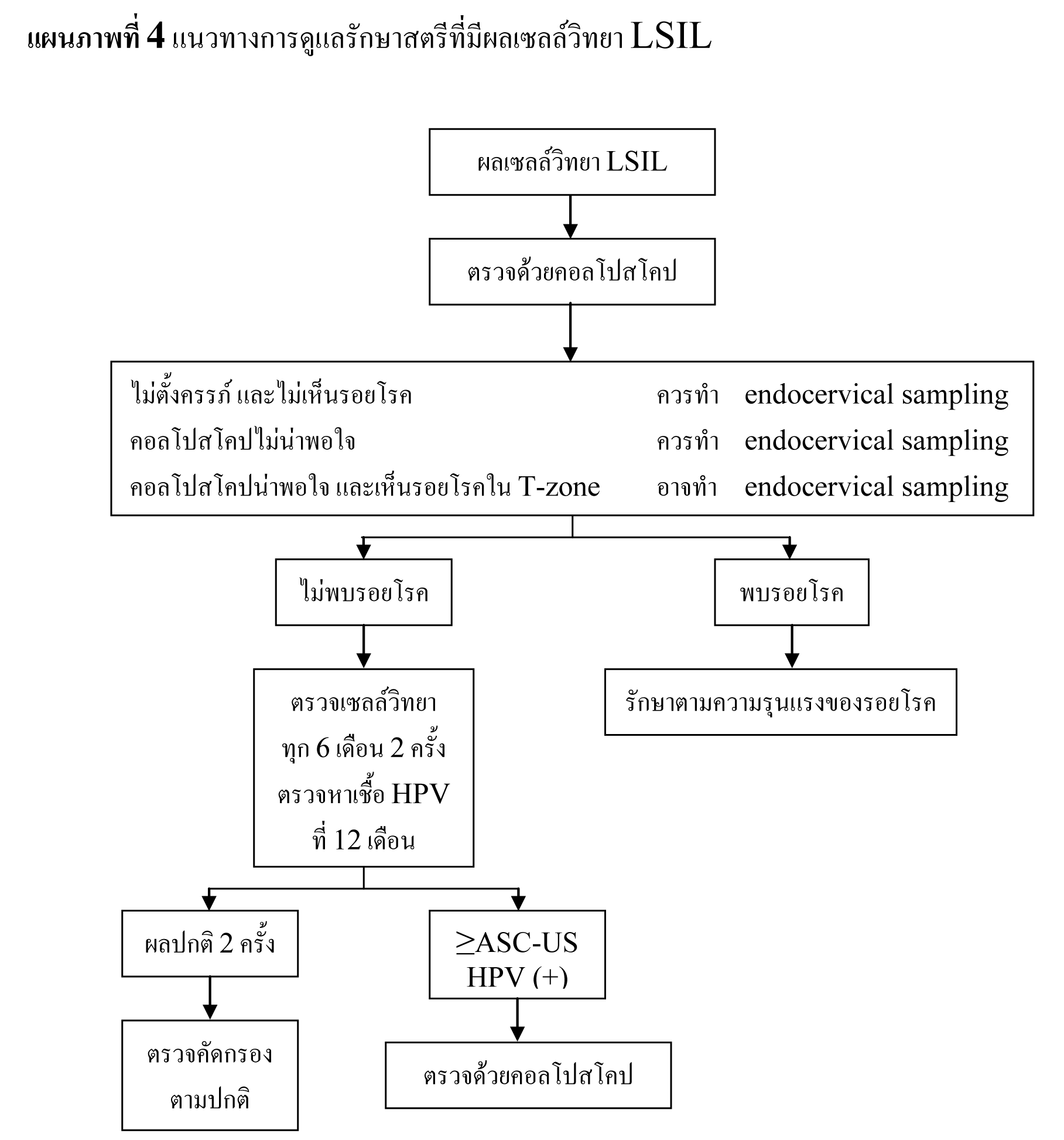
ในหญิงที่อายุมากกว่า 20 ปี ที่ตรวจพบ ASC-US และ LSIL ให้ตรวจต่อเหมือนหญิงที่ไม่ได้ตั้งครรภ์ แต่มีข้อยกเว้นที่อาจจะยืดเวลาที่จะทำ colposcopy ไปได้ถึง 6 สัปดาห์หลังคลอด
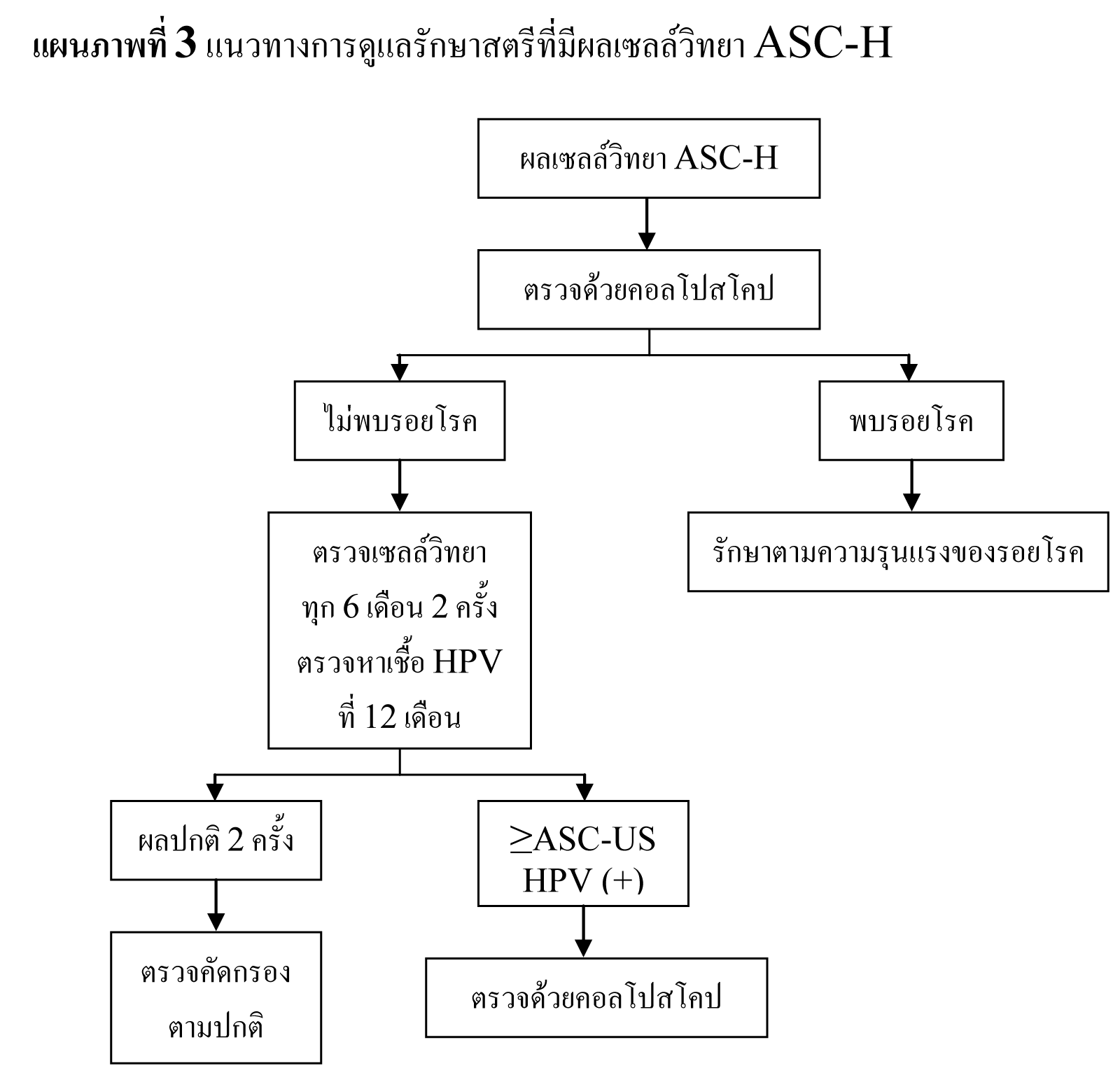
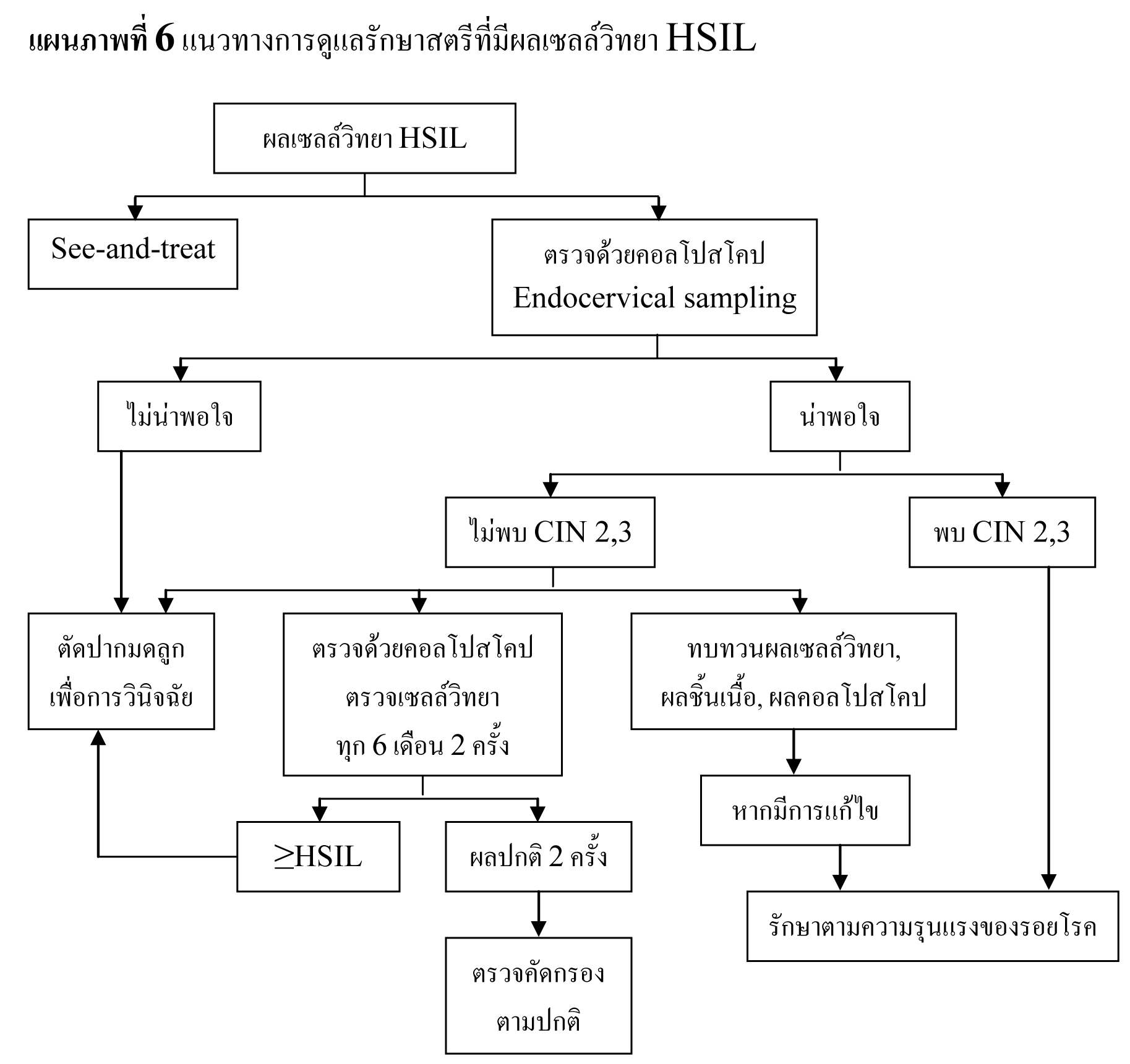
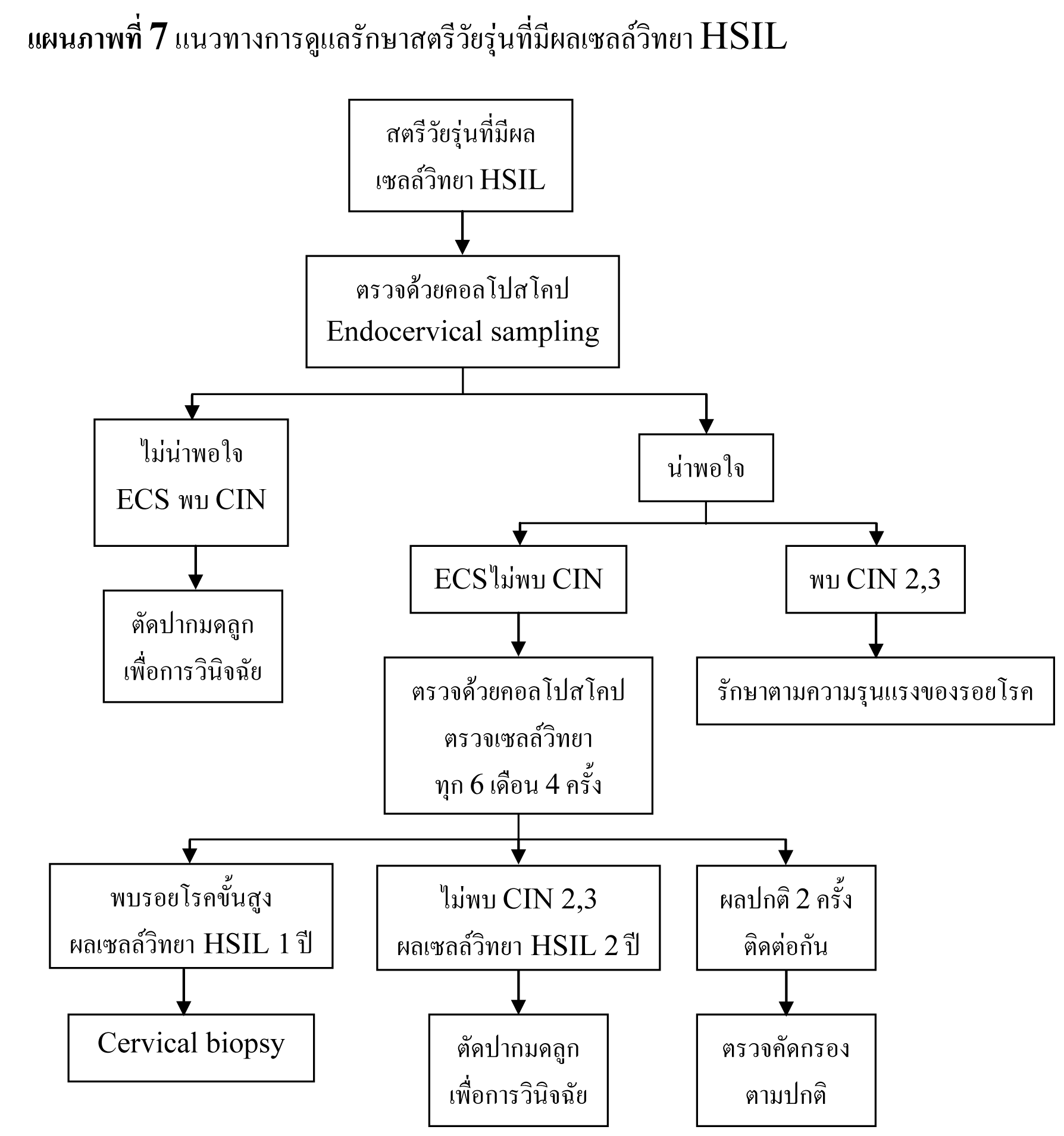
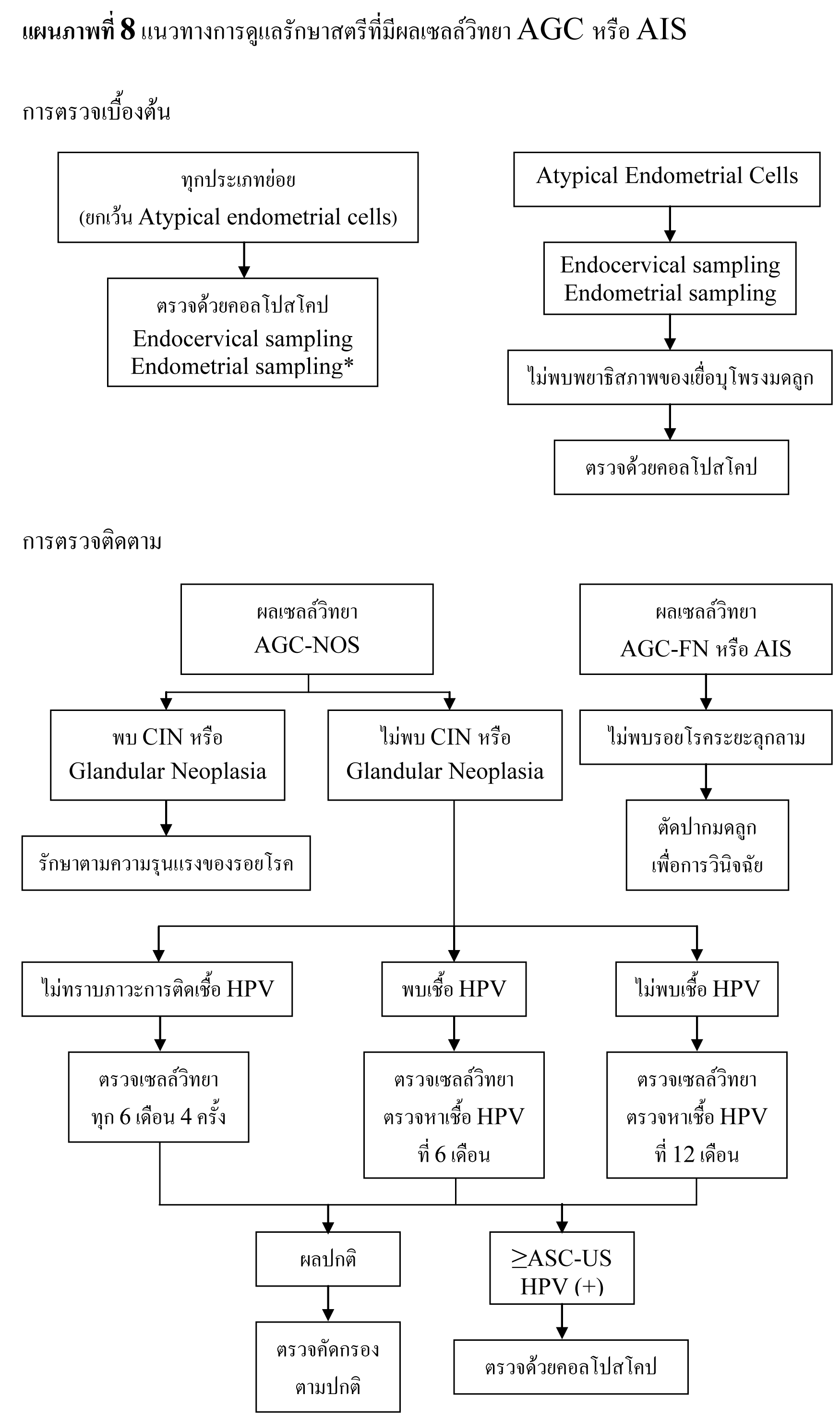
แนะนำให้ทำ colposopy ในทุกรายที่ผล cytology เป็น ASC-H , HSIL และ AGC
รอยโรคที่สงสัยว่าจะเป็น CIN 2,3 หรือมะเร็งให้ทำ biopsy ทุกราย
ไม่แนะนำให้ทำ endocervical curettage ในหญิงตั้งครรภ์
หากผลการตรวจ colposcopy ไม่สงสัย CIN 2,3 หรือมะเร็ง การตรวจ cytology เพิ่มเติมหรือ การตรวจ colposcope ซ้ำ ควรทำหลังคลอด แต่ไม่ควรเร็วกว่า 6 สัปดาห์หลังคลอด
Colposcopy
เมื่อพบว่า มี cytology ผิดปกติ ให้ตรวจด้วย colposcopy ต่อ การทำ cervical biopsy สามารถทำได้ในหญิงตั้งครรภ์ โดยไม่ได้พบว่าจะเพิ่มความเสี่ยงเรื่องการตกเลือด(8) และ/หรือถ้ามีก็สามารถทำให้หยุดได้โดยการใช้ monsel’ solution หรือ การเย็บ อย่างไรก็ตามไม่แนะนำให้ทำ endocervical curettage แม้ยังไม่มีหลักฐานชัดเจนว่าจะรบกวนการตั้งครรภ์(7)
การทำ colposcopy ในหญิงตั้งครรภ์ ต้องอาศัย colopscopist ที่มีประสบการณ์ ในการแยกระหว่างการเปลี่ยนแปลงที่ปากมดลูกเนื่องจากการตั้งครรภ์กับการเปลี่ยนแปลงจากมะเร็ง(8,9) เช่น การมี vascularity ที่เพิ่มขึ้นในการตั้งครรภ์ ทำให้ immature metaplastic epithelieum ทำปฏิกิริยากับกรดอะซิติกมากขึ้นกว่าปกติทำให้ดูคล้ายกับ dysplastic lesion(10) หรือบางที neoplastic lesion เองก็อาจมองไม่เห็นเนื่องจากมี eversion ของ squamocolumnar junction หรือการมี benign cervical decidualizatiom
หากการทำ colposcopy ในช่วงแรกๆ ของการตั้งครรภ์ให้ผลเป็น unsatisfactory การทำซ้ำอีกใน 6-12 สัปดาห์ต่อมามักให้ผล satisfactory เพราะ transformation zone มีการ migrated มาที่ ectocervix การทำ colposcopy ร่วมกับ direct biopsy จะให้ผลที่น่าเชื่อถือแค่ไหนนั้นไม่ขึ้นอยู่กับอายุครรภ์ แต่ขึ้นอยู่กับประสบการณ์ของ colposcopist มากกว่า(9)
Conization
การทำ conization ในหญิงที่ไม่ได้ตั้งครรภ์ ใช้วินิจฉัย invasive cancer เมื่อ punch biopsy บอกว่าเป็น microinvasive disease หรือ adenocarcinoma insitu แต่ในหญิงตั้งครรภ์แนะนำให้ทำเฉพาะเมื่อต้องการยืนยันภาวะ invasive cancer ซึ่งจะมีผลต่อเวลาและวิธีการคลอด อย่างไรก็ตามควรเลื่อนการทำ conization ไปทำในช่วงหลังคลอดจะได้ไม่มีผลกระทบกับการตั้งครรภ์( 11,12)
แต่ถ้าหากจะต้องทำ conization ในระยะก่อนคลอด ช่วงเวลาที่เหมาะสมคือช่วงไตรมาสที่ 2 ( แนะนำในช่วงอายุครรภ์ 14 – 20 สัปดาห์) และไม่ควรทำในช่วง 4 สัปดาห์ก่อนครบกำหนดคลอด เพราะการเจ็บครรภ์คลอดจะทำให้มีเลือดออกจากแผลมาก(13) นอกจากนี้การทำ conization ยังทำให้เกิดภาวะแทรกซ้อนอี่นๆ อีก เช่น การแท้ง , การเจ็บครรภ์คลอดก่อนกำหนด และการติดเชื้อ ส่วน fetal death พบได้แต่ไม่บ่อย
ในด้านเทคนิดแล้วเนื่องจากมีข้อจำกัดในการทำ wedge biopsy ในหญิงตั้งครรภ์ มีผู้เชี่ยวชาญแนะนำให้ตัดเป็น coin-shape specimen แทน cone เพื่อหลีกเลี่ยงการรบกวน endocervical canal , ลดการเสียเลือด และลดการรบกวน fetal membrane(14)
หากจะต้องทำ conization จริงๆ ก็มีการแนะนำให้ทำ cerclage หลัง conization(15)
Staging
ในมะเร็งปากมดลูกมีการใช้ clinical staging ตาม Federation of Gynecology and Obstetrics ( FIGO)
Physical examination : เนื่องจากการตรวจร่างกายเป็นส่วนที่สำคัญของ clinical staging หากการตรวจภายในตามปกติได้ข้อมูลไม่พอ แนะนำให้ตรวจภายใต้การดมยาสลบ
Imaging study : ในหญิงที่ไม่ได้ตั้งครรภ์มีการใช้ chest และ skeletal radiograph , IVP และ barium enema สำหรับ clinical staging แต่ในหญิงตั้งครรภ์มีข้อจำกัดในเรื่องการรับสารรังสี จึงมีคำแนะนำดังนี้
Chest X-ray ( with abdominal shieding) ให้ทำเฉพาะในผู้ป่วยที่เป็นโรคระยะมากกว่า microscopic cervical cancer เพื่อค้นหาการกระจายของโรคไปที่ปอด
สำหรับผู้ป่วยในระยะ IA และ IB ที่ขนาด tumor < 1 ซม. ซึ่งพบการลามของโรคออกนอกปากมดลูกได้น้อย สามารถงดทำ urinary imaging ได้
หญิงตั้งครรภ์ที่เป็นระยะ IB1 ที่ tumor ขนาดใหญ่ , IB2 หรือ advanced disease รวมถึงกลุ่ม high risk histology ( adenocarcinoma , small cell carcinoma ) ควรตรวจระบบปัสสาวะด้วยการทำ ultrasound หรือ MRI เพื่อแยกจากระยะ IIIB
นอกจากนี้ การทำ ultrasound และ/หรือ MRI มีประโยชน์ในการประเมินการกระจายของโรคไปที่ตับหรือระบบปัสสาวะ โดยที่ MRI จะมีข้อได้เปรียบในแง่ที่ให้ข้อมูลเรื่อง tumor size , parametrium involvement หรือ การกระจายที่ต่อมน้ำเหลือง ที่ดีกว่า
Lymphadenectomy
ในผู้ป่วยบางรายที่ต้องการตั้งครรภ์ต่อแต่มีความเสี่ยงสูงที่จะเกิด lymph node metastasis การทำ staging lymphadenectomy ผ่านทาง extraperitoneal หรือผ่านทาง laparoscope ก็จะทำให้ได้ข้อมูลของ lymph node ซึ่งจะมีประโยชน์ในการวางแผนการรักษา 16,17 )
Endoscopy
ไม่ได้แนะนำให้ทำ cystoscopy หรือ progtosigmoidoscopy แต่ถ้าหากมีความจำเป็นก็สามารถทำได้อย่างปลอดภัยภายใต้การดูแลของผู้เชี่ยวชาญ(18,19)
General principles of management
การดูแลผู้ป่วยต้องอาศัยผู้เชี่ยวชาญหลายๆ สาขามาร่วมกันวางแผน โดยมีประเด็นสำคัญที่ต้องพิจารณาคือ
การให้ตั้งครรภ์ต่อหรือจะยุติการตั้งครรภ์
ความเสี่ยงที่จะเกิดขึ้นหาก defintive treatment ล่าช้าออกไป
รูปแบบวิธีการรักษาเทียบกับในหญิงที่ไม่ได้ตั้งครรภ์
เวลาและวิธีการที่จะให้คลอด
หากทารกในครรภ์ term หรือ near term แนะนำให้คลอดแล้วเริ่มการรักษาในมารดาเลย แต่ถ้าการตั้งครรภ์อยู่ในช่วงที่อายุครรภ์ยังน้อยและทารกยังอยู่ในช่วง previable สามารถให้ทางเลือกในการยุติการตั้งครรภ์ได้แล้วทำการรักษาในมารดา หากมารดาต้องการที่จะตั้งครรภ์ต่อก็จะต้องพิจารณาเรื่องการคลอดและการรักษาอีกทีตามอายุครรภ์และระยะของโรค
มีการแนะนำให้ทำการรักษามารดาทันทีโดยไม่สนใจอายุครรภ์ หากพบว่าเป็นโรคระยะ locally advanced , มีข้อมูลของ lymph node metastasis, ผู้ป่วยต้องการรับการรักษาเลยทันที และมี progression ของโรคในระหว่างตั้งครรภ์(2)
Delaying treatment to minimize fetal / neonatal risks
การ delayed treatment สามารถทำได้ในผู้ป่วยระยะ IA ถึง IB1 ที่วินิจฉัยโรคได้ตอนอายุครรภ์อยู่ในช่วง late second และ early trimester เพื่อหลีกเลี่ยงผลกระทบกับทารกในครรภ์จากการรักษาโรค และการคลอดก่อนกำหนด โดยไม่เพิ่มความเสี่ยงกับมารดา ( 2,20,21) เนื่องจากพบว่า
ในหญิงที่ไม่ได้ตั้งครรภ์ เราสามารถรอผ่าตัดได้ถึง 6 สัปดาห์หลังการทำ conization โดยไม่มีผลเสียกับโรค( 22)
จากการทบทวนข้อมูลหญิงตั้งครรภ์ที่เป็นมะเร็งปากมดลูกระยะ IA- IB1 98 คน ที่ delayed treatment ไป 3-40 สัปดาห์ เพื่อรอ fetal maturation พบว่า 93 คนมีชีวิตอยู่โดยไม่พบการกลับเป็นโรคซ้ำ(20 )
มีการศึกษาแบบ case- control study เปรียบเทียบผลการรักษาในหญิงตั้งครรภ์ที่เป็นมะเร็งปากมดลูกระยะที่ I 45 คนกับตัวอย่างควบคุม 44 คน (21 ) พบว่า 23 คนมีอายุครรภ์เฉลี่ย 22 สัปดาห์ 10 คนในกลุ่มนี้ delayed treatment ไปถึง 8 สัปดาห์ มี overall five-year survival rate 80% ซึ่งใกล้เคียงกับที่พบในกลุ่ม control ( 82% )
ในกลุ่ม advanced disease ยังไม่มีข้อมูลเพียงพอ มีผู้เชี่ยวชาญให้ความเห็นว่าการรักษาไม่ควรที่จะเลื่อนออกไปหากขนาดก้อนเนื้องอกมีขนาดถึง 4 ซม. และพบว่ามีการกระจายของโรคไปที่ต่อมน้ำเหลืองแล้ว(23)
High grade preinvasive disease
สามารถเลื่อนการรักษาไปทำในช่วงหลังคลอดได้ เพราะมีการพบว่ามี progression ของรอยโรคไปเป็น invasive cancer น้อยในระหว่างการตั้งครรภ์ ( 0-0.4% ) และมีโอกาสที่จะมี regression ของรอยโรคหลังคลอดได้ แต่ยังไม่มีข้อมูลว่าการคลอดทางช่องคลอดหรือการผ่าตัดคลอดทางหน้าท้องจะมีผลอย่างไรต่อการ regression ของรอยโรค(24,25)
Microinvasive disease ( stage IA1 )
หากมีการทำ conization แล้วผล pathology ยืนยันว่าป็นระยะ IA1 จริง ควรติดตามผู้ป่วยต่อด้วยการตรวจร่างการ/ตรวจภายใน และการทำ colposcopy trimester ละครั้ง ไปตลอดการตั้งครรภ์ ส่วนการคลอดแนะนำให้คลอดทางช่องคลอด ทำการผ่าตัดคลอดทางหน้าท้องเฉพาะเมื่อมีข้อบ่งชี้ทางสูติศาสตร์ แล้วตรวจ colposcopy พร้อมกับทำ biopsy และทำ endocervical curettage อีกครั้ง 6-8 สัปดาห์หลังคลอด
หากหลังทำ conization แล้วพบว่า cervical margin positive for dysplasia ซึ่งมีความเสี่ยงที่จะเหลือ residual disease ในมดลูก 22 % และมีโอกาสที่จะเป็นมากกว่า microinvasive disease ได้ 10 % (26) ดังนั้นจึงแนะนำให้ติดตามผู้ป่วยด้วยการตรวจร่างกายทุก 1 เดือน ตรวจด้วยการทำ colposcopy ทุก trimester ให้คลอดด้วยการผ่าตัดคลอดทางหน้าท้อง แล้วทำ conization ซ้ำหลังคลอด
หลังทำ conization ซ้ำหลังคลอดแล้วพบว่าไม่มี residual disease เหลือ หากผู้ป่วยยังต้องการมีบุตรต่อ ให้ตรวจติดตามต่อไปอย่างใกล้ชิดเพื่อเฝ้าระวังการเกิดโรคซ้ำ(27) แต่หากผู้ป่วยมีบุตรเพียงพอแล้วแนะนำให้ทำ extrafascial hysterectomy ไปเลยโดยไม่ต้องเลาะต่อมน้ำเหลือง เพราะมีน้อยกว่า 5% ที่ระยะIA1 จะมี recurrent หรือ มี metastasis
การทำ cesarean hysterectomy เป็นทางเลือกหนึ่งสำหรับระยะ IA1 หากผู้ป่วยต้องคลอดด้วยการผ่าตัดคลอดทางหน้าท้องตามข้อบ่งชี้ทางสูติศาสตร์ แต่จะต้องชั่งระหว่างประโยชน์ที่จะได้รับและความเสี่ยงเรื่องภาวะแทรกซ้อนที่อาจจะเกิดขึ้น อย่างไรก็ตามแม้ในผู้ป่วยที่ทำ conization แล้วพบว่ามี cervical margin positive ที่ต้องคลอดด้วยการผ่าตัดทำคลอดทางหน้าท้อง ก็ยังแนะนำให้รอทำ colposcope ซ้ำหลังคลอดก่อนแล้วพิจารณาเรื่องทำ hysterectomy ตามข้อบ่งชี้ทีหลัง
Early stage invasive disease ( stage IA2, IB , nonbulky IIA )
ผู้ป่วยในกลุ่มนี้ใช้แนวทางการรักษาแบบเดียวกับผู้ป่วยที่ไม่ได้ตั้งครรภ์ คือ รักษาด้วยการผ่าตัด หรือ การให้เคมีบำบัดร่วมกับรังสีรักษา( ตั้งแต่ระยะ IB ขึ้นไป ) ซึ่งให้ผลการรักษาดีทัดเทียมกัน แต่แตกต่างกันในแง่ของผลข้างเคียงและภาวะแทรกซ้อน
การผ่าตัด ในกรณีที่ผู้ป่วยเลือกที่จะยุติการตั้งครรภ์ก็มีทางเลือกของ radical hysterectomy with fetus in situ
Radical cesarean hysterectomy เนื่องจากผู้ป่วยในกลุ่มนี้แนะนำให้คลอดโดยการผ่าตัดคลอดทางหน้าท้องอยู่แล้ว จึงมีทางเลือกในการทำ radical hysterectomy และเลาะต่อมน้ำเหลือง ( pelvic / paraaortic lymphadenectomy ) หลังทารกคลอดและเย็บมดลูกแล้ว แต่วีธีนี้มักจะทำให้เสียเลือดมากกว่าการผ่าตัดในหญิงที่ไม่ได้ตั้งครรภ์(28,29) อย่างไรก็ตามมีข้อมูลว่าไม่ได้มีภาวะแทรกซ้อนอื่น เช่น ระยะเวลาในการนอนโรงพยาบาล , ระยะเวลาในการฟื้นตัวของระบบปัสสาวะ , การติดเชื้อหรือแผลแยก เพิ่มขึ้นมากกว่า(29) ดังนั้นต้องเทียบว่าประโยชน์ที่ได้จะคุ้มกับความเสี่ยงเรื่องการเสียเลือดหรือไม่
Radical trachelectomy การทำ trachelectomy ร่วมกับการเลาะต่อมน้ำเหลืองใน 6 – 8 สัปดาห์หลังคลอดเป็นอีกทางเลือกหนึ่งในผู้ป่วยระยะ IA2 หรือ IB1 ที่ยังต้องการมีบุตรเพิ่มอีก(30,31)
แต่ในระหว่างตั้งครรภ์มีรายงานผู้ป่วยมะเร็งปากมดลูกระยะ IB1 แค่ 6 คน ที่ทำ radical trachelectomy(32,33) ในช่วงอายุครรภ์ 7- 18 สัปดาห์ ซึ่งพบว่า 3 คน มี fetal loss ในช่วง 1- 16 วันหลังผ่าตัด ส่วนอีก 3 คน สามารถคลอดเมื่ออายุครรภ์เกิน 36 สัปดาห์ และไม่พบการกลับมาเป็นโรคซ้ำในมารดาหลังจากติดตามไปในช่วง 9 – 54 เดือน เนื่องจากมีอัตราการเกิด fetal loss สูงดังนั้นจึงไม่แนะนำให้ทำ radical trachelectomy ในระหว่างตั้งครรภ์
Radiotherapy
ในช่วงแรกของการตั้งครรภ์ การได้รับรังสีรักษาจะทำให้ทารกเสียชีวิตตั้งแต่อยู่ในครรภ์ พบว่าผู้ป่วยที่ได้รับรังสีทั้งหมด 40 Gy จะเกิด fetal loss ได้ถึง 70%(34,35) ในช่วง second trimester fetal loss จะเกิดช้ากว่าในช่วง fist trimester เนื่องจากมีความไวต่อรังสีลดลง ดังนั้นจึงแนะนำให้ evacuate เอาทารกออกจากมดลูกก่อนเริ่มทำการรักษาด้วยรังสีรักษาในคนที่อายุครรภ์มากกว่า 20 สัปดาห์(36)
Chemoradiotherapy
การให้รังสีรักษาร่วมกับการให้เดมีบำบัดในกลุ่ม platinum-based chemotherapy มีรายงานการให้ในผู้ป่วย 4 รายที่ตั้งครรภ์ในช่วง second trimester ตั้งแต่ยังมีทารกอยู่ในครรภ์ พบว่าทารกในครรภ์เสียชีวิตหมด(37,38)
Neoadjuvant chemotherapy
ในผู้ป่วยมีก้อนเนื้องอกมะเร็งขนาดใหญ่ และอยู่ในระยะ locally advanced cancer จะมีการรักษาโดยการให้ neoadjuvant chemotherapy ซึ่งการศึกษา Two phase III trails ในหญิงที่ไม่ได้ตั้งครรภ์พบว่า มี survival benefit ที่ดีกว่าการผ่าตัดอย่างเดียว , รังสีรักษาอย่างเดียว หรือ การให้เคมีบำบัดร่วมกับรังสีรักษา(39,40)
ได้มีการเริ่มให้ neoadjuvant chemotherapy ในหญิงตั้งครรภ์ระยะ locally advanced ที่ไม่ต้องการยุติการตั้งครรภ์และไม่ต้องการวิธีการรักษาที่ทำให้ทารกในครรภ์เสียชีวิต โดยมีเป้าหมายในการควบคุมให้โรคไม่ลุกลามเพิ่มจนกว่าทารกจะคลอดได้อย่างปลอดภัย
มีรายงานผู้ป่วย 9 รายที่รับการรักษาด้วยวิธีนี้ โดยมีอายุครรภ์อยู่ในช่วง 14-23 สัปดาห์ ได้รับ cisplatin อย่างเดียวหรือร่วมกับยาตัวอื่น เช่น bleomycin , vincristine หรือ paclitaxel 2-7 รอบ พบว่า 4 คนที่เป็นโรคระยะ IB มีผลการรักษาที่ดี แต่ที่เหลืออีก 5 คนที่เป็นโรคระยะ IIA – IIIB เสียชีวิตจากโรค ส่วนลูกทั้ง 9 คนสุขภาพแข็งแรงดี ไม่พบ congenital anomaly หลังจากติดตามไปถึง 5-80 เดือน(20,41,42)
Chemotherapy in pregnancy
ผลกระทบจากการได้รับเคมีบำบัดต่อทารกนั้นขึ้นอยู่กับอายุครรภ์ , ชนิดของเคมีบำบัด และปริมาณยาที่ได้รับ(43) cisplatin เป็นเคมีบำบัดตัวที่ใช้บ่อยในการรักษามะเร็งปากมดลูก แต่ข้อมูลการใช้ในหญิงตั้งครรภ์ยังมีน้อย
การศึกษาในสัตว์ทดลองพบว่าเพิ่มการเกิด fetal loss แต่สังเกตไม่พบผลด้าน teratogenic effect(44,45) จากการทบทวนข้อมูลการใช้ในหญิงตั้งครรภ์พบว่า มีทารก 2 รายที่มีภาวะโตช้าในครรภ์ , 2 รายมี moderate bilateral hearing loss และทารก 1 รายมี isolated ventriculomegaly แต่ยังไม่สามารถยืนยันได้ว่าเป็นผลมาจาก cisplatin จริงๆ(46)
มีรายานการเกิด transient neutropenia ในทารกแรกคลอดที่เคยสัมผัสกับ cisplatin ตั้งแต่อยู่ในครรภ์ ซึ่งเป็นผลข้างเคียงที่ทราบกันดีอยู่แล้ว ดังนั้นควรให้เคมีบำบัดครบอย่างน้อย 3 สัปดาห์ก่อนทารกคลอด เพื่อให้ไขกระดูกกลับมาทำงานเป็นปกติเหมือนเดิม และให้รกได้มีเวลากำจัดยาจากทารกในครรภ์ แนะนำว่าควรหลีกเลี่ยงการให้เคมีบำบัดในช่วงท้ายของ third trimester(47)
แนะนำว่าควรพิจารณาให้เคมีบำบัดในผู้ป่วยระยะ IB2, IIA , และ IIB ช่วงแรกๆ ที่ต้องการ neoadjuvant chemotherapy ( NAC ) และต้องการที่จะตั้งครรภ์ต่อจริงๆ หากอายุครรภ์ประมาณ 20 สัปดาห์ และต้องการตั้งครรภ์ต่อ ก็มีความเหมาะสมที่จะให้ทางเลือกเป็นเคมีบำบัดเพื่อรอ fetal maturity ในช่วงระยะ 6-10 สัปดาห์ ซึ่งใกล้เคียงกับการให้ NAC ในหญิงที่ไม่ได้ตั้งครรภ์ แต่สำหรับกรณีที่อายุครรภ์ น้อยกว่า 20 สัปดาห์ ยังไม่พบว่ามีประโยชน์หากต้องให้เคมีบำบัดเป็นเวลานานเมื่อเทียบกับความเสี่ยงที่จะเกิดขึ้นกับมารดา
Stage IIB or high
การให้ chemoradiotherapy เป็นการรักษามาตรฐานในผู้ป่วยระยะ IIB ถึงระยะ IVA ขณะที่ผู้ป่วยระยะ IVB ต้องการการรักษาที่เป็นแบบ systemic มากกว่า อาจเริ่มให้ chemotherapy ในระหว่างที่ตั้งครรภ์ไปเลย การรักษาผู้ป่วยกลุ่มนี้ใช้หลักการและวิธีการรักษาแบบเดียวกับผู้ป่วยที่ไม่ได้ตั้งครรภ์
Delivery route
ยังไม่มี randomized trails ที่ศึกษาเกี่ยวกับ maternal outcome ที่สัมพันธ์กับวิธีการคลอด แต่มีretrospective และ case- controlled study ที่ให้ข้อมูลว่าการคลอดทางช่องคลอดไม่มีผลต่อ prognosis ของมารดา ในผู้ป่วยที่เป็น microscopic cervical cancer ดังนั้นผู้ป่วยระยะ IA1 ที่ cervical margin negative จากการทำ conization ควรให้คลอดทางช่องคลอดและผ่าตัดคลอดเฉพาะเมื่อมีข้อบ่งชี้ทางสูติศาสตร์(48)
การคลอดทางช่องคลอดควรหลีกเลี่ยงในกรณีที่ก้อนมะเร็งมีขนาดใหญ่ และมีลักษณะที่เปราะ เพราะว่าจะเพิ่มความเสี่ยงในการตกเลือดและขัดขวางการคลอด(49,50) นอกจากนี้ยังพบรายงานว่ามีผู้ป่วยมะเร็งปากมดลูก 15 คน ที่มีปัญหาเรื่องมะเร็งลามมาที่แผลฝีเย็บ(48) ดังนั้นในผู้ป่วยระยะตั้งแต่ IB ขึ้นไป แนะนำให้คลอดด้วยวิธีการผ่าตัดทำคลอดทางหน้าท้อง
Outcome
การศึกษาส่วนใหญ่ให้ข้อมูลว่า ไม่มีความแตกต่างกันในเรื่องของ prognosis ของโรคมะเร็งปากมดลูกในหญิงตั้งครรภ์กับหญิงที่ไม่ได้ตั้งครรภ์ เมื่อเทียบกันตามระยะของโรค แต่อย่างไรก็ตามข้อมูลยังมีจำกัด เช่น ในการศึกษาหนึ่งเป็นแบบ retrospective study(4) เปรียบเทียบหญิงตั้งครรภ์ 40 คนที่เป็นเมะเร็งปากมดลูกกับผู้หญิงที่เป็นมะเร็งปากมดลูก 89 คนที่ไม่ได้ตั้งครรภ์ พบว่า maternal survival ไม่ได้แตกต่างกันเมี่อติดตามผู้ป่วยไป 30 ปี อีกการศึกษาหนึ่งเป็น long-term series ขนาดใหญ่ ติดตามหญิงตั้งครรภ์ที่เป็น invasive cervical cancer พบว่ามีรายงานการเกิด second primary cancer 5.5% ซึ่งใกล้เคียงกับที่พบในหญิงทั่วไปที่อายุน้อยกว่า 50 ปี(51)
ผลกระทบของมะเร็งปากมดลูกต่อการตั้งครรภ์ยังไม่มีข้อมูลที่ชัดเจน บาง retrospective study บอกว่าไม่มีผลกับการตั้งครรภ์ ในแง่ของอายุครรภ์ที่คลอด , อัตราการคลอดก่อนกำหนด , ทารกโตช้าในครรภ์
หรือทารกตายคลอด เมื่อเทียบกับหญิงตั้งครรภ์ที่ไม่ได้เป็นมะเร็งปากมดลูก(4,28)
แต่ในทางตรงกันข้ามก็มีการศึกษาอื่นที่ให้ผลขัดแย้งกัน โดยพบว่าหญิงที่ได้รับการวินิจฉัยว่าเป็นมะเร็งปากมดลูกในช่วงที่ตั้งครรภ์หรือหลังคลอด มีอัตราการเกิด spontaneous หรือ iatrogenic prematurity ที่สูงกว่า ซึ่งส่งผลให้มีอัตราทารกแรกคลอดน้ำหนักน้อยสูงกว่าตามมา(52)
นอกจากนี้มีรายงานเรื่องการเกิดมะเร็งกระจายไปที่รก ในผู้ป่วยที่เป็น cervical squamous cell carcinoma ด้วย แต่พบเพียง 1 ราย(53)
REFERENCES
1. Smith, LH, Dalrymple, JL, Leiserowitz, GS, et al. Obstetrical deliveries associated with maternal malignancy in California, 1992 through 1997. Am J Obstet Gynecol 2001; 184:1504.
2. Duggan, B, Muderspach, LI, Roman, LD, et al. Cervical cancer in pregnancy: reporting on planned delay in therapy. Obstet Gynecol 1993; 82:598.
3. Van Calsteren, K, Vergote, I, Amant, F. Cervical neoplasia during pregnancy: diagnosis, management and prognosis. Best Pract Res Clin Obstet Gynaecol 2005; 19:611.
4. Zemlickis, D, Lishner, M, Degendorfer, P, et al. Maternal and fetal outcome after invasive cervical cancer in pregnancy. J Clin Oncol 1991; 9:1956.
5. Hopkins, MP, Morley, GW. The prognosis and management of cervical cancer associated with pregnancy. Obstet Gynecol 1992; 80:9.
6. Lee, RB, Neglia, W, Park, RC. Cervical carcinoma in pregnancy. Obstet Gynecol 1981; 58:584.
7. Wright TC, Jr, Massad, LS, Dunton, CJ, et al. 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests. Am J Obstet Gynecol 2007; 197:346.
8. Economos, K, Perez Veridiano, N, Delke, I, et al. Abnormal cervical cytology in pregnancy: a 17-year experience. Obstet Gynecol 1993; 81:915.
9. Baldauf, JJ, Dreyfus, M, Ritter, J, Philippe, E. Colposcopy and directed biopsy reliability during pregnancy: a cohort study. Eur J Obstet Gynecol Reprod Biol 1995; 62:31.
10. Burghardt E, Pickel H, Girardi F. Colposcopy-Cervical Pathology: Textbook and Atlas, Rev ed 3, Thieme, 1998.
11. Robinson, WR, Webb, S, Tirpack, J, et al. Management of cervical intraepithelial neoplasia during pregnancy with LOOP excision. Gynecol Oncol 1997; 64:153.
12. Douvier, S, Filipuzzi, L, Sagot, P. [Management of cervical intra-epithelial neoplasm during pregnancy]. Gynecol Obstet Fertil 2003; 31:851.
13. Muller, CY, Smith, HO. Cervical neoplasia complicating pregnancy. Obstet Gynecol Clin North Am 2005; 32:533.
14. DiSaia PJ, Creasman WT. Clinical Gynecologic Oncology, 6 ed, Mosby, 2002.
15. Goldberg, GL, Altaras, MM, Block, B. Cone cerclage in pregnancy. Obstet Gynecol 1991; 77:315.
16. Alouini, S, Rida, K, Mathevet, P. Cervical cancer complicating pregnancy: implications of laparoscopic lymphadenectomy. Gynecol Oncol 2008; 108:472.
17. Stan, C, Megevand, E, Irion, O, et al. Cervical cancer in pregnant women: laparoscopic evaluation before delaying treatment. Eur J Gynaecol Oncol 2005; 26:649.
18. Maikranz, P, Lindheimer, M, Coe, F. Nephrolithiasis in pregnancy. Baillieres Clin Obstet Gynaecol 1994; 8:375.
19. O’mahony, S. Endoscopy in pregnancy. Best Pract Res Clin Gastroenterol 2007; 21:893.
20. Karam, A, Feldman, N, Holschneider, CH. Neoadjuvant cisplatin and radical cesarean hysterectomy for cervical cancer in pregnancy. Nat Clin Pract Oncol 2007; 4:375.
21. van der Vange, N, Weverling, GJ, Ketting, BW, et al. The prognosis of cervical cancer associated with pregnancy: a matched cohort study. Obstet Gynecol 1995; 85:1022.
22. Method, MW, Brost, BC. Management of cervical cancer in pregnancy. Semin Surg Oncol 1999; 16:251.
23. Germann, N, Haie-Meder, C, Morice, P, et al. Management and clinical outcomes of pregnant patients with invasive cervical cancer. Ann Oncol 2005; 16:397.
24. Kaplan, KJ, Dainty, LA, Dolinsky, B, et al. Prognosis and recurrence risk for patients with cervical squamous intraepithelial lesions diagnosed during pregnancy. Cancer 2004; 102:228.
25. Ahdoot, D, Van Nostrand, KM, Nguyen, NJ, et al. The effect of route of delivery on regression of abnormal cervical cytologic findings in the postpartum period. Am J Obstet Gynecol 1998; 178:1116.
26. Roman, LD, Felix, JC, Muderspach, LI, et al. Risk of residual invasive disease in women with microinvasive squamous cancer in a conization specimen. Obstet Gynecol 1997; 90:759.
27. Ward, RM, Bristow, RE. Cancer and pregnancy: recent developments. Curr Opin Obstet Gynecol 2002; 14:613.
28. Monk, BJ, Montz, FJ. Invasive cervical cancer complicating intrauterine pregnancy: treatment with radical hysterectomy. Obstet Gynecol 1992; 80:199.
29. Sood, AK, Sorosky, JI, Krogman, S, et al. Surgical management of cervical cancer complicating pregnancy: a case-control study. Gynecol Oncol 1996; 63:294.
30. Covens, A, Shaw, P, Murphy, J, et al. Is radical trachelectomy a safe alternative to radical hysterectomy for patients with stage IA-B carcinoma of the cervix? Cancer 1999; 86:2273.
31. Dargent, D, Martin, X, Sacchetoni, A, Mathevet, P. Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 2000; 88:1877.
32. Ungár, L, Smith, JR, Pálfalvi, L, Del Priore, G. Abdominal radical trachelectomy during pregnancy to preserve pregnancy and fertility. Obstet Gynecol 2006; 108:811.
33. van de Nieuwenhof, HP, van Ham, MA, Lotgering, FK, Massuger, LF. First case of vaginal radical trachelectomy in a pregnant patient. Int J Gynecol Cancer 2008; 18:1381.
34. Creasman, WT. Cancer and pregnancy. Ann N Y Acad Sci 2001; 943:281.
35. Creasman, WT, Rutledge, FN, Fletcher, GH. Carcinoma of the cervix associated with pregnancy. Obstet Gynecol 1970; 36:495.
36. Prem, KA, Makowski, EL, McKelvey, JL. Carcinoma of the cervix associated with pregnancy. Am J Obstet Gynecol 1966; 95:99.
37. Ostrom, K, Ben-Arie, A, Edwards, C, et al. Uterine evacuation with misoprostol during radiotherapy for cervical cancer in pregnancy. Int J Gynecol Cancer 2003; 13:340.
38. Benhaim, Y, Haie-Meder, C, Lhommé, C, et al. Chemoradiation therapy in pregnant patients treated for advanced-stage cervical carcinoma during the first trimester of pregnancy: report of two cases. Int J Gynecol Cancer 2007; 17:270.
39. Germann, N, Haie-Meder, C, Morice, P, et al. Management and clinical outcomes of pregnant patients with invasive cervical cancer. Ann Oncol 2005; 16:397.
40. Sardi, JE, Giaroli, A, Sananes, C, et al. Long-term follow-up of the first randomized trial using neoadjuvant chemotherapy in stage Ib squamous carcinoma of the cervix: the final results. Gynecol Oncol 1997; 67:61.
41. Giacalone, PL, Laffargue, F, Benos, P, et al. Cis-platinum neoadjuvant chemotherapy in a pregnant woman with invasive carcinoma of the uterine cervix. Br J Obstet Gynaecol 1996; 103:932.
42. Palaia, I, Pernice, M, Graziano, M, et al. Neoadjuvant chemotherapy plus radical surgery in locally advanced cervical cancer during pregnancy: a case report. Am J Obstet Gynecol 2007; 197:e5.
43. Cardonick, E, Iacobucci, A. Use of chemotherapy during human pregnancy. Lancet Oncol 2004; 5:283.
44. Anabuki, K, et al. Reproductive studies on cisplatin. Yakuri to Chiryo 1982; 10:659.
45. Nagaoka, T, et al. Reproductive studies on cisplatin. Kiso to Rinsho 1981; 15:5769.
46. Caluwaerts, S, VAN Calsteren, K, Mertens, L, et al. Neoadjuvant chemotherapy followed by radical hysterectomy for invasive cervical cancer diagnosed during pregnancy: report of a case and review of the literature. Int J Gynecol Cancer 2006; 16:905.
47. Weisz, B, Meirow, D, Schiff, E, Lishner, M. Impact and treatment of cancer during pregnancy. Expert Rev Anticancer Ther 2004; 4:889.
48. Van den Broek, NR, Lopes, AD, Ansink, A, Monaghan, JM. “Microinvasive” adenocarcinoma of the cervix implanting in an episiotomy scar. Gynecol Oncol 1995; 59:297.
49. Baloglu, A, Uysal, D, Aslan, N, Yigit, S. Advanced stage of cervical carcinoma undiagnosed during antenatal period in term pregnancy and concomitant metastasis on episiotomy scar during delivery: a case report and review of the literature. Int J Gynecol Cancer 2007; 17:1155.
50. Tewari, K, Cappuccini, F, Gambino, A, et al. Neoadjuvant chemotherapy in the treatment of locally advanced cervical carcinoma in pregnancy: a report of two cases and review of issues specific to the management of cervical carcinoma in pregnancy including planned delay of therapy. Cancer 1998; 82:1529.
51. Pettersson, BF, Andersson, S, Hellman, K, Hellström, AC. Invasive carcinoma of the uterine cervix associated with pregnancy: 90 years of experience. Cancer 2010; 116:2343.
52. Dalrymple, JL, Gilbert, WM, Leiserowitz, GS, et al. Pregnancy-associated cervical cancer: obstetric outcomes. J Matern Fetal Neonatal Med 2005; 17:269.
53. Dildy GA, 3rd, Moise KJ, Jr, Carpenter RJ, Jr, Klima, T. Maternal malignancy metastatic to the products of conception: a review. Obstet Gynecol Surv 1989; 44:535.
54. Amer ,K.cervial cancer in pregnancy : a review . up to date september 2010