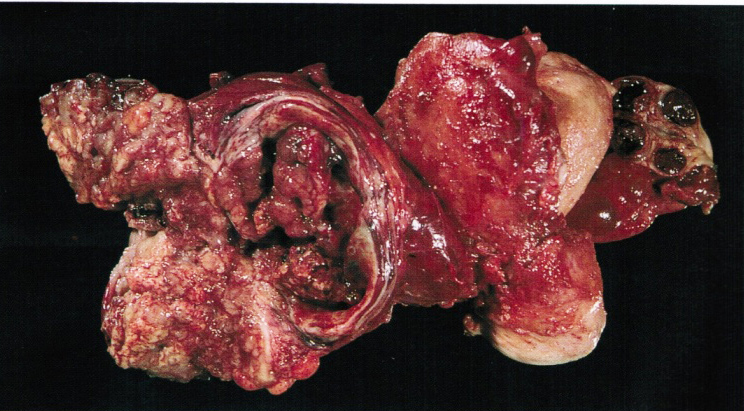
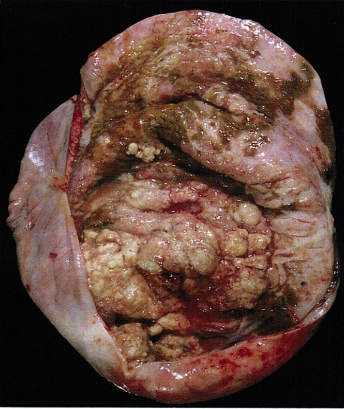
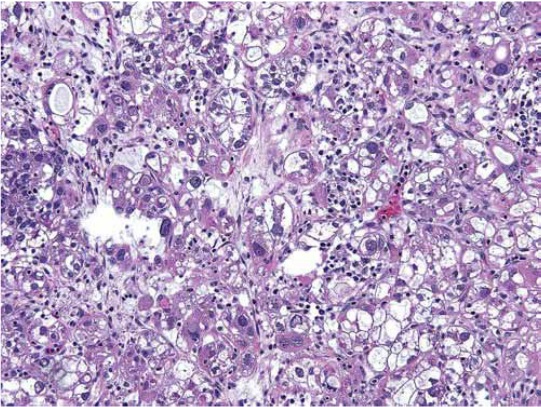
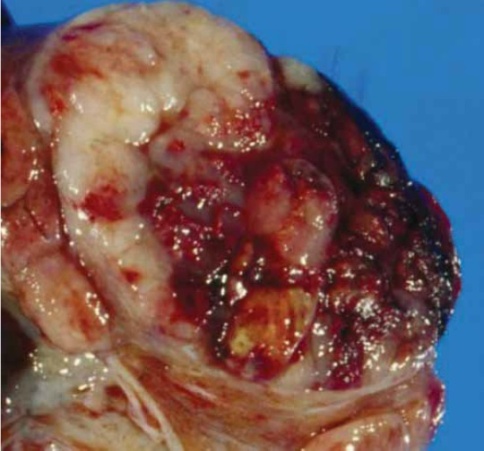
Fertility sparing surgery for invasive cervical cancer
พญ. พนิดา มีลาภกิจ
อาจารย์ที่ปรึกษา ผศ.พญ. จารุวรรณ แซ่เต็ง
คำนำ
สมาคมโรคมะเร็งแห่งประเทศสหรัฐอเมริกา (American cancer society) ได้สนับสนุนให้แพทย์อภิปรายเกี่ยวกับหัวข้อการมีบุตรในผู้ป่วยมะเร็งที่อยู่ในวัยเจริญพันธุ์ เพื่อนำไปใช้ประโยชน์ในผู้ป่วยโรคมะเร็งที่ยังมีความต้องการมีบุตร (1) ซึ่งเป็นเหตุผลหนึ่งที่มีอิทธิพลต่อทางด้านจิตใจและสังคมอย่างมีนัยสำคัญ ผู้ป่วยส่วนมากมีประสบการณ์ความรู้สึกหดหู่ ความเศร้าโศกเสียใจ ความเครียดและความรู้สึกทางเพศที่ลดลง (2, 3)
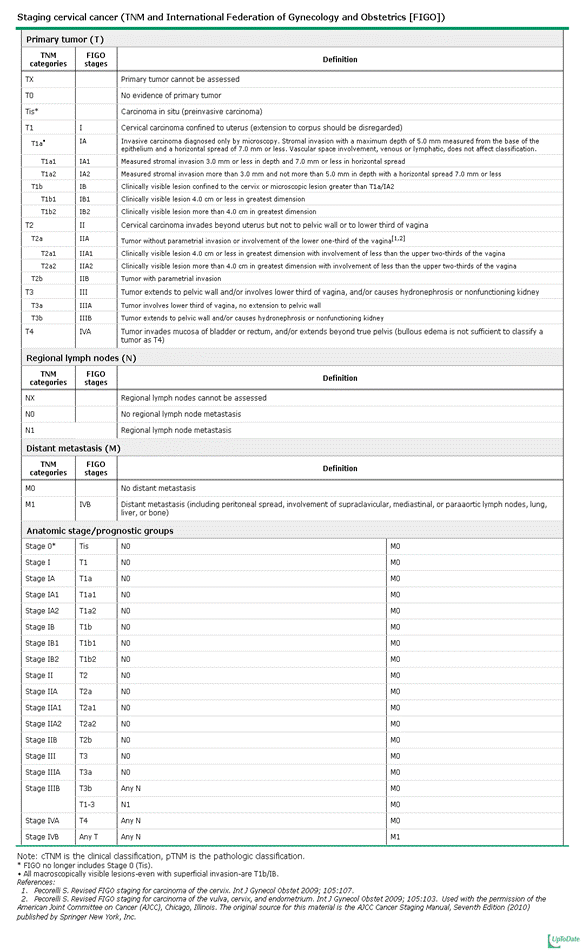
มีความน่าเป็นห่วงเกี่ยวกับการอนุรักษ์ภาวะการดำรงพันธุ์ในผู้ป่วยทางมะเร็งนรีเวช พบว่าร้อยละ 42 ของผู้ป่วยที่เป็นมะเร็งปากมดลูก ได้รับการวินิจฉัยเมื่ออายุน้อยกว่า 45 ปี (4) โดยผู้ป่วยกลุ่มนี้ได้รับการผ่าตัดเพื่อรักษาการดำรงพันธุ์ไว้ ได้แก่การผ่าตัด Radical trachelectomy, เมื่อได้รับการวินิจฉัยโรคระยะต้น (ตารางที่ 1) พบว่ามีโอกาสรอดชีวิตมากกว่าร้อยละ 90 (4) การศึกษานี้เป็นการศึกษาแบบสังเกตติดตาม (Observational study) ถูกตีพิมพ์ครั้งแรกเมื่อ 10 ปีที่ผ่านมา และพบว่ามีผลลัพธ์ที่ดีทั้งด้านมะเร็งและทางสูติศาสตร์
การตัดปากมดลูก(Conization) ในผู้ป่วยมะเร็งปากมดลูกระยะที่ IA1 (ตารางที่ 1) โดยจะทำเมื่อยังไม่มีการแพร่กระจายไปยังหลอดน้ำเหลือง (LVSI) ผู้ป่วยกลุ่มนี้จะได้รับการคัดเลือกให้ทำการรักษาโดยการตัดปากมดลูกเพียงอย่างเดียว (Cold knife conization) (5) จากข้อมูลการศึกษาของสถาบันมะเร็งแห่งชาติ จำนวน 1409 ราย ที่อายุน้อยกว่า 40 ปี ที่ได้รับการวินิจฉัยว่าเป็นมะเร็งปากมดลูกระยะที่ IA1 พบว่าไม่มีความแตกต่างกันในเรื่องของการมีชีวิตอยู่ในช่วง 5 ปี (5 yrs survival) ของผู้ป่วยที่ได้รับการตัดปากมดลูก เทียบกับการผ่าตัดมดลูก (Hysterectomy) คิดเป็นร้อยละ 98 และร้อยละ 99 ตามลำดับ (6)
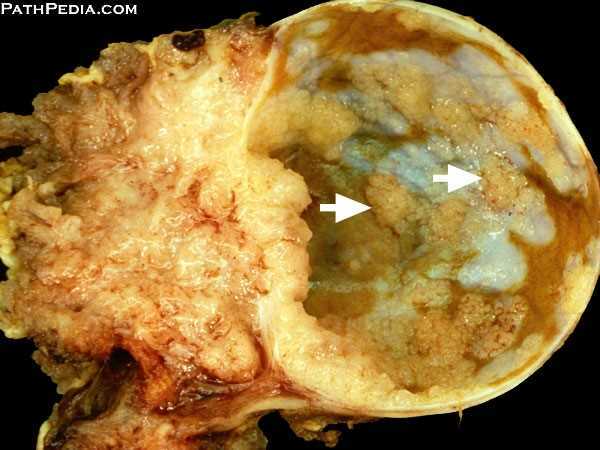
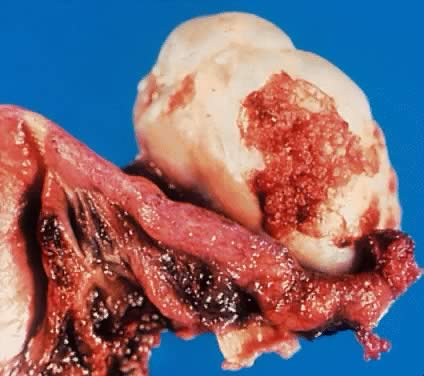
การตัดปากมดลูกและช่องคลอด (Vaginal radical trachelectomy) หรือ VRT ถูกพัฒนาขึ้นโดย Professor Danlel Dargent จาก Lyon ประเทศฝรั่งเศสตั้งแต่ปี ค.ศ. 1980s (7)
การคัดเลือกผู้ป่วย – เกณฑ์การคัดเลือกผู้ป่วยที่จะเข้ารับการผ่าตัด VRT ยังคงมีความสำคัญและถูกใช้มาตั้งแต่ครั้งแรกเมื่อปี ค.ศ.1998 และไม่ถูกเปลี่ยนแปลงจนถึงปัจจุบัน (8)
- ต้องการภาวะดำรงพันธุ์
- อายุน้อยกว่า 40 ปี (45 ปีได้รับการยกเว้นในบางราย)
- มะเร็งปากมดลูกระยะ IA1 ที่มีการรุกรานเข้าไปในหลอดเลือด (LVSI) , IA2 หรือ IB1
(ระยะ IA1 ที่ไม่มีการรุกรานเข้าหลอดเลือด สามารถรักษาโดยการตัดปากมดลูกเพียงอย่างเดียว)
- ขนาดรอยโรคน้อยกว่า 2-2.5 เซนติเมตรและจำกัดอยู่เฉพาะในปากมดลูกด้านใน (endocervical) โดยการตรวจด้วยวิธีส่องกล้อง (colposcopy) และการตรวจด้วยคลื่นแม่เหล็กไฟฟ้า(MRI)
- ผลพยาธิชิ้นเนื้อเป็น Squamous carcinoma หรือ Adenocarcinoma
- ไม่มีหลักฐานการแพร่กระจายไปยังหลอดเลือดหรือหลอดน้ำเหลือง
- ไม่มีหลักฐานการแพร่กระจายไปที่ต่อมน้ำเหลือง
- ไม่มีผลพยาธิชิ้นเนื้อที่รุนแรง(High risk histology เช่น Neuroendocrine)
การใช้เกณฑ์การคัดเลือกใน 1 กลุ่ม เฉลี่ยมีผู้ป่วยร้อยละ 40 ที่ผ่านการคัดเลือกเข้ารับการผ่าตัด VRT(9) อย่างไรก็ตาม เฉลี่ยร้อยละ 10-12 ของผู้ป่วย พบว่ามีการแผ่ขยายของรอยโรคเข้าไปในปากมดลูกเมื่อถึงเวลาผ่าตัดจริง หรือพบว่ามีการแพร่กระจายไปที่ต่อมน้ำเหลืองจากการตัดชิ้นเนื้อแช่แข็ง (Frozen) ซึ่งต้องทำการรักษาในขั้นตอนต่อไปเช่น การฉายแสง หรือการผ่าตัดโดยสมบูรณ์ (Radical hysterectomy) (10-13)
การประเมินก่อนการผ่าตัด
ก่อนเริ่มทำการผ่าตัด เป็นข้อตกลงกันให้ใช้การตรวจทางคลื่นแม่เหล็กไฟฟ้า(MRI) ดูภายในอุ้งเชิงกรานของผู้ป่วยทุกราย ที่มีก้อนเนื้องอกที่สามารถมองเห็นได้ด้วยตาเปล่า (14) จากภาพตัดขวางระดับ T2 จะเห็นภาพที่ชัดเจนทั้งด้านขนาดและตำแหน่งของก้อน ระดับความกว้างที่เข้าสู่ปากมดลูกด้านใน ความยาวของปากมดลูก และระยะห่างของขอบบนสุดของรอยโรคและ isthmus (15) ในระยะหลัง การวัดขนาดต้องพิถีพิถันเป็นพิเศษ เพราะว่าในรายที่ระยะห่างน้อยกว่า 1 เซนติเมตร มีสิทธิที่จะได้รับการให้ Neoadjuvant chemotherapy (NACT) ครั้งแรกและก่อนผ่าตัด VRT ต่อไป
วิธีการปฏิบัติ
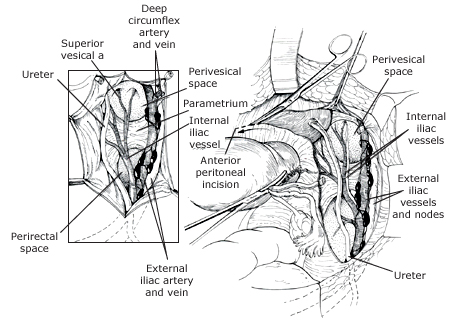
การผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองนั้นสามารถทำได้ตั้งแต่ครั้งแรก นอกจากรายที่มีการแพร่กระจายไปที่ต่อมน้ำเหลืองแล้ว ซึ่งเป็นข้อห้ามในการผ่าตัดแบบดำรงพันธุ์(16) แม้ว่าจะมีการทำแผนที่ sentinel node มาแทนวิธีนี้
ซึ่งน่าเชื่อถือกว่า ซึ่งสามารถใช้ได้ในการรักษามะเร็งปากมดลูกระยะเริ่มแรก แต่ก็ยังไม่มีการยืนยันแน่นอน
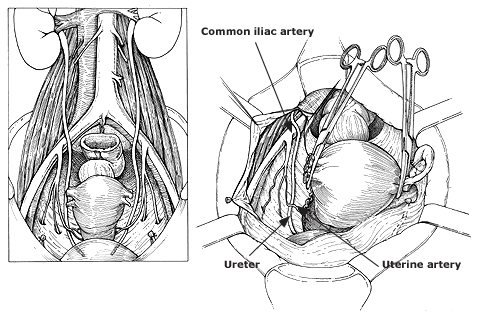
รายละเอียดประกอบคำบรรยายของการผ่าตัด VRT สามารถสรุปขั้นตอนได้ 6 ขั้นตอนดังนี้
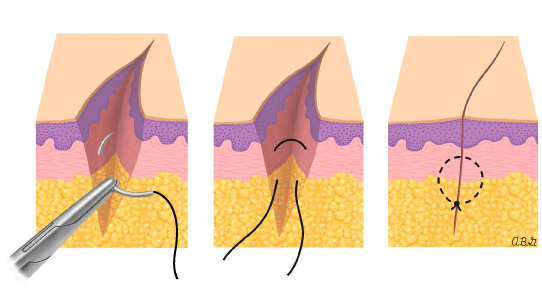
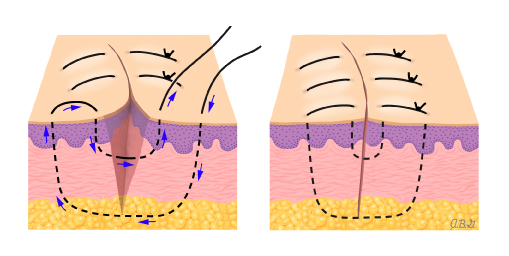
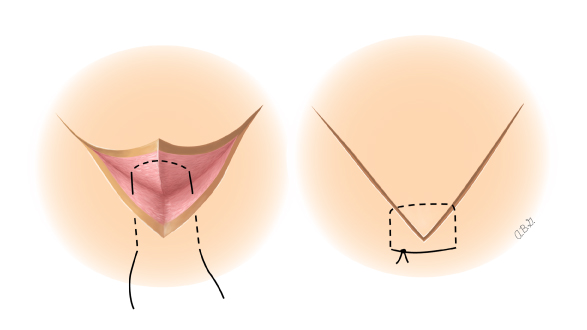
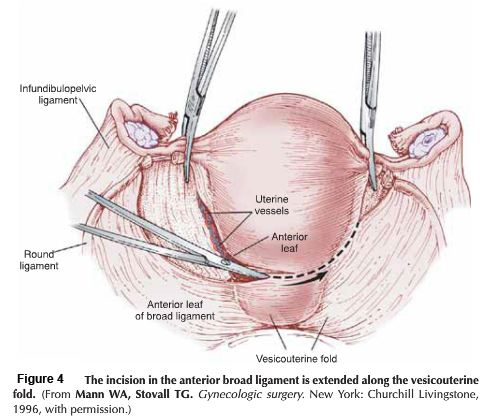
- Preparatory phase: ลากเส้น 1-2 เซนติเมตร บริเวณเยื่อบุช่องคลอดที่อยู่รอบปากมดลูกและตัดออก ขอบทางด้านหน้าและด้านหลัง กะประมาณว่าสามารถมาเชื่อมกันได้ในแนวกึ่งกลาง เพื่อปิดบริเวณปากมดลูก
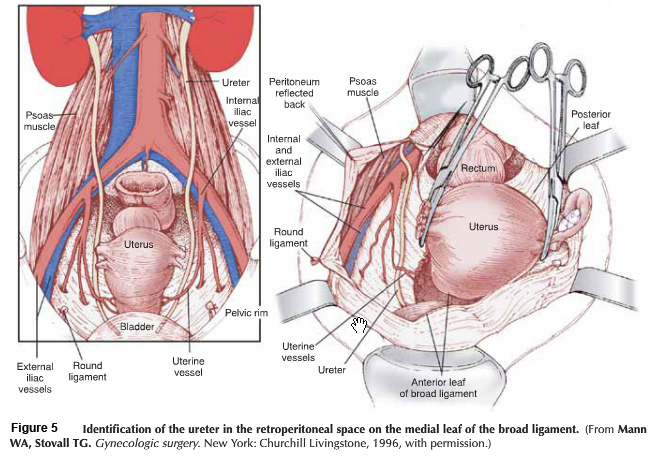
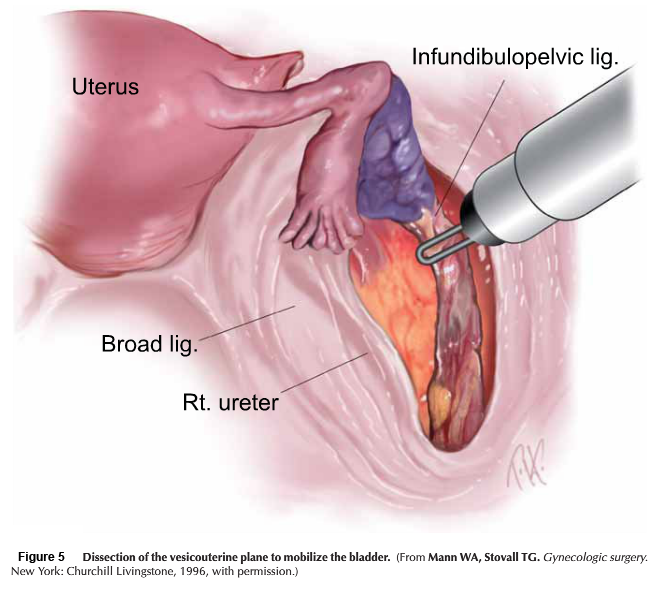
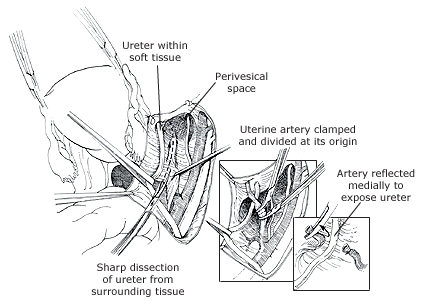
- Anterior phase: กำหนดขอบเขตของ vesicovaginal space ทางด้านหน้าให้ชัดเจน เพื่อความปลอดภัยต่อของกระเพาะปัสสาวะ ต้องเห็น paravesicle space ชัดเจนทางด้านข้าง สามารถใช้ bladder pillar ช่วยได้ และคลำ ureter และแยกออกมาให้เห็นชัดเจนเพื่อความปลอดภัย
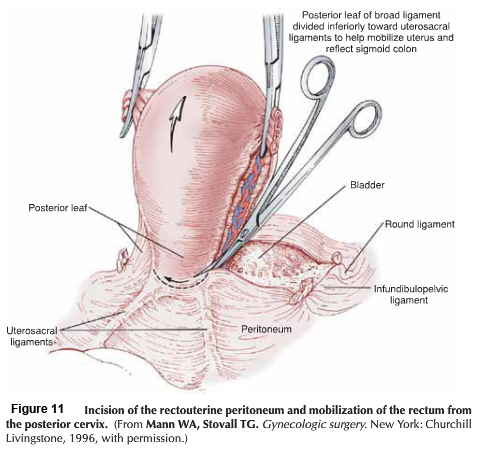
- Posterior phase: ทางด้านหลังของ Cul-de-sac (pouch of Douglas) ถูกเปิดออก แยกด้าน pararectal ให้ชัดเจนและตัดบริเวณ proximal ของ uterosacral ligament ออกไป
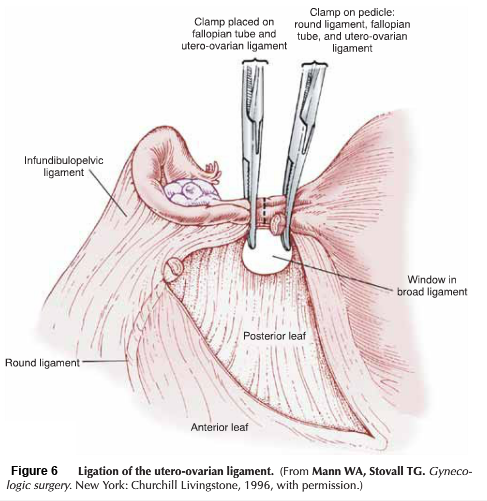
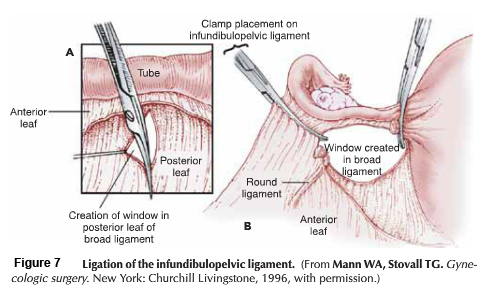
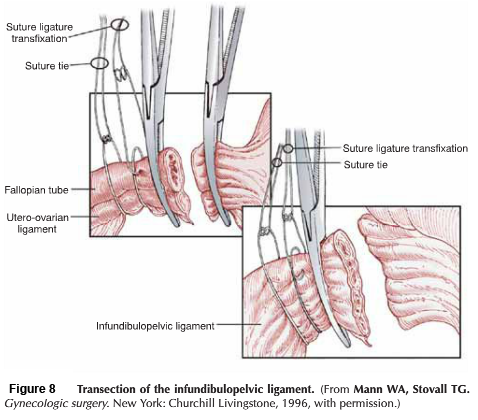
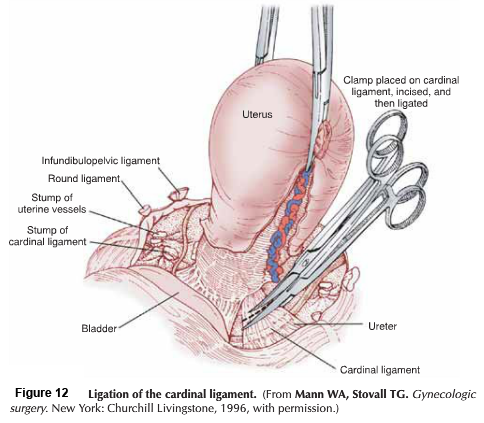
- Lateral phase: หลังจากเห็นตำแหน่งของ ureter แล้ว ตัดชิ้นเนื้อบริเวณ proximal ของ parametrial ที่ระดับเดียวกับ isthmus ออกไป , ต้องระมัดระวังเก็บเส้นเลือดสาขาของ uterine artery ไว้เพื่อให้เกิดผลดีต่อการหล่อเลี้ยงมดลูกขณะตั้งครรภ์ แม้ว่า ureteral stent สามารถที่จะทำให้เห็น ureter ที่ชัดเจนได้ แต่ก็มีการรายงานว่าพบไตวายทุติยภูมิ( secondary renal failure) ทำให้เกิดการบวมบริเวณรูทางเข้าของ ureter จากการใส่ stent ได้ (18)
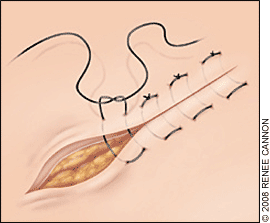
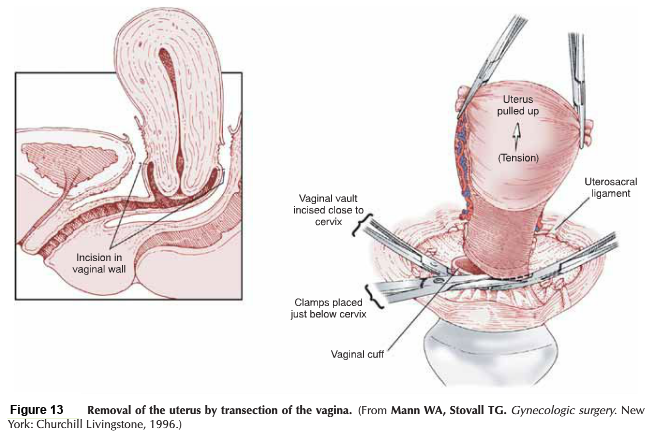
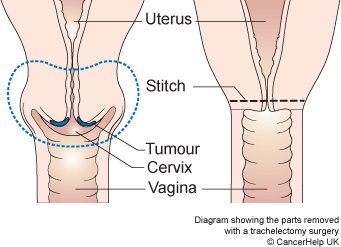
- Excision: ชิ้นส่วน Trachelectomy ถูกตัดออกเฉลี่ยประมาณ 1 เซนติเมตร ต่ำกว่า isthmus และตามด้วยการทำการขูดด้านในปากมดลูก (endocervical curettage)
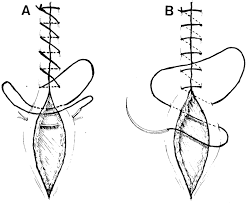
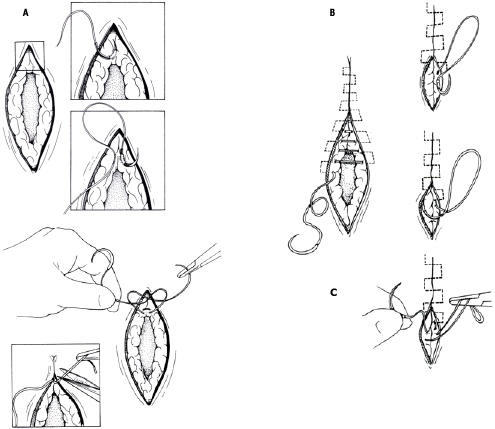
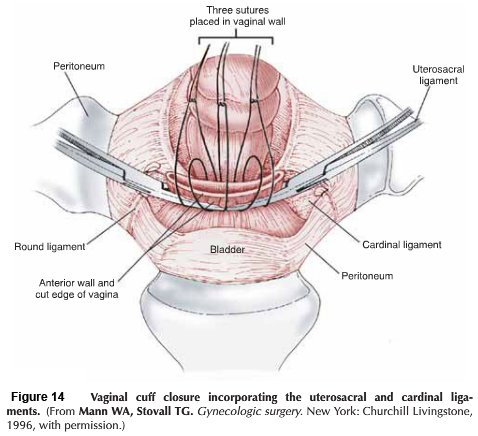
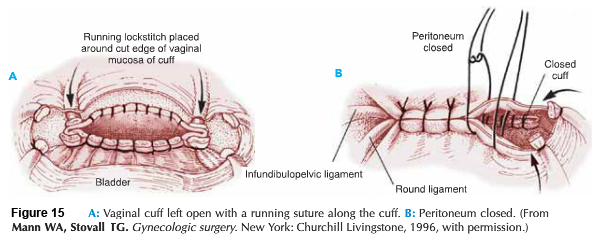
- Closure : เย็บปิดบริเวณด้านหลัง Cul-de-sac ด้วยวิธี purse string และทำการเย็บปิดแบบถาวรที่ระดับ Isthmus , เยื่อหุ้มบริเวณช่องคลอด ถูกดึงกลับมาชิดกันอีกครั้ง เพื่อทำปากมดลูกนอกอันใหม่ และเย็บปิดด้วยวิธี interrupted suture.
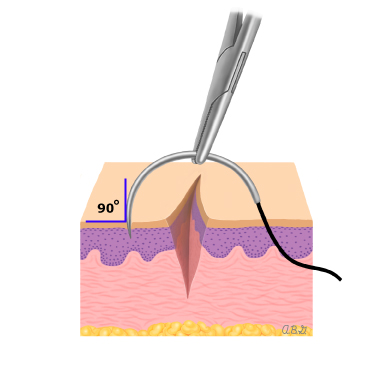
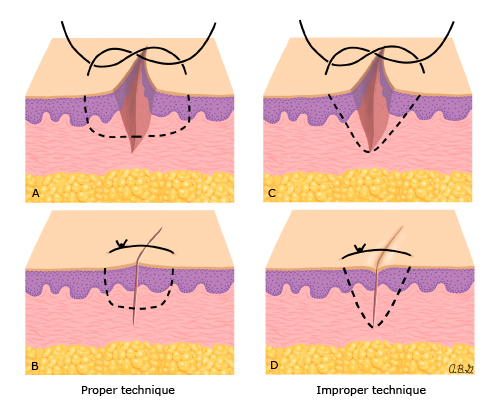
วิธีที่ดีที่สุดของการทำ cerclage ยังเป็นที่ถกเถียงกัน เราใช้ permanent nonresorbale monofilament เบอร์ 0 (Polypropylene) เป็นวัสดุในการเย็บ(13) ซึ่งมีความเหนียวและแข็งแรง และสามารถลดความเสี่ยงต่อการติดเชื้อได้ด้วย สิ่งสำคัญคือ ต้องไม่เย็บลึกลงไปใน cervical stroma เพื่อหลีกเลี่ยงการเซาะเข้าไปในปากมดลูกด้านใน (endocervical canal)
ศัลยแพทย์บางท่านได้แนะนำการใช้ Mersilene tape(19) แต่ทางคณะผู้ประพันธ์เห็นว่าเป็นการเพิ่มความเสี่ยงต่อการเกิดการกัดเซาะ และเพิ่มความเสี่ยงต่อการติดเชื้อมากขึ้น และไม่มีความแข็งแรงพอ
Dargent ใช้วิธี Saling(20) เพราะว่าสามารถเย็บปิดปากมดลูกได้ทั้งหมด แต่ก็ไม่ได้ปรากฏว่าจะช่วยเพิ่มผลลัพท์ที่ดีมากกว่าการใช้ cerclage ทั่วไป และสัมพันธ์กับการเพิ่มภาวะแทรกซ้อนที่มากขึ้น (19,22,23) ซึ่งสรุปว่าควรใช้ในกรณีที่ผู้ป่วยไม่สามารถทำ cerclage แบบทั่วไปได้เท่านั้น (23)
การใช้การตัดชิ้นเนื้อแช่แข็ง (Frozen section)
ตรวจหารอยโรคที่สามารถมองเห็นได้ด้วยตาเปล่า เราจะทำการส่งตรวจชิ้นเนื้อแบบแช่แข็ง(25, 26) โดยนักพยาธิวิทยาจะเริ่มทำการตัดชิ้นเนื้อแช่แข็งในแนวยาว (จาก exocervix ไปยัง endocervix) จนถึงระดับของรอยโรค เพื่อที่จะกำหนดระยะห่างระหว่างขอบบนสุดของ endocervical tumor margin และขอบชิ้นเนื้อที่ตัดออกมา ซึ่งดีที่สุดควรมีชิ้นเนื้อปกติติดออกมาด้วย 8-10 มิลลิเมตร อีกกรณีนึงถ้าต้องตัดชิ้นเนื้อเพิ่มเติม ถ้าก้อนเนื้อนั้นแผ่ขยายมากกว่า และเข้ามาใน endocervical canal และยังมีขอบเขตบวก (positive margin) หรือชิดกับรอยโรคมากเกินไป (น้อยกว่า 5 มิลลิเมตร) ซึ่งจำเป็นต้องได้รับการผ่าตัดแบบ Radical hysterectomy ต่อไป
หากมองไม่เห็นรอยโรคจากการตรวจร่างกาย (เช่น หลังจากทำ diagnostic cone) เราแนะนำให้เก็บชิ้นส่วนจากการผ่าตัด trachelectomy เพื่อใช้ในการวิเคราะห์ผลพยาธิวิทยาขั้นตอนสุดท้ายต่อไป
Morbidity เปรียบเทียบกับการทำ Hysterectomy
อัตราการป่วยจากการทำผ่าตัด radical trachelectomy นั้นใกล้เคียงหรือน้อยกว่าการผ่าตัด Radical hysterectomy หนึ่งในการศึกษาในงานวิจัยที่ใหญ่ที่สุดของสถาบันแห่งหนึ่ง เปรียบเทียบ perioperative morbidity
จากการทำการผ่าตัด Laparoscopic assisted vaginal radical trachelectomy (LAVRT n=118) เทียบกับการผ่าตัดส่องกล้อง Laparoscopic assisted vaginal radical hysterectomy (LAVRH n=139) (10) พบว่าอัตราการเกิดภาวะแทรกซ้อนขณะทำการผ่าตัดและหลังทำการผ่าตัดของทั้งสองกลุ่มใกล้เคียงกัน (ภาวะแทรกซ้อนขณะผ่าตัด มีร้อยละ 2.5 และ 5.8 ตามลำดับ) และภาวะแทรกซ้อนหลังผ่าตัดเป็นร้อยละ 21.2 และร้อยละ 19.4 ตามลำดับ ซึ่งพบว่าผลการศึกษาใกล้เคียงกันกับการศึกษาอื่นๆ (11,12,27,28)
การศึกษาอื่นๆที่เปรียบเทียบการทำ VRT กับการทำผ่าตัด Radical hysterectomy ผ่านทางหน้าท้อง (ARH) (29), พบว่า VRT เป็นการผ่าตัดที่เล็กกว่าและใช้เวลาน้อยกว่าการทำ ARH แต่พบว่ามีการรายงานของ long term morbidity ในคนที่ทำ VRT ที่ยังเหลือมดลูกอยู่ และยังคงมี cerclage อยู่ก็ได้รับการรายงาน เช่น สารคัดหลั่งบริเวณช่องคลอด การมีเลือดออกผิดปกติ การปวดท้องประจำเดือนอย่างลึก และ cerclage erosion นอกจากนี้ผู้ป่วยที่ได้รับการทำ VRT ไปจะกลายเป็นผู้หญิงที่ไม่มีประจำเดือน
ร้อยละ 10-15 ของผู้ป่วย ที่มีปัญหาของการตีบแคบของปากมดลูก หลังจากการทำ VRT(29,30) โดยผู้ป่วยส่วนมากไม่มีอาการ แต่มักมีประสบการณ์ในเรื่องปวดท้องประจำเดือน มีเลือดคั่งในโพรงมดลูก(Hematometra), hematosalpinx, หรือเยื่อบุมดลูกเจริญผิดที่ (endometriosis) (31) และการที่มีการตีบแคบของปากมดลูก อาจเป็นปัญหาของผู้หญิงที่ต้องใช้เทคโนโลยีช่วยในการเจริญพันธุ์ ได้แก่ การใส่อุปกรณ์หรือการย้ายตัวอ่อนหลังจากการทำ in vitro fertilization (31-34)
Oncologic issues
การกลับเป็นซ้ำของโรค (Recurrence)- จากผู้ป่วยจำนวน 550 ราย ที่เป็นมะเร็งปากมดลูกที่ได้รับการผ่าตัดแบบ VRT ได้ถูกกล่าวถึงในงานวิจัย พบว่ามีอุบัติการณ์การกลับเป็นซ้ำน้อยกว่าร้อยละ 5 และมีอัตราการเจ็บป่วย (mortality) ร้อยละ 2-3 (10,12) เปรียบเทียบผลลัพธ์หลังการผ่าตัดแบบ Radical hysterectomy ในขนาดใกล้เคียงกัน (10) ซึ่งใกล้เคียงกันกับรายงานฉบับอื่นๆ (24,25)
ประมาณร้อยละ 40 ของผู้ป่วยที่กลับเป็นโรคซ้ำ ซึ่งพบว่าเกิดที่บริเวณ Parametrium หรือ pelvic side wall ซึ่งเป็นไปได้ว่าอาจจะสัมพันธ์กับการตัดเลาะ parametrium ออกไม่เพียงพอ หรือยังมีรอยโรคที่มองไม่เห็นด้วยตาเปล่าซ่อนอยู่ (LVSI) (36), ร้อยละ 25 ของผู้ป่วยที่เกิดโรคซ้ำ เกิดที่ต่อมน้ำเหลืองตำแหน่ง paraaortic และ supraclavicular (12) ในอนาคตการใช้แผนที่ต่อมน้ำเหลือง sentinel node อาจช่วยในการประเมินการแพร่กระจายของโรคมะเร็งที่มีขนาดเล็กมากๆได้ หรือถ้าตรวจพบต่อมน้ำเหลืองที่มีการระบายน้ำเหลืองผิดปกติไป อาจจะหมายถึงว่ามีการเกิดซ้ำของโรค (12,16) , มีการรายงานตรวจพบการเกิดโรคซ้ำที่ 5 ตำแหน่งศูนย์กลางในอุ้งเชิงกราน ซึ่ง 4 ตำแหน่งพบในผู้ป่วยที่เป็น Adenocarcinoma ซึ่งอาจจะสัมพันธ์กับ multifocal nature ของรอยโรคชนิดนั้น(37)
ยังไม่มีข้อมูลเชิงคุณภาพที่ดีพอในการเปรียบเทียบ VRT กับการผ่าตัด radical hysterectomy ในการรักษามะเร็งปากมดลูก, มีการศึกษา case control study 137 ราย ที่ได้รับการทำผ่าตัดแบบ VRT เปรียบเทียบกับกลุ่ม control ที่ได้รับการทำ radical hysterectomy(38) พบว่าไม่มีการกลับเป็นซ้ำของโรคภายใน 5 ปี โดยอัตราเท่าๆกับทั้งสองกลุ่ม คือ ร้อยละ 95 และ 100 ตามลำดับ
ปัจจัยเสี่ยงต่อการเกิดการกลับเป็นซ้ำของโรค
- รอยโรคขนาดใหญ่ คือ ขนาดรอยโรคใหญ่กว่าหรือเท่ากับ 2 เซนติเมตร ซึ่งพบว่าสัมพันธ์กับความเสี่ยงที่สูงขึ้นต่อการกลับเป็นซ้ำ (10,12,13,39) และควรได้รับการส่งเสริมให้ทำ VRT หากรอยโรคนั้น exophytic มากและมีการเจริญรุกรานเข้ามาใน stromal เล็กน้อย (40)
- LVSI พบว่าการมีการรุกรานเข้าหลอดเลือดหรือหลอดน้ำเหลืองนั้น เพิ่มโอกาสการเกิดโรคซ้ำสูงขึ้น (ร้อยละ 12 เทียบกับร้อยละ 2) (12) แต่ก็ยังไม่ได้เป็นข้อห้ามในการทำ VRT แต่ควรจะแจ้งข้อมูลกับผู้ป่วยไว้ด้วย กรณีที่มี LVSI ขยายออกไป(42,43)
- Non squamous histology- Adenocarcinoma ยังไม่ได้รับการพิสูจน์ว่าสัมพันธ์กับการเกิดโรคซ้ำหรือไม่ แต่อย่างไรก็ตาม neuroendocrine tumor นั้นเป็นพยาธิชนิดที่รุนแรงมากชนิดนึงของมะเร็งปากมดลูกพบว่าสัมพันธ์กับการแพร่กระจายไปยังบริเวณที่มีการผ่าตัด โดยไม่คำนึงว่าเคยได้รับการผ่าตัดเลาะต่อมน้ำเหลืองออกได้หมดแล้วหรือไม่ (10,12,13)
ความต้องการรักษา Adjuvant treatment
การรักษาแบบส่งเสริม เป็นการรักษาที่เหมาะสำหรับผู้ป่วยมะเร็งปากมดลูกที่มีความเสี่ยงสูงต่อการกลับเป็นซ้ำของโรค แต่อาจจะเพิ่มความเสี่ยงต่อการเกิดรังไข่หยุดทำงานก่อนวัย (Premature ovarian failure) และสูญเสียภาวะการดำรงพันธุ์อย่างถาวร
การรักษาแบบ adjuvant สามารถให้การรักษาได้อย่างปลอดภัยแต่ควรหลีกเลี่ยงในรายที่ยังไม่ได้กำหนดระยะของโรคชัดเจน, การรักษาแบบอนุรักษ์ด้วยการตรวจติดตามอย่างใกล้ชิด อาจเป็นการเพิ่มความเสี่ยง ต้องมีการชั่งน้ำหนักกันระหว่างความเสี่ยงสูงต่อการเกิดรอยโรคซ้ำหรือจะเสียภาวการณ์ดำรงพันธุ์ไปอย่างถาวรจากการได้รับ adjuvant ซึ่งข้อมูลการศึกษายังมีจำกัด:
- หนึ่งในรายงายวิจัยชิ้นใหญ่ที่อธิบายไว้ พบว่าผู้ป่วย 3 ใน 5 รายที่มีการแพร่กระจายไปที่ต่อมน้ำเหลืองที่มองไม่เห็นด้วยตาเปล่า เลือกที่จะไม่รับการรักษาแบบ adjuvant radiation และพบว่าไม่เกิดกลับเป็นซ้ำของโรค(10), 2 ราย ที่มีขอบก้อนเนื้อชิดกับรอยโรค น้อยกว่า 5 มิลลิเมตร และปฏิเสธการรับการรักษา adjuvant และไม่มีการกลับซ้ำของโรค
- การศึกษาอื่นๆ 1 ในผู้ป่วยที่มีขอบเขตรอยโรคชิดน้อยกว่า 5 มิลลิเมตร เกิดเป็นโรคซ้ำที่บริเวณ corpus uteri ที่ 3 เดือนหลังจากทำการผ่าตัดแบบ VRT และหนึ่งในผู้ป่วยนั้นเกิดเป็น Adenocarcinoma in situ 2 ปีหลังจากการทำ VRT และปฏิเสธการทำ definitive treatment และเกิดการเป็นมะเร็งชนิดรุกรานเมื่อ 10 เดือนต่อมา (37)
- ในหัวข้อเดียวกัน ผู้ป่วย 4 รายที่มี node positive จากการผลชิ้นเนื้อขั้นสุดท้าย โดยไม่คำนึงถึง positive frozen section โดยทั้ง 4 รายปฏิเสธการเข้ารับการฉายแสงรังสี แต่ยอมรับการให้ยาเคมีบำบัด (Carboplatin/ Ifosfamide) เพื่อจะรักษาภาวะดำรงพันธุ์ไว้ พบว่าทั้งหมดไม่มีการกลับเป็นซ้ำของโรคผู้ป่วย 3 รายจากผู้ป่วยทั้งหมดที่มี close margin (5,4 และ 1 มิลลิเมตร) ยังไม่พบการกลับเป็นซ้ำของโรคขณะนี้ เป็นเวลาอย่างน้อย 2 ปี ที่ติดตามมา (13)
ยังไม่มีแนวทางการตรวจติดตามผู้ป่วยหลังจากการผ่าตัด VRT ที่ชัดเจน โดยทั่วไปการตรวจด้วยการส่องกล้อง Colposcope ร่วมกับการตรวจทางเซลล์วิทยา (Cytology) โดยจะทำ endocervical curettage หรือไม่ก็ได้ นั้นแนะนำให้ทำทุก 3-4 เดือน ในช่วง 3 ปีแรกหลังทำการผ่าตัด และทุก 6 เดือนใน 2 ปีถัดไป และทุก 1 ปีหลังจากนั้น(44) ผู้เชี่ยวชาญบางท่านแนะนำให้ทำ pelvic MRI ในการตรวจติดตามที่ 6, 12 และ 24 เดือน(44) ซึ่งผลการอ่านควรเป็นจากผู้อ่านคนเดียวกันในผู้ป่วยแต่ละรายที่เคยได้รับการผ่าตัด VRT, ในผู้ป่วยบางรายที่มีการเปลี่ยนแปลงทางกายวิภาค เนื่องจากการผ่าตัด อาจมีการผิดพลาดในการแปลผลว่ามีการกลับเป็นซ้ำของโรค(45)
การตรวจติดตามทางเซลล์วิทยา หลังจากการทำ VRT เป็นประจำแสดงให้เห็นว่ามีความผิดปกติ และการตรวจด้วยการส่องกล้อง colposcope เหมาะสำหรับใช้ในผู้ป่วยที่สื่อสารได้ดีและเป็นการตรวจโดยผู้เชี่ยวชาญทางพยาธิ เพื่อหลีกเลี่ยงการประเมิน benign smear ที่ไม่จำเป็น(11)
การศึกษาย้อนหลังในผู้ป่วยจำนวน 197 ราย ที่ได้รับการตรวจ pap smear หลังทำ VRT รายงานพบ false positive ร้อยละ 2, ซึ่งบ่อยครั้งยังมี atypical endometrial cell อยู่, และมากกว่าร้อยละ 41 ของการตรวจ pap smear เป็น squamous cell(46), ซึ่งเห็นว่าควรมีการเสนอผลอ่านเป็น “Unsatisfactory” ใน 2 ปีแรก และ “Negative for intraepithelial neoplasia” หรือ cancer ในปีถัดมา(44), อย่างไรก็ตาม ในบางรายเกิดการกลับเป็นซ้ำก่อนที่จะมีอาการแสดง ดังนั้นต้องตรวจติดตามอย่างระมัดระวัง(46)
การตรวจติดตามผู้ป่วยที่มีความเสี่ยงสูงต่อการติดเชื้อ HPV อาจจะมีประโยชน์ต่อผู้ป่วยหลังผ่าตัด trachelectomy ซึ่งยังมีความเสี่ยงต่อการเกิด HPV positive ควรได้รับการตรวจติดตามอย่างระมัดระวัง และมีความเสี่ยงต่อการเกิดโรคซ้ำที่ตำแหน่งเดิมสูงมากขึ้น และผู้ป่วยกลุ่มนี้ควรได้รับการฉีดวัคซีน HPV ด้วย
การผ่าตัดมดลูกเมื่อเคยผ่านการคลอดบุตรมาแล้ว (Hysterectomy when childbearing is completed)
การอภิปรายกันถึงการผ่าตัดมดลูกหลังจากการคลอดบุตรแล้ว ยังคงเป็นที่ถกเถียงกันอยู่ ยังไม่มีข้อมูลที่เปรียบเทียบกันในระยะยาวเทียบระหว่างผู้ที่ตัดมดลูกและผู้ที่ไม่ได้ตัดมดลูก แต่ทางคณะผู้แต่งเห็นว่ายังไม่แนะนำให้ทำการตัดมดลูกในทุกราย แต่ควรได้ให้คำแนะนำหรือพูดคุยกับผู้ป่วยที่ต้องการตัดมดลูกเฉพาะบางราย และทางคณะผู้แต่งยังไม่แนะนำให้ทำการตัดมดลูกหลังการผ่าตัดคลอดบุตร นอกเสียจากว่ามีเหตุการณ์ฉุกเฉิน แต่แนะนำให้ทำในรายที่การตั้งนั้นจะเป็นการตั้งครรภ์บุตรคนสุดท้ายแล้ว(3)
Reproductive issues
Fertility – การให้คำปรึกษาและเซ็นสัญญาข้อตกลงยินยอมผ่าตัดรักษา ในผู้ป่วยที่คาดหวังว่าสามารถเก็บรักษาภาวะดำรงพันธุ์ไว้ได้หลังจากทำ VRT (47), ผู้หญิงที่อายุมากแล้วหรือทราบว่าตัวเองมีปัญหาในเรื่องการมีบุตรยาก ควรได้รับคำแนะนำก่อนการผ่าตัดจากผู้เชียวชาญทางด้านการมีบุตรยาก (Infertile) (27) อย่างไรก็ตาม ปัจจัยเสี่ยงทางด้านการมีบุตรยาก ก็ยังไม่ใช่ข้อห้ามในการผ่าตัดทำ VRT เนื่องจากผู้ป่วยเหล่านี้อาจสามารถช่วยใช้เทคโนโลยีด้านการเจริญพันธุ์ช่วยให้มีบุตรได้ (24,27,30,48)
มีการรายงานอุบัติการณ์ของการมีบุตรยากหลังจากการผ่าตัด VRT พบได้ตั้งแต่ ร้อยละ 14-41 (24,30) หนึ่งในการศึกษาแบบ prospective study พบว่าผู้ป่วย 12 รายจาก 15 ราย ทีมีปัญหาการมีบุตรยากตั้งแต่แรก และสามารถตั้งครรภ์ได้ในที่สุด(24) หลังจากผ่าตัด VRT, ปัจจัยเกี่ยวกับปากมดลูก เช่นการตีบแคบของปากมดลูก พบได้ประมาณร้อยละ 40-75 ที่ทำให้มีปัญหาทางด้านการมีบุตร และยังคิดว่าเป็นต้นเหตุให้มีบุตรยาก ซึ่งไม่สัมพันธ์กับการผ่าตัด VRT (19,24,32,40)
ทั้งนี้ผู้หญิงที่มีปัญหาด้านการมีบุตรยาก ควรได้รับการตรวจประเมินปากมดลูกและสาเหตุอื่นๆ รวมถึงปัจจัยจากฝ่ายชายตามความเหมาะสมและจัดการแก้ไขเมื่อมีการตีบแคบของปากมดลูกและรอยแผลบริเวณทางเข้าปากมดลูก (50)
ผลลัพธ์การตั้งครรภ์ (Pregnancy outcome)
จากการทบทวนวรรณกรรม จำนวนผู้ป่วยที่ตั้งครรภ์ทั้งสิ้น 200 ราย พบว่ามีร้อยละ 66 สามารถตั้งครรภ์ได้หลังผ่าตัด radical trachelectomy ในตอนสุดท้ายหลังคลอด(22) และร้อยละ 42 ของการตั้งครรภ์ทั้งหมด สามารถคลอดครบกำหนดได้ มีเพียงร้อยละ 25 ที่คลอดก่อนกำหนด (อายุครรภ์น้อยกว่า 37 สัปดาห์) แต่มีเพียงครึ่งหนึ่งของการคลอดทั้งหมดที่สัมพันธ์กับการคลอดก่อนอายุครรภ์ 32 สัปดาห์
การแท้งบุตรในช่วงไตรมาสที่สอง- พบว่าอัตราการแท้งบุตรสูงกว่าเมื่อเทียบกับประชากรทั่วไป (ร้อยละ 9.5 เทียบกับร้อยละ 4) (22,30) สมมติฐานว่าเกิดจากการติดเชื้อในน้ำคร่ำและการกระตุ้นโดย cytokine จะเป็นสาเหตุชักนำให้เกิดการแตกของถุงน้ำก่อนกำหนด (PPROM)
ผู้ป่วยส่วนใหญ่สามารถขับ conceptive product ออกมาได้โดยไม่จำเป็นต้องตัด cerclage หรือเพียงทำการขยายปากมดลูกและคีบออก (Dilatation& Evacuation) โดยทำการขยายเพียงพอที่จะใส่หัวขูดเข้าไปได้เท่านั้น และมีบางรายเสนอให้เอา cerclage ออก หลังจากที่กระตุ้นคลอดด้วย Misoprostol, ส่วนการทำ Hysterotomy นั้นพบน้อยมาก (30)
การคลอดก่อนกำหนด- เป็นสิ่งที่กังวลมากหลังจากการผ่าตัดทำ VRT พบว่ามีอัตราส่วนที่สูงขึ้น โดยสมมติฐานเกี่ยวข้องกับที่ 1 และ 2 ปัจจัย ได้แก่ ปัจจัยด้านกลไก (Mechanical factor) มดลูกบีบตัวแรงมาก ในขณะที่ปากมดลูกสั้น ทำให้เกิดการคลอดก่อนกำหนด หรือปัจจัยด้านการติดเชื้อ (การสร้างมูกเพื่อปิดกั้นบริเวณปากมดลูกไม่ดีพอ) ทำให้เกิดการติดเชื้อง่ายขึ้น (49)
อัตราการคลอดก่อนกำหนด แตกต่างกันมากระหว่างกลุ่มที่เคยทำผ่าตัด VRT(22) เราเชื่อว่ามีอัตราส่วนที่ต่ำมากหากความยาวของ endocervix ยังอยู่อย่างน้อย 1 เซนติเมตร หลังจากผ่าตัด trachelectomy; เพื่อช่วยผยุงบริเวณส่วนล่างของมดลูก เปรียบเทียบกับกลุ่มที่ตัดชิ้นส่วนตรงไปที่ isthmus โดยไม่เหลือชิ้นส่วนของปากมดลูกไว้เลย (23,49) ข้อมูลทางมะเร็งวิทยา ยังไม่สนับสนุนสมมติฐานว่าการเหลือชิ้นเนื้อบริเวณปากมดลูกไว้มากขึ้น จะเพิ่มโอกาสต่อการเกิดมะเร็งซ้ำบริเวณนั้น (52)
การศึกษาแบบ prospective ในผู้ป่วย 106 รายที่ตั้งครรภ์ หลังจากทำ Vaginal trachelectomy พบว่า ร้อยละ 20 และร้อยละ 3 มีอัตราการแท้งบุตรในช่วงไตรมาสแรกและไตรมาสที่สอง และร้อยละ 75 ของผู้ป่วยสามารถตั้งครรภ์ต่อจนถึงไตรมาสที่สามและคลอดครบกำหนดด้วย (24)
ภาวะแทรกซ้อนหลังการทำ Cerclage
ยังไม่ชัดเจนว่าการทำ cerclage จะเป็นการเพิ่มความเสี่ยงต่อการเกิดการติดเชื้อในโพรงมดลูกและเพิ่มความเสี่ยงต่อการแตกของถุงน้ำก่อนกำหนด (PPROM) (22) เป็นไปได้ว่าผลข้างเคียงจากการทำ cerclage อาจหมายรวมถึงการมีสารคัดหลั่งเรื้อรังและอาจตรวจพบเชื้อ Actinomyces จากผลเซลล์วิทยาได้ (54,55)
หากมีการนำ cerclage ออก ต้องมีการใส่อันใหม่มาแทนขณะตั้งครรภ์ในช่วงอายุครรภ์ 12-14 สัปดาห์, การทำ cerclage ทางช่องท้องอาจจะจำเป็นหากปากมดลูกสั้นมาก หรือมีแผลเป็นหลังจากทำการผ่าตัด trachelectomy(56)
การวางแผนการตั้งครรภ์และการจัดการ
แนะนำให้ผู้ป่วยรออย่างน้อย 6 เดือนหรือถ้าเป็นไปได้ 12 เดือน หลังจากทำ VRT ก่อนที่จะพยายามตั้งครรภ์ใหม่(23) มีการศึกษาเกี่ยวกับการคลอดก่อนกำหนดและถุงน้ำคร่ำแตกก่อนกำหนดในผู้หญิงที่ได้รับการวินิจฉัยว่าเป็นมะเร็งปากมดลูก แต่ข้อมูลยังไม่เพียงพอ(52) และยังไม่มีข้อมูลจากการทดลอง Randomize control trail หลังจากการทำ VRT ศึกษาในเรื่องความหลากหลายในการทำ Intervention, การใช้ยาปฏิชีวนะป้องกันตั้งแต่แรก, การนอนพัก และ/หรือลดกิจกรรม และการใช้ยาสเตียรอยด์เพื่อกระตุ้นการเจริญของปอดเด็กก่อนที่จะคลอดก่อนกำหนด(49) ด้วยเหตุนี้แพทย์แผนกดูแลทารกปริกำเนิดจึงควรมีบทบาทในการดูแลและให้คำแนะนำร่วมด้วย(57)
ทางคณะผู้ประพันธ์ยังไม่แนะนำให้ผู้ป่วยลดกิจกรรมระหว่างตั้งครรภ์ จนกว่าจะตรวจพบว่ามี Cervical shortening และถ้ามีความเสี่ยงต่อการคลอดก่อนกำหนด หรือมีโอกาสแท้งบุตรในช่วงไตรมาสที่สอง ควรจะได้รับการตรวจติดตามอย่างใกล้ชิด ด้วยการอัลตราซาวล์วัดความยาวของปากมดลูก (Cervical length) และส่งเสริมการให้ยา Glucocorticoid ก่อนคลอดตามข้อบ่งชี้ และไม่แนะนำให้ให้ยาปฏิชีวนะไปก่อนในผู้ป่วยที่ถุงน้ำคร่ำยังไม่แตก จากการศึกษาพบว่าไม่มีส่วนช่วยป้องกันการคลอดก่อนกำหนดได้
หากมีการแตกของถุงน้ำคร่ำก่อนกำหนด จะแนะนำให้คลอดเมื่อตรวจพบหลักฐานของการเกิดการติดเชื้อในน้ำคร่ำ (Chorioamnionitis) หรือเมื่ออายุครรภ์ 32-34 สัปดาห์, การทำ cerclage จะถูกละทิ้งไว้ที่เดิม และให้ยาปฏิชีวนะและ expectant management.
ช่องทางการคลอด (Delivery route)
ควรหลีกเลี่ยงการคลอดทางช่องคลอดเนื่องจากมีโอกาสที่จะเกิดการฉีกขาดบริเวณด้านข้างของปากมดลูกได้ และอาจเกิดกายฉีกขาดที่ขยายเข้าบริเวณหลอดเลือดใกล้เคียงเกิดการสูญเสียเลือดที่รุนแรงตามมาได้ ด้วยเหตุนี้จึงแนะนำให้คลอดบุตรโดยการผ่าตัดคลอด อายุครรภ์ที่เหมาะสมคือ 37-38 สัปดาห์ โดยแนะนำให้ลงแผลผ่าตัดแบบ low transverse incision แต่บางท่านอาจลงแผลแบบ low vertical incision กรณีที่มีความเสี่ยงต่อการบาดเจ็บของเส้นเลือด ด้านข้างปากมดลูก แต่ก็ยังพบว่าความเสี่ยงต่ำมาก(11,44)
Abdominal radical trachelectomy (ART)
การผ่าตัด ART พบมีมีความคล้ายคลึงกับการผ่าตัดทางหน้าท้องแบบ Radical hysterectomy ซึ่งถูกพัฒนาขึ้นโดยคุณ Smith และคณะ เมื่อปี ค.ศ. 1997 (59) โดยมีการดัดแปลงเทคนิคเล็กน้อยจากต้นแบบ (60) เบื้องต้นได้มีการรายงานเกี่ยวกับการใช้หุ่นยนต์ช่วยผ่าตัดส่องกล้องในการทำ Radical hysterectomy แล้ว (61)
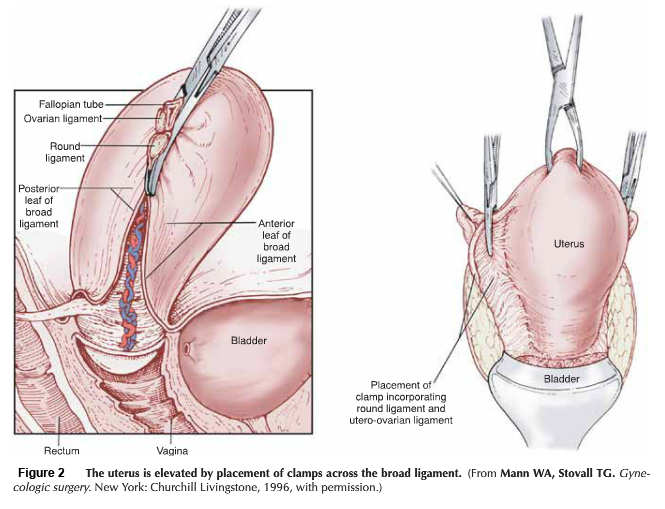
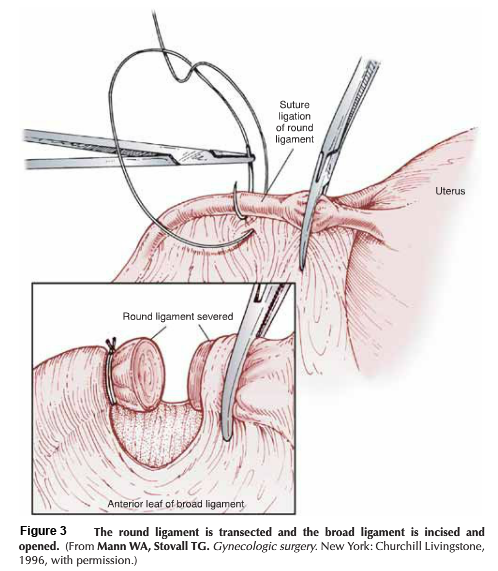
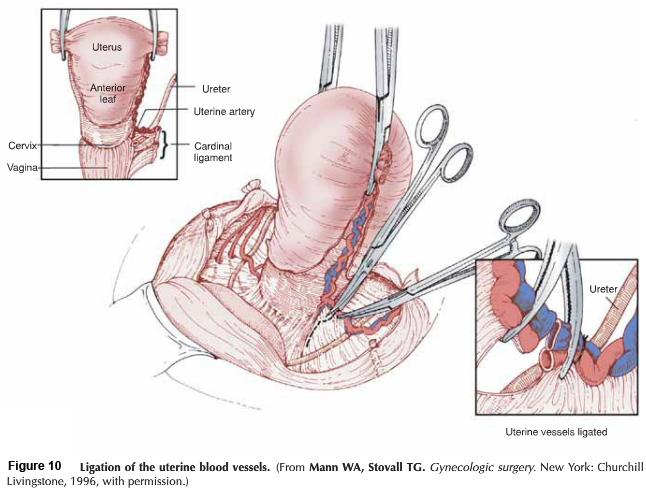
โดยสรุปขั้นตอนการผ่าตัด ลงแผลกึ่งกลาง หลังจากเลาะต่อมน้ำเหลืองในอุ้งเชิงกรานทั้งสองข้าง เปิด paravesicle และ pararectal space แยก round ligament ออกจากกัน, แยก uterine vessel ออกจากต้นกำเนิดของ hypogastric vessel อย่างระมัดระวัง และพยายามเก็บ infundibulopelvic และ tuboovarian ligament ไว้ เนื่องจากเป็นเส้นเลือดที่จะไปเลี้ยงมดลูก, parametrium และ paracolpos ตลอดแนวหลอดเลือด uterine vessel, ถูกเคลื่อนย้ายโดยการทำ trachelectomy specimen ตัด ureteral dissection ผ่านทาง parametrium tunnel ซึ่งจำเป็นในการผ่าตัด Radical hysterectomy type III, ด้านหลังของ Cul-de-sac ถูกตัดและต้องตัด Uterosacral ligament ออก
การกำหนดความยาวในการตัดปากช่องคลอด ตัดออกเป็นวงกลมผ่านทาง anterior colpotomy และชิ้นส่วนนั้นก็จะแยกออกโดยสมบูรณ์จากส่วนปลายของช่องคลอด อาจใช้ vaginal cylinder(กระบอกกลม) เพื่อเป็นโครงสร้างให้กับช่องคลอดก่อน แล้วตัดด้านชิดกับตัวก้อนซึ่งควรตัดต่ำกว่าตำแหน่งนั้น 5 มิลลิเมตร และต่ำกว่าปากมดลูกด้านใน และส่งชิ้นเนื้อแช่แข็งเพื่อวิเคราะห์ผล หากมั่นใจว่าขอบที่ตัดนั้นครอบคลุมดีแล้ว ก็พิจารณาทำ cerclage ได้ทันทีที่ตำแหน่ง isthmus แม้ขณะนี้ทางผู้ประพันธ์จะยังไม่ได้กำหนดตำแหน่งที่ทำ cerclage ไว้ทั้งหมดอย่างชัดเจน สุดท้ายทำการเย็บมดลูกส่วนล่างเชื่อมเข้ากับยอดของปากช่องคลอดแบบ interrupted ด้วยไหมละลายอีก 6-8 ครั้ง
ข้อได้เปรียบของการผ่าตัดทางหน้าท้องคือ ใช้เวลาในการเรียนรู้น้อยและไม่ต้องใช้ทักษะในด้านการส่องกล้อง หรือการผ่าตัดทางช่องคลอด, ข้อเสียคือ ต้องลงแผลในแนวกลางหน้าท้อง เสียเลือดมากกว่า ใช้เวลาในการนอนโรงพยาบาลนานกว่า และต้องเสียเส้นเลือด uterine artery ไปทั้งสองข้าง ซึ่งอาจเป็นสาเหตุให้เกิดการฝ่อไปของกล้ามเนื้อมดลูก และเกิดการตีบแคบของปากมดลูกได้ เกิดเป็นแผลเป็นได้
โอกาสการเกิดโรคซ้ำน้อยมาก มีการรายงานไว้หลังจากทำ ART อย่างน้อย 2 ราย จากจำนวนผู้ป่วย 91 ราย ที่มีรอยโรคขนาดใหญ่ (3.8 และ 5 เซนติเมตร) (63-66)
ทางเลือกในอนาคต
ข้อคิดเห็นกับการผ่าตัดแบบรักษาการดำรงพันธุ์ มีความก้าวหน้าและกว้างขว้างในแวดวงแพทย์ทางมะเร็งวิทยา และเป็นทางเลือกที่ของผู้ป่วยหญิงที่อายุน้อย แต่ก็ยังมีบางส่วนที่ปฏิเสธการผ่าตัดเนื่องจากขนาดของรอยโรค ซึ่งการใช้ Neoadjuvant chemo therapy (NACT) เป็นทางเลือกฉุกเฉินในผู้ป่วยเท่านั้น ในทางตรงข้ามถ้ามีรอยโรคขนาดเล็ก การผ่าตัดแบบครอบคลุม(extensive nature) ของการทำ radical trachelectomy อาจจะมากเกินไป ซึ่งอาจจะทำแค่การผ่าตัดเฉพาะที่ก็คงเพียงพอแล้ว
Neoadjuvant chemo therapy
ขนาดรอยโรคที่ใหญ่กว่า 2 เซนติเมตร พบว่ามีความสัมพันธ์กับการกลับเป็นซ้ำของโรคหลังจากผ่าตัด VRT (72,73) , NACT ใช้เพื่อลดขนาดของก้อน และเชื่อว่าจะทำให้ตอบสนองดีต่อการผ่าตัดแบบดำรงพันธุ์หลังจากได้ยาเคมีบำบัด(72,74,75) โดยสูตรยาที่ใช้ได้แก่ Toxol, ifosfamide, cisplatin (TIP)
แนวคิดการให้ NACT เป็นที่ดึงดูดความสนใจและควรที่จะได้รับการศึกษาต่อไปในอนาคต และมีการกล่าวถึง non-gonadotoxic ว่าอาจจะรุนแรงน้อยกว่าการให้ยาเคมีบำบัด ก็ควรได้รับไว้พิจารณาเพื่อลดความกระทบกระเทือนที่อาจมีต่อรังไข่ (76)
มีการศึกษาในผู้ป่วย 7 รายที่ได้รับการให้ NACT ที่มีรอยโรคขนาด 3-4.5 เซนติเมตร (77) พบว่าที่ 22 เดือนหลังติดตามอาการ ไม่มีรายใดเลยที่กลับเป็นซ้ำของโรค และมีหนึ่งรายที่สามารถตั้งครรภ์ได้
Ultraconservative fertility sparing
ความคิดเกี่ยวกับการผ่าตัดเพื่อดำรงพันธุ์ ในผู้ป่วยที่เป็นมะเร็งปากมดลูกระยะต้น (IA2 และ Early IB1) พบว่าการผ่าตัดทำ Radical trachelectomy ไม่มีประโยชน์เนื่องจากมีความเสี่ยงต่ำมากที่จะเกิดการกระจายของก้อนเนื้องอกไปที่บริเวณ parametrium (78)
นอกจากนั้นยังพบว่าร้อยละ 62-67 ในผู้ป่วย ไม่มี residual cancer ในชิ้นเนื้อที่ได้จากการตัด trachelectomy ออกมาตรวจอย่างละเอียด ดังนั้นเราอาจทำแค่ Diagnostic cone (10,11,13) ก็อาจจะเพียงพอ การผ่าตัด simple trachelectomy หรือการผ่าตัด cold knife cone ขนาดใหญ่เพื่อเอาส่วนของชิ้นเนื้อบริเวณปากมดลูกออกให้มากที่สุด ก็อาจจะเพียงพอสำหรับผู้ป่วย แต่อย่างไรก็ตามถ้ามีความเสี่ยงต่อการเกิดการแพร่กระจายไปที่ต่อมน้ำเหลือง ก็อาจจะพิจารณาผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองหรือทำ sentinel lymph node mapping
มีการทำการศึกษาแบ่งการประเมินเป็น 2 ขั้นตอน รักษาแบบผู้ป่วยนอก ผู้ป่วยจำนวน 26 ราย ทีเป็นมะเร็งปากมดลูกระยะต้น IA1-IB2 (79) ผู้ป่วยจะได้รับการส่องกล้องทำ sentinel node mapping และทำ Frozen section ตามด้วยการเลาะต่อมน้ำเหลืองในอุ้งเชิงกรานอย่างสมบูรณ์
1 สัปดาห์ต่อมาแยกผู้ป่วยนอกเป็นผู้ป่วยที่ได้รับการทำ simple trachelectomy และทำในผู้ป่วยที่ยังไม่มีการแพร่กระจายไปยังต่อมน้ำเหลือง ตรวจพบว่าผู้ป่วย 4 รายที่มีการแพร่กระจายไปที่ต่อมน้ำเหลืองจากการตรวจชิ้นเรื้อแช่แข็ง และได้รับการผ่าตัด Radical hysterectomy ต่อมา, 1 ราย มีการกลับเป็นซ้ำของโรคและเข้ารับยาเคมีบำบัดต่อ อีก 15 ราย สามารถตั้งครรภ์ได้ โดยมี 8 รายที่คลอดเมื่ออายุครรภ์ 24 สัปดาห์, 34 สัปดาห์ 1 ราย, 36 สัปดาห์ 1 ราย และคลอดครบกำหนด 5 ราย (79)
อีกกลุ่มหนึ่ง เป็นการผ่าตัดรักษาแบบอนุรักษ์ (Conservative Surgery) ในผู้ป่วย 5 รายที่เป็นมะเร็งปากมดลูกระยะ IB2 (73) โดยผู้ป่วยทั้งหมดขนาดรอยโรคกว้างน้อยกว่า 2 เซนติเมตร และมีการรุกราน superficial stromal infiltration ลึกน้อยกว่า 2 มิลลิเมตร และปริมาตรชิ้นเนื้อน้อยกว่า 500 มิลลิเมตร(3) ใช้ Loop cone ร่วมกันหรือไม่ก็ได้การผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองในตอนสุดท้าย และพบว่าไม่มีการเกิดโรคซ้ำหรือเกิดการแพร่กระจายไปยังต่อมน้ำเหลืองในชิ้นเนื้อชิ้นสุดท้ายจากข้อมูลในขณะนี้
ความคิดเห็นเกี่ยวกับการทำ ultraconservative treatment ควรได้รับการสืบค้นต่อไป เพื่อประเมินความปลอดภัยและกำหนดเกณฑ์การคัดเลือกผู้ป่วยที่จำกัดและรายละเอียดเกี่ยวกับการรายงานผลชิ้นเนื้อที่ได้จากการตัดปากมดลูก (cone specimen) มีความสำคัญมากเพื่อหลีกเลี่ยงการกลับเป็นซ้ำของโรคและการเสียชีวิตในผู้ป่วยที่สามารถรักษาให้หายได้ ส่วนผลกระทบต่อการคลอดบุตรในผู้ป่วยที่เคยได้รับการตัดปากมดลูกเป็นรูปกรวยขนาดใหญ่ยังคงต้องได้รับการศึกษาต่อไป
Summary and Recommendation
สำหรับผู้หญิงที่เป็นมะเร็งปากมดลูกความเสี่ยงต่ำ ที่ยังไม่มีบุตร แนะนำให้ทำ Radical trachelectomy มากกว่าการทำ Radical hysterectomy เพื่อที่จะรักษาภาวะดำรงพันธุ์เอาไว้ (Grade 2C)
การทำ MRI อุ้งเชิงกราน นั้นแนะนำให้ทำก่อนการผ่าตัด ในผู้ป่วยที่มีรอยโรคมองเห็นด้วยตาเปล่า
ก่อนที่จะทำ Radical trachelectomy การผ่าตัดส่องกล้องเลาะต่อมน้ำเหลืองเพื่อที่จะแยกว่ามีการแพร่กระจายไปที่ต่อมน้ำเหลืองหรือไม่ หากรอยโรคมองเห็นได้ด้วยตาเปล่า จากนั้นส่งชิ้นเนื้อแช่แข็ง เพื่อประเมินขอบเขตว่าตัดออกได้เพียงพอหรือไม่
ผลที่ตามมาหลังจากการผ่าตัด Radical trachelectomy อาจมีสารคัดหลั่งออกจากช่องคลอดได้ มีเลือดออกผิดปกติ มีอาการปวดประจำเดือนแบบลึกๆ มีรอยถลอกบริเวณที่ทำ cerclage ขาดประจำเดือน และมีปากช่องคลอดตีบแคบ
กรณีที่ขนาดรอยโรคใกล้เคียงกัน พบว่าอัตราการกลับเป็นซ้ำของโรคก็ใกล้เคียงกันระหว่างการทำ Radical trachelectomy กับ Radical hysterectomy
ในผู้หญิงที่เคยผ่าตัด Radical trachelectomy แล้ว ที่มีบุตรเพียงพอแล้ว ก็ไม่ได้แนะนำให้ทำการตัดมดลูก(Hysterectomy) ในทุกราย
2 ใน 3 ของผู้ป่วยสามารถตั้งครรภ์ได้หลังจากผ่าตัด Radical trachelectomy และพบว่าสามารถคลอดบุตรมีชีวิตได้ พบว่าร้อยละ 40 สามารถตั้งครรภ์ครบกำหนดและคลอดบุตรที่สุขภาพแข็งแรงได้
อัตราการแท้งและการคลอดบุตรก่อนกำหนดพบว่าสูงขึ้นมากกว่าหญิงตั้งครรภ์ทั่วไป
การคลอดทางช่องคลอดควรหลีกเลี่ยง เนื่องจากมีโอกาสฉีกขาดของผนังด้านข้างของปากมดลูก ในบริเวณที่เป็นรอยแผลที่ปากมดลูก อาจเกิดการแผ่ขยายออกไปยังหลอดเลือดข้างเคียง เป็นผลให้เสียเลือดอย่างรุนแรง ซึ่งแนะนำให้ผ่าตัดคลอดบุตร โดยอายุครรภ์ที่เหมาะสมคือ 37-38 สัปดาห์
ในอนาคตการใช้ Neoadjuvant chemotherapy หลังจากการได้รับการผ่าตัด Radical trachelectomy อาจได้รับการพิสูจน์ว่าเป็นทางเลือกหนึ่งของผู้ป่วยที่มีรอยโรคขนาดใหญ่ และในทางกลับการผู้ป่วยหญิงที่มีรอยโรคขนาดเล็ก อาจใช้การรักษาโดยการผ่าตัดเฉพาะตำแหน่งเอาได้
REFERENCES
- Lee SJ, Schover LR, Partridge AH, et al. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol 2006; 24:2917.
- Carter J, Rowland K, Chi D, et al. Gynecologic cancer treatment and the impact of cancer-related infertility. Gynecol Oncol 2005; 97:90.
- Corney RH, Crowther ME, Everett H, et al. Psychosexual dysfunction in women with gynaecological cancer following radical pelvic surgery. Br J Obstet Gynaecol 1993; 100:73.
- http://www.seer.cancer.gov/statfacts/html/cervix.html (Accessed on September 07, 2011).
- Bisseling KC, Bekkers RL, Rome RM, Quinn MA. Treatment of microinvasive adenocarcinoma of the uterine cervix: a retrospective study and review of the literature. Gynecol Oncol 2007; 107:424.
- Wright JD, NathavithArana R, Nathavithrana R, et al. Fertility-conserving surgery for young women with stage IA1 cervical cancer: safety and access. Obstet Gynecol 2010; 115:585.
- Dargent, D, Brun, JL, Roy, M. La trachélectomie élargie (T.E.). Une alternative à l’hystérectomie radicale dans le traitement des cancers infiltrants développés sur la face externe du col utérin. J Obstet Gynecol 1994; 2:292.
- Roy M, Plante M. Pregnancies after radical vaginal trachelectomy for early-stage cervical cancer. Am J Obstet Gynecol 1998; 179:1491.
- Sonoda Y, Abu-Rustum NR, Gemignani ML, et al. A fertility-sparing alternative to radical hysterectomy: how many patients may be eligible? Gynecol Oncol 2004; 95:534.
- Marchiole P, Benchaib M, Buenerd A, et al. Oncological safety of laparoscopic-assisted vaginal radical trachelectomy (LARVT or Dargent’s operation): a comparative study with laparoscopic-assisted vaginal radical hysterectomy (LARVH). Gynecol Oncol 2007; 106:132.
- Shepherd JH, Spencer C, Herod J, Ind TE. Radical vaginal trachelectomy as a fertility-sparing procedure in women with early-stage cervical cancer-cumulative pregnancy rate in a series of 123 women. BJOG 2006; 113:719.
- Beiner ME, Covens A. Surgery insight: radical vaginal trachelectomy as a method of fertility preservation for cervical cancer. Nat Clin Pract Oncol 2007; 4:353.
- Plante M, Renaud MC, François H, Roy M. Vaginal radical trachelectomy: an oncologically safe fertility-preserving surgery. An updated series of 72 cases and review of the literature. Gynecol Oncol 2004; 94:614.
- Sahdev A, Sohaib SA, Wenaden AE, et al. The performance of magnetic resonance imaging in early cervical carcinoma: a long-term experience. Int J Gynecol Cancer 2007; 17:629.
- Peppercorn PD, Jeyarajah AR, Woolas R, et al. Role of MR imaging in the selection of patients with early cervical carcinoma for fertility-preserving surgery: initial experience. Radiology 1999; 212:395.
- Hauspy J, Beiner M, Harley I, et al. Sentinel lymph nodes in early stage cervical cancer. Gynecol Oncol 2007; 105:285.
- Plante M, Renaud MC, Roy M. Vaginal radical trachelectomy. In: Atlas of procedures in gynecologic oncology, Levine DA, Barakat RR, Hoskins WJ (Eds), Martin Dunitz, 2003.
- Abu-Rustum NR, Sonoda Y, Black D, et al. Cystoscopic temporary ureteral catheterization during radical vaginal and abdominal trachelectomy. Gynecol Oncol 2006; 103:729.
- Bernardini M, Barrett J, Seaward G, Covens A. Pregnancy outcomes in patients after radical trachelectomy. Am J Obstet Gynecol 2003; 189:1378.
- Saling E. [Early total occlusion of os uteri prevent habitual abortion and premature deliveries (author’s transl)]. Z Geburtshilfe Perinatol 1981; 185:259.
- Dargent D, Martin X, Sacchetoni A, Mathevet P. Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 2000; 88:1877.
- Jolley JA, Battista L, Wing DA. Management of pregnancy after radical trachelectomy: case reports and systematic review of the literature. Am J Perinatol 2007; 24:531.
- Plante M, Renaud MC, Hoskins IA, Roy M. Vaginal radical trachelectomy: a valuable fertility-preserving option in the management of early-stage cervical cancer. A series of 50 pregnancies and review of the literature. Gynecol Oncol 2005; 98:3.
- Plante M, Gregoire J, Renaud MC, Roy M. The vaginal radical trachelectomy: an update of a series of 125 cases and 106 pregnancies. Gynecol Oncol 2011; 121:290.
- Tanguay C, Plante M, Renaud MC, et al. Vaginal radical trachelectomy in the treatment of cervical cancer: the role of frozen section. Int J Gynecol Pathol 2004; 23:170.
- Park KJ, Soslow RA, Sonoda Y, et al. Frozen-section evaluation of cervical adenocarcinoma at time of radical trachelectomy: pathologic pitfalls and the application of an objective scoring system. Gynecol Oncol 2008; 110:316.
- Sonoda Y, Chi DS, Carter J, et al. Initial experience with Dargent’s operation: the radical vaginal trachelectomy. Gynecol Oncol 2008; 108:214.
- Kim JH, Park JY, Kim DY, et al. Fertility-sparing laparoscopic radical trachelectomy for young women with early stage cervical cancer. BJOG 2010; 117:340.
- Alexander-Sefre F, Chee N, Spencer C, et al. Surgical morbidity associated with radical trachelectomy and radical hysterectomy. Gynecol Oncol 2006; 101:450.
- Boss EA, van Golde RJ, Beerendonk CC, Massuger LF. Pregnancy after radical trachelectomy: a real option? Gynecol Oncol 2005; 99:S152.
- Selo-Ojeme DO, Ind T, Shepherd JH. Isthmic stenosis following radical trachelectomy. J Obstet Gynaecol 2002; 22:327.
- Aust T, Herod J, Macdonald R, Gazvani R. Infertility after fertility-preserving surgery for cervical carcinoma: the next challenge for reproductive medicine? Hum Fertil (Camb) 2007; 10:21.
- Klemm P, Tozzi R, Köhler C, et al. Does radical trachelectomy influence uterine blood supply? Gynecol Oncol 2005; 96:283.
- Aust TR, Herod JJ, Gazvani R. Placement of a Malecot catheter to enable embryo transfer after radical trachelectomy. Fertil Steril 2005; 83:1842.
- Lanowska M, Mangler M, Spek A, et al. Radical vaginal trachelectomy (RVT) combined with laparoscopic lymphadenectomy: prospective study of 225 patients with early-stage cervical cancer. Int J Gynecol Cancer 2011; 21:1458.
- Lanowska M, Morawietz L, Sikora A, et al. Prevalence of lymph nodes in the parametrium of radical vaginal trachelectomy (RVT) specimen. Gynecol Oncol 2011; 121:298.
- Hertel H, Köhler C, Grund D, et al. Radical vaginal trachelectomy (RVT) combined with laparoscopic pelvic lymphadenectomy: prospective multicenter study of 100 patients with early cervical cancer. Gynecol Oncol 2006; 103:506.
- Beiner ME, Hauspy J, Rosen B, et al. Radical vaginal trachelectomy vs. radical hysterectomy for small early stage cervical cancer: a matched case-control study. Gynecol Oncol 2008; 110:168.
- Burnett AF. Radical trachelectomy with laparoscopic lymphadenectomy: review of oncologic and obstetrical outcomes. Curr Opin Obstet Gynecol 2006; 18:8.
- Covens, A. Preserving fertility in early cervical cancer with radical trachlectomy. Contemp Ob Gyn 2003; 2:48.
- Mathevet P, Laszlo de Kaszon E, Dargent D. [Fertility preservation in early cervical cancer]. Gynecol Obstet Fertil 2003; 31:706.
- Marchiolé P, Buénerd A, Benchaib M, et al. Clinical significance of lympho vascular space involvement and lymph node micrometastases in early-stage cervical cancer: a retrospective case-control surgico-pathological study. Gynecol Oncol 2005; 97:727.
- Chernofsky MR, Felix JC, Muderspach LI, et al. Influence of quantity of lymph vascular space invasion on time to recurrence in women with early-stage squamous cancer of the cervix. Gynecol Oncol 2006; 100:288.
- Shepherd JH. Uterus-conserving surgery for invasive cervical cancer. Best Pract Res Clin Obstet Gynaecol 2005; 19:577.
- Sahdev A, Jones J, Shepherd JH, Reznek RH. MR imaging appearances of the female pelvis after trachelectomy. Radiographics 2005; 25:41.
- Singh N, Titmuss E, Chin Aleong J, et al. A review of post-trachelectomy isthmic and vaginal smear cytology. Cytopathology 2004; 15:97.
- Carter J, Sonoda Y, Abu-Rustum NR. Reproductive concerns of women treated with radical trachelectomy for cervical cancer. Gynecol Oncol 2007; 105:13.
- Kay TA, Renninson JN, Shepherd JH, Taylor MJ. Successful pregnancy following radical trachelectomy and in vitro fertilisation with ovum donation. BJOG 2006; 113:965.
- Shepherd JH, Mould T, Oram DH. Radical trachelectomy in early stage carcinoma of the cervix: outcome as judged by recurrence and fertility rates. BJOG 2001; 108:882.
- Noyes N, Abu-Rustum NR, Ramirez PT, Plante M. Options in the management of fertility-related issues after radical trachelectomy in patients with early cervical cancer. Gynecol Oncol 2009; 114:117.
- Lavie O, Peer G, Sagi S, et al. The management of an early-missed abortion after radical trachelectomy–a case report and a review of the literature. Int J Gynecol Cancer 2006; 16:1688.
- Plante M, Roy M. Fertility-preserving options for cervical cancer. Oncology (Williston Park) 2006; 20:479.
- Speiser D, Mangler M, Köhler C, et al. Fertility outcome after radical vaginal trachelectomy: a prospective study of 212 patients. Int J Gynecol Cancer 2011; 21:1635.
- Kolomainen DF, Herod JJ, Holland N, Shepherd JH. Actinomyces on a papanicolaou smear following a radical trachelectomy. BJOG 2003; 110:1036.
- Allahdin S, Lees DA, Busby-Earle RM, Querleu D. Persistent vaginal discharge after radical trachelectomy. J Obstet Gynaecol 2004; 24:941.
- Lee KY, Jun HA, Roh JW, Song JE. Successful twin pregnancy after vaginal radical trachelectomy using transabdominal cervicoisthmic cerclage. Am J Obstet Gynecol 2007; 197:e5.
- Alexopoulos E, Efkarpidis S, Fay TN, Williamson KM. Pregnancy following radical trachelectomy and pelvic lymphadenectomy for Stage I cervical adenocarcinoma. Acta Obstet Gynecol Scand 2002; 81:791.
- Petignat P, Stan C, Megevand E, Dargent D. Pregnancy after trachelectomy: a high-risk condition of preterm delivery. Report of a case and review of the literature. Gynecol Oncol 2004; 94:575.
- Smith JR, Boyle DC, Corless DJ, et al. Abdominal radical trachelectomy: a new surgical technique for the conservative management of cervical carcinoma. Br J Obstet Gynaecol 1997; 104:1196.
- Abu-Rustum NR, Sonoda Y, Black D, et al. Fertility-sparing radical abdominal trachelectomy for cervical carcinoma: technique and review of the literature. Gynecol Oncol 2006; 103:807.
- Ramirez PT, Schmeler KM, Malpica A, Soliman PT. Safety and feasibility of robotic radical trachelectomy in patients with early-stage cervical cancer. Gynecol Oncol 2010; 116:512.
- Wan XP, Yan Q, Xi XW, Cai B. Abdominal radical trachelectomy: two new surgical techniques for the conservation of uterine arteries. Int J Gynecol Cancer 2006; 16:1698.
- Del Priore G, Ungar L, Richard Smith J, Heller PB. Regarding “First case of a centropelvic recurrence after radical trachelectomy: literature review and implications for the preoperative selection of patients,” (92:1002-5) by Morice et al. Gynecol Oncol 2004; 95:414; author reply 414.
- Ungar, L, Palfalvi, L, Smith, JR, et al. Update on and long-term follow-up of 91 abdominal radical trachelectomies. Gynecol Oncol 2006; 101:S20.
- Bader AA, Tamussino KF, Moinfar F, et al. Isolated recurrence at the residual uterine cervix after abdominal radical trachelectomy for early cervical cancer. Gynecol Oncol 2005; 99:785.
- Cibula D, Slama J, Fischerova D. Update on abdominal radical trachelectomy. Gynecol Oncol 2008; 111:S111.
- Ungár L, Pálfalvi L, Hogg R, et al. Abdominal radical trachelectomy: a fertility-preserving option for women with early cervical cancer. BJOG 2005; 112:366.
- Abu-Rustum NR, Su W, Levine DA, et al. Pediatric radical abdominal trachelectomy for cervical clear cell carcinoma: a novel surgical approach. Gynecol Oncol 2005; 97:296.
- Ungár L, Smith JR, Pálfalvi L, Del Priore G. Abdominal radical trachelectomy during pregnancy to preserve pregnancy and fertility. Obstet Gynecol 2006; 108:811.
- Li J, Li Z, Wang H, et al. Radical abdominal trachelectomy for cervical malignancies: surgical, oncological and fertility outcomes in 62 patients. Gynecol Oncol 2011; 121:565.
- Hong DG, Lee YS, Park NY, et al. Robotic uterine artery preservation and nerve-sparing radical trachelectomy with bilateral pelvic lymphadenectomy in early-stage cervical cancer. Int J Gynecol Cancer 2011; 21:391.
- Sakhel K, Khalil A, Kaspar H, et al. Placental site trophoblastic tumor in a patient with secondary infertility and radiological findings consistent with a leiomyoma: a case report. Int J Gynecol Cancer 2004; 14:694.
- Naik R, Cross P, Nayar A, et al. Conservative surgical management of small-volume stage IB1 cervical cancer. BJOG 2007; 114:958.
- Landoni F, Parma G, Peiretti M, et al. Chemo-conization in early cervical cancer. Gynecol Oncol 2007; 107:S125.
- Kobayashi Y, Akiyama F, Hasumi K. A case of successful pregnancy after treatment of invasive cervical cancer with systemic chemotherapy and conization. Gynecol Oncol 2006; 100:213.
- Plante M, Lau S, Brydon L, et al. Neoadjuvant chemotherapy followed by vaginal radical trachelectomy in bulky stage IB1 cervical cancer: case report. Gynecol Oncol 2006; 101:367.
- Marchiole P, Tigaud JD, Costantini S, et al. Neoadjuvant chemotherapy and vaginal radical trachelectomy for fertility-sparing treatment in women affected by cervical cancer (FIGO stage IB-IIA1). Gynecol Oncol 2011; 122:484.
- Covens A, Rosen B, Murphy J, et al. How important is removal of the parametrium at surgery for carcinoma of the cervix? Gynecol Oncol 2002; 84:145.
- Rob L, Charvat M, Robova H, et al. Less radical fertility-sparing surgery than radical trachelectomy in early cervical cancer. Int J Gynecol Cancer 2007; 17:304.
- Kyrgiou M, Koliopoulos G, Martin-Hirsch P, et al. Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: systematic review and meta-analysis. Lancet 2006; 367:489.
- Klaritsch P, Reich O, Giuliani A, et al. Delivery outcome after cold-knife conization of the uterine cervix. Gynecol Oncol 2006; 103:604.
- Schmeler KM, Frumovitz M, Ramirez PT. Conservative management of early stage cervical cancer: is there a role for less radical surgery? Gynecol Oncol 2011; 120:321.