การตั้งครรภ์เกินกำหนด (Postterm pregnancy)
จัดทำโดย พ.ญ. อรพิน จิตคุณธรรมกุล
อาจารย์ที่ปรึกษา พ.ญ. สุชยา ลือวรรณ
นิยาม (Definition)
การตั้งครรภ์เกินกำหนด (Postterm pregnancy, Prolonged pregnancy) หมายถึง การตั้งครรภ์ที่มีอายุครรภ์ 42 สัปดาห์เต็ม (294 วัน) หรือมากกว่า โดยเริ่มนับจากวันแรกของประจำเดือนครั้งสุดท้าย (Last menstrual period : LMP) [1]
การกำหนดอายุครรภ์
การประเมินอายุครรภ์ที่ถูกต้องและแม่นยำ ถือเป็นสิ่งสำคัญในการวางแผนดูแลสตรีตั้งครรภ์เกินกำหนด จากนิยามอายุครรภ์จะนับจากวันแรกของประจำเดือนครั้งสุดท้าย (LMP) ซึ่งจะตามหลังการตกไข่ประมาณ 2 สัปดาห์ [2] บางครั้งปัญหาการคำนวณอายุครรภ์ผิดพลาดเกิดขึ้นมาจากการจำประจำเดือนครั้งสุดท้ายผิดพลาด หรือการตกไข่ช้ากว่าปกติ ดังนั้นอายุครรภ์ที่แน่นอนจึงต้องนับจากวันที่ตกไข่ หรือวันที่ปฏิสนธิเท่านั้น แต่ในปัจจุบันยังไม่มีข้อมูลประวัติ หรือวิธีการตรวจที่บ่งบอกอายุครรภ์ที่แน่นอนได้ จึงต้องอาศัยข้อมูลหลายอย่างประกอบกัน ได้แก่ ประวัติวันแรกของประจำเดือนครั้งสุดท้าย (LMP) การตรวจภายในเพื่อประเมินขนาดมดลูกในไตรมาสแรกของการตั้งครรภ์ การได้ยินเสียงหัวใจทารกเต้นเป็นครั้งแรก [3, 4] ข้อมูลดังกล่าวสามารถคำนวณอายุครรภ์คลาดเคลื่อนได้ 2 สัปดาห์หรือมากกว่า [4] นอกจากนี้จากหลายการศึกษาพบว่าการตรวจด้วยคลื่นเสียงความถี่สูง (Ultrasound) เพื่อประเมินอายุครรภ์ในไตรมาสแรก และไตรมาสที่สองของการตั้งครรภ์ ก็มีความคลาดเคลื่อนได้ตั้งแต่ 3 – 10 วัน แต่สามารถระบุอายุครรภ์ได้แม่นยำมากกว่าจากประจำเดือนครั้งสุดท้าย [5-9] ดังนั้นจากข้อมูลทั้งหมดประกอบกันจะเป็นตัวกำหนดอายุครรภ์ และให้การดูแลรักษาครรภ์เกินกำหนดได้อย่างเหมาะสม
อุบัติการณ์ (Incidence)
การตั้งครรภ์เกินกำหนดพบประมาณร้อยละ 4 – 19 ของการตั้งครรภ์ [10]
พยาธิสรีรวิทยา (Pathophysiology)
สาเหตุ
สาเหตุของการตั้งครรภ์เกินกำหนดยังไม่ทราบแน่ชัด แต่อาจเกิดจากความผิดปกติของทารกในครรภ์ เช่น Anencephaly ต่อมใต้สมองผิดปกติ ต่อมหมวกไตฝ่อ และการขาดฮอร์โมน Placental sulfatase deficiency [11, 12] ทำให้สร้างฮอร์โมนเอสโตรเจนน้อยลง จึงไม่มีอาการเจ็บครรภ์รวมถึงปากมดลูกไม่พร้อมที่จะนำไปสู่กระบวนการคลอด
ปัจจัยที่มีผลทำให้เกิดการตั้งครรภ์เกินกำหนด (Risk factors) [13-15]
- ดัชนีมวลกายก่อนตั้งครรภ์ (Prepregnancy body mass index : BMI) ≥ 25 kg/m2
- ครรภ์แรก (Nulliparity) พบได้มากกว่าครรภ์หลัง
- มีประวัติเคยตั้งครรภ์เกินกำหนดมาก่อน
Postmaturity syndrome
จากรายงานของ Clifford [16] ได้อธิบายลักษณะทารกที่คลอดจากครรภ์เกินกำหนด (Postmature, Postmaturity syndrome) ดังนี้ ผิวหนังแห้งแตก เหี่ยวย่น และหลุดลอก เนื่องจากสูญเสียไขมันใต้ผิวหนัง มีขี้เทาเคลือบติดตามตัว รูปร่างผอม มีลักษณะขาดสารอาหาร แต่ตื่นตัว (alert) หน้าตาดูแก่กว่าเด็กทั่วไป และเล็บยาว ดังรูปภาพที่ 1 – 4 แต่ลักษณะดังกล่าวพบแค่ร้อยละ 10 – 20 ของทารกที่อายุครรภ์เกินกำหนด แต่ภาวะน้ำคร่ำน้อย (Oligohydramnios) ตรวจพบได้สูงถึงร้อยละ 88 ของทารกที่มีลักษณะ postmature ทั้งหมด [17] ซึ่งอาจพบร่วมกับภาวะทารกเจริญเติบโตช้าในครรภ์ เนื่องจากปัญหารกเสื่อมสภาพ (Uteroplacental insufficiency) ทำให้ทารกมีขนาดเล็กกว่าอายุครรภ์ (Small-for-gestational-age : SGA) [18]
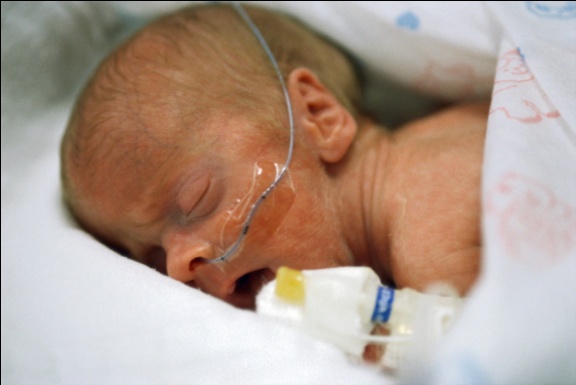
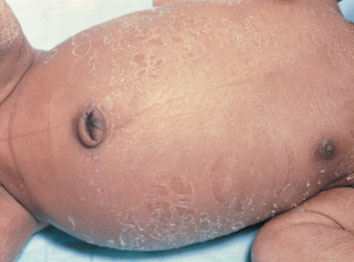
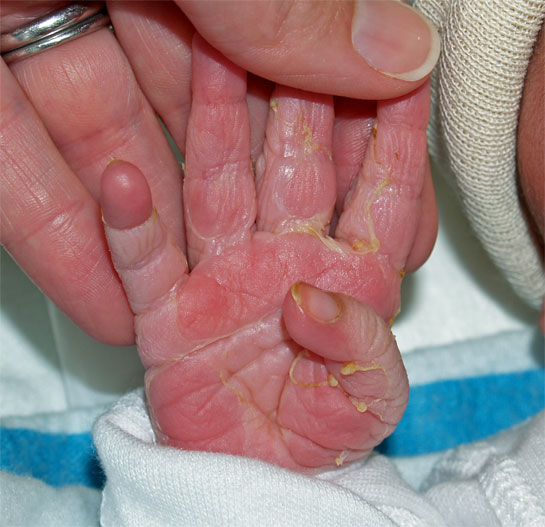

รูปที่ 1-4 ลักษณะของทารกที่คลอดจากครรภ์เกินกำหนด
รกเสื่อมสภาพ (Placental dysfunction)
จากการศึกษาของ Smith และ Baker ในปี ค.ศ. 1999 พบว่าตั้งแต่อายุครรภ์ 41 สัปดาห์ขึ้นไปจะมีการตายของเซลล์รก (Placental apoptosis) มากขึ้น [19] และจากการศึกษาของ Jazayeri และคณะ ในปี 1998 ได้ทำการศึกษาระดับ Erythropoietin ในเลือดจากสายสะดือของทารกที่คลอดระหว่างอายุครรภ์ 37 – 43 สัปดาห์ พบว่าทารกที่คลอดหลังอายุครรภ์ 41 สัปดาห์มีระดับของ Erythropoietin สูงขึ้น แสดงถึงภาวะออกซิเจนในเลือดต่ำ ซึ่งน่าจะเกิดจากการที่รกเสื่อมสภาพ [20]
ทารกอยู่ในภาวะคับขัน (Fetal distress) และน้ำคร่ำน้อย (Oligohydramnios)
ภาวะน้ำคร่ำน้อย (Oligohydramnios) เป็นปัจจัยส่งเสริมทำให้สายสะดือถูกกด (Cord compression) และทารกอยู่ในภาวะคับขัน (Fetal distress) [21] ซึ่งจะแสดงให้เห็นได้จากการตรวจติดตามด้วย Electronic monitoring จะพบว่ามีรูปแบบของ prolong fetal heart rate deceleration หรือ variable deceleration ดังรูปภาพที่ 5 และ 6 แต่ถ้าเป็น Late deceleration จะพบในภาวะรกเสื่อมสภาพ
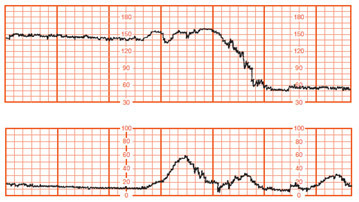
รูปภาพที่ 5 Prolonged deceleration [21]
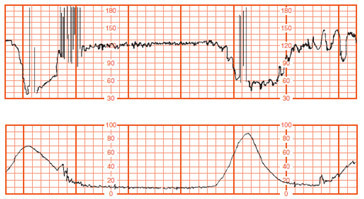
รูปภาพที่ 6 Severe variable deceleration [21]
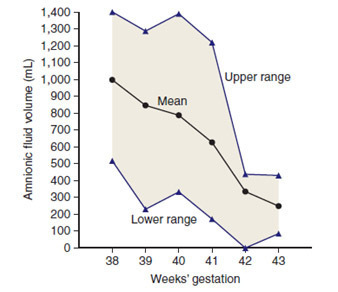
รูปภาพที่ 7 เปรียบเทียบปริมาณน้ำคร่ำในแต่ละอายุครรภ์ [22]
ในการตั้งครรภ์ปกติปริมาณน้ำคร่ำจะลดลงหลังจากอายุครรภ์ 38 สัปดาห์ ดังรูปภาพที่ 7 ในรายที่ทารกถ่ายขี้เทาในครรภ์ ปัญหาน้ำคร่ำน้อย (Oligohydramnios) จะเสริมให้ขี้เทาที่ปนในน้ำคร่ำมีความเข้มข้นมากขึ้น ทำให้เกิดปัญหาการสำลักขี้เทา (Meconium aspiration syndrome) หลังคลอดตามมาได้ สาเหตุของภาวะน้ำคร่ำน้อยเกิดจากทารกที่อายุครรภ์เกินกำหนดจะมีเลือดไปเลี้ยงที่ไต (Fetal renal blood flow) ลดลง ทำให้มีการสร้างปัสสาวะ (Fetal urine production) ลดลง [23]
ทารกเจริญเติบโตช้าในครรภ์ (Fetal-Growth restriction)
จากการศึกษาของ Clausson และคณะ ในปี ค.ศ. 1999 พบว่า 1 ใน 3 ของทารกที่คลอดหลังอายุครรภ์ 42 สัปดาห์ และเกิดทารกตายคลอด (Stillbirth) จะเป็นทารกที่เจริญเติบโตช้าในครรภ์ (Fetal-Growth restriction) [18, 24]
ผลกระทบของการตั้งครรภ์เกินกำหนดต่อทารก (Perinatal risks)
1. Morbidity and Mortality
ทารกมีความเสี่ยงต่อการเสียชีวิตในครรภ์เพิ่มขึ้น ถ้าคลอดหลังอายุครรภ์ 42 สัปดาห์ โดยจะเพิ่มเป็น 3 เท่าในอายุครรภ์ 43 สัปดาห์ และเพิ่มเป็น 4 – 6 เท่าในอายุครรภ์ 44 สัปดาห์ [4] และความเสี่ยงจะเพิ่มขึ้นอย่างรวดเร็วที่อายุครรภ์ระหว่าง 41 – 42 สัปดาห์ [25] ดังรูปภาพที่ 8
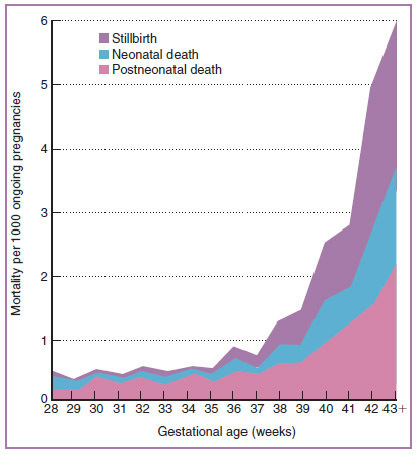
รูปภาพที่ 8 กราฟแสดงความสัมพันธ์ระหว่างความเสี่ยงต่อการเสียชีวิตในครรภ์ของทารกกับอายุครรภ์ [25]
จากการศึกษาของ Alexander และคณะ ในปี ค.ศ. 2000 เกี่ยวกับผลลัพธ์ของการคลอดที่อายุครรภ์ 40 สัปดาห์เปรียบเทียบกับการคลอดที่อายุครรภ์ 41 และ 42 สัปดาห์ พบว่าอายุครรภ์ 41 สัปดาห์ ระยะที่ 1 และ 2 ของการคลอดนานขึ้น อัตราการทำหัตถการทางสูติศาสตร์ทั้งผ่าตัดคลอดและช่วยคลอดด้วยคีมมากขึ้น ในอายุครรภ์ 42 สัปดาห์ มีอัตราการชักนำคลอด การผ่าท้องทำคลอดจากสาเหตุการคลอดติดไหล่ และ fetal distress มากขึ้น และทารกคลอดต้องเข้ารับการรักษาใน Neonatal Intensive Care Unit (NICU) มากขึ้น อุบัติการณ์ของ Neonatal seizure และการเสียชีวิตเพิ่มขึ้นเป็น 2 เท่า ดังตารางที่ 1 จากผลลัพธ์ดังกล่าวทำให้ต้องเฝ้าระวังมากขึ้นเมื่ออายุครรภ์เกินกำหนด หรือมีการชักนำคลอดเมื่ออายุครรภ์ 42 สัปดาห์ [26]
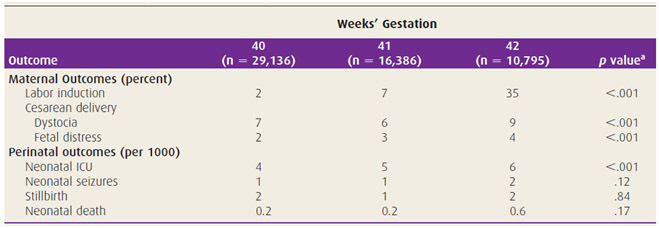
ตารางที่ 1 แสดง Pregnancy outcomes ที่อายุครรภ์ 40, 41 และ 42 สัปดาห์ [26]
2. การเจริญเติบโตของทารกในครรภ์ผิดปกติ (Abnormal fetal growth)
ได้แก่ Postmaturity syndrome, ทารกที่เจริญเติบโตช้าในครรภ์ (Fetal-Growth restriction) ดังที่ได้กล่าวถึงในข้างต้น และทารกตัวโตกว่าปกติ (Macrosomia)
ทารกตัวโตกว่าปกติ (Macrosomia)
การเจริญเติบโตเพิ่มน้ำหนักของทารกในครรภ์จะสูงสุดที่อายุครรภ์ 37 สัปดาห์เต็ม ดังรูปภาพที่ 9 หลังจากนั้นการเจริญเติบโตจะช้าลง แต่ยังคงดำเนินต่อไป ทำให้ทารกมีขนาดโตกว่าปกติ
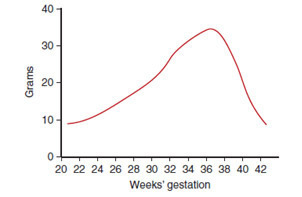
รูปภาพที่ 9 กราฟแสดงอัตราการเจริญเติบโตของทารกตามอายุครรภ์ที่เพิ่มขึ้น [20]
ทารกตัวโตกว่าปกติ (Macrosomia) ทำให้เกิดภาวะแทรกซ้อน เช่น มีภาวะผิดสัดส่วนระหว่างศีรษะทารกกับช่องเชิงกราน (CPD) การคลอดไหล่ยาก ต้องใช้หัตถการทางสูติศาสตร์ เกิดอันตรายต่อช่องทางคลอดของมารดา และเกิดอันตรายต่อทารก เช่น ภาวะเลือดออกที่เยื่อหุ้มสมองใต้กะโหลกศีรษะ (Cephalhematoma) กระดูกหัก และบาดเจ็บต่อเส้นประสาท Brachial plexus [27]
วิธีการคลอดของทารกตัวโตกว่าปกติ ถ้าคะเนน้ำหนักไม่มากเกินไป สามารถให้คลอดทางช่องคลอดได้ ทั้งนี้ขึ้นกับการประเมินดุลยพินิจของแพทย์ผู้ดูแล ถึงแม้ว่าคะเนน้ำหนักทารกเกิน 5000 กรัม และมารดาไม่ได้เป็นเบาหวาน ก็ไม่ได้เป็นข้อห้ามในการคลอดทางช่องคลอด แต่แนะนำให้ผ่าท้องทำคลอดในรายที่คะเนน้ำหนักทารกเกิน 4500 กรัม และมีระยะที่ 2 ของการคลอดยืดเยื้อ (Prolonged second-stage of labor) หรือ Arrest of descent [28]
3. ขี้เทาปนในน้ำคร่ำ และปัญหาการสำลักขี้เทา (Meconium staining and Pulmonary aspiration)
จากปัญหาขี้เทาปนในน้ำคร่ำ ทำให้ทารกสำลักขี้เทา (Meconium aspiration syndrome) และปัญหาน้ำคร่ำน้อย (Oligohydramnios) ยิ่งเสริมให้ขี้เทาที่ปนในน้ำคร่ำมีความเข้มข้นมากขึ้น [29] ในรายที่รุนแรงทำให้ทารกเสียชีวิตได้
การประเมินทารก และการดูแลรักษา (Fetal evaluation and management)
เมื่อทราบว่าทารกที่อายุครรภ์เกินกำหนดมีความเสี่ยง สิ่งสำคัญจึงต้องทราบอายุครรภ์ที่แน่นอน และให้การดูแลรักษา โดยการตรวจติดตามสุขภาพทารกในครรภ์ก่อนคลอดอย่างใกล้ชิด หรือการชักนำคลอด
การตรวจติดตามสุขภาพทารกในครรภ์ก่อนคลอด (Antepartum fetal monitoring)
จากการศึกษาพบว่าภาวะแทรกซ้อนของมารดาและทารกในครรภ์เพิ่มขึ้นหลังอายุครรภ์ 41 สัปดาห์ [10, 24, 30, 31] การศึกษาส่วนใหญ่จึงแนะนำให้เริ่มตรวจติดตามสุขภาพทารกในครรภ์อย่างใกล้ชิดตั้งแต่อายุครรภ์ 41 สัปดาห์ และทำการตรวจสัปดาห์ละ 2 ครั้ง [1, 30, 32, 33] ซึ่งพบว่าสามารถลดอัตราการเสียชีวิตของทารกได้ [29, 34, 35] ส่วนการตรวจที่อายุครรภ์ก่อน 41 สัปดาห์นั้นยังไม่มีข้อมูลเกี่ยวกับการลดอัตราการเสียชีวิตของทารก วิธีการตรวจ และความถี่ในการตรวจที่เหมาะสม
วิธีการตรวจมีหลายวิธีสามารถใช้ประเมินร่วมกันได้แล้วแต่ดุลยพินิจของผู้ตรวจ ประกอบด้วย
- Non stress test (NST) [1, 33]
- Biophysical profile (BPP) หรือ Modified BPP [1, 33]
- Contraction stress test (CST) [1, 34]
- การวัดปริมาณน้ำคร่ำด้วยการตรวจคลื่นเสียงความถี่สูง (Ultrasound) [1, 33]
การวัด Doppler ultrasound ของเส้นเลือดสายสะดือของทารก (Umbilical artery) ยังไม่มีข้อมูลว่ามีประโยชน์ในการตรวจติดตามสุขภาพของทารกในครรภ์ที่อายุครรภ์เกินกำหนด [36] และจากการศึกษาของ Oz และคณะ ในปี ค.ศ. 2002 พบว่าการวัด Renal artery Doppler resistance index สามารถพยากรณ์ภาวะน้ำคร่ำน้อยได้ดีกว่าการวัด Umbilical artery Doppler resistance index [23]
วิธีการที่ใช้วัดปริมาณน้ำคร่ำยังไม่มีข้อสรุปที่แน่นอน เนื่องจากมีข้อจำกัดจากตัวผู้วัดแต่ละคนแตกต่างกัน และมีหลากหลายเกณฑ์ที่ใช้วินิจฉัยภาวะน้ำคร่ำน้อย เกณฑ์ที่ดีที่สุดที่ใช้วินิจฉัย [37] คือ Amniotic fluid index (AFI) ≤ 5 หรือ Pocket ที่ใหญ่ที่สุดของน้ำคร่ำ ≤ 2 cm หากพบว่าน้ำคร่ำน้อยอาจนำไปสู่การทำหัตถการอื่นๆ เกินความจำเป็น แต่ช่วยบ่งบอกภาวะแทรกซ้อนและอันตรายที่อาจตามมา ได้แก่ สายสะดือถูกกด Fetal hypoxemia ทารกสำลักขี้เทา และอัตราการเต้นของหัวใจทารกผิดปกติ เกิดภาวะ fetal distress และนำไปสู่การผ่าท้องทำคลอด และความเสี่ยงที่ทารกจะต้องอยู่ใน Neonatal Intensive Care Unit (NICU) ดังรูปภาพที่ 10 ดังนั้นน้ำคร่ำน้อยจึงเป็นข้อบ่งชี้หนึ่งของการให้ยุติการตั้งครรภ์
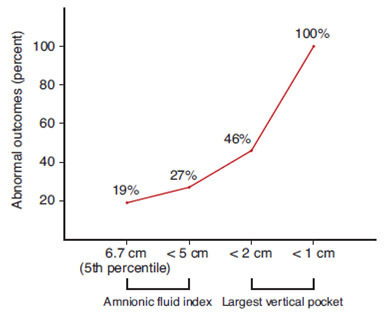
รูปภาพที่ 10 กราฟแสดงการเปรียบเทียบปริมาณน้ำคร่ำในสตรีอายุครรภ์เกินกำหนดกับ outcomes [37]
การชักนำคลอด (Induction of labor)
การชักนำคลอด คือ การทำให้มดลูกมีการหดรัดตัวของกล้ามเนื้อมดลูกอย่างมีประสิทธิภาพ และปากมดลูกนุ่ม บางลง และถ่างขยาย
ปัจจัยที่ส่งผลให้การชักนำคลอดสำเร็จ (Prognostic factors for successful induction)
1. ความพร้อมของปากมดลูก (Cervical ripening)
การประเมินความพร้อมของปากมดลูก สามารถใช้ Bishop score ดังตารางที่ 2 เป็นเครื่องมือในการเลือกวิธีการชักนำคลอด การประเมินนี้เหมาะกับสตรีครรภ์แรกมากที่สุด
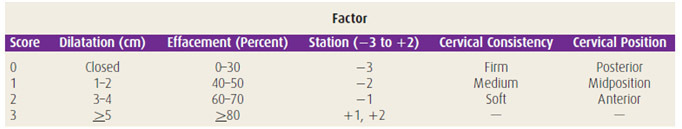
ตารางที่ 2 Bishop score [2]
คะแนนจาก Bishop score ที่น้อยกว่า 7 ถือว่าปากมดลูกอยู่ในสภาวะที่ไม่เหมาะสม (Unfavorable cervix) ต่อการชักนำคลอด มีโอกาสล้มเหลวสูงและอาจเพิ่มภาวะแทรกซ้อนให้แก่มารดาและทารก ดังนั้นควรทำให้ปากมดลูกมีความพร้อมก่อนการกระตุ้นการหดรัดตัวของมดลูก [38]
วิธีการทำให้ปากมดลูกพร้อมต่อการชักนำคลอด
- การเซาะแยกถุงน้ำคร่ำ (Sweeping or stripping of the membrane) จะเริ่มทำ Membrane stripping เมื่ออายุครรภ์ 38 สัปดาห์ จะช่วยลดอุบัติการณ์ของการตั้งครรภ์เกินกำหนดได้ และไม่เพิ่มการติดเชื้อของมารดาและทารกในครรภ์ด้วย [39] แต่ผู้ป่วยอาจมีอาการปวด เลือดออกทางช่องคลอด และเจ็บครรภ์ไม่สม่ำเสมอได้ [40]
- การใช้ยา Prostaglandin ACOG 2004 [1] แนะนำว่ายานี้ในรูปแบบ Gel สามารถใช้ได้อย่างปลอดภัยในการตั้งครรภ์เกินกำหนด ได้แก่
- Prostaglandin E2 : PGE2 (Dinoprostone หรือชื่อทางการค้า Prepidil และ Cervidil) ใช้สอดทางช่องคลอดหรือในรูปากมดลูก
- Prostaglandin E1 : PGE1 (Misoprostol หรือชื่อทางการค้า Cytotec) ใช้สอดทางช่องคลอด หรือรับประทาน
ในปัจจุบันยังไม่มีขนาดยามาตรฐานที่ระบุให้ใช้ แต่ที่แนะนำ คือขนาดของยา Misoprostol คือ 25 µg ใช้สอดทางช่องคลอดทุก 4 ชั่วโมง พบว่ามีประสิทธิภาพมากกว่าการใช้ยา Dinoprostone เล็กน้อย แต่มีโอกาสเกิด Uterine tachysystole ได้สูงกว่า [1, 40, 41] และการใช้ยาทั้ง 2 แบบมีประสิทธิภาพในการเพิ่ม Bishop score และส่งผลให้เวลาที่ใช้ในการคลอดสั้นลง และโอกาสการชักนำคลอดล้มเหลวลดลงด้วย [42]
- การใช้ Balloon catheter สอดทางช่องคลอด เพื่อถ่างขยายปากมดลูก พบว่ายังไม่มีการเปรียบเทียบวิธีนี้กับการใช้ยาในแง่ของโอกาสสำเร็จในการคลอด แต่วิธีนี้การเกิด Uterine hypercontractility น้อยกว่า [43] แต่เกิดการติดเชื้อในมารดาและทารกในครรภ์สูงขึ้น [40]
- การเจาะถุงน้ำคร่ำ (amniotomy) ถ้าปากมดลูกมีความพร้อมแล้ว คือนุ่มลง บางลง และเริ่มถ่างขยาย การชักนำคลอดในทางปฏิบัติจะเริ่มจากการเจาะถุงน้ำคร่ำ (amniotomy) เป็นอันดับแรก เนื่องจากเป็นวิธีที่มีประสิทธิภาพสูงสุดในการชักนำคลอด [4]
- การให้ยา Oxytocin ทางกระแสเลือด เป็นการชักนำคลอดที่เหมาะสมเมื่อปากมดลูกมีความพร้อมแล้ว จะช่วยกระตุ้นการหดรัดตัวของมดลูก แต่ถ้าปากมดลูกยังไม่พร้อม จะไม่สามารถเจาะถุงน้ำคร่ำได้ และการให้ยา Oxytocin ก็จะไม่สามารถทำให้ปากมดลูกนุ่มลงได้ และไม่ง่ายต่อการชักนำ ถึงแม้ว่าการให้ยา Oxytocin จะกระตุ้นการหดรัดตัวของมดลูก และส่งผลให้มีการเปลี่ยนแปลงของปากมดลูกได้ แต่อาจทำให้เกิดการคลอดยืดเยื้อ และนำไปสู่ Morbidity ได้แก่ เพิ่มความเสี่ยงของการตกเลือดหลังคลอด เพิ่มความเสี่ยงของการผ่าท้องทำคลอด [4]
2. ระดับของส่วนนำ (Station of vertex)
เป็นอีกหนึ่งปัจจัยที่บ่งบอกความสำเร็จในการชักนำคลอดได้ จากการศึกษาหนึ่งพบว่าสตรีที่อายุครรภ์ 41 สัปดาห์ที่ได้รับการชักนำคลอดมีอัตราการผ่าท้องทำคลอดสูงขึ้นตามระดับของส่วนนำที่อยู่สูงขึ้น [44]
การตรวจติดตามสุขภาพทารกในครรภ์ กับ การชักนำคลอด (Fetal monitoring Vs Induction of labor)
ถึงแม้ว่าการตรวจติดตามสุขภาพทารกในครรภ์ระยะก่อนคลอดจะสามารถลด Fetal morbidity และ mortality ได้ แต่ถ้ามีความกังวลผลลัพธ์ที่ไม่ดีต่อทารกในครรภ์ วิธีการชักนำคลอดเป็นอีกทางเลือกหนึ่ง โดยทำให้ปากมดลูกมีความพร้อมก่อนที่จะชักนำคลอด
จากการศึกษาของ Hannah และคณะ ในปี ค.ศ. 1992 พบว่าการชักนำการคลอดมีอัตราการผ่าคลอดจากภาวะ fetal distress น้อยกว่าในรายที่รอคลอด และตรวจติดตามสุขภาพทารกอย่างใกล้ชิด [45] และอีกการศึกษาหนึ่งยืนยันว่า fetal morbidity และ mortality ไม่แตกต่างกัน และอัตราการผ่าท้องทำคลอดก็ไม่แตกต่างกัน ดังนั้นทั้ง 2 วิธีการรักษาจึงมีประโยชน์ไม่แตกต่างกัน [46]
ข้อสรุปการดูแลรักษา [1]
1. กลุ่มที่ทราบอายุครรภ์แน่นอน
a. เมื่ออายุครรภ์ 41 สัปดาห์เต็ม
i. ร่วมกับไม่มีภาวะแทรกซ้อนอื่นๆ เช่น ความดันโลหิตสูง ลูกดิ้นลดลง หรือน้ำคร่ำน้อย ให้เริ่มตรวจติดตามสุขภาพทารกในครรภ์ สัปดาห์ละ 2 ครั้ง โดยใช้การตรวจด้วย NST หรือ BPP และการวัดปริมาณน้ำคร่ำ
ii. ถ้ามีภาวะแทรกซ้อนดังกล่าว ให้ชักนำคลอดเมื่อปากมดลูกมีความพร้อมแล้ว
b. เมื่ออายุครรภ์ 42 สัปดาห์เต็ม ให้ชักนำคลอด ประมาณร้อยละ 90 จะเข้าสู่ระยะคลอดภายใน 2 วัน แต่ถ้าการชักนำคลอดครั้งแรกล้มเหลว ให้เริ่มชักนำคลอดครั้งที่ 2 ภายใน 3 วันถัดมา แต่ถ้ายังไม่คลอด สามารถเลือกได้ระหว่างการชักนำคลอดครั้งที่ 3 หรือการผ่าท้องทำคลอด
2. กลุ่มที่อายุครรภ์ไม่แน่นอน ให้ตรวจติดตามสุขภาพทารกในครรภ์สัปดาห์ละ 1 ครั้งด้วย NST และการวัดปริมาณน้ำคร่ำ ถ้าพบว่า AFI ≤ 5 cm หรือลูกดิ้นลดลง ให้ชักนำคลอด
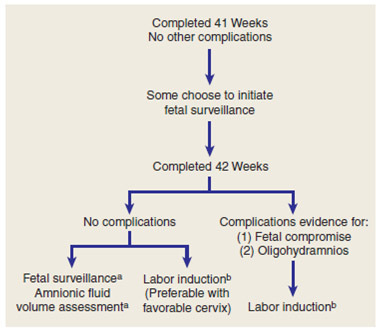
รูปภาพที่ 11 แผนภาพแสดงข้อสรุปการรักษาสตรีที่ตั้งครรภ์เกินกำหนด [1]
การดูแลรักษาในระยะคลอด (Intrapartum management)
ระยะคลอดเป็นระยะที่อันตรายที่สุดของการตั้งครรภ์เกินกำหนด ดังนั้นสตรีตั้งครรภ์เกินกำหนดควรมาโรงพยาบาลทันทีเมื่อเจ็บครรภ์คลอด เพื่อตรวจสุขภาพของทารกในครรภ์ตลอดเวลาด้วย Electronic Fetal Heart Rate Monitoring และตรวจติดตามการหดรัดตัวของมดลูกด้วย [47]
การเจาะถุงน้ำคร่ำ (amniotomy) มีทั้งข้อดีและข้อเสีย เนื่องจากการเจาะถุงน้ำคร่ำจะทำให้น้ำที่มีปริมาณอยู่ไม่มากลดปริมาณลงอีก มีโอกาสเกิดสายสะดือถูกกดได้ แต่ข้อดีคือสามารถดูลักษณะน้ำคร่ำได้ว่ามีขี้เทาปนหรือไม่ และสามารถทำ Internal Fetal Heart Rate Monitoring ได้ด้วย
การเติมน้ำคร่ำ (Amnioinfusion) ไม่มีประโยชน์ในรายที่มีขี้เทาปนในน้ำคร่ำ เนื่องจากไม่ได้ช่วยลดอุบัติการณ์การเกิดปัญหาการสำลักขี้เทา (Meconium Aspiration Syndrome) [48] แต่ ACOG 2005, 2006 แนะนำให้ทำเมื่อมีลักษณะของ Repetitive Variable Deceleration ซึ่งเกิดจากปัญหาการกดสายสะดือ โดยไม่คำนึงถึงลักษณะของขี้เทาปนในน้ำคร่ำ
การผ่าท้องทำคลอดอาจพิจารณาทำได้ เช่น น้ำคร่ำมีขี้เทาปนมากและคาดว่าใช้เวลาอีกนานกว่าทารกจะคลอด สงสัยภาวะการผิดสัดส่วนระหว่างเชิงกรานกับทารก (Cephalopelvic disproportion) หรือการหดรัดตัวของมดลูกผิดปกติ
การดูแลทารกแรกคลอด [49]
ในปี ค.ศ. 2006 The American Academy of Pediatrics และ The American Heart Association กล่าวถึงแนวทางในการกู้ชีพทารกแรกเกิด (Neonatal resuscitation) ไว้ว่าทารกแรกคลอดทุกคนที่มีขี้เทาปนในน้ำคร่ำ หลังจากศีรษะของทารกคลอดไม่ควรดูดเมือกออกจากปาก คอ จมูกของทารกก่อนจะคลอดไหล่ของทารก (Intrapartum suctioning) ดังเช่นแนวทางในการกู้ชีพทารกแรกเกิดเดิม ให้ทำคลอดไหล่และลำตัวของทารกต่อมา เนื่องจากการทำ Intrapartum suctioning ไม่ได้ช่วยป้องกันและเปลี่ยนแปลงการเกิด Meconium aspiration syndrome จากนั้นให้แพทย์ผู้ดูแลทารกแรกคลอดพิจารณา ถ้าทารกมีอาการหายใจช้า ติดขัด หรือไม่หายใจ (Non-vigorous) ให้ทำการดูดขี้เทาอย่างเพียงพอผ่านท่อช่วยหายใจ (Endotracheal tube) แต่ถ้าทารกหายใจได้ดี (Vigorous) หมายถึงหายใจเองได้เต็มที่ ความตึงตัวของกล้ามเนื้อดี และอัตราการเต้นของหัวใจมากกว่า 100 ครั้งต่อนาที ให้ทำการกู้ชีพทารกแรกคลอดตามปกติ ไม่มีความจำเป็นต้องทำการดูดขี้เทาผ่านท่อช่วยหายใจ (Endotracheal tube) เนื่องจากจะทำให้เกิดอันตรายต่อเส้นเสียง
พัฒนาการของทารกที่มีอายุครรภ์เกินกำหนด (Developmental effects of Postterm gestation)
จากการศึกษาพบว่าทารกที่มีภาวะเจริญเติบโตช้าในครรภ์ (Growth-restricted neonate) โดยไม่คำนึงถึงอายุครรภ์ที่คลอด จะมีปัญหาเรื่องการเจ็บป่วยง่าย ปัญหาการนอนหลับ และปัญหาการเข้าสังคมตั้งแต่อายุ 1 ปี และทารกที่มีภาวะ fetal distress และ Birth asphyxia จะมีระบบประสาทที่ผิดปกติได้มากในช่วงแรกเกิด [50] และอีกการศึกษาหนึ่งเปรียบเทียบทารกที่คลอดเมื่ออายุครรภ์เกินกำหนดกับทารกที่คลอดเมื่ออายุครรภ์ครบกำหนดพบว่าเมื่อทารกอายุ 1 ปี หรือ 2 ปีไม่มีความแตกต่างกันในแง่ของระดับสติปัญญา และการเจ็บป่วย [51]
เอกสารอ้างอิง
- ACOG Practice Bulletin. Clinical management guidelines for obstetricians-gynecologists. Number 55, September 2004 (replaces practice pattern number 6, October 1997). Management of Postterm Pregnancy. Obstet Gynecol, 2004. 104(3): p. 639-46.
- Cunningham, F.G., postterm pregnancy, in Williams obstetrics, K.D. Alyssa Fried, Editor. 2010. p. 832-841.
- Doherty, L. and E.R. Norwitz, Prolonged pregnancy: when should we intervene? Curr Opin Obstet Gynecol, 2008. 20(6): p. 519-27.
- Jamie L. Resnik, R.R., Post-term Pregnancy. 6th ed. CREASY AND RESNIK’S MATERNAL-FETAL MEDICINE: PRINCIPLES AND PRACTICE, ed. R.R. Robert K. Creasy, Jay D. Iams 2009, California: Saunders. 6.
- Bennett, K.A., et al., First trimester ultrasound screening is effective in reducing postterm labor induction rates: a randomized controlled trial. Am J Obstet Gynecol, 2004. 190(4): p. 1077-81.
- Blondel, B., et al., Algorithms for combining menstrual and ultrasound estimates of gestational age: consequences for rates of preterm and postterm birth. BJOG, 2002. 109(6): p. 718-20.
- Boyd, M.E., et al., Obstetric consequences of postmaturity. Am J Obstet Gynecol, 1988. 158(2): p. 334-8.
- Gardosi, J., T. Vanner, and A. Francis, Gestational age and induction of labour for prolonged pregnancy. Br J Obstet Gynaecol, 1997. 104(7): p. 792-7.
- Taipale, P. and V. Hiilesmaa, Predicting delivery date by ultrasound and last menstrual period in early gestation. Obstet Gynecol, 2001. 97(2): p. 189-94.
- Divon, M.Y. and N. Feldman-Leidner, Postdates and antenatal testing. Semin Perinatol, 2008. 32(4): p. 295-300.
- Macdonald, P.C. and P.K. Siteri, Origin of Estrogen in Women Pregnant with an Anencephalic Fetus. J Clin Invest, 1965. 44: p. 465-74.
- Taylor, N.F., Review: placental sulphatase deficiency. J Inherit Metab Dis, 1982. 5(3): p. 164-76.
- Mogren, I., H. Stenlund, and U. Hogberg, Recurrence of prolonged pregnancy. Int J Epidemiol, 1999. 28(2): p. 253-7.
- Oberg, A.S., et al., Maternal and fetal genetic contributions to postterm birth: familial clustering in a population-based sample of 475,429 Swedish births. Am J Epidemiol. 177(6): p. 531-7.
- Olesen, A.W., J.G. Westergaard, and J. Olsen, Prenatal risk indicators of a prolonged pregnancy. The Danish Birth Cohort 1998-2001. Acta Obstet Gynecol Scand, 2006. 85(11): p. 1338-41.
- Clifford, S.H., Postmaturity, with placental dysfunction; clinical syndrome and pathologic findings. J Pediatr, 1954. 44(1): p. 1-13.
- Trimmer, K.J., et al., Observations on the cause of oligohydramnios in prolonged pregnancy. Am J Obstet Gynecol, 1990. 163(6 Pt 1): p. 1900-3.
- Clausson, B., S. Cnattingius, and O. Axelsson, Outcomes of post-term births: the role of fetal growth restriction and malformations. Obstet Gynecol, 1999. 94(5 Pt 1): p. 758-62.
- Smith, S.C. and P.N. Baker, Placental apoptosis is increased in post-term pregnancies. Br J Obstet Gynaecol, 1999. 106(8): p. 861-2.
- Jazayeri, A., J.C. Tsibris, and W.N. Spellacy, Elevated umbilical cord plasma erythropoietin levels in prolonged pregnancies. Obstet Gynecol, 1998. 92(1): p. 61-3.
- Leveno, K.J., et al., Prolonged pregnancy. I. Observations concerning the causes of fetal distress. Am J Obstet Gynecol, 1984. 150(5 Pt 1): p. 465-73.
- Elliott, P.M. and W.H. Inman, Volume of liquor amnii in normal and abnormal pregnancy. Lancet, 1961. 2(7207): p. 835-40.
- Oz, A.U., et al., Renal artery Doppler investigation of the etiology of oligohydramnios in postterm pregnancy. Obstet Gynecol, 2002. 100(4): p. 715-8.
- Divon, M.Y., et al., Fetal and neonatal mortality in the postterm pregnancy: the impact of gestational age and fetal growth restriction. Am J Obstet Gynecol, 1998. 178(4): p. 726-31.
- Hilder, L., K. Costeloe, and B. Thilaganathan, Prolonged pregnancy: evaluating gestation-specific risks of fetal and infant mortality. Br J Obstet Gynaecol, 1998. 105(2): p. 169-73.
- Alexander, J.M., D.D. McIntire, and K.J. Leveno, Forty weeks and beyond: pregnancy outcomes by week of gestation. Obstet Gynecol, 2000. 96(2): p. 291-4.
- Usher, R.H., et al., Assessment of fetal risk in postdate pregnancies. Am J Obstet Gynecol, 1988. 158(2): p. 259-64.
- Chatfield, J., ACOG issues guidelines on fetal macrosomia. American College of Obstetricians and Gynecologists. Am Fam Physician, 2001. 64(1): p. 169-70.
- Eden, R.D., et al., Perinatal characteristics of uncomplicated postdate pregnancies. Obstet Gynecol, 1987. 69(3 Pt 1): p. 296-9.
- Guidetti, D.A., M.Y. Divon, and O. Langer, Postdate fetal surveillance: is 41 weeks too early? Am J Obstet Gynecol, 1989. 161(1): p. 91-3.
- Nakling, J. and B. Backe, Pregnancy risk increases from 41 weeks of gestation. Acta Obstet Gynecol Scand, 2006. 85(6): p. 663-8.
- Bochner, C.J., et al., The efficacy of starting postterm antenatal testing at 41 weeks as compared with 42 weeks of gestational age. Am J Obstet Gynecol, 1988. 159(3): p. 550-4.
- Mandruzzato, G., et al., Guidelines for the management of postterm pregnancy. J Perinat Med. 38(2): p. 111-9.
- Freeman, R.K., et al., Postdate pregnancy: utilization of contraction stress testing for primary fetal surveillance. Am J Obstet Gynecol, 1981. 140(2): p. 128-35.
- Johnson, J.M., et al., Biophysical profile scoring in the management of the postterm pregnancy: an analysis of 307 patients. Am J Obstet Gynecol, 1986. 154(2): p. 269-73.
- Stokes, H.J., R.V. Roberts, and J.P. Newnham, Doppler flow velocity waveform analysis in postdate pregnancies. Aust N Z J Obstet Gynaecol, 1991. 31(1): p. 27-30.
- Fischer, R.L., et al., Amniotic fluid volume estimation in the postdate pregnancy: a comparison of techniques. Obstet Gynecol, 1993. 81(5 ( Pt 1)): p. 698-704.
- Harris, B.A., Jr., et al., The unfavorable cervix in prolonged pregnancy. Obstet Gynecol, 1983. 62(2): p. 171-4.
- Boulvain, M., et al., Sweeping of the membranes to prevent post-term pregnancy and to induce labour: a systematic review. Br J Obstet Gynaecol, 1999. 106(5): p. 481-5.
- Winer, N., [Different methods for the induction of labour in postterm pregnancy]. J Gynecol Obstet Biol Reprod (Paris). 40(8): p. 796-811.
- Hofmeyr, G.J. and A.M. Gulmezoglu, Vaginal misoprostol for cervical ripening and induction of labour. Cochrane Database Syst Rev, 2003(1): p. CD000941.
- Crane, J.M., et al., Misoprostol compared with prostaglandin E2 for labour induction in women at term with intact membranes and unfavourable cervix: a systematic review. BJOG, 2006. 113(12): p. 1366-76.
- Boulvain, M., et al., Mechanical methods for induction of labour. Cochrane Database Syst Rev, 2001(4): p. CD001233.
- Shin, K.S., K.L. Brubaker, and L.M. Ackerson, Risk of cesarean delivery in nulliparous women at greater than 41 weeks’ gestational age with an unengaged vertex. Am J Obstet Gynecol, 2004. 190(1): p. 129-34.
- Hannah, M.E., et al., Induction of labor as compared with serial antenatal monitoring in post-term pregnancy. A randomized controlled trial. The Canadian Multicenter Post-term Pregnancy Trial Group. N Engl J Med, 1992. 326(24): p. 1587-92.
- A clinical trial of induction of labor versus expectant management in postterm pregnancy. The National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. Am J Obstet Gynecol, 1994. 170(3): p. 716-23.
- ACOG Practice Bulletin. Clinical Management Guidelines for Obstetrician-Gynecologists, Number 70, December 2005 (Replaces Practice Bulletin Number 62, May 2005). Intrapartum fetal heart rate monitoring. Obstet Gynecol, 2005. 106(6): p. 1453-60.
- Fraser, W.D., et al., Amnioinfusion for the prevention of the meconium aspiration syndrome. N Engl J Med, 2005. 353(9): p. 909-17.
- ACOG Committee Opinion No. 379: Management of delivery of a newborn with meconium-stained amniotic fluid. Obstet Gynecol, 2007. 110(3): p. 739.
- Lovell, K.E., The effect of postmaturity on the developing child. Med J Aust, 1973. 1(1): p. 13-7.
- Shime, J., et al., The influence of prolonged pregnancy on infant development at one and two years of age: a prospective controlled study. Am J Obstet Gynecol, 1986. 154(2): p. 341-5.


