Ovarian hyperstimulation syndrome (OHSS): ภาวะรังไข่ถูกกระตุ้นมากเกินไป
แพทย์หญิงชญานิษฐ์ คุณานุกุลวัฒนา
ผู้ช่วยศาสตราจารย์แพทย์หญิงณัฐนิตา มัทวานนท์
บทนำ
ภาวะรังไข่ถูกกระตุ้นมากเกินไป (Ovarian hyperstimulation syndrome, OHSS) เป็นภาวะแทรกซ้อนที่พบได้ไม่บ่อย ที่สามารถเกิดขึ้นได้จากกระบวนการเทคโนโลยีช่วยการเจริญพันธุ์ (Assisted Reproductive Technology: ART) แต่ส่งผลกระทบต่อผู้ป่วยได้มาก ซึ่งแสดงระดับความรุนแรงได้หลายระดับ และในระดับความรุนแรงมากที่สุดอาจจะทำให้เกิดอันตรายต่อชีวิตได้ อีกทั้งภาวะรังไข่ถูกกระตุ้นมากเกินไป อาจจะส่งผลกระทบหลายอย่างต่อผู้ป่วย เนื่องจากผู้ป่วยที่เกิดภาวะนี้ขึ้น มักเป็นผู้ป่วยที่เป็นผู้หญิงในวัยเจริญพันธุ์ ที่ต้องการมีบุตรจากการใช้เทคโนโลยีช่วยการเจริญพันธุ์ ไม่ว่าจะเป็นผลกระทบทางเศรษฐกิจ ต้องลาหยุดงาน นอนพักสังเกตอาการที่บ้าน หรือนอนโรงพยาบาลเป็นระยะเวลานาน เพื่อทำการรักษา
ภาวะรังไข่ถูกกระตุ้นมากเกินไป (Ovarian hyperstimulation syndrome, OHSS) เกิดขึ้นในขั้นตอนการใช้ฮอร์โมนเพื่อกระตุ้นการเจริญของไข่ (Controlled Ovarian Hyperstimulation, COH) เป็นกระบวนการฉีดยากระตุ้นเพื่อกระตุ้นให้ไข่ในรังไข่โตขึ้น (follicle) ก่อนจะทำการเก็บไข่ที่เจริญเต็มที่แล้วออกมาปฏิสนธิกับอสุจิด้านนอก สำหรับยาที่ใช้ในกระบวนการกระตุ้นไข่ ได้แก่
1. Ovarian hyperstimulation: Gonadotropin hormone
ฮอร์โมน FSH, LH หรือ Gonadotropin เป็นฮอร์โมนหลักที่ใช้ในการกระตุ้นการเจริญเติบโตของไข่ (Follicles) และชักนำให้เกิดการตกไข่ได้
2. Prevention of premature LH surge
ยากลุ่มนี้จะช่วยป้องกันการหลั่งฮอร์โมน LH จาก Pituitary gland ทำให้ป้องการการตกไข่ก่อนกำหนด
2.1 GnRH agonist – ในช่วงแรกของการออกฤทธิ์ยา จะจับกับ GnRH receptor กระตุ้นการหลั่ง gonadotropin ก่อน เรียกว่า Flare effect หลังจากนั้นค่อยเกิด Down regulation ปริมาณ GnRH receptor จะลดลง ทำให้ไม่สามารถหลั่ง gonadotropin ได้
2.2 GnRH antagonist – จะออกฤทธิ์แย่งจับกับ GnRH receptor ที่ Pituitary gland ทันที ทำให้ไม่สามารถหลั่ง gonadotropin ได้ ปริมาณ gonadotropin จะลดลงอย่างรวดเร็ว
3. Trigger ovulation
โดยทั่วไปแล้วจะมีการเกิด LH surge เพื่อชักนำให้ไข่เจริญเติบโตในระยะสุดท้ายเพื่อให้สุกเต็มที่ หลังจากนั้น 36 ชั่วโมงจะเกิดการตกไข่เกิดขึ้น ในผู้ป่วยที่ใช้เทคโนโลยีช่วยการเจริญพันธุ์ จะมีการใช้ยาเพื่อป้องกัน Premature LH surge อยู่ ดังนั้นจึงต้องให้ยาเพิ่มเพื่อกระตุ้นให้ไข่เจริญเติบโตระยะสุดท้ายและตกไข่ โดยจะใช้เป็นฮอร์โมน hCG หรือ GnRH agonist ทำหน้าที่เสมือนฮอร์โมน LH ในบางรายจะใช้ยาทั้ง 2 ชนิดร่วมกัน (Dual trigger)
ภาวะแทรกซ้อนที่พบได้จากการใช้เทคโนโลยีช่วยการเจริญพันธุ์ (Complication from ART)
- มีเลือดออก (Bleed) ติดเชื้อ (Infection) หรือเกิดอันตรายต่ออวัยวะข้างเคียงตอนเก็บไข่
- ตั้งครรภ์แฝด (Multiple gestation)
- การตั้งครรภ์นอกโพรงมดลูก (Ectopic pregnancy) หรือ การตั้งครรภ์ที่เกิดขึ้นทั้งในโพรงมดลูกและนอกโพรงมดลูกพร้อมกัน (Heterotopic pregnancy)
- ภาวะรังไข่ถูกกระตุ้นมากเกินไป (Ovarian hyperstimulation syndrome)
- ภาวะแทรกซ้อนต่อทารกจากการตั้งครรภ์แฝด เช่น การคลอดก่อนกำหนด (Preterm birth) คลอดทารกน้ำหนักตัวน้อย (Low birth weight) การเสียชีวิตของทารกในครรภ์ก่อนคลอด (Perinatal mortality)
ลักษณะของภาวะรังไข่ถูกกระตุ้นมากเกินไป (Characteristics) 1 คือ
- รังไข่มีขนาดใหญ่ขึ้น (Enlargement of ovaries)
- มีการเพิ่มขึ้นของการซึมผ่านผนังหลอดเลือด (Increased capillary permeability) และการสร้างเส้นเลือดใหม่เพิ่มขึ้นบริเวณรังไข่ (Ovarian neoangiogenesis)
- มีการเคลื่อนที่ของสารน้ำออกจากหลอดเลือดเข้าไปในช่องว่างของร่างกาย (Third space loss)
รูปแบบของภาวะรังไข่ถูกกระตุ้นมากเกินไป สามารถแบ่งได้เป็น 2 ชนิด 2 คือ
- แบบที่เกิดเร็ว (Early onset OHSS) พบได้ตั้งแต่ 3-7 วันหลังจากที่ผู้ป่วยได้รับ hCG hormone (Exogenous hCG) เพื่อกระตุ้นการตกไข่
- แบบที่เกิดช้า (Late onset OHSS) พบได้ตอน 12-17 วัน หลังจากที่ได้รับ hCG hormone และชนิดที่เกิดช้านี้ พบว่าเกี่ยวข้องกับการตั้งครรภ์หลังจากการย้ายตัวอ่อนรอบสด (Fresh embryo transfer) ซึ่งพบว่ามีระยะเวลาการดำเนินโรคนานกว่า และความรุนแรงที่มากกว่า เนื่องจากจะมีการสร้าง hCG hormone (Endogenous hCG) จากการตั้งครรภ์ขึ้นมาเสริมด้วย
พยาธิสรีรวิทยา (Pathophysiology)
ในขั้นตอนการให้ฮอร์โมน hCG เพื่อกระตุ้นการเจริญเติบโตของฟอลลิเคิลในระยะสุดท้าย (Final follicular maturation) และกระตุ้นให้เกิดการตกไข่ (Trigger of ovulation) จะทำให้มีการสร้างสาร VEGF (Vascular epithelial growth factor) เกิดขึ้นจาก Corpus luteum เกิดการปล่อยสารโปรตีนต่างๆ (Vasoactive-angiogenic substances) ทำให้มีการสร้างเส้นเลือดใหม่ขึ้น (Perifollicular neovascularization) ทำให้หลอดเลือดมี vascular permeability เพิ่มขึ้น เกิดการเคลื่อนที่ของสารน้ำออกจากหลอดเลือดเข้าไปสู่ช่องว่างของร่างกาย (Third space) หากเกิดขึ้นในปริมาณมาก จะทำให้เกิดอาการสูญเสียสารน้ำหรือเลือดออกจากหลอดเลือด บวมน้ำ มีท้องมานน้ำ น้ำบริเวณเยื่อหุ้มปอด,เยื่อหุ้มหัวใจ เลือดไปเลี้ยงอวัยวะต่างๆลดลง โดยเฉพาะเส้นเลือดไต โดยอาจจะทำให้เกิดอันตรายต่ออวัยวะต่างๆ ค่าความเข้มข้นเลือดสูงขึ้น ทำให้เกิดภาวะลิ่มเลือดอุดตันในร่างกายได้ ซึ่งถือว่าเป็นภาวะที่อันตรายต่อชีวิตได้
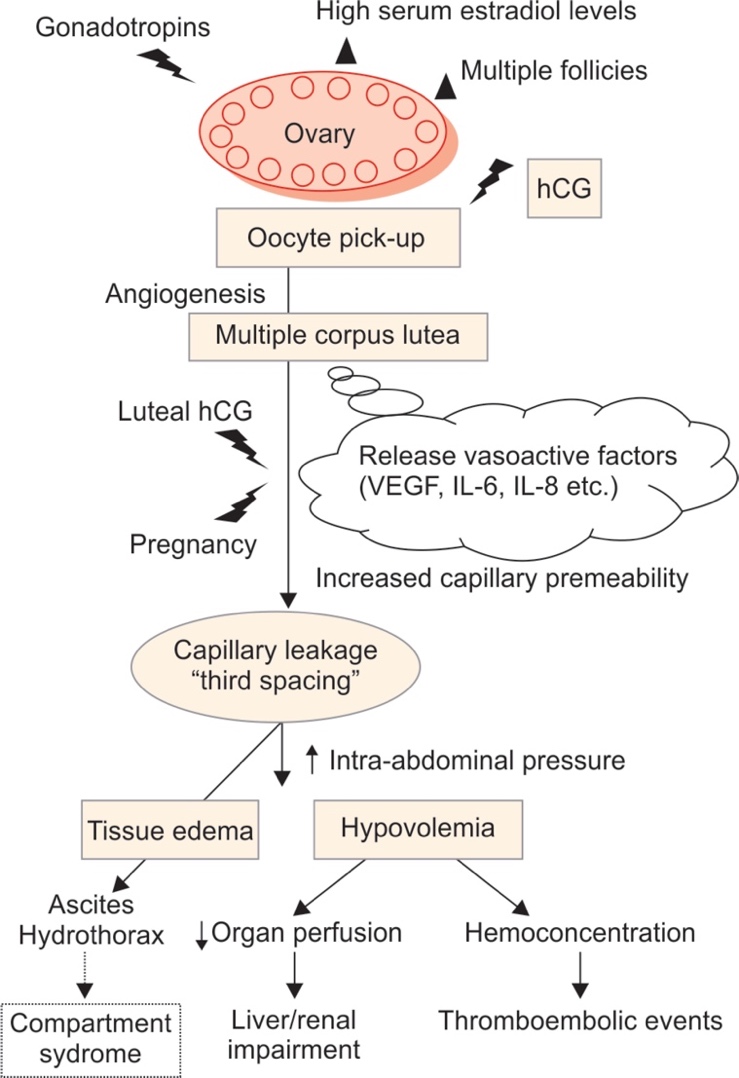
ที่มา: Nelson SM. Prevention and management of ovarian hyperstimulation syndrome. Thromb Res. 2017 Mar;151 Suppl 1:S61-S64. doi: 10.1016/S0049-3848(17)30070-1. PMID: 28262238. 3
hCG
ฮอร์โมน hCG คือฮอร์โมนหลักที่กระตุ้นทำให้เกิด OHSS เนื่องจากในกระบวนการเทคโนโลยีช่วยการเจริญพันธุ์ (ART) จะมีการใช้ hCG เพื่อไปจับกับ LH receptors และกระตุ้นทำให้เกิดการเจริญเติบโตของ Follicle และ ไข่ ในระยะสุดท้าย ในการเลือกใช้ฮอร์โมน hCG เนื่องจาก ฤทธิ์ทางชีวภาพ (Biological activity) ของ hCG สูงกว่า ฮอร์โมน LH 6-7 เท่า มีค่าครึ่งชีวิต (Half-life) และ การจับกับ Receptor ที่ดีกว่า 4 hCG จะกระตุ้นให้มีการหลั่งสาร VEGF ออกมามากขึ้น ซึ่ง VEGF เป็น cytokines หลัก ที่ทำให้เกิด OHSS
Vascular endothelial growth factor (VEGF)
ฮอร์โมน hCG จะกระตุ้นการหลั่งสาร VEGF จากตัว Follicle ทำให้เกิดการเปลี่ยนแปลงของโปรตีนบริเวณผิวเซลล์หลอดเลือด ได้แก่ Cadherin และ Claudin 5 และเพิ่ม Vascular permeability 5 ดังนั้นระดับ VEGF จึงสัมพันธ์กับระดับความรุนแรงของ OHSS โดยระดับของ VEGF จะเพิ่มสูงขึ้นมากที่สุดตอน 48 ชั่วโมงหลังจากฉีด hCG 6
Estradiol
ฮอร์โมน Estradiol ที่สร้างขึ้นจาก Granulosa cell ในรังไข่ สามารถใช้เป็นตัวบ่งบอกถึงการทำงานที่ของ Granulosa cell ในรังไข่ได้ หาก granulosa cell ในรังไข่ทำงานมากขึ้น ก็จะทำให้ปริมาณ Estradiol เพิ่มสูงขึ้น โดยหากมี Estradiol > 2,500 pg/ml หรือระดับฮอร์โมน estradiol ที่สูงเพิ่มขึ้นอย่างรวดเร็ว มักจะสัมพันธ์กับการเกิด OHSS ได้ และ Estradiol ถือว่าเป็น marker สำคัญที่สามารถนำมาใช้เพื่อการคาดคะเนการเกิด OHSS ได้ 1
Inflmatory mediators
พบว่าการเพิ่มขึ้นของสาร Cytokines ต่างๆ ที่เกิดขึ้นจากกระบวนการ ART เนื่องจากมีภาวะ inflammation เช่น สาร interleukin-6 (IL-6) พบว่า สัมพันธ์กับการเพิ่มขึ้นของ Vascular permeability, การเกิด Hemoconcentration 7
Renin-angiotensin system (RAS)
การทำงานของสาร Renin พบว่าสัมพันธ์กับระดับความรุนแรงของ OHSS เนื่องจาก Estradiol ที่เพิ่มสูงขึ้น จะกระตุ้นการสร้าง angiotensinogen มากขึ้น และภาวะ Hypovolemia ทำให้เกิดการกระตุ้นการหลั่งของสาร Renin ใน Renin-angiotensin system เพื่อสร้าง Angiotensin II ทำให้เกิดการหดตัวของเส้นเลือด และ หลั่ง Aldosterone เพิ่มขึ้น เพื่อดูดกลับน้ำและ NaCl ที่ไต 8
ปัจจัยเสี่ยงในการเกิด OHSS (Risk factors)
- อายุน้อย: พบว่า > 60% ของผู้ป่วย OHSS อายุต่ำกว่า 35 ปี 9
- น้ำหนักตัวน้อย
- ภาวะถุงน้ำในรังไข่หลายใบ (PCOS)
- การใช้ Gonadotropins ในปริมาณมาก
- การเพิ่มขึ้นของ Estradiol ในระดับสูงหรือเพิ่มขึ้นอย่างรวดเร็ว: ผู้ป่วย OHSS จะมีระดับ Estradiol ในร่างกายที่สูงกว่าปกติ ค่าเฉลี่ยของระดับ Estradiol ในร่างกายของผู้ป่วย OHSS อยู่ที่ > 3,500 pg/ml 10
- เคยมีประวัติเป็น OHSS มาก่อน
- ปริมาณของ Follicle ที่อยู่ในรังไข่: ในระหว่างกระบวนการกระตุ้นการเจริญเติบโตของไข่ หากมี Follicles เจริญเติบโต ≥ 20 Follicles จะเพิ่มความเสี่ยงการเกิด OHSS อย่างมีนัยสำคัญ 11
- ปริมาณของไข่ที่เก็บได้ในรอบนั้น: ในกระบวนการเก็บไข่ (Oocyte retrieval) หากเก็บได้ > 15 oocyte พบว่ามีความเสี่ยงในการเกิด OHSS ได้อย่างมีนัยสำคัญ 12
- การตั้งครรภ์: การตั้งครรภ์จะเพิ่มโอกาสของการเกิด OHSS ขึ้นได้จากการที่มี endogenous hCG เพิ่มขึ้นจากการตั้งครรภ์
การวินิจฉัย (Diagnosis) ภาวะ OHSS สามารถวินิจฉัยจากประวัติและอาการแสดงของผู้ป่วยได้เลย
อาการแสดง (Clinical) 13
- ปวดท้อง (Acute abdominal pain, Localized or generalized peritonitis)
- คลื่นไส้อาเจียน (Nausea and vomiting)
- ท้องบวมน้ำและมีน้ำในช่องท้อง (Ascites)
- ความดันต่ำ ภาวะน้ำในร่างกายน้อย (Hypotension and/or hypovolemia)
- หายใจเหนื่อย (Dyspnea)
- ภาวการณ์แข็งตัวของเลือดผิดปกติ (Hypercoagulable state)
- ความผิดปกติของสารอิเล็กโทรไลต์ (Electrolyte imbalance)
- ภาวะไตวาย (Acute renal failure)
การแบ่งระดับความรุนแรง (Severity) ตาม RCOG Classification 14
| Category | Features |
| Mild |
|
| Moderate |
|
| Severe |
|
| Critical |
|
ที่มา: RCOG. The management of ovarian hyperstimulation syndrome. Guideline No.5, Feb 2016
การแบ่งระดับความรุนแรง (Severity) ตาม ASRM Classification 15
| Category | Clinical Features | Laboratory features |
| Mild |
|
|
| Moderate |
|
(Hct > 41%)
|
| Severe |
|
Hct > 55%
|
| Critical |
|
|
ที่มา: Practice Committee of the ASRM. Prevention and treatment of moderate and severe OHSS. Fertil Steril 2016.
การป้องกันการเกิด OHSS (Prevention)
- Type of Stimulation Protocol
GnRH agonist VS GnRH antagonist protocols
การใช้ GnRH antagonist protocol ในกระบวนการป้องกัน premature LH surge พบว่าสัมพันธ์กับอุบัติการณ์การเกิด OHSS ที่น้อยกว่าการใช้ GnRH agonist protocol สำหรับกลไกพบว่าการใช้ GnRH antagonist สัมพันธ์กับการสร้างฮอร์โมน Estradiol ในร่างกายที่น้อยกว่า
Cochrane review 29 RCTs พบว่า ในกลุ่มที่ใช้ GnRH antagonist protocol มีอุบัติการณ์การเกิด OHSS ที่น้อยกว่ากลุ่ม GnRH agonist อย่างมีนัยยะสำคัญทางสถิติ และไม่มีความแตกต่างใน Live-birth rate ในทั้ง 2 กลุ่ม 16
- Choice of trigger for final oocyte maturation
โดยปกติแล้วการใช้ยาเพื่อกระตุ้นการเจริญเติบโตของไข่เพื่อให้สุกเต็มที่ในระยะสุดท้ายก่อนไข่ตก และกระตุ้นให้เกิดการตกไข่ตามมา จะใช้ฮอร์โมน hCG ซึ่งมีโครงสร้างคล้ายคลึงกับฮอร์โมน LH เพื่อเลียนแบบธรรมขาติมากที่สุด แต่เนื่องจากฮอร์โมน hCG มีค่าครึ่งชีวิต (Half life) ที่ยาวนานกว่าฮอร์โมน LH ทำให้การออกฤทธิ์อยู่ได้นานไปจนถึงหลังการเก็บไข่ ซึ่งการที่ฮอร์โมน hCG จับกับ LH receptor บริเวณ Corpus luteum ที่มีปริมาณมาก หลังจากการเก็บไข่เสร็จแล้ว จะทำให้เกิด OHSS ได้ ดังนั้นมีการทำการศึกษาวิจัยพบว่าการใช้ GnRH agonist ในการ Trigger ไข่ ช่วยลดความเสี่ยงในการเกิด OHSS ได้ แต่การลดขนาดของฮอร์โมน hCG ที่ใช้ในการ Trigger ไข่ พบว่ายังมีการศึกษาวิจัยที่ไม่มากพอที่จะสรุปได้ว่าจะช่วยลดความเสี่ยงในการเกิด OHSS ได้หรือไม่
- Coasting
มีการศึกษาพบว่าการหยุดใช้ Gonadotropins ชั่วคราว สามารถลดความเสี่ยงในการเกิด OHSS ได้ แต่พบว่า หากมีการหยุดใช้ Gonadotropins ≥ 4 วัน จะลดอัตราการการฝังตัวอ่อนลงได้ 17 กลไกคือการหยุด Gonadotropin จะทำให้ follicle ที่มีขนาดเล็ก โดยเฉพาะขนาดที่ < 14 mm เกิดการ apoptosis และตายไป ทำให้ลดการสร้าง Estradiol และ VEGF ทำให้ลดการเกิด OHSS ได้
ควรพิจารณาการ Coasting เมื่อระดับ Estradiol > 4,500 pg/ml หรือพบว่ามี mature follicles 15-30 ฟอง เป็นต้นไป โดยพิจารณาหยุดให้ gonadotropin และ ทำการอัลตราซาวน์ผ่านทางช่องคลอดและตรวจวัดระดับ Estradiol ทุกวัน และเริ่มการให้ gonadotropins ใหม่ เมื่อระดับ Estradiol ลดต่ำลง < 3500 pg/ml 18
- Cycle cancellation
แนะนำให้ทำการยกเลิก Cycle ในกรณีที่
- ตรวจพบ > 30 mature follicles
- มีการหยุดให้ Gonadotropin > 4 วันขึ้นไป
- ระดับ Estradiol เพิ่มสูงขึ้น > 6,500 pg/ml ในระหว่างที่หยุดการฉีด gonadotropin (Coasting)
แต่การยกเลิก cycle อาจจะก่อให้เกิดผลกระทบต่อผู้ป่วยทั้งในด้านจิตใจและความเสียหายทางการเงิน เนื่องจากค่าใช้จ่ายที่ค่อนข้างสูงในการทำเทคโนโลยีช่วยการเจริญพันธุ์ (ART) 18
- Cryopreservation
การแช่แข็งตัวอ่อนเพื่อเตรียมย้ายใน cycle อื่น ทำเพื่อป้องกันไม่ให้เกิดการตั้งครรภ์ขึ้นใน cycle ที่ทำการกระตุ้นไข่ เนื่องจากการตั้งครรภ์จะทำให้ปริมาณฮอร์โมน endogenous hCG เพิ่มสูงมากขึ้น ทำให้มีโอกาสในการเกิด Late-onset OHSS ได้ สำหรับการศึกษาวิจัย มี 2 การศึกษา พบว่าการทำ Cryopreservation ลดการเกิด OHSS เมื่อเทียบกับการย้ายตัวอ่อนในรอบเดียวกับการเก็บไข่ (Fresh embryo transfer) และไม่มีความแตกต่างในอัตราการตั้งครรภ์และการคลอดบุตร 19 แต่เนื่องจากยังมีข้อมูลหลักฐานที่มีน้อยจึงยังไม่เพียงพอที่จะสามารถสรุปได้ว่าการทำ Cryopreservation จะช่วยลดการเกิด OHSS 20
- Aspirin
พบว่าสาร VEGF ที่เพิ่มขึ้นในร่างกาย จะไปกระตุ้นการทำงานของ Platelet function เกิดการหลั่งสาร cytokines ต่างๆ ตามมาได้ เช่น Histamine, Serotonin, Platelet-derived growth factor, Lysophosphatidic acid เป็นต้น ทำให้เกิดกระบวนการกระตุ้นการเกิด OHSS ได้ ดังนั้นจึงมีการศึกษาเกี่ยวกับการใช้ Aspirin เพื่อป้องกันการเกิด OHSS เช่น การศึกษาวิจัยหนึ่งได้ให้ผู้ป่วยรับประทาน Aspirin 100 mg ในวันที่มีประจำเดือนวันแรกของการเริ่มทำการกระตุ้นไข่ ไปจนกระทั่งผู้ป่วยมีประจำเดือนอีกรอบเดือนนึง พบว่ากลุ่มที่ได้รับยา Aspirin มีอุบัติการณ์การเกิด Severe OHSS น้อยกว่ากลุ่มที่ไม่ได้ทานยา Aspirin อย่างมีนัยะสำคัญทางสถิติ (2/780, 0.25% VS 43/112, 8.4%, P<0.001) 21
- Metformin
ในรายที่เป็น Polycystic ovarian syndrome (PCOS) จะมีฮอร์โมน Androgen มากกว่าคนทั่วไป ซึ่งในกระบวนการกระตุ้นไข่ หากมีฮอร์โมน Androgen สูง จะทำให้รังไข่ตอบสนองต่อ Gonadotropin ได้มากขึ้น ทำให้เพิ่มความเสี่ยงต่อการเกิด OHSS มากขึ้น มีการศึกษาการให้ยา Metformin ซึ่งเป็น insulin sensitizing agent ในผู้ป่วย PCOS เพื่อช่วยลดปริมาณ Follicles ลง ทำให้ช่วยลดระดับ Estradiol ในเลือดลงได้และลดการสร้าง Androgen จากรังไข่ ในช่วงที่ผู้ป่วยได้รับการกระตุ้นไข่ พบว่า ในผู้ป่วย PCOS กลุ่มที่ได้รับ Metformin มีความเสี่ยงในการเกิด OHSS ลดลงอย่างมีนัยยะสำคัญ เมื่อเทียบกับกลุ่มที่ไม่ได้รับยา Metformin โดยไม่มีความแตกต่างในอัตราการตั้งครรภ์ อัตราการคลอด และอัตราการแท้งบุตร 22
- Dopamine agonist
มีการศึกษาพบว่า Dopamine receptor agonist สามารถลดการสร้าง VEGF ได้ จึงทำให้เกิดผลในการลดความเสี่ยงในการเกิด OHSS โดยจากการศึกษา 7 studies พบว่า Cabergoline (Dopamine receptor agonist) สามารถลดอุบัติการณ์การเกิด OHSS ได้เมื่อเทียบกับกลุ่มที่ไม่ได้รับ Cabergoline โดยไม่กระทบต่อการตั้งครรภ์ (Pregnancy rates) จึงมีการแนะนำให้เริ่ม Dopamine receptor agonist ในตอนที่เริ่มให้ hCG trigger เพื่อลดการเกิด OHSS 23
- Albumin
Albumin เป็นโปรตีนที่อยู่ในกระแสเลือด ช่วยทำหน้าที่ในการดึงสารน้ำต่างๆที่รั่วออกจากกระแสเลือดให้กลับเข้ามาในเส้นเลือดได้ และสามารถจับกับสารต่างๆในเลือด เช่น VEGF ได้ แต่จากการศึกษาพบว่าให้ผลขัดแย้งกัน บางการศึกษาพบว่าสามารถช่วยลดการเกิด OHSS ได้ 24 แต่บางการศึกษาพบว่า Albumin ไม่ได้มีประสิทธิภาพในการลดความเสี่ยงการเกิด OHSS และยังลดอัตราการตั้งครรภ์ลงอีกด้วย 25 ดังนั้นจากการศึกษาในขณะนี้ยังไม่สามารถสรุปได้ว่าการใช้ Albumin สามารถลดความเสี่ยงในการเกิด OHSS ได้หรือไม่
- Calcium
พบว่า Calcium สามารถยับยั้ง cAMP ที่จะไปกระตุ้นให้เกิดการสร้าง Renin ทำให้ลดการสร้าง Angiotensin II และสาร VEGF ได้ โดยแนะนำให้ Calcium ในวันที่เก็บไข่ ไปจนถึงระยะเวลา 3 วันหลังเก็บไข่ 26
การรักษา (Management)
สำหรับ OHSS เป็นกลุ่มอาการที่สามารถอาการดีขึ้นได้เอง โดยมักจะดีขึ้นหลังจากที่ระดับ hCG ลดลง การรักษาหลักคือการรักษาตามอาการและเฝ้าระวัง หากผู้ป่วยอาการแย่ลงควรได้รับการประเมินโดยแพทย์ผู้เชี่ยวชาญอย่างใกล้ชิด
การรักษาแบบผู้ป่วยนอก (Outpatient management) 1
Mild OHSS สามารถให้การรักษาแบบผู้ป่วยนอกด้วย โดยส่วนมากแล้วการรักษาหลักมักจะเป็นการให้ยาแก้ปวด และแจ้งข้อมูลให้ผู้ป่วยเฝ้าระวังอาการที่แสดงว่าตัวโรคแย่ลง
- ควรงดการมีเพศสัมพันธ์เนื่องจากจะทำให้เกิดอาการปวดและเพิ่มความเสี่ยงในการเกิดการแตกของรังไข่ได้ (Ovarian rupture)
- ให้ทานน้ำ ≥ 1 ลิตรต่อวัน สามารถทานเป็นน้ำเกลือแร่ได้
- ควรหลีกเลี่ยงการทำกิจกรรมที่ต้องใช้แรงมาก เนื่องจากจะเพิ่มความเสี่ยงในการเกิดรังไข่บิดขั้ว (Ovarian torsion) และ รังไข่แตก (Ovarian rupture) ได้
- สามารถทำกิจกรรมที่ไม่ต้องออกแรงมากได้ และไม่ควรนอนอยู่เฉยๆ เนื่องจากจะเพิ่มความเสี่ยงต่อการเกิดลิ่มเลือดอุดตัน (Thromboembolism) เนื่องจากภาวะ OHSS เป็นภาวะที่เสี่ยงต่อปัญหาการแข็งตัวของเลือดผิดปกติ จากการที่ค่าความเข้มข้นของเลือดสูงมากกว่าปกติ
- จดบันทึกปริมาณน้ำที่ทาน และปริมาณปัสสาวะต่อวัน
- ให้ผู้ป่วยชั่งน้ำหนัก และวัดรอบท้องทุกวัน หากน้ำหนักเพิ่มขึ้น ≥ 1 กิโลกรัมต่อวัน หรือปัสสาวะออกน้อยลง ผู้ป่วยควรได้รับการประเมินอาการ ตรวจร่างกาย อัลตราซาวน์ และเจาะเลือดส่งตรวจ
เกณฑ์ในการนอนโรงพยาบาล (Hospital admission)
สำหรับเกณฑ์ในการนอนโรงพยาบาลไม่ได้มีข้อบ่งชี้แน่ชัด แต่แนะนำในรายที่
- ไม่สามารถควบคุมอาการปวดได้จากยาแก้ปวดแบบรับประทาน
- มีอาการคลื่นไส้อาเจียนมาก ไม่สามารถดื่มน้ำให้เพียงพอต่อการรักษาปริมาณน้ำในร่างกายได้
- มีอาการแย่ลงหลังจากที่รับการรักษาแบบผู้ป่วยนอก
- ไม่สามารถมาตรวจติดตามตามนัดได้
- ผู้ป่วยอยู่ในระดับ Critical OHSS
ผู้ป่วยที่นอนโรงพยาบาลควรได้รับการตรวจโดยแพทย์ อย่างน้อยวันละ 1 ครั้ง หรืออาจจะมากกว่านั้นในรายที่เป็น Critical OHSS การตรวจประจำวันเบื้องต้น ประกอบไปด้วย
- ประเมินค่าสัญญาณชีพ ปริมาณน้ำที่ทาน และปริมาณปัสสาวะ โดยปริมาณปัสสาวะควรออกมากกว่า 30 ml/hr
- ชั่งน้ำหนักและ Urine specific gravity
- ตรวจเลือด Hb, Hct, Cr, Electrolytes, Albumin ส่วน Liver enzymes พิจารณาตรวจสัปดาห์ละครั้ง หรือหากมีอาการแย่ลงตามสมควร
การให้การรักษาอาการคลื่นไส้อาเจียนและปวดท้องถือเป็นสิ่งสำคัญสำหรับผู้ป่วย OHSS เนื่องจากอาการเหล่านี้จะทำให้ผู้ป่วยเกิดความไม่สุขสบายขึ้นได้ ยาแก้ปวดที่ให้ได้คือยาพาราเซตามอลและยากลุ่ม Opioid หลีกเลี่ยงการให้ยา NSAIDs เนื่องจากจะทำให้การทำงานของไตแย่ลงได้ หากผู้ป่วยมีอาการปวดที่รุนแรง จำเป็นที่จะต้องตรวจเพิ่มเติมว่าเกิดภาวะแทรกซ้อนขึ้นหรือไม่ ได้แก่ รังไข่บิดขั้ว รังไข่แตก มีการติดเชื้อบริเวณอุ้งเชิงกราน หรือเกิดการตั้งครรภ์นอกมดลูกขึ้น
การดูแลเรื่องสารน้ำ (Fluid management) 27
สิ่งสำคัญสำหรับการดูแลผู้ป่วยที่เกิดภาวะ OHSS ขึ้น คือการประเมินปริมาณสารน้ำในร่างกายผู้ป่วย ป้องกันและแก้ไขปัญหา Hypovolemia, Hypotension และ Oliguria
- ติดตามปริมาณสารน้ำเข้าและออกร่างกายผู้ป่วยอย่างใกล้ชิด (Fluid intake and urine output)
- ติดตามปริมาณน้ำดื่มที่ผู้ป่วยได้รับในแต่ละวัน
- การให้สารน้ำเบื้องต้น หากประเมินแล้วผู้ป่วยมีอาการขาดน้ำ ให้ Fluid 500-1,000 ml IV load
- ปริมาณสารน้ำที่เหมาะสม สามารถสังเกตได้จากปริมาณปัสสาวะ ควร > 20-30 ml/hr หรือภาวะ hemoconcentration เริ่มดีขึ้น
- ชนิดของสารน้ำพิจารณาให้ 5%DNSS มากกว่าการให้ LRS เนื่องจาก LRS มีแนวโน้มเกิด Hyponatremia ได้มากกว่า
- 25% Albumin 50-100 gm IV drip in 4 hr สามารถให้ซ้ำได้ทุก 4-12 ชั่วโมง ให้ได้ในรายที่ Normal saline ไม่สามารถควบคุมระดับสารน้ำในร่างกายให้อยู่ในปริมาณที่เหมาะสม หรือผู้ป่วยมีปัสสาวะออกน้อย
ส่วนสารอื่นๆที่สามารถให้ได้ คือ Mannitol, Fresh frozen plasma ส่วน Dextran สามารถทำให้เกิด ARDS ได้ ดังนั้นจึงควรหลีกเลี่ยง - Diuretics สามารถให้ได้ในผู้ป่วยที่มี Intravascular volume เพียงพอแล้ว สามารถพิจารณาได้จาก ค่า Hct < 38% โดยหากให้ยา Diuretics เร็วเกินไป จะทำให้เกิดภาวะ Hypovolemia, Hemoconcentration และเพิ่มความเสี่ยงต่อการเกิด Thromboembolism ได้ หากอาการของผู้ป่วยดีขึ้นแล้ว สามารถพิจารณาลดสารน้ำลง และให้ผู้ป่วยดื่มน้ำเองได้
ข้อบ่งชี้ในการเจาะระบายน้ำในท้อง (Indications for abdominal paracentesis)
- มีอาการปวดท้องรุนแรงจากท้องขยายตัวเพิ่มขึ้น (Abdominal distension)
- หายใจเหนื่อยหอบ (Dyspnea)
- ปัสสาวะออกน้อยเนื่องจากความดันในช่องท้องเพิ่มสูงมากขึ้น ทำให้เลือดไปเลี้ยงบริเวณไตลดลง
การเจาะระบายน้ำในท้องควรใช้การอัลตราซาวน์นำ (Ultrasound guided) ทุกครั้ง เพื่อป้องกันการบาดเจ็บต่อรังไข่ และลำไส้ที่ลอยอยู่ในน้ำ 28
ความเสี่ยงต่อการเกิดภาวะลิ่มเลือดอุดตันในเส้นเลือด (Risk for thromboembolism)
สำหรับ Severe OHSS ถือว่าเป็นภาวะที่มีความเสี่ยงในการเกิดภาวะลิ่มเลือดอุดตันได้
อุบัติการณ์การเกิดอยู่ที่ 0.7-10%
แนะนำให้ใช้ ถุงน่องป้องกันภาวะหลอดเลือดอุดตัน (Full-length venous support stockings), เครื่องมือที่ใช้ลมบีบให้เกิดแรงกดเป็นระยะๆ (Intermittent pneumatic compression device) หรือพิจารณาให้ ยาต้านการแข็งตัวของเลือด (Prophylactic heparin therapy 5000 unit SC every 12 hours)
ภาวะแทรกซ้อน (Complication) ที่สามารถเกิดขึ้นได้และเป็นอันตรายต่อชีวิต ได้แก่
- ภาวะไตวาย (Renal failure)
- ลิ่มเลือดอุดตันในหลอดเลือด (Thromboembolism)
- ภาวะมีน้ำในเยื่อหุ้มหัวใจ (Pericardial effusion)
- ภาวะหายใจล้มเหลวเฉียบพลัน (Acute respiratory distress syndrome, ARDS)
ผู้ป่วยควรได้รับการวินิจฉัยโดยเร็ว รักษาด้วยทีมสหสาขาวิชาชีพ (Multidisciplinary team) ได้รับการดูแลในหอผู้ป่วยวิกฤต (Intensive care unit, ICU)
เอกสารอ้างอิง
- Ovarian hyperstimulation syndrome. Fertil Steril. 2008;90(5 Suppl):S188-93.
- Papanikolaou EG, Tournaye H, Verpoest W, Camus M, Vernaeve V, Van Steirteghem A, et al. Early and late ovarian hyperstimulation syndrome: early pregnancy outcome and profile. Hum Reprod. 2005;20(3):636-41.
- Nelson SM. Prevention and management of ovarian hyperstimulation syndrome. Thromb Res. 2017;151 Suppl 1:S61-s4.
- Soares SR, Gómez R, Simón C, García-Velasco JA, Pellicer A. Targeting the vascular endothelial growth factor system to prevent ovarian hyperstimulation syndrome. Hum Reprod Update. 2008;14(4):321-33.
- Villasante A, Pacheco A, Ruiz A, Pellicer A, Garcia-Velasco JA. Vascular endothelial cadherin regulates vascular permeability: Implications for ovarian hyperstimulation syndrome. J Clin Endocrinol Metab. 2007;92(1):314-21.
- Gómez R, Simón C, Remohí J, Pellicer A. Administration of moderate and high doses of gonadotropins to female rats increases ovarian vascular endothelial growth factor (VEGF) and VEGF receptor-2 expression that is associated to vascular hyperpermeability. Biol Reprod. 2003;68(6):2164-71.
- Rizk B, Aboulghar M, Smitz J, Ron-El R. The role of vascular endothelial growth factor and interleukins in the pathogenesis of severe ovarian hyperstimulation syndrome. Hum Reprod Update. 1997;3(3):255-66.
- Manno M, Tomei F. Renin-angiotensin system activation during severe OHSS: cause or effect? Fertil Steril. 2008;89(2):488.
- Aramwit P, Pruksananonda K, Kasettratat N, Jammeechai K. Risk factors for ovarian hyperstimulation syndrome in Thai patients using gonadotropins for in vitro fertilization. Am J Health Syst Pharm. 2008;65(12):1148-53.
- Hendriks DJ, Klinkert ER, Bancsi LF, Looman CW, Habbema JD, te Velde ER, et al. Use of stimulated serum estradiol measurements for the prediction of hyperresponse to ovarian stimulation in in vitro fertilization (IVF). J Assist Reprod Genet. 2004;21(3):65-72.
- Jayaprakasan K, Herbert M, Moody E, Stewart JA, Murdoch AP. Estimating the risks of ovarian hyperstimulation syndrome (OHSS): implications for egg donation for research. Hum Fertil (Camb). 2007;10(3):183-7.
- Steward RG, Lan L, Shah AA, Yeh JS, Price TM, Goldfarb JM, et al. Oocyte number as a predictor for ovarian hyperstimulation syndrome and live birth: an analysis of 256,381 in vitro fertilization cycles. Fertil Steril. 2014;101(4):967-73.
- Kumar P, Sait SF, Sharma A, Kumar M. Ovarian hyperstimulation syndrome. J Hum Reprod Sci. 2011;4(2):70-5.
- Mathur R, Kailasam C, Jenkins J. Review of the evidence base of strategies to prevent ovarian hyperstimulation syndrome. Hum Fertil (Camb). 2007;10(2):75-85.
- Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome: a guideline. Fertil Steril. 2016;106(7):1634-47.
- Al-Inany HG, Youssef MA, Aboulghar M, Broekmans F, Sterrenburg M, Smit J, et al. Gonadotrophin-releasing hormone antagonists for assisted reproductive technology. Cochrane Database Syst Rev. 2011(5):Cd001750.
- Nardo LG, Cheema P, Gelbaya TA, Horne G, Fitzgerald CT, Pease EH, et al. The optimal length of ‘coasting protocol’ in women at risk of ovarian hyperstimulation syndrome undergoing in vitro fertilization. Hum Fertil (Camb). 2006;9(3):175-80.
- Garcia-Velasco JA. How to avoid ovarian hyperstimulation syndrome: a new indication for dopamine agonists. Reprod Biomed Online. 2009;18 Suppl 2:71-5.
- Ferraretti AP, Gianaroli L, Magli C, Fortini D, Selman HA, Feliciani E. Elective cryopreservation of all pronucleate embryos in women at risk of ovarian hyperstimulation syndrome: efficiency and safety. Hum Reprod. 1999;14(6):1457-60.
- D’Angelo A, Amso N. Embryo freezing for preventing ovarian hyperstimulation syndrome. Cochrane Database Syst Rev. 2007(3):Cd002806.
- Várnagy A, Bódis J, Mánfai Z, Wilhelm F, Busznyák C, Koppán M. Low-dose aspirin therapy to prevent ovarian hyperstimulation syndrome. Fertil Steril. 2010;93(7):2281-4.
- Huang X, Wang P, Tal R, Lv F, Li Y, Zhang X. A systematic review and meta-analysis of metformin among patients with polycystic ovary syndrome undergoing assisted reproductive technology procedures. Int J Gynaecol Obstet. 2015;131(2):111-6.
- Leitao VM, Moroni RM, Seko LM, Nastri CO, Martins WP. Cabergoline for the prevention of ovarian hyperstimulation syndrome: systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2014;101(3):664-75.
- Isik AZ, Gokmen O, Zeyneloglu HB, Kara S, Keles G, Gulekli B. Intravenous albumin prevents moderate—severe ovarian hyperstimulation in in-vitro fertilization patients: a prospective, randomized and controlled study. European Journal of Obstetrics & Gynecology and Reproductive Biology. 1996;70(2):179-83.
- Jee BC, Suh CS, Kim YB, Kim SH, Choi YM, Kim JG, et al. Administration of intravenous albumin around the time of oocyte retrieval reduces pregnancy rate without preventing ovarian hyperstimulation syndrome: a systematic review and meta-analysis. Gynecol Obstet Invest. 2010;70(1):47-54.
- Gurgan T, Demirol A, Guven S, Benkhalifa M, Girgin B, Li TC. Intravenous calcium infusion as a novel preventive therapy of ovarian hyperstimulation syndrome for patients with polycystic ovarian syndrome. Fertil Steril. 2011;96(1):53-7.
- Whelan JG, 3rd, Vlahos NF. The ovarian hyperstimulation syndrome. Fertil Steril. 2000;73(5):883-96.
- Aboulghar MA, Mansour RT, Serour GI, Amin Y. Ultrasonically guided vaginal aspiration of ascites in the treatment of severe ovarian hyperstimulation syndrome. Fertil Steril. 1990;53(5):933-5.

