Urinary Tract Infections in Pregnancy
Urinary Tract Infections in Pregnancy
นพ.ณัฐพล พบลาภ
รศ.พญ.เฟื่องลดา ทองประเสริฐ
การติดเชื้อทางเดินปัสสาวะ (urinary tract infection, UTI) พบได้ประมาณร้อยละ 8 ของการตั้งครรภ์ (1, 2)
มีระดับความรุนแรงตั้งแต่ไม่มีอาการ (asymptomatic bacteriuria, ASB) มีอาการของกระเพาะปัสสาวะอักเสบ (symptomatic acute cystitis) และกรณีที่มีความรุนแรงมากที่สุดคือภาวะไตอักเสบเฉียบพลัน (acute pyelonephritis) โดย Escherichia coli เป็นเชื้อแบคทีเรียที่พบมากที่สุดในการเก็บตัวอย่างปัสสาวะจากสตรีตั้งครรภ์ (3-6)
การมีภาวะ UTI ส่งผลกระทบต่อการตั้งครรภ์โดยพบว่าเพิ่มอัตราการคลอดก่อนกำหนด (preterm birth)
และทารกแรกเกิดน้ำหนักน้อย (low birth weight) รวมถึงถ้าระดับความรุนแรงจนถึงทำให้มีภาวะไตอักเสบเฉียบพลันเกิดขึ้นจะทำให้เกิดภาวะแทรกซ้อนต่างๆ ตามมาได้ เช่น การติดเชื้อในกระแสเลือด (sepsis) การเกิดลิ่มเลือดในหลอดเลือดกระจายทั่วไป (disseminated intravascular coagulation, DIC) และภาวะทางเดินหายใจล้มเหลวเฉียบพลัน (acute respiratory distress syndrome, ARDS) ฉะนั้นการวินิจฉัยและรักษาภาวะนี้จึงมีความสำคัญสำหรับแพทย์
ที่ดูแลสตรีตั้งครรภ์
ระบาดวิทยา
การติดเชื้อทางเดินปัสสาวะถูกจัดประเภทโดยอิงตามตำแหน่งของการติดเชื้อโดยแบ่งเป็น lower urinary tract (ASB or cystitis) และ upper urinary tract (pyelonephritis)
asymptomatic bacteriuria พบได้ร้อยละ 2-10 ของสตรีตั้งครรภ์ (7) และจากการศึกษาพบว่าการคัดกรองและรักษา ASB สามารถลดอัตราการเกิด pyelonephritis ได้ (7-9) จึงทำให้ลดความเสี่ยงต่อการตั้งครรภ์ เช่น preterm birth, anemia, sepsis, disseminated intravascular coagulation, acute respiratory distress syndrome ได้
acute cystitis เกิดขึ้นในสตรีตั้งครรภ์ร้อยละ 1-2 (10) โดยมีอัตราการเกิดเทียบเท่ากับ pyelonephritis (11)
โดย pyelonephritis นั้นมักเกิดขึ้นในไตรมาสที่สองของการตั้งครรภ์ และเป็นสาเหตุหนึ่งที่ทำให้สตรีตั้งครรภ์
ต้องเข้ารับการรักษาในโรงพยาบาล
การเปลี่ยนแปลงทางกายวิภาคและสรีรวิทยาที่เกิดขึ้นของระบบทางเดินปัสสาวะช่วงระหว่างการตั้งครรภ์
ล้วนทำให้มีความเสี่ยงต่อการติดเชื้อในทางเดินปัสสาวะเพิ่มขึ้น เช่น การขยายตัวของ ureter ที่เกิดจากฮอร์โมน
โปรเจสเตอโรน, การกดทับต่อ ureter จากมดลูกที่มีขนาดโตขึ้น, การเพิ่มขึ้นของ residual urine ในกระเพาะปัสสาวะส่งผลต่อ urinary stasis และเกิด vesicoureteral reflex ซึ่งการเปลี่ยนแปลงต่างๆ เหล่านี้ มีผลต่อ bacterial colonization และ ascending infection ที่เพิ่มมากขึ้น
ASYMPTOMATIC BACTERIURIA
การคัดกรองภาวะ asymptomatic bacteriuria มีความสำคัญในการป้องกันการเกิด pyelonephritis ในสตรีตั้งครรภ์ มีการศึกษาแสดงให้เห็นว่าเมื่อมีการคัดกรองและรักษาภาวะ asymptomatic bacteriuria เกิดขึ้น อุบัติการณ์การเกิด pyelonephritis ในสตรีตั้งครรภ์ลดลงจากร้อยละ 20-35 ร้อยละ 1-4 (7) และเมื่อมีภาวะ asymptomatic bacteriuria แล้วไม่ได้รับการรักษามีโอกาสเกิด pyelonephritis สูงขึ้นเป็น 5 เท่า
แม้ว่าอุบัติการณ์การเกิด pyelonephritis ณ ปัจจุบันมีเพียงร้อยละ 2.4 แต่ยังคงแนะนำให้มีการคัดกรองภาวะ asymptomatic bacteriuria เพื่อลดอัตราการเกิด pyelonephritis อยู่ โดยแนะนำให้มีการคัดกรองอย่างน้อย 1 ครั้งในช่วงระยะแรกที่มาฝากครรภ์ แต่ยังไม่มีข้อมูลการศึกษาที่มากพอว่าควรทำที่อายุครรภ์มากน้อยเพียงใด (12-14)
วิธีการคัดกรองไม่แนะนำให้ใช้ urine dipstick testing เพื่อตรวจหาการติดเชื้อเพียงอย่างเดียวเพราะ
มีความไวที่ไม่มากพอ (15, 16) การเก็บปัสสาวะส่งตรวจควรเป็นปัสสาวะช่วง midstream เพื่อช่วยลดการปนเปื้อน
ของเชื้อแบคทีเรียบริเวณ vulvovaginal (17) และควรเก็บอย่างถูกวิธีเพราะยิ่งอายุครรภ์มากขึ้นจะมีโอกาสที่ผลเพาะเชื้อจากปัสสาวะจะมีการปนเปื้อนสูงขึ้น (13)
เมื่อผลการคัดกรองเป็นผลลบ (urine culture negative) ไม่มีความจำเป็นต้องทำการคัดกรองซ้ำเนื่องจากโอกาสในการเกิด pyelonephritis ตามมาจะมีแนวโน้มที่ต่ำ (18) ยกเว้นกลุ่มสตรีตั้งครรภ์ที่เป็นพาหะของ alpha, beta thalassemia และพาหะ sickle cell
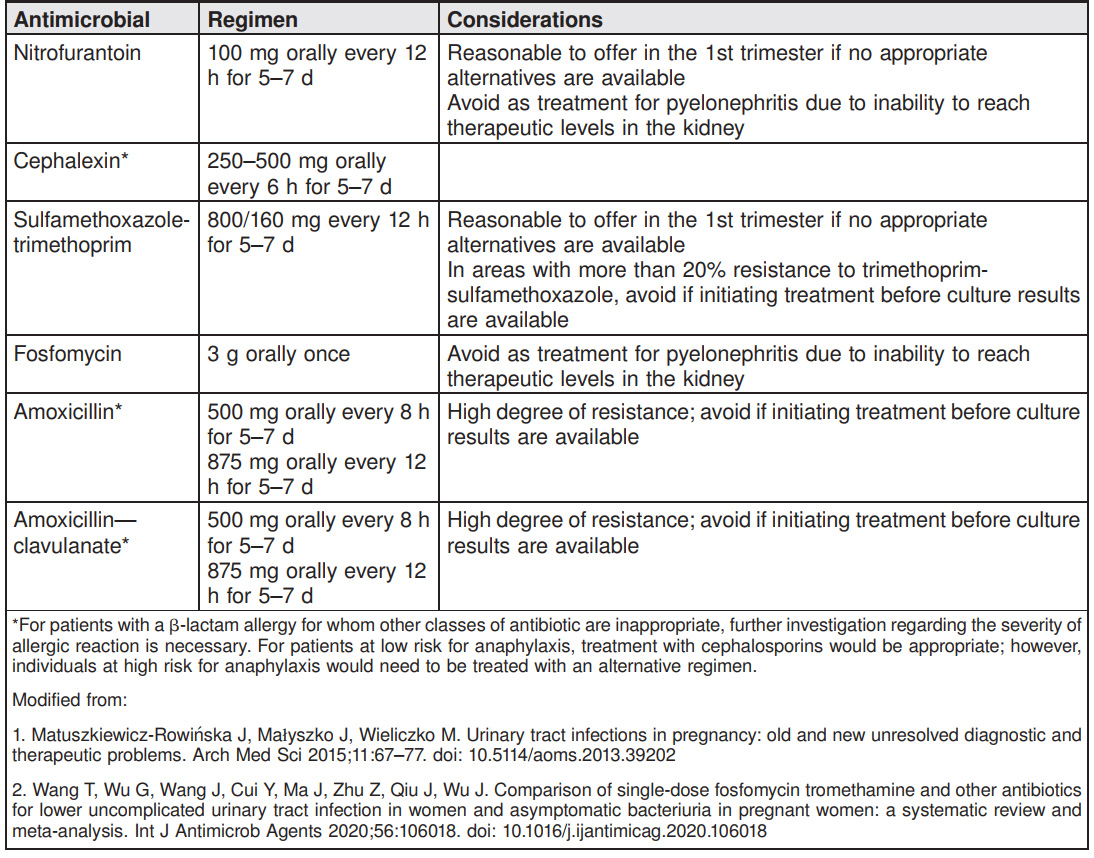
การรักษาภาวะ asymptomatic bacteriuria จะรักษาเมื่อผล urine culture ขึ้นเชื้อจำนวนมากกว่าเท่ากับ
105 CFU/mL โดยจะทำการรักษาด้วยยาปฏิชีวนะ 5-7 วัน ยาปฏิชีวนะที่ใช้ควรครอบคลุมเชื้อ E.coli , Proteus และ Klebsiella spp. ดังตารางที่ 1 และกรณี urine culture ขึ้นเชื้อเป็น Group B streptococcus แต่มีเชื้อจำนวนน้อยกว่า
105 CFU/mL ไม่ต้องทำการรักษา แต่เป็นข้อบ่งชี้ในการให้ยาปฏิชีวนะเพื่อป้องกัน (indication for group B streptococcus prophylaxis) ในตอนคลอด
(ตารางที่ 1) Antibiotic Regimens for Treatment of Asymptomatic Bacteriuria and Acute Cystitis
(อ้างอิงจาก ACOG Clinical Consensus Number 4 Aug 2023, Urinary Tract Infections in Pregnant Individuals)
ACUTE CYSTITIS
acute cystitis แตกต่างจาก asymptomatic bacteriuria ตรงที่จะมีอาการแสดง ได้แก่ dysuria, hematuria, urinary frequency และ nocturia ซึ่งจะสังเกตได้ว่าอาการ urinary frequency และ nocturia นั้นสามารถเป็นอาการที่พบได้ในสตรีตั้งครรภ์ปกติ (20, 21) ดังนั้นเพื่อหลีกเลี่ยงการรักษาที่มากเกินความจำเป็น เมื่อสตรีตั้งครรภ์มีอาการดังกล่าวจึงควรส่งตรวจ urinalysis เพื่อแยกโรค
(ตารางที่ 2) แสดง sensitivity, specificity, PPV และ NPV ในแต่ละ test สำหรับช่วยวินิจฉัยภาวะ UTI
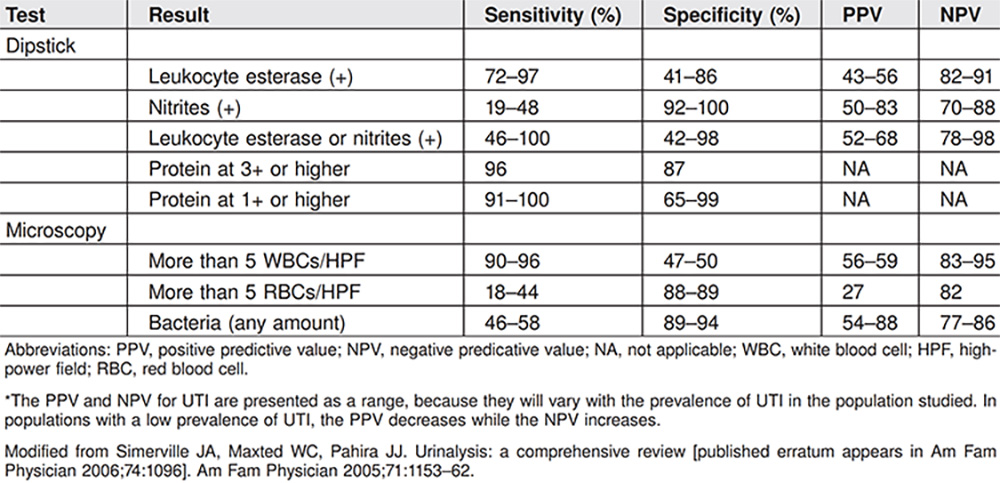
(อ้างอิงจาก ACOG Clinical Consensus Number 4 Aug 2023, Urinary Tract Infections in Pregnant Individuals)
นิยามของคำว่า pyuria คือการที่ส่งตรวจ urinalysis พบ WBC มากกว่า 5 WBCs/HPF หรือการตรวจพบ leukocyte esterase ซึ่งการมีภาวะ pyuria นั้นมี sensitivity ถึงร้อยละ 97 แต่ specificity ต่ำ เนื่องจาก WBC สามารถปนเปื้อนขณะส่งตรวจจากบริเวณ vulva และ vagina ได้
จากตารางที่ 2 จะเห็นว่า nitrate จะมี specificity สูง แต่เนื่องจากแบคทีเรียทุกชนิดไม่ได้สร้าง nitrate จึงทำให้ไม่สามารถตรวจพบได้ในผู้ป่วยทุกรายที่วินิจฉัย UTI (PPV ร้อยละ 50-83 , NPV ร้อยละ 70-88) แต่ถ้าพิจารณาใช้ทั้ง nitrate และ leukocyte esterase ร่วมกันจะช่วยในการช่วยวินิจฉัยแยกโรคได้ดีขึ้น โดยถ้าผล negative ทั้งคู่จะทำให้คิดถึงภาวะ UTI ลดลง (จาก NPV ร้อยละ 78-98)
ในกรณีที่ผลการตรวจปัสสาวะเบื้องต้นพบความผิดปกติ (positive urinalysis) ควรเริ่มยาปฏิชีวนะเพื่อช่วย
ลดอาการ และในกรณีที่ไม่สามารถเก็บปัสสาวะส่งตรวจได้ควรให้ยาปฏิชีวนะเมื่อมี new onset ของ dysuria หรือมีจำนวนปัสสาวะบ่อยครั้งขึ้นจาก baseline ปกติ (22)
การส่ง urine culture จะทำเพื่อยืนยันการวินิจฉัยโดยดูจากปริมาณของเชื้อที่ขึ้นมากกว่าเท่ากับ 105 CFU/ml และการส่ง urine culture ยังมีประโยชน์การปรับเปลี่ยนยาปฏิชีวนะให้เหมาะสมกับเชื้อที่ขึ้น
การรักษาภาวะ acute cystitis จะรักษาด้วยยาปฏิชีวนะอย่างน้อย 5-7 วัน และควรเริ่มยาปฏิชีวนะแบบ empirical treatment ก่อนที่ผล urine culture จะรายงานกลับมา โดยยาปฏิชีวนะที่แนะนำจะแสดงในตารางที่ 1
ซึ่งเป็นการพิจารณาจากเชื้อแบคทีเรียที่พบมากที่สุดจากการศึกษาวิจัย แต่ในเวชปฏิบัติจริงอาจต้องคำนึงถึงการดื้อยาของ E.coli ต่อ amoxicillin หรือ ampicillin ในแต่ละพื้นที่ร่วมด้วย (4, 23, 24) ซึ่งการดื้อยานี้เป็นผลมาจากการใช้ยาปฏิชีวนะที่แพร่หลายมากขึ้น
ปัจจุบันเริ่มมีการกล่าวถึง nitrofurantoin และนำมาใช้ในการรักษาการติดเชื้อในทางเดินปัสสาวะส่วนล่าง
มากขึ้น เชื่อว่ามีประสิทธิภาพสูงและมีอัตราการดื้อยาที่ต่ำ (E.coli, Klebsiella, P.aeruginosa, S.aureus) (24)
ปัจจุบันถูกจัดให้เป็น 1st line drug of choice ในการรักษาการติดเชื้อในทางเดินปัสสาวะส่วนล่าง รวมถึงมีความปลอดภัยเพียงพอในการรักษาช่วงไตรมาสแรกของการตั้งครรภ์โดยไม่ได้ส่งผลต่ออัตราการเกิด major anomaly (25)
อย่างไรก็ตามควรหลีกเลี่ยงในสตรีตั้งครรภ์ที่เป็น G6PD deficiency เพราะสัมพันธ์กับอัตราการเกิด pulmonary toxicity และ hemolytic anemia ที่สูงขึ้น (26)
Fosfomycin (อ้างอิงจากตารางที่ 1) ขนาดยาและระยะเวลาที่ใช้คือ 3 กรัม รับประทานครั้งเดียว (27) ซึ่งง่ายต่อการบริหารจัดการยา (เปรียบเทียบกับยาปฏิชีวนะชนิดอื่นๆ ที่ต้องใช้ระยะเวลาในการรักษา 5-7 วัน) มีการศึกษา meta-analysis (28) ยืนยันถึงประสิทธิภาพและผลลัพธ์การรักษาที่ดี ไม่มีความแตกต่างกับยาปฏิชีวนะชนิดอื่น
อย่างไรก็ตามทั้ง nitrofurantoin และ fosfomycin มีข้อจำกัดคือควรหลีกเลี่ยงการใช้เมื่อยังไม่สามารถวินิจฉัยแยกโรคได้ว่ามีภาวะ pyelonephritis ร่วมด้วยหรือไม่ เพราะยาปฏิชีวนะทั้งสองชนิดไม่สามารถมีระดับยาที่เพียงพอ (inability adequate tissue levels) ต่อการรักษา pyelonephritis ซึ่งเป็นการติดเชื้อในไต
การป้องกันการกลับมาเป็นซ้ำของการติดเชื้อทางเดินปัสสาวะในสตรีตั้งครรภ์ (prevention of recurrent UTI)
ภาวะ acute cystitis เป็นความเสี่ยงหนึ่งในการเกิด pyelonephritis ซึ่งจะสัมพันธ์ต่อ adverse maternal
และ obstetric outcomes ดังนั้นการป้องกันการกลับมาเป็นซ้ำจึงเป็นสิ่งสำคัญ นิยามการกลับมาเป็นซ้ำ (recurrent UTI in pregnancy) คือมีการวินิจฉัยพบการติดเชื้อในทางเดินปัสสาวะมากกว่าหรือเท่ากับ 2 ครั้งในช่วงระหว่างการตั้งครรภ์ (29) โดยพบว่าอุบัติการณ์การเกิดอยู่ที่ร้อยละ 4-5 (1)
เนื่องด้วยข้อมูลการศึกษาที่จำกัดในสตรีตั้งครรภ์ทำให้แนวทางในการ management ยังไม่ชัดเจน การศึกษาในกลุ่มสตรีที่ไม่ได้ตั้งครรภ์พบว่าการให้ยาปฏิชีวนะสามารถช่วยลดอัตราการเกิด recurrent UTI ได้ (30) ในทางตรงข้ามการศึกษาจาก Cochrane review ปี ค.ศ. 2015 (31) ซึ่งทำการศึกษาเปรียบเทียบระหว่างกลุ่มสตรีตั้งครรภ์ที่ได้รับการ suppression ด้วยการรับประทานยา nitrofurantoin วันละ 1 ครั้ง ร่วมกับติดตามอาการ และส่งตรวจ urine culture และพิจารณาให้ยาปฏิชีวนะเมื่อผล culture positive (กล่าวคือมี nitrofurantoin เป็น intervention) กับ กลุ่มสตรีตั้งครรภ์ที่ได้รับการตรวจติดตามเพียงอย่างเดียว พบว่าอัตราการเกิดซ้ำของภาวะ cystitis ไม่มีความแตกต่างกัน
แต่อย่างไรก็ตามข้อสรุปข้างต้นยังเป็นเพียงข้อมูลจากการศึกษาเดียว
ACOG 2023 ยังแนะนำให้ยาปฏิชีวนะเมื่อพบการกลับมาเป็นซ้ำของการติดเชื้อทางเดินปัสสาวะเช่นเดียวกับสตรีที่ไม่ได้ตั้งครรภ์ และแนะนำให้เก็บ urine culture 1-2 สัปดาห์หลังสิ้นสุดการรักษาทุกราย หรืออาจติดตามจากอาการและทำการส่ง urine culture เฉพาะรายที่มีอาการ โดยเมื่อพบภาวะ recurrent UTI ให้พิจารณา prophylaxis
รูปแบบของการ prophylaxis มี 2 รูปแบบ แบบแรกคือ postcoital prophylaxis ให้รับประทานยาปฏิชีวนะก่อนหรือหลังจากมีเพศสัมพันธ์ ข้อดีคือสามารถลดผลข้างเคียงจากการใช้ยาปฏิชีวนะได้ แบบที่สองคือ continuous prophylaxis ให้รับประทานยาปฏิชีวนะขนาดยาต่ำๆ วันละ 1 ครั้ง ข้อดีคือสามารถช่วยลดการเกิดเชื้อดื้อยาได้ โดยขนาดยาที่เหมาะสมยังไม่มีการศึกษาแน่ชัด แต่แนะนำให้ nitrofurantoin 100 mg หรือ cephalexin 250-500 mg รับประทานทุกวัน (32, 33)
PYELONEPHITIS
pyelonephritis คือภาวะที่มีการติดเชื้อที่ไตจาก ascending infection ของเชื้อแบคทีเรียขึ้นมาจากกระเพาะปัสสาวะ โดย acute cystitis และ pyelonephritis จะวินิจฉัยแยกโรคโดยการซักประวัติและตรวจร่างกายเป็นหลัก เนื่องจากการเก็บปัสสาวะส่งตรวจจะสามารถตรวจพบความผิดปกติได้ในทั้งสองภาวะ โดยอาการและอาการแสดง
ที่ทำให้คิดถึงภาวะ pyelonephritis นั้นคือไข้, คลื่นไส้/อาเจียน และการตรวจร่างกายที่สนับสนุนคือ flank pain ,
CVA tenderness การตรวจ renal ultrasonography ที่มีความผิดปกติก็จะช่วยในการสนับสนุนการวินิจฉัย pyelonephritis ได้เช่นกัน (11)
ในบางกรณี เช่น มีไข้และอาการทางระบบทางเดินปัสสาวะชัดเจนแต่ตรวจร่างกายแล้วไม่พบ CVA tenderness หรือมีอาการทางระบบทางเดินปัสสาวะร่วมกับตรวจร่างกายพบ CVA tenderness แต่ไม่มีไข้
หรือมี clinical ที่ยังทำให้สงสัย กรณีดังกล่าวเหล่านี้ควรคำนึงถึงภาวะ early pyelonephritis เป็นหนึ่งใน
differential diagnosis เสมอ
การส่งตรวจทางห้องปฏิบัติการ CBC อาจแสดง leukocytosis, bandemia, thrombocytopenia หรือ anemia การเก็บปัสสาวะส่งตรวจ urinalysis, urine culture ควรเก็บก่อนเริ่มการให้ยาปฏิชีวนะ และเก็บอย่างถูกวิธีในช่วงกลางของปัสสาวะ (midstream urine) หรือเก็บจากการใส่สายสวนปัสสาวะ (catheterized urine)
สำหรับ hemoculture พบว่าให้ผล positive เพียงร้อยละ 21 ของสตรีตั้งครรภ์ที่วินิจฉัยภาวะ pyelonephritis
ฉะนั้นจะพิจารณาส่งหรือไม่นั้น อาจไม่ได้ส่งผลต่อการเปลี่ยนแปลงการรักษา (34)
การวินิจฉัยแยกโรคควรคำนึงถึงภาวะอื่นๆ ร่วมด้วยเสมอ ตัวอย่างเช่น นิ่วในไต (nephrolithiasis), ฝีที่ไต (renal abscess) หรือการอักเสบติดเชื้อภายในถุงน้ำคร่ำ (chorioamnionitis) เป็นต้น เพราะมีแนวทางในการรักษา
ที่แตกต่างออกไป
(ตารางที่ 3) antibiotic regimens for treatment of pyelonephritis
| Antimicrobial | Regimen |
| Ampicillin + gentamicin | 2 gm IV every 6 hr 1.5 mg/kg IV every 8 hr 5 mg/kg IV every 24 hr |
| Ceftriaxone | 1 gm IV every 24 hr |
| Cefepime | 1 gm IV every 12 hr |
| Aztreonam (appropriate in patients with b-lactam allergy) |
1 gm IV every 8–12 hr |
| Abbreviation: IV, intravenously. Data from: 1. Wing DA, Hendershott CM, Debuque L, Millar LK. A randomized trial of three antibiotic regimens for the treatment of pyelonephritis in pregnancy. Obstet Gynecol 1998;92:249–53.doi: 10.1016/s0029-7844(98)00156-2 2. Sanchez-Ramos L, McAlpine KJ, Adair CD, Kaunitz AM, Delke I, Briones DK. Pyelonephritis in pregnancy: once-a-day ceftriaxone versus multiple doses of cefazolin. A randomized, double-blind trial. Am J Obstet Gynecol 1995;172:129–33. doi: 10.1016/0002-9378(95)90100-0 3. Vazquez JC, Abalos E. Treatments for symptomatic urinary tract infections during pregnancy. The Cochrane Database of Systematic Reviews 2011, Issue 1. Art. No.: CD002256. doi: 10.1002/14651858.CD002256.pub2 4. Glaser AP, Schaeffer AJ. Urinary tract infection and bacteriuria in pregnancy. Urol Clin North Am 2015;42:547–60. doi: 10.1016/j.ucl.2015.05.004 | |
(อ้างอิงจาก ACOG Clinical Consensus Number 4 Aug 2023, Urinary Tract Infections in Pregnant Individuals)
การรักษาภาวะ pyelonephritis ควรพิจารณาการรักษาแบบผู้ป่วยใน (inpatient management) โดยการให้สารน้ำให้เพียงพอร่วมกับยาปฏิชีวนะทางหลอดเลือดดำ (ควร empirical antibiotic เมื่อวินิจฉัยภาวะ pyelonephritis ขณะรอผล urine culture) โดยชนิดและขนาดยาที่แนะนำดังตารางที่ 3 อย่างไรก็ตามควรพิจารณาร่วมกับประวัติข้อมูลการแพ้ยา, การตอบสนองต่อยาปฏิชีวนะในอดีตและการดื้อยา
สำหรับสตรีตั้งครรภ์ที่เป็น beta-lactams allergy ควรมี investigation เพิ่มเติมเพื่อบ่งบอกความรุนแรงของการแพ้ที่เกิดขึ้น สตรีตั้งครรภ์ที่มีประวัติแพ้ penicillin แบบไม่รุนแรง (low risk for anaphylaxis) ควรพิจารณารักษาด้วยกลุ่มยา cephalosporins ส่วนสตรีตั้งครรภ์ที่แพ้แบบรุนแรง (high risk for anaphylaxis) ควรพิจารณาเป็น alternative regimen เช่น aztreonam เป็นต้น
หลังได้รับการรักษาพบว่าร้อยละ 75-95 จะอาการดีขึ้นภายใน 48-72 ชั่วโมงหลังได้รับยาปฏิชีวนะทางหลอดเลือดดำ (กล่าวคือไข้ลดลงมากกว่า 24 ชั่วโมงและอาการทางระบบปัสสาวะดีขึ้น) สตรีตั้งครรภ์ที่อาการไม่ดีขึ้นหลังจากได้รับยาปฏิชีวนะทางหลอดเลือดดำ ควรตรวจหาปัจจัยอื่นเพิ่มเติม ประเมินเรื่องของ bacterial resistance หรือพิจารณาส่งตรวจ imaging เพื่อ role out urinary tract pathology (5, 6, 10)
การพิจารณาเปลี่ยนยาปฏิชีวนะทางหลอดเลือดดำเป็นแบบรับประทานจะทำเมื่ออาการดีขึ้นและไม่มีไข้ติดต่อกันมากกว่า 24 ชั่วโมง โดยพิจารณาจากผล urine culture ที่กลับมาว่าเชื้อแบคทีเรียชนิดนั้น ตอบสนองต่อยาปฏิชีวนะชนิดใด และจะพิจารณาให้เป็นระยะเวลารวมจนครบ 14 วัน (5, 26) มีข้อควรระวังคือยา nitrofurantoin และ fosfomycin ไม่เหมาะสมในการรักษาภาวะ pyelonephritis ตามเหตุผลข้างต้นที่ได้กล่าวไป และควรส่งตรวจ
urine culture ซ้ำเมื่อสิ้นสุดการรักษาเพื่อประเมิน residual infection
ในปัจจุบันยังไม่มีแนวทางที่ชัดเจนในการดูแลสตรีตั้งครรภ์ภายหลังการเกิดภาวะ pyelonephritis
อาจพิจารณา suppressive therapy กรณีเช่นเดียวกับ acute cystitis ในกรณีที่เกิด recurrent UTI (แนะนำให้ nitrofurantoin 100 mg หรือ cephalexin 250-500 mg รับประทานทุกวัน) (32, 33) แต่มีข้อพิจารณาเพิ่มเติมคือใน pyelonephritis อาจส่ง routine urine culture ในทุกๆ เดือนเพื่อคัดกรองภาวะ recurrent UTI (11)
ปัญหาเรื่องเชื้อดื้อยายังคงเพิ่มขึ้นอย่างต่อเนื่องตามการใช้ยาปฏิชีวนะที่เพิ่มมากขึ้น การศึกษาแบบ systematic review และ meta-analysis เกี่ยวกับความชุกของการเกิด E.coli และ extended-spectrum B-lactamase-producing (ESBL) E.coli ในสตรีตั้งครรภ์ (35) พบว่ามีความชุกสูงอยู่ที่ประมาณร้อยละ 34 โดยเฉพาะในแถบยุโรปและเอเชีย ซึ่งสอดคล้องไปกับอีกหลายการศึกษา สำหรับ methicillin-resistant S.aureus (MRSA) ก็ไปในทำนองเดียวกันโดยความชุกสูงถึงประมาณร้อยละ 30 (36) ดังนั้นเมื่อมีการติดเชื้อดื้อยาเกิดขึ้นควรพิจารณาปรึกษาอายุรแพทย์โรคติดเชื้อร่วมประเมิน ชนิดและระยะเวลาการให้ยาปฏิชีวนะ
ถึงแม้ว่าปัญหาเชื้อดื้อยาจะสูงมากขึ้นแต่กลับพบว่ามีเพียงการศึกษาเดียวเท่านั้นที่แสดงถึง maternal mortality ที่สูงกรณีติดเชื้อ ESBL E.coli (37) ในทางตรงกันข้ามการศึกษาส่วนใหญ่ยังไม่พบความแตกต่างของ
maternal หรือ obstetric outcome ระหว่างสตรีตั้งครรภ์ที่ติดเชื้อ E.coli กับ ESBL E.coli (38)
เอกสารอ้างอิง
- McCormick T, Ashe RG, Kearney PM. Urinary tract infection in pregnancy. Obstet Gynaecol. 2008;10(3):156-62.
- Patterson TF, Andriole VT. Bacteriuria in pregnancy. Infect Dis Clin North Am. 1987;1(4):807-22.
- Unlu BS, Yildiz Y, Keles I, Kaba M, Kara H, Tasin C, et al. Urinary tract infection in pregnant population, which empirical antimicrobial agent should be specified in each of the three trimesters? Ginekol Pol. 2014;85(5):371-6.
- Zhanel GG, Hisanaga TL, Laing NM, DeCorby MR, Nichol KA, Weshnoweski B, et al. Antibiotic resistance in Escherichia coli outpatient urinary isolates: final results from the North American Urinary Tract Infection Collaborative Alliance (NAUTICA). Int J Antimicrob Agents. 2006;27(6):468-75.
- Wing DA. Pyelonephritis in pregnancy: treatment options for optimal outcomes. Drugs. 2001;61(14):2087-96.
- Denoble A, Reid HW, Krischak M, Rosett H, Sachdeva S, Weaver K, et al. Bad bugs: antibiotic-resistant bacteriuria in pregnancy and risk of pyelonephritis. Am J Obstet Gynecol MFM. 2022;4(2):100540.
- Nicolle LE, Gupta K, Bradley SF, Colgan R, DeMuri GP, Drekonja D, et al. Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria: 2019 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2019;68(10):e83-e110.
- Smaill FM, Vazquez JC. Antibiotics for asymptomatic bacteriuria in pregnancy. Cochrane Database Syst Rev. 2019;2019(11).
- Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. Screening for Asymptomatic Bacteriuria in Adults: US Preventive Services Task Force Recommendation Statement. Jama. 2019;322(12):1188-94.
- Gilstrap LC, 3rd, Ramin SM. Urinary tract infections during pregnancy. Obstet Gynecol Clin North Am. 2001;28(3):581-91.
- Jolley JA, Wing DA. Pyelonephritis in pregnancy: an update on treatment options for optimal outcomes. Drugs. 2010;70(13):1643-55.
- Langermans LM, Cools W, Van Limbergen I, Gucciardo L, Faron G. Optimal timing to screen for asymptomatic bacteriuria during pregnancy: first vs. second trimester. J Perinat Med. 2021;49(5):539-45.
- Hill JB, Sheffield JS, McIntire DD, Wendel GD, Jr. Acute pyelonephritis in pregnancy. Obstet Gynecol. 2005;105(1):18-23.
- McDonnold MA, Friedman AM, Raker CA, Anderson BL. First-Trimester Pyelonephritis Is Associated with Later Initiation of Prenatal Care: A Retrospective Cohort Analysis. Am J Perinatol. 2012;29(02):141-6.
- American Academy of Pediatrics, American College of Obstetricians and Gynecologists. Guidelines for perinatal care. 8th ed. Kilpatrick SJ, Papile L-A, editors. Illinois: American Academy of Pediatrics; 2017.
- O’Leary BD, Armstrong FM, Byrne S, Talento AF, O’Coigligh S. The prevalence of positive urine dipstick testing and urine culture in the asymptomatic pregnant woman: A cross-sectional study. Eur J Obstet Gynecol Reprod Biol. 2020;253:103-7.
- Schneeberger C, van den Heuvel ER, Erwich J, Stolk RP, Visser CE, Geerlings SE. Contamination rates of three urine-sampling methods to assess bacteriuria in pregnant women. Obstet Gynecol. 2013;121(2 Pt 1):299-305.
- Macejko AM, Schaeffer AJ. Asymptomatic bacteriuria and symptomatic urinary tract infections during pregnancy. Urol Clin North Am. 2007;34(1):35-42.
- Urinary Tract Infections in Pregnant Individuals. Obstet Gynecol. 2023;142(2):435-45.
- FitzGerald MP, Graziano S. Anatomic and functional changes of the lower urinary tract during pregnancy. Urol Clin North Am. 2007;34(1):7-12.
- Aslan D, Aslan G, Yamazhan M, Ispahi C, Tinar S. Voiding symptoms in pregnancy: an assessment with international prostate symptom score. Gynecol Obstet Invest. 2003;55(1):46-9.
- Chu CM, Lowder JL. Diagnosis and treatment of urinary tract infections across age groups. Am J Obstet Gynecol. 2018;219(1):40-51.
- Naber KG, Schito G, Botto H, Palou J, Mazzei T. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy. Eur Urol. 2008;54(5):1164-75.
- Emami A, Javanmardi F, Pirbonyeh N. Antibiotic resistant profile of asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Expert Rev Anti Infect Ther. 2020;18(8):807-15.
- Goldberg O, Koren G, Landau D, Lunenfeld E, Matok I, Levy A. Exposure to nitrofurantoin during the first trimester of pregnancy and the risk for major malformations. J Clin Pharmacol. 2013;53(9):991-5.
- Glaser AP, Schaeffer AJ. Urinary Tract Infection and Bacteriuria in Pregnancy. Urol Clin North Am. 2015;42(4):547-60.
- Wang T, Wu G, Wang J, Cui Y, Ma J, Zhu Z, et al. Comparison of single-dose fosfomycin tromethamine and other antibiotics for lower uncomplicated urinary tract infection in women and asymptomatic bacteriuria in pregnant women: A systematic review and meta-analysis. Int J Antimicrob Agents. 2020;56(1):106018.
- Schulz GS, Schütz F, Spielmann FVJ, da Ros LU, de Almeida JS, Ramos JGL. Single-dose antibiotic therapy for urinary infections during pregnancy: A systematic review and meta-analysis of randomized clinical trials. Int J Gynecol Obstet. 2022;159(1):56-64.
- Epp A, Larochelle A. No. 250-Recurrent Urinary Tract Infection. J Obstet Gynaecol Can. 2017;39(10):e422-e31.
- Albert X, Huertas I, Pereiró, II, Sanfélix J, Gosalbes V, Perrota C. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev. 2004;2004(3):Cd001209.
- Schneeberger C, Geerlings SE, Middleton P, Crowther CA. Interventions for preventing recurrent urinary tract infection during pregnancy. Cochrane Database Syst Rev. 2015;2015(7):Cd009279.
- e Rossi P, Cimerman S, Truzzi JC, Cunha CAD, Mattar R, Martino MDV, et al. Joint report of SBI (Brazilian Society of Infectious Diseases), FEBRASGO (Brazilian Federation of Gynecology and Obstetrics Associations), SBU (Brazilian Society of Urology) and SBPC/ML (Brazilian Society of Clinical Pathology/Laboratory Medicine): recommendations for the clinical management of lower urinary tract infections in pregnant and non-pregnant women. Braz J Infect Dis. 2020;24(2):110-9.
- Anger J, Lee U, Ackerman AL, Chou R, Chughtai B, Clemens JQ, et al. Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline. J Urol. 2019;202(2):282-9.
- Chen Y, Nitzan O, Saliba W, Chazan B, Colodner R, Raz R. Are blood cultures necessary in the management of women with complicated pyelonephritis? J Infect. 2006;53(4):235-40.
- Moradi Y, Eshrati B, Motevalian SA, Majidpour A, Baradaran HR. A systematic review and meta-analysis on the prevalence of Escherichia coli and extended-spectrum β-lactamase-producing Escherichia coli in pregnant women. Arch Gynecol Obstet. 2021;303(2):363-79.
- Rizvi M, Khan F, Shukla I, Malik A, Shaheen. Rising prevalence of antimicrobial resistance in urinary tract infections during pregnancy: necessity for exploring newer treatment options. J Lab Physicians. 2011;3(2):98-103.
- Melzer M, Petersen I. Mortality following bacteraemic infection caused by extended spectrum beta-lactamase (ESBL) producing E. coli compared to non-ESBL producing E. coli. J Infect. 2007;55(3):254-9.
- Greer LG, Roberts SW, Sheffield JS, Rogers VL, Hill JB, McIntire DD, Wendel GD. Ampicillin Resistance and Outcome Differences in Acute Antepartum Pyelonephritis. Infect Dis Obstet Gynecol. 2008;2008:891426.